牙周炎致病菌多重荧光PCR检测试剂盒的制作方法
本发明涉及一种牙周炎致病菌多重荧光PCR检测试剂盒。
背景技术:
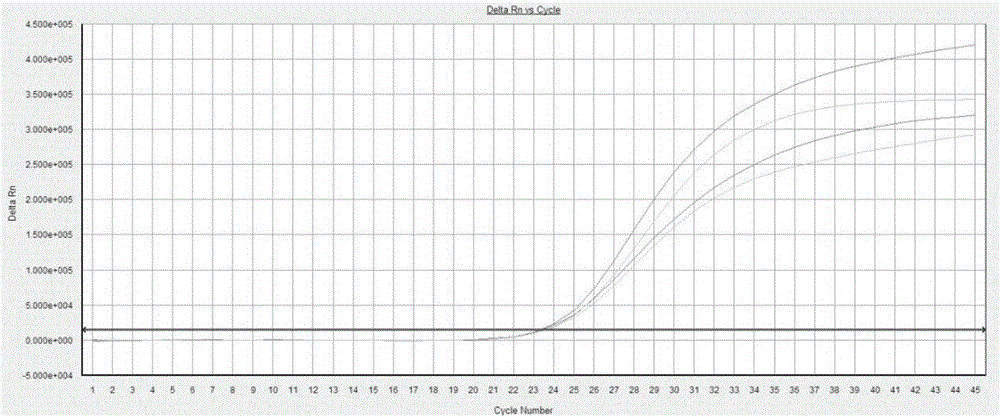
:牙周炎是以牙龈红肿、出血、溢脓、龈肉萎缩、牙龈外漏、牙齿松动为特征的多因素疾病,是人类口腔中常见疾病之一。全国口腔健康流行病调查发现,牙周炎疾病具有多发性和普遍性的特点,全国牙周炎患者医院就诊约在2000万人/年;美国进行的流行病学研究估计,超过400万以上的美国人患有牙周炎疾病。牙周炎是多种危险因素和易感因素综合作用的结果,它们错综复杂、相互影响。危险因素如环境、行为和微生物等因素,它们直接增大了疾病发生的可能性。大量研究发现细菌是牙周病发生发展的始动因子,包括伴放线杆菌、牙龈卟啉单胞菌、中间普氏菌、福赛斯坦纳菌、粪肠球菌、具核梭杆菌、齿垢密螺旋体等。目前,市场上尚未出现针对牙周炎致病菌检测的试剂盒。技术实现要素:基于此,有必要提供一种用于快速检测牙周炎致病菌的牙周炎致病菌多重荧光PCR检测试剂盒。一种牙周炎致病菌多重荧光PCR检测试剂盒,包括第一预分装PCR反应液、第二预分装PCR反应液、第三预分装PCR反应液、酶以及PCR缓冲液;所述第一预分装PCR反应液包括人核糖核酸酶P基因探针、细菌16SrDNA基因探针、伴放线杆菌探针、牙龈卟啉单胞菌探针、第一正向引物、第一反向引物、第二正向引物、第二反向引物、第三正向引物、第三反向引物、第四正向引物以及第四反向引物,所述第一正向引物和所述第一反向引物用于扩增人核糖核酸酶P基因的目的片段,所述第二正向引物和所述第二反向引物用于扩增细菌16SrDNA基因的目的片段,所述第三正向引物和所述第三反向引物用于扩增伴放线杆菌的目的片段,所述第四正向引物和所述第四反向引物用于扩增牙龈卟啉单胞菌的目的片段,所述人核糖核酸酶P基因探针、所述细菌16SrDNA基因探针、所述伴放线杆菌探针和所述牙龈卟啉单胞菌探针分别采用不同的荧光标记物标记;所述第二预分装PCR反应液包括中间普氏菌探针、齿垢密螺旋体探针、福赛斯坦纳菌探针、具核梭杆菌属探针、第五正向引物、第五反向引物、第六正向引物、第六反向引物、第七正向引物、第七反向引物、第八正向引物以及第八反向引物,所述第五正向引物和所述第五反向引物用于扩增中间普氏菌的目的片段,所述第六正向引物和所述第六反向引物用于扩增齿垢密螺旋体的目的片段,所述第七正向引物和所述第七反向引物用于扩增福赛斯坦纳菌的目的片段,所述第八正向引物和所述第八反向引物用于扩增具核梭杆菌的目的片段,所述中间普氏菌探针、所述齿垢密螺旋体探针、所述福赛斯坦纳菌探针和所述具核梭杆菌属探针分别采用不同的荧光标记物标记;所述第三预分装PCR反应液包括纤细弯曲杆菌探针、直肠弯曲菌探针、纠缠真杆菌探针、星座链球菌探针、第九正向引物、第九反向引物、第十正向引物、第十反向引物、第十一正向引物、第十一反向引物、第十二正向引物以及第十二反向引物,所述第九正向引物和所述第九反向引物用于扩增纤细弯曲杆菌的目的片段,所述第十正向引物和所述第十反向引物用于扩增直肠弯曲菌的目的片段,所述第十一正向引物和所述第十一反向引物用于扩增纠缠真杆菌的目的片段,所述第十二正向引物和所述第十二反向引物用于扩增星座链球菌的目的片段,所述纤细弯曲杆菌探针、所述直肠弯曲菌探针、所述纠缠真杆菌探针和所述星座链球菌探针分别采用不同的荧光标记物标记。这种牙周炎致病菌多重荧光PCR检测试剂盒用于对10种牙周炎主要致病菌:伴放线杆菌、牙龈卟啉单胞菌、中间普氏菌、齿垢密螺旋体、福赛斯坦纳菌、具核梭杆菌属、纤细弯曲杆菌、直肠弯曲菌、纠缠真杆菌以及星座链球菌进行检测,可以对样品采集、核酸提取、PCR扩增等试验过程进行全程质量控制,并且快速的得到检测结果。这种牙周炎致病菌多重荧光PCR检测试剂盒可以用于快速检测牙周炎致病菌。附图说明图1为实施例1中第一预分装PCR反应液阳性质控品的扩增曲线;图2为实施例1中第二预分装PCR反应液阳性质控品的扩增曲线;图3为实施例1中第三预分装PCR反应液阳性质控品的扩增曲线;图4为实施例2中伴放线杆菌灵敏度扩增曲线;图5为实施例2中牙龈卟啉单胞菌灵敏度扩增曲线;图6为实施例2中中间普氏菌灵敏度扩增曲线;图7为实施例2中齿垢密螺旋体灵敏度扩增曲线;图8为实施例2中福赛斯坦纳菌灵敏度扩增曲线;图9为实施例2中具核梭杆菌属灵敏度扩增曲线;图10为实施例2中纤细弯曲杆菌灵敏度扩增曲线;图11为实施例2中直肠弯曲菌灵敏度扩增曲线;图12为实施例2中纠缠真杆菌灵敏度扩增曲线;图13为实施例2中星座链球菌灵敏度扩增曲线;图14为实施例3中中间普氏菌与样本1的扩增曲线;图15为实施例3中直肠弯曲菌与样本1的扩增曲线;图16为实施例3中伴放线杆菌与样本1的扩增曲线;图17为实施例3中纠缠真杆菌与样本2的扩增曲线;图18为实施例3中牙龈卟啉单胞菌与样本2的扩增曲线;图19为实施例3中齿垢密螺旋体与样本2的扩增曲线;图20为实施例3中具核梭杆菌属与样本2的扩增曲线;图21为实施例3中星座链球菌与样本3的扩增曲线;图22为实施例3中纤细弯曲杆菌与样本3的扩增曲线;图23为实施例3中福赛斯坦纳菌与样本3的扩增曲线。具体实施方式为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图和具体实施例对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施的限制。如图1所示的一实施方式的牙周炎致病菌多重荧光PCR检测试剂盒,包括第一预分装PCR反应液、第二预分装PCR反应液、第三预分装PCR反应液、酶以及PCR缓冲液。第一预分装PCR反应液包括人核糖核酸酶P基因探针、细菌16SrDNA基因探针、伴放线杆菌探针、牙龈卟啉单胞菌探针、第一正向引物、第一反向引物、第二正向引物、第二反向引物、第三正向引物、第三反向引物、第四正向引物以及第四反向引物。第一正向引物和第一反向引物用于扩增人核糖核酸酶P基因的目的片段,第二正向引物和第二反向引物用于扩增细菌16SrDNA基因的目的片段,第三正向引物和第三反向引物用于扩增伴放线杆菌的目的片段,第四正向引物和第四反向引物用于扩增牙龈卟啉单胞菌的目的片段。其中,人核糖核酸酶P基因探针、细菌16SrDNA基因探针、伴放线杆菌探针和牙龈卟啉单胞菌探针分别采用不同的荧光标记物标记。第二预分装PCR反应液包括中间普氏菌探针、齿垢密螺旋体探针、福赛斯坦纳菌探针、具核梭杆菌属探针、第五正向引物、第五反向引物、第六正向引物、第六反向引物、第七正向引物、第七反向引物、第八正向引物以及第八反向引物,第五正向引物和第五反向引物用于扩增中间普氏菌的目的片段,第六正向引物和第六反向引物用于扩增齿垢密螺旋体的目的片段,第七正向引物和第七反向引物用于扩增福赛斯坦纳菌的目的片段,第八正向引物和第八反向引物用于扩增具核梭杆菌的目的片段。其中,中间普氏菌探针、齿垢密螺旋体探针、福赛斯坦纳菌探针和具核梭杆菌属探针分别采用不同的荧光标记物标记。第三预分装PCR反应液包括纤细弯曲杆菌探针、直肠弯曲菌探针、纠缠真杆菌探针、星座链球菌探针、第九正向引物、第九反向引物、第十正向引物、第十反向引物、第十一正向引物、第十一反向引物、第十二正向引物以及第十二反向引物,第九正向引物和第九反向引物用于扩增纤细弯曲杆菌的目的片段,第十正向引物和第十反向引物用于扩增直肠弯曲菌的目的片段,第十一正向引物和第十一反向引物用于扩增纠缠真杆菌的目的片段,第十二正向引物和第十二反向引物用于扩增星座链球菌的目的片段。其中,纤细弯曲杆菌探针、直肠弯曲菌探针、纠缠真杆菌探针和星座链球菌探针分别采用不同的荧光标记物标记。优选的,人核糖核酸酶P基因的目的片段的序列如SEQIDNo.1所示,细菌16SrDNA基因的目的片段的序列如SEQIDNo.2所示,伴放线杆菌的目的片段的序列如SEQIDNo.3所示,牙龈卟啉单胞菌的目的片段的序列如SEQIDNo.4所示。优选的,中间普氏菌的目的片段的序列如SEQIDNo.5所示,齿垢密螺旋体的目的片段的序列如SEQIDNo.6所示,福赛斯坦纳菌的目的片段的序列如SEQIDNo.7所示,具核梭杆菌的目的片段的序列如SEQIDNo.8所示。优选的,纤细弯曲杆菌的目的片段的序列如SEQIDNo.9所示,直肠弯曲菌的目的片段的序列如SEQIDNo.10所示,纠缠真杆菌的目的片段的序列如SEQIDNo.11所示,星座链球菌的目的片段的序列如SEQIDNo.12所示。本实施方式中,人核糖核酸酶P基因探针、细菌16SrDNA基因探针、伴放线杆菌探针、牙龈卟啉单胞菌探针、中间普氏菌探针、齿垢密螺旋体探针、福赛斯坦纳菌探针、具核梭杆菌属探针、纤细弯曲杆菌探针、直肠弯曲菌探针、所述纠缠真杆菌探针以及星座链球菌探针均为TaqMan探针。优选的,人核糖核酸酶P基因探针的序列如SEQIDNo.13所示,细菌16SrDNA基因探针的序列如SEQIDNo.14所示,伴放线杆菌探针的序列如SEQIDNo.15所示,牙龈卟啉单胞菌探针的序列如SEQIDNo.16所示。优选的,中间普氏菌探针的序列如SEQIDNo.17所示,齿垢密螺旋体探针的序列如SEQIDNo.18所示,福赛斯坦纳菌探针的序列如SEQIDNo.19所示,具核梭杆菌属探针的序列如SEQIDNo.20所示。优选的,纤细弯曲杆菌探针的序列如SEQIDNo.21所示,直肠弯曲菌探针的序列如SEQIDNo.22所示,纠缠真杆菌探针的序列如SEQIDNo.23所示,星座链球菌探针的序列如SEQIDNo.24所示。本实施方式中,人核糖核酸酶P基因探针的5’端采用JOE标记,人核糖核酸酶P基因探针的3’端采用BHQ1标记,细菌16SrDNA基因探针的5’端采用ROX标记,细菌16SrDNA基因探针的3’端采用BHQ2标记,伴放线杆菌探针的5’端采用ATTO425标记,伴放线杆菌探针的3’端采用BHQ1标记,牙龈卟啉单胞菌探针的5’端采用Cy5标记,牙龈卟啉单胞菌探针的3’端采用BBQ650标记。本实施方式中,中间普氏菌探针的5’端采用JOE标记,中间普氏菌探针的3’端采用BHQ1标记,齿垢密螺旋体探针的5’端采用ROX标记,齿垢密螺旋体探针的3’端采用BHQ2标记,福赛斯坦纳菌探针的5’端采用ATTO425标记,福赛斯坦纳菌探针的3’端采用BHQ1标记,具核梭杆菌属探针的5’端采用Cy5标记,具核梭杆菌属探针的3’端采用BBQ650标记。本实施方式中,纤细弯曲杆菌探针的5’端采用JOE标记,纤细弯曲杆菌探针的3’端采用BHQ1标记,直肠弯曲菌探针的5’端采用ROX标记,直肠弯曲菌探针的3’端采用BHQ2标记,纠缠真杆菌探针的5’端采用ATTO425标记,纠缠真杆菌探针的3’端采用BHQ1标记,星座链球菌探针的5’端采用Cy5标记,星座链球菌探针的3’端采用BBQ650标记。优选的,第一正向引物的序列如SEQIDNo.25所示,第一反向引物的序列如SEQIDNo.26所示,第二正向引物的序列如SEQIDNo.27所示,第二反向引物的序列如SEQIDNo.28所示,第三正向引物的序列如SEQIDNo.29所示,第三反向引物的序列如SEQIDNo.30所示,第四正向引物的序列如SEQIDNo.31所示,第四反向引物的序列如SEQIDNo.32所示,第五正向引物的序列如SEQIDNo.33所示,第五反向引物的序列如SEQIDNo.34所示,第六正向引物的序列如SEQIDNo.35所示,第六反向引物的序列如SEQIDNo.36所示,第七正向引物的序列如SEQIDNo.37所示,第七反向引物的序列如SEQIDNo.38所示,第八正向引物的序列如SEQIDNo.39所示,第八反向引物的序列如SEQIDNo.40所示,第九正向引物的序列如SEQIDNo.41所示,第九反向引物的序列如SEQIDNo.42所示,第十正向引物的序列如SEQIDNo.43所示,第十反向引物的序列如SEQIDNo.44所示,第十一正向引物的序列如SEQIDNo.45所示,第十一反向引物的序列如SEQIDNo.46所示,第十二正向引物的序列如SEQIDNo.47所示,第十二反向引物的序列如SEQIDNo.48所示。本发明中涉及的引物和探针,按照如下操作设计:应用PrimerPremier5.0或BeaconDesigner8在病原体核酸保守区内设计特异的TaqMan探针,在针对该探针设计相应的扩增引物,其扩增子大小应为80~150bp,根据序列的比对结果可以在引物或探针上引入简并碱基。设计依据:为了保证采用同一条件检测所有10种牙周炎主要致病菌,在引物、探针设计阶段首先要遵循设计的基本原则是全部病原体的正向引物、反向引物的Tm值相差小于2℃,其对应TaqMan探针的Tm要比引物Tm值高7~10℃,且探针之间的Tm值相差小于3℃;每一个组合的四对引物、探针之间不能有明显的二聚体结构。应用PrimerPremier5.0、BeaconDesigner8或DNASTAR评估设计的引物、探针序列,分析所有引物、探针之间或内部可能形成的所有二聚体结构,其稳定性不能超过软件给出的范围,若超过则视为不合格序列,需要重新设计,一般要求形成的Dimer的ΔG绝对值小于4.5kcal/mol为佳。BLAST分析设计的引物、探针序列,确保其特异性,且不能与人基因组高度同源。设计得到引物后,还需要进行初步验证,具体步骤如下:合成引物、探针和含有扩增子的质粒DNA,探针分别采用JOE、ROX、ATTO425和Cy5标记;用Real-TimePCR(SYBRGreen法)对合成的引物做评估,分别以阴性人基因组、阳性质粒DNA、去离子水为模板,评估其扩增特异性和扩增效率,同时测试是否有明显的引物二聚体生成,最终确定引物、探针序列。若空白对照和阴性对照有明显的非特异产物生成,且低浓度阳性对照也有相似的非特异峰(Tm通常小于80℃),则说明该对引物质量较差,有严重的二聚体,会影响扩增效率或造成假阳性;对于质量差的引物,将会重新设计、评估。若结果表明空白对照和阴性对照没有严重的二聚体,且所有阳性对照的峰单一致(Tm需大于80℃),且经电泳检测后产物大小与理论相符,则说明该对引物质量合格,可继续开展。多重体系优化:组合多重检测体系,通过调整体系中的MgCl2、dNTP、HotStartTaqDNAPolymerase、K+或NH4+等组分浓度使其扩增的灵敏度、特异性、重复性等达到最优的效果,尽可能的接近单重体系的扩增效率。PCR缓冲液包括MgCl2、dNTP、10×buffer以及H2O2。在一个具体的实施例中,PCR缓冲液中各组分的配比如下表所示:在一个具体的实施例中,第一预分装PCR反应液中各组分的配比如下表所示:第一预分装PCR反应液组分体积(μL)PCR反应体系终浓度(nM)10μM第一上游引物315010μM第一下游引物315010μM人核糖核酸酶基因探针315010μM第二上游引物315010μM第二下游引物315010μM细菌16SrDNA基因探针210010μM第三上游引物315010μM第三下游引物315010μM伴放线杆菌探针525010μM第四上游引物315010μM第四下游引物15010μM牙龈卟啉单胞菌探针150H2O17合计50在一个具体的实施例中,第二预分装PCR反应液中各组分的配比如下表所示:在一个具体的实施例中,第三预分装PCR反应液中各组分的配比如下表所示:10μM第九上游引物210010μM第九下游引物315010μM纤细弯曲杆菌探针315010μM第十上游引物315010μM第十下游引物315010μM直肠弯曲菌探针210010μM第十一上游引物2.512510μM第十一下游引物315010μM纠缠真杆菌探针315010μM第十二上游引物210010μM第十二下游引物2.512510μM星座链球菌探针2100H2O19合计50优选的,酶为Taq酶。具体的,在用于检测时,通常采用的20μL的扩增体系中,包括:13μL的PCR缓冲液、5μL的第一预分装PCR反应液(或5μL的第二预分装PCR反应液,或5μL的第三预分装PCR反应液)、1μL的酶以及1μL的模板DNA(通常为样本中提取得到)。下面对本发明的牙周炎致病菌多重荧光PCR检测试剂盒用于检测样本的具体步骤进行简单说明。待测样本的核酸提取采用核酸提取试剂盒或全自动核酸提取仪,针对每个样品取3个干净的0.5mlEP管,分别标号为N-1、N-2、N-3(N为样品编号),每个管中吸取PCR缓冲液13μL、Taq酶1μL以及对应样品DNA1μL;在N-1管中加入5μL的第一预分装PCR反应液,在N-2管中加入5μL的第二预分装PCR反应液,在N-3管中加入5μL的第三预分装PCR反应液;分别混匀,短暂离心。反应管放到荧光定量PCR反应仪中,按照不同组PCR的标记设计,分别设置ReporterDye和QuencherDye,参比染料(PassiveReference)为None。扩增程序:95℃10min;95℃15sec,62℃1min,45个循环。荧光信号收集设在62℃,反应体系设为20μL。结果判断:这种牙周炎致病菌多重荧光PCR检测试剂盒内预设了质控基因的扩增体系,每个待测样本的人核糖核酸酶P基因以及细菌16SrDNA基因都应扩增成功,且Ct应≤35,若Ct>35则建议重新提取。只有待测样本的质控基因成功扩增时,该样本的10种牙周炎主要致病菌检测结果才有意义,否则检测结果视为无效。10种牙周炎主要致病菌检测结果判定依据如下:阳性:检测结果Ct≤40,且有明显指数增长期;可疑:检测结果40<Ct<45,有明显指数增长期;对于检测结果为可疑的样本,建议复核一次,如果复核结果Ct<45且有指数扩增,则判定为阳性,否则判定为阴性;阴性:无指数扩增期,Ct=45或无Ct值。这种牙周炎致病菌多重荧光PCR检测试剂盒用于对样本中的10种牙周炎主要致病菌:伴放线杆菌、牙龈卟啉单胞菌、中间普氏菌、齿垢密螺旋体、福赛斯坦纳菌、具核梭杆菌属、纤细弯曲杆菌、直肠弯曲菌、纠缠真杆菌以及星座链球菌进行检测,可以对样品采集、核酸提取、PCR扩增等试验过程进行全程质量控制,并且快速的得到检测结果。这种牙周炎致病菌多重荧光PCR检测试剂盒可以用于快速检测牙周炎致病菌。以下为具体实施例。实施例1、试剂盒检测方法1.1样本的采集:采用无菌纸尖法从患者牙周袋内最深处或牙周健康者牙龈沟内分别采集样本,具体采集方法如下:常规清水漱口后,生理盐水冲洗去除食物残渣,吹干,棉球隔湿,局部用2.5%碘酊棉球消毒,将1片无菌纸尖插入牙周袋内或龈沟内,当有阻力时停止插入,停留30s后取出,置于无菌离心管中。1.2样品DNA的制备:本发明试剂盒未提供DNA样本提取试剂,用户可选用合适的商品化试剂盒提取样本核酸。1.3配制反应体液:反应体积为20μL;每个样品取3个干净的0.5mlEP管,分别标号为N-1、N-2、N-3(N为样品编号),每个管中吸取PCR缓冲液13μL、Taq酶1μL以及对应样品DNA1μL;在N-1管中加入5μL的第一预分装PCR反应液,在N-2管中加入5μL的第二预分装PCR反应液,在N-3管中加入5μL的第三预分装PCR反应液;分别混匀,短暂离心。1.4上机检测:将反应管放到荧光定量PCR反应仪中,按照不同组PCR的标记设计,分别设置ReporterDye和QuencherDye,参比染料(PassiveReference)为None。扩增程序:95℃10min;95℃15sec,62℃1min,45个循环。荧光信号收集设在62℃,反应体系设为20μL。检测结果如图1~图3所示。1.5结果判断:通过在试剂盒内预设了质控基因的扩增体系,每个待测样本的人核糖核酸酶P基因以及细菌16SrDNA基因都应扩增成功,且Ct应≤35,若Ct>35则建议重新提取。只有待测样本的质控基因成功扩增时,该样本的10种牙周炎主要致病菌检测结果才有意义,否则检测结果视为无效。10种牙周炎主要致病菌检测结果判定依据如下:阳性:检测结果Ct≤40,且有明显指数增长期;可疑:检测结果40<Ct<45,有明显指数增长期;对于检测结果为可疑的样本,建议复核一次,如果复核结果Ct<45且有指数扩增,则判定为阳性,否则判定为阴性;阴性:无指数扩增期,Ct=45或无Ct值。由图1~图3可以看出,第一预分装PCR反应液、第二预分装PCR反应液以及第三预分装PCR反应液中的12种目的基因均显示出明显的指数增长,说明12种目的基因均成功扩增。实施例2、试剂盒灵敏度分析2.1模板:合成含有扩增子的质粒DNA作为检测用的模板,利用微量紫外分光光度计测定纯化质粒DNA的浓度,通过分子量计算出初始DNA模板的拷贝数,然后将其依次做10倍梯度稀释至个位拷贝数,共计7个梯度,拷贝数为:1x106至1x100。2.2PCR检测:采用上述检测方法进行反应液配制,然后将反应管置于荧光PCR仪上进行扩增和检测。反应完成后观察荧光曲线图谱,分析上述试剂盒所能检测到的模板拷贝数最低限,具体扩增曲线如图4~图13所示。2.3结果与分析:由图4~图13可以看出,上述牙周炎致病菌PCR检测试剂盒的检测下限分别为:伴放线杆菌1×102拷贝(图4);牙龈卟啉单胞菌1×101拷贝(图5);中间普氏菌1×102拷贝(图6);齿垢密螺旋体1×102拷贝(图7);福赛斯坦纳菌1×102拷贝(图8);具核梭杆菌属1×101拷贝(图9);纤细弯曲杆菌1×102拷贝(图10);直肠弯曲菌1×101拷贝(图11);纠缠真杆菌1×102拷贝(图12);星座链球菌1×102拷贝(图13)。由此可以看出,上述牙周炎致病菌PCR检测试剂盒的灵敏度高,能在快速应急检测和微量样本检测中发挥重要作用。实施例3、试剂盒临床样本检测3.1样本采集:采用上述样本采集方法采集感染伴放线杆菌、牙龈卟啉单胞菌、中间普氏菌、齿垢密螺旋体、福赛斯坦纳菌、具核梭杆菌属、纤细弯曲杆菌、直肠弯曲菌、纠缠真杆菌和星座链球菌10种牙周炎主要致病菌样本,并提取样本DNA。3.2PCR检测:采用上述检测方法进行反应液配制,然后将反应管置于荧光PCR仪上进行扩增和检测。3.3结果与分析:通过检测样本1~3,检测结果如图14~图23所示。由图14~图23可以看出,利用上述牙周炎致病菌PCR检测试剂盒可检出全部10种牙周炎主要致病菌。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1