用于从幼稚T细胞诱导扩增调节性T细胞的试剂盒的制作方法
本发明属于分子生物工程领域,涉及一种试剂盒,具体地涉及一种用于从幼稚T细胞诱导扩增调节性T细胞的试剂盒,以及该试剂盒的使用方法。
背景技术:
免疫耐受是指免疫活性细胞接触抗原性物质时所表现出的一种主动的不应答状态,是一种有别于免疫缺陷和免疫抑制生物学现象。免疫耐受不良与多种疾病相关,如自身免疫性疾病、移植物抗宿主病(graft versus host disease,GVHD)和母胎免疫排斥等。在器官或组织移植中,传统的免疫抑制药物虽能显著延长移植物的存活时间,但其伴随的副作用是患者整体免疫功能下降、感染机会增加,并可能诱发肿瘤等,极大地限制了临床器官移植的进一步发展;在母胎免疫排斥所导致的复发性流产等疾病中,使用免疫抑制药物治疗可能对胎儿生长发育造成潜在的不良影响。因此细胞靶向性诱导免疫耐受日益受到重视。通过体外诱导的方式,扩增一种安全有效、半衰期长、甚至注入体内后具有再生能力的,能诱导特异性免疫耐受的细胞具有广阔的应用前景。
调节性T细胞(regulatory T cells,Treg)是一大类具有免疫调节和抑制功能的T细胞亚群,它参与并维持机体的免疫自稳,其数量和功能的稳定与肿瘤逃逸、自身免疫性疾病、X连锁隐性遗传病IPEX(免疫调节异常,多内分泌腺病,肠病,X连锁综合征)、移植物抗宿主病(GVHD)和妊娠免疫耐受等密切相关。根据来源不同,Treg可分为两大类:(1)天然型调节性T细胞(natural Treg,nTreg):成熟于胸腺,表达CD25分子和Foxp3,约占外周CD4+T细胞的5%‐10%;(2)诱导型调节性T细胞(induced Treg,iTreg):在不完全暴露抗原刺激和/或联合刺激的特定条件下,由幼稚T细胞(T cells)在体内周围组织中激活扩增而来。nTreg和iTreg虽然来源不同,但其表型和免疫学功能相似,均以表达核转录因子Foxp3为最主要特征,表达CTLA‐4、ICOS及OX‐40等表面分子,分泌IL‐10、TGF‐β等细胞因子,通过多种途径抑制效应T细胞的免疫应答并促进抑制型细胞因子分泌,维持机体内环境的免疫自稳、诱导宿主对移植物的免疫耐受,是机体以主动方式获得并维持自身免疫耐受的重要方式。
近来,过继转移实验研究显示,CD4+、CD25+Treg可以推迟甚至治疗同种异体移植物排斥反应。在动物模型中,IgG介导扩增调节性T细胞表位组合物可预防、治疗甚至治愈自身免疫疾病的小鼠。对Treg的基础和临床研究,尤其是临床应用潜能的研究是基础医学和免疫学的研究热点。然而,nTreg仅占正常人周围血CD4+T细胞的5‐15%,大大地限制了其临床应用。在现有的应用于诱导扩增Treg的试剂盒产品中,大多存在以下问题:使用anti‐CD3/CD28‐磁珠作为诱导剂,扩增成本高;使用异种或异体血清,具有潜在生物安全问题;需要多次分选,操作复杂且增加成本;此外,还存在扩增诱导周期较长、稳定性欠佳等其他问题。
技术实现要素:
本发明的目的是针对以上要解决的技术问题,提供一种用于从幼稚T细胞诱导扩增调节性T细胞的试剂盒,所述试剂盒操作简便、安全有效、扩增诱导周期较短、稳定性较好、成本经济。
本发明的另一个目的是提供所述试剂盒的使用方法。
为实现以上目的,本发明提供了一种用于从幼稚T细胞诱导扩增调节性T细胞的试剂盒,所述试剂盒包括以下组分:anti‐CD3抗体、PBS缓冲液、淋巴细胞分离液、CD4+T Cell Biotin‐Antibody Cocktail II抗体、Naive CD4+T Cell Micro Bead Cocktail II磁珠、Treg诱导培养基。
作为一种优选的实施方式,所述Treg诱导培养基的配方比例为:已添加2.06mM Glutamax‐I和25mM HEPES缓冲液的RPMI 1640培养基,向所述RPMI 1640培养基中加入10%v/v自体血清,并加入终浓度为200U/ml重组人IL‐2、1‐5ng/ml重组人TGF‐β1、0.1‐10μg/ml anti‐CD28、10‐200nM雷帕霉素。
本发明还提供了所述试剂盒的使用方法,其包括如下步骤:
(1)anti‐CD3抗体包被:细胞培养,在24孔培养板中每孔加入含0.1‐2μg/ml anti‐CD3抗体的PBS缓冲液1mL置于4℃孵育1h至24h备用,其他孔板根据体积或底面积换算;
(2)外周血单个核细胞的分离:抽取肝素抗凝静脉血20ml,取3支15ml管离心管,每管加入淋巴细胞分离液4ml,将6‐7mL外周血沿管壁缓慢置于淋巴细胞分离液层面之上,800g离心17min,分别收集血浆和外周血单个核细胞,血浆56℃水浴灭活补体,外周血单个核细胞加入足量的生理盐水洗涤1‐2次;
(3)磁珠分选幼稚T细胞:将所述步骤(2)中获得的外周血单个核细胞进行计数,加PBS洗涤,用美天旎磁珠阴性分选幼稚T细胞;每107细胞以40μl缓冲液重悬,加入10μlCD4+T Cell Biotin‐Antibody Cocktail II抗体,混匀后4℃孵育5min;加入30μl缓冲液、20μl的Naive CD4+T Cell Micro Bead Cocktail II磁珠,混匀后4℃孵育10min,得到细胞混合液;用3‐5ml缓冲液平衡LD型细胞分选柱,将所得的细胞混合液加入平衡后的LD型细胞分选柱,用3‐5ml缓冲液洗涤装有细胞混合物的离心管后加入所述细胞分选柱,收集过柱后的细胞悬液,得到阴选的未被抗体结合的细胞,即幼稚T细胞;
(4)诱导扩增培养:将包被anti‐CD3的培养板从4℃取出于置于37℃培养箱平衡;吸去PBS;将幼稚T细胞重悬于Treg诱导培养基,调整至0.2‐2×106/孔接种于包被anti‐CD3的培养板。
本发明的试剂盒组分设计合理、操作简便、安全有效、扩增诱导周期较短、稳定性较好、成本经济。
同时,本发明的试剂盒的使用方法采用预包被的anti‐CD3抗体的培养板作为扩增诱导剂;在使用淋巴细胞分离液分离外周血单个核细胞(PBMC)的同时,吸取上层自体血清作为Treg培养血清,从而避免了同种异体血清和异种血清潜在的生物安全问题及免疫排异反应,并且节约了商品血清成本;此外,本发明仅在培养开始阶段用磁珠阴性分选幼稚T细胞,培养过程不需要进行多次分选,从而降低成本,减少污染机会和对细胞的损伤和消耗,节省操作时间;本发明还进一步标准化了每个培养孔的细胞数、培养基量和刺激剂浓度、治疗时间和治疗的细胞总数、细胞浓度,使扩增和治疗效果更为稳定。利用表型和功能实验验证体外扩增Treg的扩增效率和纯度,实验结果表明,使用本发明的试剂盒进行扩增诱导,其扩增诱导周期是12‐21天,Treg细胞纯度达到85%以上。
附图说明
图1示出了Treg抑制功能实验的操作示意图。
图2示出了使用根据本发明的方法诱导增殖后的调节性T细胞的生长情况。
图3示出了Treg表型和CD25、CD127、Foxp3表达的流式分析结果。
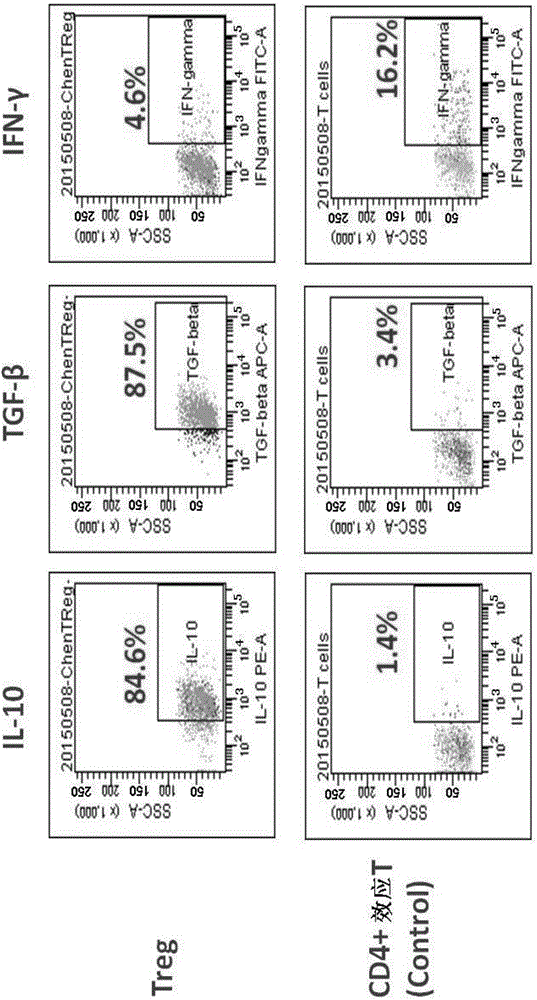
图4示出了Treg表型和IL‐10、TGF‐β、IFN‐γ表达的流式分析结果。
图5示出了Treg抑制功能实验的实验结果。
具体实施方式
下面结合附图和具体实施例,对本发明的技术方案作进一步的详述,但本发明并不限于以下实施例。如未特别指出,本发明的实施例中所使用试剂、仪器均为本领域已知并可获得的。
本发明的从幼稚T细胞诱导扩增调节性T细胞的试剂盒包括以下组分:anti‐CD3抗体、PBS缓冲液、淋巴细胞分离液、CD4+T Cell Biotin‐Antibody Cocktail II抗体、Naive CD4+T Cell Micro Bead Cocktail II磁珠、Treg诱导培养基。其中,优选地,所述Treg诱导培养基的配方比例为:已添加2.06mM Glutamax‐I和25mM HEPES缓冲液的RPMI 1640培养基,向所述RPMI 1640培养基中加入10%v/v自体血清,并加入终浓度为200U/ml重组人IL‐2、1‐5ng/ml重组人TGF‐β1、0.1‐10μg/ml anti‐CD28、10‐200nM雷帕霉素。
根据本发明的从幼稚T细胞诱导扩增调节性T细胞的试剂盒的使用方法,其具体步骤如下:
步骤1. anti‐CD3抗体包被
细胞培养前24h至1h,在U型或平底培养板中每孔加入含0.1‐2μg/ml(优选为1μg/ml)的anti‐CD3(OKT3,eBioscience)抗体的PBS(磷酸盐缓冲盐水),24孔板加1ml,其他孔板根据体积或底面积换算。置于4℃直至使用。
步骤2.外周血单个核细胞(PBMC)的分离
抽取肝素抗凝静脉血20ml,取3支15ml管离心管,每管加入淋巴细胞分离液4ml,将6‐7mL外周血沿管壁缓慢置于淋巴细胞分离液层面之上,800g离心17min,分别收集血浆和PBMC,血浆56℃水浴灭活补体,PBMC加入足量的生理盐水洗涤1‐2次。
步骤3.磁珠分选Naive T细胞(幼稚T细胞)
1)将步骤2中获得的PBMC进行计数,加PBS洗涤一遍,用美天旎磁珠(CD4+T Cell Isolation Kit II,human,cat 130‐094‐131)阴性分选幼稚T细胞;
2)每107细胞以40μl缓冲液重悬(以下所加缓冲液及抗体均按107细胞计算),加入10μlCD4+T Cell Biotin‐Antibody Cocktail II抗体。混匀后置于冰箱4℃孵育5min;
3)加入30μl缓冲液、20μl的Naive CD4+T Cell Micro Bead Cocktail II磁珠。混匀后于冰箱孵育10min;
4)用3‐5ml缓冲液平衡LD型细胞分选柱,将步骤3)所得的细胞混合液加入平衡后的柱子,用3‐5ml缓冲液洗涤装细胞混合物的离心管后加入柱子,收集过柱后的细胞悬液即为阴选的未被抗体结合的细胞,此为幼稚T细胞(T细胞);
5)将柱子从磁铁上取下,加入5ml缓冲液将液体打出后收集,此为其他细胞(即非幼稚T细胞)。
步骤4.诱导扩增培养
1)提前至少20min将包被anti‐CD3的培养板从4℃冰箱取出,置于37℃培养箱预热平衡。
2)吸去PBS,不可吹打已包被抗体的区域。
3)将幼稚T细胞重悬于Treg诱导培养基,调整至0.2‐2×106/孔接种于包被anti‐CD3的培养板。Treg诱导培养基配方:RPMI 1640培养基(已添加2.06mM Glutamax‐I和25mM HEPES缓冲液)加10%v/v自体血清,并加入终浓度为200U/ml rh IL‐2,1‐5ng/ml rh TGF‐β1,0.1‐10μg/ml anti‐CD28,10‐200nM Rapamycin(雷帕霉素)。
4)未使用的孔加满PBS以降低边缘蒸发效应,37℃培养箱培养3‐5天。
步骤5. Treg细胞传代
3‐5天后根据细胞情况,离心计数细胞数,重悬于Treg诱导培养基,调整至0.2×106‐2×106/ml,接种于另一个包被anti‐CD3的24孔板,其他孔板根据体积或底面积换算。
步骤6.每2‐3天重复步骤5,直至细胞冻存,或者从抽血培养开始算第12‐15天,取部分细胞流式分析Treg细胞比例及表型,并进行Treg抑制功能实验。
步骤7. Treg细胞冻存
配制冻存液:RPMI 1640Medium(已添加2.06mM Glutamax‐I和25mM HEPES缓冲液)按体积百分比加10%DMSO、20%自体血清,置于4℃冰箱直至使用。根据需要调整Treg细胞数重悬于冻存液中,‐80℃冰箱过夜,置于液氮中保存。
步骤8. Treg细胞复苏
37℃水浴复苏细胞,5ml Treg诱导培养基洗涤细胞后,重悬于Treg诱导培养基,调整至0.2×106‐2×106/ml接种于包被anti‐CD3的24孔板,其他孔板根据体积或底面积换算。重复步骤6。
步骤9. Treg效能评价
在培养过程中,每天镜下观察细胞增殖情况,拍照存档;每3天取2×105细胞流式分析Treg纯度和各种细胞因子表达:包括CD4、CD25、CD45‐RA、CD127、Foxp3、IL‐10、TGF‐β、IFN‐γ等;于第10‐15天,进行Treg抑制功能实验:CFSE(羧基荧光素双乙酸盐琥珀酰亚胺酯)是一种荧光探针,可穿透细胞膜后与胞内蛋白共价结合,定位于细胞膜、细胞质和细胞核,水解后释放出绿色荧光。细胞核中荧光染色最强。CFSE不影响细胞的增殖能力,在细胞增殖过程中,其荧光强度随细胞分裂而逐级递减,荧光平均分配至两个子代细胞中,因此其荧光强度是亲代细胞的一半,根据这一特性,它可被用于检测细胞增殖,细胞周期的估算及细胞分裂等方面。本发明采用CFSE染色的PBMC与梯度稀释的Treg共培养,流式检测CFSE,CFSE荧光强度的衰减程度与效应细胞PBMC的增殖程度正相关,与Treg抑制能力负相关,对比不加Treg与添加Treg,效应细胞CFSE荧光强度的衰减程度的变化即可知道Treg的抑制功能,具体操作方法如下。
9.1包被孔板:
用冷的PBS稀释α‐CD3(0.1‐0.5μg/ml),混匀后在96孔板每孔加入100μl包被抗体,置于4℃冰箱过夜。从6‐12孔全部包被抗体。
9.2应答细胞CFSE染色:
(1)取出一管CFSE(A)溶解于18μl DMSO,配制成5mM的CFSE储液;
(2)用PBS或RPMI(无血清,血清可终止染色)将CFSE储液稀释成10μM(2×)工作液备用;
(3)用15ml离心管收集细胞并计数,用预热好的PBS洗涤2次以去除血清残留,将细胞重悬于PBS,调整浓度至2×106/ml;加入等体积CFSE(2×),混匀,置于37℃培养箱孵育10分钟,期间颠倒混匀数次;
(4)加入含10%血清的培养基至15ml,充分混匀以终止反应;300×g离心5min,去上清;
(5)用10%血清培养基再洗涤一次;
(6)用完全培养基重悬,调整浓度至2×106/ml(即2×105/100μ1)。
9.3 Treg与应答细胞混合培养:
用CD127磁珠阴选Treg,调整细胞数至1×106/ml(即1×105/100μ1)(可先用127磁珠阴选,再用CD25+磁珠阳选富集Treg)。
如图1所示,在96孔板中第5‐11列加入50μl RPMI完全培养基,第12列加入100μl Treg(仅有Treg的对照)。从第12列中吸取50μl细胞于第11列(2:1),混匀,再从第11列吸50μl于第10列,以此类推直至第7列。最后从第7列吸取50μl细胞丢弃(32:1)。从第6‐11列,每孔加入CFSE染色的T细胞50μl(1×105/孔),第6列为只有T细胞的对照,在第5列加入50μl T细胞(1×105/孔,不刺激的对照)。在第12列加入50μl RPMI完全培养基使各孔终体积保持一致。置于37℃培养箱培养3‐4天。A、B、C为复孔。
实验结果
使用根据本发明的方法诱导增殖后的调节性T细胞的生长情况如图2所示。其中,图2中的A、B、C、D分别为day2(第2天)、day4(第4天)、day6(第6天)、day12(第12天)的细胞生长情况。由图2可见,细胞生长状态良好,刺激后细胞较刺激前大,胞膜较光滑,碎片较少,背景干净。
图3和图4分别示出了Treg表型和转录因子标志以及细胞因子表达的流式分析结果。结果显示,培养细胞向CD127o/‐‐CD25+Foxp3+Treg方向分化。
图5示出了Treg抑制功能实验的实验结果,结果显示,加入培养后,Treg能明显抑制效应细胞的增殖。
实验结果表明,本发明方法的扩增诱导周期是12‐21天,CD25+Foxp3+Treg细胞纯度达到85%以上。
- 还没有人留言评论。精彩留言会获得点赞!