一种拮抗葡萄霜霉病菌的植物内生生防菌株Zyx‑3的生产方法与流程
技术领域
本发明涉及生物繁殖培育技术领域,特别是一种拮抗葡萄霜霉病菌的植物内生生防菌株Zyx-3的生产方法。
背景技术:
葡萄霜霉病(Plasmopara viticola)是葡萄生产上最重要的病害之一,在我国各葡萄产区几乎都有发生。据调查,2010 年我国葡萄栽培面积达 55.2 万公顷,严重发病地块的葡萄霜霉病发生率高达 70% 以上。近年来,我省葡萄栽培面积迅速扩大,葡萄霜霉病已成为甘肃省葡萄种植最严重的病害之一。给农业生产造成了巨大的经济损失。目前,常见的预防及控制葡萄霜霉病的方法主要有种植抗病品种、准确预警、避雨栽培和化学农药的使用。生产中,由于葡萄高效益的特点,促使果农在防治病害的过程中不断增加化学农药的施药量,不但增加了对环境的污染,也降低了果品品质和其在国际市场上的竞争能力。化学农药的大量使用也导致果品中农药残留超标,对食品安全产生一定的影响,同时,也诱发了葡萄霜霉病抗药性的产生,进而增大了该病害的防治难度。
随着绿色农业的蓬勃发展,微生物源农药以其资源丰富、生物安全性高和环境友好等特点,成为近年来研究的热点。有研究表明,田间小区试验中,利用链霉菌 A02 发酵上清液对葡萄霜霉病的防治效果可达 95.7%,枯草芽孢杆菌 B-FS01 对葡萄霜霉病的防效达 88.25%。经叶盘法检测,砖红微杆菌N6 对葡萄霜霉病防治效果好并且稳定,其防效达到 74.20%。田间试验显示,苍白杆菌株 SY286 发酵原液对葡萄霜霉病防效可达80% 以上。因此,利用拮抗生防菌来进行果蔬生物防治越来越引起各国研究者的重视。
而在生防细菌中研究较多的是芽孢杆菌,此外还有放射性农杆菌、荧光假单胞杆菌和某些病原细菌的无毒性突变体等。假单孢菌属细菌大量存在于植物的根围.许多菌株对植物有抑制病害、促进生长的作用,其中荧光假单孢杆菌是报道最多、在防治土传病害方面应用效果较好的一类生防菌,对马铃薯、黄瓜、甜菜、豌豆、胡萝卜、小麦等常见土传病害如猝倒。假单胞杆菌及其转基因菌株的开发与应用目前拮抗细菌对病原真菌的作用已成为研究热点,但绝大多数是有关假单胞菌的研究。因为易于实验室培养和繁殖,且该菌能利用一些简单的新陈代谢有机物,便于检测。假单胞菌能最大程度地适应根围生活,具有较强的根际生态竞争力,这是其能成功用于生物防治的主要原因。但由于假单胞菌在高于45℃的情况下很快失活,所以在各国气温偏低的地区使用较多。在夏季室外常有50℃高温的一些地区,不利于假单胞菌的存活,而芽孢杆菌较耐高温,从而能正常地发挥生防效果。
芽孢杆菌的抑菌范围很广,包括根部病害,枝干病害、叶花部病害和收获后果品病害 。如棉花枯萎病、黄萎病、立枯病 、小麦赤霉病、番茄青枯病、苹果红腐病及其他一些土传和地上部病害。由于其具内生芽孢,抗逆性强,营养要求简单。繁殖速度快并在植物根圈易于定殖,所以被广泛应用于植物病害的生物防治中。目前应用于生防的芽孢杆菌种类主要有枯草芽孢杆菌、蜡状芽孢杆菌、巨大芽孢杆菌、多粘芽孢杆菌和短小芽孢杆菌等。国外利用枯草芽孢杆菌防治丝核菌、腐霉菌、镰刀霉等引起的病害,均取得较好的效果。
本发明解决现有技术的不足,提供一种安全便捷、拮抗效果显著、可产业化生产的拮抗葡萄霜霉病菌的植物内生生防菌株Zyx-3的生产方法。
本发明解决其技术问题所采用的技术方案为:
一种拮抗葡萄霜霉病菌的植物内生生防菌株Zyx-3的生产方法,包括如下步骤:
A、清洗修剪
采集葡萄叶片及叶柄,叶片及叶柄用自来水冲洗后展开晾干表面水分,叶柄剪成0.5㎝的小段,叶片剪成0.5㎝的小块,将叶片和叶柄分别混合均匀;
B、消毒处理
将上述叶片及叶柄进行表面消毒,先将叶片及叶柄浸泡在质量浓度75%的乙醇溶液中2 min,无菌水清洗3~5次,再将叶片及叶柄浸泡在质量浓度20%次氯酸钠溶液中5min,无菌水清洗3~5次;
C、研磨处理
将表面消毒后的叶片及叶柄在灭菌的研钵中加无菌水中研磨至糊状,用无菌纱布过滤留取滤液;
D、增殖培养
滤液稀释为10倍液和100倍液,分别取滤液、10倍液和100倍液各200μL涂在马铃薯葡萄糖琼脂培养基上,马铃薯葡萄糖琼脂培养基配方为马铃薯200g、葡萄糖15g、琼脂糖12g和水1000mL,在27℃恒温箱中培养一周;
E、纯化培养
挑选出生防菌株Zyx-3,在营养琼脂培养基NA中纯化培养,营养琼脂培养基NA配方为牛肉膏3 g、酵母浸膏1g、蛋白胨5g、葡萄糖10g、琼脂12g和自来水1000 mL。
所述步骤B中收集最后一次冲洗用过的无菌水,取200μL涂在马铃薯葡萄糖琼脂培养基上,马铃薯葡萄糖琼脂培养基配方为马铃薯200g、葡萄糖15g、琼脂糖12g和水1000mL,培养并检测表面消毒是否彻底。
所述步骤A中叶片及叶柄分别选取不同地区、不同季节、不同品种进行采摘。
所述无菌纱布为4层,纱布目数100-500目。
本发明的有益效果在于:
内生生防菌株Zyx-3对病菌的抑菌机理主要表现为能使得病菌分生孢子及孢子囊萌发受阻,少量分生孢子虽可萌发,但萌发的芽管发生扭曲,而且芽管长度明显缩短;且能使多种植物病原菌菌丝顶端膨大、畸形、形成膨胀泡;中间菌丝断裂、消融,原生质外泄等。通过对Zyx-3内生生防菌株产酶能力的研究发现,其能产生水解淀粉酶、过氧化氢酶等,这也是可能是其能够抑菌的因素之一。
经测序获得菌株Zyx-3的16S rDNA基因有1428个碱基,GenBank 序列登录号为:KT265261,经过Blast相似性分析,菌株Zyx-3与枯草芽孢杆菌Bacillus subtilis和解淀粉芽孢杆菌Bacillus amyloliquefaciens同源性最高,相似值均在99%以上。用DNAStar 软件将菌株Zyx-3与来自GenBank的10株细菌一起构建基于16S rDNA序列的系统发育树,菌株Zyx-3与枯草芽孢杆菌Bacillus subtilis(CP009684)聚在一个分支。其它菌株分别聚在另外的一支,没有与菌株Zyx-3聚在同一支上,说明菌株Zyx-3与Bacillus subtilis (CP009684)枯草芽孢杆菌遗传距离更近,结合形态学和生理生化特性等初步将其鉴定为枯草芽孢杆菌(Bacillus subtilis)。
本发明提供一种能够防治葡萄霜霉病的植物内生生防菌资源。以期为开发经济环保的生物源农药提供菌种资源,为其开发和利用提供理论依据。该菌株的开发利用将会丰富葡萄及其它农作物病害绿色防控的技术手段,通过产业化将会增加我国生物农药的种类,为确保粮食生产安全、农产品质量安全和生态安全保驾护航,具有广阔的开发应用前景。
附图说明
图1 内生拮抗细菌Zyx-3对多种植物病原真菌菌丝的抑制作用示意图;
图2 PDA培养基上Zyx-3菌落形态;
图3 内生拮抗细菌Zyx-3革兰氏染色反应;
图4 内生生防菌株Zyx-3 16S rDNA 系统发育树。
具体实施方式
一种拮抗葡萄霜霉病菌的植物内生生防菌株Zyx-3的生产方法,其特征在于包括如下步骤:
A、清洗修剪
叶片及叶柄分别选取不同地区、不同季节、不同品种进行采摘,采集葡萄叶片及叶柄,叶片及叶柄用自来水冲洗后展开晾干表面水分,叶柄剪成0.5㎝的小段,叶片剪成0.5㎝的小块,将叶片和叶柄分别混合均匀;
B、消毒处理
将上述叶片及叶柄进行表面消毒,先将叶片及叶柄浸泡在质量浓度75%的乙醇溶液中2 min,无菌水清洗3~5次,再将叶片及叶柄浸泡在质量浓度20%次氯酸钠溶液中5min,无菌水清洗3~5次;
C、研磨处理
将表面消毒后的叶片及叶柄在灭菌的研钵中加无菌水中研磨至糊状,用无菌纱布过滤留取滤液,无菌纱布为4层,纱布目数100-500目;
D、增殖培养
滤液稀释为10倍液和100倍液,分别取滤液、10倍液和100倍液各200μL涂在马铃薯葡萄糖琼脂培养基上,马铃薯葡萄糖琼脂培养基配方为马铃薯200g、葡萄糖15g、琼脂糖12g和水1000mL,在27℃恒温箱中培养一周;
E、纯化培养
挑选出生防菌株Zyx-3,在营养琼脂培养基NA中纯化培养,营养琼脂培养基NA配方为牛肉膏3 g、酵母浸膏1g、蛋白胨5g、葡萄糖10g、琼脂12g和自来水1000 mL。
所述步骤B中收集最后一次冲洗用过的无菌水,取200μL涂在马铃薯葡萄糖琼脂培养基上,马铃薯葡萄糖琼脂培养基配方为马铃薯200g、葡萄糖15g、琼脂糖12g和水1000mL,培养并检测表面消毒是否彻底。
实施例1
A、清洗修剪
叶片及叶柄分别选取河西走廊、夏秋三季、当地种植的不同品种进行采摘,采集葡萄叶片及叶柄,叶片及叶柄用自来水冲洗后展开晾干表面水分,叶柄剪成0.5㎝的小段,叶片剪成0.5㎝的小块,将叶片和叶柄分别混合均匀;
B、消毒处理
将上述叶片及叶柄进行表面消毒,先将叶片及叶柄浸泡在质量浓度75%的乙醇溶液中2 min,无菌水清洗3-5次,再将叶片及叶柄浸泡在质量浓度20%次氯酸钠溶液中5min,无菌水清洗3-5次;
收集最后一次冲洗用过的无菌水,取200μL涂在马铃薯葡萄糖琼脂培养基上,马铃薯葡萄糖琼脂培养基配方为马铃薯200g、葡萄糖15g、琼脂糖12g和水1000mL,培养并检测表面菌种残留情况,消毒彻底进行下一步;
C、研磨处理
将表面消毒后的叶片及叶柄在灭菌的研钵中加无菌水中研磨至糊状,用无菌纱布过滤留取滤液,无菌纱布为4层,纱布目数100目;
D、增殖培养
滤液稀释为10倍液和100倍液,分别取滤液、10倍液和100倍液各200μL涂在马铃薯葡萄糖琼脂培养基上,马铃薯葡萄糖琼脂培养基配方为马铃薯200g、葡萄糖15g、琼脂糖12g和水1000mL,在27℃恒温箱中培养一周;
E、纯化培养
挑选出生防菌株Zyx-3,在营养琼脂培养基NA中纯化培养,营养琼脂培养基NA配方为牛肉膏3 g、酵母浸膏1g、蛋白胨5g、葡萄糖10g、琼脂12g和自来水1000 mL。
具体对比测试实验如下:
拮抗内生细菌Zyx-3菌株对多种植物病原真菌的抑制作用
供试植物病原真菌共15种,分别是1、葡萄霜霉病菌(Plasmopara viticola);2、葡萄灰霉病菌(Botrytis cinerea);3、黄瓜枯萎病菌(Fusarium oxysporum f.sp.Cucumerinum);4、西瓜蔓枯病菌(Mycosphaerella melonis);5、玉米大斑病菌(Exserohilum turcicum(Pass.)Leonard et Suggs);6、辣椒炭疽病菌(Colletotrichum gloeosporioides);7、苹果腐烂病菌(Valsa mali Miyabe et Yamada);8、番瓜绵腐病菌(Pythiun aphanidermatum (Eds.) Fitzp);9、马铃薯立枯丝核病菌(Rhizoctonia solani Kühn);10、半夏早疫病菌(Alternaria sonali);11、苹果轮纹病菌(Physalospora piricola Nose);12、棉花枯萎病菌(Fusarium oxysporum f .sp.vesinfectum(Atk .) Snyder et Hansen);13、葡萄白腐病菌(Coniothyrium diplodiella);14、辣椒疫霉病菌(Phytophthora capsici Leonian);15、茄子菌核病菌(Sclerotinia sclerotiorum(Lib.) De Bary)。均保存于甘肃省农业科学院植物保护研究所植物病理实验室。
对葡萄霜霉病菌的测定采用离体叶盘法:分别取供试品种成熟的健康叶片,用消毒的打孔器取直径为1.5cm的叶盘,将叶盘放到倒好的质量浓度8%水琼脂培养基上,每皿放置10个叶盘,每个叶盘接种10uL孢子囊悬浮液,孢子囊悬浮液浓度为1×105~1×106个/mL,将接种后的培养皿放到22℃人工气候箱内,先黑暗处理12小时,后光照处理16h 再黑暗处理8h的条件下培养,以喷清水为对照,试验设置3次重复。逐天观察病害发生情况,7 d后观察其发病情况并计算发病率和病情指数。病情调查:按叶片感病面积采用6级记载法。0级:无病斑;1级:病斑面积占叶面积5%以下;3级:病斑面积占叶面积5% ~25%;5级:病斑面积占叶面积25% ~50%;7级:病斑面积占叶面积50%~75%;9级:病斑面积占叶面积75% ~100%。
对其它14种植物病原真菌测定采用平板对峙法:将植物病原真菌2-15作为指示菌,分别取培养好的各植物病原真菌菌落边缘的菌丝块(d=5mm)放在倒好的PDA平板中央,在培养皿背面距指示菌约2.5 cm十字交叉法标记4点,分别在这4点点接在NA培养基上活化培养36h的葡萄内生细菌,以不点接内生细菌为对照,置于28℃下培养,待到植物病原真菌长满皿时测量抑菌带的宽度(即内生细菌落边缘到供试病原真菌菌落边缘的距离),该试验重复3 次,取平均值。
菌落生长抑制率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100%
将菌株Zyx-3与供试植物病原真菌对峙培养5d后,挑取抑菌带中央和边缘的病菌,在光学显微镜下观察病原菌菌丝变化情况。
表1 内生拮抗细菌Zyx-3对葡萄霜霉病菌的抑制作用
采用离体叶盘法测定其对葡萄霜霉病菌(Plasmopara viticola)的抑菌效果,由试验结果可知:该菌发酵液原液对葡萄霜霉病菌的抑制效果达93.34%,稀释十倍后发酵液的抑菌效果仍可达到73.34%。
表2 内生拮抗细菌Zyx-3对14种植物病原真菌的抑菌作用
采用平板对峙法测定了其对其它植物病原真菌的抑菌能力,发现该菌对葡萄灰霉病菌(Botrytis cinerea)的抑制作用也在60%以上(表2);菌株Zyx-3对玉米大斑病菌(Exserohilum turcicum(Pass.)Leonard et Suggs)、葡萄白腐病菌(Coniothyrium diplodiella)、辣椒炭疽病菌(Colletotrichum gloeosporioides)、马铃薯立枯丝核病菌(Rhizoctonia solani Kühn)、苹果轮纹病菌(Physalospora piricola Nose)、苹果腐烂病菌(Valsa mali Miyabe et Yamada)、茄子菌核(Sclerotinia sclerotiorum(Lib.) De Bary)半夏早疫病菌(Alternaria sonali)等13种供试的植物病原真菌也均有不同程度的抑制作用,抑制率在58.17%-74.12%之间,抑菌谱广,具有很强的生防潜力。
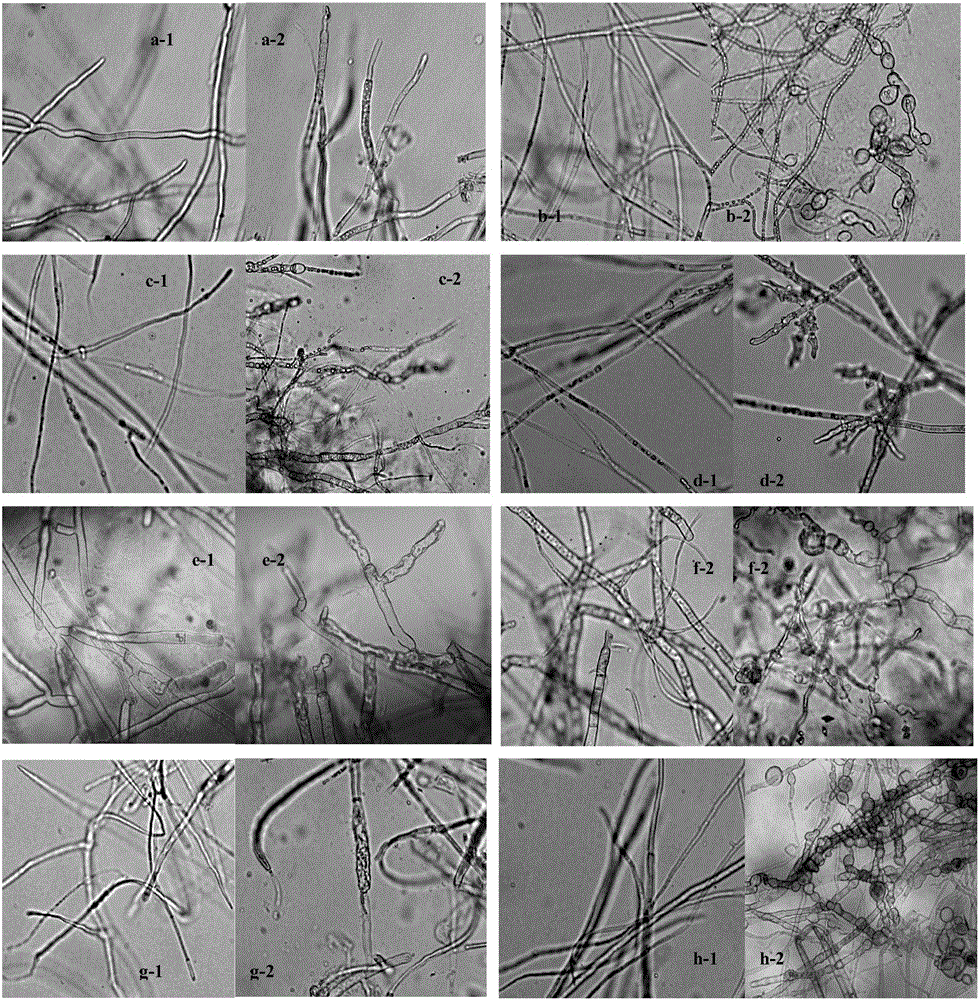
在光学显微镜下镜检对峙培养中抑菌带中央和边缘的病菌菌丝变化状况,发现植物病原菌受到内生拮抗细菌Zyx-3菌株抑制后主要表现出,菌落边缘明显停止生长,菌丝顶端膨大、畸形、形成膨胀泡、分支增多;菌丝短粗、膨大、丛枝聚集增多;中间菌丝形成致密的串状泡囊,菌丝断裂、消融、 原生质外泄等现象(图1:a-2 - h-2)。而正常菌丝细长,光滑而均匀,有分支(图1:a-1 - h-1)。图1中标记:-1表示对照正常菌丝;-2表示处理后变形菌丝;a-葡萄灰霉病菌;b-黄瓜枯萎病菌;c-辣椒炭疽病菌;d-辣椒疫霉病菌;e-马铃薯立枯丝核病菌;f-葡萄白腐病菌;g-茄子菌核病菌;h-玉米大斑病菌。
在光学显微镜下镜检对峙培养中抑菌带中央和边缘的病菌菌丝变化状况,发现植物病原菌受到内生拮抗细菌Zyx-3菌株抑制后,菌落边缘明显停止生长,菌丝顶端膨大、畸形、形成膨胀泡、分支增多;菌丝短粗、膨大、丛枝聚集增多;中间菌丝形成致密的串状泡囊,菌丝断裂、消融、 原生质外泄等现象。而正常菌丝细长,光滑而均匀,有分支。因此可以得出拮抗内生细菌Zyx-3菌株具有潜在的生防价值。
小范围活体生测
供试葡萄品种为红地球,试验共设4个处理,处理1:菌株Zyx-3发酵液浓度为104-105cfu/mL;处理2:菌株Zyx-3发酵液浓度为107-108cfu/mL;处理3:菌株Zyx-3发酵液浓度为1010-1011cfu/mL,;处理4:喷清水(空白对照)。每处理选5株葡萄苗,分别对叶片正反面喷雾处理,整个生育期喷雾4次。待到空白对照叶片充分发病时进行调查中间连续的3株,每株调查全部叶片。
病害分级方法:0级:无病斑;1级:病斑面积占整个叶面积的5%以下;3级:病斑面积占整个叶面积的6%~25%;5级:病斑面积占整个叶面积的26%~50%;7级:病斑面积占整个叶面积的51%~75%;9级:病斑面积占整个叶面积的76%以上。
表3 Zyx-3不同浓度发酵液处理对葡萄霜霉病防治效果
调查结果(见表3)表明,菌株Zyx-3发酵液浓度分别为104-105cfu/mL、107-108cfu/mL和1010-1011cfu/mL时,对葡萄霜霉病的防效分别为34.45%~42.25%、50.12%~57.45%和60.03%~70.47%之间。
拮抗内生细菌Zyx-3菌株产酶能力的研究
蛋白酶测定: 培养基为酪蛋白10.0g,牛肉膏3.0g,Nacl5.0g,K2HPO42.0g,琼脂粉15.0g,水1000ml,PH7.4。
纤维素酶:培养基为 (NH4)2SO4 2.0g,MgSO40.5g,KH2PO41.0g, NaCL0.5g ,纤维素粉2.0g,刚果红0.4g,琼脂15.0g,水1000ml,接种新鲜的Zyx-3菌株,观察透明圈。②采用肉汁胨液体培养基,接种新鲜的Zyx-3菌株,同时浸泡一条灭菌的优质滤纸,观察滤纸条1-4周的分解情况。
过氧化氢酶:移一环新鲜培养的菌株Zyx-3放在洁净的载波片上,加一滴过氧化氢,观察气泡的产生情况。
膦酸酯酶:培养基为酵母提取物0.5g,葡萄糖10.0g,Ca3(PO4)25.0g,(NH4)2SO40.5g,Kcl0.2g,Mgcl20.1g ,MnSO4 .H2O 0.1mg,Fe SO4 0.1mg,琼脂15.0g,水1000ml,接种新鲜的Zyx-3菌株,观察透明圈。
油脂酶:培养基为蛋白胨10.0g,牛肉膏5.0g,Nacl5.0g,花生油10.0g,琼脂粉15.0g,质量浓度1.6%中性红水溶液1 ml,水1000ml,PH7.2左右,接种新鲜的Zyx-3菌株,观察透明圈。
淀粉酶:培养基为在上述NA培养基中加入质量浓度2%的可溶性淀粉倒成平板,倒置过夜后,接种新鲜菌种,28℃条件下培养,待形成明显均落后滴加碘液,观察菌落四周颜色变化。
从内生细菌Zyx-3产酶能力测定结果可以看出:能水解淀粉,不能水解纤维素;能产生过氧化氢酶;不能产生蛋白酶、油脂酶和磷酸酯酶 。
内生拮抗细菌Zyx-3发酵液对葡萄苗生长的影响
将不同浓度(104-105cfu/ml;107-108cfu/ml;1010-1011cuf/ml)的Zyx-3发酵液(NA培养液)喷雾到温室种植的红地球苗木上,观察有无药害产生。
通过观察内生拮抗细菌Zyx-3不同浓度菌悬液对葡萄苗木安全,未出现药害现象,可以在葡萄上使用。
内生拮抗细菌Zyx-3发酵液对种子萌发率和出苗的影响结果
将小麦、玉米种子分别置于不同浓度(104-105cfu/ml;107-108cfu/ml;1010-1011cfu/ml)的Zyx-3发酵液(将内生细菌Zyx-3在NA培养基上活化后,接种到NA培养液(牛肉膏3 g,酵母浸膏1g,蛋白胨5g,葡萄糖10g,自来水1000 mL,pH自然。)中,28℃条件下,180r/min,摇培2d。)中浸泡30min后,放在铺有两层无菌水浸湿的灭菌纸的直径为90mm的培养皿内,每皿分别放10粒种子,3次重复,并设对照处理,28℃条件下保湿培养。每24h观察一次,统计种子发芽粒数,计算发芽率。
发芽率(%)=(发芽的种子粒数/供试种子总粒数)×100
表4 内生拮抗细菌Zyx-3对不同作物种子发芽速率的影响
将试验结果经Duncan新复极差法分析可知(表4),不同浓度(104 cfu/ml -1011 cfu/ml)的内生拮抗细菌Zyx-3发酵液浸种处理的小麦和玉米种子,种子的发芽率均与未处理的对照没有明显的差异,说明内生拮抗细菌Zyx-3对这2种作物种子萌发是安全的,没有抑制作用,也没有明显的促生作用。
内生拮抗细菌Zyx-3的鉴定
形态学及生理生化特性研究:
参考东秀珠《常见细菌系统鉴定手册》和方中达《植病研究方法》的研究方法,进行形态特征观察、培养特性及生理生化特性测定。
16S rDNA鉴定:
细菌基因组DNA的提取:根据16S rDNA两端的保守序列,采用一对细菌的通用引物27F :5-AGAGTTTGATCCTGGCTCAG-3,1492R:5-CTACGGCTACCTTGTTACGA-3。引物由上海桑尼生物工程有限公司合成。PCR反应体系为:10×Buffer(含 2.5mMMg2+) 5.0ul,Taq 聚合酶(5u/μL) 1.0ul,dNTP(10mM)1.0ul,27F 引物 (10uM) 1.5ul,1492R引物 (10uM) 1.5ul,基因组DNA1.0ul,ddH2O39.0ul。扩增程序为:95℃预变性5min;95℃变性 30s;55℃退火45s;72℃延伸1min30s;循环数45后,再72℃终延伸7min。反应完成后,取3ul PCR产物进行1%琼脂糖凝胶电泳检测。确认PCR扩增片段。将特异性条带亮度好、纯度高且无非特异性条带的PCR产物冷冻条件下,送上海桑尼生物科技有限公司进行DNA测序。用BLAST软件将所得序列与GenBank(http://www.ncbi.nln.nih.gov)中已知的16S rDNA进行同源性比较,而后用DNAstar软件进行多序列比对,构建系统发育进化树。
内生细菌Zyx-3在PDA上生长,菌落呈现圆形,表面凸起,后产生皱褶,表面无光泽,不光滑(图2)。在PDA斜面上划线培养生长良好,边缘整齐。在澄清的牛肉膏培养液中生长良好,在培养液表面形成褶皱的膜层,液体不浑浊。内生细菌Zyx-3需氧,能运动;能够使明胶液化;可以水解淀粉;过氧化氢酶反应为阳性;可以在质量浓度10% NaCL培养液中生长;不能利用柠檬酸盐;不能水解纤维素;不产生H2S。在光学显微镜观察下,菌体呈杆状,革兰氏染色为阳性,芽孢着生于菌体的中间,柱形或者椭圆形(图3)。根据形态特征可以初步确定Zyx-3为芽孢杆菌属(Bacillus spp.)。
经质量浓度1%琼脂糖凝胶电泳检测,提取的细菌基因组DNA条带清楚、 亮度高,且无非特异性条带,说明获得的基因组DNA纯度高,可用作为16S rDNA PCR扩增的模板。16S rDNA PCR扩增产物经1%琼脂糖凝胶电泳检测,菌株Zyx-3在1500bp处有一条明亮的PCR目的条带,且无其他非特异性条带。表明16S rDNA PCR扩增得到的目的DNA片段产量高、纯度好。经测序获得菌株Zyx-3的16S rDNA基因有1428个碱基,GenBank 序列登录号为:KT265261,经过Blast相似性分析,菌株Zyx-3与枯草芽孢杆菌Bacillus subtilis同源性最高,相似值均在99%以上。用DNAStar 软件将菌株Zyx-3与来自GenBank的10株细菌一起构建基于16S rDNA序列的系统发育树,Zyx-3与枯草芽孢杆菌Bacillus subtilis(CP009684)聚在一个分支。其它菌株分别聚在另外的一支,没有与菌株Zyx-3聚在同一支上(图4),说明菌株Zyx-3与Bacillus subtilis (CP009684)枯草芽孢杆菌遗传距离更近,结合形态学和生理生化特性等将其鉴定为枯草芽孢杆菌(Bacillus subtilis)。
- 还没有人留言评论。精彩留言会获得点赞!