一种乙醇脱氢酶和葡萄糖脱氢酶共交联酶聚集体的制备方法与流程
本发明涉及一种乙醇脱氢酶和葡萄糖脱氢酶共交联酶聚集体的制备以及该酶聚集体的稳定性和重复使用率的研究,属于酶固定化技术领域。
背景技术:
2011年8月3日,美国食品药品监督管理局批准由辉瑞公司生产的克唑替尼用于治疗alk基因重排的nsclc。2016年3月11日,又被批准用于治疗ros1基因突变的nsclc,其市场需求不断增加。在其合成过程中,(s)-1-(2,6-二氯-3-氟苯基)乙醇是关键的手性中间体。现多通过化学法合成(s)-1-(2,6-二氯-3-氟苯基)乙醇,但不容易得到高纯度的手性化合物,且合成过程复杂,生物合成可以克服这些弊端。
现有的最新的生物合成技术是通过乙醇脱氢酶和葡萄糖脱氢酶共表达菌株的发酵液,通过乙醇脱氢酶和葡萄糖脱氢酶与nadp和nadph的辅酶循环再生体系来催化1-(2,6-二氯-3-氟苯基)乙酮合成手性中间体(s)-1-(2,6-二氯-3-氟苯基)如参考文献(刘丽勤,张骏梁,谭俊,等.乙醇脱氢酶与葡萄糖脱氢酶偶联催化制备(s)-1-(2,6-二氯-3-氟苯基)乙醇[j].工业微生物,2016,46(3):8-12.)。
交联酶聚集体是一种新型的酶固定化技术,能实现酶的聚集和固定化,便于回收利用,而且不需要载体,制备成本低。因此,为了有效地提高手性化合物的制备效率,降低制备成本,本领域技术人员致力于开发催化1-(2,6-二氯-3-氟苯基)乙酮合成手性中间体(s)-1-(2,6-二氯-3-氟苯基)酶固定化技术。
技术实现要素:
本发明的目的在于提供一种乙醇脱氢酶和葡萄糖脱氢酶共交联酶聚集体的制备方法。
本发明的第一方面,提供了一种乙醇脱氢酶和葡萄糖脱氢酶共交联酶聚集体的制备方法,所述方法中包括步骤:
在表面活性剂存在的条件下,经交联剂进行乙醇脱氢酶和葡萄糖脱氢酶的共交联反应。
在另一优选例中,所述表面活性剂选自下组:吐温80、和吐温60。
在另一优选例中,所述方法中,进行所述共交联反应的交联反应体系内表面活性剂和底物酶(乙醇脱氢酶和葡萄糖脱氢酶)的质量比为0.1~1.2:0.5~1;优选地质量比为0.2~1:0.5~1;最优选为约0.4~0.8:1。
在另一优选例中,定义所述底物酶为乙醇脱氢酶和葡萄糖脱氢酶之和。
在另一优选例中,所述交联反应中使用戊二醛作为交联剂。
在另一优选例中,所述交联反应体系内戊二醛和底物酶(乙醇脱氢酶和葡萄糖脱氢酶)的质量比为0.1~1.2:0.5~1;优选为0.2~1.2:1;最优选为约1:1。
在另一优选例中,交联反应中表面活性剂:交联剂:底物酶(乙醇脱氢酶和葡萄糖脱氢酶)的质量比为0.4-0.8:0.8-1.2:0.8-1.2。
在另一优选例中,所述方法包括步骤:
(1)提供含有乙醇脱氢酶和葡萄糖脱氢酶的混合物;
(2)交联反应
制备交联反应体系,所述交联反应体系中包括:步骤(1)提供的含有乙醇脱氢酶和葡萄糖脱氢酶的混合物、交联剂和表面活性剂,0℃~40℃条件下进行交联反应,从而制得所述乙醇脱氢酶和葡萄糖脱氢酶共交联酶聚集体。
在另一优选例中,所述步骤(1)中,包括步骤:
在基因工程菌中共表达乙醇脱氢酶和葡萄糖脱氢酶,从而获得所述含有乙醇脱氢酶和葡萄糖脱氢酶的混合物。
在另一优选例中,所述含有乙醇脱氢酶和葡萄糖脱氢酶的混合物中,乙醇脱氢酶和葡萄糖脱氢酶的质量比为:0.5~1:0.5~1。
在另一优选例中,所述步骤(1)中,包括步骤:
在基因工程菌中共表达乙醇脱氢酶和葡萄糖脱氢酶,从而获得所述含有乙醇脱氢酶和葡萄糖脱氢酶的粗酶液;取所述粗酶液与沉淀剂混合,使得所述乙醇脱氢酶和葡萄糖脱氢酶发生沉淀,从而获得所述含有乙醇脱氢酶和葡萄糖脱氢酶的混合物;优选地,所述沉淀剂为丙酮、乙醇、或硫酸铵。
在另一优选例中,所述沉淀剂为55%~100%(v/v)的丙酮水溶液(优选为60%~100%(v/v);更优选为80%~95%(v/v),如90%);优选地,所述沉淀剂和所述粗酶液的体积为10~30:2~10;优选为20:4。
在另一优选例中,所述步骤(2)中,包括步骤:
向步骤(1)中获得的所述含有乙醇脱氢酶和葡萄糖脱氢酶的混合物中加入交联剂戊二醛水溶液,然后加入吐温80。
在另一优选例中,所述戊二醛水溶液的浓度为1%~5%(v/v),优选为2.5%(v/v)。
在另一优选例中,所述戊二醛水溶液和所述含有乙醇脱氢酶和葡萄糖脱氢酶的混合物的体积比为0.2~1:15~30;优选为0.3~0.6:18~25。
在另一优选例中,所述吐温80为30%~80%(v/v)的吐温80水溶液;优选的所述吐温80水溶液和所述含有乙醇脱氢酶和葡萄糖脱氢酶的混合物的体积比为0.1~0.5:15~30;优选为0.2~0.4:18~25。
本发明的第二方面,提供了一种交联酶聚集体,所述交联酶聚集体由乙醇脱氢酶和葡萄糖脱氢酶经交联剂共交联形成。
在另一优选例中,所述交联酶聚集体由乙醇脱氢酶和葡萄糖脱氢酶经交联剂共交联形成,并且在表面活性剂存在的条件下,进行交联反应。
在另一优选例中,所述表面活性剂为吐温80。
在另一优选例中,交联反应中表面活性剂:交联剂:底物酶(乙醇脱氢酶和葡萄糖脱氢酶)的质量比为0.4-0.8:0.8-1.2:0.8-1.2。
在另一优选例中,所述乙醇脱氢酶和葡萄糖脱氢酶共交联酶聚集体通过权利要求1所述的方法制备。
本发明的第三方面,提供了如本发明第二方面所述的交联酶聚集体在催化1-(2,6-二氯-3-氟苯基)乙酮合成手性中间体(s)-1-(2,6-二氯-3-氟苯基)中的用途。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1.sds-page三个泳道分别是(a)蛋白marker(b)e.colibl21-adh/gdh发酵提取的粗酶液(c)90%丙酮沉淀后上清
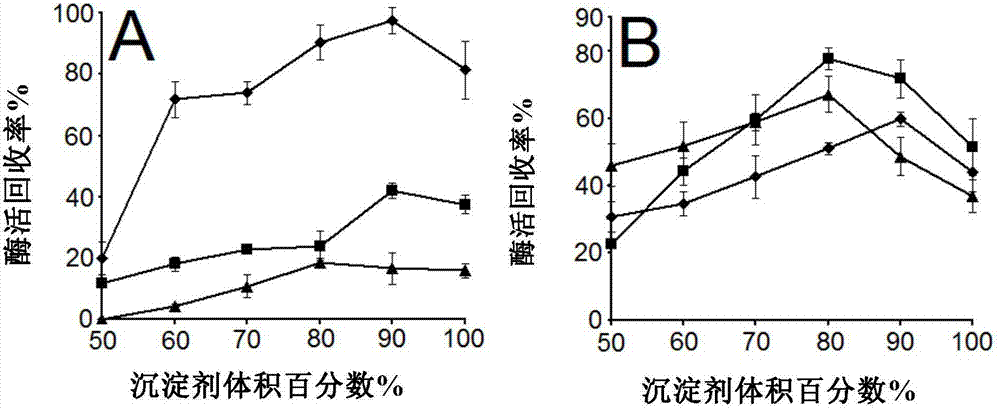
图2.不同体积分数沉淀剂沉淀粗酶液的酶活回收率,a表示adh,b表示gdh,(◆)表示丙酮,(■)表示饱和硫酸铵,(▲)表示乙醇。
图3.不同戊二醛和总蛋白质量比时的酶活回收率,(▲)表示交联时不加吐温80的adh;(◆)表示交联时加吐温80的adh;(●)表示交联时不加吐温80的gdh;(■)表示交联时加吐温80的gdh。
图4.不同ph时的酶活回收曲线,a表示adh,b表示gdh,(▲)表示交联酶聚集体,(■)表示游离酶。
图5.不同温度时的酶活回收曲线,a表示adh,b表示gdh,(▲)表示交联酶聚集体,(■)表示游离酶。
具体实施方式
本发明人通过广泛而深入的研究,获得一种乙醇脱氢酶和葡萄糖脱氢酶共交联酶聚集体的制备方法,在该方法中,通过高密度发酵共表达乙醇脱氢酶和葡萄糖脱氢酶的基因工程菌,以破壁离心后的上清作为粗酶液,粗酶液经沉淀后,将粗酶液中的乙醇脱氢酶和葡萄糖脱氢酶经戊二醛交联制备共交联酶聚集体,而且通过在交联反应中添加吐温80将共交联酶聚集体的酶活回收率提高到80%以上。
在描述本发明之前,应当理解本发明不限于所述的具体方法和实验条件,因为这类方法和条件可以变动。还应当理解本文所用的术语其目的仅在于描述具体实施方案,并且不意图是限制性的,本发明的范围将仅由所附的权利要求书限制。
除非另外定义,否则本文中所用的全部技术与科学术语均具有如本发明所属领域的普通技术人员通常理解的相同含义。如本文所用,在提到具体列举的数值中使用时,术语“约”意指该值可以从列举的值变动不多于1%。例如,如本文所用,表述“约100”包括99和101和之间的全部值(例如,99.1、99.2、99.3、99.4等)。
虽然在本发明的实施或测试中可以使用与本发明中所述相似或等价的任何方法和材料,本文在此处例举优选的方法和材料。
交联酶聚集体
交联酶聚集体技术(cross-linkedenzymeaggregates,cleas)一种新型无载体固定化酶技术,它仅由沉淀和交联两步骤组成,不需要繁琐复杂的酶纯化结晶过程,操作简单、成本低廉、单位体积活性大。通过交联酶聚集体技术制备交联酶聚集体是一种新型的酶固定化技术,对酶的纯度要求不高,能实现酶的聚集和固定化,便于回收利用,而且不需要载体,制备成本低。
本发明通过制备乙醇脱氢酶和葡萄糖脱氢酶共交联酶聚集体来提高生物利用率。粗酶液中酶蛋白上的氨基可以与交联剂的羰基发生schiff碱反应,形成不可逆的化学键,从而制得稳定的颗粒大小为1—100μm的不溶水酶聚集体。现有的交联酶聚集体的制备是通过酶蛋白重溶的溶液来交联,本发明中用共表达adh/gdh大肠杆菌bl21经iptg诱导表达,通过高密度发酵破壁离心后的上清作为粗酶液,将粗酶液中的乙醇脱氢酶和葡萄糖脱氢酶经戊二醛交联制备共交联酶聚集体,而且通过添加吐温80将共交联酶聚集体的酶活回收率提高到82%。
共表达菌体
本发明中制备乙醇脱氢酶和葡萄糖脱氢酶的共表达菌体。本发明用特异性限制内切酶ndei和xhoi对含有adh和gdh的质粒和载体质粒pet-28a进行双酶切和连接,得到含有氨苄青霉素和卡那霉素抗性的质粒pet-28a-adh和pet-28a-gdh,并这两个质粒导入感受态细胞e.colidh5α,得到共表达菌株e.colibl21-adh/gdh,经发酵培养后超声破菌离心得到的上清,通过sds-page检验,如图1所示,证明目标蛋白表达成功。具体的制备共表达菌体的方法可以参考文献“刘丽勤,张骏梁,谭俊,等.乙醇脱氢酶与葡萄糖脱氢酶偶联催化制备(s)-1-(2,6-二氯-3-氟苯基)乙醇[j].工业微生物,2016,46(3):8-12.”或中国专利申请:201610302564x。
本发明的目的是制备乙醇脱氢酶和葡萄糖脱氢酶的共交联酶聚集体。
为实现上述目的,需要进行以下步骤:(1)粗酶液的制备;(2)加入沉淀剂使粗酶液中的酶蛋白沉淀下来;(3)加入交联剂形成酶聚集体;(4)酶聚集体的回收。
其中上述步骤(1)中的酶液不是由酶蛋白溶解得到的,而是由adh/gdh共表达大肠杆菌bl21诱导表达产生。e.colibl21-adh/gdh经iptg诱导表达后,通过高密度发酵后离心收集菌体,菌体经清洗后重悬在0.1mol/l三乙醇胺缓冲液(ph7.0)中,超声破壁离心得到的上清即为粗酶液,蛋白的终浓度是24.64mg/ml。
其中上述步骤(2)中的沉淀剂可以是有机试剂、高浓度盐溶液,本专利通过用不同体积分数的乙醇、丙酮、硫酸铵进行蛋白沉淀试验,最后用90%的丙酮沉淀粗酶液时乙醇脱氢酶的酶活回收率最高几乎达到了98%,如图2所示。
其中上述步骤(3)中的交联剂为戊二醛,得到体系中戊二醛与蛋白的终质量比是0.5:1时交联酶聚集体中乙醇脱氢酶的酶活回收率最大达到了82%,交联的最适时间是1.5小时。
本专利的另一发明目的是提高共交联酶聚集体的酶活,并检验其ph稳定性、温度稳定性,得到酶活较高且相对稳定的共交联酶聚集体。
为实现上述目的,本专利在酶蛋白分子与戊二醛交联时加入表面活性剂吐温80。加入表面活性剂可以改变酶分子表面的疏水性,增加其与底物分子之间的亲和力,使得到的共交联酶聚集体的酶活提高,乙醇脱氢酶的酶活回收率由原来的59%增加到82%,葡萄糖脱氢酶的酶活回收率由原来的35%增加到62%。且得到的共交联酶聚集体ph更稳定,如图4所示在ph4-7时乙醇脱氢酶和葡萄糖脱氢酶都保留了80%的相对酶活,而原酶液在ph4时乙醇脱氢酶的酶活回收率只有40%。由于反应中葡萄糖不断被葡萄糖脱氢酶转化为葡萄糖酸,使体系的ph下降,交联酶聚集体在酸性条件下更稳定,这有利于反应的进行。温度稳定性也相对原粗酶液有所改善如图5所示。在重复使用7次时,乙醇脱氢酶和葡萄糖脱氢酶的活性回收率仍有80%,以实现固定化酶的多次重复使用。
本发明的主要优点在于:
(1)首次制备了乙醇脱氢酶和葡萄糖脱氢酶共交联酶聚集体,实现了固定化酶的多次重复使用,有效地提高了酶的生物利用率;
(2)提供来一种制备乙醇脱氢酶和葡萄糖脱氢酶共交联酶聚集体的方法,所述方法具有较高的酶活性回收率。
下面结合具体实施例,进一步详陈本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明详细条件的实验方法,通常按照常规条件如美国sambrook.j等著《分子克隆实验室指南》(黄培堂等译,北京:科学出版社,2002年)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。以下实施例中所用的实验材料和试剂如无特别说明均可从市售渠道获得。
实施例1
乙醇脱氢酶和葡萄糖脱氢酶共表达
用特异性限制内切酶ndei和xhoi(美国thermo)对含有adh和gdh的质粒进行双酶切,跑电泳后对目标片断进行切胶回收,对载体质粒pet-28a也用ndei和xhoi进行双酶切和切胶回收。将adh和gdh基因片段分别与载体片断进行连接,得到质粒pet-28a-adh和pet-28a-gdh,两个质粒都有氨苄青霉素和卡那霉素抗性。将两个质粒转入感受态细胞e.colidh5α,得到乙醇脱氢酶和葡萄糖脱氢酶的共表达菌株e.colibl21-adh/gdh。将共表达菌株接种到含有氨苄青霉素(amp,100μg/ml)和卡那霉素(kan,100μg/ml)的lb培养基中,37℃恒温摇床230r/min过夜培养。按1ml培养液100mllb培养基(含amp和kan各100μg/ml)的体积比接种到摇瓶中,于37℃(230r/min)摇床中生长,培养到od600约0.8时,添加iptg,使其终浓度为0.2mmol/l,在25℃下(220r/min)培养12h,离心收集菌体。用ph7.0的三乙醇胺(0.1mol/l)缓冲溶液重悬菌体,采用超声破碎仪破碎细胞,3900r/min离心15min去除破碎细胞组织,得到含有乙醇脱氢酶和葡萄糖脱氢酶的粗酶液(以总蛋白计,总蛋白含量为24mg/ml),如sds-page电泳图1的b泳带所示,有明显的目标蛋白条带,说明目标蛋白诱导表达成功,粗酶液中adh和gdh的含量比为约1:1,各占总蛋白质量的约25%~30%。
e.colidh5、e.colibl21(de3)购自cicc23796,质粒购自biovector质粒载体菌种细胞基因保藏中心。
实施例2
沉淀剂的选择
具体实施步骤如下:
(1)本文分别取乙醇,丙酮和饱和硫酸铵溶液1000μl,900μl,800μl,700μl,600μl,500μl,将其分别与0μl,100μl,200μl,300μl,400μl,500μl0.1mol/l的ph7.0的tea缓冲溶液混合,制成100%,90%,80%,70%,60%,50%体积浓度的沉淀剂。
(2)取1ml不同浓度沉淀剂于1.5mlep管中,放在冰水浴上预冷5min,加入200μl粗酶液,在冰水浴上150r/min震荡30min后离心,上面液体用于测定蛋白含量。
(3)沉淀重新用600μltea缓冲溶液重悬,用于测定酶活。结果如图2所示,当用90%的丙酮沉淀粗酶液时,adh的酶活回收率最高约98%,gdh酶活回收率为58%;当用80%硫酸铵沉淀粗酶液时,gdh的酶活回收率最高为80%,adh酶活回收率为41%。由于本反应中adh为限速酶,所以最终选用90%的丙酮沉淀粗酶液,离心后的上清蛋白含量如图1中的c条带,可见明显没有adh和gdh,说明目标蛋白都被沉淀下来。
实施例3
共交联酶聚集体的制备
具体实施步骤如下:
(1)取18ml丙酮和2mltea缓冲溶液配制90%的丙酮溶液于烧杯中,封口并放在冰水浴中,预冷5min后开始搅拌,缓缓滴加4ml粗酶液,搅拌沉淀30min。
(2)滴加体积分数为2.5%的戊二醛溶液480μl,此时溶液中戊二醛:总蛋白质量比为0.5,冰水浴上搅拌1.5小时。
(3)取2ml交联后的固定化酶在3000r/min,4℃下离心2min去上清,可用等体积tea缓存溶液清洗三次,用1mltea缓冲溶液重悬交联酶聚集体,用于酶活测定。
实施例4
加吐温80的共交联酶聚集体的制备
具体实施步骤如下:
(1)取18ml丙酮和2mltea缓冲溶液配制90%的丙酮溶液于烧杯中,封口并放在冰水浴中,预冷5min后开始搅拌,缓缓滴加4ml粗酶液,搅拌沉淀30min。
(2)滴加2.5%的戊二醛溶液480μl,此时溶液中戊二醛:总蛋白质量比为0.5,5min后滴加50%的吐温80直到吐温80与总蛋白的质量比为0.24,冰水浴上搅拌1.5小时。
(3)取2ml交联后的固定化酶在3000r/min,4℃下离心2min去上清,可用等体积tea缓存溶液清洗三次,用1mltea缓冲溶液重悬交联酶聚集体,用于酶活测定。
实施例5
交联时最佳戊二醛浓度的选择
按实施例4的步骤,在其制备过程中滴加2.5%的戊二醛溶液240μl,480μl,960μl,1200μl,1680μl,5%的戊二醛1680μl,使溶液中戊二醛:总蛋白质量比为0.25、0.5、1.0、1.25、1.75、2.50,之后得到的交联酶聚集体清洗三次后测定酶活,结果如图3所示,加或者不加吐温80,戊二醛:总蛋白质量比为0.5时adh酶活回收率最大,而且加吐温80的共交联酶聚集体的酶活回收率为82%明显高于不加时的59%。
实施例6
共交联酶聚集体的ph稳定性试验
按照具体实施例四的步骤制备共交联酶聚集体,将制得的共交联酶聚集体平分成6份,每一份4ml,3000r/min离心后,用等体积ph分别为4,5,6,7,8,9三乙醇胺(0.1mol/l)缓冲溶液洗涤三次,最后用2ml对应ph的缓冲溶液重悬,用于酶活的测定,取酶活最高的点为100%,测定交联酶聚集体在不同ph时的稳定性。
将6份1ml粗酶液分别用ph4,5,6,7,8,9的三乙醇胺缓冲溶液(0.1mol/l)稀释成2.8ml,用ph1和ph12的0.1mol/l三乙醇胺缓冲液调节ph,直至体系ph最终分别为4,5,6,7,8,9,且体积为3ml,测定酶活,取酶活最高的点为100%,测定游离酶在不同ph时的稳定性。
实施例7
共交联酶聚集体的温度稳定性试验
按照具体实施例4的步骤制备共交联酶聚集体,将制得的共交联酶聚集体分成5份,每一份4ml,3000r/min离心后,用等体积ph7.0的三乙醇胺(0.1mol/l)缓冲溶液洗涤三次,最后用2ml缓冲溶液重悬。将五份交联酶聚集体分别放在20℃,30℃,40℃,50℃,60℃水浴锅中保温30min,之后测定酶活,取酶活最高的点为100%,测定交联酶聚集体在不同温度时的稳定性。
将5ml粗酶液用ph7.0的三乙醇胺缓冲溶液(0.1mol/l)稀释成15ml,平分成5份,分别放在20℃,30℃,40℃,50℃,60℃水浴锅中保温30min,之后测定酶活,取酶活最高的点为100%,测定游离酶在不同温度时的稳定性。
实施例8
酶活测定方法
葡萄糖脱氢酶酶活测定方法:
酶反应体系200ul包括:a.0.1mol/l的三乙醇胺缓冲液(ph7.0)110ul。b.10mmol/lnadp+20ul。c.1mol/lc6h12o620ul。d.酶液50ul混合均匀后放30℃保温,从加入gdh粗酶液的那一刻开始计时,监测10s内在340nm处吸光值的上升。根据标曲计算反应生成nadph的量。一个酶活单位u定义为:1分钟内产生1μmolnadph所需要的酶量。
乙醇脱氢酶酶活测定方法:
酶反应体系200ul包括:a.0.1mol/l的三乙醇胺缓冲液(ph7.0)86ul。b.10mmol/lnadph10ul。c.0.1mol/l2,6-二氯-3-氟苯乙酮4ul。d.酶液100ul。混合均匀后放30℃保温,加入100ul酶液后开始计时,检测20s内在340nm处吸光值的降低。根据标曲计算反应消耗nadph的量。1个酶活单位u定义为:1分钟内消耗1μmolnadph所需要的酶量。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!