一种环金属化β‑咔啉类钌配合物及其制备方法和应用与流程
本发明涉及抗肿瘤药物技术领域,具体涉及一种环金属化β-咔啉类钌配合物及其制备方法和应用。
背景技术:
铂类药物作为金属类抗肿瘤药物的代表取得了令人瞩目的成就,但由于铂类药物的毒副作用严重限制了它们的实际疗效和适用范围,寻找高效低毒的新型金属抗癌药物,以改良或补充现有铂类药物的性能是当前的研究热点。
近年来钌配合物作为新的抗肿瘤药物引起科研人员的广泛的关注,国际上普遍认为钌及钌配合物属于低毒性,容易吸收并在体内很快排泄,是非铂类抗肿瘤药物中最有前途的药物之一。为此欧盟于1997年成立了钌类抗肿瘤药物研究和发展工作组(COST D8),专门加强该类药物的研究。目前已经有三个金属钌配合物进入临床研究,分别是:[ImH][trans-RuCl4(Im)(DMSO)](NAMI-A)、[ImH][trans-RuCl4(Im)2](ICR)和KP1019。最新的研究表明钌配合物可以通过多种途径诱使肿瘤死亡:NAMI-A对转移瘤细胞增殖的抑制作用可能是由于能导致细胞膜的形态改变、下调CD44基因编码的表达。KP1019能抑制一些对顺铂具有耐药性的肿瘤生长,且能够连续几周重复高剂量给药而不产生毒副作用,能有选择性的作用于肿瘤细胞。另外钌配合物诱导发生细胞周期阻滞,不同钌配合物作用于不同细胞,细胞周期被阻滞的阶段可能各不相同,但最终都可阻滞细胞增殖,达到诱导细胞凋亡的目的。许多研究也表明,钌配合物可以和细胞内的各种蛋白酶类产生相互作用,达到诱导肿瘤细胞凋亡的目的,如:端粒酶,蛋白激酶、DNA拓扑异构酶、RNA聚合酶等。随着对钌配合物抑制肿瘤细胞增值作用机制研究的深入,越来越多各种类型的钌配合物被报道,为配合机制性研究,对各种易跨膜、高靶向、低毒性的结构修饰也成为一个非常重要的研究内容。
环金属化钌配合物(Cyclo-Ru)应用于抗肿瘤研究起步较晚,近年来,相关的研究报道逐渐增多。Pfeffer课题组于2007年合成了19个Cyclo-Ru,通过活性筛选发现以phpy(2-phenylpyridine)作为C-N环金属化配体的RDC11具有较好的抗肿瘤活性。随后该课题组又设计合成了一系列双齿C-N型,三齿N–C–N和N–N–C型的Cyclo-Ru。体外活性测试表明这一系列Cyclo-Ru均具有非常理想的抗肿瘤活性,其中的一部分IC50值达到纳摩尔级别。中山大学巢晖教授课题组设计合成了一系列结构相似的多吡啶类Cyclo-Ru,与对应的多吡啶钌配合物比较,前者脂溶性增加,靶向细胞核,抗肿瘤活性显著提高。如:[Ru(bpy)(phpy)(dppz)]+与[Ru(bpy)(bpy)(dppz)]2+相比较,当把其中的一个Ru-N键转化为Ru-C键后,抗肿瘤活性增大100多倍,IC50值比顺铂小一个数量级,详细的抗肿瘤机制研究表明前者能够快速的聚集于细胞核,2h后达90%。与RDC11类配合物显著不同的是:多吡啶类Cyclo-Ru具有较强的DNA键合能力,能够干扰转录因子NF-κB与DNA的结合,从而抑制基因转录,诱使不可逆的细胞凋亡。
β-咔啉能够通过多种途径抑制肿瘤,如:嵌入DNA、抑制DNA拓扑异构酶Ⅰ和Ⅱ,抑制细胞周期激酶等。谭彩萍等研究表明β-咔啉与钌配位可以增强该生物碱的抗肿瘤活性,且可以靶向线粒体,引起自噬。对于把β-咔啉及环金属化的概念相结合,设计制备出钌类配合物,将是一个高靶向性的配合物设计策略。
技术实现要素:
本发明所要解决的首要问题是,提供一种结构新型的环金属化β-咔啉类钌配合物,所述的钌配合物具有非常优异的抗肿瘤活性。
本发明所要解决的另一个技术问题是,提供一种结构新型的环金属化β-咔啉类钌配合物的制备方法。
本发明所要解决的再一个技术问题是,提供一种结构新型的环金属化β-咔啉类钌配合物的应用。
本发明所要解决的上述技术问题,通过以下技术方案予以实现:
一种环金属化β-咔啉类钌配合物,以1-phenyl-9H-pyrido[3,4-b]indole(本专利中简称为1-Ph-βC)为主配体,以2,2-联吡啶(本专利中简称为bpy)或4,4-二甲基-2,2联吡啶(本专利中简称为dmb)为辅助配体。
优选地,所述钌配合物中的阳离子具有式Ⅰ或式Ⅱ所示的结构:
优选地,所述配合物中的阴离子为无机盐离子。
最优选地,所述的无机盐离子为(PF6)-。
优选地,所述配合物的化学式为[Ru(bpy)2(1-Ph-βC)](PF6)或[Ru(dmb)2(1-Ph-βC)](PF6)。
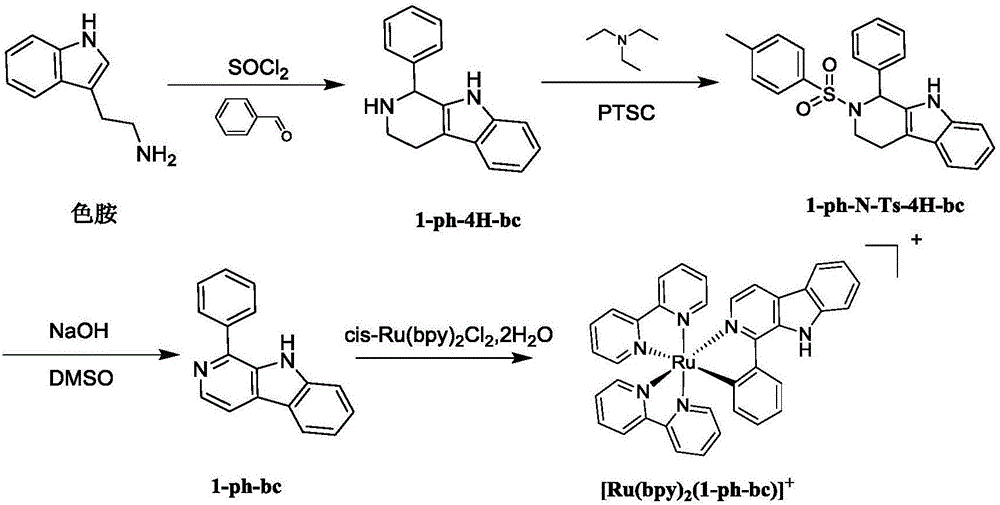
上述环金属化β-咔啉类钌配合物的制备方法,包含如下步骤:
S1.色胺盐酸盐的合成:将色氨与氯化亚砜反应,即得色胺盐酸盐;
S2.1-phenyl-2,3,4,9-tetrahydro-1H-pyrido[3,4-b]indole(本专利中简称为1-Ph-4H-βC)的合成:将色胺盐酸盐与苯甲醛进行加热回流反应,反应结束将产物再加入碳酸钾溶液中进行回流反应,得1-Ph-4H-βC;
S3.1-phenyl-2-tosyl-2,3,4,9-tetrahydro-1H-pyrido[3,4-b]indole(本专利中简称为1-Ph-N-Ts-4H-βC)的合成:将1-Ph-4H-βC与三乙胺混合,然后滴加对甲苯磺酰氯,然后进行室温反应得1-Ph-N-Ts-4H-βC;
S4.1-Ph-βC的合成:将1-Ph-N-Ts-4H-βC溶于NaOH溶液中进行加热回流反应,得1-Ph-βC;
S5.环金属化β-咔啉类钌配合物的合成:将1-Ph-βC与cis-[Ru(bpy)2Cl2]·2H2O或cis-[Ru(dmb)2Cl2]·2H2O进行反应,得所述的环金属化β-咔啉类钌配合物。
优选地,步骤S1中色胺盐酸盐的具体合成方法为:将色氨溶于有机溶剂中,冰浴下滴加氯化亚砜,室温反应20~40min,过滤、漂洗,即得色胺盐酸盐。最优选地,所述的有机溶剂为甲醇。
优选地,步骤S2中1-Ph-4H-βC的具体合成方法为:将色胺盐酸盐与苯甲醛以1~2:1~2的摩尔比于有机溶剂中加热回流,待反应结束后,冷却至室温,旋干;加入碳酸钾溶液充分搅拌回流,萃取、干燥得1-Ph-4H-βC;最优选地,所述的有机溶剂为乙腈。
优选地,步骤S3中1-Ph-N-Ts-4H-βC的具体合成方法为:将1-Ph-4H-βC与三乙胺按摩尔比1~2:2~4加入到有机溶剂中,-10℃下滴加与1-Ph-4H-βC等摩尔量的对甲苯磺酰氯,滴加完毕后,室温搅拌2~4h,旋干、萃取、干燥得1-Ph-N-Ts-4H-βC;优选地,所述的有机溶剂为二氯甲烷。
优选地,步骤S4中1-Ph-βC的具体合成方法为:将1-Ph-N-Ts-4H-bc溶于含有质量百分比为20%~40NaOH的DMSO溶液中,加热回流,反应完全后冷却至室温,加水搅拌,过滤、干燥得1-Ph-βC。
优选地,步骤S5中环金属化β-咔啉类钌配合物的具体合成方法为:将cis-[Ru(bpy)2Cl2]·2H2O或cis-[Ru(dmb)2Cl2]·2H2O与1-Ph-βC以1~2:1~2的摩尔比在惰性气体保护下,加热回流5~8h,然后抽滤,旋干,将粗产物用200-300目中性氧化铝柱进行分离,收集中间红色带洗脱液,得所述的环金属化β-咔啉类钌配合物。
优选地,步骤S5中所述的cis-[Ru(bpy)2Cl2]·2H2O是以RuCl3·nH2O和bpy为原料,以氯化锂为催化剂,经加热回流制备得到。
最优选地,步骤S5中所述的cis-[Ru(bpy)2Cl2]·2H2O具体通过如下方法制备得到:将RuCl3·nH2O、bpy以摩尔比1~2:2~4加入到DMF中,并以氯化锂为催化剂,在惰性气体保护下加热回流,冷却至室温,然后加入丙酮,过滤、干燥即得cis-[Ru(bpy)2Cl2]·2H2O;
优选地,步骤S5中所述的cis-[Ru(dmb)2Cl2]·2H2O是以RuCl3·nH2O和dmb为原料,以氯化锂为催化剂,经加热回流制备得到。
最优选地,步骤S5中所述的cis-[Ru(dmb)2Cl2]·2H2O具体通过如下方法制备得到:将RuCl3·nH2O、dmb以摩尔比1~2:2~4加入到DMF中,并以氯化锂为催化剂,在惰性气体保护下加热回流,冷却至室温,然后加入丙酮,过滤、干燥即得cis-[Ru(bpy)2Cl2]·2H2O。
所述的室温是指15~30℃。
上述环金属化β-咔啉类钌配合物作为抗肿瘤药物的应用。
优选地,所述的肿瘤为肝癌、乳腺癌、肺癌及宫颈癌。
上述环金属化β-咔啉类钌配合物作为细胞周期阻滞剂的应用。
优选地,所述的细胞周期阻滞剂为G0/G1期周期阻滞剂。
有益效果:本发明提供了一种全新结构的环金属化β-咔啉类钌配合物,该钌配合物具有非常优异的抗肿瘤作用;实施例中数据显示,其体外抗肿瘤活性比顺铂更优越,比已报道的结构类似的咔啉类钌配合物活性高出近30倍;实施例数据还显示,所述的钌配合物可以诱导肿瘤细胞的凋亡、能阻滞细胞周期、以及能诱导肿瘤细胞线粒体膜电位损伤。
附图说明
图1为目标化合物[Ru(bpy)2(1-Ph-βC)]+的合成路线图。
图2为为目标化合物[Ru(bpy)2(1-Ph-βC)]+的ESI-MS图以及紫外吸收光谱图。
图3为目标化合物[Ru(dmb)2(1-Ph-βC)]+的合成路线图。
图4为目标化合物[Ru(dmb)2(1-Ph-βC)]+的ESI-MS图以及紫外吸收光谱图。
图5为AO/EB和Hoechst33324染色测试目标化合物诱导HeLa细胞凋亡图。
图6为目标化合物对HeLa细胞周期的阻滞。
图7为JC-1染色检测目标化合物诱导HeLa细胞线粒体膜电位损伤。
具体实施方式
以下结合具体实施例来进一步解释本发明,但实施例对本发明不做任何形式的限定。
实施例1[Ru(bpy)2(1-Ph-βC)](PF6)(简称Ru 1)的制备
(1)色胺盐酸盐的合成
色氨(0.64g,4.0mmol)溶于甲醇中,冰浴下缓慢滴加氯化亚砜(0.20~0.32g,2.0~3.2mmol),滴加完毕,恢复至室温下反应30min,过滤得盐酸盐固体,再将滤液减压蒸馏去溶剂,所得固体用乙酸乙酯漂洗,烘干后得到白色盐酸盐固体,产率为85.3%。
(2)1-Ph-4H-βC的合成
在50ml反应管中将色胺盐酸盐(0.78g,4mmol)与苯甲醛(0.508g,4.8mmol)在10mL分子筛干燥的乙腈中混匀。80℃回流13h,冷却至室温,TLC跟踪反应结束。观察到如果有沉淀生成,以石油醚和乙酸乙酯的混合液按照2:1过滤;如果没有观察到沉淀,旋干样品,随后,加入5mL 10%的碳酸钾溶液在100℃下回流,充分搅拌,冷却后用乙酸乙酯萃取,合并有机相,无水MgSO4干燥,蒸干溶剂得产品,产率为89.7%。
(3)1-Ph-N-Ts-4H-βC的合成
将1-Ph-4H-βC(0.20g,0.8mmol)与三乙胺按照摩尔比为1:2加入到二氯甲烷中,-10℃下慢慢加入对甲苯磺酰氯(0.152g,0.8mmol),滴加完毕后,恢复室温反应3h,TLC跟踪,至到原料点消失。旋干二氯甲烷,乙酸乙酯10mL溶解固体,先用HCl萃取洗涤,再用碳酸钠萃取洗涤。无水硫酸镁干燥,抽滤,旋干,石油醚淋洗固体,抽滤,得粗产品,产率:82.1%。
(4)主配体1-Ph-βC的合成
将1-Ph-N-Ts-4H-βC(0.22g,0.5mmol)溶于含有30%NaOH的DMSO溶液中,120℃加热回流,TLC跟踪反应结束,待恢复至室温,加入30mL水搅拌反应30min,过滤,沉淀,用水漂洗3次,干燥得粗产品,产率为80.2%。
(5)cis-[Ru(bpy)2(Cl)2]·2H2O的合成
在50mL的三口瓶中:将bpy(0.62g,4mmol)、氯化锂(1.26g,30mmol)、三氯化钌(0.6g,2mmol)于DMF中混匀,在氩气保护下加热140℃回流反应8h。停止反应后,冷却到室温,加入丙酮,在-4℃放置过夜,抽滤,得到紫黑色晶体。以冰水、丙酮淋洗晶体,真空干燥,得到紫黑色晶体,产率82.5%。
(6)Ru 1的合成
将cis-Ru(bpy)2Cl2·2H2O(0.106g,0.2mmol)和2.5倍量三氟甲磺酸银(0.128g,0.5mmol)溶于15mL分子筛干燥过的无水乙醇中,在氩气保护下80℃加热回流反应3h。然后加入1倍量1-Ph-βC(0.0488g,0.2mmol),80℃下加热回流反应过夜。待反应冷却至室温,加入NH4PF6除去溶液中溶解的杂质,将析出的晶体干燥,用少量乙腈溶解,以甲苯:乙腈(2:1,v/v)为洗脱剂氧化铝柱层析纯化,产率:82.1%。结构式如式1所示。C37H27F6N6PRu理论值:C 55.43%,H 3.39%,N 10.48%;实验值:C 55.37%,H 3.37%,N 10.53%。ESI-MS(CH3OH):C37H27N6Ru+[M-PF6]+m/z理论值657.13,实验值657.06。
实施例2[Ru(dmb)2(1-Ph-βC)](PF6)(简称Ru 2)的制备
(1)色胺盐酸盐的合成
同实施例1。
(2)1-Ph-4H-βC的合成
同实施例1。
(3)1-Ph-N-Ts-4H-βC的合成
同实施例1。
(4)主配体1-Ph-βC的合成
同实施例1。
(5)cis-[Ru(dmb)2(Cl)2]·2H2O的合成
在50mL的三口瓶中:将dmb(0.73g,4mmol)、氯化锂(1.26g,30mmol)、三氯化钌(0.6g,2mmol)于DMF中混匀,在氩气保护下140℃加热回流反应8h。停止反应后,冷却到室温,加入丙酮,在-4℃放置过夜,抽滤,得到紫黑色晶体,并以冰水、丙酮淋洗晶体,真空干燥,得到紫黑色晶体,产率85.7%。
Ru 2的合成。
(6)Ru 2的合成
将cis-Ru(dmb)2Cl2·2H2O(0.108g,0.2mmol)和2.5倍量三氟甲磺酸银(0.128g,0.5mmol)溶于15mL分子筛干燥过的无水乙醇中,在氩气保护下80℃加热回流3h,然后加入1倍量1-ph-bc(0.0488g,0.2mmol),在80℃下继续加热回流反应过夜。待反应冷却至室温,加入NH4PF6除去溶液中溶解的杂质,将析出的晶体干燥,用少量甲醇溶解,以甲苯:乙腈(2:1,v/v)为洗脱剂氧化铝柱层析纯化,产率:81.8%。结构式如式2所示。C41H35F6N6PRu理论值:C 57.41%,H 4.11%,N 9.80%;实验值:C 57.21%,H 4.01%,N 9.92%。ESI-MS(CH3OH):C41H35N6Ru+[M-PF6]+m/z理论值713.20,实验值713.21。
实施例3本发明所述钌配合物体外毒性试验
待测试的肿瘤细胞:肿瘤细胞A549(肺癌细胞)、HeLa(宫颈癌细胞)、NCl-H460(非小细胞肺癌细胞)、HepG-2(肝癌细胞)、MCF-7(人乳腺癌细胞)。
细胞毒性实验:采用MTT法研究了化合物的体外细胞毒性,具体操做如下:先将胰酶消化的肿瘤细胞稀释为5~10×104个/mL,取含肿瘤细胞的培养液0.1mL于96孔细胞培养板中,然后将接种好的细胞板在37℃,5%的CO2培养箱中培养24h。将长满单层细胞培养板弃液加入不同浓度的化合物(Ru 1与Ru 2的浓度分别为0.25、0.5、1.0、2.0、4.0、8.0、16.0μM,顺铂的浓度分别为2.0、4.0、8.0、16.0、、32.0、64.0、128.0μM),并设对照组(细胞培养板中加入0.1mL培养基),放入37℃,5%CO2的培养箱中培养48h后,吸去培养液,用PBS洗涤一次。每孔加20L 5mg/mL的MTT染料液,在37℃,5%CO2的培养箱中培养4h后,随后加入三联液100L每孔并混匀,37℃放置过夜以溶解甲臢,用酶标仪在490nm处检测各孔OD值。计算50%细胞存活时化合物的浓度(IC50)。由下表1可知,两个咔啉环金属化钌配合物表现出比顺铂(Cisplatin)更优越的抗肿瘤活性,比已报道的结构类似的咔啉类钌配合物活性高出近30倍(Tan,等,J.Med.Chem.2010,53,7613–7624)。
表1本发明所述钌配合物体对肿瘤细胞的IC50值
*1-Py-βC=1-(2-pyridyl)-β-carboline),[Ru(bpy)2(1-Py-βC)](PF6)2的IC50数据来自文献Tan,等,J.Med.Chem.2010,53,7613–7624。
实施例4,本发明所述钌配合物诱导HeLa细胞凋亡试验
细胞凋亡实验具体步骤如下:将细胞接种于60mm的Corning培养皿中,12h后,加入不同浓度药物进行处理24h,细胞用4%多聚甲醛于4℃固定30min(AO/EB染色细胞不用固定),用预冷的PBS洗涤两次。AO/EB、Hoechst 33324常温下染色10min,随后用预冷的PBS洗涤两次,荧光显微镜下观察,其细胞凋亡如附图5。结果表明配合物Ru 1、Ru 2能够显著的诱导HeLa细胞凋亡。
实施例5本发明所述钌配合物诱导HeLa细胞周期阻滞试验
细胞周期实验具体步骤如下:将细胞以1×105个接种于六孔板中,培养12h后加入不同浓度药物进行处理,经过24h后,细胞用胰蛋白酶消化,并用预冷的PBS洗涤两次,75%乙醇-20℃固定过夜,离心去除固定液再加入40L的RNAse(50g/mL)和20L的碘化丙啶(PI,50g/mL),于37℃、5%的CO2培养箱中孵化30min,立即采用流式细胞仪进行分析,每个样品收集的细胞数为1×104个。化合物对HeLa细胞周期阻滞图如图6所示,结果表明目标配合物能够诱导HeLa细胞发生G0/G1期周期阻滞。
实施例6本发明所述钌配合物诱导HeLa细胞线粒体膜电位损伤试验
线粒体膜电位检测具体步骤如下:将细胞以1×105接种于六孔板中,培养12h后加入不同浓度药物进行处理,经过24h后,细胞用胰蛋白酶消化,并用预冷的PBS洗涤两次,离心后再加入250L的线粒体荧光探针JC-1在37℃、5%的CO2培养箱中孵化30min,立即采用流式细胞仪进行分析,每个样品收集的细胞数为1×104个。实验结果如图7所示,结果表明目标配合物能够诱导HeLa细胞线粒体膜电位降低。
- 还没有人留言评论。精彩留言会获得点赞!