深层过滤单克隆抗体细胞培养液的方法与流程
本发明属于抗体药物纯化方法领域,具体内容涉及中试规模澄清过滤抗PD-1单克隆抗体细胞液的方法。
背景技术:
通过淋巴细胞杂交瘤技术或基因工程技术制备单克隆抗体药物已经成为生物制药领域的一个重要方面由于单克隆抗体药物专一性强、疗效显著,因此成为近年来研究的热点药物之一。其中,针对PD-1受体的单克隆抗体药物更为众多国内外医药研发机构所关注。
程序性死亡受体1(Programmed Death-1),也称之PD-1和CD279,最初是在1992年从凋亡的小鼠T细胞杂交瘤2B4.11克隆得到并命名。PD-1是免疫球蛋白超家族CD28家族成员,相对分子量为50~55KD的Ⅰ型跨膜糖蛋白。PD-1是T细胞免疫抑制受体,在激活的T细胞和B细胞中高表达,在肿瘤细胞中可限制T细胞效应子的功能,同时在调控肿瘤免疫逃逸以及自身免疫反应方面起着关键性的作用。
PD-1作为受体,它的配体有两个PD-L1(B7-H1)和PD-L2(B7-DC)。PD-1与PD-L1结合可以激活TCR和BCR,促使PD-1的ITSM结构域中的Tyr磷酸化,进而使SH2结构域(包括SHP-2和SHP-1)结合到PD-1的胞桨区,引起CD28调控的PI3K去磷酸化,抑制下游AKT/ERK等通路的活化,导致T细胞活化所需的基因及细胞因子转录和翻译被抑制。PD-1同时也可以抑制其他信号分子的磷酸化,比如CD3,ZAP70和PCK。PD-1/PD-L1信号通路的免疫抑制作用对多种免疫失调性疾病的发生及发展具有重要作用。
单克隆抗体生产的细胞培养阶段目前多采用悬浮细胞高密度培养,细胞培养完成后所获得的含有抗体的细胞培养液会含有蛋白酶、宿主细胞、细胞碎片等污染物,影响抗体的稳定性和纯度,需要经过去除使细胞液澄清后才能用于后续的抗体分离纯化过程。细胞培养液澄清的方法有很多,比如离心,中空纤维过滤,表面过滤,深层过滤等,而深层过滤是目前国内外单抗生产细胞培养液澄清的主要方法。深层过滤指的是利用多孔介质从流动相中截留固体颗粒而不是表面截留,且一般介质表面都带有正电荷,可以通过静电吸附的方式来拦截杂质颗粒。深层过滤一般应用介质层较厚的滤床类(如沙层、硅藻土等)作为过滤介质,小于介质空隙的颗粒可进入到介质内部,而长而曲折的孔道中被截留并附着于介质之上。目前行业内拥有深层过滤介质产品的公司包括赛多利斯,默克密理博,PALL,3M等公司。例如赛多利斯公司的Sartoclear Dynamics和PALL公司的Seitz BS、Seitz HR系列都常用于哺乳动物细胞的澄清过滤。
深层过滤过程有别于表面过滤,是一种逐渐堵塞的过程,在一定的膜通量条件下,随着时间的进行,澄清过滤的料液体积逐渐增大,深层滤膜的压降也逐渐增大,滤过的澄清液的浊度也变大,整个过滤过程相当复杂,例如过程所需的膜面积与过滤时间、过滤体积和压降相关。在实际工艺放大过程中,对于不同特性的抗体细胞的过滤,若选取的深层过滤膜面积偏小,不足以满足全部过滤完所有的细胞培养液,造成过滤膜的堵塞将影响工艺的进行,造成过滤后的细胞培养液浊度较高而影响下游柱层析的堵塞,且容易增加污染风险;若选取的膜面积过大,不能有效的利用膜面积,则会造成不必要的成本浪费。因此在对抗PD-1单克隆抗体细胞液采用深层过滤时,需要对过滤的参数进行优化研究,特别是中试以上规模的抗体生产中,成本的增加更需要合适的深层过滤工艺。
技术实现要素:
本发明通过小试模拟深层过滤的过程,采用测试得到的数据拟合数学方程计算得到中试规模所需深层过滤膜的面积,并优化深层过滤工艺参数,得到中试规模深层过滤抗PD-1单克隆抗体细胞培养液的方法,该方法能够有效的抗PD-1单克隆抗体细胞培养液进行澄清过滤,能够有效利用膜面积,最大限度的减少深层过滤膜的浪费,适合中试规模的生产。
本发明提供的中试规模深层过滤抗PD-1单克隆抗体细胞培养液的方法,其特征在于,所述细胞培养液细胞密度为100×105~400×105cell/mL,细胞活率为50%~90%,浊度为4000NTU~6000NTU,所述方法包含以下步骤:
步骤1)深层过滤膜的组装:将深层过滤膜片组装至深层过滤器中,所述过滤膜片按过滤顺序先后为D0HC和A1HC两种型号;
步骤2)预冲洗:采用注射用水对深层过滤膜进行预冲洗和润湿,注射用水预冲洗体积为50~150L/㎡,预冲洗通量为400~700LMH;
步骤3)缓冲液平衡:采用缓冲液对深层过滤膜进行平衡,所述缓冲液为20mM NaPi缓冲溶液,pH为7.2,,平衡体积为20~50L/㎡,缓冲液平衡通量为400~700LMH;
步骤4)过滤细胞培养液:用蠕动泵将发酵罐中的细胞培养液送至深层过滤器中过滤,过滤通量为50~180LMH,细胞液澄清过滤压力终点为12~22psi,过滤工艺时间为1~3小时;
步骤5)冲膜回收:用步骤3)所述缓冲液对深层过滤膜进行冲洗并回收缓冲液,冲洗体积为20~50L/㎡,冲洗通量为50~180LMH。
本发明所述抗PD-1单克隆抗体细胞培养液所用的细胞株为采用二氢叶酸还原酶缺陷型系统表达的抗PD-1单克隆抗体的基因重组CHO细胞。
本发明采用的深层过滤膜型号D0HC和A1HC为默克密理博公司生产,采用的介质均为两层高密度的吸附介质,为带正电荷的硅藻土和纤维素膜,可高效的截留细胞污染物,提高截留载量。D0HC和A1HC的膜孔径分布范围分别为0.5~10μm和0.01~0.5μm,能有效保证细胞培养液澄清后的浊度。根据所需澄清过滤的细胞液的体积以及研究和生产需要,有测试级的过滤膜包和放大生产的膜片供使用,其中测试级的过滤膜包单个膜包的膜面积为23cm2,供放大生产的单个膜片的膜面积为1.1m2,使用时根据实际需要的膜面积进行膜片的叠加安装。
本发明所述中试规模指体积为130~150L细胞培养液。
由于抗体制备的成本昂贵,为了节约成本,本发明采用测试级的D0HC和A1HC过滤器进行深层过滤工艺研究,以获得最适合放大中试规模对抗PD-1抗体细胞液进行深层澄清过滤的工艺。
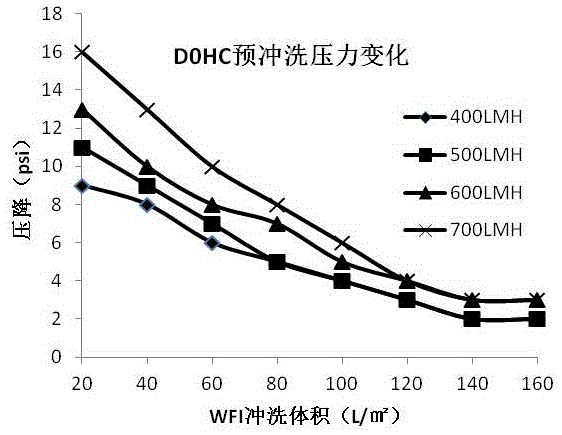
首先将测试型号的膜面积均为23cm2的D0HC和A1HC过滤膜包,先后通过硅胶管组装一起。用注射用水冲洗深层过滤膜包,将膜包内空气全部赶出,充分润湿。为了得到注射水冲洗深层过滤膜的最佳通量以及冲洗体积,减少资源的浪费;本发明分别通过400LMH、500LMH、600LMH、700LMH四种不同的通量条件下用160L/㎡注射用水分别冲洗D0HC和A1HC深层过滤膜包,并在每隔20L/㎡分别记录每级的压力差,并绘制曲线(见图1和图2),观察通量和冲洗体积之间的变化关系以及对膜压力的影响;从图1、图2的结果可知,在700LMH通量条件下,起始压力过高,故高通量不适合使用,注射水冲洗的通量优选500~600LMH。
总有机碳(TOC)一般指存在于含水溶液中并测量为碳含量的有机分子的量度,在实际应用中TOC常常用于评价设备或容器的清洗干净程度,因此本发明用注射用水以600LMH通量预冲洗深层滤器,每冲洗10L/㎡时,分别在每级过滤器出口端取样,测定TOC的变化值,以得到最优的注射水冲洗体积(见图3)。
从图3可知,当冲洗体积为90L/㎡时,两级深层过滤器的出口端收集液测得的TOC趋于稳定,小于2ppm,可认为冲洗完全,满足工艺要求。从图1和图2中可以得到,深层滤膜D0HC和A1HC在用注射用水预冲洗50L/㎡后,压力变化缓慢,预冲洗150L/㎡后趋于稳定。因此根据图1、图2、图3显示的结果,综合考虑注射水冲洗时间和压力的关系,效率和成本的最优化,优选预冲洗的注射用水体积为90~140L/㎡。
在细胞培养液通过深层过滤膜包前,需用一种合适的缓冲液将膜包内的注射用水置换出来,保证当料液进入深层过滤膜包时保持相对稳定的渗透压以及pH等条件,保持抗体蛋白性质的稳定。本发明的缓冲液采用20mM磷酸-磷酸钠(NaPi)缓冲液,pH为7.2。
保持与上述注射水冲洗深层过滤膜的通量500~600LMH不变,用20mM NaPi,pH7.2缓冲溶液平衡深层过滤膜包,记录最终深层过滤膜包出口的pH和电导率的变化,当pH和电导接近于入口端的条件时,表示平衡完成(见图4)。
从图4可以得知,当平衡体积为20L/㎡时,两级深层过滤器出口端收集液测得的pH趋于稳定,接近平衡液的pH;当平衡体积为20L/㎡时,两级深层过滤器出口端收集液测得的电导趋于稳定,接近平衡缓冲液的电导值。
综合以上结果,考虑平衡缓冲液的使用成本和平衡效果,优选平衡体积为20~40L/㎡,平衡时缓冲液通量为500~600LMH,与预冲洗一致。
平衡结束后,用蠕动泵将细胞培养液泵入深层过滤器,为了能够得到真实模拟抗PD-1单克隆抗体细胞培养液深层过滤澄清的过程,本发明每隔一定时间记录过滤的体积L(mL)、深层过滤膜两侧的压力差/压降P(psi)、过滤出口端测得的瞬时浊度(NTU)。
根据记录的数值,用瞬时的过滤体积L(mL)和膜面积M(㎡)的比值来表示深层过滤膜对细胞培养液的载量L/M(L/㎡);再通过深层过滤膜的膜载量L/M(L/㎡)和过滤时间的比值来计算得到瞬时通量(LMH);再以瞬时压力与通量的比值计算得到每个时间节点的深层滤膜堵塞量P/LMH,堵塞量表明在一定压力终点下的通量值的变化。根据记录和计算的数据,填写如下表格:
以深层滤膜的载量(L/M)为X值,以深层滤膜堵塞量P/LMH为Y值,建立一元三次方程:Y=aX3+bX2+cX+d,即:P/LMH=a(L/M)3+b(L/M)2+c(L/M)+d。
上述方程中,限定其他任何三个变量值,可求解得到另一个变量。例如,在放大工艺中,将工艺中既定参数如处理料液体积L为140L,处理时间H为2小时,压力终点P为15psi,代入方程中,通过单变量求解即可得到所需的膜面积M的值。
通过上述方法可计算得到不同放大规模的细胞培养液所需要的深层过滤膜的理论膜面积,在理论膜面积的基础上乘以一定的安全系数即为实际生产中所需的实际膜面积。安全系数一般是指为了考虑膜材料的批次差异、工作的偏差、外力等因素引起的后果偏差,实际使用值必须大于理论计算值,从而定义这种数值比值为安全系数。本发明要求安全系数在1.5以上,否则会造成实际应用时过滤膜出现堵塞,压力上升,造成产品过滤效果变差,影响抗体纯化后续工艺。
由于含有细胞和细胞碎片的培养液通过用缓冲液平衡好的深层滤膜时,流速的差异可能会带来深层滤膜逐渐堵塞的问题,本发明按以下方法实验研究得到最佳通量(LMH)范围。
取抗PD-1单克隆抗体细胞培养液进行测试,其细胞密度为342.56×105,细胞活率为80.1%,浊度为4563NTU。分别设定通量为50LMH、100LMH、150LMH、200LMH条件下采用D0HC和A1HC过滤膜过滤上述细胞培养液,过滤过程中每5分钟记录压力P(psi),过滤体积L(mL),并测定浊度(NTU)。
计算得到每个时间节点的载量L/M(L/㎡)和深层滤膜堵塞量P/LMH,代入方程P/LMH=a(L/M)3+b(L/M)2+c(L/M)+d中,拟合得到在四种不同通量下的深层过滤膜堵塞方程,得出回归系数R2,如下表所示:
从上述D0HC和A1HC的过滤堵塞方程可知,从50LMH~200LMH内回归系数都较好,说明在这个通量范围内都适用于本发明的深层过滤工艺,当膜通量在100LMH~150LMH之间时,方程的回归系数更接近1,模型拟合程度最高。
本发明按以下方法预测计算抗PD-1单克隆抗体细胞培养液深层过滤的放大工艺条件。
设定深层过滤膜压力终点为15psi,以中试放大规模的细胞培养液的过滤体积为140L,分别通过上述方程式计算得到不同通量条件下,工艺时间从0.5,1,1.5,2,2.5,3,3.5,4小时所需的最小膜面积,得到D0HC和A1HC过滤膜不同过滤时间条件下计算得到的膜面积变化图(图5和图6)。
由图5和图6可知,在相同膜通量条件下,随着工艺时间的延长,所需要的膜面积相对减少;同样随着膜通量的增加,相同工艺时间条件下所需要的膜面积增大。
由图5可知,在工艺时间小于1小时和大于3小时区间时,计算得到的所需理论膜面积随膜通量的变化影响较小;另一方面,在过滤膜通量在60LMH~140LMH之间得到曲率最大,即计算得到的理论膜面积变化较大,有优化空间。
由图6可知,与图5不同的是,A1HC受深层过滤通量和工艺时间影响较小,曲率相对平缓。当深层过滤通量大于140LMH和工艺时间大于3小时条件下,计算得到的理论膜面积随工艺条件变化较小。
因此,抗PD-1单克隆抗体细胞培养液中试放大规模深层过滤的最佳工艺条件为:深层过滤通量为60LMH~140LMH,过滤工艺时间为1~3小时。
另外,在深层过滤膜通量为60LMH~140LMH,过滤工艺时间为1~3小时条件下,计算深层过滤所需的最小膜面积分别为:D0HC为1.5~2.3㎡,A1HC为1.1~1.8㎡。根据安全系数需大于1.5,计算得到D0HC和A1HC两级深层过滤膜理论膜面积分别为2.25~3.45㎡和1.65~2.70㎡,由于单个膜片的膜面积是1.1m2,所以实际应用于中试放大深层过滤的总膜面积为3.3㎡和2.2㎡。
当细胞培养液深层过滤结束后,需要用平衡缓冲液将滤膜内残留的细胞培养液赶出回收,简称冲膜回收。冲洗膜包回收细胞澄清液时,用pH7.2,20mM NaPi,缓冲溶液冲洗滤膜,通量保持与细胞培养液澄清过滤时一致,即60LMH~140LMH。用40L/㎡的平衡缓冲液以90LMH通量进行冲膜回收,每收集10L/㎡时取样测定收集液的抗体含量,计算收集得到的澄清液抗体含量与原始细胞培养液的抗体含量差值所占百分比,即计算冲洗回收率(%)(见图7),若回收率接近百分百,表明深层滤膜冲洗干净,几乎无细胞培养液残留在滤膜内部。
由图7可知,当平衡液冲洗体积到达20L/㎡时,抗PD-1单克隆抗体的瞬时回收率上升为98%,之后曲线趋于平稳回收率接近100%,表明滤膜冲洗干净,综合考虑回收率和经济效益,优选平衡缓冲液冲洗回收的体积为20L/㎡~40L/㎡。
综合以上研究结果,得到抗PD-1单克隆抗体细胞培养液深层过滤中试放大优化工艺参数如下:
本发明提供了一种中试放大规模澄清过滤抗PD-1单克隆抗体的方法,该方法是采用D0HC和A1HC过滤膜两级深层过滤,通过小试模拟深层过滤的过程,采用测试得到的数据拟合数学方程计算得到中试规模所需深层过滤膜的面积,同时优化其它工艺参数而得到的,该方法能够使中试放大规模澄清过滤抗PD-1单克隆抗体时,使用尽量少面积的的深层过滤膜,节约生产成本,而滤膜压力终点不大于15psi,过滤澄清液浊度小于20NTU,适合工业化放大生产。
下面结合具体实施方式的实施例和说明书附图对本发明做进一步说明。
附图说明
附图1不同通量下冲洗深层过滤膜D0HC的压力变化情况;
附图2不同通量下冲洗深层过滤膜A1HC的压力变化情况;
附图3预冲洗深层过滤膜D0HC和A1HC的总有机碳(TOC)冲洗曲线;
附图4平衡缓冲液冲洗深层过滤膜D0HC和A1HC的pH和电导流出曲线;
附图5以不同通量抗PD-1单克隆抗体细胞培养液测试深层过滤膜D0HC得到堵塞方程,并通过计算得到不同过滤时间条件下,过滤达到压力终点15psi所需要的理论膜面积变化图;
附图6以不同通量抗PD-1单克隆抗体细胞培养液测试深层过滤膜A1HC得到堵塞方程,并通过计算得到不同过滤时间条件下,过滤达到压力终点15psi所需要的理论膜面积变化图;
附图7用40L/㎡的平衡缓冲液以90LMH通量下冲膜回收得到的最终抗体含量回收率的变化曲线;
附图8实施例1中抗PD-1单克隆抗体细胞培养液装载于深层过滤膜D0HC所得的过滤曲线;
附图9实施例1中抗PD-1单克隆抗体细胞培养液装载于深层过滤膜A1HC所得的过滤曲线;
附图10实施例2中抗PD-1单克隆抗体细胞培养液装载于深层过滤膜D0HC所得的过滤曲线;
附图11实施例2中抗PD-1单克隆抗体细胞培养液装载于深层过滤膜A1HC所得的过滤曲线;
附图12实施例3中抗PD-1单克隆抗体细胞培养液装载于深层过滤膜D0HC所得的过滤曲线;
附图13实施例3中抗PD-1单克隆抗体细胞培养液装载于深层过滤膜A1HC所得的过滤曲线;
附图14实施例4中抗PD-1单克隆抗体细胞培养液装载于深层过滤膜D0HC所得的过滤曲线;
附图15实施例4中抗PD-1单克隆抗体细胞培养液装载于深层过滤膜A1HC得到的过滤曲线;
附图16实施例5中抗PD-1单克隆抗体细胞培养液装载于深层过滤膜D0HC所得的过滤曲线;
附图17实施例5中抗PD-1单克隆抗体细胞培养液装载于深层过滤膜A1HC所得的过滤曲线。
具体实施方式
在进一步详细描述本发明之前会定义多个术语。使用这些术语并不限制本发明的范围,而仅用来单独地表明每个单独的出版物、专利或专利申请援引加入文本相同。
如本文所用,短语“细胞培养液”包括细胞、细胞碎片和胶体颗粒,以及所关注的生物分子、HCP及DNA。
如本文所用,短语“澄清过滤”一般是指在纯化生物分子中最初使用的一个或者多个步骤,特别地,在本文和“深层过滤”具有相同概念。
如本文所用,短语“CV”一般是指层析柱或膜腔体积,特别地在本文指深层滤器膜腔体积,和10L/㎡具有相同的体积概念。
如本文所用,术语“总有机可提取物”或“TOC”一般指存在于含水溶液中并测量为碳含量的有机分子的量度。用来测量TOC的分析技术通常包括将溶液中的所有有机分子氧化为二氧化碳,测量所得的CO2浓度,以及将这个反应关联至已知的碳浓度。
如本文所用,术语“百万分数”或“ppm”在本文中可交换使用。
如本文所用,术语“通量”,与“流速”同义,指单位时间滤过一定膜面积的深层滤器的液体体积,特别地,在本文用单位LMH表示。
如本文所用,术语“浊度”一般指含水的溶液中的悬浮物对光线透过时所发生的阻碍程度,特别地在本文悬浮物指细胞、细胞碎片等,用单位NTU表示。
如本文所用,短语“压降”、“压力”或“压力终点”是指当溶液通过滤器时,由于受到阻碍所产生的膜两侧的压力差,用单位“psi”或“bar”或“MPa”表示。
如本文所用,短语“载量”是指每平方米深层滤膜所能加载或通过的水、溶液或细胞发酵液等液体的体积,单位用L/㎡表示。
如本文所用,短语“膜孔径”是指多孔固体表面或内部通道的大小或形状,特别地在本文指深层滤器膜内部通道的大小分布范围,一般用“μm”表示。
如本文所用,术语“细胞密度”一般是指在单位体积(mL)或单位面积(cm2)内计数得到的细胞总数,用单位:“cell/mL”或“cell/cm2”表示,者具有相同含义。
如本文所用,术语“细胞活率”一般是指在单位体积(mL)或单位面积(cm2)内计数得到的活细胞数量与细胞总数的比值,用单位“%”表示。
如本文所用,短语“安全系数”一般是指为了考虑材料的缺点,工作的偏差、外力等因素引起的后果,实际使用值必须大于理论计算值,从而定义这种数值比值为安全系数;特别地在本文指实际使用膜面积与理论计算得到的膜面积比值。
如本文所用,短语“堵塞模型”是特指用一种数学模型方式模拟细胞培养液经过深层滤膜,被滤膜拦截所引起的压力升高的过程。
实施例1中试规模深层过滤抗PD-1单克隆抗体细胞培养液
将深层过滤膜片按3.3㎡D0HC和2.2㎡A1HC的过滤顺序,用匹配型号的夹具装载组成深层过滤系统;用100L/㎡的WFI预冲洗组装好的过滤系统,冲洗的通量为500LMH;冲洗结束后用体积为20L/㎡的20mM NaPi,pH7.2平衡缓冲液平衡过滤系统,平衡通量为500LMH;待过滤系统平衡完成后,将细胞密度为210.14×105cell/mL,细胞活率为74.3%,浊度为5680NTU的抗PD-1单克隆抗体细胞培养液(批号:WLB304-01-20131201D)通过过滤系统过滤,过滤通量为90LMH,体积为140L,记录最终两级深层过滤膜两侧的压力差P、获得澄清液的浊度;细胞培养液过滤完成后再用40L/㎡的20mM NaPi,pH7.2缓冲液冲洗过滤过滤系统,回收残留细胞澄清液,冲洗通量为90LMH。
安全系数验证:
取1L上述细胞培养液用作深层过滤膜堵塞模型的测试(测试深层滤膜的型号为23cm2),通过方程计算得到理论膜面积;与上述实际膜面积相比计算得到安全系数。
过滤过程每5分钟记录压力(P)、过滤体积(L),并测定浊度(NTU);根据时间,压力和过滤体积计算得到滤膜堵塞量(P/LMH)和载量(L/M);代入方程P/LMH=a(L/M)3+b(L/M)2+c(L/M)+d,得到的深层滤膜D0HC和A1HC的堵塞曲线方程分别为:y=-3E-07x3+5E-05x2+0.0006x-0.0104,R2=0.9991;y=7E-07x3-9E-05x2+0.0037x-0.0005,R2=0.9834(见图8、9)。
根据上述方程计算得到澄清过滤140L该批次的细胞培养液所需的理论最小膜面积D0HC和A1HC分别为1.57㎡和1.22㎡。
本实施例深层过滤放大应用结果如下:
由上述结果可得到,通过堵塞方程计算得到的D0HC+A1HC理论最小膜面积,与实际使用膜面积相比,得到的安全系数分别为2.1和1.8,均大于1.5。澄清过滤结束后两级膜压力分别为11psi和9psi,均未超过15psi,未出现堵塞,所得细胞澄清液浊度为16NTU,控制深层过滤工艺在安全范围内。
实施例2中试规模深层过滤抗PD-1单克隆抗体细胞培养液
将深层过滤膜片按3.3㎡D0HC和2.2㎡A1HC的过滤顺序,用匹配型号的夹具装载组成深层过滤系统;用110L/㎡的WFI预冲洗组装好的过滤系统,冲洗的通量为600LMH;冲洗结束后用体积为30L/㎡的20mM NaPi,pH7.2平衡缓冲液平衡过滤系统,平衡通量为600LMH;待过滤系统平衡完成后,将细胞密度323.76×105cell/mL,细胞活率为74.5%,浊度为5440NTU的抗PD-1单克隆抗体细胞培养液(批号:WLB304-01-20140301D)通过过滤系统过滤,过滤通量为100LMH,体积为130L,记录最终两级深层过滤膜两侧的压力差P、获得澄清液的浊度;细胞培养液过滤完成后再用30L/㎡的20mM NaPi,pH7.2缓冲液冲洗过滤系统,回收残留细胞澄清液,冲洗通量为100LMH。
安全系数验证:
取1L上述细胞培养液用作深层过滤膜堵塞模型的测试(测试深层滤膜的型号为23cm2),通过方程计算得到理论膜面积;与上述实际膜面积相比计算得到安全系数。
过滤过程每5分钟记录压力(P)、过滤体积(L),并测定浊度(NTU);根据时间,压力和过滤体积计算得到滤膜堵塞量(P/LMH)和载量(L/M);代入方程P/LMH=a(L/M)3+b (L/M)2+c(L/M)+d,得到的深层滤膜D0HC和A1HC的堵塞曲线方程分别为:y=-5E-09x3+5E-05x2+8E-05x-0.0051,R2=0.998;y=7E-07x3-9E-05x2+0.0034x-0.0016,R2=0.9842(如图10、11)。
根据上述方程计算得到澄清过滤130L该批次的细胞培养液所需的理论最小膜面积D0HC和A1HC分别为1.46㎡和1.25㎡。
本实施例深层过滤放大应用结果如下:
由上述结果可得到,通过堵塞方程计算得到的D0HC+A1HC理论最小膜面积,与实际使用膜面积相比,得到的安全系数分别为2.3和1.8,均大于1.5。澄清过滤结束后两级膜压力分别为10psi和9psi,均未超过15psi,未出现堵塞,所得细胞澄清液浊度为15NTU,控制深层过滤工艺在安全范围内。
实施例3中试规模深层过滤抗PD-1单克隆抗体细胞培养液
将深层过滤膜片按3.3㎡D0HC和2.2㎡A1HC的过滤顺序,用匹配型号的夹具装载组成深层过滤系统;用90L/㎡的WFI预冲洗组装好的过滤系统,冲洗的通量为600LMH;冲洗结束后用体积为40L/㎡的20mM NaPi,pH7.2平衡缓冲液平衡过滤系统,平衡通量为600LMH;待过滤系统平衡完成后,将细胞密度318.45×105cell/mL,细胞活率为83.8%,浊度为4620NTU的抗PD-1单克隆抗体细胞培养液(批号:WLB304-01-20140302D)通过过滤系统过滤,过滤通量为80LMH,体积为145L,记录最终两级深层过滤膜两侧的压力差P、获得澄清液的浊度;细胞培养液过滤完成后再用30L/㎡的20mM NaPi,pH7.2缓冲液冲洗过滤系统,回收残留细胞澄清液,冲洗通量为80LMH。
安全系数验证:
取1L上述细胞培养液用作深层过滤膜堵塞模型的测试(测试深层滤膜的型号为23cm2),通过方程计算得到理论膜面积;与上述实际膜面积相比计算得到安全系数。
过滤过程每5分钟记录压力(P)、过滤体积(L),并测定浊度(NTU);根据时间,压力和过滤体积计算得到滤膜堵塞量(P/LMH)和载量(L/M);代入方程P/LMH=a(L/M)3+b(L/M)2+c(L/M)+d,得到的深层滤膜D0HC和A1HC的堵塞曲线方程分别为:y=6E-07x3-2E-06x2+0.0015x-0.004,R2=0.9988;y=3E-07x3-4E-05x2+0.0022x-0.0205,R2=0.9834(如图12、13)。
根据上述方程计算得到澄清过滤145L该批次的细胞培养液所需的理论最小膜面积D0HC和A1HC分别为1.91㎡和0.85㎡。
本实施例深层过滤放大应用结果如下:
由上述结果可得到,通过堵塞方程计算得到的D0HC+A1HC理论最小膜面积,与实际使用膜面积相比,得到的安全系数分别为1.7和2.6,均大于1.5。澄清过滤结束后两级膜压力分别为12psi和9psi,均未超过15psi,未出现堵塞,所得细胞澄清液浊度为18NTU,控制深层过滤工艺在安全范围内。
实施例4中试规模深层过滤抗PD-1单克隆抗体细胞培养液
将深层过滤膜片按3.3㎡D0HC和2.2㎡A1HC的过滤顺序,用匹配型号的夹具装载组成深层过滤系统;用90L/㎡的WFI预冲洗组装好的过滤系统,冲洗的通量为400LMH;冲洗结束后用体积为30L/㎡的20mM NaPi,pH7.2平衡缓冲液平衡过滤系统,平衡通量为400LMH;待过滤系统平衡完成后,将细胞密度196.12×105cell/mL,细胞活率为88.9%,浊度为4920NTU的抗PD-1单克隆抗体细胞培养液(批号:WLB304-01-20140403D)通过过滤系统过滤,过滤通量为120LMH,体积为135L,记录最终两级深层过滤膜两侧的压力差P、获得澄清液的浊度;细胞培养液过滤完成后再用30L/㎡的20mM NaPi,pH7.2缓冲液冲洗过滤系统,回收残留细胞澄清液,冲洗通量为120LMH。
安全系数验证:
取1L上述细胞培养液用作深层过滤膜堵塞模型的测试(测试深层滤膜的型号为23cm2),通过方程计算得到理论膜面积;与上述实际膜面积相比计算得到安全系数。
过滤过程每5分钟记录压力(P)、过滤体积(L),并测定浊度(NTU);根据时间,压力和过滤体积计算得到滤膜堵塞量(P/LMH)和载量(L/M);代入方程P/LMH=a(L/M)3+b(L/M)2+c(L/M)+d,得到的深层滤膜D0HC和A1HC的堵塞曲线方程分别为:y=3E-07x3+5E-05x2+0.0002x+0.0108,R2=0.9995;y=2E-07x3-4E-05x2+0.0022x-0.0076,R2=0.9855(如图14、15)。
根据上述方程计算得到澄清过滤135L该批次的细胞培养液所需的理论最小膜面积D0HC和A1HC分别为1.80㎡和1.14㎡。
本实施例深层过滤放大应用结果如下:
由上述结果可得到,通过堵塞方程计算得到的D0HC+A1HC理论最小膜面积,与实际使用膜面积相比,得到的安全系数分别为1.8和1.9,均大于1.5。澄清过滤结束后两级膜压力分别为11psi和9psi,均未超过15psi,未出现堵塞,所得细胞澄清液浊度为16NTU,控制深层过滤工艺在安全范围内。
实施例5对比实施例
将深层过滤膜片按2.2㎡D0HC和2.2㎡A1HC的过滤顺序,用匹配型号的夹具装载组成深层过滤系统;用100L/㎡的WFI预冲洗组装好的过滤系统,冲洗的通量为500LMH;冲洗结束后用体积为20L/㎡的20mM NaPi,pH7.2平衡缓冲液平衡过滤系统,平衡通量为500LMH;待过滤系统平衡完成后,将细胞密度296.32×105cell/mL,细胞活率为85.9%,浊度为4980NTU的抗PD-1单克隆抗体细胞培养液(批号:WLB304-01-20140504D)通过过滤系统过滤,过滤通量为110LMH,体积为135L,记录最终两级深层过滤膜两侧的压力差P、获得澄清液的浊度;细胞培养液过滤完成后再用30L/㎡的20mM NaPi,pH7.2缓冲液冲洗过滤系统,回收残留细胞澄清液,冲洗通量为110LMH。
安全系数验证:
取1L上述细胞培养液用作深层过滤膜堵塞模型的测试(测试深层滤膜的型号为23cm2),通过方程计算得到理论膜面积;与上述实际膜面积相比计算得到安全系数。
过滤过程每5分钟记录压力(P)、过滤体积(L),并测定浊度(NTU);根据时间,压力和过滤体积计算得到滤膜堵塞量(P/LMH)和载量(L/M);代入方程P/LMH=a(L/M)3+b(L/M)2+c(L/M)+d,得到的深层滤膜D0HC和A1HC的堵塞曲线方程分别为:y=7E-07x3-9E-05x2+0.0037x-0.0005,R2=0.9834;y=-2E-07x3+5E-05x2+0.0007x-0.0106,R2=0.999(如图16、17)。
根据上述方程计算得到澄清过滤135L该批次的细胞培养液所需的理论最小膜面积D0HC和A1HC分别为2.25㎡和1.66㎡。
本实施例深层过滤放大应用结果如下:
由上述结果可得到,通过堵塞方程计算得到的D0HC+A1HC理论最小膜面积,与实际使用膜面积相比,得到安全系数值为1.0和1.3,小于1.5。澄清过滤结束后两级膜压力分别为17psi和14psi,其中第一级压力超过15psi,出现堵塞,所得细胞澄清液浊度为34NTU,已不符合下游纯化样品的浊度要求。
- 还没有人留言评论。精彩留言会获得点赞!