用于鉴定甲型肝炎病毒的引物组及其应用的制作方法
本发明属于生物技术领域中病毒的分子生物学检测方法,具体涉及一种用于鉴定甲型肝炎病毒的引物组及其应用。
背景技术:
甲型肝炎病毒呈球形,直径约为27nm。无囊膜。衣壳由60个壳微粒组成,呈20面体立体对称,有HAV的特异性抗原(HAVAg),每一壳微粒由4种不同的多肽即VP1、VP2、VP3和VP4所组成。在病毒的核心部位,为单股正链RNA。除决定病毒的遗传特性外,兼具信使RNA的功能,并有传染性。HAV的单股RNA,其长度相当于7400个核苷酸。在RNA的3′末端有多聚的腺苷序列,在5′末端以共价形式连接一由病毒基因编码的细小蛋白质,称病毒基因组蛋白(Viral protein,genomic,VPG)。它在病毒复制过程中,能使病毒核酸附着于宿主细胞的核蛋白体上进行病毒蛋白质的生物合成。
开展甲型肝炎病毒的实验室诊断研究具有重要意义。目前用于甲型肝炎病毒诊断的实验室方法很多,如病毒的分离鉴定、免疫荧光抗体技术、ABC-ELISA试验和琼脂扩散试验等,其中琼脂扩散试验简便、快速,常用于甲型肝炎病毒病毒或血清的检查,但是其敏感性较低,很难在临床上推广应用。为此,急需建立一种敏感、准确、快速、简便的甲型肝炎病毒实验室诊断方法。虽然基于PCR技术的检测方法也已建立,但PCR需要昂贵的仪器,而且操作繁琐。
技术实现要素:
本发明的目的是提供一种用于鉴定甲型肝炎病毒的引物组及其应用。
本发明首先提供了一种特异引物组,由引物F3、引物B3、引物FIP、引物BIP和引物LB组成;
所述引物F3为如下(a1)或(a2);
(a1)序列表的序列1所示的单链DNA分子;
(a2)将序列1经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列1具有相同功能的DNA分子;
所述引物B3为如下(a3)或(a4);
(a3)序列表的序列2所示的单链DNA分子;
(a4)将序列2经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列2具有相同功能的DNA分子;
所述引物FIP为如下(a5)或(a6);
(a5)序列表的序列3所示的单链DNA分子;
(a6)将序列3经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列3具有相同功能的DNA分子;
所述引物BIP为如下(a7)或(a8);
(a7)序列表的序列4所示的单链DNA分子;
(a8)将序列4经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列4具有相同功能的DNA分子;
引物LB如下(a9)或(a10);
(a9)序列表的序列5所示的单链DNA分子;
(a10)将序列5经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列5具有相同功能的DNA分子。
所述引物组的用途为如下(b1)或(b2):(b1)鉴定甲型肝炎病毒;(b2)鉴定待测样本是否感染了甲型肝炎病毒。
本发明还保护所述引物组在制备试剂盒中的应用;所述试剂盒的用途为如下(b1)或(b2):(b1)鉴定甲型肝炎病毒;(b2)鉴定待测样本是否感染了甲型肝炎病毒。
本发明还保护含有所述引物组的试剂盒;所述试剂盒的用途为如下(b1)或(b2):(b1)鉴定甲型肝炎病毒;(b2)鉴定待测样本是否感染了甲型肝炎病毒。
本发明还保护所述试剂盒的制备方法,包括将各条引物单独包装的步骤。
本发明还保护一种鉴定待测病毒是否为甲型肝炎病毒的方法,包括如下步骤:
(1)提取待测病毒的总RNA;
(2)以步骤(1)得到的总RNA为模板,采用所述引物组进行逆转录环介导等温扩增;如果采用所述引物组可以实现以所述总RNA为模板的扩增,待测病毒为或候选为甲型肝炎病毒;如果采用所述引物组不能实现以所述总RNA为模板的扩增,待测病毒为或候选为非甲型肝炎病毒。
本发明还保护一种鉴定待测样本是否感染甲型肝炎病毒的方法,包括如下步骤:
(1)提取待测样本的总RNA;
(2)以步骤(1)得到的总RNA为模板,采用所述引物组进行逆转录环介导等温扩增;如果采用所述引物组可以实现以所述总RNA为模板的扩增,待测样本为或疑似为感染甲型肝炎病毒的样本;如果采用所述引物组不能实现以所述总RNA为模板的扩增,待测样本为或疑似为未感染甲型肝炎病毒的样本。
本发明还保护所述引物组在鉴定待测病毒是否为甲型肝炎病毒中的应用。
本发明还保护所述引物组在鉴定待测样本是否感染了甲型肝炎病毒中的应用。
本发明还保护一种鉴定待测病毒是否为甲型肝炎病毒的方法,包括如下步骤:检测待测病毒的总RNA中是否含有特异区段,如果待测病毒的总RNA含有所述特异区段、待测病毒为或候选为甲型肝炎病毒,如果待测病毒的总RNA不含有所述特异区段、待测病毒为或候选为非甲型肝炎病毒;所述特异区段为如下(c1)或(c2):(c1)序列表的序列7自5’末端第27-244位核苷酸所示的RNA;(c2)序列表的序列7所示的RNA。
本发明还保护一种鉴定待测样本是否含有甲型肝炎病毒的方法,包括如下步骤:检测待测样本的总RNA中是否含有特异区段,如果待测样本的总RNA含有所述特异区段、待测样本为或疑似为含有甲型肝炎病毒的样本,如果待测样本的总RNA不含有所述特异区段、待测样本为或疑似为不含有甲型肝炎病毒的样本;所述特异区段为如下(c1)或(c2):(c1)序列表的序列7自5’末端第27-244位核苷酸所示的RNA;(c2)序列表的序列7所示的RNA。
以上任一所述逆转录环介导等温扩增的反应体系中,各引物的摩尔配比如下:40pmol FIP:40pmol BIP:20pmol LB:5pmol F3:5pmol B3。
以上任一所述逆转录环介导等温扩增的反应体系中,每25μl体系含有40pmol FIP、40pmol BIP、20pmol LB、5pmol F3和5pmol B3。
以上任一所述逆转录环介导等温扩增的反应体系具体如下(25μl):模板加入体积为2μl-5μl,溶剂为pH8.8、20mM的Tris-HCl缓冲液;溶质及其在反应体系中的浓度或含量如下:10mM KCl、10mM(NH4)2SO4、0.1%(体积百分含量)Tween20、0.8M甜菜碱(betaine)、8-10mM MgSO4、1.4mM dNTP(即dATP、dTTP、dCTP和dGTP的浓度均为1.4mM)、8U Bst DNA聚合酶、8U逆转录酶、40pmol FIP、40pmol BIP、20pmol LB、5pmol F3和5pmol B3。
以上任一所述逆转录环介导等温扩增的反应条件:65℃恒温60min。
以上任一所述待测病毒具体可为甲型肝炎病毒、乙型肝炎病毒或丙型肝炎病毒。
以上任一所述甲型肝炎病毒具体可为甲型肝炎病毒BL-08株。以上任一所述乙型肝炎病毒具体可为乙型肝炎病毒adr亚型NC-1毒株。以上任一所述丙型肝炎病毒具体可为丙型肝炎病毒J6CF株。
本发明提供的引物组具有如下优点:
(1)高特异性:5条引物对甲型肝炎病毒靶序列的7个特异区域的识别保证了RT-LAMP扩增的高度特异性,即RT-LAMP能从相差仅一个核苷酸的基因标本中找出相应的靶序列进行扩增;
(2)高灵敏度:灵敏度比普通PCR高10倍;
(3)结果鉴定简便:可通过肉眼观察结果(钙黄绿素显色),也可以直接用浊度仪判断结果;
(4)操作简单:只要将检测样品(靶核酸)和检测试剂一起放入65℃恒温水浴锅中60分钟后就可以判断结果;
(5)快速、高效扩增:整个RT-LAMP扩增反应一小时内即可完成。
综上所述,本发明可以在等温条件下快速、方便、高效、高特异、高灵敏地检测到甲型肝炎病毒,不需要复杂仪器,为甲型肝炎病毒的检测提供了一个新的技术平台,可用于医疗单位筛查和检测甲型肝炎病毒,具有广阔的市场前景和较大的经济、社会效益,适于大范围推广应用。本发明为甲型肝炎病毒的检测提供了一个新的技术平台,可用于医疗单位筛查和检测甲型肝炎病毒,具有广阔的市场前景和较大的经济、社会效益,适于大范围推广应用。
附图说明
图1为实施例2的结果。
图2为实施例3的结果。
图3为实施例4的步骤3的结果。
图4为实施例4的步骤5的结果。
图5为实施例4的步骤7的结果。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
实施例中所用的甲型肝炎病毒为甲型肝炎病毒BL-08株:参考文献:甲肝灭活疫苗(Vero细胞)毒株稳定性研究;万铁军;《吉林大学》,2006。实施例中所用的乙型肝炎病毒为乙型肝炎病毒NC-1毒株:乙型肝炎病毒adr亚型NC-1毒株表面抗原基因的顺序测定与结构研究;琦祖和、阎珺、熊伟军、蔡良琬;《生物化学杂志》1988年03期。实施例中所用的丙型肝炎病毒为丙型肝炎病毒J6CF株:丙型肝炎病毒RNA聚合酶复制的生化与分子机制研究;翁磊云;中国科学院上海生命科学研究院,2010。
实施例1、引物组的设计
基于大量序列比对,设计用于鉴定甲型肝炎病毒的多个引物组,然后通过预实验比较各个引物组的特异性和灵敏度,最终得到一组效果最好的引物组,将其命名为引物组Ⅰ。
引物组Ⅰ中的各条引物如下:
F3(序列表中序列1):5’-TTGCTATTTGTCTGTCACAG-3’;
B3(序列表中序列2):5’-GTTTCCCAACTTCTAATCTCAA-3’;
FIP(序列表中序列3):5’-TGATTCAGTGGATAACATGGCATCAATCAGAGTTTTATTTTCCCAG-3’;
BIP(序列表中序列4):5’-GACTTGGAGTCATCAGTGGATGATTTTATATGGCTTCCTGCATTC-3’;
LB(序列表中序列5):5’-CCTAGATCAGAGGAGGACAAAAGA-3’。
引物组Ⅰ的靶序列如序列表的序列6所示。
引物组Ⅱ和引物组Ⅲ作为对照引物组。
引物组Ⅱ中的各条引物如下:
F3:5’-CAATCAGAGTTTTATTTTCCCAG-3’;
B3:5’-TGTTTCCCAACTTCTAATCTCA-3’;
FIP:5’-AGCTGCAATTCTGCTCATCATAGCTCCATTGAATTCAAATGC-3’;
BIP:5’-TTGGAGTCATCAGTGGATGATCCTAATTCTTTATATGGCTTCCTGC-3’;
LB:5’-GATCAGAGGAGGACAAAAGATTTGA-3’。
引物组Ⅲ中的各条引物如下:
F3:5’-CATTGAATTCAAATGCCATGTT-3’;
B3:5’-CTCCTGAGCATACTTGAGT-3’;
FIP:5’-GGATCATCCACTGATGACTCCATCCACTGAATCAATGATGAGC-3’;
BIP:5’-AGATCAGAGGAGGACAAAAGATTTGTGTTTCCCAACTTCTAATCTCA-3’;
LB:5’-AGAGTCACATAGAATGCAGGAAGC-3’。
实施例2、不同引物组的效果比较
待测引物组分别为:引物组Ⅰ、引物组Ⅱ或引物组Ⅲ。
1、取甲型肝炎病毒,提取总RNA。
2、以步骤1得到的总RNA为模板,采用待测引物组进行逆转录环介导等温扩增。
逆转录环介导等温扩增的反应体系(25μl):模板加入体积为2μl,溶剂为pH8.8、20mM的Tris-HCl缓冲液;溶质及其在反应体系中的浓度或含量如下:10mM KCl、10mM(NH4)2SO4、0.1%(体积百分含量)Tween20、0.8M甜菜碱(betaine)、10mM MgSO4、1.4mM dNTP(即dATP、dTTP、dCTP和dGTP的浓度均为1.4mM)、8U Bst DNA聚合酶、8U逆转录酶、40pmol FIP、40pmol BIP、20pmol LB、5pmol F3和5pmol B3。
逆转录环介导等温扩增的反应条件:65℃恒温60min。
进行逆转录环介导等温扩增的过程中,采用浊度仪实时监测反应体系的浊度值。
结果见图1。采用引物组Ⅰ时,22分钟后浊度值显著增高。采用引物组Ⅱ时,26分钟后浊度值显著增高。采用引物组Ⅲ时,24分钟后浊度值显著增高。结果表明:引物组Ⅰ的扩增效率优于引物组Ⅱ和引物组Ⅲ。
实施例3、引物组Ⅰ的特异性
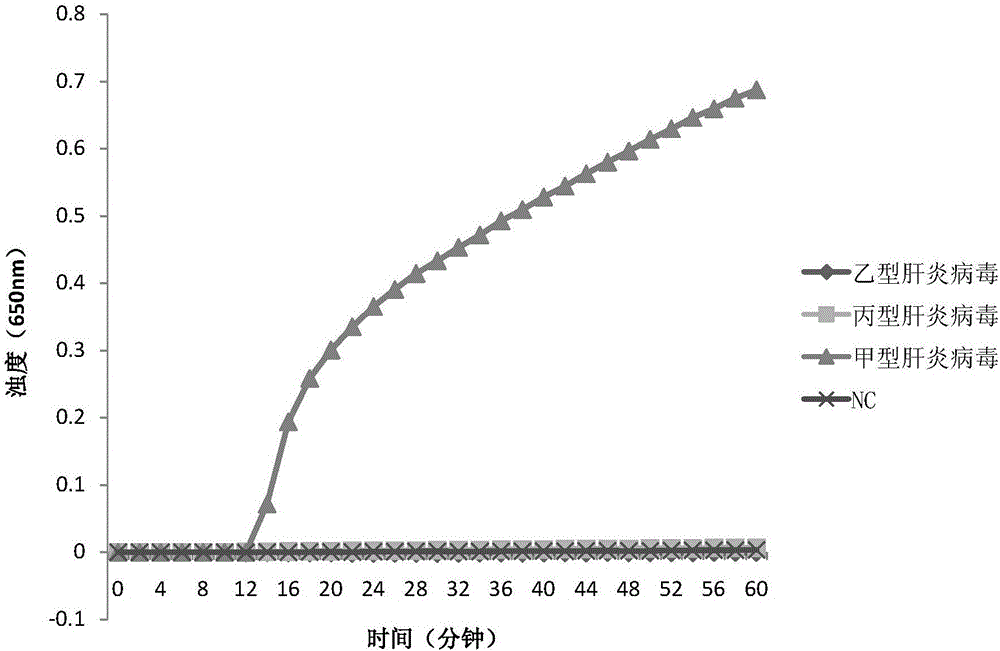
待测病毒分别为:甲型肝炎病毒、乙型肝炎病毒和丙型肝炎病毒。
1、取待测病毒,提取总RNA。
2、以步骤1得到的总RNA为模板,采用引物组Ⅰ进行逆转录环介导等温扩增。
逆转录环介导等温扩增的反应体系(25μl):模板加入体积为5μl,溶剂为pH8.8、20mM的Tris-HCl缓冲液;溶质及其在反应体系中的浓度或含量如下:10mM KCl、10mM(NH4)2SO4、0.1%(体积百分含量)Tween20、0.8M甜菜碱(betaine)、8mM MgSO4、1.4mM dNTP(即dATP、dTTP、dCTP和dGTP的浓度均为1.4mM)、8U Bst DNA聚合酶、8U逆转录酶、40pmol FIP、40pmol BIP、20pmol LB、5pmol F3和5pmol B3。
将无菌水作为空白对照(NC)。
逆转录环介导等温扩增的反应条件:65℃恒温60min。
进行逆转录环介导等温扩增的过程中,采用浊度仪实时监测反应体系的浊度值。
结果见图2。以甲型肝炎病毒的总RNA为模板,12分钟后浊度值显著增高。以乙型肝炎病毒的总RNA为模板,浊度值没有增高。以丙型肝炎病毒的总RNA为模板,浊度值没有增高。结果表明,引物组Ⅰ对甲型肝炎病毒特异性良好,对于乙型肝炎病毒和丙型肝炎病毒均不存在非特异性扩增。
实施例4、引物组Ⅰ的灵敏度
1、取甲型肝炎病毒,提取总RNA。
2、取步骤1得到的总RNA,用无菌水梯度稀释,得到各个稀释液。
稀释液1中的病毒RNA浓度为105拷贝/μl。稀释液2中的病毒RNA浓度为104拷贝/μl。稀释液3中的病毒RNA浓度为103拷贝/μl。稀释液4中的病毒RNA浓度为102拷贝/μl。稀释液5中的病毒RNA浓度为101拷贝/μl。稀释液6中的病毒RNA浓度为1拷贝/μl。将无菌水作为空白对照(NC)。
3、以步骤2得到的稀释液为模板,采用引物组Ⅰ进行逆转录环介导等温扩增。
逆转录环介导等温扩增的反应体系(25μl):模板加入体积为2μl,溶剂为pH8.8、20mM的Tris-HCl缓冲液;溶质及其在反应体系中的浓度或含量如下:10mM KCl、10mM(NH4)2SO4、0.1%(体积百分含量)Tween20、0.8M甜菜碱(betaine)、8mM MgSO4、1.4mM dNTP(即dATP、dTTP、dCTP和dGTP的浓度均为1.4mM)、8U Bst DNA聚合酶、8U逆转录酶、40pmol FIP、40pmol BIP、20pmol LB、5pmol F3和5pmol B3。
将无菌水作为空白对照(NC)。
逆转录环介导等温扩增的反应条件:65℃恒温60min。
进行逆转录环介导等温扩增的过程中,采用浊度仪实时监测反应体系的浊度值。
结果见图3。以稀释液1、稀释液2、稀释液3和稀释液4为模板,均在24分钟内出现浊度值的显著升高,以稀释液5为模板,42分钟后出现浊度值的显著升高。结果表明,采用引物组Ⅰ检测甲型肝炎病毒的灵敏度为20拷贝数/反应体系。
4、以步骤2得到的稀释液为模板,采用引物组Ⅰ进行逆转录环介导等温扩增。
逆转录环介导等温扩增的反应体系(25μl):模板加入体积为2μl,溶剂为pH8.8、20mM的Tris-HCl缓冲液;溶质及其在反应体系中的浓度或含量如下:10mM KCl、10mM(NH4)2SO4、0.1%(体积百分含量)Tween20、0.8M甜菜碱(betaine)、8mM MgSO4、1.4mM dNTP(即dATP、dTTP、dCTP和dGTP的浓度均为1.4mM)、8U Bst DNA聚合酶、8U逆转录酶、40pmol FIP、40pmol BIP、20pmol LB、5pmol F3和5pmol B3。
将无菌水作为空白对照(NC)。
逆转录环介导等温扩增的反应条件:65℃恒温60min。
5、完成步骤4后,在反应体系中加入1μl颜色指示剂,观察颜色变化。
颜色指示剂:含0.5mM钙黄绿素和10mM氯化锰的水溶液。
加入颜色指示剂后:如果反应体系显示为绿色,检测结果为阳性;如果反应体系为橙色,检测结果为阴性。
结果见图4。以稀释液1、稀释液2、稀释液3、稀释液4和稀释液5为模板,反应体系均显示为绿色,为阳性结果。结果表明,采用引物组Ⅰ检测甲型肝炎病毒的灵敏度为20拷贝数/反应体系。
6、以步骤2得到的稀释液为模板,采用引物组Ⅰ中的F3和B3组成的引物对进行逆转录PCR扩增。
逆转录PCR扩增的反应体系(25μl):模板加入体积为1μl,加入F3和B3,加入12.5μl 2×Taq MIX,余量为水。反应体系中,F3和B3的含量均为10pmol。将无菌水作为空白对照(NC)。
逆转录PCR扩增的反应条件:50℃逆转录30min,94℃预变性5min;94℃变性30s、55℃退火30s、72℃延伸30s,共40个循环;最后延伸7min。
7、完成步骤6后,将扩增产物进行琼脂糖凝胶电泳。
结果见图5(DNA Marker为D2000)。结果表明,灵敏度为100拷贝数/反应体系。
序列表
<110> 中华人民共和国东港出入境检验检疫局
北京蓝谱生物技术开发有限公司
<120> 用于鉴定甲型肝炎病毒的引物组及其应用
<130> GNCYX161997
<160> 7
<210> 1
<211> 20
<212> DNA
<213> 人工序列
<400> 1
ttgctatttg tctgtcacag 20
<210> 2
<211> 22
<212> DNA
<213> 人工序列
<400> 2
gtttcccaac ttctaatctc aa 22
<210> 3
<211> 46
<212> DNA
<213> 人工序列
<400> 3
tgattcagtg gataacatgg catcaatcag agttttattt tcccag 46
<210> 4
<211> 45
<212> DNA
<213> 人工序列
<400> 4
gacttggagt catcagtgga tgattttata tggcttcctg cattc 45
<210> 5
<211> 24
<212> DNA
<213> 人工序列
<400> 5
cctagatcag aggaggacaa aaga 24
<210> 6
<211> 349
<212> DNA
<213> 人工序列
<400> 6
cactctgatg aatatttgtc ttttagttgc tatttgtctg tcacagaaca atcagagttt 60
tattttccca gagctccatt gaattcaaat gccatgttat ccactgaatc aatgatgagc 120
agaattgcag ctggagactt ggagtcatca gtggatgatc ctagatcaga ggaggacaaa 180
agatttgaga gtcacataga atgcaggaag ccatataaag aattgagatt agaagttggg 240
aaacaaagac tcaagtatgc tcaggaggaa ttgtcaaatg aagtacttcc accccctagg 300
aaaattaagg gactgttttc acaagccaaa atttctcttt tttatactg 349
<210> 7
<211> 349
<212> RNA
<213> 人工序列
<400> 7
cacucugaug aauauuuguc uuuuaguugc uauuugucug ucacagaaca aucagaguuu 60
uauuuuccca gagcuccauu gaauucaaau gccauguuau ccacugaauc aaugaugagc 120
agaauugcag cuggagacuu ggagucauca guggaugauc cuagaucaga ggaggacaaa 180
agauuugaga gucacauaga augcaggaag ccauauaaag aauugagauu agaaguuggg 240
aaacaaagac ucaaguaugc ucaggaggaa uugucaaaug aaguacuucc acccccuagg 300
aaaauuaagg gacuguuuuc acaagccaaa auuucucuuu uuuauacug 349
- 还没有人留言评论。精彩留言会获得点赞!