一种维吉尼亚链霉菌IBL14typeI‑B‑sv14型CAS基因编辑系统的制作方法
本发明涉及生物技术中的基因工程领域,确切地说是一种维吉尼亚链霉菌IBL14type I-B-sv14型CAS基因编辑系统。
背景技术:
在生物技术领域中,CRISPR-Cas9系统是继锌指核酸内切酶/ZFN(zinc-finger nucleases)、类转录激活因子效应物核酸酶/TALEN(transcription activator-like effector nucleases)之后出现的第三代基因编辑技术。与前两代技术相比,因其成本低、操作简便、快捷高效而迅速风靡于世界生物技术领域,现已成为科研、医疗、食品等领域的有效工具(Rath,D.;Amlinger,L.;Rath,A.;Lundgren,M.,The CRISPR-Cas immune system:Biology,mechanisms and applications.Biochimie 2015,117,119-128)。
CRISPR-Cas系统指在RNA的指导下降解外源噬菌体或病毒入侵的一种适应性免疫系统,可分为I型(type I)、П型和Ш型(Gasiunas,G.;Sinkunas,T.;Siksnys,V.,Molecular mechanisms of CRISPR-mediated microbial immunity.Cell Mol Life Sci 2014,71,(3),449-65)。I型CRISPR-Cas系统的标志蛋白是Cas3,它具有DNA酶活性和解旋酶活性,与crRNA与Cascade复合物相结合,将外源靶标DNA裂解以达到阻止其侵染的目的(Gasiunas,G.;Sinkunas,T.;Siksnys,V.,Molecular mechanisms of CRISPR-mediated microbial immunity.Cell Mol Life Sci 2014,71,(3),449-65;Gong,B.;Shin,M.;Sun,J.;Jung,C.H.;Bolt,E.L.;van der Oost,J.;Kim,J.S.,Molecular insights into DNA interference by CRISPR-associated nuclease-helicase Cas3.Proceedings of the National Academy of Sciences of the United States of America 2014,111,(46),16359-64)_ENREF_3。П型CRISPR-Cas系统的标志蛋白是Cas9,已商业化的来源于Streptococcus pyogenes的Cas9由1368个氨基酸构成,是一种含两个核酸酶结构域(RuvC-like切割编码链和HNH切割与crRNA互补配对的非编码链)的DNA内切酶(Terao,M.,et al.(2016)."Utilization of the CRISPR/Cas9system for the efficient production of mutant mice using crRNA/tracrRNA with Cas9nickase and FokI-dCas9."Experimental Animals 65(3):275-283)。Ш型CRISPR-Cas系统的标志蛋白是Cas10,与Cmr复合体结合达到阻止其外源核酸侵染的目的(Gasiunas,G.;Sinkunas,T.;Siksnys,V.,Molecular mechanisms of CRISPR-mediated microbial immunity.Cell Mol Life Sci2014,71,(3),449-65)。三种类型的CRISPR-Cas系统中,除II型外,I型和III型均无应用于基因编辑的报道。
由本实验室分离纯化得到的维吉尼亚链霉菌IBL-14(Streptomyces virginiae IBL14)是一株能降解多种甾体化合物的放线菌。全基因组测序与分析发现存在一个cas7-5-3-4-1-2序列的type I-B-sv14型Cas系统,现已证实可对自身染色体进行基因编辑(童望宇;雍德祥;李雪;邱彩花一种维吉尼亚链霉菌IBL14中的CRISPR-Cas系统及应用其进行基因编辑的方法.2015110028173,2015;童望宇;李雪;雍德祥一种维吉尼亚链霉菌IBL14产青霉素重组菌株的构建方法.2015109993334,2015)。
本发明将该type I-B-sv14型CRISPR-Cas系统中的基因cas7-5-3-4-1-2与载体连接得到一个蛋白表达质粒plasmid-cas7-5-3-4-1-2,结合设计的基因编辑质粒(plasmid-t/gDNA)和/或其它质粒首次实现了在非自身原核生物大肠杆菌与枯草杆菌中的基因编辑及免疫。
技术实现要素:
本发明要解决的技术问题是提供一种基于维吉尼亚链霉菌IBL14type I-B-sv14型CRISPR-Cas系统而建立的蛋白表达质粒体系,结合基因编辑质粒和/或其它质粒实现原核生物的基因编辑与免疫。
技术方案如下:
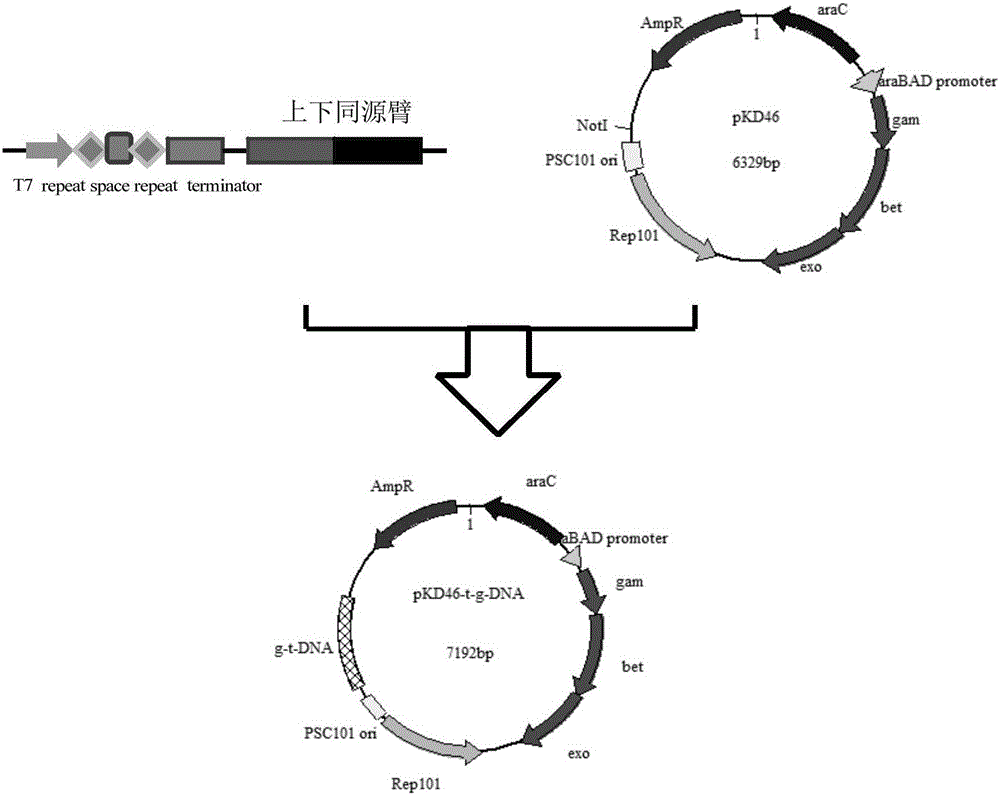
一种维吉尼亚链霉菌IBL14type I-B-sv14型CAS基因编辑系统,其特征在于:该系统包含一个cas7-5-3-4-1-2六个基因(附表1)所组成的重组蛋白表达质粒(附图1)和一个基因编辑质粒(附图3),可有效的用于原核生物基因编辑及免疫。
所述的一种维吉尼亚链霉菌IBL14type I-B-sv14型CAS基因编辑系统,其特征在于:编辑方法包括以下步骤:
(1)根据维吉尼亚链霉菌IBL14基因cas7-5-3-4-1-2及相关信息序列设计引物(附表2),以提取到的维吉尼亚链霉菌IBL14基因组为模版,用TransTaq DNA Polymerase High Fidelity聚合酶通过聚合酶链式反应(PCR反应)扩增得到末端带有与载体限制性内切酶识别和切割位点15-25bp重叠区域的cas7-5-3-4-1-2基因,连接到质粒(plamisd)上,得蛋白表达质粒plamisd-cas7-5-3-4-1-2;
(2)根据靶向基因DNA序列信息设计引物(附表2),以提取到的原核生物基因组为模版,用TransTaq DNA Polymerase High Fidelity DNA聚合酶通过PCR反应分别扩增得到末端带有限制性内切酶识别和切割位点以及overlap PCR互补序列的靶向基因上下同源臂PCR片段,并用overlap PCR将上下同源臂结合起来构建基因编辑模版(t-DNA),同时根据生物靶向基因序列信息设计并直接合成首尾分别含T7启动子和RNA终止子的靶向基因片段(g-DNA)(附表2),将基因编辑模版与靶向基因片段连接到质粒上得基因编辑质粒(plasmid-t/gDNA);
(3)制备原核生物细胞感受态,并将按步骤(1)得到的蛋白表达质粒和按步骤(2)得到的各种靶向基因编辑质粒分别转化到目标菌感受态中得到不同的基因编辑后的重组子,对重组子染色体进行PCR和基因测序和/或功能分析(附图3),以确证编辑后的目的重组子。
所述的一种维吉尼亚链霉菌IBL14type I-B-sv14型CAS基因编辑系统,其特征在于:所述原核生物指大肠杆菌、枯草杆菌及其它各种原核微生物。
所述的一种维吉尼亚链霉菌IBL14type I-B-sv14型CAS基因编辑系统,其特征在于:所述的基因编辑指应用该蛋白表达质粒结合基因编辑质粒和/或其它质粒可对原核细胞的染色体基因进行敲除、插入、无痕点突变及任意组合。
所述的一种维吉尼亚链霉菌IBL14type I-B-sv14型CAS基因编辑系统,其特征在于:所述的免疫指通过基因编辑模版设计的CRISPR可应用于生物细胞阻止外源核酸的侵入。
本发明有益效果为:
本发明提供了一种维吉尼亚链霉菌IBL14type I-B-sv14型CAS基因编辑系统,首次实现了CRISPR-Cas I型系统对其它原核生物基因组的基因编辑与免疫;该系统对原核生物基因组可方便、快速、有效地进行基因编辑与免疫。该基因编辑方法可广泛应用于生物科学及制药、食品、农业等其它应用领域。
说明书附图
图1蛋白表达质粒pET28a-cas7-5-3-4-1-2的构建。Ori/origin:DNA复制起始位点;f1ori:f1噬菌体起源的复制起始位点;T7promoter:T7启动子起始DNA转录;KanR/Kanamycin resistance:卡那霉素抗性;T7terminator:T7终止子,终止DNA转录,lacI/lactose repressor:编码乳糖阻遏蛋白
图2基因编辑质粒pKD46-t/g-DNA的构建。pSC101ori/the origin from pSC:来自低拷贝(copy)质粒载体pSC101的复制起始点;Rep101:基于基因RepA控制质粒pSC101复制拷贝数;araC/L-arabinose regulatory protein:阿拉伯糖调节蛋白;AmpR/ampicillin resistance:氨苄青霉素抗性;aBAD promoter/promoter of the L-arabinose operon of E.coli:大肠杆菌中受阿拉伯糖调控的araB启动子;exo,bet,gam基因:Red同源重组由λ噬菌体的exo,bet,gam 3个基因组成,分别编码Exo、Beta、Gam 3种蛋白质
图3菌株EC JM109(DE3)中galM基因的敲除结果。(A)大肠杆菌JM109(DE3)蓝白斑筛选结果,蓝色表明为原始菌株,白色表明为重组菌株;(B)基因galM外部PCR电泳图,泳道M:1500bp DNA ladder,泳道1:空白对照,泳道2~8:质粒pET28a-cas-7-5-3-4-1-2和pKD46-galM-g/t-DNA后的转化子的galM基因PCR结果(970bp表明敲除成功),泳道9:野生型EC JM109(DE3)基因组的galM基因PCR(1341bp代表野生型EC JM109(DE3)基因组的galM基因)
具体实施方式
为了更充分理解本发明的技术内容,下面结合具体实施例对本发明的技术方案作进一步介绍和说明,旨在更好的解释本发明的内容,以下实施例不限制本发明的保护范围。此外,在所列实施例中如无特别说明匀采用如下材料:
1)菌株与质粒
维吉尼亚链霉菌Streptomyces virginiae IBL14/SV IBL14;大肠杆菌Escherichia coli DH5α/EC DH5α;Escherichia coli JM109/EC JM109(DE3);枯草芽孢杆菌Bacillus subtilis168/BS 168,质粒pET28a、pKD46、pKD3。
2)培养基
TB培养基:
1.2%(W/V)Tryptone 2.4%(W/V)Yeast Extract 0.4%(V/V)Glycerol 17Mm K2PO4 72Mm K2HPO4
10×spizzen盐溶液(100ml):
K2HPO4 14g,KH2PO4 6g,(NH4)2SO4 2g,柠檬酸钠1g,MgSO4·7H2O 0.2g按顺序依次溶解在双蒸水中,加水至100ml。
GM Ⅰ(100ml):
1×spizzen盐溶液95ml,50%葡萄糖1ml,5%水解酪蛋白500μl,10%酵母汁1ml,2mg/ml L-trp 2.5ml
GM Ⅱ(100ml):
1×spizzen盐溶液97.5ml,50%葡萄糖1ml,5%水解酪蛋白80μl,10%酵母汁40μl,2mg/ml L-trp 500μl,0.5M/L MgCl2 500μl,0.1M CaCl2 500μl
所用试剂均为市售品。
实施例1(EC JM109(DE3)β-半乳糖苷酶基因galM敲除)
(1)Cas7-5-3-4-1-2蛋白表达质粒的构建
根据SV IBL14全基因组测序信息及质粒pET28a序列信息,设计基因cas7-5-3-4-1-2特异性引物cas7-5-3-4-1-2-F和cas7-5-3-4-1-2-R(表2);提取SV IBL-14基因组DNA,使用北京全式金生物技术有限公司生产的DNA聚合酶(TransTaq DNA Polymerase High Fidelity)进行cas基因PCR扩增,反应条件:95℃2min,95℃20s,60℃20s,72℃3min,250units的TransTaq DNA Polymerase High Fidelity(50μl反应体系),30个循环,72℃10min。PCR产物经1%琼脂糖电泳检测,试剂盒回收,得到纯化的cas全长基因片段;通过一步法将cas全长基因序列与质粒pET28a连接,得蛋白表达质粒pET28a-cas7-5-3-4-1-2备用。
(2)基因编辑质粒的构建
(A)基因galM引物设计与扩增
根据EC JM109(DE3)全基因组测序信息,设计基因galM特异性引物GalM-F和GalM-R(表2)。提取EC JM109(DE3)基因组DNA,用TransTaq DNA Polymerase High Fidelity进行galM基因PCR扩增,反应条件:95℃5min,94℃30s,52℃30s,72℃2min,250units的TransTaq DNA Polymerase High Fidelitye(50μl反应体系),30个循环,72℃10min;PCR产物经1%琼脂糖电泳检测,试剂盒回收,得到纯化的galM全长基因片段备用。
(B)制备上、下游同源臂
根据galM基因全序列(表1)设计galM基因上游同源臂引物galM-UF和galM-UR、下游同源臂引物galM-DF和-galMDR(表2),且上下同源臂引物含NotI和HindIII限制性内切酶酶切位点;以纯化的galM基因DNA为模板,先分别扩增上、下游同源臂,反应条件为:95℃5min,94℃30s,55℃30s,72℃1min,250units的TransTaq DNA Polymerase High Fidelity(50μl反应体系)30个循环,72℃10min;PCR产物经1%琼脂糖电泳检测,试剂盒回收,得到纯化后的上、下游同源臂DNA片段备用。
(C)制备基因编辑模版(galM/t-DNA)
取上同源臂纯化产物与下同源臂纯化产物0.5μl混合作为模板,30μl反应体系进行overlap PCR,反应条件为:94℃预变性5min,94℃变性l min,60℃退火1min,72℃延伸30s,一个循环后加人引物galMUF与galMDR各1μl,继续PCR,反应条件为:95℃预变性5min,94℃变性30s,55℃退火30s,72℃延伸2min,进行30个循环,72℃10min;1%琼脂糖凝胶电泳检测扩增产物并纯化,得的编辑模版片段;将获得的编辑模版片段通过HindIII限制性内切酶切出粘性末端,得到纯化后的上下游同源臂DNA片段备用。
(D)构建基因编辑质粒pKD46-galM-t/g-DNA
含启动子T7及连接产物的靶向基因片段(g-DNA)(表2)由滁州通用生物公司直接合成,首尾分别与载体限制性内切酶识别和切割位点15-25bp的NotI酶切位点和HindIII酶切位点,中间依次是启动子T7,spacer,repeat以及终止子得galM-g-DNA;将靶向基因片段g-DNA通过北京全式金生物技术有限公司生产的T4连接酶将其连接到得基因编辑模版galM-t-DNA上,得基因编辑模版载体galM-t/g-DNA;然后通过北京全式金生物技术有限公司生产的Peasy-Uni Seamless Cloning and Assembly Kit将其连接到pKD46质粒上;得基因编辑模版载体pKD46-galM-t/g-DNA。
(3)重组子的制备与检验
(A)EC JM109(DE3)感受态制备
在无菌条件下用已灭过菌的牙签挑取大肠杆菌平板上的单克隆于30ml TB液体培养基中,37℃,220rpm过夜培养。取过夜培养的菌液100μl转接至新的TB液体培养基中,37℃,220rpm培养约2h,至菌液OD600值约为0.5左右。取1ml上述菌液至1.5ml EP管中,4℃下4000rpm离心10min,除尽上清液后,取已经在冰上预冷的来自Generay Biotech生产的SSCS溶液100μl将菌体沉淀吹打均匀,即得大肠杆菌的感受态细胞,-80℃下保存备用(此过程全程要在冰上进行)。
(B)蛋白表达质粒与基因编辑质粒的共转化
将质粒pET28a-cas7-5-3-4-1-2与pKD46-galM-t/g-DNA加入到融化后的感受态细胞中,冰浴30min,42℃热击90s,然后立即放到冰上10~15min。加入800μl TB液体培养基,于30℃,220rpm恒温摇床中,复苏1小时。取复苏之后的菌液100μl或浓缩后菌液涂布到含终浓度为50μg/ml卡那霉素(Kana)溶液和50μg/ml氨苄青霉素(Amp)溶液、20mg/ml X-gal和0.84mol/L IPTG的TB固体平板上,30℃恒温培养箱中培养过夜得转化子。
(C)重组子功能检测与基因分析
筛选白色单克隆为待定重组子,并以其基因组为模板,进行PCR验证与测序分析,发现重组子染色体DNA扩增条带与野生型相比减少了预期的371bp,经通用生物系统(安徽)有限公司测序证明galM基因已成功敲除。
实施例2(EC JM109(DE3)中CmR抗性基因的插入)
(1)蛋白表达质粒pET28a-cas7-5-3-4-1-2
同实施例1步骤(1)
(2)基因编辑质粒pKD46-t/g-DNA的构建
除以含氯霉素(CmR)抗性标记基因的质粒pKD3为模板,结合galM基因敲除中的上下游同源臂进行PCR反应合成上下游同源臂中间插入氯霉素(CmR)抗性标记的PCR产物,连接到质粒pKD46上,形成基因编辑质粒pKD46-galM-cm-t/g-DNA外;其余步骤与实施例1中步骤(2)相同。
(3)重组子的获取与检验
用所得重组子菌株经过诱导后,再转接TB液体培养基在39℃条件下培养15小时,之后将所得菌液进行稀释涂布,得到的单菌落再分别转入TB含Cm抗性平板进行标记抗性测试,含有Cm抗生素的TB平板上挑取单克隆,进行PCR,产物经1%琼脂糖电泳检测验证,发现重组子染色体DNA扩增条带大小与预期的一致,并经基因测序证明基因编辑后的ECJM109(DE3)重组子中galM及氯霉素抗性基因的敲除与插入成功;其余步骤与实施例1中步骤(3)相同。
实施例3(EC JM109(DE3)对质粒pKD3的免疫-EC JM109(DE3)中的Repeat序列)
(1)蛋白表达质粒pET28a-cas7-5-3-4-1-2的构建
同实施例1步骤(1)
(2)基因编辑质粒pKD46-galM-pKD3-g/tEC-DNA的构建
根据质粒pKD3中DNA基因序列,直接合成首尾分别加上NotI酶切位点,中间依次是启动子T7,spacer(pKD3碱基序列),repeat(EC JM109(DE3)的CRISPR中的repeat序列)以及终止子的pKD3-tEC-DNA;与实施例1步骤(2)中的galM-g-DNA通过T4连接酶将其连接到质粒pKD46中,得基因编辑质粒基因编辑质粒pKD46-galM-pKD3-g/tEC-DNA;其余步骤与实施例1中步骤(2)相同。
(3)重组子的获取与检验
同实施例1步骤(3);经DNA扩增与基因测序证明基因编辑后得到重组子ECJM109(DE3)-galM-pKD3。
(4)重组子的免疫
将质粒pKD3对宿主ECJM109和重组子ECJM109-galM-pKD3分别进行转化,发现在CmR抗性平板上有ECJM109生长,无重组子EC JM109-galM-pKD3生长,表明重组子ECJM109-galM-pKD3中对质粒pKD3免疫成功。
实施例4(EC JM109(DE3)对质粒pKD3的免疫-SV IBL14中的Repeat序列)
(1)蛋白表达质粒pET28a-cas7-5-3-4-1-2的构建
同实施例1步骤(1)
(2)基因编辑质粒pKD46-galM-pKD3-g/tSV-DNA的构建
repeat序列采用SV IBL14的CRISPR中的repeat序列;其余步骤与实施例3中步骤(2)相同。
(3)重组子的获取与检验
同实施例3步骤(3)。
(4)重组子的免疫
同实施例3步骤(4)。
实施例5(BS 168基因amyE的双质粒敲除及氯霉素抗性基因的插入)
(1)蛋白表达质粒pHT304-cas7-5-3-4-1-2
将cas7-5-3-4-1-2全长基因序列与质粒pHT-304连接,得蛋白表达质粒pET28a-cas7-5-3-4-1-2备用;其余步骤与实施例1中步骤(3)相同。
(2)基因编辑质粒pKC1139-amyE-t/g-DNA的构建
(A)基因amyE引物设计与amyE全长基因的扩增
设计基因引物为amyE-F和amyE-R(表2)。以BS168基因组DNA为模版,扩增amyE基因片段。反应条件:95℃5min,94℃30s,58℃30s,72℃1min30s,250U TransTaq DNA Polymerase High Fidelity(50μl反应体系),30个循环,72℃10min。PCR产物经1.0%琼脂糖电泳检测,试剂盒回收,得到纯化的amyE全长基因片段备用。
(B)上、下游同源臂的制备
分别设计上、下同源臂引物amyE-UPF、amyE-UPR、amyE-CmF、amyE-CmR、amyE-DownF、amyE-DownR(表2)。以纯化的amyE基因和Cm基因DNA为模板,先分别扩增上、Cm、下游同源臂,反应条件为:95℃5min,94℃30s,58℃30s,72℃1min 20s,250U全式金生物有限公司生产的TransTaq DNA Polymerase High Fidelity(50μl反应体系),30个循环,72℃10min。PCR产物经1.0%琼脂糖电泳检测,试剂盒回收,得到纯化后的上同源臂、Cm、下游同源臂DNA片段备用。
(C)基因编辑模版载体pKC1139-amyE-t-DNA的构建
取上同源臂纯化产物、cm纯化产物及下同源臂纯化产物1.0μl混合作为模板,25μl反应体系进行overlap PCR,反应条件为:94℃预变性5min,94℃变性l min,55℃退火1min,72℃延伸30s,一个循环后加人引物UF与DR各1μl,继续PCR,反应条件为:95℃预变性5min,94℃变性30s,58℃退火30s,72℃延伸2min,进行30个循环,72℃10min。1.0%琼脂糖凝胶电泳检测扩增产物并纯化,得基因编辑模版;将获得的基因编辑模版通过HindIII和XbaI限制性内切酶切出粘性末端,然后通过T4连接酶将其连接到pKC1139质粒上,得基因编辑模版载体pKC1139-amyE-t-DNA。
(D)基因编辑质粒pKC1139-amyE-t/g-DNA的构建
含乳糖操纵子启动子及guide DNA-amyE连接产物的靶向基因片段(表2)由滁州通用生物公司直接合成,首尾分别加上BamHI及EcoRI酶切位点,中间依次是启动子,重复序列(repeat),间隔序列(spacer),重复序列(repeat)及终止子;将合成的靶向基因片段通过BamHI和EcoRI限制性内切酶切出粘性末端,然后通过T4连接酶将其连接到得基因编辑模版载体pKC1139-amyE-t-DNA上得基因编辑质粒pKC1139-amyE-t/g-DNA。
(3)重组子的获取与检验
(A)BS168感受态的制备
接种新鲜的BS168单菌落于5ml GM Ⅰ中,30℃,100~150转/分钟摇床培养过夜。次日接种1ml上述培养物于9ml GM Ⅰ培养基中,在摇床中37℃,200转/分钟培养3~4h。取5ml第二步培养物转接于45ml GM Ⅱ培养基中进行第二次传代,37℃,100~150转/分钟摇床培养90min。取全部培养物,4000转/分钟室温离心5min,用1/10体积上清液重悬菌体,即得BS168感受态细胞。
(B)质粒pHT304-cas7-5-3-4-1-2和pKC1139-amyE-t/g-DNA的共转化
将质粒pHT304-cas7-5-3-4-1-2和pKC1139-amyE-t/g-DNA加入1ml BS168感受态细胞悬液中混匀,37℃恒温水浴中静置30~60min,然后在摇床中以37℃,200转/分钟振荡培养2~4h。将转化液涂布含有氯霉素抗性的(终浓度5μg/ml)TB固体培养基,在37℃恒温培养箱中倒置培养过夜,次日检查转化子吸取适量菌液涂布到含有Cm抗性的TB培养基上。
(C)重组子染色体PCR和基因测序分析
挑取含有CmR抗性平板上长出的单菌落,提取其基因组或用热处理过的菌落作为模板,敲除基因的上下游引物为模板进行PCR扩增,将所得基因片段进行电泳,产物经1%琼脂糖电泳检测,观察重组子染色体DNA扩增条带大小的改变与预期一致,并经基因测序证明BS168-amyE基因敲除及氯霉素抗性基因插入成功。
实施例6(BS 168基因amyE的单质粒敲除及氯霉素抗性基因的插入)
(1)蛋白表达质粒pHT304-cas7-5-3-4-1-2的构建
同实施例1步骤(1)
(2)基因编辑质粒pHT304-cas7-5-3-4-1-2-amyE-t/g-DNA的构建
除amyE-t/g-DNA靶基因片段连接到pHT304-cas7-5-3-4-1-2质粒外,其余步骤与实施例5中步骤(2)相同。
(3)重组子的获取与检验
同实施例5步骤(3)
以上所述仅以实施例来进一步说明本发明的技术内容,以便于读者更容易理解,但不代表本发明的实施方式仅限于此,任何依本发明所做的技术延伸或再创造,均受本发明的保护。
表1大肠杆菌galM、枯草杆菌amyE及维吉尼亚链霉菌IBL14 cas7-5-3-4-1-2基因序列
基因 序列
galM
(1041bp) gtgctgaacgaaactcccgcactggcacccgatggtcagccgtaccgactgttaactttgcgtaacaacgcagggatggtagtcacgctgatggactggggtgcgactttactttccgcccgtattccgctttccgatggcagcgtccgcgaggcgctgctcggctgtgccagcccggaatgctatcaggatcaggccgcgtttctgggggcctctattggtcgttatgccaaccgtatcgccaatagccgttatacctttgacggtgaaaccgtgacgctttcgccaagtcagggcgttaaccagctgcacggcgggccggaagggttcgacaaacgtcgctggcagattgtgaaccagaacgatcgtcaggtgctgtttgccctgagttcagatgatggtgatcagggcttcccgggtaatctcggcgcgacggtgcaatatcgtctgaccgacgataaccgtatctccattacttatcgcgccacagttgataaaccttgcccggtgaatatgactaatcacgtctatttcaatcttgacggcgagcagtctgacgtgcgcaatcacaagttgcagattctggcggacgaatatctgccggttgatgaaggcggcattccgcacgacggcctgaaatctgtcgccggaacgtcttttgatttccgcagcgccaaaatcatcgccagtgagtttcttgccgacgacgatcagcgcaaagtgaaaggttacgatcacgcattcttgttacaggccaaaggcgatggcaagaaagtggcggcgcatgtctggtcagcagatgaaaaattgcagctgaaggtctacaccaccgctccggctctgcaattctactccggcaacttcctcggcggcacaccgtcgcggggaaccgaaccttacgccgactggcaagggctggctctggaaagcgagtttctaccggacagcccgaaccaccctgaatggccgcaaccggactgcttcctgcgtcctggcgaagagtattccagcctgacggaatatcagtttattgctgagtaa
amyE
(1980bp) atgtttgcaaaacgattcaaaacctctttactgccgttattcgctggatttttattgctgtttcatttggttctggcaggaccggcggctgcgagtgctgaaacggcgaacaaatcgaatgagcttacagcaccgtcgatcaaaagcggaaccattcttcatgcatggaattggtcgttcaatacgttaaaacacaatatgaaggatattcatgatgcaggatatacagccattcagacatctccgattaaccaagtaaaggaagggaatcaaggagataaaagcatgtcgaactggtactggctgtatcagccgacatcgtatcaaattggcaaccgttacttaggtactgaacaagaatttaaagaaatgtgtgcagccgctgaagaatatggcataaaggtcattgttgacgcggtcatcaatcataccaccagtgattatgccgcgatttccaatgaggttaagagtattccaaactggacacatggaaacacacaaattaaaaactggtctgatcgatgggatgtcacgcagaattcattgctcgggctgtatgactggaatacacaaaatacacaagtacagtcctatctgaaacggttcttagacagggcattgaatgacggggcagacggttttcgatttgatgccgccaaacatatagagcttccagatgatggcagttacggcagtcaattttggccgaatatcacaaatacatctgcagagttccaatacggagaaatcctgcaggatagtgcctccagagatgctgcatatgcgaattatatggatgtgacagcgtctaactatgggcattccataaggtccgctttaaagaatcgtaatctgggcgtgtcgaatatctcccactatgcatctgatgtgtctgcggacaagctagtgacatgggtagagtcgcatgatacgtatgccaatgatgatgaagagtcgacatggatgagcgatgatgatatccgtttaggctgggcggtgatagcttctcgttcaggcagtacgcctcttttcttttccagacctgagggaggcggaaatggtgtgaggttcccggggaaaagccaaataggcgatcgcgggagtgctttatttgaagatcaggctatcactgcggtcaatagatttcacaatgtgatggctggacagcctgaggaactctcgaacccgaatggaaacaaccagatatttatgaatcagcgcggctcacatggcgttgtgctggcaaatgcaggttcatcctctgtctctatcaatacggcaacaaaattgcctgatggcaggtatgacaataaagctggagcgggttcatttcaagtgaacgatggtaaactgacaggcacgatcaatgccaggtctgtagctgtgctttatcctgatgatattgcaaaagcgcctcatgttttccttgagaattacaaaacaggtgtaacacattctttcaatgatcaactgacgattaccttgcgtgcagatgcgaatacaacaaaagccgtttatcaaatcaataatggaccagagacggcgtttaaggatggagatcaattcacaatcggaaaaggagatccatttggcaaaacatacaccatcatgttaaaaggaacgaacagtgatggtgtaacgaggaccgagaaatacagttttgttaaaagagatccagcgtcggccaaaaccatcggctatcaaaatccgaatcattggagccaggtaaatgcttatatctataaacatgatgggagccgagtaattgaattgaccggatcttggcctggaaaaccaatgactaaaaatgcagacggaatttacacgctgacgctgcctgcggacacggatacaaccaacgcaaaagtgatttttaataatggcagcgcccaagtgcccggtcagaatcagcctggctttgattacgtgctaaatggtttatataatgactcgggcttaagcggttctcttccccattga
cas7-5-3-4-1-2
(5882bp) gtggtcgccggtgccccgaacaacggggagggcgaggacaacacggggcgtgtgaagaagctgagggtcgggcgggaggagttcccgtacgtgtccgcgcaggcgttccgtcggtggttgcgtgactcgctgccggcgcaggagccgcgttcggtggtcactcgctcgggcagcggtgccaagcagcaggcacacaccgcgggccggccggacctgcacctggacgatgatctgttcggctacatggtcgcggtgaaggggaaggggggaagctaccagcgggacaccgtgctggctaccgggactttagtttcagtggtgccgcagcgtccgacgttggacttcggcacgatgagccgggacttcccggctggtgagcacccggtgattcactcgcacgagctgtacagcgcgaccctggccggcgatgttctgctggatctgccgcgggctggggtcttcgagacggacggcaacgggttgcgcgtggcgatcagccctgccgtcgctgaggaagcggcgaagaacggggcggaggtcaccacgctgcggggcagtgcggccattcggttgccgcttactgagcggcaccggcggatcggcacgctgttgcggacgctggcgtcggtgcgtggtggggccaagcaggctctgcactacggggaccgggccccttcattggtcttgttggctcctctcaagggtggcgtcaatccgttcacccgtgttctgggcgcccgcgacggtaagcctgtgttcctgagcgatgtcctgcgcgaggagctcgaggcgtgggcggatgagctggacgggccggtgctgctgggctgggccccggggtttctcggcgatcagcgtgagcaggtccgccgcgagctcaaggatctgattgacgagggccgtgtcgtcctgagccatcctcgtgtgctgctgacccagctggccgaccggatcgagcagggtgatcatgacgcgtggttcgaggactccgcggcgtgacgggtacggaggtcacggccctgcagatcacggtgacggcgccggttgtctccttccgtaatccgctgtatgccggggtgcaggtgacgctgccgtgtccgccgccggccaccgtcggcggcctcctcgccgcagcggctggggggtgggagcaggtcaatccggagctgcgtttcgcgatggcgttccacgctggcggcaaggcggtcgatctcgagacgtaccacccgctggacgcgtctgggaagaaggcgtcgcctgccccgcgtaaccgggagttccttacggcggccgagctcaccgtgtggctggtcgacgaccctgaagggtggcagcgccgcctgcgtcggccggtgtggccgctgcggctgggccgcagccaggacctggtcggtatccgcaccggcctggttccgttgcgcgcggagcccggcgagcagcggtccgccgtggtgccggagacggcggggaggatgggaaccctactgcggctgccgactgcggtctctgggggccgggaccgtacccggtgggacagctaccggttcgacagctcgggccgcagtgaccatgtggtcgtaggcggctggtcgactgccgggggacaggcagtcattctgctgccctcggcccatcccgataccgtcgcgcgttcctgatggttctgccgtcgggccgtaccgatagggagcccatcgccactatgacggacgtcctgtccacgctgcgggccaagagcgctcaacgggggcgttctgcggaccttctcaccgcgcatttgtccgagactcgtgctgcggcagctgggctgcggcagcgtgtgggccgtctggacgcggtggaggacgtcttcggcggcaggttctggcccgtcgtggaactcgctggcctcacccacgacgccggcaagattcccgaaggcttccagcggatgctggcgggatacagccgtgcctggggtgagcgtcacgaagtcgcctcgttgggcttcctgcccgcgctcatcggcgacccggacgtgctgttgtgggtggcgaccgcggtcgccacccaccatcgtccgctgaccggccagaacggacgcgacctgcagactctctacagcggtgtcaccatcaccgagctcgcgcaccgtttcgggccttttgacccacgcgctgtccccgccttggaggcctggcttcgtgcgagcgccatccgggtcggcctccccgcggccgctgttccagacgacggcacgctcaccgacaccggagtggtcgctggcgcccaccagctgctggaggagattttggaccgttgggcagaccgtgtgaggcctgaggtgggcttggccgctgtactgctgcagggggcggtcaccctggccgaccacttgtcctccgcccatcaggctctgcccaccgtccagccgttgggggccgggttccggtcccggttggagaaggagttcgctgaacgcggcaggaccctgcgtgcccaccagctggaggccgccaccgttaccggacatcttctgctgcgcgggccgaccggcagtgggaagaccgaggctgccctgctgtgggctgccagccaggtcgaggccctgaaggcggaaggccggggcgtgccgcgtgtgtttttcactctcccctacctggcctccatcaacgccatggcaacacggctgggtgacactctcggcgatggtgaggctgtcggcgttgcccactcccgcgccgcctcctaccaccttgcccaggccatcgccccgcaggacggcgacgaggaggacgaacacggagccccctgccgtgttgacgcggccgccaaggccttgtcccgggccgctgccaccaagctgttccgcgagagtgtccgcgtcgccaccccctaccagcttctgcgggccgccctggccgggccggcccactccggcatcctcatcgacgccgcgaactcggtgttcatcctggacgaactccacgcctacgacgcccgcaggctcggctacatcctggccagtgcccggctgtgggaacgcctcggtggacggatcacagtcctgtccgcgaccctgcccagggccctggccgacctgttcgagagcaccctcaccgcccccatcaccttcctcgacacccccgacctcgggctgccggcgcgccacctcctgcacacccgaggccaccatctcaccgacccggccacactggaggagatccgtctgcggctgtcccgggacgagtcggtcctggtgatcgccaacaacgtgtcccaggccatcgccctgtacgaacagctcgcacccgacgtgtgtgaacgcttcggtcaggacgccgcgctactgctgcactcccggtttcgacggatggaccggtcccggattgagcagaagatcgccgaccggttcgccactgtggcacctgatgcccagaacagccgtaagccgggcctggtcgttgccacgcaggtggtcgaggtcagtctcgacgtcgacttcgatgtgctgttcactggagcggctccgctcgaggccctcctgcagcgcttcggccggaccaaccgcgtcggggcccgcccgccggccgacgtcatcgtccaccatcccgcctggaccacacgccgccgacagcccggcgagtacgccgacggcatctacccacgggagccggtcgagtccgcgtggcacatcctcacccgcaatcacgggcgagtcatcgacgaagcggacgccaccgcgtggctggacgaggtctacgccacggactggggcaggcaatggcaccgcgaggtgctggagcggcgagaaagattcgaccgtgcgttcctgcagttccgctaccccttcgaagaccgcactgacctggccgataccttcgacgaactcttcgacggctccgaagccatcctcgccgaagaccaggacgcctactcagccgcactggccgcaccagacggcgaccaccccggagctggccggctcctcgcagaggaatacctcatccccgttccccactgggccagccccctcagccgctacgagaagcagctcaaagtccgcgtcatcaacggcgactaccaccccgaccacggcctcatggcggtccgggggctgccccagcccgcctaccgcgccggggaggtcttgtgatcgacaaggaggacatcggcggcgtccacatcaagtacctctaccactgccgccgccagctgtggctgtacctgcgcggcatccgtcccgaacacctcagtgccaccgtccggtccggtgaagccgtccacgacacctcctacacccgcaacacccctgtcgacctcggcgcagcacgactcgacttcatcgacggcgcgcactgggtccacgagatcaaatcctccacacgccccagcctggccgatcaggcccagggccgccactactgtcaccggctgcgccgcatcggcatcgatgcccggggcgccgttctgcactaccccaagactcggcgcacacagcgattcccctacacccccgaggctgccgcccaagccgaagaggacatcgccgaggccctcatcgttgccgctgctcaaagctccccggagcggctcaaccgctccgcctgccggggctgcagtttcaccgactactgctggacggaatgagatgcccgctgccgcccaaacatactggctgaccagccccagtcgaatccgccgaaaagaccaatcgctgatcatcgaacgcgaaaccggcggcaacgtccatatccccattaccgatgttcgcgatatcatcgcctgcgccgaggtcgacatcaacaccgcggtgatctcactgctcaaccagcaccgcatcaacattcacgtcctcagctactacggcgactacgccggctccctgctcacctcagaaaccagcacctccggggacactgttctggcacaggcaagaatcgcccaggatcgcgatgcgagcctgaatattgcccgcaacatcattgactccaccgccttcaacgtgcgccgcattgtcgaccgtaagctcctaagccgcccctacgccgtcctcaaaaactccatagtcaccgctgagagcccagcccagctcatgggcgccgagggaacattccgccgctccgcctgggaagtcatagacaccaaactccccgactggctgcaactcggcggccgcagccgccgcccgcccaagaacgccgggaacgccttcatcagctacgtcaacgggatcacgtatgcgcgactcctcagcgccattcgtctcaccccactgcacagcggaatctcttttctccacagcagcatggaacgccagcggcactccttggtcttggacctctccgagatgttcaagcccctcttcgccgaacggctcctgctacgcatgtcaggacgaaaccaacttaaggaacaccacttcgaccgcgacagcaaccaagcaatgctcagcgaggcgggtcgcaaactcgtggtccaaagtgtccgagacgaattcgccgtcaccgtagcgcaccgcagcctcggccgtaacgtcgcctacgacgaattgctgtacctggacgcgcttgccctaacccgccattgcctggaaggcgccgcctacaaacctttccgaatctggtggtgaacaccacgtgtatgtagtcgtcgtctacgacacccacgccaaacgaaacgcacggatcctgcgtacctgccgcaagtacctccaccacgtccagcgcagcgtcttcgaaggccacctcagcgacgcccaactccgacactttcaagctgcagtcgaagatgccctcgacttggagtacgacaacgtcctcgtctacacgttcccagccggcaccgtgccacaacgccttgaatggggagcagtcgaacccgcccccagtgacatcctgtga
表2 引物及编辑元件序列表
引物名称 引物序列(5,to 3,) 酶切位点
28acas-AF aagaaggagatataccatggtggtcgccggtgccccgaacaac NdeI
28acas -AR cattatgcggccgcaagcttgcggcttacgactcacaggatgtcact BamHI
304cas -TF accatgattacgccaagcttgtggtcgccggtgccccgaacaac HindIII
304cas -TR gtacccggggatcctctagatgcggcttacgactcacaggatgtcact EcoRI
galMF gtgctgaacgaaactccc
galMR aatactcttcgccaggac
galMUF gcaagctcggttgcggccgcgctgatggactggggtgc NotI
galMUR gcggaatgccgccttcatcatcgttctggttcacaatctg
galMDF cagattgtgaaccagaacgatgatgaaggcggcattccgc
galMDR
galM-check-F
galM-check-R CCCAAGCTTtcagggtggttcgggctgt
cgcgacgaagcaacagcaatgct
gaccggcggcggatttggcg HindIII
amyE-F atgtttgcaaaacgattcaaaa
amyE -R tcaatggggaagagaaccgctta
amyE -UPF cgacggccagtgccaagcttcaaatcgaatgagcttacagc HindIII
amyE -UPR tcttacgtgccgatcaacgtctcagtttttaatttgtgtgtttccat
amyE -CmF atggaaacacacaaattaaaaactgagacgttgatcggcacgtaaga
amyE -CmR tcattggcatacgtatcatgcgataaatgaagttcctattccgaagttc
amyE -DownF gaacttcggaataggaacttcatttatcgcatgatacgtatgccaatga
amyE -DownR gcggccgcggatcctctagaaggataaagcacagctacagacc XbaI
sgRNA 序列 Note
guide DNA -galM
guide DNA -pKD3-tEC-DNA gcaagctcggttgcggccgctaatgtgagttagctcactcattaggcaccccaggctttacactttatgcttccggctcgtatgttgtgtggaattgtgagcggataacaattgcatcagacattgccgtcactgcgtcttttacaccgggcaaggtttatcaactgtggcgcgataagtaatggttgcatcagacattgccgtcactgcgtcctagcataaccccttggggcctctaaacgggtcttgaggggttttttgAAGCTTCCC
gcaagctcggttgcggccgctaatgtgagttagctcactcattaggcaccccaggctttacactttatgcttccggctcgtatgttgtgtggaattgtgagcggataacaattgcatcagacattgccgtcactgcgtccggatgagcattcatcaggcgggcaagaatgtgaataaagttgcatcagacattgccgtcactgcgtcctagcataaccccttggggcctctaaacgggtcttgaggggttttttgtttgcccgattgcggccgc NotI
HindIII
NotI
guide DNA -pKD3-tSV-DNA gcaagctcggttgcggccgctaatgtgagttagctcactcattaggcaccccaggctttacactttatgcttccggctcgtatgttgtgtggaattgtgagcggataacaagtcctcatcgccccttcgaggggtcgcaaccggatgagcattcatcaggcgggcaagaatgtgaataaaggtcctcatcgccccttcgaggggtcgcaacctagcataaccccttggggcctctaaacgggtcttgaggggttttttgtttgcccgattgcggccgc
NotI
guide DNA -amyE aggtcgactctagaggatcctaatgtgagttagctcactcattaggcaccccaggctttacactttatgcttccggctcgtatgttgtgtggaattgtgagcggataacaattgcatcagacattgccgtcactgcgtctgttagacagggcattgaatgacggggcagacggttttcgatttgcatcagacattgccgtcactgcgtcctagcataaccccttggggcctctaaacgggtcttgaggggttttttgtatgacatgattacgaattc BamHI
EcoRI
注:大写字母为酶切位点,波浪线为保护碱基,引物黑体加粗为互补区,单下划线为启动子promoter,斜体为spacer,黑体加粗为repeat,双下划线为终止子terminator
- 还没有人留言评论。精彩留言会获得点赞!