一种大肠杆菌菌影载体pPBA1100‑DLS‑ES及其制备方法与流程
本发明涉及基因工程领域,具体说,是一种大肠杆菌菌影载体pPBA1100-DLS-ES及其制备方法。
背景技术:
禽大肠杆菌是引起禽类大肠杆菌病的重要病原,引起复杂多样的临床症状,常呈混合感染,给养禽业造成巨大的影响。由于抗生素的长期使用,大肠杆菌的耐药性和耐药谱不断扩展,随着耐药菌株和超级菌的出现,使药物防治的效果已大不如前。抗生素也容易导致药物残留,现在很多地方已经禁止使用抗生素类药物。目前对于大肠杆菌病的控制,主要采取综合防治措施,比如说加强管理,合理给药,并进行适当的免疫接种。由于大肠杆菌血清型众多,各血清型之间缺乏交叉免疫保护力,必须做好血清型监测,以便有针对性的进行免疫接种。国内外常用的大肠杆菌疫苗有灭活苗,弱毒活菌苗,亚单位疫苗。它们都有一定的优缺点:灭活苗成本低,操作简单但缺乏交叉保护力,而且灭活过程会破坏免疫原性;弱毒活菌苗有良好的免疫原性,制备简单但存在毒力返强的风险;亚单位疫苗免疫效果好但存在血清特异性没有交叉保护效果等缺点。因此,研制一种高效,安全的规模化生产的新型疫苗十分必要。
目前,菌影疫苗被成功应用到各种不同类型的革兰氏阴性细菌中,包括鼠伤寒沙门氏菌、肠炎沙门氏菌、胸膜肺炎放线杆菌、霍乱弧菌等,但都处于实验室阶段,灭活效率是菌影疫苗能否成功应用到生产实践的关键。
技术实现要素:
为解决上述现有技术存在的问题,本发明的目的在于提供一种大肠杆菌菌影载体pPBA1100-DLS-ES及其制备方法,以卡那抗性的E.coli-Pm穿梭载体pPBA1100为表达载体骨架,在温控单裂解表达系统中引入编码金黄色葡萄球菌核酸酶A的SN基因,提高了裂解效率,制备了大肠杆菌菌影。
为达到上述目的,本发明的技术方案为:
一种大肠杆菌菌影载体pPBA1100-DLS-ES,由E基因,SN基因,PBV2200载体的温控表达原件DLS和E.coli-Pm穿梭载体pPBA1100组成;所得E-15L-SN基因的核苷酸序列如SEQ ID NO.1所示;
借助15个柔性氨基酸linker采用融合PCR方法实现噬菌体PhiX174的E基因与金黄色葡萄球菌核酸酶A基因SN的串联,并构建温控表达载体PBV-ES;以PBV-ES质粒为模板,扩增温控双基因裂解盒DLS-ES,将其插入到E.coli-Pm穿梭载体pPBA1100,构建温控双基因裂解载体pPBA1100-DLS-ES。
进一步的,所述菌影载体为双基因表达载体。
进一步的,PBV220-ES载体的温控双裂解表达盒DLS-ES为PBV220-ES载体基因序列中从阻遏蛋白到终止子的全部基因序列。
进一步的,所述的pPBA1100为载体E.coli-Pm穿梭载体,可同时制备大肠杆菌和多杀性巴氏杆菌菌影。
一种大肠杆菌菌影载体pPBA1100-DLS-ES的构建方法包括如下步骤:
1)、以噬菌体PhiX174RF1质粒和金黄色葡萄球菌标准株ATCC25923的基因组为模板,分别扩增裂解基因E和核酸酶A基因SN,通过15个柔性氨基酸linker采用融合PCR方法实现E与SN基因的串联E-15L-SN,将融合片段E-15L-SN与T载体相连,筛选阳性质粒;
2)、将步骤1)得到的阳性质粒,亚克隆到质粒pBV220中,得到重组质粒pBV220-ES;
3)、以步骤2)得到的重组质粒pBV220-ES为模板,PCR扩增DLS-ES基因;将DLS-ES片段与T载体相连,筛选阳性质粒;
4)、将步骤3)得到的阳性质粒,亚克隆到E.coli-Pm质粒pPBA1100中,得到重组质粒pPBA1100-DLS-ES;
5)、将步骤4)得到的重组质粒pPBA1100-DLS-ES电转入大肠杆菌电转感受态中,通过升温诱导制备大肠杆菌菌影,菌影冻干保存。
进一步的,所述构建方法包括如下步骤:
1)引物设计与合成
根据GenBank上发表基因序列:E,9626372;SN,685631213,设计引物,通过linker3:G4S将双基因串联,引物序列如下表:
2)E,SN和E-15L-SN基因的PCR扩增
以噬菌体Φ174RFI DNA为模板,以E1,E2为上、下游引物,扩增E基因;以E1,E2’为上、下游引物,扩增E-15aalinker。反应条件94℃5min;94℃45s,60℃30s,72℃30s,35个循环;72℃10min;4℃保存;反应结束后,取5ul PCR产物进行1%琼脂糖凝胶电泳检测;
以金黄色葡萄球菌基因组为模板,以SN1’,SN2为上、下游引物,扩增15aalinker-SN;反应条件94℃5min;94℃45s,60℃30s,72℃45s,35个循环;72℃10min;4℃保存;反应结束后,取5ul PCR产物进行1%琼脂糖凝胶电泳检测;
以E-15aalinker和15aalinker-SN为模板,以E1,SN2为上、下游引物,采用降落PCR扩增E-15L-SN基因,反应条件:94℃预变性3min;94℃变性45s,60℃退火90s,每循环降0.5℃,72℃延伸1min,20个循环;再94℃变性45s,55℃退火90s,72℃延伸1min,30个循环,72℃延伸10min;反应结束后,取5ul PCR产物进行1%琼脂糖凝胶电泳检测后回收目的片段;
3)目的基因的鉴定
回收E,SN和E-15L-SN基因,与pMD18-T载体相连,转化筛选阳性重组子提质粒酶切鉴定;阳性重组子送上海生工测序;
4)重组温控表达载体构建
EcoR I和Sal I分别双酶切片段E-15L-SN及PBV220载体,回收目的片段,T4连接酶16℃连接过夜,转化筛选阳性重组子,构建重组表达载体PBV-ES;
5)温控裂解盒的扩增
根据GenBank上λpL/pR-cI857温控启动子序列及pBV220质粒序列设计温控裂解盒上游引物,下游引物即为SN基因下游引物,引物序列如下:
WK-BamHI:5’-CCG GGATCC TCAGCCAAACGTCTCTTCAG-3’(BamHI)
SN2:5'-GGC GTCGAC TTATTGACCTGAATCAGCG-3'(SalI)
以pBV-ES质粒为模板,以WK-BamHI和SN2为上、下游引物,扩增温控双基因裂解盒DLS-ES;反应条件:94℃5min;94℃45s,60℃30s,72℃1.5min,35个循环;72℃10min;4℃保存;反应结束后,电泳检测后回收目的片段;
6)重组穿梭载体pPBA1100-DLS-ES的构建
BamHI和SalI分别双酶切片段DLS-ES和质粒pPBA1100,回收目的片段,T4连接酶16℃连接过夜,转化筛选阳性重组子,获得重组穿梭载体pPBA1100-DLS-ES;
7)大肠杆菌电转感受态的制备
取一80℃保存的大肠杆菌菌株涂布于LB平板37℃培养24h,挑取单菌落,在5mL LB培养基中37℃,225rpm过夜振荡培养,将此培养液取1mL再接种在100mL新鲜的LB培养基中,1:100,37℃振荡培养至OD介于0.3-0.4之间约2h取出,冰浴30min,10%的灭菌甘油同时置于冰上;
4℃,2500rpm/min离心15min,用30mL冰浴的10%的甘油充分重悬沉淀;
4℃,2500rpm/min离心15min,10%甘油洗涤三次弃上清;最后用1mL冰浴的10%甘油充分重悬沉淀,保持冰浴状态下分装成200ul/份。注意制备的感受态细胞应尽量在当天使用,不宜保存;
8)大肠杆菌菌影的制备
采用电转法将重组穿梭载体pPBA1100-DLS-ES电转入大肠杆菌电转感受态中,通过升温诱导制备大肠杆菌菌影,并以pPBA100,pPBA1100-DLS-E转化大肠杆菌作对照,对其裂解效率做了初步研究和比较,透射电镜观察裂解前后菌体的变化。
相对于现有技术,本发明的有益效果为:
本发明在温控单裂解表达系统中引入编码金黄色葡萄球菌核酸酶A的SN基因,提高了裂解率,裂解率可达99.99999%,同时也降低了仅通过裂解基因E来制作菌影存在的功能基因在菌体间转移的风险,以卡那抗性的E.coli-Pm穿梭载体pPBA1100为表达载体骨架,使耐青霉素类大肠杆菌也能通过温控载体制备菌影,制备了大肠杆菌菌影。本发明构建好的载体可以同时在大肠和巴氏杆菌中表达。
附图说明
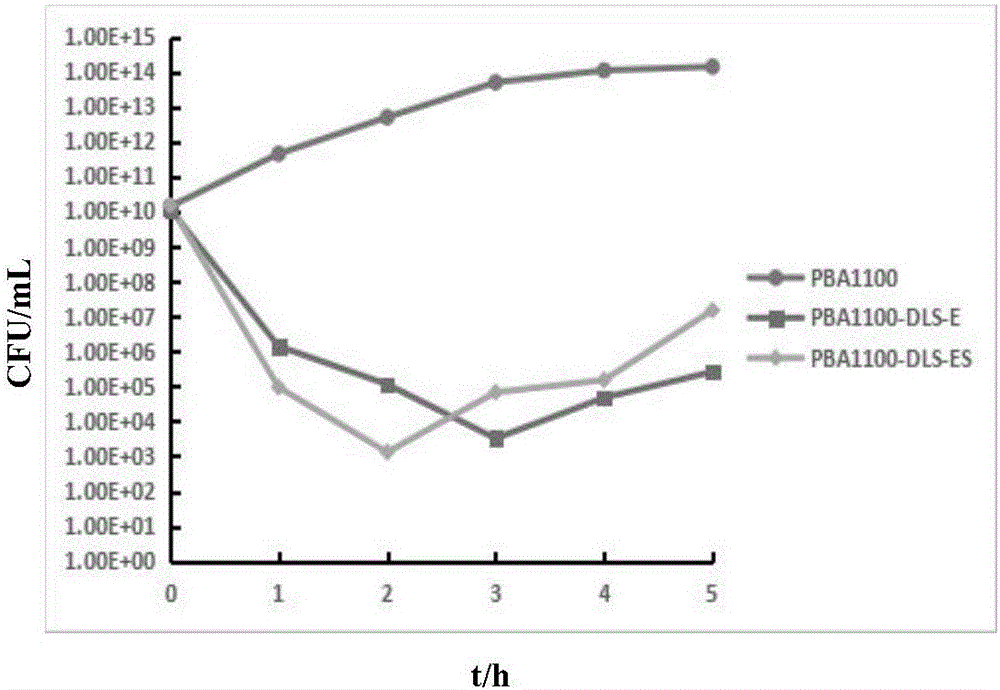
图1为42℃诱导后各组菌液生长曲线;
图2为42℃诱导后各组菌菌落计数;
图3为致病大肠杆菌菌影电镜照片;
图4为E基因的核苷酸序列;
图5为SN基因的核苷酸序列;
图6为E-15L-SN基因的核苷酸序列;
其中,框体为上游引物;灰色框体为为Linker;
黑粗体为下游引物;黑粗体:为上下游引物重复部分
酶切位点:开头为EcoR I(GAATTC),结尾为SalI(GTCGAC)设保护碱基。
具体实施方式
下面结合附图和具体实施方式对本发明技术方案做进一步详细描述:
试验例:致肾性大肠杆菌菌影的制备
1材料与方法
1.1材料
致肾性大肠杆菌为中国兽医药品监察所惠赠,金黄色葡萄球菌标准株TACC25923购自广东环凯微生物科技有限公司;pPBA1100质粒由澳大利亚莫纳什大学微生物学系的BenAdler教授惠赠;PBV220质粒购自北京鼎国生物技术有限公司;限制性内切酶EcoRI,SalI和BamHI,T4连接酶,pMD18-T和E.coli DH5a,噬菌体Φ174RFI DNA购自大连Takara公司。
1.2方法
1.2.1引物的设计与合成
根据GenBank上发表基因序列(E,9626372;SN,685631213)设计引物,通过linker(G4S)3将双基因串联,引物序列见下表,所有引物均由上海生工生物工程公司合成。
表1引物序列
1.2.2E,SN和E-15L-SN基因的PCR扩增
以噬菌体Φ174RFI DNA为模板,以E1,E2为上、下游引物,扩增E基因;以E1,E2’为上、下游引物,扩增E-15aalinker。反应条件94℃5min;94℃45s,60℃30s,72℃30s,35个循环;72℃10min;4℃保存。反应结束后,取5ul PCR产物进行1%琼脂糖凝胶电泳检测。
以金黄色葡萄球菌基因组为模板,以SN1,SN2为上下游引物,扩增SN基因;以SN1’,SN2为上、下游引物,扩增15aalinker-SN。反应条件94℃5min;94℃45s,60℃30s,72℃45s,35个循环;72℃10min;4℃保存。反应结束后,取5ul PCR产物进行1%琼脂糖凝胶电泳检测。
以E-15aalinker和15aalinker-SN为模板,以E1,SN2为上、下游引物,采用降落PCR扩增E-15L-SN基因,反应条件:94℃预变性3min;94℃变性45s,60℃退火90s,每循环降0.5℃,72℃延伸1min,20个循环;再94℃变性45s,55℃退火90s,72℃延伸1min,30个循环,72℃延伸10min。反应结束后,取5ul PCR产物进行1%琼脂糖凝胶电泳检测后回收目的片段。
1.2.3目的基因的鉴定
如图4-6所示,回收E,SN和E-15L-SN基因,所得E-15L-SN基因的核苷酸序列如SEQ ID NO.1所示;与pMD18-T载体相连,转化筛选阳性重组子提质粒酶切鉴定。阳性重组子送上海生工测序。
1.2.4重组温控表达载体构建
用EcoR I和Sal I分别双酶切片段E和片段E-15aalinker-SN及PBV220载体,回收目的片段,T4连接酶16℃过夜连接,转化筛选阳性重组子,构建重组表达载体PBV-E和PBV-ES。
1.2.5温控裂解盒的扩增
根据GenBank上λpL/pR-cI857温控启动子序列及pBV220质粒序列设计温控裂解盒上游引物,下游引物为E基因或者SN基因下游引物,引物序列如下:
WK-BamHI:5’-CCG GGATCC TCAGCCAAACGTCTCTTCAG-3’(BamHI)
E2:5'-GGC GTCGAC TTA CTCCTTCCGCACGTAAT-3'(SalI)
SN2:5'-GGC GTCGAC TTATTGACCTGAATCAGCG-3'(SalI)
以PBV-E质粒为模板,WK-BamHI和E2为上、下游引物,扩增温控单基因裂解盒(DLS-E);以pBV-ES质粒为模板,以WK-BamHI和SN2为上、下游引物,扩增温控双基因裂解盒(DLS-ES)。反应条件:94℃5min;94℃45s,60℃30s,72℃1.5min,35个循环;72℃10min;4℃保存。反应结束后,电泳检测后回收目的片段。
1.2.6重组穿梭载体pPBA1100-DLS-ES的构建
用BamHI和SalI分别双酶切片段DLS-ES和DLS-E,质粒pPBA1100,回收目的片段,构建重组穿梭载体pPBA1100-DLS-E和pPBA1100-DLS-ES。阳性菌落提质粒做PCR和双酶切鉴定。
1.2.7致肾性大肠杆菌电转感受态的制备
取一80℃保存的致肾性大肠杆菌菌株涂布于LB平板37℃培养24h,挑取单菌落,在5mL LB培养基中37℃,225rpm过夜振荡培养,将此培养液取1mL再接种在100mL新鲜的LB培养基中(1:100),37℃振荡培养至OD介于0.3-0.4之间约2h取出,冰浴30min,10%的灭菌甘油同时置于冰上;
4℃,2500rpm/min离心15min,用30mL冰浴的10%的甘油充分重悬沉淀;
4℃,2500rpm/min离心15min,弃上清(10%甘油洗涤三次);最后用1mL冰浴的10%甘油充分重悬沉淀,保持冰浴状态下分装成200ul/份。注意制备的感受态细胞应尽量在当天使用,不宜保存。
1.2.8致肾性大肠杆菌菌影的制备
采用电转法将pPBA1100-DLS-ES质粒电转入致肾性大肠杆菌电转感受态中。通过升温诱导制备致肾性大肠杆菌菌影,并以pPBA100,pPBA1100-DLS-E转化大肠杆菌作对照,对其裂解效率做了初步研究和比较。
1.2.9致肾性大肠杆菌菌影裂解率的检测
将含有pPBA1100,pPBA1100-DLS-E和pPBA1100-DLS-ES质粒的致肾性大肠杆菌28℃225rpm摇床过夜培养。次日,再1:100转接种于含卡那抗性(50ug/mL)的LB液体培养基中,28℃下培养,直至OD600值达到0.4-0.6(约2h)。含有三种不同质粒的菌液各取出1mL菌液用于菌落计数。然后各分2组,一组作为对照组,仍然在28℃下继续培养5h,另一组立即升温到42℃热诱导培养5h;从热诱导开始,每间隔0.5h分别取样测定各组的OD600值见图1,诱导组每隔1h各取1mL菌液用于菌落计数见图2。裂解率=(1-裂解后菌落数/裂解前菌落数)*100%。在裂解率最高时,pPBA1100-DLS-E组的裂解率达99.99992%,pPBA100-DLS-ES组的裂解率达99.99999%,裂解后活菌数下降了将近6个指数。
1.2.8透射电镜观察
选择裂解率最高时收集菌影做透射电镜观察。将诱导4h的菌液4000g X 10min离心生理盐水洗涤3次,置入2.5%的戊二醛溶液中进行固定,置4℃下2h,乙醇逐级脱水,包埋剂包埋等步骤处理,在透射电镜下进行观察。
由图1和图2可以看出pPBA100-DLS-ES组的裂解率比pPBA1100-DLS-E组的高;从图3的电镜图可以看出菌体发生不同程度的裂解,菌影呈空泡状,细菌由于胞内物质排出,表明致肾性大肠杆菌菌影制备成功。这些可以证明利用穿梭温控双表达载体pPBA1100-DLS-ES制备菌影不仅提高了裂解效率而且可以用于耐青霉素类大肠杆菌菌影的制备。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何不经过创造性劳动想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应该以权利要求书所限定的保护范围为准。
SEQUENCE LISTING
<110> 湖北省农业科学院畜牧兽医研究所
<120> 一种大肠杆菌菌影载体pPBA1100-DLS-ES及其制备方法
<130> 2016
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 786
<212> DNA
<213> 人工序列
<400> 1
caggaattca tggtacgctg gactttgtgg gataccctcg ctttcctgct cctgttgagt 60
ttattgctgc cgtcattgct tattatgttc atcccgtcaa cattcaaacg gcctgtctca 120
tcatggaagg cgctgaattt acggaaaaca ttattaatgg cgtcgagcgt ccggttaaag 180
ccgctgaatt gttcgcgttt accttgcgtg tacgcgcagg aaacactgac gttcttactg 240
acgcagaaga aaacgtgcgt caaaaattac gtgcggaagg agggtggtgg tggttctggt 300
ggtggtggtt ctggtggtgg tggttctgca acttcaacta aaaaattaca taaagaacct 360
gcgacattaa ttaaagcgat tgatggtgat actgttaaat taatgtacaa aggtcaacca 420
atgacattca gactattatt ggttgataca cctgaaacaa agcatcctaa aaaaggtgta 480
gagaaatatg gtcctgaagc aagtgcattt acgaaaaaga tggtagaaaa tgcaaagaaa 540
attgaagtcg agtttgacaa aggtcaaaga actgataaat atggacgtgg cttagcgtat 600
atttatgctg atggaaaaat ggtaaacgaa gctttagttc gtcaaggctt ggctaaagtt 660
gcttatgttt ataaacctaa caatacacat gaacaacttt taagaaaaag tgaagcacaa 720
gcgaaaaaag agaaattaaa tatttggagc gaagacaacg ctgattcagg tcaataagtc 780
gacgcc 786
- 还没有人留言评论。精彩留言会获得点赞!