CRISPR-Cas9体外敲除耐药基因mcr-1的方法及其专用细胞穿透肽与流程
本发明涉及微生物基因工程和生物技术领域,特别是一种利用CRISPR-Cas9系统体外敲除微生物耐药基因mcr-1的方法及其专用细胞穿透肽CPP5a。
背景技术:
华南农业大学刘健华教授和中国农业大学沈建忠教授在动物和住院患者中发现多粘菌素耐药的新基因mcr-1(Liu YY, Wang Y, Walsh TR, Yi LX, Zhang R, Spencer J, Doi Y, Tian G, Dong B, Huang X, Yu LF, Gu D, Ren H, Chen X, Lv L, He D, Zhou H, Liang Z, Liu JH, Shen J. 2016. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study. Lancet Infect Dis 16:161-168.)该基因由质粒所携带,可以在不同菌株间进行水平转移,而在该文献发表之前,仅报道过由基因突变导致的多粘菌素耐药,而这种耐药性是不会在细菌间进行传播的。由于多粘菌素被认为是对抗多重耐药细菌的最后一道防线,因此,质粒携带的mcr-1基因一经发现,立即引起全球广泛关注。根据该文献报道mcr-1基因主要存在于中国,可能已传播至东南亚国家,目前尚无良好的防控方法。
CRISPR(clustered regularly interspaced short palindromic repeats)技术为开发新型微生物基因治疗措施提供了可能。CRISPR-Cas9系统是2013年新发现的强大基因定点编辑技术,能够方便而精确的对DNA和核苷酸序列进行编辑、切割、修饰。CRISPR-Cas9系统的工作原理是成簇的、规律间隔的短回文重复序列crRNA(CRISPR-derived RNA)通过碱基配对与 tracrRNA(trans-activating RNA)结合形成tracrRNA/crRNA组合物,此组合物引导核酸酶Cas9蛋白在与 crRNA 配对的序列靶位点实现定点剪切双链DNA。在实际应用中tracrRNA/crRNA组合物可优化为一条sgRNA序列,包含tracrRNA/crRNA的双重功能。
目前CRISPR-Cas9系统最广泛的应用方式是通过设计 1 个 sgRNA-Cas9体系在目标基因PAM(如NGG基序)元件上游实现DNA 双链断裂,在DNA损伤修复过程中(同源重组或非同源末端连接) 目标 DNA会发生缺失或者插入,从而造成目的基因敲除或者插入新的基因。随着对Cas9蛋白研究深入,改变该蛋白3个氨基酸后可以解决脱靶问题,在宏基因组水平检测不到对非目标基因的切割,结果为这一技术应用于治疗提供支撑。
CRISPR-Cas9系统基因编辑效率很高且系统非常简单,可用于微生物基因改造技术。利用这种技术可以在体外有效敲除微生物耐药及毒力相关基因。Citorik等将可编码 Cas9 蛋白基因和sgRNA基因整合在噬菌体基因组中或者放在转导质粒中实现对超级耐药基因的定点敲除;最近发现将sgRNA-Cas9蛋白组合物用脂质体包裹或者在Cas9蛋白中插入细胞穿透肽CPP可以将sgRNA-Cas9蛋白组合物递送入细胞内,实现在体内的基因敲除。而在微生物体外对耐药基因mcr-1进行敲除后,再由细胞穿透肽将缺失基因递送入细胞内的方法,目前尚未见报道。
技术实现要素:
针对上述问题,本发明提供一种利用CRISPR-Cas9系统体外敲除微生物耐药基因mcr-1的方法及其专用细胞穿透肽CPP5a,本发明是这样实现的:
一种CRISPR-Cas9体外敲除耐药基因mcr-1的方法,具体步骤如下:
A)按照SEQ ID NO.5合成DNA序列并进行退火处理,获得杂交双链;
B)利用BsaI酶切载体pCas9;
C)利用T4连接酶连接杂交双链与酶切后的载体pCas9,获得载体pCas9-mcr;
D)将载体pCas9-mcr、细胞穿透肽CPP5a与含耐药基因mcr-1的微生物混合,4-37℃环境中共同孵育,即实现对微生物中耐药基因mcr-1的敲除。
进一步,本发明所述CRISPR-Cas9体外敲除耐药基因mcr-1的方法中,步骤A)所述的退火处理是指:
退火体系:浓度为100μM的合成DNA1μL,10xPCR Buffer 1μL,加水补足10μL;
退火过程:95℃变性5min,之后在以2℃每分钟的速率降温至25℃,完成反应。
进一步,本发明所述CRISPR-Cas9体外敲除耐药基因mcr-1的方法中,步骤D)所述孵育是指:
将终浓度为0.1-1μg/ml的载体pCas9-mcr、终浓度为5-45μg/ml的细胞穿透肽CPP5a(纯度为99%)以及终浓度为108个/ml的微生物混合,于4-37℃环境中共同孵育6小时以上。
进一步,本发明所述CRISPR-Cas9体外敲除耐药基因mcr-1的方法,其特征在于,所述微生物为大肠杆菌。
一种用于权利要求1所述CRISPR-Cas9体外敲除耐药基因mcr-1方法的专用细胞穿透肽CPP5a,其氨基酸序列如SEQ ID NO.2所示。
本发明利用申请人在猪繁殖与呼吸障碍综合征病毒(PRRSV)研究中首次发现的双重功能阳离子穿透肽基序CPP5a(其氨基酸序列如SEQ ID NO.2所示),将缺失基因带入微生物细胞内,首次实现利用CRISPR-Cas9系统体外敲除微生物耐药基因mcr-1的方法。
目前已知的细胞穿透肽虽然从理论上,具有细胞穿透功能,但不能实现携带核酸或者蛋白进入细胞的功能。本发明提供的穿透肽CPP5a序列中的精氨酸可以实现细胞穿透的功能,递送蛋白进入微生物内部,其自身组成的结构可以与核酸相互作用,是良好的递送元件。相较于细胞内敲除,实现细胞体外敲除可以将此技术应用于临床超级耐药细菌的防控,具备广阔应用前景。
附图说明
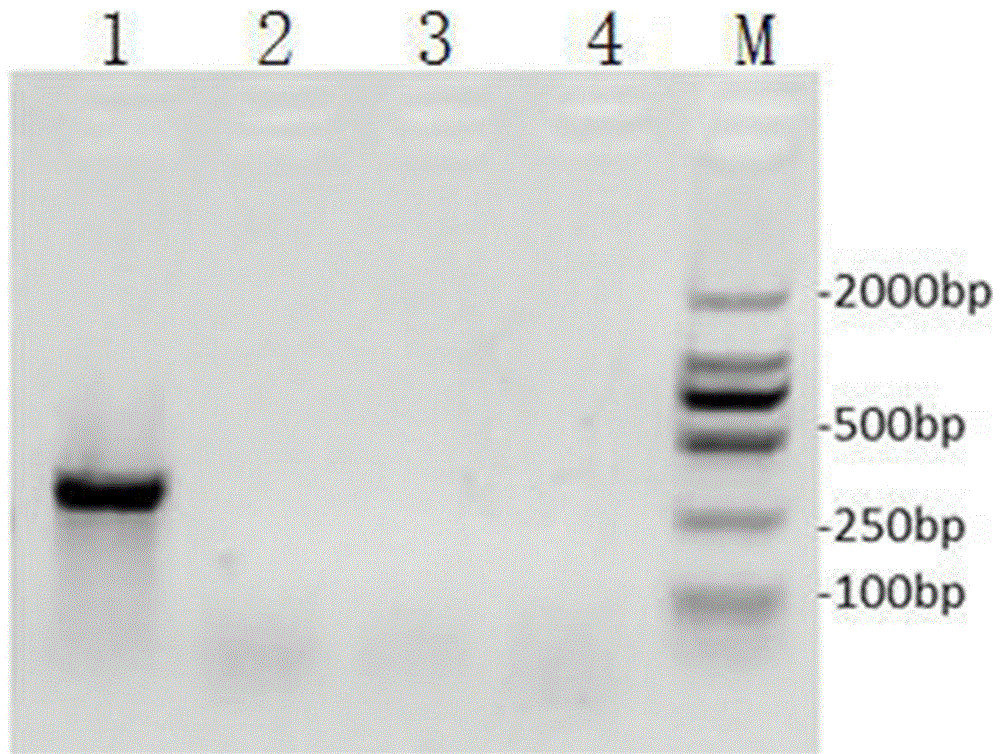
图1为mcr-1基因敲除成功后单克隆检测结果电泳图。
图2为mcr-1基因敲除成功单克隆耐药性分析示意图。
图3为穿透肽 CPP5a进入金黄色葡萄球菌的荧光共聚焦分析图。
图4为穿透肽CPP5a 与sgRNA-Cas9表达载体凝胶阻滞实验电泳图。
具体实施方式
以下实施例仅用于说明本发明并非是对本发明保护范围的限制。
实施例中使用的材料、试剂及技术手段,若未特别指明,所用技术手段为本领域技术人员所熟知的常规技术手段,所用原料和试剂均为市售商品。
pCas9购自addgene公司;
Alexa FluorR 488 Protein Labeling Kit(A10235,ThermoFisher公司);
金黄色葡萄球菌JS17、含有mcr-1基因的大肠杆菌NJ13,均为江苏省农业科学院分离保存。
细胞穿透肽CPP5a由吉尔生化科技有限公司合成。
以下实施例中未作具体说明的分子生物学实验方法,均参照《分子克隆实验指南》(第三版)J.萨姆布鲁克一书中描述的具体方法进行,或者按照试剂盒和产品说明书进行。
实施例涉及的序列:
SEQ ID NO.1(mcr-1基因特异性靶向序列):
ggtcagtccg tttgttcttg 20;
SEQ ID NO.2(细胞穿透肽CPP5a氨基酸序列):
Arg Gln Arg Gln Gln Arg Gln Gln;
1 5
SEQ ID NO.3(mcr-1基因上游引物):
aatcgttgca cttggtttga c 21;
SEQ ID NO.4(mcr-1基因下游引物):
atccttggtc tcggcttgg 19;
SEQ ID NO.5(sgRNA对应的DNA序列):
gttttagagc tagaaatagc aagttaaaat aaggctagtc cgttatcaac ttgaaaaagt 60
ggcaccgagt cggtgc 76;
实施例涉及的培养基:
TSB培养基配方:加入终浓度为胰蛋白胨1.5%(g/100ml)、大豆蛋白胨0.5%(g/100ml)、氯化钠 0.5%(g/100ml),然后用蒸馏水补足余量;调节pH为7.2±0.2,经121℃压力蒸汽灭菌15分钟后获得。
实施例1 针对mcr-1基因的CRISPR-Cas9系统的构建
1、比对mcr-1基因序列,寻找一个相对保守的区域,该区域mcr-1基因特异性靶向序列如SEQ ID NO. 1所示,对靶向序列进行sgRNA的设计,并获得了一条sgRNA,其对应的DNA序列信息如SEQ ID NO.5所示。
2、 pCas9-mcr的构建:
(1)按照SEQ ID NO.5设计并合成识别mcr-1基因的sgRNA DNA序列oligo DNA;
(2)对合成后的oligo DNA序列进行梯度降温退火,具体步骤为:
将合成的oligo DNA(100μM,1μL)与10xPCR Buffer(1μL)混合后,再加入水补齐体系10μL;然后95℃变性5min,之后在以2℃每分钟的速率降温至25℃完成反应;退火后形成合成的oligo DNA杂交双链。
(3)利用BsaI酶切载体pCas9以产生粘性末端,具体操作方法按addgene(http://www.addgene.org/)说明书进行。
(4)以T4连接酶将步骤(2)获得oligo DNA杂交双链与酶切后的载体pCas9进行连接,操作方法严格依照addgene(http://www.addgene.org/)说明书进行;连接后获得CRISPR-Cas9系统的载体pCas9-mcr。
(5)合成细胞穿透肽CPP5a,其氨基酸序列如SEQ ID NO.2所示;将合成后的多肽交由吉尔生化公司纯化,纯化后的细胞穿透肽CPP5a纯度达到99%。
(6)将步骤(4)获得的载体pCas9-mcr(终浓度:0.1-1μg/ml)与步骤(5)获得的纯化后的细胞穿透肽CPP5a(终浓度5-45μg/ml)混合,4-37℃,与大肠杆菌(终浓度108个/ml)共同孵育6小时以上,以敲除mcr-1基因,获得敲除mcr-1基因的大肠杆菌NJ13单克隆菌体。
(7)筛选转化后大肠杆菌NJ13单克隆,针对mcr-1基因,设计引物序列如SEQ ID NO.3和SEQ ID NO.4所示,以步骤(6)获得的大肠杆菌NJ13单克隆菌体为模板(同时以大肠杆菌NJ13野生型菌体为模板作为对照试验),进行PCR扩增:
PCR反应体系(50μL):上游引物(10pmol/μL)1μL、下游引物(10pmol/μL)1μL、dNTP(2.5μM)4μL、Taq DNA Polymerase 1μL、模板(反应体系中模板约加入106个)、10×Reaction Buffer 5μL、ddH2O补足至50μL;
PCR反应程序:95℃预变性,5min;95℃20S,55℃30S,72℃30S,共35个循环;最后72℃延伸10min。
扩增产物以0.8%的琼脂糖凝胶电泳,电压 120V,电泳结果如图1所示,图1泳道M为DNA marker,泳道1为大肠杆菌NJ13野生型菌体对照,泳道2-4均为步骤(6)获得的大肠杆菌NJ13单克隆菌体。由图1可见, mcr-1基因被打断后,耐药质粒无法完成损伤修复,耐药质粒在大肠杆菌中被清除。
电泳CR检测筛选到不含mcr-1耐药基因突变克隆,证实本实施例构建的CRISPR-Cas9系统可以敲除mcr-1耐药质粒。
(8)依照NCCLS标准方法,利用MIC实验(具体参见National Committee for Clinical Laboratory Standards. Reference method for broth dilution antifungal susceptibility testing of yeasts[S].Approved standard NCCLS document M27-A2. NCCLS. 2002. Villanova, PA.)分析步骤(7)筛选到的mcr-1缺失体大肠杆菌针对多粘菌素耐药性,结果如图2所示,图2中,1为大肠杆菌NJ13野生型菌体,2-4均为步骤(6)获得的大肠杆菌NJ13单克隆菌体。可见,步骤(6)敲除mcr-1基因的单克隆也丧失耐药性。
实施例2 穿透肽CPP5a金黄色葡萄球菌JS17内
试验步骤如下:
1、按照SEQ ID NO.2合成细胞穿透肽CPP5a ,用 Alexa FluorR 488 Protein Labeling Kit进行标记(操作步骤严格依照说明书进行),标记后蛋白命名为CPP5a-488;该标记化合物可以与蛋白质N-端NH2-残基连接,使标记后的蛋白在激光激发下发绿色荧光。
2、在TSB培养基中加入金黄色葡萄球菌JS17,再加入终浓度为0.1mg/ml的CPP5a-488,室温共同培养1小时后,用PBS洗去重组蛋白。
3、取步骤(2)共培养后的金黄色葡萄球菌JS17感染MAC-T细胞1小时作为实验组(GFP-CPP5a),同时设立未经步骤(2)共同培养的金黄色葡萄球菌JS17感染MAC-T细胞1小时作为对照组(GFP);然后洗涤MAC-T细胞三次,在60倍荧光共聚焦显微镜下观察,其结果如图3所示,图3A为对照组,图3B为实验组,图3B组实验组(插入CPP5a-488)可见绿色荧光,说明穿透肽CPP5a可以进入金黄色葡萄球菌JS17内。
实施例3 穿透肽CPP5a与sgRNA-Cas9表达载体pCas9-mcrDNA凝胶阻滞实验以电泳迁移率分析细胞穿透肽CPP5a与 DNA 的结合情况,若有物质与 DNA 结合,则 DNA在电泳中的迁移就会受到影响,即与单独的 DNA 迁移距离相比有一定的滞后。
实验组(12μL):载体pCas9-mcr的DNA 250 ng、实施例1步骤 (4)获得的载体pCas9-mcr 45μg、实施例1步骤(5)获得的穿透肽45μg、ddH20补足12μL;
对照组(12μL):载体pCas9-mcr的DNA 250 ng、实施例1步骤 (4)获得的载体pCas9-mcr 45μg、ddH20补足12μL;
将对照组和实验组分别室温孵育30分钟。孵育结束后,用 0.8%的琼脂糖凝胶跑电泳,电压 120V, 电泳结束后将电泳胶置于凝胶成像系统,在紫外光下观察、记录,分析 DNA 的迁移情况。
实验结果如图4所示,图4中,泳道1为实验组,泳道2为对照组,可见,sgRNA-Cas9表达载体与穿透肽CPP5a共孵育组DNA迁移速率明显变慢,说明sgRNA-Cas9表达载体与穿透肽CPP5a,存在相互作用。
SEQUENCE LISTING
<110> 江苏省农业科学院
<120> CRISPR-Cas9体外敲除耐药基因mcr-1的方法及其专用细胞穿透肽
<130> 5
<160> 5
<170> PatentIn version 3.3
<210> 1
<211> 20
<212> DNA
<213> 人工合成
<400> 1
ggtcagtccg tttgttcttg 20
<210> 2
<211> 8
<212> PRT
<213> 人工合成
<400> 2
Arg Gln Arg Gln Gln Arg Gln Gln
1 5
<210> 3
<211> 21
<212> DNA
<213> 人工合成
<400> 3
aatcgttgca cttggtttga c 21
<210> 4
<211> 19
<212> DNA
<213> 人工合成
<400> 4
atccttggtc tcggcttgg 19
<210> 5
<211> 76
<212> DNA
<213> 人工合成
<400> 5
gttttagagc tagaaatagc aagttaaaat aaggctagtc cgttatcaac ttgaaaaagt 60
ggcaccgagt cggtgc 76
- 还没有人留言评论。精彩留言会获得点赞!