一种替格瑞洛新晶型S及其在药物制剂中的应用的制作方法
本发明属于药物化学领域,具体涉及药用化合物替格瑞洛的一种新的晶型S及其制备方法,以及新晶型的药物组合物在治疗冠状动脉、脑血管或外周血管疾病患者的动脉血栓形成并发症中的应用。
背景技术:
替格瑞洛(Ticagrelor),又名替卡格雷,商品名为倍林达,其化学名为:(1S,2S,3R,5S)-3-[7-[(1R,2S)-2-(3,4-二氟苯基)环丙胺基]-5-(丙硫基)-3H-[1,2,3]三唑[4,5-d]嘧啶-3-基]-5-(2-羟基乙氧基)环戊烷-1,2-二醇。化学结构式为:
替格瑞洛是英国阿斯利康(AstraZeneca)公司研发的一种新型的、具有选择性的小分子抗凝血药,于2011年7月20日通过FDA批准用于减少急性冠脉综合征(ACS)患者的心血管死亡和心脏病发作,截止2014年11月已经在全球85个国家得到批准,被列入29个国家的医疗保险目录,并进入31个国家病人自付目录。
欧洲专利(WO01/92262)和美国专利(US7265124)以及中国专利(CN1817883A)中分别报道了替格瑞洛晶型Ⅰ、Ⅱ、Ⅲ、Ⅳ。其中,晶型Ⅰ是在甲醇-水中结晶形成的(熔点146-152℃),晶型Ⅱ是在氯仿中结晶得到(熔点136-139℃),晶型Ⅲ(熔点127-132℃)和Ⅳ(熔点139℃)是分别在乙醇和乙腈中结晶得到。替格瑞洛晶型Ⅰ的X射线粉末衍射图的反射角2θ在约5.3°、20.1°和20.7°有最强三个特征吸收峰,晶型Ⅱ的X射线粉末衍射图的反射角2θ在约13.5°、18.3°和24.3°有最强三个特征吸收峰,晶型Ⅲ的X射线粉末衍射图的反射角2θ在约14.0°、17.4°和21.4°有最强三个特征吸收峰,晶型Ⅳ的X射线粉末衍射图的反射角2θ在约4.9°、11.6°和15.6°有最强三个特征吸收峰。本发明人在研究替格瑞洛晶型的过程中,发现还存在不同于上述四种晶型中任何一种的新晶型S,它是不含水和其它溶剂的结晶形态,具有良好的稳定性,适合制备药物制剂和长期贮存。
技术实现要素:
本发明提供了替格瑞洛一种新的晶型S以及该晶型的制备方法,并进一步提供了该晶体在相关药物组合、特别是用于治疗急性冠脉综合症中的应用。
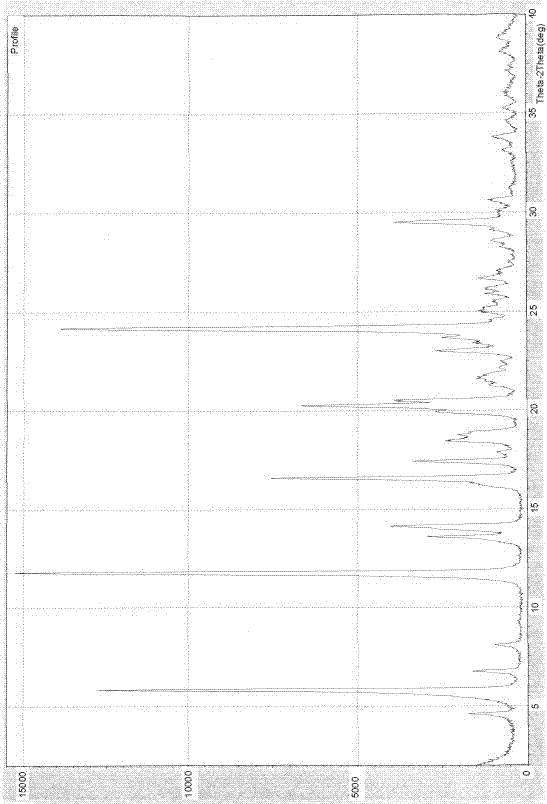
本发明提供的替格瑞洛晶型S,其X射线粉末衍射图的反射角2θ在约4.5°(±0.1°),5.8°(±0.1°),6.7(±0.1°),8.0°(±0.1°),11.7°(±0.1°),13.5°(±0.1°),13.0°(±0.1°),14.1°(±0.1°),16.65(±0.1°),17.4°(±0.1°),18.4°(±0.1°),18.7°(±0.1°),19.9°(±0.1°),和,29.4°(±0.1°)处有特征吸收峰,其中在约11.7°(±0.1°),24.1°(±0.1°)和5.8°(±0.1°)处为三个最强吸收峰。
本发明提供的替格瑞洛晶型S,其红外光谱图中在约3394cm-1,3288cm-1,2929cm-1,1656cm-1,1630cm-1,1521cm-1,1322m-1,1273cm-1,1091cm-1和 766cm-1处有特征吸收峰。
进一步实验表明,该晶型的药物组合具有良好的溶出度,每个制剂单元中包含60mg、90mg或120mg该晶体,在1000mlpH7.2的磷酸缓冲液中5min的溶出率≥70%、30min的溶出率≥96%。
本发明中,替格瑞洛晶型S的制备,是在氮气保护下,室温条件下将替格瑞洛溶于质量体积比(克/毫升)为1:2~1:5的DMF中,溶清后滴加质量体积比(克/毫升)为1:4~1:10的乙腈,-20~0℃搅拌析晶2~6h,得到该新晶型S。具体来讲,替格瑞洛与DMF的质量体积比以1:4为最佳,替格瑞洛与乙腈的质量体积比以1:8为最佳,搅拌析晶的温度以-5℃以下为最佳,析晶时间以4h为最佳。实验结果显示,该晶型S的熔点为139~143℃,所得到的产品最大单杂<0.1%,总杂<0.3%。
以有效治疗剂量的上述替格瑞洛晶型S为药物有效成分,与药学中可以接受的辅料形成药物制剂,如粘合剂(羟丙基甲基纤维素、轻丙基纤维素、聚乙烯毗咯烷酮、淀粉浆、聚乙烯醇、微晶纤维素、水、乙醇-水溶液等中的至少一种)、填充剂(微晶纤维素、乳糖、木糖醇、淀粉、预胶化淀粉、玉米淀粉、甘露醇、山梨醇等中的至少一种)、稀释剂、压片剂、润滑剂(硬脂酸镁、硬脂酸钙、硬脂酞胺、棕桐酸、硅酸铝、硬脂酸、滑石粉等中的至少一种)、崩解剂(低取代轻丙基纤维素、交联聚乙烯毗咯烷酮、聚乙烯毗咯烷酮、淀粉、微晶纤维素、羧甲基纤维素钠等中的至少一种)、着色剂、调味剂、稳定剂等,按照相应剂型的加工制造方式即可以制备成可供临床使用的相应药物制剂,特别是不同形式的口服制剂药物,如常用的素片或糖衣包片等片剂(包括缓释片、口含片、口腔崩解片、咀嚼片、泡腾片、分散片、控缓释片等),胶囊,颗粒等制剂形式。
上述所说的有效剂量为50mg~200mg/天,优选90~150mg/天。实验结果显示,以上述替格瑞洛晶型S为有效成分,每个药物单元中含有60mg、90mg或120mg的药物制剂,都具有良好的溶出度,在1000mlpH7.2的磷酸缓冲液中5min的溶出率≥70%、30min的溶出率≥96%。
稳定性实验结果显示,替格瑞洛晶型S所制备的药物片剂分别在高温(40℃/60℃)、高湿(75%/90%)、光照(4500lx±500lx)条件下放置10天,以及在温度(25℃)/湿度(60%)条件下放置6个月,有关物质测定结果与放置前测定结果基本一致,说明本品有关物质在高温、高湿、光照以及长期放置条件下稳定。
以下结合附图及实施例的具体实施方式,进一步对本发明进行说明,但不应理解为本发明只限于实施例范围之内。在本发明的基础上,使用普通技术进行的改造和变更,都属于本发明保护的范围内。
附图说明
附图1:替格瑞洛晶型S X-射线粉末衍射图
附图2:替格瑞洛晶型S X-射线粉末衍射的反射角2θ数据列表
附图3:替格瑞洛晶型S红外吸收光谱图。
具体实施方式
实施例一
氮气保护下,于1000ml三口瓶中加入50g替格瑞洛粗品,200mlDMF,室温下,机械搅拌至固体完全溶清,然后滴加400ml乙腈,边滴加边搅拌,机械搅拌转速≥80r/min。滴毕,降温至-5℃,机械搅拌转速控制在30~50r/min之间,搅拌析晶4h,抽滤,滤饼用50ml预冷至0℃的乙腈洗涤,40℃减压干燥6h,可得到替格瑞洛晶型S,最大单杂<0.1%,总杂<0.3%。
实施例二
氮气保护下,于500ml三口瓶中加入20g替格瑞洛粗品,80mlDMF,室温下,磁力搅拌至固体完全溶清,然后滴加160ml乙腈,边滴加边搅拌,磁力搅拌转速≥60r/min。滴毕,降温至-5℃,磁力搅拌转速控制在30r/min以下,搅拌析晶4~6h,抽滤,滤饼用30ml预冷至0℃的乙腈洗涤,40℃减压干燥6h,可得到替格瑞洛晶型S,最大单杂<0.1%,总杂<0.3%。
实施例三
氮气保护下,于1000ml三口瓶中加入50g替格瑞洛粗品,200mlDMF,室温下,机械搅拌至固体完全溶清,然后滴加400ml乙腈,边滴加边搅拌,机械搅拌转速≥80r/min。滴毕,加入少许替格瑞洛晶型S晶种,机械搅拌转速控制在30~50r/min之间,降温至-5℃,搅拌析晶4h,抽滤,滤饼用50ml预冷至0℃的乙腈洗涤,40℃减压干燥6h,可得到替格瑞洛晶型S,最大单杂<0.1%,总杂<0.3%。
实施例四
氮气保护下,于500ml三口瓶中加入20g替格瑞洛粗品,80mlDMF,室温下,磁力搅拌至固体完全溶清,然后滴加160ml乙腈,边滴加边搅拌,磁力搅拌转速≥60r/min。滴毕,加入少许替格瑞洛晶型S晶种,磁力搅拌转速控制在30r/min以下,降温至-5℃,搅拌析晶4~6h,抽滤,滤饼用30ml预冷至0℃的乙腈洗涤,40℃减压干燥6h,可得到替格瑞洛晶型S,最大单杂<0.1%,总杂<0.3%。
实施例五
替格瑞洛S晶片剂(规格:90mg)
按下述方法制备每片含90mg替格瑞洛片剂:
处方:替格瑞洛S晶型90g,羧甲基淀粉钠105.5g,聚乙烯吡咯烷酮15.5g,硬脂酸镁2.8g,制成1000片;
制备方法:将替格瑞洛S晶型、羧甲基淀粉钠、聚乙烯吡咯烷酮和硬脂酸镁分别过80目,混合均匀,压片,制成1000片,每片含替格瑞洛90mg。
实施例六
替格瑞洛S晶胶囊(规格:120mg)
按下述方法制备每粒含120mg替格瑞洛胶囊:
处方:替格瑞洛S晶120g,预胶化淀粉100g,羧甲基淀粉钠45g,丁二醇2.5ml,制成1000粒;
制备方法:将替格瑞洛S晶、预胶化淀粉、羧甲基淀粉钠混合均匀,用2.5ml10 %丁二醇水溶液润湿,挤压通过16目筛制成湿颗粒,置50℃通风干燥4小时,干颗粒通过16目筛,整粒,加压条件加进行胶囊填充。
实施例七
溶出速率测定:分别取不同批次替格瑞洛上述片剂8片,按照中国药典2005年版二部附录X C第一法中的溶出度测定法,以pH 7.2磷酸盐缓冲溶液(0.2mol/L磷酸二氢钾试液50ml与0.2mol/氢氧化钠溶液35ml,加水至200ml)1000ml为溶出介质,转速50转/min,分别于5min、10min、15min、20min、25min、30min取溶出液5ml(每次取液后用同种溶出介质补足总量),滤过,精密量取续滤液2ml,加溶出液稀释至25ml,作为样品溶液。各时间段内替格瑞洛的溶出度(w%)试验结果如下所示:
实施例八
稳定性试验:取上述片剂6片,分为6组,测试样品在不同温度、湿度、光照强度和长时间放置后有关物质的含量,测试结果如下:
实验结果显示,该药物片剂分别在高温(40℃/60℃)、高湿(75%/90%)、光照(4500lx±500lx)条件下放置10天,以及在温度(25℃)/湿度(60%)条件下放置6个月,有关物质测定结果与放置前测定结果基本一致,说明本品有关物质在高温、高湿、光照以及长期放置条件下较为稳定。
- 还没有人留言评论。精彩留言会获得点赞!