一种能够用两种荧光颜色清楚区分和同时成像细胞膜脂筏与非脂筏微区的探针及其应用的制作方法
本发明涉及一种荧光探针,尤其涉及一种能够以两种荧光颜色清楚区分和同时成像细胞膜脂筏和非脂筏微区的单一荧光探针及其在标记活细胞细胞膜上的脂筏和非脂筏微区中的应用。
背景技术:
细胞膜的亚微结构近年来引起了人们广泛的关注。鞘磷脂等含有饱和脂肪酸侧链的磷脂和胆固醇一起可以形成致密排列的脂筏微区,而含有不饱和侧链的磷脂可以形成疏松排布的非脂筏微区。研究表明,脂筏微区与蛋白质团簇形成,信号转导,细胞凋亡以及病毒侵入过程密切相关。另一方面,非脂筏微区,由于其疏松的排布结构,在保持胆固醇平衡和细胞融合过程中起着重要的作用。两种微区含量的失衡会直接导致诸多疾病,例如非脂筏微区的增多会增加动脉硬化等疾病的风险。因此,实时原位的观测两种微区在生理学和病理学研究中具有重要的价值。
荧光成像方法是对生物体系靶标进行原位观测的最优方法。搭配以合适的荧光探针,荧光成像方法可以完成对活细胞内靶标的实时原位观测,且操作简便。然而,目前能够同时双色成像细胞膜中脂筏和非脂筏微区的荧光探针紧缺,且目前的探针具有明显缺点。Laurdan及其衍生物是目前最常用来研究脂筏和非脂筏微区的荧光探针。它能够染色低极性的脂筏微区并呈现蓝色荧光(440nm),同时染色高极性的非脂筏微区并呈现绿色荧光(490nm)。然而laurdan具有明显的缺点:首先两种荧光波长差异较小,仅为50nm,这使其很难在细胞膜上清晰的区分两种微区;其次是它会很快内在化进入细胞,这也严重限制了它在成像研究中的应用。因此,开发能够以较大荧光波长差异区分两种微区,能够清楚区分和同时成像的细胞膜上脂筏和非脂筏微区的荧光探针需求迫切且势在必行。
技术实现要素:
针对现有技术的不足,本发明要解决的问题是提供一种可以实时原位以两种荧光颜色清楚区分和同时成像细胞膜脂筏微区和非脂筏微区的单一荧光探针及其在标记活细胞细胞膜上的脂筏和非脂筏微区中的应用。
本发明所述可以实时原位以两种荧光颜色清楚区分和同时成像细胞膜脂筏微区和非脂筏微区的单一荧光探针,其特征在于:所述荧光探针是式(I)所述结构的化合物:
其中,上述R1表示2-乙氧乙基、氨烷基、羟烷基或烷基;R2或R3表示烷基。
上述用于双色成像细胞膜脂筏和非脂筏的荧光探针中:所述R1优选表示2-乙氧乙基、氨烷基、羟烷基或C1-12烷基。所述R2和R3表示C10-20烷基。
上述用于双色成像细胞膜脂筏和非脂筏的荧光探针中:所述R1最优选2-乙氧乙基,R2和R3最优选C12烷基,最优选的荧光探针是2,7-二(N-(1’-十二烷基)吡啶碘盐乙烯基)-N-乙氧乙基-咔唑(2,7-9E-BHVC12)。
上述荧光探针即式(I)所述结构化合物的制备方法概述如下:
首先是对二溴联苯硝基化生成4,4-二溴-2-硝基联苯;然后4,4-二溴-2-硝基联苯扣环得到2,7-二溴咔唑;2,7-二溴咔唑与碘代的氨基烷、羟基烷或烷烃在强碱催化下反应得到N-取代的2,7-二溴咔唑;接下来,N-取代的2,7-二溴咔唑与四乙烯基吡啶通过Heck反应可生成2,7-二吡啶乙烯基-N-取代咔唑;最后其与碘代烷烃加成反应即可得到终产物。
具体的,上述2,7-二(N-(1’-十二烷基)吡啶碘盐乙烯基)-N-乙氧乙基-咔唑(2,7-9E-BHVC12)的制备反应式如下:
2,7-9E-BHVC12的合成路线
本发明所述荧光探针在实时原位以红绿两种荧光颜色标记活细胞细胞膜上的脂筏和非脂筏微区中的应用。
其中:所述活细胞为宫颈癌细胞(HeLa)、宫颈鳞癌细胞(SiHa)或前列腺癌细胞(pc-3)细胞。
实验结果证实,本发明所述双色荧光探针在致密的脂筏微区诱导下能够在其表面形成聚集体,并发出深红色荧光(650nm),同时该探针能够嵌入疏松的非脂筏微区形成单体状态,并发出绿色荧光(540nm)。
本发明对所述荧光探针在细胞上的选择性经过了严格的证明。首先通过与商业化的脂筏染料进行复染实验,高的复染率(85%)证实了深红色荧光来自于细胞膜上的脂筏微区。另外,用MβCD处理细胞,消除细胞膜上脂筏微区后,细胞染色结果为绿光微区明显增多,红光微区明显减少,再次证明了本发明所述探针能够以红光标记脂筏微区,同时以绿光标记非脂筏微区。
本发明的有益结果是:与目前常用的商业化同类染料laurdan相比,本发明所述荧光探针具有明显的优势。首先在脂筏微区和非脂筏微区探针的荧光发射波长差异较大(110nm),是laurdan的两倍以上,这使得本发明所述探针能够清楚地区分两种微区。另外相比于laurdan容易内在化的染色结果,本发明所述探针内在化问题较小,使其在实用中操作更加方便,且得到的结果更加可靠。另外探针的毒性低,生物相容性好。由于成像细胞膜亚微结构的重要意义,以及目前探针欠缺的形势,本发明所述探针应具有广阔的商业化前景。
附图说明
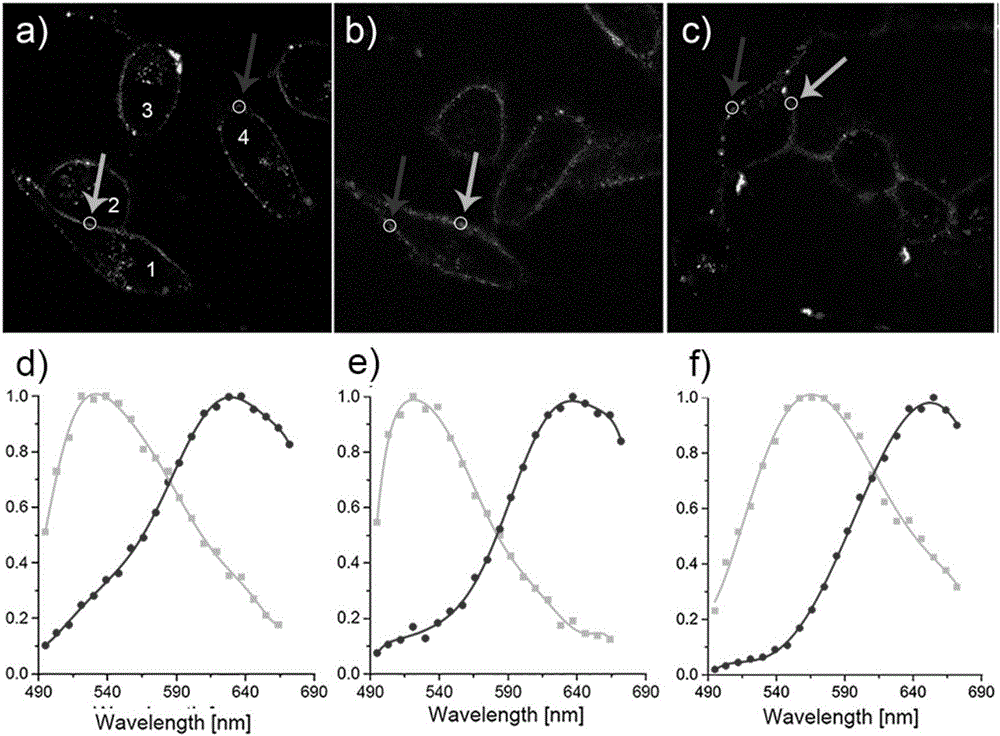
图1:用4μM的2,7-9E-BHVC12染色HeLa,SiHa以及pc-3细胞(a-c),得到的实彩成像图片,以及两种微区原位的荧光光谱(d-f)。其中d-f中以红色和绿色标记的荧光光谱是在a-c图片中红色和绿色箭头所指圆形区域内采集得到的。激发波长为488nm,红色微区为脂筏微区,绿色微区为非脂筏微区。
图2:用4μM的2,7-9E-BHVC12以及1mg/mL的商业化脂筏探针CT-B591共同染色HeLa(a-c),SiHa(d-f)和pc-3(g-i)得到的荧光成像图片。其中a,d,g的激发波长为488nm,荧光收集波长为650-700nm;b,e,h的激发波长为561nm,荧光收集波长为600-650nm;c,f,i为前两者的叠加图片。共定位率为85%。
图3:用4μM的2,7-9E-BHVC12染色HeLa,SiHa以及pc-3细胞,得到的实彩成像图片。其中a-c为未处理普通细胞的染色结果,d-f为用5mM的MβCD处理细胞1小时,消除脂筏微区后的染色结果。显然,消去脂筏微区后细胞绿光区域明显增多。
图4:用4μM的2,7-9E-BHVC12染色HeLa细胞2小时、12小时和24小时后细胞的存活率。染色24小时后细胞存活率仍高达95%,说明探针的毒性很低。
具体实施方式
实施例1
4,4-二溴-2-硝基联苯(1)的合成
将10g对二溴联苯溶解到120mL冰醋酸中,然后将溶液搅拌并加热到100℃。加入40mL发烟硝酸,体系反应30分钟。反应完成后,将溶液冷却至室温,,过滤可得粗产物。用乙醇重结晶可得纯净产物,产率91%。
1H NMR(300MHz,CDCl3),δ(ppm):8.03(d,J=1.8Hz,1H),7.76(dd,J1=8.1Hz,J2=1.8Hz,1H),7.54–7.59(m,2H),7.31(s,1H),7.14–7.18(m,2H)。
2,7-二溴咔唑(2)的合成
将7.8g化合物1溶解到30mL亚磷酸三乙酯中并搅拌均匀。在氮气的保护下将上述体系加热到150℃,反应24小时。减压蒸馏整掉多余的溶剂后,剩余物用柱色谱分离提纯。最终得到一种白色固体为纯净产物,产率为48%。
1H NMR(300MHz,DMSO-d6),δ(ppm):10.64(s,1H),8.09(d,J=8.4Hz,2H),7.75(d,J=1.8Hz,2H),7.37(dd,J1=8.4Hz,J2=1.8Hz,2H)。
2,7-二溴-N-乙氧乙基咔唑(3)的合成
把3g氢氧化钾固体加入到250mL烧瓶中,然后加入30mL的DMF并搅拌均匀。上述体系搅拌10分钟后,将2g化合物2加入其中,然后搅拌体系30分钟。随后,加入1.38mL的2-溴乙基乙醚,室温下反应18小时。反应完成后,将上述体系倒入400mL水中,并用400mL的二氯甲烷萃取。有机层用4g无水硫酸镁干燥后蒸去溶剂,得到白色产物,产率81%。
1H NMR(400MHz,DMSO-d6):δ(ppm)8.12(d,J=11.2,2H),7.91(s,2H),7.36(dd,J1=11.2,J2=2,2H),4.57(t,J=6.80,2H),3.70(t,J=7.00,2H),3.53(q,J=8.80,2H),0.95(t,J=9.40,3H)。
2,7-二吡啶乙烯基-N-乙氧乙基咔唑(4)的合成
将1g化合物3、0.0283g醋酸钯和0.115g三(邻甲苯基)膦加入到三口烧瓶中。然后加入20mL的DMF并将体系搅拌5分钟。搅拌条件下,加入5mL的三乙胺和1.08mL的4-乙烯基吡啶,在氮气保护下室温搅拌上述体系30分钟。然后再氮气保护下将上述体系加热至95℃反应48小时以完成反应。反应完毕后,将反应体系冷却至室温,并倒入400mL水中。随后,用400mL二氯甲烷分两次萃取产物,萃取液合并后用水洗涤三次,加入4g无水硫酸镁干燥。干燥完毕后,蒸去溶剂,用柱色谱法提纯产物,最终得到黄色粉末为纯净产物,产率为51%。
1H NMR(400MHz,DMSO-d6):δ(ppm)8.57(d,J=8.00,4H),8.17(d,J=10.8,2H),7.94(s,2H),7.78(s,2H),7.72(s,2H),7.58(dd,J1=20.4,J2=9.6,4H),7.43(s,2H),7.37(s,2H),4.64(t,J=7.00,2H),3.82(t,J=7.20,2H),3.43(q,J=9.20,2H),3.34(s,2H),1.00(t,J=9.20,3H)。
2,7-二(N-(1’-十二烷基)吡啶碘盐乙烯基)-N-乙氧乙基-咔唑(2,7-9E-BHVC12)的合成
将0.2g化合物4加入三口瓶中,倒入20mL乙醇,搅拌均匀。然后加入0.55mL的碘十二烷,室温下将上述体系搅拌10分钟,然后加热至80℃使乙醇回流。持续加热回流36小时以完成上述反应,然后将反应体系冷却至室温。有红色粉末状固体析出,过滤后用冷的乙醇洗涤3次可得粗产物。将粗产物在乙醇中重结晶得纯净产物,为红色粉末状固体,产率为63%。
1H NMR(400MHz,DMSO-d6):δ(ppm)8.98(d,J=6.6,4H),8.28(q,J=11.23,8H),8.08(s,2H),7.69(dd,J1=12.06,J2=8.34,4H),4.68(s,2H),4.51(t,J=7.14,4H),3.85(t,J=8.48,2H),3.42(q,J=6.95,2H),1.93(s,4H),1.30(s,8H),1.24(s,28H),0.98(t,J=6.96,3H),0.85(t,J=6.68,6H).13C NMR(400MHz,DMSO-d6),δ(ppm)=152.90,144.12,141.95,141.54,133.44,123.58,123.53,122.76,121.18,119.53,109.96,67.96,65.69,59.63,31.18,30.39,28.89,28.78,28.66,28.57,28.27,25.33,21.97,14.88,13.83.HRMS(m/z):[M]2+calcd.for C54H77N3,391.8028;found,391.7864。
实施例2
SiHa、HeLa和pc-3细胞的培养
所有的细胞株都是在37℃,5%CO2的饱和湿度孵箱中培养。SiHa和HeLa细胞株贴壁培养于内含10%胎牛血清H-DMEM培养液中(含1%双抗)。而pc-3细胞株贴壁培养于内含10%胎牛血清1640培养液中。待细胞生长到对数期,接片培养:①将盖玻片于无水乙醇中浸泡30min,酒精灯烘干后放入一次性35mm培养皿中;②将100mL细胞瓶中的细胞用PBS洗三遍,用1mL0.25%胰酶消化3-5min,小心地倒出培养基,加入少量新鲜培养基吹打均匀,细胞计数后,留下合适密度的细胞,将培养基加至所需体积(控制细胞终浓度为1×104),接种至内含盖玻片的培养皿中,放入CO2培养箱中培养,使细胞爬片生长。
实施例3
2,7-9E-BHVC12染色SiHa、HeLa和pc-3细胞以及实彩成像
首先将探针2,7-9E-BHVC12配制成5mM浓度的DMSO母液,染色实验时,取出上述母液4μL加入1mL的PBS缓冲液中,摇晃均匀做染色液。将接种好的细胞爬片用PBS洗三遍,然后放入染色液中染色,在CO2培养箱中染色20min。吸出染色液,并用PBS冲洗染色后的细胞爬片三遍,细胞生长面朝下盖在载玻片上,在激光扫描共聚焦荧光显微镜进行成像观察。实彩荧光图片是通过蔡司共聚焦显微镜LSM780的Lambda光谱成像模块获得的。该模块用488nm激光做光源激发,并以8.7nm为间隔分多个通道收集490-690范围内的荧光,最终给每个通道按波长赋予相对应的色彩并叠加得到实彩成像图片。得到的实彩成像图片中,红色部分为脂筏微区,绿色部分为非脂筏微区。
结果见图1。
图1:用4μM的2,7-9E-BHVC12染色HeLa,SiHa以及pc-3细胞(a-c),得到的实彩成像图片,以及两种微区原位的荧光光谱(d-f)。其中d-f中以红色和绿色标记的荧光光谱是在a-c图片中红色和绿色箭头所指圆形区域内采集得到的。激发波长为488nm,红色微区为脂筏微区,绿色微区为非脂筏微区。
实施例4
2,7-9E-BHVC12与商业化脂筏探针CT-B591的共定位分析实验
首先将探针2,7-9E-BHVC12配制成5mM浓度的DMSO母液,染色实验时,取出上述母液4μL加入1mL的PBS缓冲液中,摇晃均匀做染色液。将接种好的细胞爬片用PBS洗三遍,然后放入染色液中染色,在CO2培养箱中染色20min。然后加入1mg/mL的CT-B591探针染色5min,吸出染色液,并用PBS冲洗染色后的细胞爬片三遍,细胞生长面朝下盖在载玻片上,在激光扫描共聚焦荧光显微镜进行成像观察。2,7-9E-BHVC12的荧光是用488nm激光做光源激发,荧光采集波段为650-700nm;CT-B591的荧光是用561nm的激光做光源激发,荧光采集波段为600-650nm。共定位成像结果表明,定位率达85%,说明了2,7-9E-BHVC12的红色荧光来自脂筏微区。
结果见图2。
图2:用4μM的2,7-9E-BHVC12以及1mg/mL的商业化脂筏探针CT-B591共同染色HeLa(a-c),SiHa(d-f)和pc-3(g-i)得到的荧光成像图片。其中a,d,g的激发波长为488nm,荧光收集波长为650-700nm;b,e,h的激发波长为561nm,荧光收集波长为600-650nm;c,f,i为前两者的叠加图片。共定位率为85%。
实施例5
2,7-9E-BHVC12染色MβCD处理的细胞结果及其对照实验
首先将探针2,7-9E-BHVC12配制成5mM浓度的DMSO母液,染色实验时,取出上述母液4μL加入1mL的PBS缓冲液中,摇晃均匀做染色液。将接种好的细胞爬片用PBS洗三遍,然后加入5mM的MβCD在CO2培养箱中处理60min。用PBS洗涤细胞爬片3遍以除去MβCD,然后将爬片放入染色液中染色,在CO2培养箱中染色20min。吸出染色液,并用PBS冲洗染色后的细胞爬片三遍,细胞生长面朝下盖在载玻片上,在激光扫描共聚焦荧光显微镜进行成像观察。对照组没有经过MβCD处理,其它染色条件相同。
结果见图3。
图3:用4μM的2,7-9E-BHVC12染色HeLa,SiHa以及pc-3细胞,得到的实彩成像图片。其中a-c为未处理普通细胞的染色结果,d-f为用5mM的MβCD处理细胞1小时,消除脂筏微区后的染色结果。显然,消除脂筏微区后细胞绿光区域明显增多。
实施例6
2,7-9E-BHVC12的毒性测试
将细胞密度为8000个/mL的HeLa细胞接种到96孔板的部分孔内,剩余孔则用无细胞的培养基填充,并在不同的条件下在CO2培养箱中孵育细胞。实验组为用含4μM的2,7-9E-BHVC12的培养基孵育2小时、12小时和24小时后的细胞样品,对照组为不加染料的含细胞样品,空白组为无细胞的培养基样品。待孵育完成后,用新鲜的培养基换掉细胞培养液,并在每个培养孔中加入10μL的CCK-8,再孵育细胞40分钟。使用酶标仪测试每个孔在450nm处的吸光度,细胞存活率可通过下述公式计算得到:
其中,Asample为实验组吸光度,Ac为对照组吸光度,Ab为空白组的吸光度。染色24小时后细胞存活率仍高达95%,说明探针的毒性很低。
结果见图4。
图4:用4μM的2,7-9E-BHVC12染色HeLa细胞2小时、12小时和24小时后细胞的存活率。
- 还没有人留言评论。精彩留言会获得点赞!