一种同时抵抗细胞衰老及恶性转化的人多能干细胞的制备方法与流程
本发明属于生物技术领域,涉及一种同时抵抗细胞衰老及恶性转化的人多能干细胞的制备方法。
背景技术:
细胞移植治疗是近年来再生医学领域最具前景和潜力的发展方向。细胞移植旨在补充或替代体内因疾病或衰老等因素导致的本已耗竭或失去正常功能的细胞,移植的细胞在体内存活并发挥正常功能,恢复组织内稳态,进而实现组织修复和再生。尽管细胞移植治疗已经在诸如骨髓干细胞移植治疗白血病等方面表达出极佳的治疗效果,但其更广泛的应用仍面临许多问题的挑战。目前,限制细胞移植治疗的主要因素集中在有效性和安全性两方面。
细胞移植治疗的有效性主要体现在移植物移植前的质量及进入体内后能否存活整合并发挥再生功能。一方面,移植物在体外培养过程中存在一定的“寿命”,具体表现为持续受到复制压力影响,有限的连续传代后迅速进入细胞老化(cellular senescence)状态,停止增殖且失去功能。另一方面,细胞移植的部位普遍位于疾病或衰老的组织微环境中,其中的炎性因子、有害代谢产物等会损害外源移植物。以上两方面都会导致细胞发生严重的功能性衰退,导致移植效率低下。细胞移植治疗的安全性主要集中在长期移植后的致瘤风险。细胞移植物在病体中持续受到压力胁迫,基因组可能变得极不稳定,若在癌基因或抑癌基因上发生突变,可能演变为癌症,形成安全隐患。
如何通过特定的干预手段提高细胞移植治疗的效率,尽可能的降低致瘤风险一直以来都是再生医学能够广泛应用的决定性问题。然而,迄今为止尚未发展出简单有效的方法克服这一技术瓶颈。当前提高细胞移植效果的尝试主要集中在改善移植部位微环境和增强移植物“抗逆”特性两方面。许多研究通过在不利细胞发挥正常功能的病体微环境中补充外源“营养及保护因子”的方式来改善移植效果,但该方法仅能在短期内改善移植环境,移植复发等不良预后问题突出。与此相比,通过特定方法改善移植物的“内因”,即增强移植材料自身固有的抵抗逆境能力来实现移植效果的改善是更为直接和长效的手段。目前已有少数研究表明可以利用慢病毒或逆转录病毒载体导入抗逆相关蛋白,调控细胞内特定的信号通路或基因表达,增强细胞对逆境的抵抗,进而实现细胞移植治疗效果的提升。尽管一系列临床前研究证明了提高细胞固有抗逆特性的可行性,但整合型病毒载体介导的基因调控必然存在基因组的随机整合,基因突变风险加大,安全性堪忧,这大大削弱了其在临床上的应用价值。
基因靶向编辑技术的发展极大的推动了细胞移植治疗的进步。这一技术使得人们可以精确的编辑基因组上的遗传密码,目前已有大量利用基因靶向编辑技术矫正疾病细胞致病突变的案例被报道。恢复正常功能的基因矫正细胞经体外扩增可以用于自体移植,是细胞移植治疗中绝佳的材料。
技术实现要素:
本发明的一个目的是提供一种同时抵抗细胞衰老及恶性转化的NRF2基因增强型的间充质干细胞的制备方法。
本发明提供的间充质干细胞的制备方法包括如下步骤:
(1)将离体的人多能干细胞中的NRF2蛋白的第82位的谷氨酸突变为甘氨酸,得到NRF2基因增强型的多能干细胞;
(2)对所述NRF2基因增强型的多能干细胞进行定向诱导分化,获得NRF2基因增强型的间充质干细胞。
上述方法中,步骤(1)中,所述将离体的人多能干细胞中的NRF2蛋白的第82 位的谷氨酸突变为甘氨酸的方法为将NRF2基因的第245位的碱基A突变为碱基G;所述NRF2基因的第245位为NRF2基因编码区的第245位。
上述方法中,所述将NRF2基因的第245位的碱基A突变为碱基G的方法为基因组定点编辑;
所述基因组定点编辑的方法可为ZFN编辑、TALEN编辑、CRISPR/Cas9编辑或 HdADV介导的定点编辑;所述基因组定点编辑的方法具体为HdADV介导的定点编辑。
在本发明的实施例中,所述HdADV介导的定点编辑可通过如下方法实现:
第一步、突变片段的获得
将人类基因组NRF2基因第1和2号内含子(intron1-exon2-intron2)的基因片段中对应NRF2基因的cDNA序列的第245位的核苷酸位点,由野生型的碱基A突变为碱基G,且保持其他序列不变,得到突变后的片段;
第二步、病毒表达质粒的构建
将所述突变后的片段插入pCIHDAdGT8-4载体的AscI和SpeI酶切位点中,得到重组质粒。
第三步、病毒表达质粒与辅助质粒共转染包装细胞获得重组腺病毒颗粒
用PI-SceI(NEB)酶切所述重组质粒,得到线性化质粒,并将所述线性化质粒同辅助病毒AdHPBGF35共同导入包装细胞中进行重组腺病毒包装,得到重组腺病毒颗粒;所述包装细胞具体为人胚胎肾细胞293系的衍生细胞系116细胞;
第四步、重组腺病毒颗粒感染目的细胞
用重组腺病毒颗粒感染人多能干细胞,经过筛选,得到一个NRF2等位基因上位点正确编辑的细胞,将其记作NRF2AG/+ hESC细胞;
第五步、将所述线性化质粒和所述辅助病毒AdHPBGF35共同导入所述NRF2AG/+hESC 细胞中再次进行基因编辑,并对编辑后细胞进行鉴定,获得两个NRF2等位基因上位点正确编辑的细胞,即为NRF2基因增强型的多能干细胞。
上述方法中,步骤(2)中,所述定向诱导分化的方法包括如下步骤:
(b1)将NRF2基因增强型的多能干细胞进行拟胚体分化,获得拟胚体;
(b2)培养所述拟胚体至纤维状细胞出现;再经过传代培养,分选其中CD73、CD90、 CD105均为阳性的细胞类群,即为所述NRF2基因增强型的间充质干细胞。
上述方法中,所述拟胚体分化的具体方法如下:准备含有300-500个细胞、大小均一的NRF2AG/AG hESC克隆,用室温PBS清洗一次,再用Dispase 37℃消化20-30min。待ESC克隆形成球体后,用CDF12培养基重悬,然后加到低粘附培养板(Corning公司,货号3471)中,37℃,5%CO2条件培养1-3天后即形成拟胚体。
培养所述拟胚体至纤维状细胞出现的具体方法如下:将所述拟胚体接种于基质胶包被的6孔板中进行培养,继续培养2周至纤维状细胞出现。
上述方法中,所述人多能干细胞为人胚胎干细胞H9细胞系或人诱导多能干细胞。
本发明的另一个目的是提供利用上述方法制备获得的NRF2基因增强型的间充质干细胞。
利用上述方法制备获得的NRF2基因增强型的多能干细胞也属于本发明的保护范围。
本发明还有一个目的是提供上述NRF2基因增强型的间充质干细胞或上述NRF2基因增强型的多能干细胞的新用途。
本发明提供了上述NRF2基因增强型的间充质干细胞或上述NRF2基因增强型的多能干细胞在如下c1)-c5)中任一种中的应用:
c1)制备抵抗和/或延缓细胞衰老的产品;
c2)制备抵抗肿瘤发生的产品;
c3)制备抵抗恶性成瘤转化的产品;
c4)制备细胞移植治疗的产品;
c5)制备再生和/或修复损伤血管的产品。
本发明最后一个目的提供一种产品。
本发明提供的产品的活性成分为上述NRF2基因增强型的间充质干细胞;
所述产品的功能为如下m1)-m5)中任一种:
m1)抵抗和/或延缓细胞衰老;
m2)抵抗肿瘤发生;
m3)抵抗恶性成瘤转化;
m4)细胞移植治疗;
m5)损伤血管的再生和/或修复。
上述应用或上述产品中,
所述抵抗和/或延缓细胞衰老体现在如下d1)-d6)中任一种:
d1)在外源刺激物刺激下细胞活力增强;
d2)在体外连续传代培养过程中表现更强的增殖能力;
d3)清除有害代谢物的能力增强;
d4)与细胞衰老相关基因的表达水平降低;
d5)具有更完整的细胞核结构;
d6)在人或动物体内存留时间更长;
所述抵抗恶性成瘤转化体现在如下e1)-e3)中的任一种:
e1)瘤化细胞增殖能力降低;
e2)与肿瘤形成相关的非锚定依赖的生长能力降低;
e3)在体内形成肿瘤的能力降低;
所述细胞移植治疗为细胞移植修复治疗。
本发明首次利用基因编辑技术成功改造抗逆相关基因,仅单一编码位点修饰便实现内源抗逆基因可控的主动激活,获得了抗逆特性提高的基因增强型干细胞,并通过体内体外实验证明了基因增强型干细胞能够抵抗逆境及细胞衰老,具有更佳的组织修复功能以及抵抗恶性成瘤转化的能力。本发明的方法同时解决了细胞移植治疗中有效性与安全性两大关键和瓶颈性难题。
附图说明
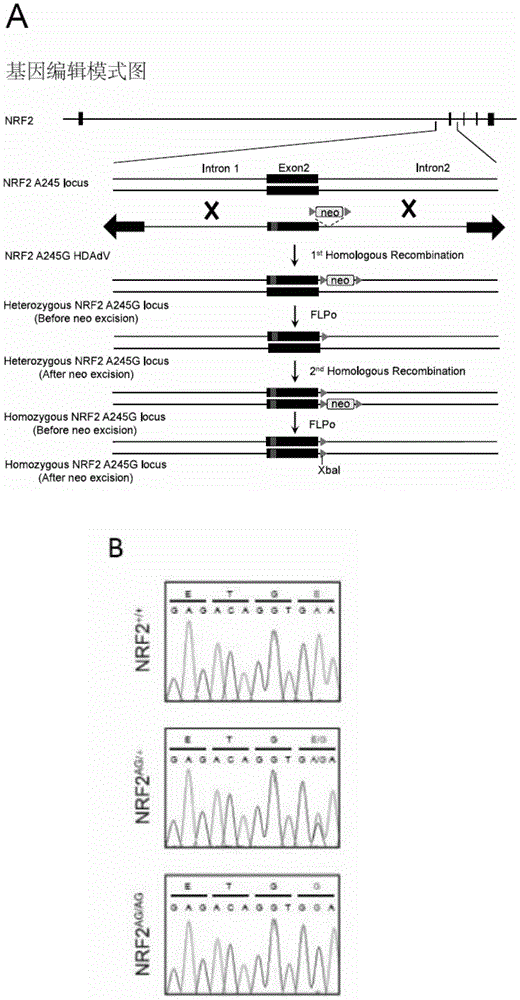
图1为本发明产生了抗逆基因NRF2单一位点编辑的多能干细胞,并由此衍生出基因增强型间充质干细胞,此细胞中的NRF2活性得到持续激活。其中,A为基因编辑的模式图;B为NRF2基因A245G位点的测序结果;C为获得的多能干细胞的形态及体内三胚层分化的免疫荧光鉴定;D为多能干细胞中干性基因的表达情况;E为分化得到的MSC中与MSC有关和无关的表面标记物鉴定情况;F为MSC中NRF2蛋白在细胞核内外的含量分析;G为NRF2下游靶基因的mRNA水平;H为NRF2及其关键下游靶基因NQO1 和HO-1的蛋白表达情况。
图2为基因增强型间充质干细胞抵抗逆境及细胞衰老的特性。其中,A为外源刺激物处理下细胞活力检测;B为MSC生长曲线;C为SA-β-Gal染色结果;D为活性氧含量检测;E为衰老相关标记物表达情况的结果;F为细胞增殖相关标记物Ki67的检测;G为核膜完整性检测。
图3为基因增强型间充质干细胞抵抗恶性转化的特性。其中,A为体外恶性转化模式图;B为恶性转化后MSC非锚定依赖的生长情况;C为恶性转化后MSC的体内成瘤能力;D为小鼠长瘤部分的横纵向切片染色鉴定。
图4为移植基因增强型间充质干细胞应用于后肢缺血模型血流恢复的实例。其中, A为MSC在肌肉微环境中的留存能力;B为每只后肢缺血小鼠血流恢复情况;C为不同时间点小鼠腿部的代表性图片。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的定量试验,均设置三次重复实验,结果取平均值。
1、下述实施例中的培养基配方如下:
(1)CDF12培养基配方:
DMEM/F12培养基(Invitrogen,11320-033);
0.1mM非必需氨基酸(Invitrogen,11140-050);
1mM GlutaMAX(Invitrogen,35050-061);
20%(体积百分含量)Knockout血清替代物(Invitrogen,N10828-028);
1%(1g/100ml)青霉素/链霉素(Invitrogen,15070-063);
55μM β-巯基乙醇(Invitrogen,21985-023);
10ng/ml人FGF2(Joint Protein Central)。
(2)间充质干细胞(MSC)培养基配方:
MEM培养基(Invitrogen,12571071);
10%(体积百分含量)胎牛血清(Invitrogen,10091148);
1%(1g/100ml)青霉素/链霉素(Invitrogen,15070-063);
10ng/ml重组人成纤维细胞生长因子(JPC,bFGF);
MSC分化培养基需额外添加5ng/ml TGFβ(Humanzyme,HZ1131)。
2、细胞系如下:
人胚胎干细胞H9细胞系是WiCell公司产品,货号:WA09(H9)-DL-7。
人胚胎肾细胞293T系购自ATCC,货号CRL-3216。
3、人胚胎干细胞H9细胞系培养方法如下:
(1)将H9细胞接种至预先培养了经过丝裂霉素(美国Sigma公司产品,货号: M0503)灭活的小鼠胚胎成纤维细胞(美国Invitrogen公司产品,货号:S1520-100) 的培养板中,使用人类胚胎干细胞培养基(CDF12培养基)与小鼠胚胎成纤维细胞共同培养;
(2)将H9细胞接种至预先用细胞外基质(qualified-Matrigel,美国BD Biosciences产品,货号:354277)包被的培养板中,使用mTeSR培养基(美国StemCell Technologies产品)培养。
4、病毒包装所用生物材料如下:
(1)重组腺病毒包装所用生物材料如下:
pCR2.1-TOPO载体为Invitrogen公司产品。
辅助腺病毒载体pCIHDAdGT8-4载体:详见“An HSV amplicon-based helper system for helper-dependent adenoviral vectors.Shuji Kubo,et al.BBRC.2003.307(4): 826-830”一文,公众可从原文作者或中国科学院生物物理研究所获得。
转染人胚胎肾细胞293系的衍生细胞系116细胞:详见“Improved system for helper-dependent adenoviral vector production.Palmer D.and Ng P.Molecular Therapy.2003.8(5):846-52.”一文,公众可从原文作者或中国科学院生物物理研究所获得。
辅助腺病毒AdHPBGF35:详见“Genome Size and Structure Determine Efficiency of Postinternalization Steps and Gene Transfer of Capsid-Modified Adenovirus Vectors in a Cell-Type-Specific Manner.Dmitry M.Shayakhmetov,et al.,Journal of Virology.2004.78(18):10009-10022.”一文,公众可从原文作者或中国科学院生物物理研究所获得。
(2)逆转录病毒包装所用生物材料如下:
逆转录病毒载体及包装质粒均购自Addgene,货号如下:pBABE-neo-hTERT(1774), pBABE-zeo-large T genomic(1778),pBABE-puro-HRAS V12(1768),gag/pol(14887), VSV-G(8454)。
(3)慢病毒包装所用生物材料如下:
过表达荧光素酶luciferase的慢病毒载体质粒:详见“SIRT6 safeguards human mesenchymal stem cells from oxidative stress by coactivating NRF2.Pan et.al,. Cell research.(2016)26:190-205.”一文,公众可从中国科学院生物物理研究所获得。
P53敲低的慢病毒载体质粒PLVTHM-shP53:详见“PTEN deficiency reprogrammes human neural stem cells towards a glioblastoma stem cell-like phenotype.Duan et.al,.Nature communication.(2015)10.1038.”一文,公众可从中国科学院生物物理研究所获得。
慢病毒包装质粒购自Addgene,货号如下:psPAX(12260),pMD2.G(12259)。
5、用于流式细胞术分选MSC的荧光标记抗体如下:
荧光素FITC标记的抗人细胞表面识别分子CD90抗体,BD BiosCiences,货号: 555595。
荧光素PE标记的抗人细胞表面识别分子CD73抗体,BD Biosciences,货号: 550257。
荧光素APC标记的抗人细胞表面识别分子CD105抗体,BD Biosciences,货号: 17-1057-42。
荧光素APC标记同型对照抗体,BD Biosciences,货号:555751。
荧光素PE标记同型对照抗体,BD Biosciences,货号:555749。
荧光素FITC标记同型对照抗体,BD Biosciences,货号:555742。
6、用于免疫荧光的抗体如下:
抗人FOXA2抗体,Cell Signaling Technology,货号:8186S。
抗人SMA抗体,中杉金桥,货号:ZM-0003。
抗人TUJ1抗体,Sigma,货号:T2200。
抗人LAP2抗体,BD Biosciences,货号:611000。
抗人Lamin B1抗体,Santa Cruz Biotechnology,货号:sc-6217。
抗人Ki 67抗体,Vector Laboratories,货号:VP-RM04。
抗人P16抗体,BD Biosciences,货号:550834。
抗人P21抗体,Cell Signaling Technology,货号:2947。
实施例1、抗逆基因NRF2靶向修饰的人类多能干细胞的制备
一、NRF2增强型多能干细胞的制备
本发明通过对多能干细胞(Pluripotent Stem Cell,PSC)中的人类抗逆基因NRF2 的单一位点进行靶向编辑,使NRF2基因(GeneBank ID:4780)的cDNA序列的第245 位由野生型的碱基A突变为碱基G,NRF2蛋白的氨基酸序列的第82位由谷氨酸(E) 变为甘氨酸(G),获得NRF2增强型多能干细胞。具体步骤如下(具体步骤参见图1A):
1、病毒表达质粒的构建
首先从RP11-483K11 BAC DNA文库(BACPAC Resources)中通过PCR扩增获得跨人类基因组NRF2基因第1和2号内含子(intron1-exon2-intron2)的基因片段。然后通过定点突变试剂盒(Invitrogen,货号:A13282)突变该片段上对应NRF2基因的 cDNA序列的第245位的核苷酸位点(A245G),由野生型的碱基A突变为碱基G,且保持其他序列不变,得到突变后的片段,并将突变后的片段插入pCIHDAdGT8-4载体的 AscI和SpeI酶切位点中,得到重组质粒。
2、病毒表达质粒与辅助质粒共转染包装细胞获得重组腺病毒颗粒
用PI-SceI(NEB)酶切步骤1获得的重组质粒,得到线性化质粒,并将该线性化质粒同辅助病毒AdHPBGF35共同导入人胚胎肾细胞293系的衍生细胞系116细胞中进行重组腺病毒包装,并通过超高速离心纯化获得重组腺病毒颗粒。
3、重组腺病毒颗粒感染目的细胞
用重组腺病毒颗粒感染hESCs细胞(H9)(1×107个细胞,病毒用量为15 bgal-transducing units(btu),病毒用量单位可参见文献“Palmer,D.J.&Ng,P. Physical and infectious titers of helper-dependent adenoviral vectors:a method of direct comparison to the adenovirus reference material.Mol Ther 10, 792-798(2004).”和“Suzuki,K.et al.Highly efficient transient gene expression and gene targeting in primate embryonic stem cells with helper-dependent adenoviral vectors.Proc Natl Acad Sci USA 105,13781- 13786(2008).”,感染后第2-4天,加入G418(25~400g/ml,invitrogen公司产品) 进行阳性的筛选,感染后第10-13天,加入4μM Ganciclovir(GANC,invitrogen 公司产品)进行阴性的筛选。最后对存活下来的细胞进行测序鉴定(PCR引物为 NRF2A245GseqF:ACCATTTGTGACTTTGCCCTTTAGTGACCTCTACCATC和NRF2A245GseqR: AACCTGCCATAACTTTCCCAAGAACTGA,测序引物为aaaaacagaaaaaacttgaa),得到一个NRF2 等位基因上位点正确编辑的细胞,将其记作NRF2AG/+ hESC细胞。
4、将上述线性化质粒同辅助病毒AdHPBGF35共同导入NRF2AG/+ hESC细胞中再次进行基因编辑,并对编辑后细胞进行鉴定,获得两个NRF2等位基因上位点正确编辑的细胞,将其记作NRF2AG/AG hESC细胞,即NRF2增强型多能干细胞。
二、NRF2增强型多能干细胞的鉴定
1、NRF2增强型多能干细胞的测序鉴定
对NRF2增强型多能干细胞进行测序鉴定。经测序鉴定表明:NRF2增强型多能干细胞中NRF2基因的A245G位点发生正确编辑(图1B),NRF2增强型成体细胞中的NRF2 基因的两条同源染色体的第245位均由碱基A突变为碱基G。
2、NRF2增强型多能干细胞的形态鉴定
对NRF2增强型多能干细胞进行形态鉴定,NRF2AG/AG hESC的形态鉴定结果如图1C 所示。此外从图中可以看出,NRF2增强型多能细胞依然具有在体内分化为内中外三胚层细胞的能力。
3、NRF2增强型多能干细胞中多能干性基因的表达水平检测
分别对野生型人胚胎干细胞H9细胞系(NRF2+/+)、NRF2AG/+ hESC细胞(NRF2AG/+hESC) 和NRF2AG/AG hESC细胞(NRF2AG/AG hESC)的表达多能干性基因OCT4、SOX2、NANOG的表达水平进行检测。用于PCR鉴定的引物如下:
18S-F:GTAACCCGTTGAACCCCATT;
18S-R:CCATCCAATCGGTAGTAGCG;
OCT4-F:GGGTTTTTGGGATTAAGTTCTTCA;
OCT4-R:GCCCCCACCCTTTGTGTT:
SOX2-F:CAAAAATGGCCATGCAGGTT;
SOX2-R:AGTTGGGATCGAACAAAAGCTATT;
NANOG-F:ACAACTGGCCGAAGAATAGCA;
NANOG-R:GGTTCCCAGTCGGGTTCAC。
结果如图1D所示。从图中可以看出:NRF2+/+、NRF2AG/+ hESC和NRF2AG/AG hESC细胞均正常表达多能干性基因OCT4、SOX2、NANOG。
实施例2、NRF2增强型间充质干细胞的制备及其功能检测
本发明将实施例1中获得的NRF2增强型多能干细胞进一步分化为NRF2增强型间充质干细胞(NRF2增强型MSC)。并通过实验证明:NRF2增强型MSC中NRF2得到主动激活,在体内体外均表现出抗逆、抗细胞衰老和抵抗恶性转化的特性。具体步骤如下:
一、NRF2增强型MSC的制备
1、将NRF2AG/AG hESC进行拟胚体(EB)分化,具体步骤如下:准备含有300-500 个细胞、大小均一的NRF2AG/AG hESC克隆,用室温PBS清洗一次,用Dispase(Invitrogen 公司,货号为17105041)37℃消化20-30min。待ESC克隆形成球体后,用CDF12培养基重悬后,加到低粘附培养板(Corning公司,货号3471)中,37℃,5%CO2条件培养1-3天后即形成拟胚体。
2、将步骤1获得的拟胚体接种于基质胶(matrigel)(Invitrogen公司)包被的 6孔板中进行培养,继续培养2周至纤维状细胞出现。再经过一次传代后,利用流式细胞术分选其中的CD73、CD90和CD105均为阳性的细胞类群,即为NRF2增强型MSC,将其记作NRF2AG/AGMSC。
将上述步骤中的NRF2AG/AG hESC替换为野生型人胚胎干细胞H9细胞系,其他步骤不变,定向诱导分化得到野生型间充质细胞记作NRF2+/+ MSC。
二、NRF2增强型MSC的表型鉴定及功能检测
1、NRF2增强型MSC的表型鉴定
对步骤一获得的NRF2AG/AG MSC和NRF2+/+ MSC的表面标记物进行检测。
结果如图1E所示。从图中可以看出:步骤一获得的NRF2AG/AG MSC和NRF2+/+ MSC 均能够表达MSC特异的表面标记物CD73,CD90和CD105,而不表达无关的CD34,CD43 和CD45。
2、NRF2增强型MSC中抗逆基因NRF2的主动激活
(1)NRF2增强型MSC中NRF2蛋白量
分别以NRF2AG/AG MSC和NRF2+/+ MSC为供试细胞,检测供试细胞中NRF2蛋白量。具体步骤如下:使用RIPA细胞裂解液(碧云天,P0013B)裂解供试细胞,然后使用BCA 蛋白定量试剂盒(碧云天,P0010)测定供试细胞中蛋白浓度,最后分别取20ug蛋白进行Western blot实验。使用一抗为NRF2(abcam,62352),二抗为羊抗兔IgG/HRP (中杉金桥,ZDR-5306)。
结果如图1H所示。从图中可以看出:NRF2AG/AG MSC(NRF2增强型MSC)中NRF2蛋白量明显高于NRF2+/+ MSC。
(2)核内定位
分别以NRF2AG/AG MSC和NRF2+/+ MSC为供试细胞,分别检测胞质及核质中NRF2蛋白含量。具体步骤如下:使用细胞核蛋白与细胞浆蛋白抽提试剂盒(碧云天,P0028)分别提取胞质及核质组分蛋白,然后取等量蛋白分别进行Western blot实验,并以胞质标记物β-tubulin和核质标记物Lamin B1为对照。
结果如图1F所示。从图中可以看出:NRF2AG/AG MSC(NRF2增强型MSC)中的NRF2 蛋白在胞质及核质中的含量均高于NRF2+/+ MSC。
(3)NRF2增强型MSC中抗逆基因NRF2下游靶基因的mRNA和蛋白水平检测
1)实时定量PCR实验
分别以NRF2AG/AG MSC和NRF2+/+ MSC为供试细胞,分别提取供试细胞的RNA并反转录为cDNA,分别使用如下引物进行实时定量PCR,检测供试细胞中抗逆基因NRF2下游靶基因:NQO1基因、HO-1基因、GCLC基因、GCLM基因、GR基因、TXN基因、TRXR1 基因的表达量。
NQO1-F:CGCAGACCTTGTGATATTCCAG;
NQO1-R:CGTTTCTTCCATCCTTCCAGG:
HO1-F:AAGACTGCGTTCCTGCTCAAC;
HO1-R:AAAGCCCTACAGCAACTGTCG;
GCLC-F:GGATTTGGAAATGGGCAATTG;
GCLC-R:CTCAGATATACTGCAGGCTTGGAA;
GCLM-F:TGCAGTTGACATGGCCTGTT;
GCLM-R:TCACAGAATCCAGCTGTGCAA;
GSR-F:TTGTCGGGCTTGGAAGTCAG;
GSR-R:TGGTAGCCTACCGGGAACTG:
TXN-F:GTGAAGCAGATCGAGAGCAAG;
TXN-R:CGTGGCTGAGAAGTCAACTACTA;
TRXR1-F:GGGCAATTTATTGGTCCTCA;
TRXR1-R:GGTCTTTCACCAGTGGCAAT。
2)分别以NRF2AG/AG MSC和NRF2+/+ MSC为供试细胞,提取供试细胞中的蛋白并进行 Western blot实验,检测供试细胞中NQO1和HO-1蛋白表达水平。并以胞质标记物β -tubulin为对照。使用抗体为NQO1(Santa Cruz Biotechnology,32793),HO-1(ENZO, ADI-SPA-895-D)。
结果如图1G和图1H所示。从图中可以看出:NRF2AG/AG MSC(NRF2增强型MSC)中下游靶基因:NQO1基因、HO-1基因、GCLC基因、GCLM基因、GR基因、TXN基因和TRXR1 基因的表达量均高于NRF2+/+ MSC。且NRF2AG/AG MSC中NQO1和HO-1蛋白表达水平也高于NRF2+/+ MSC。
综上所述,NRF2单一位点修饰后NRF2基因得到组成型激活。
3、NRF2增强型MSC的抗逆抗细胞衰老特性
(1)外源刺激下的高活力
使用包括氧化压力,内质网压力,DNA损伤压力及凋亡刺激在内的外源刺激物处理MSC。具体步骤如下:将供试细胞NRF2AG/AG MSC和NRF2+/+ MSC铺于96孔板上,分别使用如下外源刺激物(括号内为外源刺激物的终浓度及购买处)刺激供试细胞48小时:
1)氧化压力:DMSO(0.1%,Sigma)、PQ(2mM,Paraquat,Sigma)、PX12(50uM, Santa Cruz Technology)、TBH(100uM,tert-Butyl hydroperoxide,Sigma)、L-BSO (500uM,L-Buthionine-sulfoximine,Sigma);
2)内质网压力:TM(6ug/mL,Tunicamycin,Sigma)和TG(1.5ug/mL,Thapsigargin, Sigma);
3)DNA损伤:4NQO(100uM,4-nitroquinoline N-oxide,Sigma)和AAT2(50uM, Apoptosis Activator 2,TOCRIS);
4)凋亡:CCCP(100uM,Carbonyl cyanide 3-chlorophenylhydrazone,Sigma)。
刺激结束后按CellTiter 96 AQueous One Solution Cell Proliferation Kit (Promega,G3582)试剂盒及其使用方法检测刺激后供试细胞的活力。检测时直接向培养细胞的培养基中加入CellTiter 96 AQueous One Solution试剂,细胞培养箱中孵育1小时后检测490nm的吸光度值,根据OD490的数值计算相对细胞活力。相对细胞活力计算公式为:Log2(OD490(NRF2AG/AG)/OD490(NRF2+/+))。
结果表明:在本底水平及刺激条件下,NRF2增强型MSC均具有更强的细胞活力(图 2A)。
(2)生长能力测定
利用细胞计数统计连续传代培养的NRF2AG/AG MSC和NRF2+/+ MSC的生长能力。
结果如图2B所示。从图中可以看出:NRF2AG/AG MSC细胞(NRF2增强型MSC)倍增速率明显高于NRF2+/+ MSC细胞,表现出明显的抵抗细胞衰老的能力。
(3)SA-β-Gal染色
细胞衰老β-半乳糖苷酶染色是一种基于衰老时SA-beta-Gal (senescence-associated beta-galactosidase)活性水平上调而对衰老细胞或组织进行染色检测的方法。分别对步骤一获得的NRF2AG/AG MSC和NRF2+/+ MSC进行SA-β-Gal 染色,并在普通的光学显微镜下就可以观测到细胞或组织的衰老情况,并进一步对两组细胞中的SA-β-Gal染色阳性细胞比率进行定量统计分析。具体步骤如下:
分别以NRF2AG/AG MSC和NRF2+/+ MSC为供试细胞(早代:第5代,晚代:第11代),用PBS洗涤1次,再加入染色固定液(2%甲醛+0.2%戊二醛),室温固定5分钟。弃去固定液,用PBS洗涤1次,每孔加入1ml染色工作液。以X-Gal为底物,在衰老特异性的β-半乳糖苷酶催化下会生成深蓝色产物。
结果如图2C所示,从图中可以看出,晚代的NRF2+/+ MSC有明显的蓝色,而早代 NRF2+/+ MSC及晚代的NRF2AG/AG MSC(NRF2增强型MSC)阳性率很低。可见,NRF2增强型MSC的衰老进程延缓。
(4)有害代谢物含量检测
分别以NRF2AG/AG MSC和NRF2+/+ MSC为供试细胞(早代EP:第5代,晚代LP:第 11代),与1μM氧自由基探针DCFDA(Invitrogen,货号:C6827)共同孵育30分钟,利用流式细胞仪检测DCFDA强度(即指针细胞内活性氧含量)。详细步骤可参考 Invitrogen公司说明书。
结果如图2D所示,NRF2AG/AG MSC(NRF2增强型MSC)在早晚代中都积累更少的活性氧,表明NRF2增强型MSC能够更有效的清除此有害代谢物。
(5)衰老基因表达检测
分别以NRF2AG/AG MSC和NRF2+/+ MSC为供试细胞(早代EP:第5代,晚代LP:第 11代),Western blot实验检测供试细胞中衰老高表达基因p16、p21、GATA4的蛋白表达情况。使用一抗为p16(BD,550834),P21(Cell signaling,2947),GATA4(Santa cruz,SC-1237)。对应二抗为羊抗小鼠IgG/HRP(中杉金桥,ZDR-5307),羊抗兔IgG/HRP (中杉金桥,ZDR-5306)及兔抗羊IgG/HRP(中杉金桥,ZDR-5308)。
结果如图2E所示。从图中可以看出,和NRF2+/+ MSC相比,基因增强型MSC(NRF2AG/AGMSC)始终表达低丰度的衰老相关基因p16、p21和GATA4。
(6)增殖能力检测
分别以NRF2AG/AG MSC和NRF2+/+ MSC为供试细胞(早代EP:第5代,晚代LP:第 11代),通过免疫荧光染色法检测与增殖活力相关的Ki67表达。具体步骤如下:供试细胞铺于圆形玻片上,使用4%多聚甲醛固定后经0.4%TritonX-100通透。通透的细胞在驴血清中封闭1h,随后一抗孵育过夜,使用一抗为Ki67(Vector Laboratories,货号:VP-RM04)。对应二抗孵育45分钟后使用激光共聚焦显微镜拍摄细胞图片。
结果如图2F所示。从图中可以看出,和NRF2+/+ MSC相比,NRF2AG/AG MSC(NRF2增强型MSC)在早晚代中均具有更高的Ki67阳性细胞率。
(7)细胞核结构完整性检测
分别以NRF2AG/AG MSC和NRF2+/+ MSC为供试细胞(早代:第5代,晚代:第11代),通过免疫荧光染色法检测核膜蛋白Lamin B1和LAP2的表达。具体步骤如下:供试细胞铺于圆形玻片上,使用4%多聚甲醛固定后经0.4%TritonX-100通透。通透的细胞在驴血清中封闭1h,随后一抗孵育过夜,使用一抗为LaminB1(Abcam,货号:16048) 及LAP2(BD,货号:611000)。对应二抗孵育45分钟后使用激光共聚焦显微镜拍摄细胞图片。
结果如图2G所示。从图中可以看出:和NRF2+/+ MSC相比,晚代的NRF2AG/AG MSC(NRF2 增强型MSC)核膜异常的细胞(图2G中箭头所指的即为核膜异常细胞,核膜蛋白染色后不可见明显的核膜轮廓)数目明显减少,表明NRF2AG/AG MSC(NRF2增强型MSC)具有更完整的细胞核结构。
4、NRF2增强型MSC抵抗恶性转化的特性
(1)NRF2AG/AG TMSC和NRF2+/+ TMSC的制备
利用体外恶性转化系统,分别向NRF2AG/AG MSC和NRF2+/+ MSC中转入致瘤因子,将非瘤的MSC转化为瘤化的MSC(transformed MSC,下称TMSC),分别得到NRF2AG/AG TMSC 和NRF2+/+ TMSC。随后检测肿瘤相关特性。具体步骤如下:
1)将体外恶性转化系统所需逆转录病毒载体质粒pBABE-neo-hTERT、 pBABE-zeo-large T genomic、pBABE-puro-HRAS V12分别与包装质粒gag/pol和VSV-G 共转染至293T细胞中,收集培养上清,并通过超高速离心纯化逆转录病毒颗粒。将体外恶性转化系统所需慢病毒载体质粒PLVTHM-shP53分别与包装质粒psPAX和pMD.2G 共转染至293T细胞中,收集培养上清,并通过超高速离心纯化慢病毒颗粒。
2)利用纯化得到的病毒分别感染NRF2AG/AG MSC和NRF2+/+ MSC。如图3A所示,MSC 的恶性转化包括端粒延长,抑癌基因缺失和致癌基因突变三方面,该过程通过感染3 种逆转录病毒和1种慢病毒实现。慢病毒可同时表达绿色荧光GFP蛋白,同时实现细胞的可视标记。具体操作过程为在早代MSC中依次感染步骤(1)中获得的 pBABE-neo-hTERT、pBABE-zeo-large T genomic以及pBABE-puro-HRAS V12三种逆转录病毒。由于三种病毒分别具有neo,zeo和puro的抗性标记,因而依次使用对应的 G418(Invitrogen,10131035),zeocin(Invitrogen,R25001)以及puromycin (Invitrogen,A1113803)三种药物进行正向筛选获得三种病毒均整合的细胞,最后感染PLVTHM-shP53慢病毒加强抑癌基因的抑制及GFP的标记。经此步骤分别得到 NRF2AG/AG TMSC和NRF2+/+ TMSC。
(2)非锚定依赖生长能力
肿瘤细胞在无法粘附的琼脂上能够长成克隆,而非瘤细胞则不可,因此非锚定依赖的生长能力与肿瘤细胞形成实体肿瘤密切相关。分别将NRF2AG/AG TMSC和NRF2+/+ TMSC 与溶解状态的琼脂糖(0.35%)混合均匀,迅速铺于细胞培养皿中,待琼脂糖凝固后覆盖TMSC培养基培养,观察非锚定依赖生长能力。
结果如图3B所示:NRF2AG/AG TMSC经恶性转化后其非锚定依赖生长能力较野生型细胞转化后大大减弱(图3B)。
(3)体内成瘤能力
分别将NRF2AG/AG TMSC和NRF2+/+ TMSC(3×10^6个细胞)移植入裸鼠(品系:Balb/C nude mice)后肢近关节处。将贴壁培养的TMSC消化为单细胞,重悬于混有20%Matrigel (BD Biosciences,354277)的PBS(Gibco,10010023)溶液中,使用普通注射器将细胞悬液注射入后肢近关节处的肌肉中。移植2-3月后,当后肢出现明显肿物隆起,处死小鼠。切下后肢使用天平称重,并计算相对质量(相对质量=移植NRF2+/+ TMSC的后肢质量/移植NRF2AG/AGTMSC的后肢质量)。
结果如图3C和图3D所示:从图中可以看出,相对质量为2.73±0.22,移植NRF2+/+TMSC的后肢质量显著大于移植NRF2AG/AG TMSC的后肢质量。说明NRF2+/+TMSC能够长出骨肉瘤状肿瘤,而NRF2AG/AG TMSC则彻底丧失了形成肿瘤的能力。
实施例3、NRF2增强型间充质干细胞在细胞移植治疗中的应用
由于实施例2获得的NRF2增强型间充质干细胞(NRF2增强型MSC)具有抗逆、抗细胞衰老及抵抗肿瘤发生的特性,本发明将实施例2中获得的NRF2增强型间充质干细胞用于细胞移植治疗。具体步骤如下:
一、将NRF2增强型MSC移植到小鼠的胫骨前肌
1、分别对NRF2AG/AG MSC和NRF2+/+ MSC进行荧光素酶标记。具体步骤如下:将过表达荧光素酶luciferase的慢病毒载体质粒与慢病毒包装质粒psPAX和pMD2.G共转染至293T细胞中,收集培养上清,并通过超高速离心纯化病毒颗粒。利用纯化得到的病毒感染NRF2AG/AGMSC和NRF2+/+ MSC,分别得到荧光素酶标记的NRF2AG/AG MSC和NRF2+/+ MSC;
2、分别将荧光素酶标记的NRF2AG/AG MSC和NRF2+/+ MSC(1×10^6个细胞)移植到小鼠的胫骨前肌中,7天后利用动物活体成像仪检测腿部存留的MSC。
结果如图4A所示,NRF2AG/AG MSC(NRF2增强型MSC)较NRF2+/+ MSC能够存留更久。
二、将NRF2增强型MSC移植到后肢缺血的免疫缺陷小鼠肌肉
分别将NRF2AG/AG MSC和NRF2+/+ MSC移植到后肢缺血的免疫缺陷小鼠肌肉中,利用激光多普勒血流仪检测移植后第0,4,8,12,16天小鼠后肢血流的恢复情况。同时将PBS溶液(control)((Gibco,10010023))作为对照。
结果如图4B和4C所示,较注射PBS溶液或移植NRF2+/+ MSC相比,移植NRF2AG/AG MSC (NRF2增强型MSC)能够更快的恢复受损后肢的血流,表明NRF2AG/AG MSC参与了损伤后血管的再生和修复。
- 还没有人留言评论。精彩留言会获得点赞!