一种封闭群五指山小型猪遗传质量检测的方法与流程
本发明属于基因工程技术领域,尤其涉及一种封闭群五指山小型猪遗传质量检测的方法。
背景技术:
五指山猪是我国非常著名的小型猪品种,不但具有肉质好、耐粗饲、抗逆性和适应性强、易于饲养管理等特点,更重要的是它体型小、器官大小和生理特性与人类接近,是作为人类试验模型的首选动物之一,1998年自原产地引种后在集中饲养在海口市郊灵山镇五指山猪种猪场按照封闭群繁育标准自闭繁殖近20年(孙瑞萍等,2015)。2014年7月11日,海南省农业科学院畜牧兽医研究所获得海南省科学技术厅颁发的实验动物生产许可证,许可证号为:SCXK(琼)2014-0006。微卫星DNA是广泛分布于真核生物基因组中的段串联重复序列,其核心通常由1-6个核苷酸为单位的多次串联重复组成,具有数量大、分布广、多态性丰富、共显性遗传等特点。微卫星DNA标记是群体遗传学研究中最常使用的分子标记之一[Kim T H,et.al,2005,Sahoo N R,et.al,2015]。微卫星标记的分析一般多采用聚丙烯酰胺电泳结合银染进行基因分型,易受电压、电泳胶和实验者等诸多因素影响,无法精确地、大规模、自动化检测,而多重PCR和荧光标记-半自动基因分型技术能够在DNA水平上实现快速简便且结果稳定可靠的检测,在基因定位、种质鉴定、遗传多样性分析、遗传图谱构建等方面已得到广泛应用[Sahoo,N.R.,et,al,2015.Cortés O,et,al.2016]。五指山小型猪目前已广泛应用于肿瘤、心血管、糖尿病、皮肤烧伤、新药安全性评价等生物医学研究的诸多领域,由于猪的质量问题已直接影响到医学生物学研究结果的准确性,而遗传监测是评定和保证小型猪群体遗传质量的有效措施。随着分子生物学技术的发展,DNA分子水平遗传标记相继出现。微卫星DNA标记,以其信息含量高(Tautz D,1989)分布广泛、高度多态性、易于交流、测定快捷等特点被认为是各类分子遗传标记中最有价值的一种。然而,从目前国内外应用微卫星对小型猪群体遗传进行分析的报道资料看,所应用的微卫星位点极不统一,某些微卫星位点多态性较差,因此选择合适的微卫星位点及数量,是建立遗传检测方法的关键。Barker(1994)提出为了使结果具有一定的准确性,用于群体遗传学检测的微卫星数目不应低于26个,彼此不连锁,每个标记至少有4个等位基因。
综上所述,目前国内外应用微卫星对小型猪群体遗传进行分析的报道资料看,所应用的微卫星位点极不统一,某些微卫星位点多态性较差(商海涛,2003,张桂香,2003)。
技术实现要素:
本发明的目的在于提供一种封闭群五指山小型猪遗传质量检测的方法,旨在解决目前国内外应用微卫星对小型猪群体遗传进行分析的报道资料看,所应用的微卫星位点极不统一,某些微卫星位点多态性较差的问题。
本发明是这样实现的,一种封闭群五指山小型猪遗传质量检测的方法,所述封闭群五指山小型猪遗传质量检测的方法包括以下步骤:
步骤一,五指山猪采集60份耳皮肤组织样,样本置于1.5mL消毒离心管中,带回实验室,-20℃冰箱保存备用;
步骤二,五指山猪基因组DNA按照天根DNA提取试剂盒中的方法提取,溶于TE中,-20℃保存;用琼脂糖凝胶电泳和NanoDrop2000双重检测DNA的纯度和浓度;
步骤三,33个微卫星标记引物进行多重PCR扩增;
步骤四,将多重PCR产物进行基因扫描,使用Genemapper软件分析SSR数据,标定片段大小和基因型;
步骤五,运用Popgene32软件对数据进行统计分析将所有样本的每个微卫星位点的基因型以ab,bb等形式输入Popgene32软件的数据文件。
进一步,所述五指山猪按照随机交配原则进行封闭繁育近20年,已繁育至3代以上。
进一步,所述多重PCR扩增的PCR反应体系为20ul,DNA模板1.0ul、Taq Buffer 2.5ul、dNTP 10mM 0.5μl、上有引物0.5ul、下游引物0.5ul、TaqaDNA聚合酶0.5ul,最后补H2O至20ul;反应条件为:95℃预变性3min,95℃变性30s,60℃退火30s,72℃延伸30s,进行10个循环;95℃变性30s,55℃退火30s,72℃延伸30s,进行20个循环;最后72℃修复延伸6min。
进一步,所述步骤五中计算样品在各微卫星位点上的基因频率、平均观察等位基因数、平均有效等位基因数、香隆指数、平均有效杂合度;利用Cervus 3.0软件计算群体P值。
本发明提供的封闭群五指山小型猪遗传质量检测的方法,采用多重PCR扫描方法对封闭群五指山小型猪的33个微卫星位点进行遗传多态性分析,统计了各个基因座的杂合度及期望杂合度、有效等位基因数、多态信息含量、固定指数和Shannon信息熵。33个微卫星位点在WZSP封闭群中平均等位基因数为6.42,平均杂合度为0.66,期望杂合度平均值为0.69。此外,总群体在33个位点多态信息含量的平均值为0.65,平均固定指数为0.05。表明封闭群五指山小型猪群体具有一定的遗传稳定性,符合封闭群动物的遗传结构特征,所选微卫星位点可用于五指山遗传多样性评估。同时也为五指山猪的种质资源的保护、选育和利用提供理论依据。
本发明所选用的微卫星位点PIC均大于0.25,29个位点PIC均大于0.50,平均PIC为0.65,属于高度多态,比原五指山小型猪核心群和近交系多态性信息含量丰富(黄礼光,2005)也优于和房山封闭群小型猪和广西巴马小型猪封闭群(黄建芳,2015.魏杰,2013)。较之以往研究更符合封闭群的特征,这也充分反映了五指山猪封闭群小型猪在长期封闭培育过程中群体基因频率已趋于稳定,已基本形成一个新的封闭群。另外,在遗传连锁分析中,可作为理想选择标记的微卫星位点,其PIC值应大于0.7。PIC值的大小还可以显示位点的可用性和使用效率,在一个群体中,某位点PIC越大,其杂合子比例则越高,提供的遗传信息就越多,选择潜力也越大。位点SW886的多态信息含量最高为0.81,表明五指山猪封闭群在该位点的遗传信息更为丰富,相比其他位点则具有更大的选择潜力。本发明中33个微卫星位点shannon信息熵均分布在0.71~2.07之间,表明WZSP封闭群群体在一些位点遗传多样性贫瘠。在33个微卫星位点中,在SWR186和SW886位点的杂合度、期望杂合度、多态信息含量和Shannon信息熵均最高,说明WZSP封闭群在该两个位点具有最为丰富的多样性。33个位点中,16个位点固定指数为负值,其他位点均为正值,平均固定指数为0.05,这表明WZSP封闭群群体处于杂合度缺失状态,群体中存在不同程度的近亲交配现象。提示在对五指山猪的人工选育过程中,仍需要加大选择力度,增强基因交流,从而选育出更为优良的高生产性能品种。群体在某个位点的基因平衡主要受突变、迁移、漂变、选择和奠基者效应等因素的影响。在实际生产中,人工选择是影响群体基因平衡的一个重要因素,对某个数量性状进行定向人工选择时,其结果必然导致该数量性状的主效基因及与之相连的其它基因或遗传标记的基因平衡被打破。χ2适合性检验表明,五指山猪在33个位点上总群体上达到Hardy-Weinberg平衡。
附图说明
图1是本发明实施例提供的五指山小型猪遗传质量检测的方法流程图。
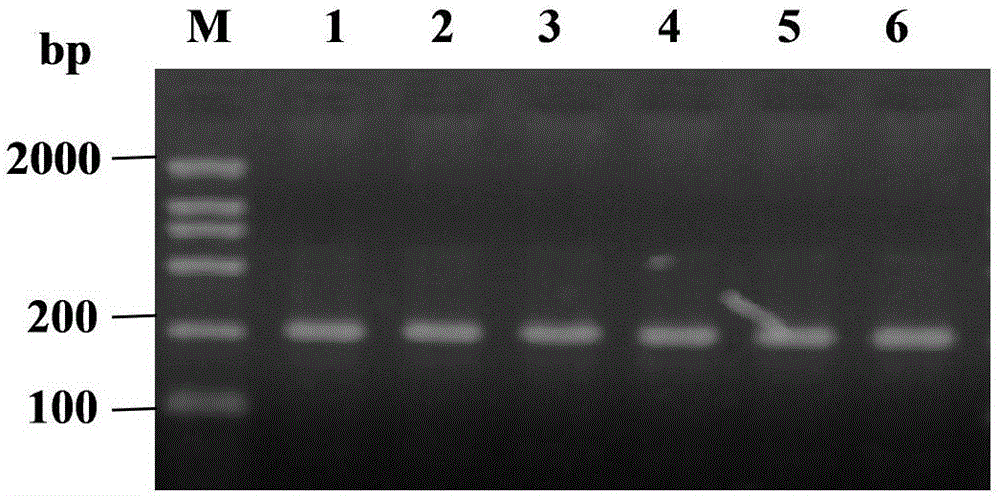
图2是本发明实施例提供的微卫星PCR扩增产物Sw902琼脂糖凝胶电泳示意图;
图中:1~6:不同样本的PCR产物;M:DL2000的marker。
图3是本发明实施例提供的微卫星PCR扩增产物STR分型图;
图中:A:S0062;B:S0068;C:S0070;D:S0091。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
下面结合附图对本发明的应用原理作详细的描述。
如图1所示,本发明实施例提供的五指山小型猪遗传质量检测的方法包括以下步骤:
S101:五指山猪采集60份耳皮肤组织样,样本置于1.5mL消毒离心管中,带回实验室,-20℃冰箱保存备用;
S102:五指山猪基因组DNA按照天根DNA提取试剂盒中的方法提取,溶于TE中,-20℃保存;用琼脂糖凝胶电泳和NanoDrop2000双重检测DNA的纯度和浓度;
S103:33个微卫星标记引物进行多重PCR扩增;
S104:将多重PCR产物进行基因扫描,使用Genemapper软件分析SSR数据,标定片段大小和基因型;
S105:运用Popgene32软件对数据进行统计分析将所有样本的每个微卫星位点的基因型以ab,bb等形式输入Popgene32软件的数据文件,计算样品在各微卫星位点上的基因频率、平均观察等位基因数、平均有效等位基因数(Ne)、香隆指数、平均有效杂合度(H)等;利用Cervus 3.0软件计算群体P值。
下面结合实验对本发明的应用原理作进一步的描述。
1材料和方法
1.1实验动物
从海南国家级五指山猪保种场永发基地实验动物繁育场(生产许可证号SCXK(琼)2014-0006)采集60份耳皮肤组织样,样本置于1.5mL消毒离心管中,带回实验室,-20℃冰箱保存备用。该品种在繁育场按照随机交配原则进行封闭繁育近20年,已繁育至3代以上。
1.2主要试剂
TaqDNA聚合酶、10×PCR Buffer(without Mg2+:100mM Tris-HCl pH 8.8 at25℃;500mM KCl,0.8%(v/v)Nonidet);MgCl2(25mM)、dNTP(10mM)、Marker、6×DNA Loading Dye(生工);HIDI、LIZ500(美国ABI公司)。
1.3DNA的提取
五指山猪基因组DNA按照天根DNA提取试剂盒中的方法提取,溶于TE中,-20℃保存。用琼脂糖凝胶电泳和NanoDrop2000双重检测DNA的纯度和浓度。基因组DNA部分样品的电泳结果如图2所示。
1.4微卫星引物
本实验选择的33对微卫星引物及荧光标记全部参照(徐玲玲等,2009.魏杰,2013)由上海生工生物技术有限公司合成。
1.5微卫星基因座的多重PCR扩增
33个微卫星标记引物进行多重PCR扩增。PCR反应体系为20ul,DNA模板1.0ul、Taq Buffer 2.5ul、dNTP 10mM 0.5μl、上有引物0.5ul、下游引物0.5ul、TaqaDNA聚合酶0.5ul,最后补H2O至20ul。反应条件为:95℃预变性3min,95℃变性30s,60℃退火30s,72℃延伸30s,进行10个循环;95℃变性30s,55℃退火30s,72℃延伸30s,进行20个循环;最后72℃修复延伸6min。
1.6微卫星基因扫描
将多重PCR产物送上海生工生物有限公司进行基因扫描,使用的测序仪为3730XL,使用Genemapper软件分析SSR数据,标定片段大小和基因型。
1.7数据统计及分析
运用Popgene32软件对数据进行统计分析将所有样本的每个微卫星位点的基因型以ab,bb等形式输入Popgene32软件的数据文件,计算样品在各微卫星位点上的基因频率、平均观察等位基因数、平均有效等位基因数(Ne)、香隆指数、平均有效杂合度(H)等。利用Cervus 3.0软件计算群体P值。
2结果与分析
2.1PCR产物检测
PCR产物1.5%浓度的琼脂糖凝胶电泳,部分结果如图2所示。PCR产物在ABI3730XL Genetic Analyzer测序后STR分型如图3所示。各峰图表示封闭群五指山猪微卫星基因座等位基因的大小及基因型。
2.2等位基因频率及其等位基因分布
五指山猪封闭群群33个微卫星位点的等位基因数、等位基因大小和最高频率等位基因见表1。由表1可看出,60头五指山猪在33个微卫星位点上共检测到212个等位基因,平均每个位点6.17个等位基因。在SWR158位点上检测到等位基因数最多,为12个,变异范围为164~216bp,170bp的等位基因频率最高,为0.3667;表明33个微卫星位点在五指山猪中存在多态性,可以用于分析五指山猪遗传特性。由表2可见33个微卫星位点的等位基因频率高低不均,每个基因位点除几个等位基因频率较高外,其他等位基因频率较低。
表1 WZSP封闭群33个微卫星位点等位基因数、有效等位基因数、大小、最高频率等位基因及其频率
2.3五指山猪封闭群的群体遗传变异分析
33个微卫星位点的遗传多样性指标见表3。表3表明,33个微卫星位点在WZSP封闭群中表观纯合度最低值与最高值分别为0.10和0.82,平均值为0.34;表观杂合度为0.22~0.90,平均为0.66。期望纯合度最低值与最高值分别为0.16和0.69;期望杂合度最低值与最高值分别为0.31和0.84,其平均值为0.67。此外,总群体在35个位点多态信息含量的平均值为0.69,29个位点呈高度多态性。33个位点中,16个位点固定指数为负值,其他位点均为正值,平均固定指数为0.05;在SWR186和SW886位点的杂合度、期望杂合度、多态信息含量和Shannon信息熵均最高,在33个微卫星位点中,WZSP封闭群在该位点具有最为丰富。在群体的Hardy-Weinberg平衡检验中也发现总群体在33个位点的P>0.05,符合遗传平衡定律。
表2 WZSP封闭群33个微卫星位点的等位基因频率
表3 WZSP封闭群33个微卫星位点的遗传多样性指标
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!