用于诊断和预测移植物排斥的生物标志物板的制作方法
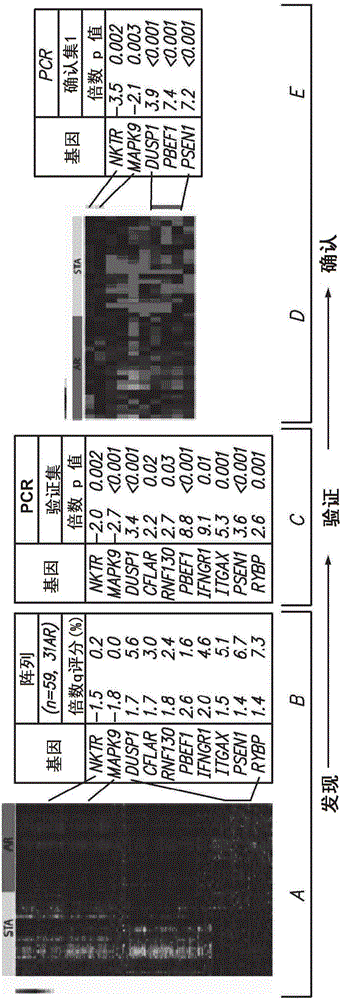
本发明是根据美国国立卫生研究院(NationalInstitutesofHealth)资助的合同(R01AI61739-01)。政府享有本发明的某些权利。背景移植器官或组织从供体至宿主患者的移植是某些医学程序和治疗方案的特征。虽然努力通过宿主-供体组织配型来避免移植物排斥,但是在供体器官被导入宿主的移植程序中,通常需要免疫遏制疗法以维持供体器官在宿主中的活力。然而尽管广泛使用了免疫遏制疗法,器官移植排斥仍可发生。同种异体移植物组织的急性移植物排斥(AR)是涉及同种异体移植物中同种抗原的T-细胞识别、共刺激信号、活化T细胞对效应分子的加工和移植物内的炎性反应的复杂免疫反应。循环白细胞的活化和向同种异体移植物的募集是这一过程的关键特征。AR的早期检测是移植受体(包括肾移植受体)护理中的主要临床问题之一。肾功能障碍发作之前的AR检测允许用积极的免疫遏制成功治疗这一病症。在不具有AR的患者中降低免疫遏制以使药物毒性最小化也同样重要。因此,监测移植物受体中的AR反应,包括预测、诊断和表征AR,是本领域中关注的。本发明满足了这些和其它需要。发明概述提供了用于监测具有移植物的受治疗者的急性排斥(AR)反应,例如以预测、诊断和/或表征AR反应,包括受治疗者中的移植物存活的方法。在实践该主题方法时,评估来自所述受治疗者的样品例如血液或活检样品中至少一种基因的表达水平以监测受治疗者,例如在核酸和/或蛋白水平进行评估。还提供了可用于实践该主题方法的组合物、系统、试剂盒和计算机程序产品。所述方法和组合物可用于多种应用。本发明的方面包括监测已接受移植物(如同种异体移植物)的受治疗者的急性排斥(AR)反应的方法,所述方法包括:(a)评估来自所述受治疗者的样品中至少一种基因的表达水平以获得基因表达结果,其中所述至少一种基因选自由以下组成的组:NKTR、MAPK9、DUSP1、PBEF1(也称为NAMPT)和PSEN1;和(b)采用所述基因表达结果来在所述受治疗者中预测AR反应的发作、诊断AR反应、和/或表征AR反应,由此监测所述受治疗者的AR反应。在某些实施方式中,评估上述5种基因的组的所有基因的表达水平。在某些实施方式中,评估步骤还包括评估选自以下的一种或多种的另外的基因的表达水平:CFLAR、RNF-130、IFNGR1、ITGAX和RYBP。在某些实施方式中,评估以上所列的全部10种基因的表达水平。在某些实施方式中,评估步骤包括测定所述样品的所述至少一种基因的表达产物。在某些实施方式中,所述表达产物是核酸转录物,而在其它实施方式中,所述表达产物是蛋白。在某些实施方式中,评估步骤包括RT-PCR测定。在某些实施方式中,所述RT-PCR测定是定量RT-PCR测定。在某些实施方式中,所述样品是血液样品。在某些实施方式中,所述同种异体移植物是肾同种异体移植物。在某些实施方式中,采用所述基因表达结果来提前6到3个月预测AR反应的发生。在某些实施方式中,采用所述基因表达结果来将AR反应表征为类固醇抗性AR反应。本发明的方面包括用于确定AR反应中被排斥的组织的身份的方法,所述方法包括评估来自所述受治疗者的样品中选自以下的一种或多种的至少一种基因的表达水平:NKTR、MAPK9、DUSP1、PBEF1(也称为NAMPT)、PSEN1、CFLAR、RNF-130、IFNGR1、ITGAX和RYBP,以获得基因表达结果,并采用该基因表达结果来确定被排斥的组织的身份。这一测试不仅仅适用于许多组织的移植排斥,包括肾、心脏、肝、肺和肠移植物。本发明的方面包括用于为已接受移植物的受治疗者确定免疫遏制方案的方法,所述方法包括:(a)评估来自所述受治疗者的样品中至少一种基因的表达水平以获得基因表达结果,其中所述至少一种基因选自由以下组成的组:NKTR、MAPK9、DUSP1、PBEF1(也称为NAMPT)和PSEN1;和(b)采用所述基因表达结果以为所述受治疗者确定免疫遏制方案。在某些实施方式中,评估上述5种基因的组的所有基因的表达水平。在某些实施方式中,评估步骤还包括评估选自以下的一种或多种的另外的基因的表达水平:CFLAR、RNF-130、IFNGR1、ITGAX和RYBP。在某些实施方式中,评估以上所列的全部10种基因的表达水平。本发明的方面包括用于监测已接受同种异体移植物的受治疗者的急性排斥(AR)反应的系统,所述系统包括:(a)基因表达评估元件,该基因表达评估元件配置为用于评估来自所述受治疗者的样品中至少一种基因的表达水平以获得基因表达结果,其中所述至少一种基因选自由以下组成的组:NKTR、MAPK9、DUSP1、PBEF1(也称为NAMPT)和PSEN1;和(b)表型确定元件,该表型确定元件采用所述基因表达结果来在所述受治疗者中预测AR反应的发作、诊断AR反应、和/或表征AR反应,由此监测所述受治疗者的AR反应。在某些实施方式中,评估上述5种基因的组的所有基因的表达水平。在某些实施方式中,所述基因表达评估元件包括用于测定样品的所述至少一种基因的表达产物的至少一种试剂。在某些实施方式中,所述至少一种基因的表达产物是核酸转录物,而在其它实施方式中,所述表达产物是蛋白。在某些实施方式中,所述基因表达评估元件包括所述至少一种基因特异性的PCR引物。在某些实施方式中,所述基因表达评估元件还配置为用于评估选自以下的一种或多种的另外的基因的表达水平:CFLAR、RNF-130、IFNGR1、ITGAX和RYBP。在某些实施方式中,评估以上所列的全部10种基因的表达水平。在某些实施方式中,所述表型确定元件包括包括所述至少一种基因的参考表达值。本发明的方面包括用于监测已接受同种异体移植物的受治疗者的急性排斥(AR)反应的试剂盒,所述试剂盒包括:(a)基因表达评估元件,该基因表达评估元件用于评估样品中至少一种基因的表达以获得基因表达结果,其中所述至少一种基因选自由以下组成的组:NKTR、MAPK9、DUSP1、PBEF1(也称为NAMPT)和PSEN1;和(b)表型确定元件,该表型确定元件采用所述基因表达结果来在所述受治疗者中预测AR反应的发作、诊断AR反应、和/或表征AR反应,由此监测所述受治疗者的AR反应。在某些实施方式中,评估上述5种基因的组的所有基因的表达水平。在某些实施方式中,所述基因表达评估元件还配置为用于评估选自以下的一种或多种的另外的基因的表达水平:CFLAR、RNF-130、IFNGR1、ITGAX和RYBP。在某些实施方式中,评估以上所列的全部10种基因的表达水平。在某些实施方式中,所述基因表达评估元件包括对以上所述的一种或多种基因特异的PCR引物对(如用于RT-PCR测定基因表达)。在某些实施方式中,所述基因表达评估元件包括对所述5种基因的组的全部5种基因特异的PCR引物对,而在其它实施方式中,所述基因表达评估元件包括对以上所列的全部10种基因特异的PCR引物对。本发明的方面包括用于监测已接受同种异体移植物的受治疗者的急性排斥(AR)反应的计算机程序产品,其中当装载于计算机上时,所述计算机程序产品配置为采用来自从所述受治疗者获得的样品的基因表达结果来确定AR监测结果,和以用户可读格式向用户提供所述AR监测结果,其中所述AR监测结果选自在所述受治疗者中预测AR反应的发作、诊断AR反应、和/或表征AR反应,其中所述基因表达结果包括选自以下的一种或多种的表达数据:NKTR、MAPK9、DUSP1、PBEF1和PSEN1。在某些实施方式中,所述表达结果包括来自所述5种基因的组的全部基因的表达数据。在某些实施方式中,所述表达结果包括选自以下的一种或多种的另外的基因的表达数据:CFLAR、RNF-130、IFNGR1、ITGAX和RYBP。在某些实施方式中,所述表达结果包括以上所列的全部10种基因的表达数据。定义为了方便,将说明书、实施例和所附权利要求书中采用的某些术语集于此处。“急性排斥或AR”是当移植的组织为免疫学上外源时,组织移植受体的免疫系统的排斥。急性排斥的特征为移植的组织被受体的免疫细胞浸润,所述免疫细胞执行其效应功能并破坏移植的组织。急性排斥的发作是迅速的,并且在人类中通常发生于移植手术后几周内。一般而言,可用免疫遏制药物抑制或遏制急性排斥,所述免疫遏制药物诸如雷帕霉素、环孢菌素A、抗-CD40L单克隆抗体和类似药物。“慢性移植排斥或CR”在人类中一般发生于移植物移入后数月至数年,甚至发生于存在急性排斥的成功免疫遏制时。纤维化是所有器官移植物类型的慢性排斥中常见的因素。慢性排斥典型地可通过特定器官特征性的一系列具体疾患来描述。例如,在肺移植物中,此类疾患包括气道的纤维增生性破坏(闭塞性细支气管炎);在心脏移植物或心脏组织的移植物中,诸如瓣膜换置术中,此类疾患包括纤维变性动脉粥样硬化;在肾移植物中,此类疾患包括梗阻性肾病、肾硬化(nephrosclerorsis)、肾小管间质性肾病变;和在肝移植物中,此类疾患包括消失型胆管综合征。慢性排斥的特征还在于局部缺血性损伤、移植的组织的去神经、高脂血症和与免疫遏制药物相关的高血压。术语“移植物排斥”涵盖急性和慢性移植物排斥二者。如本文所用的术语“严格测定条件”指适于产生具有充分互补性的核酸例如表面结合的核酸和溶液相核酸的结合对来提供测定中期望的特异性水平,而较不适于在不具有充足的互补性的结合成员之间形成结合对来提供期望的特异性的条件。严格测定条件是杂交和洗涤条件二者的总和或组合(总体)。在核酸杂交(如阵列杂交、DNA印迹杂交或RNA印迹杂交中)上下文中,“严格杂交条件”和“严格杂交洗涤条件”是序列依赖性的,并且在不同的实验参数下是不同的。可用于鉴定本发明范围内的核酸的严格杂交条件可包括,例如,在包括50%甲酰胺、5×SSC和1%SDS的缓冲液中在42℃下的杂交,或在包括5×SSC和1%SDS的缓冲液中在65℃下的杂交,二者均以0.2×SSC和0.1%SDS在65℃下洗涤。示例性严格杂交条件还可包括杂在40%甲酰胺、1MNaCl和1%SDS的缓冲液中在37℃下杂交和在1×SSC中在45℃下洗涤。可选地,可采用与过滤器结合的DNA在0.5MNaHPO4、7%十二烷基硫酸钠(SDS)、1mMEDTA在65℃下的杂交和在0.1×SSC/0.1%SDS中在68℃下的洗涤。另外的严格杂交条件包括在60℃或更高和3×SSC(450mM氯化钠/45mM柠檬酸钠)下的杂交或在42℃下在含有30%甲酰胺、1MNaCl、0.5%肌氨酸钠、50mMMES、pH6.5的溶液中的孵育。技术人员将容易理解,可利用替代但相当的杂交和洗涤条件来提供相似严格性的条件。在某些实施方式中,洗涤条件的严格性列出了决定核酸是否与表面结合的核酸特异性杂交的条件。用于鉴定核酸的洗涤条件可包括,例如:约pH7下约0.02M的盐浓度和至少约50℃或约55℃至约60℃的温度;或,约0.15MNaCl的盐浓度,72℃,约15分钟;或,约0.2×SSC的盐浓度,至少约50℃或约55℃至约60℃的温度,约15至约20分钟;或,用含0.1%SDS的约2×SSC的盐浓度的溶液在室温下洗涤杂交复合体两次,每次15分钟,然后用含0.1%SDS的0.1×SSC在68℃下洗涤两次,每次15分钟;或等同条件。用于洗涤的严格条件还可以是,例如,0.2×SSC/0.1%SDS,42℃。严格测定条件的一个具体实例是在65℃下在总单价阳离子浓度为1.5M的基于盐的杂交缓冲液中旋转杂交(如2000年9月5号提交的美国专利申请第09/655,482号中所述,该专利申请的公开内容通过引用并入本文),然后在室温下在0.5×SSC和0.1×SSC下洗涤。严格测定条件是至少与以上代表性条件同样严格的杂交条件,其中如果与以上具体条件相比,在给定的条件集下大致上没有另外的缺乏提供期望特异性的足够互补性的结合复合体产生,则认为该给定的条件集是至少同样严格的,其中“大致上不多于”意指少于约5倍多、一般少于约3倍多。其它严格杂交条件是本领域已知的,并且在适当时也可采用。如本文所用,术语“基因”或“重组基因”指包括编码多肽的开放可读框的核酸,包括外显子和(任选地)内含子序列。术语“内含子”指给定基因中存在的不被翻译成蛋白质的DNA序列,并且一般发现于DNA分子的外显子之间。此外,基因可任选地包括其天然启动子(即,非重组细胞即天然存在的细胞中基因的外显子和内显子与其可操作地连接的启动子)和相关的调控序列,并可具有或不具有AUG起始位点上游的序列,并且可包括或不包括非翻译的先导序列、信号序列、下游非翻译序列、转录起始和终止序列、多腺苷酸化信号、翻译起始和终止序列、核糖体结合位点以及类似序列。“蛋白编码序列”或“编码”特定多肽或肽的序列是当置于适当的调控序列的控制下时,在体外或体内转录(在DNA的情况下)和翻译(在mRNA的情况下)成多肽的核酸序列。编码序列的边界由5'(氨基)末端的起始密码子和3'(羧基)末端的翻译终止密码子确定。编码序列可包括但不限于,来自病毒、原核生物或真核生物mRNA的cDNA、来自病毒、原核生物或真核生物DNA的基因组DNA序列,和甚至合成的DNA序列。转录终止序列可位于编码序列的3'。术语“参考”和“对照”可互换地使用以指观察值可与之比较的已知值或已知值集。如本文所用的,已知意指该值代表已被理解的参数,例如,移植物存活或损失表型中标志物基因的表达水平。术语“核酸”包括DNA、RNA(双链或单链)、其类似物(如PNA或LNA分子)和衍生物。如本文所用的术语“核糖核酸”和“RNA”意指主要由核糖核苷酸组成的聚合物。如本文所用的术语“脱氧核糖核酸”和“DNA”意指主要由脱氧核糖核苷酸组成的聚合物。术语“mRNA”意指信使RNA。“寡核苷酸”一般指约10个至100个核苷酸长度的核苷酸多聚物,而“多核苷酸”包括具有任何数量的核苷酸的核苷酸多聚物。本申请中使用的术语“蛋白”和“多肽”是可互换的。“多肽”指氨基酸的聚合物(氨基酸序列),而不涉及该分子的具体长度。因此,多肽的定义中包括肽和寡肽。该术语也不涉及或包括多肽的翻译后修饰,例如,糖基化、乙酰化、磷酸化和类似修饰。包括在该定义中的有,例如,含有一个或多个氨基酸类似物的多肽、具有置换的连接的多肽、以及本领域中已知的其它修饰,包括天然存在的和非天然存在的修饰二者。术语“评价”和“评估”可互换地使用以指测量的任何形式,并包括确定元件是否存在。术语“确定”、“测量”、“评价”和“测定”可互换地使用,并包括定量和定性确定二者。评价可以是相对的或绝对的。“评价...的存在”包括确定存在的某物的量以及确定该物是否存在。本申请中采用的某些缩写包括以下:AR:急性排斥;AZA:硫唑嘌呤;BKV:BK病毒;CMV:巨细胞病毒;CSA:环孢菌素A;DSA:供体特异性抗体;EBV:埃巴病毒;FDR:假发现率;FK:FK506;HCT:血细胞比容;LRD:活体亲属供体;MMF:麦考酚酸吗乙酯;PBL:外周血白细胞;PAM:微阵列预测分析;PRA:板反应性抗体;Q-PCR:定量实时聚合酶链反应;ROC:接收器工作特性;SAM:微阵列显著性分析;STA:稳定的;SNS:NIH-CCTPTU01资助的随机化多中心儿科肾移植物的患者的基于类固醇对比无类固醇的移植研究(SNS01);WBC:白细胞。附图简述图1.研究设计概述。本研究划分为2个具体部分:在研究的部分1中:我们在3种不同的微阵列平台,即Affymetrix、Agilent和cDNA阵列上进行了外周血样品的代表性微阵列分析。通过将转录物定位至人类基因组织(HUGO)基因名称比较从3种平台产生的阵列数据。使用共同的显著性阈值(FDR<10%),对每个数据集进行适当的标准化程序,然后进行SAM分析以鉴定AR中显著调节的基因。525种基因是跨3种平台差异表达的AR特异性基因中共同的。选择32基因-集用于选自用于微阵列的样品中的34种样品的初步验证(验证集)。在测试的32种基因中,10种最显著的基因(p<0.03)在42个独立的样品(确认集1)中进行进一步确认。使用来自确认集1的5种最显著的基因的表达产生回归模型。然后将这一模型应用于64个样品的第二独立集(确认集2)用于真实的AR分类。在该研究的部分2中,我们对AR之前(preAR;n=27)和AR之后(postAR;n=30)收集的配对血液样品进行纵向5-基因Q-PCR分析,其中将回归模型应用于57个系列AR样品。图2.5基因-集的基因表达的验证和确认。外周血样品阵列跨共同的525基因-集的聚类显示样品按诊断表型聚类。这里显示了在Affymetrix阵列上运行的59个样品的聚类(图2A);跨在所有3种阵列平台上差异表达的525种重叠基因观察到样品按表型聚类(参见图5),而与样品采集、加工或多个临床混淆因素无关。样品跨525的基因按表型(AR或STA)聚类。这里仅显示了在Affymetrix阵列上运行的样品的代表性聚类数据。显示了选择的10基因-集的总结表达,如在其中一种阵列平台(Affymetrix)上测量的(图2B)。显示了全血样品中的Affymetrix微阵列数据的SAM分析的倍数变化和q评分。显示了表达Q-PCR样品的验证集的同样10个基因的表达(图2C)。Q-PCR的倍数变化是AR和STA样品之间的平均差异;Q-PCR表达差异的显著性通过T检验确定,其中p<0.05视为显著的。在血液样品的独立确认集(确认集1)中,显示了最显著的5个基因的表达。未在阵列分析中使用的新的血液样品同样通过跨5种基因的表型(AR或STA)分离(图2D)。确认集1中使用的样品的5种基因的倍数变化和p值显示于图2E。图3.接收器工作特性(ROC)曲线。使用逻辑回归模型分析,从独立样品(确认集1)的5基因Q-PCR表达数据产生预测模型。通过ROC评分=95.2%显示该模型的特异性和灵敏度。将回归模型应用于独立样品集(确认集2),其中5基因的表达明显地将AR与STA分离(非监督聚类),并且当与STA比较时,差异表达的5基因在AR中是显著不同的(p<0.02).图4.在临床移植物功能障碍之前通过5基因-集血液采样预测急性排斥。将回归模型应用于移植后前两年的不同时间在STA样品集的患者中顺序采集的样品(图4A),以评估在移植后不同时间预测为AR的概率。STA样品分组为在移植后0至3个月内、3至6个月内、6至12个月内和12至24个月内采集的样品。每个血液样品具有配对的活检以证实血液样品采集时移植物中AR的不存在。使用肾移植后不同时间的5基因-集的协调表达计算所有STA样品的AR概率的平均值和标准偏差。如所见的,任何STA样品在移植后任何时间被预测为AR的可能性少于50%。存在2个错误分类的STA样品(具有58%的AR概率评分的S99,和具有72%的AR预测评分的S88;参见图9)。具有错误分类的STA样品的两个患者在血液采样6个月内显示发展活检证明的AR。在右图(图4B)中,显示了活检证明AR时采集的血液样品、以及在AR样品之前(preAR)1-3个月内和3-6个月内采集的样品(作为协议样品采集的一部分)的AR概率的平均值和标准偏差。如所见的,血液样品分类为AR的概率(一般为75-100%)与AR的活检诊断强烈一致。根据AR诊断强化免疫遏制(类固醇脉冲或抗体)后,AR预测概率下降,证明5基因-集特征的AR预测概率通过增强的免疫遏制降低。AR集中所有样品的AR预测概率在所有preAR、AR和postAR样品中显著高于任何STA样品(p<0.001),表明发展AR的患者可比移植后从未发展AR的患者具有更高的免疫活化阈值。图5提供了显示跨样品制备(A)或跨不同的微阵列平台(B)的每个发现平台内的AR显著基因和如通过SAM(q<10%)确认的重叠显著基因的Venn图。重叠的525基因(标双下划线的)与STA样品相比在AR中受到统计学显著的(超几何检验;p<0.001)调节,并且是AR共有的,不管与不同阵列平台的杂交是否使用采集外周血的不同方法。图6A显示了基因列表和使用Q-PCR测定的基因的ABI探针ID。图6B显示了跨验证集(17AR、17STA)中的34个血液样品通过Q-PCR测定的10-基因的标准化表达值。图7是参考文献中指明在AR中差异表达的3个基因的跨验证集的34个样品的阵列和Q-PCR的基因表达值的总结。图8显示了通过Q-PCR的跨确认集1中的42个独立血液样品(21AR和21STA)的10基因的标准化表达值。图9显示了通过Q-PCR的跨确认集2的64个独立血液样品(32AR和32STA)的5基因的标准化表达值。图10比较了跨10基因集(上图)和5基因集(下图)的AR的不同分类模型。图11显示了对所有Q-PCR实验检查的18个人口统计学和临床混淆因素。图12显示了确定图11中的18个参数作为5-基因集表达的潜在混淆因素的任何影响的Pearson关联和t-检验(如果需要)的结果。图13是图12中的结果的图形表示。图14显示了活检Banff等级、小管周C4d阳性和体液与细胞AR和AR预测概率之间的关联。图15.图A显示AR发作之前和之后6个月内采集的配对样品的AR预测概率。图B显示比较AR时的AR预测评分对比preAR和postAR评分的p值。图C是图A中的数据的图形表示。图D是显示STA样品中的AR概率的图。图E显示图D所示的图中使用的数据。图16显示使用Ingenuity系统(IPA;2008)的跨3个阵列平台的重叠525基因的生物学相关性分析。图17是图16中显示的信息的图形表示。图18显示交叉引用进行的样品和测定的表格。具体实施方式描述提供了监测具有移植物的受治疗者的急性排斥(AR)反应,例如以预测、诊断、和/或表征AR反应的方法。在实践该主题方法中,评估至少一种基因在来自受治疗者的样品例如血液或活检样品中的表达水平,例如核酸和/或蛋白水平,以监测该受治疗者。还提供了在实践该主题方法中有用的组合物、系统、试剂盒和计算机程序产品。所述方法和组合物可用于多种应用。在更详细地描述本发明之前,应理解本发明不限于所描述的具体实施方式,因为这些实施方式当然可以变化。还应理解,本文使用的术语仅是出于描述特定实施方式目的,而不意图限制,因为本发明的范围将仅受所附权利要求的限制。当提供值的范围时,应理解该范围的上限和下限之间的每个中间值(除非上下文另外清楚指明,至下限单位的十分之一)和在所称范围内的其它声称值或中间值涵盖在本发明内。这些更小范围的上限和下限可独立地包括在更小的范围内,并且也涵盖在本发明内,符合所称范围内任何特别排除的限值。当所称范围包括一个或两个限值时,排除所包括的限值中的任一个或两个的范围也包括在本发明中。某些范围在本文中呈现时数值前有术语“约”。术语“约”在本文用于提供对其前的准确数字、以及接近或近似于该术语前的数字的数字的文字支持。在确定数字是否接近或近似于具体陈述的数字时,接近或近似的未陈述的数字可以是在其所呈现的上下文中,提供所述具体陈述的数字的实质等同的数字。除非另外定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员理解的含义相同的含义。虽然与本文所描述的方法和材料相似或等同的任何方法和材料也可用于实践或测试本发明,但是现在描述了代表性的示例方法和材料。本说明书中引用的所有出版物和专利通过引用并入本文,如同具体和单独地指明每个单独的出版物或专利通过引用并入,并通过引用并入本文以结合所引用的出版物公开和描述所述方法和/或材料。任何出版物的引用是因为其在申请日之前公开,而不应解释为承认本发明没有资格因为先前的发明而早于这样的出版物。另外,所提供的出版日期可能与实际出版日期不同,这可能需要独立地确认。应注意,如本文和所附权利要求中所用的,除非上下文另外清楚指明,单数形式“一个”、“一种”和“该”包括复数指代物。还应注意的是,权利要求可撰写为排除任何任选的要素。因此,此声明意图充当结合引用权利要求要素使用诸如“仅仅”、“仅”和类似术语的排除性术语、或使用“负”限制的先行基础。如本领域技术人员阅读本公开后将明白的,本文描述和例证的每个单独实施方式具有离散的组件和特征,这些组件和特征可容易地与其它多种实施方式的任何实施方式的特征分离或组合,而不背离本发明的范围或精神。任何所述方法可按所述的事件顺序或以逻辑上可行的任何其它顺序进行。如上所概括的,本发明涉及在受治疗者中监测AR反应的方法、以及用于实践该主题方法的试剂和试剂盒。在进一步描述本发明时,首先描述了该主题方法,然后综述了用于实践该主题方法的试剂和试剂盒。监测急性排斥反应的方法如以上所综述的,本发明提供用于监测已接受移植物的受治疗者的AR反应的方法。在某些实施方式中,监测受治疗者以预测是否将发生AR反应,其中所述方法可在AR反应发生前6到3个月预测AR。在某些实施方式中,监测受治疗者以确定是否存在持续的AR反应。在某些实施方式中,监测受治疗者以表征发生或已发生的AR反应,例如来确定先前的AR反应的严重度和/或类别,例如AR反应是否为/曾为类固醇抗性AR反应。在某些实施方式中,本发明包括确定AR反应中被排斥组织的身份的方法。本发明的方面还包括用于确定已接受移植物例如同种异体移植物的受治疗者的免疫遏制方案的方法。因此,本发明的某些实施方式提供评估,例如以预测的方式,包括移植物的受治疗者中的移植物存活的方法。例如,主题方法可用于确定受治疗者是否将发动针对移植物的AR反应,在缺乏有效的免疫遏制干预下,该AR反应将造成移植物组织的丧失。因此,本发明提供评估移植患者或受治疗者中的移植物是将存活或将丧失的方法。在某些实施方式中,所述方法可被视为确定移植受治疗者是否具有移植物存活表型即其中移植物将存活的表型的方法。移植物存活表型是特征为长期移植物存活的存在的表型。“长期”移植物存活意指在当前取样之外移植物存活至少约5年,尽管发生AR的一次或多次先前发作。在某些实施方式中,确定已发生至少一次急性排斥(AR)发作的患者的移植物存活。因此,这些实施方式是确定或预测AR后的移植物存活的方法。在移植疗法例如免疫遏制疗法上下文的某些实施方式中,确定或预测移植物存活,其中免疫遏制疗法是本领域已知的。在又其它的实施方式中,提供了确定急性排斥的类别和/或严重度(而不仅是其存在)的方法。如移植领域已知的,移植物器官、组织或细胞可以是同种的或异种的,以致移植物可以是同种异体移植物或异种移植物。感兴趣的器官和组织包括但不限于:皮肤、心脏、肾、肝、骨髓和其它器官。在实践主题方法中,测定受治疗者或患者样品,例如细胞或其集合,例如,组织,以监测宿主的AR反应。因此,主题方法的第一步是从感兴趣的患者,即受治疗者或患者具有至少一种移植物例如同种异体移植物的患者,获得合适的样品。样品来源于任何初始的合适来源,其中感兴趣的样品来源包括但不限于许多不同的生理来源,例如脑脊液(CSF)、尿、唾液、泪液、组织来源样品例如匀浆物(诸如移植的组织或器官的活检样品(包括但不限于肾、心脏、肺活检)),和血液或其衍生物。在某些实施方式中,患者样品的合适的初始来源是血液样品。因此,这些实施方式的主题测定中采用的样品一般是血液来源样品。血液来源样品可来自全血或其级分,例如血清、血浆、细胞级分等,其中在某些实施方式中样品来源于从全血收获的血液细胞。作为样品来源特别受关注的是外周血单核细胞/淋巴细胞(PBMC/PBL)。可采用获得此类样品的任何方便方案,其中合适的方案是本领域熟知的(如全血样品的密度梯度分级分离),并且代表性方案报道于下面的实验部分。在实践主题方法中,测定样品以获得选自表1的一种或多种基因的表达水平评估,例如表达谱,其中术语表达谱用于广泛地包括基因组表达谱,例如感兴趣的一种或多种基因的核酸转录物例如mRNA的表达谱,或蛋白质组表达谱,例如一种或多种蛋白的表达谱,其中蛋白/多肽是所述感兴趣的一种或多种基因的表达产物。因此,在某些实施方式中,仅评估表1中的1种基因的表达水平。在又其它实施方式中,评估表1中的两种或更多种基因例如表1中的3、4或全部5种基因的表达水平。在某些实施方式中,还评估表1中列出的那些之外的一种或多种另外的基因的表达水平,其中在某些实施方式中,所述另外的基因选自表2中列出的那些。这里应注意的是,包括评估表1和2中的基因的任何组合的表达水平的表达谱可用于监测在移入的组织中已发展或易发展AR反应的受治疗者,包括评估表1和2中列出的全部10种基因的表达。表1.表达水平可用于监测具有同种异体移植物的受治疗者中的AR的5种基因表2.表达水平可用于监测具有同种异体移植物的受治疗者中的AR的5种另外的基因基因符号基因名称NCBI基因ID编号CFLAR半胱天冬酶8和FADD-样凋亡调节蛋白8837IFNGR1干扰素γ受体13459ITGAX整连蛋白αX3687RNF130环指蛋白13055819RYBP环1和YY1结合蛋白23429在最广泛的意义上,表达评估可以是定性的或定量的。因此,当检测是定性的时,该方法提供靶分析物例如核酸或其它表达产物(如蛋白)是否存在于测定的样品中的读数或评估,例如评价。在又其它实施方式中,该方法提供靶分析物是否存在于测定的样品中的定量监测,即评估或评价测定的样品中靶分析物例如核酸的实际量或相对丰度。在这样的实施方式中,定量检测可以是绝对的,或如果所述方法是检测样品中两种或更多种不同的分析物例如靶核酸的方法,定量检测可以是相对的。因此,当用于定量样品中的靶分析物例如核酸的上下文中,术语“定量”可指绝对或相对定量。绝对定量可通过包括一种或多种对照分析物的已知浓度并将靶分析物的检测水平与已知的对照分析物进行参比(如通过产生标准曲线)来实现。可选地,相对定量可通过比较两种或更多种不同的靶分析物的检测水平或量以提供所述两种或更多种不同的分析物的每一种的相对定量,例如相对于彼此。此外,相对定量可使用对照或参考样品确认,如基于阵列的测定以及定量PCR/RT-PCR分析(在下文进一步详细描述)中通常所进行的。如以上所述,表1和2中显示了可用于监测受治疗者的AR反应的基因/蛋白、即在已具有、正在具有或将具有AR发作的受治疗者中差异表达或以不同水平存在的基因/蛋白。应注意,关于这些表格中的基因,详细的信息包括准确的序列信息可通过位于网站http://www.ncbi.nlm.nih.gov的NCBIEntrez基因数据库确定。然后通过选择“基因”并搜索这些表格中列出的基因ID编号来获得每个基因的详细信息。在某些实施方式中,可测定表1和2中列出的那些之外的另外的基因,这些另外的基因包括表达水平/模式可用于确定AR反应的其它基因以及表达水平/模式可用于评估另外的移植特征的基因,所述另外的移植特征包括但不限于:受治疗者中的移植物耐受表型、血液中的慢性同种异体移植物损伤(慢性排斥);免疫遏制药物毒性或不良副作用,包括药物诱导的高血压;与肾病理学相关或导致受体年龄相关移植物接受的差异的年龄或体重指数相关基因;全血中的免疫耐受标志物;可能在移植结果中起作用的具有免疫调节作用的文献研究中发现的基因。此外,可评估其它阵列测定功能相关基因,例如用于评价样品质量(探针位置中的3’-至5’-偏好)、基于活检的研究中的采样误差、细胞表面标志物和标准化基因以校准杂交结果(这些类别中的示例性基因可见于2006年3月3号提交的美国专利申请第11/375,681号,该申请通过引用整体并入本文)。在某些实施方式中,评估另外的基因以确定已同种异体移植物的受治疗者是否具有移植物耐受表型,例如,如2008年8月18日提交的临时专利申请61/089,805中所述,该专利申请通过引用整体并入本文。移植物耐受表型意指受治疗者不排斥已被引入到该受治疗者中/上的移植物器官、组织或细胞。换言之,受治疗者耐受或维持已移植于其的器官、组织或细胞。检测的或鉴定的移植物耐受表型的特征是,其是在无免疫遏制疗法时发生的表型,即它存在于未经历免疫遏制疗法的受治疗者,从而未向宿主施用免疫遏制剂。在这些实施方式中,除了评估表1和2中的一种或多种基因以确定具有同种异体移植物的受治疗者中的AR反应之外,还评估选自下面的表3和4的一种或多种基因以确定受治疗者是否具有移植物耐受表型。表3和4中的基因的任何组合的评估可用于这样的实施方式中,包括评估表3和4中的一个表格或两个表格列出的全部基因的表达。表3:表达水平预测3种不同的受治疗者类别(HD对比TOL对比CAN)的28种基因的列表。表4:在3种类别(HD对比SP对比IN)中或向上或向下显著差异表达的基因列表(24种基因)。在某些实施方式中,获得的表达谱是基因组或核酸表达谱,其中确定样品中的一种或多种核酸例如感兴趣的基因的核酸转录物的量或水平。在这些实施方式中,测定以产生诊断方法中采用的表达谱的样品是为核酸样品的样品。核酸样品包括多种不同核酸或不同核酸的群体,所述不同核酸包括诊断的细胞或组织的感兴趣的表型决定基因的表达。核酸可包括RNA或DNA核酸,例如、mRNA、cRNA、cDNA等,只要样品保留了获得所述核酸的宿主细胞或组织的表达信息。可以本领域已知的许多不同方式制备样品,例如通过从细胞中分离mRNA,其中原样使用所分离的mRNA、扩增所分离的mRNA、采用所分离的mRNA制备cDNA、cRNA等,如差异表达领域已知的。在某些实施方式中,使用标准方案从获自诊断的受治疗者的细胞或组织制备样品,例如经由组织的活检,其中可产生这类核酸的细胞类型或组织包括其中存在待确定的表型的表达模式的任何组织,包括但不限于外周血淋巴细胞等,如以上所综述的。可使用任何方便的方案从初始核酸样品产生表达谱。虽然已知产生表达谱的许多不同方式,诸如差异基因表达分析领域所采用的那些,但是产生表达谱的一个代表性的和方便的方案类型是基于阵列的基因表达谱产生方案。在某些实施方式中,此类应用是其中采用核酸阵列的杂交测定,所述核酸阵列显示待产生的谱中测定的/表征的每个基因的“探针”核酸。在这些测定中,首先从测定的初始核酸样品制备靶核酸样品,其中制备可包括用标记物例如信号产生系统的成员标记靶核酸。制备靶核酸样品后,将样品与阵列在杂交条件下接触,由此在与连接至阵列表面的探针序列互补的靶核酸之间形成复合物。然后定性地或定量地检测杂交的复合体的存在。可用于产生主题方法中所用的表达谱的特异性杂交技术包括描述于美国专利No5,143,854;5,288,644;5,324,633;5,432,049;5,470,710;5,492,806;5,503,980;5,510,270;5,525,464;5,547,839;5,580,732;5,661,028;5,800,992(这些专利的公开内容通过引用并入本文);以及WO95/21265;WO96/31622;WO97/10365;WO97/27317;EP373203;和EP785280的技术。在这些方法中,如上所述地将“探针”核酸的阵列与靶核酸接触,所述阵列包括测定其表达的每个表型决定基因的探针。接触在杂交条件例如严格杂交条件下进行,然后除去未结合的核酸。所得的杂交核酸的模式提供关于所探测的每个基因的表达的信息,其中表达信息是关于基因是否表达,以及通常地以什么水平表达,其中表达数据即表达谱(如以转录组的形式)可以是定性和定量两方面。可选地,可采用用于定量样品中的一种或多种核酸的水平的非基于阵列的方法,包括定量PCR、实时定量PCR和类似方法。(有关实时PCR的一般细节,参见Real-TimePCR:AnEssentialGuide(实时PCR:基础指南),K.Edwards等人编辑,HorizonBioscience,Norwich,U.K.(2004))。当表达谱是蛋白表达谱时,可采用任何方便的蛋白定量方案,其中确定样品中一种或多种蛋白的水平。代表性方法包括但不限于:蛋白质组阵列、流式细胞术、标准免疫测定(如ELISA测定、蛋白质印迹)、蛋白活性测定包括多重蛋白活性测定等。从测定的样品获得表达数据或表达谱之后,分析表达谱。在某些实施方式中,分析包括将表达谱与参考或对照谱进行比较以监测样品所获自/来源于的受治疗者的AR发作。如本文所用的术语“参考”和“对照”意指用于解释给定患者关于AR反应的表达特征的基因表达的标准化模式或某些基因的表达水平。参考或对照谱可以是获自已知具有期望表型例如具有AR表型的细胞/组织的谱,并因此可以是正参考或对照谱。此外,参考或对照谱可以来自已知不具有期望的表型例如AR阴性表型(如STA或非移植的对照)的细胞/组织,并因此是负参考或对照谱。在某些实施方式中,将获得的表达谱与单一参考/对照谱进行比较以获得关于AR反应的信息。在又其它实施方式中,将获得的表达谱与两种或多种不同的参考/对照谱进行比较以获得关于测定的细胞/组织的AR表型的更深入的信息。例如,可将获得的表达谱与正参考谱和负参考谱进行比较以获得关于细胞/组织是否具有特定AR表型的确认信息。获得的表达谱和所述一种或多种参考/对照谱的比较可使用任何方便的方法进行,其中许多方法是阵列领域的技术人员已知的,例如通过比较表达谱的数字图像、通过比较表达数据的数据库等。描述比较表达谱的方式的专利包括但不限于美国专利第6,308,170和6,228,575号,其公开内容通过引用并入本文。比较表达谱的方法也在以上描述。比较步骤得到关于获得的表达谱与对照/参考谱如何相似或不相似的信息,采用所述相似/不相似信息来确定测定的细胞/组织的表型并由此提供监测受治疗者中的AR的方法。例如,获得的基因表达谱与来自经历活性AR反应的受治疗者的对照样品的基因表达谱的相似性表明测定的细胞/组织是来自经历AR的受治疗者。同样,获得的基因表达谱与来自不曾具有(或不具有)AR发作(如STA)的受治疗者的对照样品的基因表达谱的相似性表明测定的细胞/组织来自未经历AR的受治疗者。取决于与获得的表达谱进行比较的参考/对照谱的类型和性质,以上比较步骤产生关于测定的细胞/组织的许多不同类型的信息。因此,以上比较步骤可产生持续的AR反应的正/负确定。在许多实施方式中,使用关于测定的细胞/组织的以上获得的信息来预测受治疗者是否将经历AR反应,例如,在距收获样品的时间3到6个月内,和/或来表征AR反应,例如AR反应是类固醇抗性的或敏感的。在某些实施方式中,AR的确定/预测可与移植物和其功能的另外特征的确定相联合。例如,在某些实施方式中,技术人员可测定其它移植物相关的病理学,例如慢性排斥(或CAN)和/或药物毒性(DT)(参见,例如2006年3月3日提交的美国专利申请第11/375,681号,其通过引用整体并入本文)。主题方法还可用于药物基因组学应用。在这些应用中,首先根据本发明监测受治疗者/宿主/患者的AR,然后至少部分基于监测结果使用确定的方案进行治疗。例如,可使用方案诸如前面章节中描述的诊断方案评估宿主的AR存在或不存在。然后可使用利用监测步骤的结果确定其合适性的方案治疗受治疗者。例如,当预测受治疗者在接下来3到6个月内具有AR反应时,可调节免疫遏制疗法,例如增加或改变药物,如AR治疗/预防领域已知的。同样,当预测受治疗者没有目前和近期的AR时,可减少免疫遏制疗法以降低DT的可能。在实践主题方法中,通常在接受移植物或移植体后监测受治疗者的AR。可在移植接受后筛选受治疗者一次或连续筛选受治疗者,例如每周一次、每月一次、两个月一次、半年一次、每年一次等。在某些实施方式中,在AR发作发生之前监测受治疗者。在某些其它实施方式中,在AR发作发生之后监测受治疗者。主题方法可用于许多不同类型的移植受治疗者。在许多实施方式中,受治疗者在哺乳动物类别内,包括以下目:食肉动物(如狗和猫)、啮齿类动物(如小鼠、豚鼠和大鼠)、兔类(例如兔)和灵长类动物(如人、黑猩猩和猴)。在某些实施方式中,动物或宿主,即受治疗者(在本文也称为患者)是人。所述方法可用于监测许多不同类型的移植物。感兴趣的移植物包括但不限于:移植的心脏、肾、肺、肝、胰腺、胰岛、脑组织、胃、大肠、小肠、角膜、皮肤、气管、骨、骨髓、肌肉、膀胱或其部分。表型决定基因的表达谱的数据库还提供了AR反应的表达谱的数据库。此类数据库将通常包括指示以下的一种或多种的来自移植受体的特定组织的表达谱:近期AR事件(在3到6个月内)、持续的AR反应、先前的AR反应和AR反应的特征(如类固醇抗性/敏感的AR反应)。可以多种介质提供表达谱和其数据库以利于其使用(如以用户可访问/可读格式)。“介质”指含有本发明的表达谱信息的产品。本发明的数据库可记录在计算机可读介质上,例如可由采用计算机的用户直接读取和访问的介质。此类介质包括但不限于:磁存储介质诸如软盘、硬盘存储介质和磁带;光存储介质诸如CD-ROM;电存储介质诸如RAM和ROM;和这些类别的组合诸如磁/光存储介质。本领域技术人员可容易地理解目前已知的任何计算机可读介质如何用于创建包括本发明数据库信息的记录的产品。“记录”指使用本领域已知的任何此类方法将信息存储在计算机可读介质上的过程。可基于用于访问存储信息的设备选择任何方便的数据存储结构。可使用多种数据处理程序和格式用于存储,例如字处理文本文件、数据库格式等。因此,主题表达谱数据库是用户可访问的,即数据库文件是以用户可读格式(如当用户控制计算机时,计算机可读格式)保存的。如本文所用,“基于计算机的系统”指用于分析本发明的信息的硬件设备、软件设备和数据存储设备。本发明的基于计算机的系统的最低硬件包括中央处理单元(CPU)、输入设备、输出设备和数据存储设备。熟练的技术人员可容易理解,目前可用的基于计算机的系统的任何一种适合用于本发明。数据存储设备可包括含有如上所述的本发明信息的记录的任何产品,或可访问此类产品的存储器访问设备。可使用多种结构格式的输入和输出设备来在本发明的基于计算机的系统中输入和输出信息,例如至和来自用户。输出设备的一种格式将拥有与参考表达谱的不同程度的相似性的表达谱排序。此类呈现形式为技术人员(或用户)提供了相似性的排序,并鉴定测试表达谱中包含的与一种或多种参考谱的相似性程度。试剂、系统和试剂盒还提供了用于实践一种或多种上述方法的试剂、系统和其试剂盒。主题试剂、系统和其试剂盒可有很大不同。感兴趣的试剂包括专门设计用于产生AR表型决定基因的表达谱的试剂,即由一种或多种试剂构成的基因表达评估元件。术语系统指试剂的集合,但是该集合是经过编译的,例如通过从相同或不同来源购买试剂的集合。术语试剂盒指一起提供例如销售的试剂的集合。这种试剂的一种类型是代表感兴趣的表型决定基因的探针核酸的阵列。许多不同的阵列形式是本领域已知的,其具有各种不同的探针结构、基质组成和连接技术(如点杂交阵列、微阵列等)。感兴趣的代表性阵列结构包括描述于以下的那些:美国专利No.5,143,854;5,288,644;5,324,633;5,432,049;5,470,710;5,492,806;5,503,980;5,510,270;5,525,464;5,547,839;5,580,732;5,661,028;5,800,992(这些专利的公开内容通过引用并入本文);以及WO95/21265;WO96/31622;WO97/10365;WO97/27317;EP373203;和EP785280。在某些实施方式中,阵列包括表1中所列的基因的至少一种的探针。因此,可采用表1中基因的任何组合的探针。因此,在某些实施方式中,阵列上代表的来自表1的基因的数目是至少2个、至少3个、至少4个、至少5个、至少8个或更多,包括表1中所列的全部基因。主题阵列可仅包括表1中所列的那些基因,或它们可包括未列在表1中的另外的基因,诸如表达模式可用于评估另外的移植特征的基因的探针,所述另外的移植特征包括但不限于:血液中的慢性同种异体移植物损伤(慢性排斥);免疫遏制药物毒性或不良副作用,包括药物诱导的高血压;与肾病理学相关或导致受体年龄相关移植物接受的差异的年龄或体重指数相关基因;全血中的免疫耐受标志物;可能在移植结果中起作用的具有免疫调节作用的文献研究中发现的基因;以及其它阵列测定功能相关基因,例如用于评价样品质量(探针位置中的3’-至5’-偏好)、基于活检的研究中的采样误差、细胞表面标志物和标准化基因以校准杂交结果;和类似特征。当主题阵列包括此类另外的基因的探针时,在某些实施方式中,代表的以及不直接或间接与移植相关的另外的基因的数目%不超过约50%,通常不超过约25%。在包括另外的基因的某些实施方式中,集合中的绝大多数基因是移植表征基因,其中绝大多数意指至少约75%、通常至少约80%和有时至少约85%、90%、95%或更高,包括其中集合中的基因100%为表型决定基因的实施方式。移植表征基因是表达可用来以某种方式表征移植功能(例如排斥的存在等)的基因。特别定制用于产生表型决定基因的表达谱的另一种类型的试剂是设计为选择性扩增此类基因(如使用基于PCR的技术,例如实时RT-PCR)的基因特异性引物的集合。基因特异性引物和其使用方法描述于美国专利第5,994,076号,其公开内容通过引用并入本文。特别感兴趣的是具有以下基因的引物的基因特异性引物的集合,所述基因为表1所列的基因的至少1个,通常为这些基因中的多个基因,例如至少2、4、8或更多个。在某些实施方式中,来自表1的所有基因在该集合中具有引物。主题基因特异性引物集合可仅包括表1中所列的那些基因,或它们可包括未列在表1中的另外的基因的引物,诸如表达模式可用于评估另外的移植特征的基因的探针,所述另外的移植特征包括但不限于:血液中的慢性同种异体移植物损伤(慢性排斥);免疫遏制药物毒性或不良副作用,包括药物诱导的高血压;与肾病理学相关或导致受体年龄相关移植物接受的差异的年龄或体重指数相关基因;全血中的免疫耐受标志物;可能在移植结果中起作用的具有免疫调节作用的文献研究中发现的基因;以及其它阵列测定功能相关基因,例如用于评价样品质量(探针位置中的3’-至5’-偏好)、基于活检的研究中的采样误差、细胞表面标志物和标准化基因以校准杂交结果;和类似特征。当主题阵列包括此类另外的基因的探针时,在某些实施方式中,代表的以及不直接或间接与移植相关的另外的基因的数目%不超过约50%,通常不超过约25%。在包括另外的基因的某些实施方式中,集合中的绝大多数基因是移植表征基因,其中绝大多数意指至少约75%、通常至少约80%和有时至少约85%、90%、95%或更高,包括其中集合中的基因100%为表型决定基因的实施方式。本发明的系统和试剂盒可包括上述阵列和/或基因特异性引物集合。所述系统和试剂盒还可包括各种方法中采用的一种或多种另外的试剂,诸如用于产生靶核酸的引物、dNTP和/或rNTP,其可以是预混合的或单独的,一种或多种独特标记的dNTP和/或rNTP,诸如生物素化的或加Cy3或Cy5标签的dNTP、具有不同散射谱的金或银颗粒,或其它合成后标记试剂,诸如荧光染料的化学活性衍生物,酶,诸如反转录酶、DNA聚合酶、RNA聚合酶和类似酶,各种缓冲介质例如杂交和洗涤缓冲液,预制造的探针阵列、标记的探针纯化试剂和组分,像旋转柱等,信号产生和检测试剂,例如链霉亲和素-碱性磷酸酶轭合物、化学荧光或化学发光底物和类似试剂。主题系统和试剂盒还可包括表型确定元件,在许多实施方式中,该元件是可采用的参考或对照表达谱,例如通过合适的计算设备来基于“输入”表达谱,例如已使用上述基因表达评估元件确定的表达谱,确定AR表型。代表性的表型确定元件包括如以上所述的表达谱例如参考或对照谱的数据库。除了以上组分之外,主题试剂盒还将包括用于实践主题方法的说明。这些说明可以多种形式存在于主题试剂盒,其中的一种或多种可存在于试剂盒。这些说明可存在的一种形式是作为合适介质或基质上的打印信息,例如其上打印了信息的一张或多张纸、在试剂盒的包装中、在包装插入物中等。另一种工具可能是其上已记录了信息的计算机可读介质,例如磁盘、CD等。可存在的另一工具是网址,其可用于经由互联网访问移动站点上的信息。任何方便的工具可存在于试剂盒中。通过例证方式提供下列实施例,而不意在限制。实验实施例I方法研究设计收集此研究中提供外周血样品的所有受体的患者人口统计学和临床数据。不同研究集(验证集、确认集1和确认集2)的平均值±标准偏差数据提供于图11和表1(下面)。在每个样品集内,AR和STA表型具有匹配的人口统计学。为了询问基于血液的基因用于AR诊断的表现而不考虑移植后的时间,故意选择样品研究集具有不同的平均移植后时间。表1该研究作为3个项目的总和进行(图1):在第一个项目中,我们进行了以2.5ml全血样品(n=106)或以5ml血液(n=16)收集以分离外周血白细胞(PBL)的122个外周血样品的横向微阵列分析7。在单一时间点收集血液样品,同时进行活检,其中证实急性排斥10存在(60个AR样品)或不存在(62STA样品)。用于阵列杂交的样品制备按照生产商的建议方案进行。将样品与3个微阵列平台之一杂交:Affymetrix(n=75,54KHGU133Plus2阵列)、Agilent(n=26,44K全人基因组寡核苷酸阵列)或LymphochipcDNA阵列(n=21,32KcDNA克隆)。对每个阵列平台应用适当的探针检测和标准化方法。样品制备、阵列杂交和分析11121314的细节在补充方法(参见下文)中提供。所有微阵列数据文件是在登录号GSE14067下在GEO中可获得的。在第二个项目中,进行Q-PCR分析以验证和确认选自项目1的阵列研究的基因。使用TaqMan基因表达测定产品(AppliedBiosystems,FosterCity,CA)通过Q-PCR测量每个血液样品中选择的候选基因的信使RNA的表达。选择32个基因用于先前用于微阵列的34个样品(17AR、17STA;验证集)中的Q-PCR验证(参见补充方法/Q-PCR候选基因选择标准),留下足够数量和质量的残留RNA。在32个基因中,选择10个最显著的基因用于在42个独立样品(21AR、21STA;确认集1)和另外的64个独立样品(32AR、32STA;确认集2)上的确认。我们对获自确认集1的10基因-集表达值应用了多种分类模型15,包括线性判断分析、5种不同的Bayesian模型、多层感知和逻辑回归(多项式和线性)模型。使用确认集1建立这些模型中的每一个,并在确认集2上进行测试以评估它们的灵敏度、特异性和准确度。使用10基因-集中的5个基因的多项式逻辑回归模型产生了最佳的总体表现。10基因中每个基因的引物列表、它们的相应ABI探针ID、10个最显著的基因通过Q-PCR的表达和使用的所有分类模型的比较均提供在图7至10。在第三个项目中,我们对已系列采集外周血样品的40名患者应用用于AR预测建模的5-基因AR诊断模型,所述外周血样品是在AR发作之前(preAR;n=27样品)和/或之后(postAR;n=30样品)采集的。对在AR发作之前1至6个月采集的配对的preAR血液样品进行纵向5-基因Q-PCR分析以估计AR损伤的预测,甚至在移植物功能未受到扰动时。这些是研究中未与移植物活检配对的仅有的样品。对AR发作治疗后1至6个月采集的postAR样品(与用来随访AR解析的移植物活检配对)进行相似的分析以询问强化的免疫遏制对5基因-集特征的影响(图1)。使用5-基因集的第一逻辑回归模型显示于以下方程中:使用最低5-基因集的第二逻辑回归模型显示于以下方程中:使用基于Stanford样品的最低5-基因集的逻辑回归模型显示于以下方程中:在以上每个方程中,θ是给定的样品属于分类(AR或STA)之一的预测概率。基于接收器工作特性(ROC)曲线,选择阈值θ=0.5用于最佳灵敏度和特异性,以确定预测类别为AR或STA表型。在确认集1中测试该模型,然后在确认集2中重新确认真实的AR分类。通过在测试集(确认集2)评估灵敏度、特异性、正预测值(PPV)和负预测值(NPV)来评价模型的准确性。最后,在确认该模型用于AR诊断的稳健性之后,使用该模型对在AR之前和之后顺序采集的配对的血液样品预测AR概率。统计学和生物信息学分析使用学生t-检验建立AR和STA样品之间Q-PCR基因表达差异的显著性。假发现率(FDR)<10%的所有差异视为统计学显著的。按以下18个人口统计学和临床变量对加工用于Q-PCR确认研究的所有样品采集数据:移植后时间、受体年龄、受体性别、供体性别、供体来源、供体年龄、采样时的巨细胞病毒/CMV、埃巴病毒/EBV和BK病毒/BKV病毒血症、并发的细菌感染、供体特异性抗体(DSA)或板反应性抗体(PRA)的存在、诱导疗法的使用、维持类固醇使用、不同神经钙蛋白抑制剂药物(FK506或环孢菌素A/CSA)的使用、不同抗代谢物(麦考酚酸吗乙酯/MMF或硫唑嘌呤/AZA)的使用、血液采集时的白细胞(WBC)计数和血细胞比容(HCT)水平(图11)。SNSO1样品的数据通由PPD(DavidIkle)提供。如果需要,使用Pearson关联和t-检验以确定所述的18种参数作为潜在的混淆因素对5-基因集的表达的任何影响(图12)。由于大多数样品具有用于评估的配对活检,根据Banff评分等级(1=Banff评分≤1A;2=Banff评分≥1B)将样品划分为2组;对于C4d+,确定是否≥10%小管周毛细血管(PTC)具有C4d沉积物(图14)。跨平台525基因集的生物学意义使用以下来评估:PANTHER分类系统(http://www.pantherdb.org)和Ingenuity途径分析(IPA;http://www.ingenuity.com)(参见图16和17)。更多的信息提供于补充方法。结果通过跨平台微阵列分析的外周血中的AR显著基因通过将共同的和重叠的转录物定位至人类基因组织(HUGO)基因名称,交叉比较了从3个阵列平台产生的微阵列数据。因为每个阵列使用不同的基因集,这些基因集使用不同的探针ID表示,我们使用AILUN(http://ailun.stanford.edu)12来用现在的HUGO基因名称重新注释探针标识符(ID),这鉴定了所有3个平台共有的10,357个共同基因。我们对3个重新注释的阵列列表中的每一个应用具有假发现率<10%的共同显著性阈值的监督的、二类别非配对微阵列显著性分析(SAM11)分析。我们鉴定了在AR中显著差异表达的Affymetrix阵列上的9710个基因、Agilent阵列上的8642个基因和cDNA阵列上的2805个基因。虽然每个平台上有大量显著性基因,但是在所有3个平台上仅有525个基因差异表达(图5),而与血液样品采集程序无关。Q-PCR验证和确认(确认集1)选择32个基因用于已在阵列研究中也使用的34个样品(17AR、17STA)的初始Q-PCR验证。根据这一数据,10个最显著的基因(q<10%)在42个独立血液样品(确认集1;21AR、21STA)中进一步确认。这10个最显著的基因的表达倍数变化与阵列数据一致、具有相同方向的倍数变化并且Q-PCR比微阵列具有更高的信号(图1),并且通过10-基因集的Q-PCR表达数据的非监督聚类,样品分离为AR或STA表型(图2)。每个基因和每个样品的单独表达数据显示于图6B。对于从AR文献中选择的3个基因,FOXP316和GRZYB1718Q-PCR表达在AR中与在STA血液样品中相比增加(分别为p=0.001、p=0.03)(图7),即使这些基因不在Affymetrix微阵列的显著性基因列表中,并且在cDNA和Agilent平台上,PFN119和GRZYB二者在AR中相反分别是下调的,通过Q-PCR在AR和STA样品之间没有统计学差异。因此这3个基因无一用于进一步的交叉确认研究。交叉确认(确认集2)和用于AR分类的预测建模显示测试的10种分类模型(详细见图10)的最佳表现的多项式逻辑回归模型得到了具有高置信度的用于AR预测的最低5基因模型,当对确认集2的64个独立样品的Q-PCR数据进行检验时,ROC评分=95.2%。5基因-集表达显示优异的AR和STA类别分离(图3),具有高AR预测评分,100%灵敏度、93.6%特异性、94.1%正预测值(PPV)和100%负预测值(NPV)。仅有的错误分类涉及2个STA样品。两个错误分类的STA样品在该研究初始采样后4和7个月发展临床AR,暗示5基因-检验的AR预测可能比预测模型估计的更为稳健。评估用于AR诊断的5基因-集的人口统计学、临床和活检混淆因素为检查是否任何基线或采样时的人口统计学、临床或免疫遏制混淆因素可驱动5基因-集AR预测评分的分离,计算对18种不同的混淆因素(图11)采集的数据的Pearson关联系数,显示对5基因-集的表达没有混淆效应(最大值|r|=0.27)(图12和13)。通过t-检验,DUSP1和PSEN1在具有阳性DSA的患者中具有更高表达(p<0.01)。相似地,我们还检查了排斥的等级或类型对5基因-集的表达是否有影响(图14)。未发现5基因-集AR概率预测和Banff评分(r=-0.13)、体液对比细胞排斥(r=0.07)和小管周C4d+的存在或不存在(r=0.2)之间的关联(图14)。这些数据支持5基因-集在外周血中的协同表达可以高置信度诊断AR,而与患者特征和通常使用的免疫遏制选择、排斥时间或潜在的排斥损伤机制无关。在移植物功能障碍和临床指示的活检之前预测AR损伤我们将基于横向样品建立的AR回归模型应用于27个preAR血液样品(在活检证明AR发作之前、在任何临床移植物功能障碍之前1至6个月顺序采集),作为移植后系列血液采样方案的一部分。另外,还通过Q-PCR对在移植后1、3、6、12和24个月的活检方案时采集的、来自不曾具有任何AR的58个独特STA患者的70个系列血液样品进行谱分析以用于5基因-集的AR预测。如图4所示,在移植后不同时间点采集的STA样品的5-基因特征保持“静止”,具有低AR预测评分并且表达评分随移植后时间几乎没有变化(图4A)。但是,在AR患者组(图4B;preAR、AR和postAR患者)中,5基因-集的表达水平在排斥患者中处于显著(p<0.001)更高的水平(所有AR患者中>50%AR预测评分,对比所有STA患者<20%),即使是在AR发作前6个月。这一发现表明,经历AR发作的患者在移植后在其外周血中具有可在临床相关和活检证明的AR发作之前定量测量免疫活化谱。值得注意的是,排斥发作3个月内检查的血液样品的AR预测评分与AR时采集的样品是相等的(图4B),提供了潜在的窗口用于免疫遏制强化以减轻或治疗早期AR和/或发起更早的活检。当在AR时强化免疫遏制治疗时(在此研究中为类固醇推注或胸腺细胞免疫球蛋白),存在5-基因特征在接下来3个月的快速递减,而无论AR治疗药物如何(图4B)。图15提供了每组样品的平均AR概率及标准偏差和计算的肌酸酐清除20。讨论移植活检是目前AR诊断的黄金标准,但是受其侵入性本质、难于获得多个样品和经常仅在晚期组织损伤和临床移植物功能障碍存在鉴定AR的限制。目前没有可靠的血液测试可用于诊断和预测AR,因为许多临床混淆因素(包括全血样品中珠蛋白基因的过度表现)驱动表达变化7,并且在过去,稳健的基于血液的AR生物标志物鉴定已受到小样品量、实验差异7、并发感染和组织排斥损伤的潜在分子异质性1的阻碍。如以上所展示的,我们已鉴定了其在移植患者样品(如外周血)中的表达评估可用于监测AR反应的高度严格的基因-集。这一基因集评估方法证明了跨多种不同的混淆因素的准确性,所述混淆因素诸如样品制备、受体和供体人口统计学、受体年龄、移植后时间、免疫遏制使用或并发感染的差异。我们已在152个独立血液样品中确认了用于非侵入性AR诊断的最低5基因集。5-基因集的表达足够以高置信度水平在甚至临床移植物功能障碍之前3个月预测活检证明的AR。另外,与在非排斥者中相比,5-基因集的表达在排斥者中在活检证明AR发作之前多达7个月是差异调节的,表明5基因-集在血液中的差异调节可用作免疫活化和将来AR风险评价的尺度。因为5基因特征“标准化”为与具有强化免疫遏制的非排斥者STA患者中所见的那些更接近的水平,所以此基因-集的系列测量可充当免疫“晴雨表”以定义个体患者的免疫活化阈值来在临床移植物功能障碍许多个月之前预测AR。这是朝向移植受体中的个性化免疫遏制方案的重要且关键的步骤。参考文献1.SarwalM,ChuaMS,KambhamN等人MolecularheterogeneityinacuterenalallograftrejectionidentifiedbyDNAmicroarrayprofiling(通过DNA微阵列谱分析鉴定的急性肾同种异体移植物排斥中的分子异质性).NEnglJMed2003;349(2):125-38.2.FlechnerSM,KurianSM,SolezK等人Denovokidneytransplantationwithoutuseofcalcineurininhibitorspreservesrenalstructureandfunctionattwoyears(未使用神经钙蛋白抑制剂的新肾移植在两年时保持肾结构和功能).AmJTransplant2004;4(11):1776-85.3.KurianSM,FlechnerSM,KaoukJ等人Laparoscopicdonornephrectomygeneexpressionprofilingrevealsupregulationofstressandischemiaassociatedgenescomparedtocontrolkidneys(腹腔镜检查供体肾切除术基因表达谱分析揭示与对照肾相比应激和缺血相关基因的上调).Transplantation2005;80(8):1067-71.4.MorgunA,ShulzhenkoN,Perez-DiezA等人Molecularprofilingimprovesdiagnosesofrejectionandinfectionintransplantedorgans(分子谱分析改善了移植的器官中排斥和感染的诊断).CircRes2006;98(12):e74-83.5.HotchkissH,ChuTT,HancockWW等人Differentialexpressionofprofibroticandgrowthfactorsinchronicallograftnephropathy(慢性同种异体移植物肾病中促纤维化因子和生长因子的差异表达).Transplantation2006;81(3):342-9.6.ParkW,GriffinM,GrandeJP,CosioF,StegallMD.Molecularevidenceofinjuryandinflammationinnormalandfibroticrenalallograftsoneyearposttransplant(移植后一年正常的和纤维化的肾同种异体移植物中损伤和炎症的分子证据).Transplantation2007;83(11):1466-76.7.LiL,YingL,NaesensM等人Interferenceofglobingeneswithbiomarkerdiscoveryforallograftrejectioninperipheralbloodsamples(珠蛋白基因的干扰以及外周血样品中用于同种异体移植物排斥的生物标志物发现).PhysiolGenomics2008;32(2):190-7.8.DengMC,EisenHJ,MehraMR等人Noninvasivediscriminationofrejectionincardiacallograftrecipientsusinggeneexpressionprofiling(使用基因表达谱分析的心脏同种异体移植受体中排斥的非侵入性判断).AmJTransplant2006;6(1):150-60.9.GwinnerW.Renaltransplantrejectionmarkers(肾移植物排斥标志物).Worldjournalofurology2007;25(5):445-55.10.RacusenLC,SolezK,ColvinRB等人TheBanff97workingclassificationofrenalallograftpathology(肾同种异体移植物病理学的Banff97工作分类).KidneyInt1999;55(2):713-23.11.EfronB,TibshiraniR.Empiricalbayesmethodsandfalsediscoveryratesformicroarrays(用于微阵列的经验bayes方法和假发现率).GenetEpidemiol2002;23(1):70-86.12.ChenR,LiL,ButteA.AILUN:reannotatinggeneexpressiondataautomatically(AILUN:自动化重新注释基因表达数据).NatureMethods2007;4(11):InPress.13.Perez-IratxetaC,AndradeMA.Inconsistenciesovertimein5%ofNetAffxprobe-to-geneannotations(5%NetAffx探针-至-基因注释中随时间的不一致).BMCBioinformatics2005;6:183.14.HarbigJ,SprinkleR,EnkemannSA.Asequence-basedidentificationofthegenesdetectedbyprobesetsontheAffymetrixU133plus2.0array(AffymetrixU133plus2.0阵列上的探针集检测的基因的基于序列的鉴定).NucleicAcidsRes2005;33(3):e31.15.WittenIH,FrankE.DataMining:Practicalmachinelearningtoolsandtechniques(数据挖掘:实用机器学习工具和技术).第2版SanFrancisco:MorganKaufmann;2005.16.LiB,HartonoC,DingR等人Noninvasivediagnosisofrenal-allograftrejectionbymeasurementofmessengerRNAforperforinandgranzymeBinurine(通过测量尿中穿孔素和粒酶B的信使RNA的肾同种异体移植物排斥的非侵入性诊断).NEnglJMed2001;344(13):947-54.17.DugreFJ,GaudreauS,Belles-IslesM,HoudeI,RoyR.Cytokineandcytotoxicmoleculegeneexpressiondeterminedinperipheralbloodmononuclearcellsinthediagnosisofacuterenalrejection(急性肾排斥诊断中在外周血单核细胞中确定的细胞因子和细胞毒性分子基因表达).Transplantation2000;70(7):1074-80.18.SimonT,OpelzG,WieselM,OttRC,SusalC.SerialperipheralbloodperforinandgranzymeBgeneexpressionmeasurementsforpredictionofacuterejectioninkidneygraftrecipients(用于预测肾移植物受体中的急性排斥的系列外周血穿孔素和粒酶B基因表达测量).AmJTransplant2003;3(9):1121-7.19.VasconcellosLM,SchachterAD,ZhengXX等人Cytotoxiclymphocytegeneexpressioninperipheralbloodleukocytescorrelateswithrejectingrenalallografts(外周血白细胞中的细胞毒性淋巴细胞基因表达与排斥的肾同种异体移植物相关).Transplantation1998;66(5):562-6.20.SchwartzGJ,HaycockGB,EdelmannCM,Jr.,SpitzerA.Asimpleestimateofglomerularfiltrationrateinchildrenderivedfrombodylengthandplasmacreatinine(身高和血浆肌酸酐得出的儿童肾小球滤过率的简单估计).Pediatrics1976;58(2):259-63.补充方法患者和样品来自274名儿科和青少年肾同种异体移植物受体的274个独特的外周血样品采集于StanfordUniversity(n=193)和其它SNS01中心(n=81)(2002年至2007年)。所有血液样品是在匹配的临床指示的或方案移植物活检时获得的,所述活检用于将样品分类为急性排斥(AR;n=109)1,或如果不存在AR或其它显著的病变,则是稳定的(STA,n=108)。在将所有样品包括到此研究之前,由单一病理学家(NK)重新评估所有样品来证实急性排斥的诊断。在用于排斥的治疗强化之前获得AR样品。还在AR前(preAR,n=27)和在AR后(postAR,n=30)采集另外57个序列样品,并且还从STA患者的子集(n=70)中采集系列移植后血液样品。从所有受治疗者获得书面知情同意书。该研究得到StanfordInstitutionalReviewBoard和每个SNSO1中心的InstitutionalReviewBoard批准。样品采集、RNA提取、微阵列靶标制备和杂交外周血样品以全血(n=106)或外周血白细胞(PBL;n=16)形式采集。所有SNSO1样品作为全血采集;来自Stanford的样品在2002-2004年间是作为PBL采集的,而在2004-2007年间是作为全血或PBL采集的。对于从全血中提取的总RNA,2.5ml外周血采集在PAXgeneTM血液RNA管(PreAnalytiX,Qiagen)中,并使用PAXgene血液RNA试剂盒(PreAnalytiX,Qiagen)处理。对于从白细胞提取的RNA,5-10ml全血采集在肝素钠管中。通过以离心初步分离白细胞和裂解红细胞而回收白细胞2。使用RNeasyMidi试剂盒(QiagenInc,Valencia,CA)提取RNA。RNA浓度使用ND-1000(NanoDropTechnologies,Wilmington,DE)测量,并使用Agilent2100Bioanalyzer利用RNANanoChips(AgilentTechnologies,SantaClara,CA)评价RNA的完整性。RNA储存于-80℃直至进一步用于微阵列和Q-PCR。用于Affymetrix和Agilent阵列杂交的样品制备使用T7方案进行(T7),该方案采用通过使用T7-Oligo(dT)引物的单循环cRNA合成。对于Affymetrix阵列,根据生产商的建议,总计2μg总RNA用于合成cRNA作为最终产物。cRNA与HumanGenomeU133Plus2.0阵列(AffymetrixInc.SantaClara,CA)杂交。根据生产商的建议,100ng总RNA用于Agilent阵列杂交。扩增的和纯化的cRNA掺入有Cy5染料(测试样品)或Cy3-染料(与cDNA阵列中使用的相同的共同参考),将两种标记的样品的混合物应用到AgilentWholeHumanGenomeOligo微阵列44k或4x44k上。含有32,000cDNA克隆(12,400个已知的独特基因)的cDNA微阵列3使用成熟的方案进行处理,针对共同参考(来自多个肿瘤系的RNA池)在每个通道中使用2μgRNA。使用GenePix4000(AxonInstruments,UnionCity,CA)扫描杂交的Affymeterix和cDNA微阵列,并用GenePixPro软件包分析荧光图像。通过使用AgilentDNA微阵列扫描仪扫描Agilent载玻片。基因表达谱分析使用不同的标准进行不同阵列平台的探针检测。对于AffymetrixHG133plus2.0阵列,在计算和测量探针水平强度和质量后,使用dChip软件(DNA-ChipAnalyzer,www.dchip.org)将原始阵列数据Quartile-Quartile标准化,包括中值强度、探针集异常值百分比和单一探针异常值百分比。对于Agilent44k,对至少一种阵列应用log2红色通道/绿色通道>0.5的绝对值截留;数据在GeneSpring中标准化。对于LymphochipcDNA阵列,使用通道1强度/介质背景强度的平均值>1.5,和/或通道2强度/介质背景强度的标准化平均值)>1.5。数据在StanfordMicroarray数据库(Stanford)标准化。所有基因表达值转化为log2以用于进一步分析。基于将转录物(探针集)定位至人类基因组织(HUGO)基因名称来定位跨所有平台的独特基因。定量实时PCR(Q-PCR)用于Q-PCR的探针选自AppliedBiosystems(ABI)的每个基因的RefseqID。所用的探针的列表显示于图6A。首先从11μl的500ng总RNA转录cDNA,在1μl10mMdNTP和1μl300ng/μl随机六聚体中在65℃下变性15min。将7μlQ-PCR混合物[4μl5×结合缓冲液、1μl0.1MDTT、1μlSuperScriptIIIRT(Invitrogen)、1μlRNaseOUT(Invitrogen)]添加到最终20μl的变性RNA管。RT反应在PCR热循环仪中进行,在50℃持续60min,72℃持续15min,然后加入1μlRNaseH,在37℃持续30min,以将剩余的RNA模板消化掉。Q-PCR按照生产商的方案进行,但有改动。将cDNA稀释至1.25ng/μl。定量RT-PCR反应在384-孔板在含有4μlcDNA(5ng)、1μlTaqMAN探针和5μl2x基因表达主混合物缓冲液(ABI,FosterCity,CA)的10μl体积中进行。Q-PCR反应按生产商建议的循环条件(95℃,10min;40个循环:95℃,15s,60℃,30s)在ABI7700序列检测仪(AppliedBiosystems,FosterCity,CA)中运行。使用比较CT方法计算RNA表达的相对量。将表达值对平板上的18S核糖体RNA和对照样品(StratageneUniversalRNA)标准化。研究设计该研究作为3个项目的总和进行(图1):在第一个项目中,我们进行了以PAXgeneTM血液RNA管(PreAnalytiX,Qiagen)中的2.5ml全血样品(n=106)或以肝素钠管中的5ml血液(n=16)收集以分离外周血白细胞(PBL)的122个外周血样品的横向微阵列分析。对于此分析,在与其中急性排斥被确认为存在(60AR样品)或不存在(62STA样品)的活检匹配的单一时间点采集血液样品。将样品与3个微阵列平台之一杂交:Affymetrix(n=75,54KHGU133Plus2阵列)、Agilent(n=26,44K全人基因组寡核苷酸阵列)或LymphochipcDNA阵列(n=21、32KcDNA克隆)。通过将共同的和重叠的转录物定位至人类基因组织(HUGO)基因名称,交叉比较了从3个阵列平台产生的微阵列数据。使用微阵列显著性分析(SAM,4)以假发现率(FDR)<10%的共同显著性阈值鉴定每个平台上的显著性基因列表。我们鉴定了在所有3个平台上在AR中显著差异表达的525个共同基因。在第二个项目中,选择32个基因用于先前用于微阵列的34个样品(验证集)中的Q-PCR验证。在通过Q-PCR测试的32个基因中,选择最显著的10个基因用于在42个独立样品(确认集1)和另外的64个独立样品(32AR、32STA;确认集2)上的进一步确认。我们对确认集1中的10基因-集应用了多种分类模型,包括线性判断分析、5种不同的Bayesian模型、多层感知和逻辑回归(多项式和线性)模型。将这些模型中的每一个应用于64个样品的独立集(确认集2)以评估它们的灵敏度、特异性和准确度。使用10基因-集中的5个基因的多项式逻辑回归模型产生了最佳的总体表现。在第三个项目中,我们对已系列采集外周血样品的30名患者应用5-基因AR诊断模型以预测AR,所述外周血样品是在AR发作之前(n=27样品)和之后(n=30样品)采集的。对在AR发作之前1至6个月采集的配对的preAR血液样品进行纵向5-基因Q-PCR分析以估计AR损伤的预测,甚至在移植物功能未受到扰动时。这些是研究中未与移植物活检配对的仅有的样品。对AR发作治疗后1至6个月采集的样品(与用来随访AR解析的移植物活检配对)进行相似的分析以询问强化的免疫遏制对5基因-集特征的影响(图1)。项目1–跨多个微阵列平台发现AR特异性基因跨3个微阵列平台的外周血样品基因表达谱分析在274个独特外周血样品中,103个独特样品(47AR,56STA)与来自3个不同平台的122个微阵列的(60AR,62STA)杂交。在这103个外周血样品中,75个在AffymetrixHGU133plus2.0微阵列、26个在Agilent微阵列且21个在cDNA微阵列上杂交。出于质量控制目的,17个样品在2个或多个平台上杂交。对于在1个以上平台上杂交的样品,代表性跨平台关联如下所示:在cDNA和Agilent之间,r=0.6;在Affymetrix和Agilent之间,r=0.8(参见图18中显示的样品和测定的交叉参考)。微阵列显著性分析我们应用微阵列显著性分析(SAM4)来鉴定所有3个平台上差异表达的AR基因。在SAM分析之前,将基因表达值转化为log2。假发现率(FDR)<10%用作所有平台的阈值。使用此阈值,我们鉴定了在AR中显著差异表达的Affymetrix阵列上的5285个基因、Agilent阵列上的8642个基因和cDNA微阵列上的2805个基因(图5)。因为每个阵列平台使用不同的基因集,这些基因集使用不同的探针ID表示,我们使用AILUN(http://ailun.stanford.edu)5来用现在的Entrez基因ID重新注释探针标识符(ID)。使用Entrez基因ID,我们鉴定了在所有3个平台上差异表达的525个基因(图5)。在同一FDR下,当与Affymetrix和Agilent平台相比时,cDNA平台显示具有最少数目的显著性AR基因(数据未显示)。虽然这些研究显示仔细选择的表型的跨平台阵列比较是鉴定基因特异性特征的有力方法,但是跨所有平台的一部分重叠基因显示跨3个平台的相反的倍数变化,表明跨阵列平台的克隆ID可能存在潜在的问题67。本研究中选择用于确认的最可靠的基因是跨3个平台具有相同的倍数变化的那些。除了从微阵列分析中选择候选基因用于确认之外,我们包括了叉头框P3(FOXP3)、穿孔素(PFN1)和粒酶B(GRZYB)8910,因为之前报道这些基因在血液中在AR下是增加的。项目2–通过Q-PCR验证和确认AR特异性基因用于Q-PCR的候选基因选择标准本研究第二个项目的目的是使用Q-PCR证实从第一个项目获得的结果,并鉴定可用于AR特异性血液生物标志物的进一步确认研究的更小的基因集。我们基于以下标准从525个重叠基因中选择了32个基因:i)12个基因被选择作为跨所有3个平台的生物学相关并且差异表达的基因(上调的基因:IFNGR1、RNF130、PBEF1、ITGAX、RYBP、CFLAR、PSEN1;下调的基因:NKTR、GOLGA8A、IL32、MCM7和NFATC3),ii)17个基因被选择为在至少2个平台上以倍数变化>1.5和q<3%生物学相关并且差异表达(上调的基因:DUSP1、SLP1、IL8RAP、STAT3、F2RL1、FCGR1A、IL6R、PTPRC、STAT1、IL1RAP、TLR8、TNFAIP6;下调的基因:MAPK9、PHLDA1、PTPN11、ZP70、PLCG1),iii)基于先前公布的关于其作为基于血液的AR生物标志物的潜能的数据选择3个基因;穿孔素或PFN111,粒酶B或GRZYB1011和叉头框P3基因、FOXP38。通过Q-PCR的验证使用TaqMan基因表达测定产品(AppliedBiosystems,FosterCity,CA)在34个样品中(验证集;17AR、17STA)证实32个基因在AR中的表达。这些样品先前已在一种或多种阵列上运行,并基于剩余样品具有足够的RNA数量和质量的标准来选择样品。用于10个基因的每个基因的引物列表和它们相应的ABI探针ID提供于图6A。10个最显著的基因的表达显示于图6B。对于每个基因,当使用基因组DNA作为模板时,这些测定没有产生荧光信号,这证实了所述测定仅测量mRNA。核糖体RNA18s用作内源性RNA和cDNA质量对照。选择18s作为对照基因是基于在阵列实验中该基因跨AR样品以及在AR和STA样品之间具有恒定的基因表达。为了控制在不同日期进行的PCR之间的可能变异,在每次Q-PCR运行中还在UniversalHumanReferenceRNA评价所有基因的表达。测定是高度可重复的,对于在UniversalHumanReferenceRNA评价的每个基因,6次运行的变异系数小于0.18。Q-PCR在384-孔板中进行,每个基因表达测量以两个重复进行。使用比较CT方法计算RNA表达的相对量。除了确认微阵列结果之外,项目2的另一目的是细化可用于确认为独立患者样品中的AR生物标志物的更小的严格基因集的选择。我们从通过Q-PCR确认的32个基因中选择了10个最显著的基因。使用学生t-检验建立通过Q-PCR的AR和STA样品之间的基因表达差异的显著性。对于p<0.05,所有差异均视为统计学显著的。接下来在42个独立样品(确认集1;21AR,21STA)中通过Q-PCR确认这10个基因在AR中的显著表达差异(图8)。用于AR的分类建模为了证实血液AR诊断中最低基因集的最佳分类模型,我们对10-基因集12应用了10种不同的分类模型。所用的分类模型包括经由回归的分类(ClassificationViaRegression)、Bayesian模型的变体(NaiveBayes、MultinomialNaiveBayes、BayesNet等)、多层感知、逻辑回归(多项式和线性)和序列最小优化(sequentialminimaloptimization)。使用确认集1的Q-PCR数据训练这些模型中的每一个,并使用来自64个独立样品(确认集2;32AR、32STA)的Q-PCR数据对其进行重新确认(图9)。在10个分类模型中,使用5个基因(DUSP1、MAPK9、NKTR、PBEF1、PSEN1)的多项式逻辑回归模型表现最好(灵敏度=100%、特异性=93.8%、PPV=94.1%1、NPV=100%)。图10提供了使用的所有分类模型的比较。使用5-基因集的第一逻辑回归模型显示于以下方程中:使用最低5-基因集的第二逻辑回归模型显示于以下方程中:使用基于Stanford样品的最低5-基因集的逻辑回归模型显示于以下方程中:在以上每个方程中,θ是预测的概率。基于接收器工作特性(ROC)曲线,选择截断θ=0.5来确定预测类别为AR或STA表型。查询人口统计学和临床混淆因素对5基因-集的影响对用于Q-PCR确认研究的所有处理样品采集18种人口统计学和临床变量的数据。SNSO1样品的数据由PPD(BrandonGraham,JasonBerg,DavidIkle)提供。研究了下列18种变量:移植后时间、受体年龄、受体性别、供体性别、供体来源、供体年龄、采样时的巨细胞病毒/CMV、埃巴病毒/EBV和BK病毒/BKV病毒血症、并发的细菌感染、供体特异性抗体(DSA)或板反应性抗体(PRA)的存在、诱导疗法的使用、维持类固醇使用、不同神经钙蛋白抑制剂药物(FK506或环孢菌素A/CSA)的使用、不同抗代谢物(麦考酚酸吗乙酯/MMF或硫唑嘌呤/AZA)的使用、血液采集时的白细胞(WBC)计数和血细胞比容(HCT)水平(图11)。计算Pearson关联系数以确定18种不同的临床参数作为潜在的混淆因素对5-基因集表达的任何影响(图12)。该分析显示,用于AR诊断的5基因-集的表达不受检查的18种混淆因素中任何一种的影响(最大|r|=0.27)。另外,对于具有分类值的13种临床混淆因素(受体性别、供体性别、供体来源、无类固醇对比基于类固醇、CMV病毒血症、EBV病毒血症、BK病毒血症、细菌感染、DSA、PRA、诱导疗法的使用与否、FK506对比CSA的使用、MMF对比AZA的使用)进行t-检验。查询AR严重度(BANFF评分)、AR类型(体液或细胞排斥)、AR时的小管周C4d阳性对5基因-集表达的影响接下来,检查Banff评分、活检时的小管周C4d+/-和体液或细胞排斥的存在、和用于AR诊断的5-基因集表达之间的任何相关性。因为大多数样品具有用于评估的配对活检,根据Banff评分等级(1=Banff评分≤1A;2=Banff评分≥1B)将样品分成2组;对于C4d+,确定是否≥10%小管周毛细血管(PTC)具有C4d沉积物。未发现5基因-集的AR概率预测和Banff评分(r=-0.13)、体液对比细胞排斥(r=0.07)和小管周C4d+的存在或不存在(r=0.2)之间的关联(图14)。项目3–在所示的移植物活检和移植物功能障碍之前通过5基因-集预测AR损伤本研究中第三个项目的目的是测试具有5-基因集的模型是否可在任何移植物功能障碍或所示的活检之前预测AR的发作。我们将我们的回归模型应用于在活检证明的AR发作之前和之后1到6个月顺序采集的样品。所述样品分组成以下类别:i)AR发作之前3到6个月采集的样品,ii)AR之前0到3个月采集的样品,iii)AR时采集的样品,iv)AR发作后0到3个月采集的样品,v)AR发作后3到6个月采集的样品。提供了每组样品的平均AR概率及标准偏差和计算的肌酸酐清除13。5基因-集的生物学相关性分析为了检查可影响AR中外周转录组的关键生物学过程,我们使用PANTHER分类系统(http://www.pantherdb.org)将525个跨平台AR特异性基因-集应用于生物学相关性分析。这些分子途径表明,关键途径中的活跃蛋白质运输/转运和脂类代谢参与免疫、细胞周期、凋亡和分化。Ingenuity途径分析(http://www.ingenuity.com)显示这些基因驱动参与凋亡的经典途径并受JAK/STAT途径的调节(图16)。补充方法的参考文献1.RacusenLC,SolezK,ColvinRB等人TheBanff97workingclassificationofrenalallograftpathology(肾同种异体移植物病理学的Banff97工作分类).KidneyInt1999;55(2):713-23.2.LiL,YingL,NaesensM等人Interferenceofglobingeneswithbiomarkerdiscoveryforallograftrejectioninperipheralbloodsamples(珠蛋白基因的干扰以及外周血样品中用于同种异体移植物排斥的生物标志物发现).PhysiolGenomics2008;32(2):190-7.3.SarwalM,ChuaMS,KambhamN等人MolecularheterogeneityinacuterenalallograftrejectionidentifiedbyDNAmicroarrayprofiling(通过DNA微阵列谱分析鉴定的急性肾同种异体移植物排斥中的分子异质性).NEnglJMed2003;349(2):125-38.4.EfronB,TibshiraniR.Empiricalbayesmethodsandfalsediscoveryratesformicroarrays(用于微阵列的经验bayes方法和假发现率).GenetEpidemiol2002;23(1):70-86.5.ChenR,LiL,ButteA.AILUN:reannotatinggeneexpressiondataautomatically(AILUN:自动化重新注释基因表达数据).NatureMethods2007;4(11):InPress.6.Perez-IratxetaC,AndradeMA.Inconsistenciesovertimein5%ofNetAffxprobe-to-geneannotations(5%NetAffx探针-至-基因注释中随时间的不一致).BMCBioinformatics2005;6:183.7.HarbigJ,SprinkleR,EnkemannSA.Asequence-basedidentificationofthegenesdetectedbyprobesetsontheAffymetrixU133plus2.0array(AffymetrixU133plus2.0阵列上的探针集检测的基因的基于序列的鉴定).NucleicAcidsRes2005;33(3):e31.8.LiB,HartonoC,DingR等人Noninvasivediagnosisofrenal-allograftrejectionbymeasurementofmessengerRNAforperforinandgranzymeBinurine(通过测量尿中穿孔素和粒酶B的信使RNA的肾同种异体移植物排斥的非侵入性诊断).NEnglJMed2001;344(13):947-54.9.DugreFJ,GaudreauS,Belles-IslesM,HoudeI,RoyR.Cytokineandcytotoxicmoleculegeneexpressiondeterminedinperipheralbloodmononuclearcellsinthediagnosisofacuterenalrejection(急性肾排斥诊断中在外周血单核细胞中确定的细胞因子和细胞毒性分子基因表达).Transplantation2000;70(7):1074-80.10.SimonT,OpelzG,WieselM,OttRC,SusalC.SerialperipheralbloodperforinandgranzymeBgeneexpressionmeasurementsforpredictionofacuterejectioninkidneygraftrecipients用于预测肾移植物受体中的急性排斥的系列外周血穿孔素和粒酶B基因表达测量).AmJTransplant2003;3(9):1121-7.11.VasconcellosLM,SchachterAD,ZhengXX等人Cytotoxiclymphocytegeneexpressioninperipheralbloodleukocytescorrelateswithrejectingrenalallografts(外周血白细胞中的细胞毒性淋巴细胞基因表达与排斥的肾同种异体移植物相关).Transplantation1998;66(5):562-6.12.WittenIH,FrankE.DataMining:Practicalmachinelearningtoolsandtechniques(数据挖掘:实用机器学习工具和技术).第2版SanFrancisco:MorganKaufmann;2005.13.SchwartzGJ,HaycockGB,EdelmannCM,Jr.,SpitzerA.Asimpleestimateofglomerularfiltrationrateinchildrenderivedfrombodylengthandplasmacreatinine(身高和血浆肌酸酐得出的儿童肾小球滤过率的简单估计).Pediatrics1976;58(2):259-63.实施例II方法选择来自肝和心脏移植患者的总计40倍和免疫遏制匹配的外周血样品用于跨实施例I中鉴定的10基因-集的384-孔形式多重ABI-TaqManqPCR确认。其中16个样品来自肝移植患者,8个AR和8个稳定无排斥(STA),24个样品来自心脏移植患者(9AR;10STA);对于病毒混淆因素控制,包括具有巨细胞病毒感染(CMV)的5STA样品。显著差异基因表达通过T检验确定,p<0.05视为显著。结果对于肝移植中相同10基因-集确认,10基因中的2个(PSEN1和RYBP)是对于与STA相比确认外周血AR诊断高度显著的(p=0.05;p=0.04);剩余8基因显示与肾移植中所见的相同方向的倍数变化,AR和STA之间没有统计学显著的差异。将从肾移植外周血得到的10基因-集产生的预测模型(ROC=97.6%)应用于肝样品PCR数据集的AR分类,揭示了86%灵敏度、75%特异性、88%PPV和78%NPV的预测评分,16个样品中的2AR和1STA被错误分类。对于心脏样品中的10基因-集确认,10基因中的3个(CFLAR、ITGAX和NKTR)是在AR相比于STA中差异表达的(p=0.04;p=0.05;p=0.01)。令人感兴趣的是,这3个基因中的1个(CFLAR)显示与先前的肾AR样品(p=0.002、倍数变化=3.1)中所见的显著的相反方向的倍数变化(p=0.04、倍数变化=-2.2)。此外,当与AR相比时,3个基因中的2个在CMV方面是显著下调的。肝和心脏之间不存在显著差异表达的基因的重叠。测试的10个基因的身份显示在对肾移植样品的先前讨论中。结论肾移植中的跨平台微阵列分析中得到和测试的高度特异和灵敏的10基因生物标志物可用于预测肝移植中的AR。10基因中的2个在肝和心脏的AR中是差异表达的,但是肝和心脏之间显著差异调节的基因的无重叠表明排斥损伤不仅在不同的器官移植体之间共有共同的生物学途径,而且还显示组织特异性。测试的10基因可用于在肝和心脏移植物排斥中诊断AR,而无论排斥等级如何。尽管为清楚理解目的,已一定程度上通过例证和实施例详细描述了本发明,但是借鉴本发明的教导,可对本发明进行某些变化和改动而不背离所附权利要求的精神或范围对于本领域技术人员是非常明显的。因此,以上仅例证了本发明的原理。应理解,本领域技术人员将能够设计各种布置,这些布置虽然没有在本文明确描述或显示,但是其体现本发明的原理并包括在本发明的精神和范围内。另外,本文所述的所有实施例和附条件的语言主要意在帮助读者理解本发明的原理和发明人提出的推动本领域的概念,因此应以非限制性方式解读此类特别引述的实施例和条件。此外,本文引述本发明的原理、方面和实施方式以及其具体实施例的所有陈述意在包括其结构和功能等同物。另外,此类等同物意在包括目前已知的等同物和将来开发的等同物,即无论结构如何,开发用于执行相同功能的任何元件。因此,本发明的范围不意图限制于本文显示和描述的t示例性实施方式。相反,本发明的范围和精神仅由所附权利要求体现。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1