一种卵巢癌检测产品及试剂盒的制作方法
本发明设计医学诊断设备
技术领域:
,具体涉及一种卵巢癌检测产品及试剂盒。
背景技术:
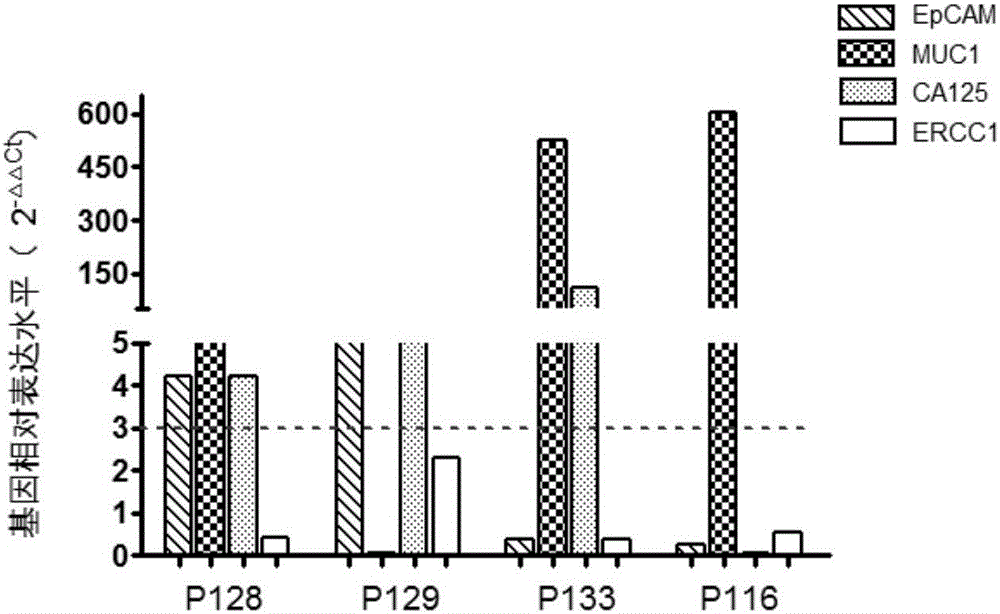
:卵巢癌是女性生殖器三大常见癌症之一,其恶性化程度及致死率极高(在中国城市地区女性生殖器癌症中死亡率居首),是严重威胁女性生命和健康的主要癌种。然而,由于卵巢深居盆腔深部,其恶性肿瘤临床症状通常不典型往往不明显且不具有特异性,尤其是在癌症早期。70%的患者就诊发现病变时已属晚期(III和IV期),该类患者五年生存率急剧下降至不足30%,治疗与预后较差。卵巢癌现有筛查、诊断方法包括影像学检查、血清学检查(肿瘤标志物检查)和病理学检查(细胞学检查和组织活检)等。然而,长期居高不下的发病率、确诊不及时以及由此引起的治疗效果差和不良预后均提示现有的卵巢癌临床检测方法并未能完全满足日益迫切的临床需求。准确、灵敏、便捷、安全的卵巢癌临床检测手段的开发迫在眉睫。公开号为CN104316683A的中国发明专利公开了一种针对全血的卵巢癌细胞检测试剂盒,该专利发明利用免疫磁珠法富集分离卵巢癌患者全血中的癌细胞后,通过链霉亲和素化的量子点(SA-QDs)与生物素化的人附睾蛋白4(HE4)抗原抗体复合物特异性靶向结合卵巢癌细胞,实现多重信号协同放大,最终通过倒置荧光显微镜观察计数分离效率及荧光信号采集系统定量分析获得最终检测结果。然而,已有研究表明HE4并不仅仅在卵巢癌中表达异常,其在子宫内膜癌等妇科癌症以及肺癌中均有异常的高表达,该专利仅针对HE4这一个靶点对卵巢癌进行检测,其卵巢癌特异性有限。公开号为CN102735840A的专利发明专利通过检测血浆中肿瘤抗原125(基因名称:MUC1或CA125)、巢蛋白1(基因名称:NID1)和基质金属蛋白酶抑制剂2(基因名称:TIMP2)这三种卵巢癌相关蛋白质的浓度,对卵巢癌进行检测和诊断。该专利联合使用了三种卵巢癌标志物,特异性较高,但其检测方法较为复杂,需分别使用ModularE170仪器(Roche,Mannheim,Germany)测定血浆中CA125的蛋白浓度,使用ELISA法测定血浆中NID1和TIMP2的蛋白浓度,且最终结果需要套入二分类逻辑回归法构建的函数中进行计算,其检测的简便性及结果的直观性有待提高。卵巢癌现有临床筛查、诊断方法可归为三大类:影像学(超声,CT,PET/CT,MRI等),血清学(血清中肿瘤标志物如CA-125的检测)和病理学(组织活检,细胞学检查等)。但所有这些方法都有不可避免的缺点,例如灵敏性及特异性差,检测结果滞后,对受检者造成放射性伤害,取样不方便,过于依赖医生判断的主观性等。连年来,卵巢癌发病率和死亡率的持续上升,表明现有的检测与治疗技术远远不能满足临床需求,更加准确、安全、便捷的卵巢癌临床诊疗新技术的开发势在必行。现有的公开号为CN104316683A和CN102735840A的专利虽然提出了卵巢癌临床常用检测方法外的新型检测手段,但是均未能同时兼顾检测操作的便捷性和检测结果的特异性。技术实现要素:本发明目的在于针对卵巢癌现有临床检测方法的缺点与不足,提供一种兼顾检测操作的便捷性和检测结果特异性的诊断或辅助诊断卵巢癌的产品及试剂盒,以及筛查或辅助筛查卵巢癌的产品或试剂盒。本发明的一个技术方案为:提供一种卵巢癌检测产品或试剂盒,包括检测上皮细胞粘附分子、卵巢癌抗原CA125、黏蛋白1和切除修复交叉互补基因1四种基因mRNA水平的物质。本发明的另一技术方案为:提供一种上皮细胞粘附分子、卵巢癌抗原CA125、黏蛋白1和切除修复交叉互补基因1的基因组合在制备诊断或辅助诊断卵巢癌的产品。本发明的又一技术方案为:提供一种卵巢癌检测试剂盒,包括使用荧光定量聚合酶链式反应检测样品中上皮细胞粘附分子、卵巢癌抗原CA125、黏蛋白1和切除修复交叉互补基因1四种基因mRNA水平的物质,所述检测的样品为利用免疫磁珠结合微流控法富集的受检者外周血中的循环肿瘤细胞。优选的,上述的卵巢癌检测试剂盒中,所述物质包括同一PCR反应体系的5个引物组和5个探针;所述5个引物组分别为:SEQIDNO:1和SEQIDNO:2;SEQIDNO:3和SEQIDNO:4;SEQIDNO:5和SEQIDNO:6;SEQIDNO:7和SEQIDNO:8;SEQIDNO:9和SEQIDNO:10;所述5个探针分别为:SEQIDNO:11-15。本发明有益效果在于:本发明的卵巢癌检测产品或试剂盒,所用检测样品为利用免疫磁珠结合微流控法富集的受检者外周血中的循环肿瘤细胞(CirculatingTumorCells,CTC),其利用荧光定量聚合酶链式反应技术对CTC中的一组卵巢癌特异性高表达基因的mRNA含量进行测定,并通过对比CTC与正常血液白细胞中几种基因mRNA水平来判断该受检者是否患有卵巢癌。该组基因包括上皮细胞粘附分子(Epithelialcelladhesionmolecule,EpCAM)、卵巢癌抗原CA125(OvariancarcinomaantigenCA125)、黏蛋白1(Mucin1,MUC1),切除修复交叉互补基因1(ExcisionRepairCross-ComplementationGroup1,ERCC1)。使用本发明产品及试剂盒进行检测对比现有临床检测产品敏感度高,特异性好;可早于影像学预知判断;即时反应,随时监测;取样便捷,安全性高。附图说明图1为本发明具体实施方式的卵巢癌与卵巢癌良性肿瘤血样的基因相对表达水平图;图2本发明具体实施方式的卵巢癌与子宫内膜样腺癌血样的基因相对表达水平图。具体实施方式为详细说明本发明的技术内容、构造特征、所实现目的及效果,以下结合实施方式并配合附图详予说明。本发明最关键的构思在于:对CTC中的一组卵巢癌特异性高表达基因的mRNA含量进行测定,并通过对比CTC与正常血液白细胞中这几种基因mRNA水平来判断该受检者是否患有卵巢癌。本发明缩略语对应如下:CTC:循环肿瘤细胞;qRT-PCR:荧光定量聚合酶链式反应;EpCAM:上皮细胞粘附分子;CA125:卵巢癌抗原CA125;MUC1:黏蛋白1;ERCC1:切除修复交叉互补基因1;本发明提供一种卵巢癌检测产品,包括检测上皮细胞粘附分子、卵巢癌抗原CA125、黏蛋白1和切除修复交叉互补基因1四种基因mRNA水平的物质组成。实施例一一种卵巢癌检测试剂盒,包括使用荧光定量聚合酶链式反应检测检测样品中上皮细胞粘附分子、卵巢癌抗原CA125、黏蛋白1和切除修复交叉互补基因1四种基因mRNA水平的物质组成,所述检测的样品为利用免疫磁珠结合微流控法富集的受检者外周血中的循环肿瘤细胞。上述试剂盒组成:本发明针对检测样品试剂盒包括:PCR引物组(包括PCR上游引物和下游引物)、PremixExTaq(qPCR)、pooledassay、PremixExTaq(ProbeqPCR)、TaqManprobe、ROXReferenceDyeII、ddH2O(灭菌蒸馏水)。所述PCR引物组如下:1)序列为GATGGGATTTCCATTGATGACA(SEQIDNO:1)的引物和序列为ATTCCACCCATGGCAAATTC(SEQIDNO:2)的引物所组成的引物组;2)序列为CTCGCGTTCGGGCTTCT(SEQIDNO:3)的引物和序列为TGTAGTTTTCACAGACACATTCTTCCT(SEQIDNO:4)的引物所组成的引物组;3)序列为ACAGGTTCTGGTCATGCAAGC(SEQIDNO:5)的引物和序列为CTCACAGCATTCTTCTCAGTAGAGCT(SEQIDNO:6)的引物所组成的引物组;4)序列为GCCTCTACCTTAACGGTTACAATGAA(SEQIDNO:7)的引物和序列为GGTACCCCATGGCTGTTGTG(SEQIDNO:8)的引物所组成的引物组;5)序列为GCGGAGGCTGAGGAACAG(SEQIDNO:9)的引物和序列为GGGAATTTGGCGACGTAATTC(SEQIDNO:10)的引物所组成的引物组;所述的pooledassay,其制备方法如下:552μlnuclease-freewater中每种引物(10μM)各加入2μl混合制成。上述的PremixExTaq(qPCR,2x)、PremixExTaq(ProbeqPCR,2x)、ROXReferenceDyeII(50x)购买自Takara公司,但不仅限于Takara公司。上述试剂盒使用时,cDNA预扩增是两步法PCR,包括95℃下15s的变性步骤和60℃下4min的退火及延伸步骤,反复进行15个循环。荧光定量PCR所用DNA模板指预扩增后的产物。其体系包括cDNA、PremixExTaqTM、pooledassay。PremixExTaqTM使用终浓度1x,pooledassay使用终浓度10nM。对预扩增产物进行浓度测定,根据浓度加入无菌蒸馏水进行稀释,稀释浓度至40-60ng/μl。荧光定量PCR体系中PCR引物组终浓度0.2μM、PremixExTaq(ProbeqPCR)终浓度1x、TaqManprobe终浓度0.4μM、ROXReferenceDyeII终浓度0.5x,在开始第一次变性步骤之前,进行以下步骤:步骤1.反应体系在95℃下保温30s;步骤2.反应体系在95℃下变性5s,60℃下退火及延伸34s,变性步骤和退火步骤的循环次数为40次。在荧光定量PCR扩增时同时使用TaqManprobe,包括探针:FAM-CCGTTCTCAGCCTTGACGGTGC-BQ1(SEQIDNO:11)FAM-ACGGCGACTTTTGCCGCAGCTTA-BQ1(SEQIDNO:12)FAM-TGGAGAAAAGGAGACTTCGGCTACCCAGA-BQ1(SEQIDNO:13)FAM-ACGGCGACTTTTGCCGCAGCTTA-BQ1(SEQIDNO:14)FAM-CACAGGTGCTCTGGCCCAGCACATA-BQ1(SEQIDNO:15)。使用各组引物和探针扩增的基因型如表1所示。表1引物和探针序列上述卵巢癌检测试剂盒使用:第一部分为卵巢癌CTC的富集分离,第二部分为CTC中卵巢癌特异性高表达基因的mRNA含量检测。1、卵巢癌CTC的富集分离使用的设备和试剂:美国Fluxion公司生产的微流体CTC细胞筛选分析系统(IsoFluxTMSystem950-0100)及其配套试剂CTC富集试剂盒(CTCEnrichmentKit,P/N:910-0091)。(1)血样的处理及上机样本制备1)通过常规手臂静脉采血的方式使用真空采血管采集受试者外周血7.5ml。2)根据样本数量准备相应个数的1.5ml小离心管,各加600μl的结合缓冲液(bindingbuffer)后置于混匀仪上混匀包被待用,4℃混匀至少一个小时。3)根据样本数量准备相应个数的50mlLeucosep带滤膜离心管,各加入15.2ml淋巴细胞分离液(Ficoll-PaqueTMPLUS),室温1000×g离心1min。4)向步骤3中50mlLeucosep带滤膜离心管中缓慢加入5ml不含钙离子与镁离子的磷酸盐缓冲液(PBS-CMF);轻柔颠倒真空采血管使血样混匀,将血样缓慢倒入带滤膜离心管中;用5mlPBS-CMF冲洗采血管,盖上采血管管盖,轻柔颠倒混匀后倒入同一带滤膜离心管中。用5mlPBS-CMF重复上述动作一次。5)800×g转速离心15min。(需缓慢降速)6)将Leucosep带滤膜离心管中的大部分上清液倒入一支新的50ml普通离心管中,余留5~10ml上清液并轻轻摇晃Leucosep带滤膜离心管,确保粘在管壁内的细胞全部被涮洗下来,倒入同一50ml普通离心管中。向Leucosep带滤膜离心管中加入10mlPBS-CMF,用5ml移液枪反复冲洗管壁后吸出,加入同一50ml普通离心管中。(注意:枪头请勿滤膜)7)室温300×g离心10min。8)用真空泵小心吸除上清液,仅余留约500μl液体。9)将离心管在实验台面上轻轻磕打,直至管底细胞团完全松散。10)将离心管底部细胞悬液用移液枪轻柔吹打混匀,转移入步骤2已包被好的1.5ml小离心管中(分装前需将小离心管中的bindingbuffer吸出)。11)向步骤10中的50ml离心管加入200μlbindingbuffer轻柔涮洗管底内壁,转移入步骤10中1.5ml小离心管中。12)向步骤10中的1.5ml小离心管加入50μlFc受体阻滞剂(Fcblocker)和4μl脱氧核糖核酸酶(Dnase),颠倒混匀后于冰上放置5min。13)将EpCAM磁珠用移液枪充分吹打重悬,取适量EpCAM磁珠(每个样本需50μl,根据样本量取相应体积的磁珠),置于新的1.5ml小离心管中,将离心管底部紧贴磁铁5s,保持磁铁紧贴在离心管上,将离心管中液体小心吸出。向小离心管中加入1mlbindingbuffer,将离心管底部紧贴磁铁5s,保持磁铁紧贴在离心管上,将离心管中液体小心吸出。再加入1mlbindingbuffer,重复上述步骤一次。用适量体积的bindingbuffer将磁珠重悬(每个样本需50μl,根据样本量加入相应体积的bindingbuffer)。14)将制备好的磁珠用移液枪充分吹打重悬之后加入步骤12中的1.5ml小离心管,每管加入50μlEpCAM磁珠,颠倒混匀。15)将小离心管紧贴在磁铁上3s,之后颠倒混匀。重复该操作5次。16)将小离心管置于垂直混匀仪上,于4℃冰箱中旋转混匀1.5h。旋转速度为15-18转/分钟。(2)使用Isoflux仪器进行CTC分离1)开机:按住开机按钮直至按钮变绿。2)待机器完全启动后,点击屏幕上的“RunProtocol”。3)根据样本数点击相应的样本个数选项(最多可一次运行4个样本),样本槽会自动滑出(从左至右分别为1,2,3,4号样本槽)。4)从包装中取出样本盒(Cartridge),丢弃4号孔中的小管,仅留白色Holder。向2号孔(即圆柱状孔)中加入3mlbindingbuffer。5)将样本盒置于样本槽中,点击屏幕上的“Prime”。样本槽会自动滑入机器中进行Prime,该过程约需6min。6)Prime完成后,屏幕上会出现“ReadytoLoadSample”选项,点击“ReadytoLoadSample”,此时1、2号样本盒会自动滑出。7)从垂直混匀仪上取下待分选的样品,用枪轻柔吹打均匀加入1号孔(即圆锥状孔)中,加样完成后从2号空中吸取50μlbindingbuffer涮洗小离心管内壁后同样加入1号孔,以确保所有样本均被收集而无残余。加样完成后将样本盒按顺序放置于样本槽上。枪头接触样品前,必须先用bindingbuffer润洗一次。8)点击屏幕上的“Load”,1、2号样本槽会自动滑入机器,如果本批样本数≤2,则此时CTC分选将自动开始;如果本批样本数>2,则此时3、4号样本槽会自动滑出,依照步骤7)中的方法加样。之后点击屏幕上的“Load”,CTC分选自动开始。9)整个分选过程约需45min,不同样品分选所需时间稍有差别。10)分选完成后,屏幕上显示“ExtractSample”,点击“ExtractSample”,样本槽会自动滑出。(样本必须在分选完成后5min内取出,机器屏幕上会显示时间倒计时)11)将白色Holder翻转置于实验桌面上,向每个Holder中加入一滴PBS-CMF以防止样品干燥。润洗枪头防止细胞粘黏在枪头内壁,吸取100μlPBS-CMF,滴加两滴在一支新的无核糖核酸酶的1.5ml小离心管中,用剩余的PBS-CMF重悬holder中的细胞样本,之后全部转移至小离心管中待用。2、CTC中卵巢癌特异性高表达基因的mRNA含量检测(1)RNA的提取(选用试剂盒为TaKaRaMiniBESTUniversalRNAExtractionKit,货号9767)1)加入350μlRL+DTT混合液使细胞裂解。2)裂解后的细胞在常温下静置2min。3)将带膜的基因组DNA离心柱插入2ml离心管中。4)将裂解液加入gDNA离心柱中。5)12000rpm离心1min。6)根据滤液体积加入等体积70%的乙醇溶液,并用枪上下抽吸混匀。7)带膜的RNA离心柱插入新的2ml收集管中,将步骤6中的混合物加入RNA离心柱,注意每次加入混合物的体积不超过600μl,如超过则分次加入。8)12000rpm离心1min,去掉离心后的下层液,RNA离心柱放回到2ml离心管中。9)加500μlRWA到RNA离心管中,12000rpm离心30s,去掉下层液。10)沿着管内壁加600μlRWB到RNA离心管中,12000rpm离心30s,去掉下层液。(注意RWB使用之前需要加入70ml100%的乙醇溶液,沿着管内壁加入RWB能够更好地去除管内壁的盐)。11)重复步骤10。12)RNA离心柱放回离心管,空管12000rpm离心2min。13)RNA离心柱放入一支新的1.5ml无RNA酶的离心管,加入50-200μlRNase-freeddH2O2到RNA离心管中,常温下孵育5min。14)12000rpm离心2min溶解得到RNA。15)如果RNA的量太低,则另外使用50-200μlRNase-freeddH2O的到RNA离心柱来增加RNA量。如果需要高浓度的RNA,则加入溶液到RNA离心柱并返回到步骤15,常温下孵育5min,12000rpm离心2min溶解得到RNA16)用nanodrop测定RNA浓度。(2)反转录成cDNA(所用试剂盒为TakaraPrimeScriptTMRTMasterMix(PerfectRealTime,货号RR036A)。a、准备水浴锅、冰盒,加实验试剂在冰盒上进行(试剂保存于-20℃冰箱),按以下量加入50μl离心管,反转录RNA使用量可以尽量多,一般不超过500ng。反应体系如下表2:表2b、试剂加完短暂离心后,37℃孵育15min进行反转录,转移到85℃孵育5S使逆转录酶失活,nanodrop测定DNA浓度,保存于4℃冰箱。(3)cDNA预扩增(使用本发明试剂盒)a、552μlnuclease-freewater中每种primer(10μM)各加入2μl,制成pooledassay(1:286稀释,工作浓度约35nM)。b、按下表3的组成加入试剂到200μlEp管中。表3c、PCR扩增程序95℃2minutes95℃15seconds60℃4minutes4℃hold重复2和3共15个循环d、浓度测定,根据浓度加入水进行稀释,例如加入40μl水进行稀释。e、稀释后的预扩增产物可直接用于下一步qPCR实验,如若暂时不进行下一步实验,则可保存于-20℃冰箱。3)荧光定量PCR(备注:以下所用DNA模板指预扩增后的产物,使用本发明试剂盒。)a、按照下表4组分在冰上配制好反应液;表4备注:为保证结果的准确性和平行性,每个反应建议设置2-3个复孔。b、荧光定量PCR反应使用ABI7500仪器,采用两步法PCR扩增标准程序进行荧光定量PCR反应,程序设定如下:预变性:95℃30seconds;PCR反应(40个循环):95℃5seconds;60℃34seconds。3、结果分析采用2-ΔΔCt法对卵巢癌CTC样本中EpCAM,MUC1,CA125及ERCC1的相对表达水平进行分析,GAPDH作为内参基因。健康人血液中白细胞样本作为荧光定量PCR反应的阴性对照品。若检测样本中EpCAM,MUC1,CA125及ERCC1其中两个或两个以上基因的相对表达水平(2-ΔΔCt)与阴性对照相比≥3,则可判断该检测样本为卵巢癌阳性。实施例二请参阅图1,分别采集5例卵巢癌患者及5例卵巢良性肿瘤患者手臂静脉血。按照实施例一部分所述方法对血样进行操作处理,检测这10例血样CTC中卵巢癌特异性高表达基因EpCAM、CA125、MUC1和ERCC1的相对表达水平。样本病理诊断信息如表5的卵巢癌及卵巢良性肿瘤样本信息所示。表5样本编号病理诊断信息P98卵巢低分化腺癌P117卵巢转移性高级别浆液腺癌P121卵巢交界性黏液性囊腺瘤P123右卵巢子宫内膜样癌P127卵巢浆液性腺癌P94子宫肌瘤P96右卵巢卵泡膜细胞瘤P130双卵巢浆液性囊腺瘤P172左卵巢低度恶性平滑肌瘤P175卵巢粘液性囊腺瘤与健康人白细胞相比5例卵巢癌患者(样本编号分别为P98,P117,P121,P123,P127)血液CTC中卵巢癌特异性高表达基因EpCAM、CA125、MUC1和ERCC1中均有两个或两个以上基因的相对表达水平(2-△△Ct)≥3;而5例卵巢良性肿瘤患者(样本编号分别为P94,P96,P130,P172,P175)血液CTC中卵巢癌特异性高表达基因EpCAM、CA125、MUC1和ERCC1相对表达水平(2-△△Ct)≥3的基因个数均小于两个。说明本发明方法可良好区分卵巢癌与卵巢良性肿瘤。图中红色虚线即为基因相对表达水平等于3的位置。请参阅图2,分别采集3例卵巢癌患者及1例子宫内膜样腺癌患者手臂静脉血。按照实施例一部分所述方法对血样进行操作处理,检测这4例血样CTC中卵巢癌特异性高表达基因EpCAM、CA125、MUC1和ERCC1的相对表达水平。样本病理诊断信息如表6的卵巢癌及子宫内膜癌样本信息所示。表6与健康人白细胞相比3例卵巢癌患者(样本编号分别为P128,P129,P133)血液CTC中卵巢癌特异性高表达基因EpCAM、CA125、MUC1和ERCC1中均有两个或两个以上基因的相对表达水平(2-△△Ct)≥3,;而1例子宫内膜样腺癌患者(样本编号为P116)血液CTC中卵巢癌特异性高表达基因EpCAM、CA125、MUC1和ERCC1相对表达水平(2-△△Ct)≥3的基因个数小于两个。说明本发明方法可良好区分卵巢癌与其他癌种。图中红色虚线即为基因相对表达水平等于3的位置。本发明中用于富集分离血液中CTC的仪器和试剂盒为美国Fluxion公司生产的微流体CTC细胞筛选分析系统(IsoFluxTMSystem950-0100),及其配套试剂CTC富集试剂盒(CTCEnrichmentKit,P/N:910-0091),其富集分离方法为Fluxion公司所提供的操作方法,但富集分离血液中CTC的仪器、试剂及方法并不局限于上述;本发明中用于检测卵巢癌特异性高表达基因EpCAM、CA125、MUC1和ERCC1相对表达水平变化的试剂盒,所用RNA提取和反转录的试剂盒为Takara公司相应试剂盒,所能够使用RNA提取和反转录的试剂盒不仅限于本发明技术方案描述的试剂盒。综上,本发明中试剂盒用于检测卵巢癌特异性高表达基因EpCAM、CA125、MUC1和ERCC1相对表达水平变化,凡是涉及富集分离血液中CTC,并通过对分离后的CTC中卵巢癌特异性高表达基因EpCAM、CA125、MUC1和ERCC1相对表达水平变化进行检测,从而对血液样本是否来源于卵巢癌患者进行判断的技术方法试剂,都属于本发明保护的范围。以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的
技术领域:
,均同理包括在本发明的专利保护范围内。SEQUENCELISTING<110>亚能生物技术(深圳)有限公司<120>一种卵巢癌检测产品及试剂盒<160>15<170>PatentInversion3.5<210>1<211>22<212>DNA<213>人工序列<400>1gatgggatttccattgatgaca22<210>2<211>20<212>DNA<213>人工序列<400>2attccacccatggcaaattc20<210>3<211>17<212>DNA<213>人工序列<400>3ctcgcgttcgggcttct17<210>4<211>27<212>DNA<213>人工序列<400>4tgtagttttcacagacacattcttcct27<210>5<211>21<212>DNA<213>人工序列<400>5acaggttctggtcatgcaagc21<210>6<211>26<212>DNA<213>人工序列<400>6ctcacagcattcttctcagtagagct26<210>7<211>26<212>DNA<213>人工序列<400>7gcctctaccttaacggttacaatgaa26<210>8<211>20<212>DNA<213>人工序列<400>8ggtaccccatggctgttgtg20<210>9<211>18<212>DNA<213>人工序列<400>9gcggaggctgaggaacag18<210>10<211>21<212>DNA<213>人工序列<400>10gggaatttggcgacgtaattc21<210>11<211>22<212>DNA<213>人工序列<400>11ccgttctcagccttgacggtgc22<210>12<211>23<212>DNA<213>人工序列<400>12acggcgacttttgccgcagctta23<210>13<211>29<212>DNA<213>人工序列<400>13tggagaaaaggagacttcggctacccaga29<210>14<211>23<212>DNA<213>人工序列<400>14acggcgacttttgccgcagctta23<210>15<211>25<212>DNA<213>人工序列<400>15cacaggtgctctggcccagcacata25当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1