一种肉类检测试剂盒和方法与流程
本发明涉及一种肉的种类的检测技术,特别是肉类检测试剂盒和方法。
背景技术:
牦牛主要分布在中国西南部的高原及周边的高山及亚高山地区,该地区海拔2000-5000m,环境艰苦恶劣。中国境内分布的牦牛占世界牦牛总数的94%,但只占了中国1.4亿头牛的很少部分。牦牛能利用这些地区的草场资源,提供肉、奶、毛和奶酪给该地区的人群。由于其独特性,牦牛肉产品的价格远高于当地的其他肉类价格,例如牦牛肉产品价格大概为黄牛肉价格的2倍。因此,近年来假牦牛肉制品持续增长,已占到市场牦牛肉制品价格的80%。此外,有研究报告指出,西方国家市场上的牦牛肉制品价格也大幅增长,市场上错误标签的产品也占到15-39%。
由于肉类食品市场上的肉类真实性认证的需求,近年来科研工作者开发了许多肉类鉴定的方法。多数运用PCR-RFLP进行鉴定。但这类方法能鉴定的肉类品种有限,根据陈的研究小组的结果,他们的方法可以鉴定5个动物品种,并且鉴定混合样品时只能鉴定3个品种。此外,Naue等在最近还发展了高分辨率熔解曲线分析(HRM)方法,该方法能鉴定包括牦牛在内的28个动物品种,但其使用却受到实验程序的限制。例如该方法受到基因组DNA的总量、严格的缓冲液条件以及当给定基因存在未知的SNP位点的时候可能会在适时荧光定量PCR导致HRM值在改变,并随之出现额外的检测错误。
技术实现要素:
为了解决上述问题,本发明提供了一种新的肉类检测试剂盒和方法。
本发明肉类检测试剂盒,包含SEQ ID NO:1~2所示的引物对1、SEQ ID NO:3~4所示的引物对2、SEQ ID NO:5~6所示的引物对3、SEQ ID NO:7~8所示的引物对4、SEQ ID NO:9~10所示的引物对5、SEQ ID NO:11~12所示的引物对6、SEQ ID NO:13~14所示的引物对7、SEQ ID NO:15~16所示的引物对8和/或SEQ ID NO:17~18所示的引物对9。
本发明还提供了SEQ ID NO:1~2所示的引物对1、SEQ ID NO:3~4所示的引物对2、SEQ ID NO:5~6所示的引物对3、SEQ ID NO:7~8所示的引物对4、SEQ ID NO:9~10所示的引物对5、SEQ ID NO:11~12所示的引物对6、SEQ ID NO:13~14所示的引物对7、SEQ ID NO:15~16所示的引物对8和/或SEQ ID NO:17~18所示的引物对9在鉴别肉类中的用途。
其中,所述肉类是黄牛肉、牦牛肉、水牛肉、山羊肉、狗肉、猪肉、兔子肉、鸡肉和鸭肉中的任意一种或者任意多种。
本发明还提供了一种肉类的检测方法,包括如下步骤:
a,提取样本DNA:提取待检样本中的DNA;
b,基因扩增:用权利要求1所述的试剂盒对待检样本中的DNA进行扩增;
c,结果检测:对DNA扩增结果进行检测。
其中,步骤a所述的样本为黄牛肉、牦牛肉、水牛肉、山羊肉、狗肉、猪肉、兔子肉、鸡肉和鸭肉中的任意一种或者任意多种。
本发明还提供了SEQ ID NO:1~2所示的引物对1、SEQ ID NO:3~4所示的引物对2、SEQ ID NO:5~6所示的引物对3、SEQ ID NO:7~8所示的引物对4、SEQ ID NO:9~10所示的引物对5、SEQ ID NO:11~12所示的引物对6、SEQ ID NO:13~14所示的引物对7、SEQ ID NO:15~16所示的引物对8和/或SEQ ID NO:17~18所示的引物对9在制备鉴别肉类的试剂中的用途。
其中,所述试剂是鉴别黄牛肉、牦牛肉、水牛肉、山羊肉、狗肉、猪肉、兔子肉、鸡肉和/或鸭肉中的试剂。
本发明建立了一种鉴定包括通常在青藏高原地区才能发现的牦牛在内的动物品种的鉴定方法。该方法是肉类市场所急需要的一种检测方法,可以检测mt DNA含量不同的混合样品。该方法需要具有精确性和和重复性以确保该方法在市场肉类产品鉴定中的权威性,并且该方法应该能够在不同的品种和地理区域进行验证。
本发明引物、试剂盒以及多重PCR检测方法,能够鉴定包括青藏高原地区在内的中国西南部动物肉类的方法,应用前景良好。
以下通过实施例形式的具体实施方式,对本发明的上述内容作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实施例。凡基于本发明权利要求书记载的内容所实现的技术均属于本发明的范围。
附图说明
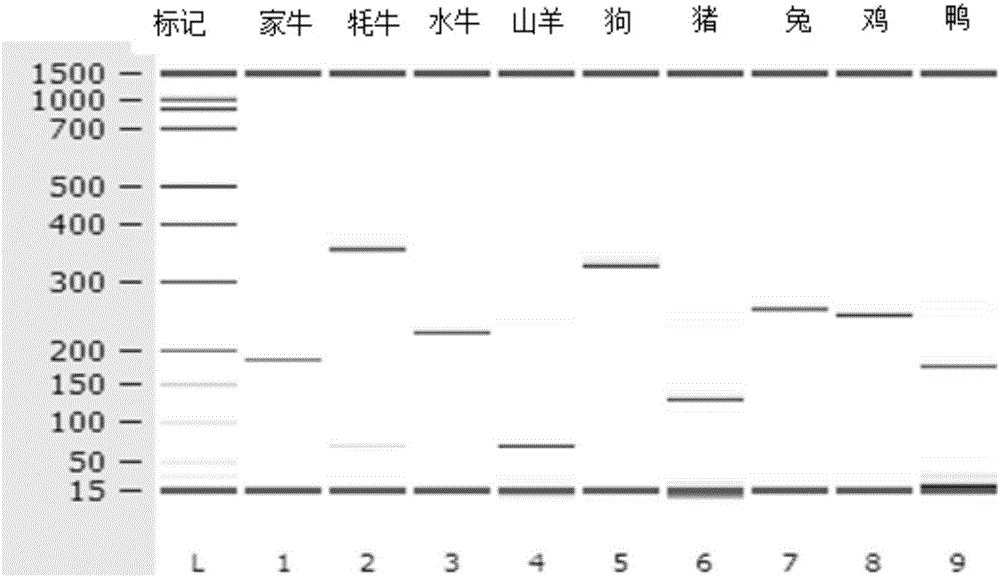
图1多重PCR在Agilent 2100 DNA芯片上的鉴定结果,标记:Agilent 2100 DNA marker;
图2牦牛和家牛线粒体DNA混合物在多重PCR中的检验结果;
图3特异性检测结果,其中,Ca:家牛,Ya:牦牛,Bu:水牛,Go:山羊,Do:狗,Pig:猪,Ra:兔,Ch:鸡,Du:鸭。
具体实施方式
本发明中,除非特别说明,所有的操作都按生产商的推荐步骤进行。
实施例1本发明检测方法
一、检测方法
1、样品准备,基因组DNA提取
本实验从中国西南部的9种动物共采集到72份肉类样品,包括:黄牛(川西北藏区,n=8)、牦牛(川西北藏区,n=8),s水牛(四川攀西地区,n=8)、藏山羊(川西北藏区,n=8)、狗(贵州铜仁,n=8)、猪(成都平原,n=8)、兔(成都平原,n=8)、鸡(成都平原,n=8)、鸭(成都平原,n=8)见附表1。基因组DNA用Qiagen公司的Qiagen Mini Kit(Qiagen,Hilden,Germany)进行提取,然后溶于水中。由于在基因组DNA中线粒体DNA含量较少,我们用Qiagen公司的REPLI-g线粒体DNA试剂盒从提取的基因组DNA中扩增线粒体DNA。
一般而言,典型的实验结果是50ul的反应体系中产生3~4ug/ul的线粒体DNA,肉干产品用蒸馏水漂洗过夜然后用Qiagen Mini Kit.进行提取。
2、序列特异引物设计
通过分析12S rRNA基因序列,设计的引物序列及相关信息如下表1所示:
我们通过单独的PCR和针对其他物种的交叉反应测试对引物的功能进行了判定。PCR反应在20μL的反应体系中进行,成分如下:1μL DNA模板、10mmol/L Tris-HCl(pH 8.3)缓冲液、2.5mmol/L MgCl2、50mmol/L KCl、10pmol/L引物、和1单位的TaqDNA聚合酶(TsingKe biotech co.,Chengdu,China)。扩增循环参数为:94℃,30s;60℃,15s;最后在72℃延伸15s。
3、多重PCR
多对引物被混合在同一个PCR反应中进行。最后的反应体系体积为40μL,其中包含PCR Master Buffer(100mM TRIS-HCl,15mM MgCl2,pH8.0),dNTP(200mM)、1.5units TaqPolyemrase(TsingKe Biotech co.,Chengdu,China)、通用正向引物的和物种特异的反向引物(最终的浓度变化范围是375nM至938nM,见表1)、无菌水和1μL的扩增后的线粒体DNA。PCR的循环参数为:先在如下的循环参数下执行33个循环:95℃,30s、60℃,15s、72℃,15s,然后在72℃延伸3minC(Eppendorf,Germany)。多重PCR的反应条件由Minitab 16的一般线性模型进行优化(Minitab co.,Pennsylvania,USA)。所有的样品均用3%的琼脂糖凝胶电泳进行分析,并用Agilent DNA1000生物分析仪进行分析(Agilent Technologies co.,California,USA)。
4、重复性评估
为评估多重PCR结果中引物对内部和相互之间的作用和精确性,我们使用了9个位点特异的引物,5种动物((黄牛(Boridae),牦牛(Boridae),狗(Canidae),猪(Suidae),和鸡(Plasianidae))进行了2轮3重复的PCR实验。用Agilent DNA 1000对PCR产物产量进行评估,并用CV%进行重复性的计算。
5、检测的低限的确定
因为观察到鸭肌肉样品(Anatidae)在凝胶电泳的实验结果中只有微弱的信号,我们对线粒体DNA模板含量的高低对多重PCR的影响进行了研究。根据我们在实际提取DNA提取过程中所获得的DNA浓度情况,检测中我们使用了60ng,6ng,600pg,60ng,和6pg的DNA总量来进行检测实验。每份DNA均用REPLI-g线粒体DNA试剂盒(Qiagen,Hilden,Germany)对样品的线粒体DNA进行了扩增。以此检测模板对实验结果的影响。
6、混合样品检测
作为跨物种和物种群体组内的混合样品,研究中制备了含100-%,90-%,80-%,50-%,20-%,10-%牦牛(Boridae)和鸡(Plasianidae)样品的混合物。此外,实验中也制备了牦牛(Boridae)和黄牛(Boridae)同一物种动物组内的典型的物种混合样品来进行检测。
7、特异性检测
为了检测多重反应的精确性,实验准备了9种动物72种组织的盲测样品来对设计引物和多重PCR的特异性进行检测。
二、检测结果
1、多重PCR的结果
在多重PCR中,每个物种均被设计为产生特定条带的PCR片段,并且每个PCR片段都能与其它8个物种产生的PCR片段成功区分(图1)。
2、再现性、最低限度、混合物和特异性的检测结果如下表2所示:
表2再现性、最低限度、混合物和特异性的检测结果
采用Agilent DNA 1000芯片检测实验中三重复的数量来评估组间和组内的重复性。再现性结果如表2所示,特定样品的PCR产物量在同一批次略高于不同的实验重复,并且每个PCR产量有不同的重复性。此外,当我们评估Agilent DNA 1000芯片(R&R,Minitab 2016)的标准差时,标准差为19.6%。因此,PCR产物的变异包含在测定系统的变异之中。实验结果说明,本发明方法的重复性好。
由于多重PCR中需要检测最低限度的信号,我们用鸭的肌肉样品(60ngto 6pg)对检测的低限进行了测定。检测最低限度的结果如表2所示,本发明方法在基因组DNA为6pg的情况下,仍能准确检测,说明本发明方法的检测限度低,灵敏度高。
为检测混合样品,我们用黄牛和牦牛的线粒体DNA进行任意混合作为一个实验动物组来扩增全线粒体DNA。同时将牦牛和鸡的样品按不同的比例(1:9,2:8,5:5,8:2,9:1)混合作为不同物种混合的另一组样品组。两个相近物种的混合样品代表了市场上的假冒商品(经常报道的作假例子)。结果两个物种可以用本发明方法的多重PCR产物大小顺利分开(图2,表2)。并且PCR产物的产量也依赖于样品模板DNA的混合比例。在牦牛和鸡线粒体DNA混合的例子中,牦牛PCR产物产量甚至没有达到最低的线粒体DNA浓度(牦牛:鸡=10:90),但是鸡的PCR产物产量增加到了给定的线粒体DNA量。研究结果表明,根据模板浓度的不同,多重PCR引物竞争将产生不同的产物模式。
为检测本研究方法的实际扩增效果和准确度,我们对从中国西南部采集到的72份动物肉样进行了检测。结果如表2和图3所示,本发明方法可以准确检测71个样品,样品准确度几乎达到100%。
三、讨论
在实际的市场上,有许多混合的肉类产品。因此,本研究建立的肉类鉴定检测方法的可靠性仍需要使用混合样品进行确认。牦牛和黄牛均属于牛科,从遗传角度看区分它们是比较困难的。因此,用我们建立的方法对牦牛和黄牛的混合样品是进行区分是最好例子。由于经济利益驱使,市场上它们的混合产品也较多。我们的检测结果表明,我们的检测方法能够清晰的区分牦牛和黄牛样品。此外,即使在检测反应中只加入少量的线粒体DNA(例如只加入我们研究方法中10%线粒体DNA,见图2和表2),该方法也能将之与其它物种顺利区分。与陈研究小组(2010)建立的混合PCR方法在混合样品20%的检测底限的结果相比,本研究建立的检测低限更低(10%)。当我们检测不同家族混合样品时(例如,以牦牛和鸡混合制作样品),本方法也能很好的区分彼此。
同时本发明用真实的肉类产品对我们方法的可靠性进行检测,实际使用了从市场上采集的9个物种的72份真实肉样进行了检测。结果有71份样品完全吻合它们的检测标志(表2和图3)。这些结果表明,我们的检测方法优于Naue建立的HRM分析方法的特异性(28个肉样中的24个,Naue et al,2014)。
四、结论
本发明PCR检测方法可以对包括牦牛等青藏高原物种进行区分,该方法的重现性好、检测限低、特异性好,可以对混合样品进行检测。
综上,本发明引物、试剂盒和PCR方法可以特异扩增各种不同的肉类,特异性好,而且灵敏度高,重现性好,为现有肉类检测提供了一种权威的认证方法,可用于在市场上消除虚假牦牛肉和肉类产品,市场应用前景优良。
SEQUENCE LISTING
<110> 西南民族大学
<120> 一种肉类检测试剂盒和方法
<130> GY223-16P1532
<160> 22
<170> PatentIn version 3.5
<210> 1
<211> 25
<212> DNA
<213> P1-1F
<400> 1
gtgacaaaaa ttaagccata aacga 25
<210> 2
<211> 22
<212> DNA
<213> 1_Ca_P1-1R
<400> 2
tcatggcttt ttacagcttg gt 22
<210> 3
<211> 21
<212> DNA
<213> P2-2F
<400> 3
gataccccac tatgcttagc c 21
<210> 4
<211> 22
<212> DNA
<213> 2-Ya-P2-1R
<400> 4
atttcataat aactttcgtg ca 22
<210> 5
<211> 24
<212> DNA
<213> P1-1F
<400> 5
gtgacaaaaa ttaagccata aacg 24
<210> 6
<211> 25
<212> DNA
<213> 4_Bu_P1-2R
<400> 6
gctgttatag agtcactttc gttgc 25
<210> 7
<211> 24
<212> DNA
<213> P1-1F
<400> 7
gtgacaaaaa ttaagccata aacg 24
<210> 8
<211> 22
<212> DNA
<213> 5_Go_P1-2R
<400> 8
gatttaccaa ccctggtcaa ca 22
<210> 9
<211> 21
<212> DNA
<213> P2-2F
<400> 9
gataccccac tatgcttagc c 21
<210> 10
<211> 21
<212> DNA
<213> 7_Do_P2-1R
<400> 10
acattcgtga aatgttcttg g 21
<210> 11
<211> 24
<212> DNA
<213> P1-1F
<400> 11
gtgacaaaaa ttaagccata aacg 24
<210> 12
<211> 20
<212> DNA
<213> 8_Pig_P1_1R
<400> 12
aacactcttt acgccgtgga 20
<210> 13
<211> 21
<212> DNA
<213> P2-2F
<400> 13
gataccccac tatgcttagc c 21
<210> 14
<211> 20
<212> DNA
<213> 9-Ra-P2-1R
<400> 14
acctaacgtt tttacggtgg 20
<210> 15
<211> 21
<212> DNA
<213> P2-2F
<400> 15
gataccccac tatgcttagc c 21
<210> 16
<211> 21
<212> DNA
<213> 10-Ch-P3-1R
<400> 16
gctattgagc tcactgttgt t 21
<210> 17
<211> 21
<212> DNA
<213> P2-2F
<400> 17
gataccccac tatgcttagc c 21
<210> 18
<211> 17
<212> DNA
<213> 11-Du-P3-2R
<400> 18
aaggggcggt tgggttg 17
<210> 19
<211> 25
<212> DNA
<213> P1-1F
<400> 19
gtgacaaaaa ttaagccata aacga 25
<210> 20
<211> 21
<212> DNA
<213> P1-1R
<400> 20
agggctaagc atagtggggt a 21
<210> 21
<211> 21
<212> DNA
<213> P2-2F
<400> 21
gataccccac tatgcttagc c 21
<210> 22
<211> 23
<212> DNA
<213> P2-2R
<400> 22
gaatctattt gaggagggtg acg 23
- 还没有人留言评论。精彩留言会获得点赞!
- 一种用于检测犬副流感病毒试剂盒的制造方法与工艺
- 腹泻相关病毒多重基因检测体系及其试剂盒和应用的制造方法与工艺
- 基于POCKIT Micro荧光PCR平台的禽流感病毒H7亚型检测试剂及应用的制造方法与工艺
- 一种流行性乙型脑炎的重组酶常温扩增核酸(RT‑RPA)试纸条检测试剂盒及应用的制造方法与工艺
- 一种腺苷高半胱氨酸酶基因启动子区甲基化程度检测试剂盒及测定方法与流程
- 一种检测心肌梗死的试剂及其应用的制造方法与工艺
- 用于检测CDKN2B基因变异的试剂盒及CDKN2B基因变异率的定量检测方法与流程
- 一种CYP2C19*3基因型检测试剂盒及其检测方法与流程
- 一种CYP2C19*2基因型检测试剂盒及其检测方法与流程
- 基于高通量测序法的人类多基因突变检测试剂盒的制造方法与工艺