一种检测猪肺炎支原体的引物对、试剂盒及Syto9荧光定量PCR‑HRM检测方法与流程
本发明属于分子生物学检测技术领域,具体地涉及一种检测猪肺炎支原体的引物对、试剂盒及Syto9荧光定量PCR-HRM检测方法。
背景技术:
猪支原体病(Mycoplasmal Diseases)是指由猪肺炎支原体(M.Hyopneumoniae,Mhp)、猪鼻支原体(M.hyorhinis,Mhr)、猪滑液支原体(M.hyosynoviae,Mhs)和猪嗜血支原体(猪附红细胞体)和絮状支原体等寄生于宿主猪,引起猪肺炎、浆膜炎、关节炎和黄疸性贫血等症状性疾病。其中,Mhp是引起猪支原体肺炎又称“喘气病”的病原微生物,其主要危害是引起猪的生长受阻和饲料转化率大幅下降,其高致病率严重影响养猪业的经济效益。
检测Mhp的常用方法有分离培养、核酸探针、PCR、微粒凝集试验、免疫荧光试验和酶联免疫吸附试验等。虽然Mhp可以在人工培养基上生长,但对营养要求极为苛刻,且培养时间长,容易被其他病原微生物污染。血清学检测方法与其他支原体之间存在严重交叉反应,给Mhp的鉴别诊断带来了困难。随着现代分子生物学技术的快速发展,荧光PCR技术不仅克服了血清学交叉反应的缺点,而且敏感、快速、方便。
荧光PCR 技术大致分为荧光探针法(标记荧光PCR)和通用型的荧光染料法(非标记荧光PCR)。前者利用荧光标记的特异性探针或者引物来识别模版,优点是特异性更高,适用于扩增序列专一检测,不过检测成本要高很多。而后者主要是利用荧光染料与双链DNA 分子结合发光的特性来指示扩增产物的增加,其优点是:无需另外设计荧光探针,简便易行,成本较低。其中,荧光染料又分为非饱和染料(如SYBR Green)和饱和染料(如LC Green 等)。
相对SYBR Green 等非饱和染料来说,Eva Green、LC Green、Syto9等饱和染料具有以下优点:①饱和的染料对PCR 反应没有任何抑制作用,因此可以在PCR 反应之前加入,而其它非饱和荧光染料若较多加入到反应液中会抑制PCR 反应,因此只能限量加入,从而对荧光PCR 反应的指示受到限制。②DNA 高温变性时,非饱和荧光染料加入则会造成DNA 双链高温变性时,单链部分的荧光染料分子发生迁移,荧光染料分子重新结合到双链DNA 的空置位点,造成荧光信号没有变化,因此出现假阴性,特异性下降,而饱和染料则不会出现此类情况。③高温稳定,对于高GC 含量的PCR 产物,Tm 值较高,在DNA 双链高温熔解时,饱和荧光染料结合核酸更稳定。
高分辨率熔解曲线(high-resolution melt,HRM) 分析技术是近几年来在国外兴起的一种用于基因突变扫描和基因分型的最新遗传学分析方法。HRM 利用了特定的染料可以插入DNA 双链中的特性,通过实时监测升温过程中双链DNA 荧光染料与PCR 扩增产物的结合情况记录熔解曲线,从而对样品进行检测。因其操作简便快速,使用成本低,结果准确,实现了真正的闭管操作,HRM 技术受到普遍关注。
因此,拟开发一种基于饱和荧光染料Syto9的检测Mhp的荧光定量PCR-HRM方法,以便更好地避免假阳性和假阴性的干扰,最终为猪肺炎支原体的流行病学调查及疫情预警提供技术支持。
技术实现要素:
本发明的目的在于提供一种检测猪肺炎支原体的引物对、试剂盒以及Syto9荧光定量PCR-HRM检测方法。
本发明所采取的技术方案是:
用于检测猪肺炎支原体的荧光定量PCR引物对,其核苷酸序列如下所示:
上游引物P1 :5’- GWCAAAGTCAAAGTCAGCAAAC -3’(SEQ ID NO:1);
下游引物P2 :5’- AGCTGTTCAAATGCTTGTCC -3’ (SEQ ID NO:2)。
一种检测猪肺炎支原体的Syto9荧光定量PCR-HRM方法,包括如下步骤:
(1)提取待测样品DNA;
(2)以步骤(1)提取的DNA为核酸模板,以Syto9为荧光染料,用权利要求1所述的用于检测猪肺炎支原体的荧光定量PCR引物对进行PCR扩增;
(3)将步骤(2)获得的PCR扩增产物进行高分辨率熔解曲线分析;
(4)结果判定:形成特异性的熔解曲线峰型为阳性,无特异的熔解曲线峰型为阴性。
其中,步骤(2)所述的PCR扩增反应的25 μL体系中含有2xTaq Plus Master Mix 12.5 μL,P1 和P2引物(100 pmol/μL)各1.0 μL,核酸模板2.0 μL,Syto9 1.0 μL,余量为去离子水。
其中,步骤(2)所述的PCR扩增反应程序为首先94℃ 5 min;随后94℃ 20 s、54.5℃ 20 s、72℃ 20 s,循环扩增45次;最后72℃延伸7 min。
其中,步骤(3)所述的高分辨率熔解曲线分析程序为98℃变性2min,40℃杂合2min,74℃~83℃以0.3℃/s的熔解速率运行。
一种猪肺炎支原体的荧光定量PCR检测试剂盒,含有上述用于检测猪肺炎支原体的荧光定量PCR引物对。
本发明的有益效果是:
本发明建立了一种基于饱和荧光染料Syto9的荧光定量PCR-HRM方法检测猪肺炎支原体。该方法操作简单,只需在PCR反应之前加荧光饱和染料Syto9即可;检测速度快且高通量,全部操作过程只需2~3小时,极大缩短了检测所需时间;费用低,不需要特异性荧光标记探针,每个样品的饱和染料成本为1.6 RMB;准确性高,相关系数大于0.99;特异性好,可有效区分包括Mhr、Mhs等猪病原;灵敏度高,最低检出限可低至4.56拷贝/μL,结合HRM的闭管检测技术可避免假阳性或假阴性的出现,更易于应用与推广。
附图说明
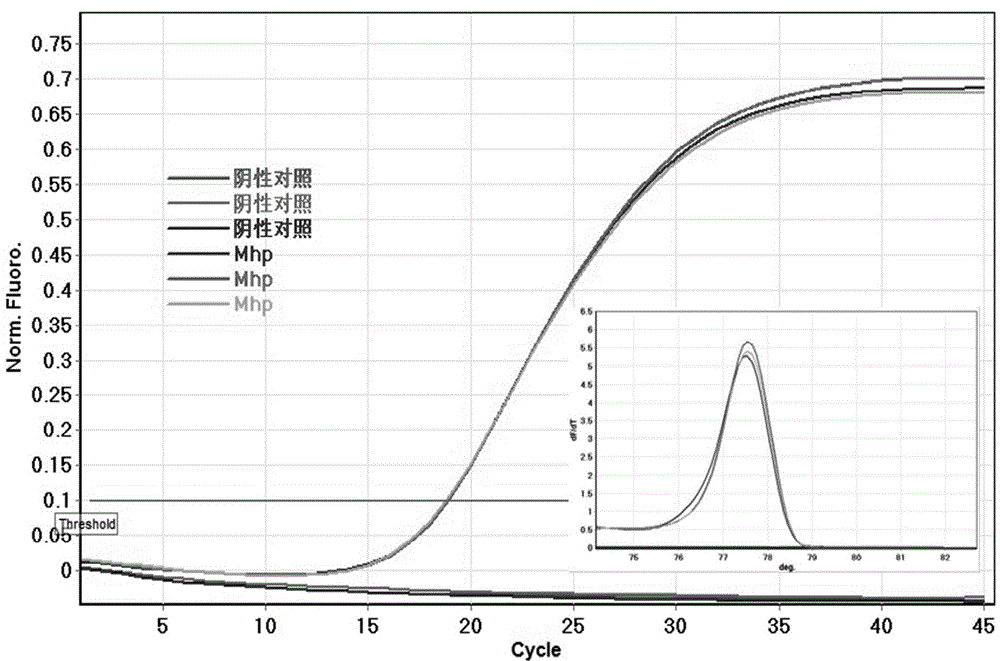
图1:猪肺炎支原体扩增曲线及HRM分析图;
图2:荧光定量方法标准曲线及HRM分析图;
图3:特异性实验扩增曲线图及熔解曲线图;
图4:灵敏度试验扩增曲线及熔解曲线图;
图5:临床样本检测图,L1~L8为8份临床肺脏样品,N1~N5为5份鼻拭子。
具体实施方式
用于检测猪肺炎支原体的荧光定量PCR引物对,其核苷酸序列如下所示:
上游引物P1 :5’- GWCAAAGTCAAAGTCAGCAAAC -3’(SEQ ID NO:1);
下游引物P2 :5’- AGCTGTTCAAATGCTTGTCC -3’ (SEQ ID NO:2)。
一种检测猪肺炎支原体的Syto9荧光定量PCR-HRM方法,包括如下步骤:
(1)提取待测样品DNA;
(2)以步骤(1)提取的DNA为核酸模板,以Syto9为荧光染料,用权利要求1所述的用于检测猪肺炎支原体的荧光定量PCR引物对进行PCR扩增;
(3)将步骤(2)获得的PCR扩增产物进行高分辨率熔解曲线分析;
(4)结果判定:形成特异性的熔解曲线峰型为阳性,无特异的熔解曲线峰型为阴性。
其中,步骤(2)所述的PCR扩增反应的25 μL体系中含有2xTaq Plus Master Mix 12.5 μL,P1 和P2引物(100 pmol/μL)各1.0 μL,核酸模板2.0 μL,Syto9 1.0 μL,余量为去离子水。
其中,步骤(2)所述的PCR扩增反应程序为首先94℃ 5 min;随后94℃ 20 s、54.5℃ 20 s、72℃ 20 s,循环扩增45次;最后72℃延伸7 min。
其中,步骤(3)所述的高分辨率熔解曲线分析程序为98℃变性2min,40℃杂合2min,74℃~83℃以0.3℃/s的熔解速率运行。
一种猪肺炎支原体的荧光定量PCR检测试剂盒,含有上述用于检测猪肺炎支原体的荧光定量PCR引物对。
下面结合实施例对本发明做进一步解释,但不局限于此。实施例中未详细说明的操作为本领域技术人员所熟知的常规操作。
实施例1猪肺炎支原体的Syto9荧光定量PCR-HRM检测方法的建立
(1)用于检测猪肺炎支原体的荧光定量PCR引物对的设计
对GenBank中登录的不同国家和地区Mhp P102基因的序列进行分析,针对保守区设计一对引物,如下:
上游引物P1:5’-GWCAAAGTCAAAGTCAGCAAAC-3’(SEQ ID NO:1);
下游引物P2:5’-AGCTGTTCAAATGCTTGTCC -3’(SEQ ID NO:2);
预期扩增片段大小为138bp。
(2)重组质粒标准品的制备
按照DNA提取试剂盒说明书提取Mhp的DNA,以其为模板,用步骤(1)设计的P1和P2引物进行PCR扩增,PCR产物回收纯化后,克隆于pMD18-T载体中构建重组质粒,经PCR鉴定和测序显示,PCR产物约为138bp,获得正确的重组质粒。
以重组质粒为荧光定量PCR的标准品,测定阳性重组质粒浓度为142.53 ng/μL,根据公式计算分子拷贝数为4.56×1010拷贝/μL,依次做10倍梯度稀释,将质粒稀释至浓度范围为4.56×109拷贝/μL~4.56×100拷贝/μL ,用作标准曲线的建立及灵敏度试验研究。
(3) PCR扩增及HRM分析
参照2xTaq Plus Master Mix(Vazyme)产品说明书,按以下组成配制PCR反应液。采用25 μL 的PCR 反应体系,在0.2 mL PCR 反应管内分别加入2xTaq Plus Master Mix 12.5 μL,P1 和P2引物(100 pmol/μL)各1.0 μL,核酸模板2.0 μL,Syto9 1.0 μL,去离子水7.5 μL。PCR 反应程序为:94 ℃ 5 min;94 ℃ 20 s、54.5 ℃ 20 s、72 ℃ 20 s,循环扩增45 次;最后72℃延伸7 min。
熔解曲线分析,采用Rotor gene Q2仪器,程序为:98℃变性2min,40℃杂合2min,74℃到83℃以0.3℃/s的熔解速率进行高分辨率熔解曲线分析。HRM试验结果用Rotor gene Q软件进行分析。
以标准样品Mhp为核酸模板,水为阴性对照,每个样品重复三次。结果如图1所示,峰型化熔解曲线图显示,形成单峰Tm值为77.49±0.1℃,无非特异性扩增。
(4)标准曲线的建立
选取重组质粒5个稀释度(4.56×109拷贝/μL到4.56×105拷贝/μL),每个稀释度重复三次,以各浓度梯度的质粒DNA为模板,采用建立的荧光定量PCR进行扩增,得到动力学曲线,并通过仪器软件自动生成标准曲线。
结果如图2所示,标准曲线方程为y=-3.118x+39.675,相关系数R2=0.99343,结果呈良好线性关系。HRM分析表明,无非特异性扩增。
(5)特异性试验
以猪肺炎支原体(Mhp)、猪鼻支原体(Mhr)、猪滑液支原体(Mhs)、猪圆环病毒(PCV2)、猪伪狂犬病病毒(PRV)的DNA及猪繁殖与呼吸综合征病毒(PRRSV)的cDNA为模板进行荧光定量PCR反应,以验证该方法的特异性。
结果如图3所示,只有Mhp有扩增曲线及特异的熔解曲线,其余均无,表明建立方法特异性良好。
(6)敏感性试验
选取重组质粒10个稀释度(4.56×109拷贝/μL到4.56×100拷贝/μL),以各浓度梯度的重组质粒DNA为模板,采用建立的荧光定量PCR为模板,以确定最低检测限,判定标准以形成特异性的熔解曲线峰型为阳性,无特异的熔解曲线峰型为阴性。
结果如图4所示,在模板浓度低至4.56×100拷贝/μL时,还有明显的扩增曲线及熔解峰形成。
实施例2 临床样品检测
以Mhp为阳性对照,水为阴性对照,采用本研究建立的基于饱和荧光染料Syto9的猪肺炎支原体荧光定量检测方法,检测临床肺脏样品8份、鼻拭子5份。
具体检测方法如下:
(1)提取待测样品DNA:按照DNA提取试剂盒进行;
(2)以待测样品DNA为核酸模板,用实施例1步骤(1)所设计的P1和P2引物进行PCR扩增,参照2xTaq Plus Master Mix(Vazyme)产品说明书,按以下组成配制PCR反应液:采用25 μL 的PCR 反应体系,在0.2 mL PCR 反应管内分别加入2xTaq Plus Master Mix 12.5 μL,P1 和P2引物(100 pmol/μL)各1.0 μL,核酸模板2.0 μL,Syto9 1.0 μL,去离子水7.5 μL;PCR 反应程序为:首先94 ℃ 5 min;随后94 ℃ 20 s、54.5 ℃ 20 s、72 ℃ 20 s,循环扩增45 次;最后72℃延伸7 min;
(3)将步骤(2)的PCR扩增产物闭管置于RotorgeneQ2仪器,进行高分辨率熔解曲线分析,程序为:98℃变性2min,40℃杂合2min,74℃到83℃以0.3℃/s的熔解速率进行高分辨率熔解曲线分析,HRM试验结果用Rotor gene Q软件进行分析;
(4)判定标准:以形成特异性的熔解曲线峰型为阳性,无特异的熔解曲线峰型为阴性。
样品检验结果如图5所示,5份肺脏样品(L2、L4、L5、L6、L7)和3份鼻拭子样品(N1、N2、N4)均出现特异性的熔解曲线峰型,判断为阳性,其余为阴性。
SEQUENCE LISTING
<110> 广东省农业科学院动物卫生研究所
<120> 一种检测猪肺炎支原体的引物对、试剂盒及Syto9荧光定量PCR-HRM检测方法
<130>
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 22
<212> DNA
<213> 人工序列
<400> 1
gwcaaagtca aagtcagcaa ac 22
<210> 2
<211> 20
<212> DNA
<213> 人工序列
<400> 2
agctgttcaa atgcttgtcc 20
- 还没有人留言评论。精彩留言会获得点赞!