一种检测NMP22的试剂盒及其制备方法与流程
本发明是一种检测NMP22含量的试剂盒及其制备方法,涉及双抗体夹心吖啶酯标记管式化学发光免疫分析法(Chemiluminesent Immunoassay,CLIA)检测人尿液中NMP22浓度水平的试剂盒的制备工艺。
背景技术:
在泌尿系统肿瘤当中,膀胱癌的发病率高居首位,近年来膀胱癌的发病率有上升趋势。大部分膀胱癌患者确诊时处于分化良好或中等分化的非肌层浸润性膀胱癌,其中约10%的患者最终发展为肌层浸润性膀胱癌或转移性膀胱癌在保留膀胱的各种手术治疗中,约50%在2a内肿瘤可能复发,约10%-15%的复发肿瘤恶性程度有增加趋势,因此长期随访早期发现肿瘤复发是膀胱肿瘤治疗成功的关键之一。
目前,寻找特异、敏感、稳定的早期诊断标志物,对膀胱癌的早期诊断治疗和预后判断起到了积极的作用。膀胱镜检查及活检是膀胱癌的诊断金标准,但属侵入性的检查,且有较高的经济成本,并存在尿路感染的风险。
研究发现,膀胱癌患者细胞中核基质蛋白(nuclear matrix protein)浓度为正常细胞的25倍。NMP22在细胞凋亡后,由细胞核释出,以可溶性复合物或片段的形式存在于尿中,膀胱癌患者尿NMP22浓度水平为非癌对照组的20-80倍。临床工作中,NMP22肿瘤标记物在膀胱癌中的检测对膀胱癌的早期诊断治疗和预后判断起到了积极的作用。
核基质蛋白构成了细胞核的内部结构框架,并与DNA复制、RNA合成、激素结合等功能有关。进一步的研究表明NMP22参与了基因表达的调节和协调。Fey和Penman的研究表明,NMP的表达存在细胞间差异。
核有丝分裂器蛋白(NuMA)在核基质蛋白中占有很大的比例。它在分裂间期的细胞核内是分散的,在有丝分裂期位于纺锤体两极。核有丝分裂器蛋白最初由Lydersen和Pettijohn在分析染色质非组蛋白时首次报道22。随后,核分裂器蛋白的其他功能被提了出来,包括维持细胞核结构,建立/维持有丝分裂纺锤体和有丝分裂后细胞核的重建。
在结构上,这一240KD的核有丝分裂器蛋白含有球形的头部和由中央螺旋竿分割开来的尾部结构域。核有丝分裂器蛋白的cDNA已被数个研究小组克隆并测序,虽然所报道的序列有所差异。在肿瘤细胞内,核有丝分裂器蛋白的升高与恶性细胞的细胞核结构/形态改变相符合。由于细胞死亡(如凋亡),该蛋白从细胞内释放出来,并达到可检测的水平。利用识别核分裂器蛋白特定区域的单克隆抗体对尿液中由膀胱肿瘤细胞释出的核分裂器蛋白进行检测。尿核基质蛋白22(NMP22)检测试剂盒(胶体金法)试验所检测的核分裂器蛋白抗原部分被Matritech公司称为NMP22。
目前市场中检测NMP22的方法有胶体金法。其中胶体金法,灵敏度较低,易出现假阳性,其结果易受主观因素的影响。本发明是采用化学发光免疫分析法检测NMP22含量。
化学发光免疫测定(CLIA)技术是继酶免技术(EIA)、放免技术(RIA)、荧光免疫技术(FIA)和时间分辨荧光免疫技术(TRFIA)之后发展的一项新兴测定技术。根据发光物质(原理)的不同,可以分为直接化学发光免疫分析和化学发光酶免疫分析、以及电化学发光几大类型。其中直接化学发光剂在发光免疫分析过程中不需酶的催化作用,直接参与发光反应,它们在化学结构上有产生发光的特有基团,可直接标记抗原或抗体,而且采用纳米磁性微珠分离。如用吖啶酯直接标记抗体(抗原),与待测标本中相应的抗原(抗体)发生免疫反应后,形成固相包被抗体-待测抗原-吖啶酯标记抗体复合物,这时只需加入氧化剂(H2O2)和NaOH使成碱性环境,吖啶酯在不需要催化剂的情况下分解、发光。CLIA特异性强、敏感性高,可检测到10-15mol/L的抗原量。快速,一般几十分钟或1~3小时内完成;操作简便,可进行固相和均相分析;试验重复性好,试剂易标准化和商品化,且不象放射分析那样存在强烈的环境污染和健康危害,是一种非常优秀的检测分析方法。目前已用于多种药物、激素、病原微生物及其代谢产物、抗体及其他生物活性物质的测定,并在临床尤其是大型医院有着较为广泛的应用。纳米磁性微珠分离是目前世界上最先进的分离手段,直接发光法不易受到检测样品中其他物质干扰,是目前世界技术最领先的发光模式。所以采用化学发光免疫分析法测定NMP22浓度。
本发明利用单位及合作团队共同研制的具有自主知识产权的全自动化学发光免疫分析仪Caris200,测定NMP22含量的试剂盒,应用于人尿液NMP22含量的检测,从而辅助膀胱癌早期诊断及预后监测等医疗需求。
本发明的试剂盒作为国内首个适用于Caris200的配套的测定NMP22的试剂盒,并利用管式吖啶酯标记的化学发光法,具有灵敏度高、特异性强、稳定性好、操作简便及成本低廉等显著优点。
技术实现要素:
本发明采用于全自动化学发光免疫分析仪Caris 200检测NMP22含量试剂盒(以下简称NMP22-CLIA试剂盒)。该试剂盒采用双抗体夹心免疫分析方法,利用化学发光磁性微球免疫技术,将抗-NMP22抗体-生物素-链霉亲和素的磁性微球和反应杯中的标准品/样本中的NMP22特异结合,然后再与吖啶酯盐标记的另一株抗-NMP22抗体反应形成免疫复合物,经预激发液(Pre-Trigger)和激发液(Trigger)的酸碱化学反应,即可测量化学发光反应的相对光单位(RLU/s);标准品/样本中NMP22的含量和光学系统所测量出的相对光单位(RLU/s)成正比关系,通过标准曲线拟合,从而对可对尿液标本中NMP22含量进行定量测定。
为了实现本发明,发明人采用了以下技术方案:
1)筛选确认试剂反应实现所需的核心原料,过程包括以下步骤:
①链霉亲和素与磁性微球偶联;
②亲和素连接NMP22抗体;
③以吖啶酯标记NMP22抗体;
④配制与吖啶酯作用的发光底物液:预激发液和激发液;
⑤配制NMP22抗体的校准品和质控品;
⑥试剂盒的组装;
2)试剂盒的性能评价,过程包括以下步骤:
①反应体系的建立与优化:即绘制剂量-反应标准曲线并优化生物素标记抗体和吖啶酯标记抗体浓度;
②实验室性能评估:即确定试剂盒的最低检测量、准确性、精密度和剂量-反应曲线的线性;
③稳定性实验:即试剂盒在加速破坏实验中稳定性测试,确定试剂盒的储存条件;
④cut-off值的建立:即通过临床样本的检测,设定试剂检测时的NMP22尿液正常参考值范围;
⑤临床样本的检测:即检测试剂盒的特异性。
本发明的试剂盒适用于全自动化学发光免疫分析仪Caris 200。
利用本发明的试剂盒进行检测,具有灵敏度高、特异性强、操作简单、检测范围宽(0~100IU/mL),范围较广、无放射性污染的特点,非常适用于临床检测。
附图说明
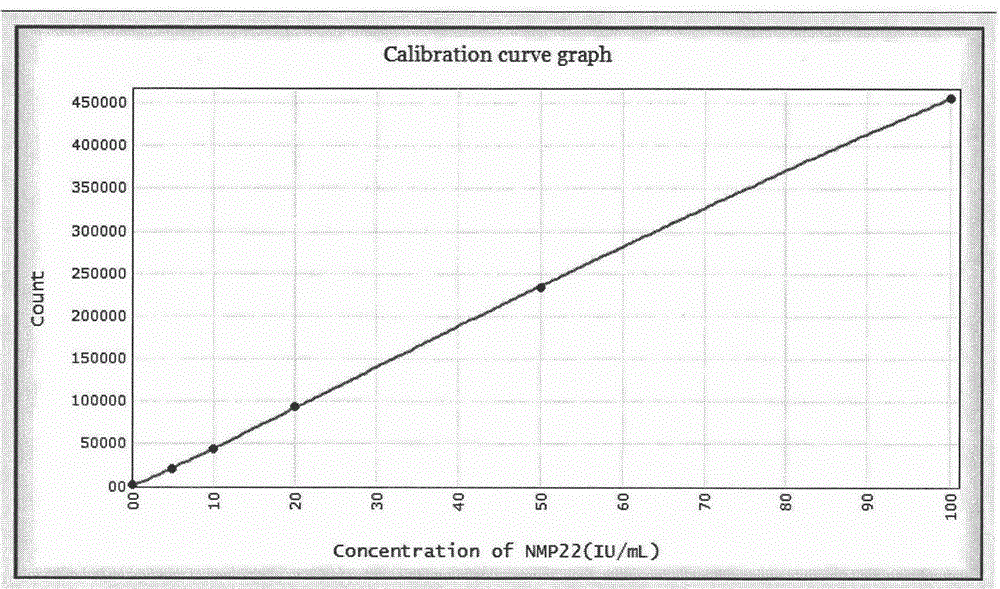
图1 NMP22-CLIA试剂盒检测剂量-反应标准曲线图。
图2 NMP22-CLIA试剂盒稳定性。
图3 NMP22-CLIA试剂盒反应线性及HOOK效应。
图4 NMP22-CLIA试剂盒检测健康者尿液浓度分布图(n=425)。
图5 NMP22-CLIA试剂盒检测100例尿液样本的ROC曲线。
具体实施方式
实施例1 链霉亲和素包被磁性微球的制备方法
1、链霉的预处理:
(1)将0.1mg链霉亲和素加入超滤离心管(10kDa)中,8000r/min离心5-6min。将离心浓缩后的链霉亲和素加入200uL Binding Buffer,8000-9000r/min离心5-6min,弃掉滤液,再加入200uL Binding Buffer,按上述方法离心。
(2)将几次离心后的离心管取出,弃掉滤液,把离心柱反转,2000-3000r/min离心1min,收集滤液,整个过程收集链霉亲和素大约200μL。
2、磁性微球的处理:
(1)用漩涡混合器充分混匀悬浮磁性微球,取20.0mg悬浮液到微量厚壁反应瓶中;
(2)将微量厚壁反应瓶置于磁分离架上约1分钟,小心移去上清;
(3)加入1mL Binding Buffer,用漩涡混合器充分混匀悬浮磁性微球;
(4)将微量厚壁反应瓶置于磁分离架上约1分钟,小心移去上清;
(6)加入50.0μL Coupling Reagent,用漩涡混合器充分混匀悬浮磁性微球;
(7)用磁性微球混合器旋转60分钟;
(8)将微量厚壁反应瓶置于磁分离架上约1分钟,小心移去上清;
(9)加入1mL Binding Buffer,用漩涡混合器充分混匀悬浮磁性微球;
(10)将微量厚壁反应瓶置于磁分离架上约1分钟,小心移去上清;
(12)加入已经预处理后的链霉亲和素,用Binding Buffer稀释至1mg/mL并用漩涡混合器充分混匀悬浮磁性微球;
(13)用磁性微球混合器,旋转包被16~20小时;
(14)将微量厚壁反应瓶置于磁分离架上约1分钟,小心移去上清;
(15)加入1mL TBST Buffer,用漩涡混合器充分混匀悬浮磁性微球;
(16)将微量厚壁反应瓶置于磁分离架上约1分钟,小心移去上清;
(17)将包被链霉亲和素的磁性微球用M试剂稀释液稀释至终浓度,存放于2-8℃。
实施例2 生物素连接NMP22抗体的制备方法
1、抗体的预处理:
(1)将1mg抗体加入超滤离心管(50kDa)中,8000r/min离心5~6min进行浓缩。将浓缩后的抗体加入200uL PB Buffer,8000~9000r/min离心5~6min,弃掉滤液,再加入200uL PB Buffer。
(2)将几次离心后的离心管取出,弃掉滤液,把离心柱反转,2000~3000r/min离心1min,收集滤液,整个过程收集抗体大约200μL。
2、抗体的标记:
用预处理后的抗体与生物素按50∶1质量比充分混匀,震荡16-20小时即可。然后经纯化仪进行纯化所得。将标记生物素的抗体用R1稀释液稀释至终浓度,存放于2~8℃。
实施例3 吖啶酯标记NMP22抗体的制备方法
1、抗体的预处理:
(1)将1mg抗体加入超滤离心管(50kDa)中,8000r/min离心5~6min进行浓缩。将浓缩后的抗体加入200uL PB Buffer,8000~9000r/min离心5~6min,弃掉滤液,再加入200uL PB Buffer。
(2)将几次离心后的离心管取出,弃掉滤液,把离心柱反转,2000~3000r/min离心1min,收集滤液,整个过程收集抗体大约200μL。
2、抗体的标记:用预处理后的抗体与吖啶酯按20∶1质量比充分混匀,震荡16-20小时即可。然后经纯化仪进行纯化所得。将标记吖啶酯的抗体用R2稀释液稀释至终浓度,存放于2~8℃。
实施例4 发光底物液的制备方法
本发明所使用的吖啶酯的化学发光底物液的配制方法:
预激发液:
激发液:pH为9-12
实施例5 NMP22校准品和质控品的制备方法
以含有明胶稳定剂的1%Mopso缓冲液为基质,加入核基质蛋白22(NMP22)纯品配制而成。制备的最终浓度为:
校准品1:0IU/mL;校准品2:5IU/mL;校准品3:10IU/mL;校准品4:20IU/mL;校
准品5:50IU/mL;校准品6:100IU/mL;
质控品:C1:2.5IU/mL,C2:25IU/mL,C3:80IU/mL。
实施例6 试剂盒的使用方法
1.装载试剂
1.1 M试剂为黄褐色磁性微球悬浮液,出现沉淀属于正常现象。首次将NMP22定量测定试剂装载到Caris200系统上前,需对M试剂瓶进行翻转混匀。
1.2如果目测磁性微球依然附着于瓶壁上,则需要继续翻转,直至磁性微球重新悬浮为止。如果长时间没有悬浮,则该试剂不能使用。
1.3将NMP22试剂按仪器要求装载于Caris200上,确保检测所需试剂全部上机。确保所有试剂瓶盖已经去除。
2.计算所需样本量
2.1首次进行NMP22检测时,需要先浆样本进行1∶10稀释,然后在样品杯中加入已稀释后的175μL样本,每增加一次检测需要向同一样本杯中加入50μL的样本。
2.2如果上机时间>3小时,为防止样本蒸发对检测造成不良影响,应适当增加样本量。
3.装载样本
将样本杯移入样本架中,按仪器要求装载样本并输入正确的样本信息。
4.运行仪器
按下仪器开始键,仪器将自动执行以下操作:
4.1移动样本到指定的位置;
4.2加载反应管;
4.3吸取和转移样本入反应管;
4.4移动反应管到指定位置,将M试剂和R1试剂加入反应管;
4.5混匀、孵育、洗涤反应混合物;
4.6添加R2试剂入反应管;
4.7混合、孵育和洗涤反应混合物;
4.8添加预激发液和激发液;
4.9测试化学发光的发光量;
4.10吸出反应管中液体倒入废液袋,卸载反应管至固体垃圾箱;
4.11计算结果。
实施例7 反应体系的建立与优化
反应模式的优化:以Ms202作为包被抗体,Ms203作为检测抗体,对标准品进行测定,采用两步法,两步法则先加入包被链霉亲和素、生物素标记抗体和标准品37℃孵育15min,洗涤2次后加入检测抗体,孵育10min,洗涤2次后加入预激发液上机检测的同时加入激发液,测发光强度。以抗原浓度的对数为横坐标,以发光值对数为纵坐标,绘制工作曲线(如图1所示)。
生物素标记抗体和吖啶酯标记抗体浓度的优化:将生物素标记的Ms202抗体稀释成一系列的稀释度,稀释比例为1∶200、1∶400、1∶800、1∶1200。将吖啶酯标记的Ms203抗体稀释成一系列的稀释度,稀释比例为1∶500、1∶1000、1∶1500。使用NMP22标准品作为检测样本,反应完成后测量RLU值。选择本底低,线性相关系数好的为最佳包被浓度和标记比例。从表1可以看出:(1)随着生物素标记抗体稀释度的降低,RLU值有明显上升,但是本底变化不大,所以灵敏度有所提高。在达到1∶400后,与1∶200稀释差别不明显,说明1∶400稀释已接近饱和。因此我们选择1∶400为生物素标记抗体的最佳稀释度;(2)随着标记吖啶酯稀释比例的提高,整体RLU值下降,当稀释比例为1000∶1时,本底低、灵敏度好。因此,选择生物素标记抗体的稀释度为1∶400,吖啶酯标记抗体的稀释度为1∶1000为最佳稀释比例。
表1最佳生物素标记抗体和吖啶酯标记抗体稀释度的确定
实施例8 试剂盒稳定性实验
将试剂盒的各组分(MP:链霉亲和素包被磁性微球,R1:生物素标记抗体R2:吖啶酯标记抗体,STD:标准品)放于37℃7天,检测工作曲线的发光值。如图2所示,与4℃对照相比较,各组分放置37℃7天后整体曲线相关系数变化不大,与对照组无差异;各组分分别于对照相比,曲线相关性变化基本无差异。试剂盒在加速破坏实验中稳定性能能良好。初步设定该试剂盒在4℃条件下可以稳定储存12个月。
实施例9 试剂盒的实验室性能
对实施例1的试剂盒进行实验室性能分析,结果如下:
1)最低检测量:2.5IU/mL。
2)准确性
用样本稀释液将NMP22抗原稀释成10IU/mL、20IU/mL、40IU/mL、80IU/mL四个浓度,测定其回收率在91.05%-106.8%之间。取高、中、低浓度(200IU/mL、100IU/mL、20IU/mL)三份NMP22抗原,用样本稀释液成50,25,10,测其回收率,回收率在92.45%-108.69%之间。
3)剂量-反应曲线的线性
将NMP22抗原稀释成一系列浓度进行测定,结果如图3所示,在120IU/mL时出现HOOK效应。故该检测试剂的线性范围为5~100IU/mL。
4)精密度(CV%)
将NMP22抗原用7.5%BSA稀释液成(20IU/mL、40IU/mL、80IU/mL)3个浓度。在一日内每份样本重复检测20次,结果显示批内变异系数(CV)为0.98-2.53%,在三个独立日内每份样本检测10次,结果显示批间变异系数为2.55-5.42%。
实施例10 试剂盒尿液检测cut-off值的建立
425例正常人样本,用于测定正常参考范围,年龄范围20-75岁,平均年龄51.52±16.22岁。50例临床患者尿液,临床诊断为膀胱癌患者,年龄范围27-70岁,平均年龄52.2±16.27岁;对照组50例,年龄20-60岁,平均年龄48.41±10.90岁。用试剂盒在Caris200上进行检测。采用百分位法结合ROC曲线法,设定cut-off值。结果检测的最低值为0.52IU/mL,最高值为9.73IU/mL,平均浓度(Mean)为3.65IU/mL,标准差(SD)1.563IU/mL。从表2-1、2-2及图4结果可以看出,95%样本的浓度值在5.93IU/mL以下,均值加2倍标准差等于6.776IU/mL,而当浓度值在6.776IU/mL以下时,包含了97.6%的标本。100例样本结果绘制ROC曲线,从图5可以得出取正确诊断指数=灵敏度-(1-特异度)=Sensitivity-(1-Specificity),AUC>0.996时其检测浓度为5.83。综合其他人的研究及临床现行参考值,建议设定本试剂检测时的NMP22尿液正常参考值范围为0-6IU/mL。
表2-1正常人尿液样本的年龄统计分析(n=425)
表2-2正常人尿液NMP22水平检测结果统计分析(n=425)
实施例11 试剂盒临床标本检测分析
100例临床尿液检测结果表3所示:50例膀胱癌患者尿液NMP22浓度为46.67±24.26IU/mL;50例对照尿液NMP22浓度为3.21±1.93IU/mL。膀胱癌患者尿液NMP22浓度明显高于对照组P=0.002<0.05,有显著差异。说明NMP22在膀胱癌方面特异性较高。
表3 100例尿液标本NMP22含量统计分析
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的人和附图标记视为限制所涉及的权利要求。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种用于检测犬副流感病毒试剂盒的制造方法与工艺
- 腹泻相关病毒多重基因检测体系及其试剂盒和应用的制造方法与工艺
- 基于POCKIT Micro荧光PCR平台的禽流感病毒H7亚型检测试剂及应用的制造方法与工艺
- 一种流行性乙型脑炎的重组酶常温扩增核酸(RT‑RPA)试纸条检测试剂盒及应用的制造方法与工艺
- 一种腺苷高半胱氨酸酶基因启动子区甲基化程度检测试剂盒及测定方法与流程
- 一种检测心肌梗死的试剂及其应用的制造方法与工艺
- 用于检测CDKN2B基因变异的试剂盒及CDKN2B基因变异率的定量检测方法与流程
- 一种CYP2C19*3基因型检测试剂盒及其检测方法与流程
- 一种CYP2C19*2基因型检测试剂盒及其检测方法与流程
- 基于高通量测序法的人类多基因突变检测试剂盒的制造方法与工艺