一种人工构建的大腹园蛛牵引丝蛋白基因及其构建方法与流程
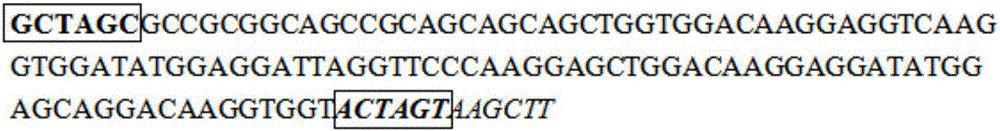
本发明属于基因工程技术领域。更具体地,涉及大腹园蛛牵引丝蛋白基因的人工构建方法及其应用。
背景技术:
蜘蛛丝是一种优良的天然蛋白纤维,具有高强度、高弹性、耐腐蚀、耐低温、轻盈、对环境友好等良好的性能,尤其是牵引丝是目前已知的最为坚韧的天然纤维之一,因此蜘蛛丝在军事、医学、工业、建筑、纺织等领域具有广泛的应用。
然而蜘蛛同类相食,不能高密度饲养以获取大量的蜘蛛丝,且蜘蛛的产丝量少,因而不能满足生产应用的需要,于是人们希望利用基因工程的方法,即将蜘蛛丝基因转入不同的生物体中来表达蜘蛛蛋白,由于蜘蛛丝蛋白基因为巨大的重复序列,处理全长基因序列非常困难,故人工构建高分子蜘蛛丝基因是这类工作的重要步骤之一。目前国际上人工构建最多的蜘蛛丝基因是络新妇属蜘蛛(Nephlia clavipe)牵引丝蛋白序列,现已分别在大肠杆菌、酵母、烟草、土豆、奶牛和家蚕等生物中尝试表达。
大腹园蛛在我国分布广泛,为常见蛛种,所结网较大且丝性能非常突出。然而目前还未有关于人工构建大腹园蛛高分子牵引丝蛋白基因的相关研究和报道。
技术实现要素:
本发明要解决的技术问题是克服上述现有技术的缺陷和不足,提供一种人工构建的大腹园蛛高分子牵引丝蛋白基因,为今后利用基因工程方法生产大腹园蛛高分子牵引丝蛋白提供靶标基因,服务于生产实际需要。
本发明的目的是提供一种人工构建大腹园蛛牵引丝蛋白基因的方法。
本发明另一目的是提供一种人工构建的大腹园蛛牵引丝蛋白基因。
本发明上述目的通过以下技术方案实现:
一种大腹园蛛牵引丝蛋白基因的单体序列,其序列如SEQ ID NO.2所示。
一种拟大腹园蛛牵引丝蛋白基因,其序列如SEQ ID NO.5所示。
一种人工构建的大腹园蛛牵引丝蛋白,由SEQ ID NO.5所示序列编码翻译得到。
另外,SEQ ID NO.1、SEQ ID NO.2或SEQ ID NO.5所示序列在人工构建大腹园蛛牵引丝蛋白基因方面的应用,也在本发明的保护范围之内。
一种人工构建大腹园蛛牵引丝蛋白基因的方法,包括如下步骤:
(1)将SEQ ID NO.2所示序列分成2个末端有18个碱基互补的72bp片段,合成得到两条寡聚核苷酸链,经过互补连接补平,获得双链序列;将该双链序列连接至pSIMPLE-19 EcoR V/BAP表达载体,获得pSIMPLE-19 EcoR V/BAP单体重组质粒;
(2)重组质粒分别经Nhe I / Hind III双酶切和Spe I / Hind III双酶切,两个酶切产物连接,得到大腹园蛛牵引丝蛋白基因核心重复序列2倍串联体;重复该步骤,获得大腹园蛛牵引丝蛋白基因核心重复序列16倍串联体,即为人工构建的大腹园蛛牵引丝蛋白的编码序列,如SEQ ID NO.5所示。
具体优选地,上述人工构建大腹园蛛牵引丝蛋白基因的方法,包括如下步骤:
S1. 制备大腹园蛛牵引丝蛋白基因的单体序列
S11. 根据大腹园蛛高分子牵引丝蛋白部分cDNA序列,确定核心重复序列,如SEQ ID NO.1所示(108bp),作为单体的基本基因组成;
S12. 在SEQ ID NO.1所示核心重复序列的5’端加上Nhe I酶切位点GCTAGC,3’端加上Spe I酶切位点ACTAGT和Hind III酶切位点AAGCTT,得到大腹园蛛牵引丝蛋白基因的单体序列,如SEQ ID NO.2所示(126bp);
S13. 将上述SEQ ID NO.2所示基因单体序列分成2个72bp的片段,两个片段的末端有18个碱基互补;根据两个片段的序列合成得到两条寡聚核苷酸链;
S14. 将合成好的两条寡聚核苷酸链进行互补连接,并通过PCR反应进行补平,获得2端带有酶切位点的大腹园蛛牵引丝蛋白基因单体的双链序列;
S2. 构建pSIMPLE-19 EcoR V/BAP单体重组质粒
S21. 将上述大腹园蛛牵引丝蛋白基因单体的双链序列进行磷酸化;
S22. 再将磷酸化的产物与pSIMPLE-19 EcoR V/BAP表达载体进行连接;
S23. 将连接产物转化感受态细胞,经过转化子的筛选及鉴定,获得pSIMPLE-19 EcoR V/BAP单体重组质粒;
S3. 构建大腹园蛛牵引丝蛋白基因核心重复序列多倍串联体
S31. 培养转化有pSIMPLE-19 EcoR V/BAP单体重组质粒的菌液,抽提pSIMPLE-19 EcoR V/BAP单体重组质粒;
S32. 将pSIMPLE-19 EcoR V/BAP单体重组质粒分别用限制性内切酶Nhe I / Hind III双酶切、用限制性内切酶Spe I / Hind III双酶切,分别回收得到目的基因和线性质粒载体;
S33. 将回收的目的基因片段和线性质粒载体以T4 DNA连接酶进行连接;连接产物转化感受态细胞;
S34. 用菌液PCR法筛选阳性重组子,从而获得大腹园蛛牵引丝蛋白基因核心重复序列2倍串联体;
S35. 抽提大腹园蛛牵引丝蛋白基因核心重复序列2倍串联体质粒,重复上述S32-S34的方法,获得大腹园蛛牵引丝蛋白基因核心重复序列16倍串联体,即为人工构建的大腹园蛛牵引丝蛋白的编码序列,如SEQ ID NO.5所示。
其中,优选地,步骤S14所述PCR反应的反应体积为25μL,反应体系包含:5×PrimeSTAR 缓冲液,200 μM dNTPs,0.75 U PrimeSTAR HS DNA 聚合酶。
优选地,步骤S14所述PCR反应条件(即补平条件)为:94℃预变性2min;94℃变性1min,49℃退火30s,72℃延伸20s,循环4次;最后72℃延伸10min。
优选地,步骤S21所述磷酸化的方法为:取大腹园蛛牵引丝蛋白基因单体的双链序列进行琼脂糖凝胶电泳,对126bp的目的条带进行割胶回收后,进行磷酸化处理。
优选地,磷酸化的反应体系为:ddH2O 10.25μl、10×T4 DNA Polynucleotide Kinase Buffer 2.5μl、上述回收的补平产物 12μl、ATP 25nmol (0.25μl) 、T4 Polynucleotide Kinase 10units。
优选地,磷酸化的反应条件为:37℃下反应30分钟。
优选地,步骤S22所述连接的反应体系为:pSIMPLE-19 EcoR V/BAP表达载体1μl、Insert DNA (上述磷酸化产物) 4μl、Solution I (DNA Ligation Kit Ver.2.1) 5μl。优选地,连接的反应条件为:16℃下反应2h。
优选地,步骤S23的具体方法为:将连接产物转化到大肠杆菌DH5α感受态细胞中,在含有Amp(优选100 µg/mL)的选择性平板上涂布菌液,培养15~18 h,挑取白色菌落,接种到含有Amp(优选100 µg/mL)的B液体培养基中,37℃摇床振荡培养6h以上;取菌液进行PCR鉴定。
优选地,所述PCR鉴定的反应体积为25 µL,Premix Taq酶,通用引物M13F和M13R(序列分别如SEQ ID NO.3和SEQ ID NO.4所示);
优选地,所述PCR鉴定的反应条件为:94℃预变性1min;94℃变性25s,49℃退火25s,72℃延伸30s,循环32次;最后72℃延伸10min。
优选地,步骤S32所述双酶切的反应体系为:质粒2μg、反应缓冲液5μL、内切酶各1μL、ddH2O补至50μL。
优选地,步骤S32所述双酶切的反应条件为:反应体系轻轻混匀后瞬时离心,37℃保温2h。
优选地,步骤S23或S33所述感受态细胞为大肠杆菌DH5α感受态细胞。
本发明首先根据大腹园蛛牵引丝蛋白部分cDNA序列,选取最有代表性的核心重复序列108bp,进行人工合成,并在其5’端加上了Nhe I酶切位点,3’端加上Spe I和Hind III酶切位点,然后与pSIMPLE-19 EcoR V/BAP载体连接并转化至大肠杆菌后得到单体重组质粒,接着采用同尾酶首尾相接法将基因单体多聚化为16倍串联体,从而成功获得了1836bp拟大腹园蛛牵引丝蛋白基因的编码序列。
本发明具有以下有益效果:
本发明首先根据大腹园蛛牵引丝蛋白部分cDNA序列,选取最有代表性的核心重复序列108bp,进行人工合成,并在序列2端加上酶切位点,然后与pSIMPLE-19 EcoR V/BAP载体连接并转化至大肠杆菌后得到单体重组质粒,接着采用同尾酶首尾相接法将基因单体多聚化为16倍串联体,从而成功获得了1836bp拟大腹园蛛牵引丝蛋白基因的编码序列,整个流程简便高效,不但节约成本,且提高了工作效率。
附图说明
图1为本发明制备大腹园蛛牵引丝蛋白基因的核心重复序列单体的流程图。
图2为本发明中制备的大腹园蛛牵引丝蛋白基因的单体序列;其中,方框内加粗序列为Nhe I酶切位点;方框内加粗斜体序列为Spe I酶切位点,斜体序列为HindⅢ酶切位点。
图3为本发明大腹园蛛牵引丝蛋白基因单体的克隆及二倍体化示意图。
图4为pSIMPLE-19 EcoR V/BAP单倍体重组质粒菌液PCR鉴定图。
图5为pSIMPLE-19 EcoR V/BAP单倍体重组质粒酶切回收图;第2泳道为单体重组质粒用限制性内切酶Nhe I / Hind III双酶切,可见到124b左右的目的基因片段条带;第3泳道为单体重组质粒用限制性内切酶Spe I / Hind III双酶切,可见2816bp左右的线性载体条带。
图6为3个二倍串联体重组质粒克隆子的PCR鉴定图。
图7为4倍串联体重组质粒克隆子的PCR鉴定图。
图8为8倍串联体重组质粒克隆子的PCR鉴定图。
图9为16倍串联体重组质粒克隆子的PCR鉴定图。
图10为人工构建的拟大腹园蛛牵引丝蛋白基因。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,本发明所用试剂和材料均为市购。
实施例1 制备大腹园蛛牵引丝蛋白基因的单体序列
流程图如附图1所示。
1、根据已发表的大腹园蛛牵引丝蛋白部分cDNA序列(JN857964.2),确定核心重复序列108bp(如SEQ ID NO.1所示)作为单体的基本基因组成。
然后在上述核心重复序列的5’端加上了Nhe I酶切位点GCTAGC,在Spe I和Hind III酶切位点ACTAGTAAGCTT,这样组成的序列总长度为126bp(如SEQ ID NO.2所示),即为大腹园蛛牵引丝蛋白基因的单体序列。
从基因单体的两端人工合成两条寡核苷酸单链(72bp,序列如SEQ ID NO.3所示),两条寡核苷酸单链的末端有18个碱基互补。
2、将合成好的两条寡聚核苷酸链(由Takara公司合成)各取100ng进行互补连接,并通过PCR反应进行补平,反应体积为25μL,5×PrimeSTAR 缓冲液,200 μM dNTPs,0.75 U PrimeSTAR HS DNA 聚合酶,补平条件:94℃预变性2min;94℃变性1min,49℃退火30s,72℃延伸20s,循环4次;最后72℃延伸10min。得到的补平产物即为大腹园蛛牵引丝蛋白基因单体的双链序列。
实施例2 构建pSIMPLE-19 EcoR V/BAP单体重组质粒
1、将上述补平产物大腹园蛛牵引丝蛋白基因单体的双链序列取5uL进行琼脂糖凝胶电泳,采用Takara的TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0胶回收试剂盒对目的条带126bp进行割胶回收。
2、将上述回收的补平产物进行磷酸化处理:
反应体系为:
ddH2O 10.25 μl、
10×T4 DNA Polynucleotide Kinase Buffer 2.5 μl、
上述回收的补平产物 12 μl、
ATP 25 nmol (0.25 μl) 、
T4 Polynucleotide Kinase 10 units。
反应条件为:37℃下反应30分钟。
3、再将磷酸化的补平产物与pSIMPLE-19 EcoR V/BAP表达载体进行连接:
反应体系为:
pSIMPLE-19 EcoR V/BAP Vector 1 μl
Insert DNA (上述磷酸化产物) 4 μl
Solution I (DNA Ligation Kit Ver.2.1) 5 μl
反应条件为:16℃下反应2h。
4、将连接产物转化到大肠杆菌DH5α感受态细胞中,在含有Amp(100 µg/mL)的选择性平板上涂布80μl菌液,培养15~18 h,挑取白色菌落,接种到800uL LB液体培养基中(含100 µg/mL Amp),37℃,摇床振荡培养6 h以上;取2 µL菌液做模板,进行PCR鉴定。
所述PCR反应体积为25 µL,Premix Taq酶,通用引物M13F和M13R(序列分别如SEQ ID NO.3和SEQ ID NO.4所示)。所述PCR反应条件为:94℃预变性1min;94℃变性25s,49℃退火25s,72℃延伸30s,循环32次;最后72℃延伸10min。
结果如图4所示,有3个克隆子在250bp左右处均有一个明亮的目的条带,并送华大基因公司进一步测序鉴定,序列完全正确,成功获得pSIMPLE-19 EcoR V/BAP单倍体重组质粒。
实施例3 构建大腹园蛛牵引丝蛋白基因核心重复序列多倍串联体
1、培养转化有pSIMPLE-19 EcoR V/BAP单倍体重组质粒的菌液,采用质粒小提试剂盒(TIANprep Mini Plasmid Kit)抽提质粒。
将质粒用限制性内切酶Nhe I / Hind III双酶切,反应组成及步骤如下:
pSIMPLE-19 1×质粒 2μg
10 × Quickcut buffer 5μL
Nhe I 1μL
Hind Ⅲ 1μL
dd H2O 补至50μL。
上述反应体系轻轻混匀后瞬时离心,37℃保温 2h。
2、以1%琼脂糖凝胶电泳分离,分析酶切片段大小(见图5),用DNA胶回收试剂盒(TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0)回收目的基因片段;再将单体重组质粒用限制性内切酶Spe I / Hind III双酶切,反应组成及步骤如下:
pSIMPLE-19 1×质粒 2μg
10 × Quickcut buffer 5μL
Spe I 1μL
HindⅢ 1μL
dd H2O 补至50μL
上述反应体系轻轻混匀后瞬时离心,37℃保温 2h。
3、以1%琼脂糖凝胶电泳分离,分析酶切片段大小(见图5),用DNA胶回收试剂盒(TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0)回收线性载体。将回收的目的基因片段和线性载体按适当比例以T4 DNA连接酶进行连接,反应体系如下:
目的基因片段 6μL
线性载体 2μL
10 × T4 ligase buffer 1μL
T4 ligase 1μL
16℃下连接反应8h。
4、将酶连产物转化至大肠杆菌DH5α感受态细胞中,用菌液PCR法筛选阳性重组子(图6),可见3个克隆子在350bp左右处均有一个明亮的目的条带,并送华大基因公司测序进一步鉴定,成功获得大腹园蛛牵引丝蛋白基因核心重复序列2倍串联体。
5、重复上述步骤,先后得到了四倍串联体、八倍串联体和16倍串联体。
图7为4倍串联体重组质粒克隆子的PCR鉴定图,8个克隆子均有一个分子量为578bp的目的条带,都为阳性克隆。
图8为8倍串联体重组质粒克隆子的PCR鉴定图,5个克隆子均有一个分子量为1034bp的目的条带,都为阳性克隆。
图9为16倍串联体重组质粒克隆子的PCR鉴定图,3个克隆子均有一个分子量为1936bp的目的条带,故鉴定的4个克隆子中有3个为阳性克隆。该为目的条带的1936bp包括16倍串联体序列(1836bp)、引物长度和离目的片段两边的距离,共1936bp。
至此,成功获得了1836bp的拟大腹园蛛牵引丝蛋白基因(如SEQ ID NO.5所示,图10)。
实施例4 拟大腹园蛛牵引丝蛋白基因的编码序列的表达
经过大量试验验证,上述构建的拟大腹园蛛牵引丝蛋白基因能够成功翻译表达出大腹园蛛牵引丝蛋白。以下是一种原核表达体系:
将成功获得的带有1836bp的拟大腹园蛛牵引丝蛋白基因生物质粒,分别以Nhe I和Hind Ⅲ两种限制性核酸内切酶进行酶切,回收酶切产物,通过T4 DNA连接酶反应,将回收的酶切产物与已经线性化的p ET28a(+)质粒连接,构建出含有蜘蛛丝核心序列串联体的原核表达载体。
再将原核表达载体转化至BL21 (DE3)感受态细胞中,过夜培养,挑取单克隆后进行活化和放大培养。
结果:成功检测到拟大腹园蛛牵引丝蛋白基因序列所表达出的牵引丝蛋白。
SEQUENCE LISTING
<110> 中山大学
<120> 一种人工构建的大腹园蛛牵引丝蛋白基因及其构建方法
<130>
<160> 5
<170> PatentIn version 3.3
<210> 1
<211> 108
<212> DNA
<213> 大腹园蛛牵引丝蛋白cDNA核心重复序列
<400> 1
gccgcggcag ccgcagcagc agctggtgga caaggaggtc aaggtggata tggaggatta 60
ggttcccaag gagctggaca aggaggatat ggagcaggac aaggtggt 108
<210> 2
<211> 126
<212> DNA
<213> 大腹园蛛牵引丝蛋白基因的单体序列
<400> 2
gctagcgccg cggcagccgc agcagcagct ggtggacaag gaggtcaagg tggatatgga 60
ggattaggtt cccaaggagc tggacaagga ggatatggag caggacaagg tggtactagt 120
aagctt 126
<210> 3
<211> 18
<212> DNA
<213> 通用引物M13F的序列
<400> 3
tgtaaaacga cggccagt 18
<210> 4
<211> 18
<212> DNA
<213> 通用引物M13R的序列
<400> 4
caggaaacag ctatgacc 18
<210> 5
<211> 1836
<212> DNA
<213> 人工构建的拟大腹园蛛牵引丝蛋白基因序列
<400> 5
gctagcgccg cggcagccgc agcagcagct ggtggacaag gaggtcaagg tggatatgga 60
ggattaggtt cccaaggagc tggacaagga ggatatggag caggacaagg tggtactagc 120
gccgcggcag ccgcagcagc agctggtgga caaggaggtc aaggtggata tggaggatta 180
ggttcccaag gagctggaca aggaggatat ggagcaggac aaggtggtac tagcgccgcg 240
gcagccgcag cagcagctgg tggacaagga ggtcaaggtg gatatggagg attaggttcc 300
caaggagctg gacaaggagg atatggagca ggacaaggtg gtactagcgc cgcggcagcc 360
gcagcagcag ctggtggaca aggaggtcaa ggtggatatg gaggattagg ttcccaagga 420
gctggacaag gaggatatgg agcaggacaa ggtggtacta gcgccgcggc agccgcagca 480
gcagctggtg gacaaggagg tcaaggtgga tatggaggat taggttccca aggagctgga 540
caaggaggat atggagcagg acaaggtggt actagcgccg cggcagccgc agcagcagct 600
ggtggacaag gaggtcaagg tggatatgga ggattaggtt cccaaggagc tggacaagga 660
ggatatggag caggacaagg tggtactagc gccgcggcag ccgcagcagc agctggtgga 720
caaggaggtc aaggtggata tggaggatta ggttcccaag gagctggaca aggaggatat 780
ggagcaggac aaggtggtac tagcgccgcg gcagccgcag cagcagctgg tggacaagga 840
ggtcaaggtg gatatggagg attaggttcc caaggagctg gacaaggagg atatggagca 900
ggacaaggtg gtactagcgc cgcggcagcc gcagcagcag ctggtggaca aggaggtcaa 960
ggtggatatg gaggattagg ttcccaagga gctggacaag gaggatatgg agcaggacaa 1020
ggtggtacta gcgccgcggc agccgcagca gcagctggtg gacaaggagg tcaaggtgga 1080
tatggaggat taggttccca aggagctgga caaggaggat atggagcagg acaaggtggt 1140
actagcgccg cggcagccgc agcagcagct ggtggacaag gaggtcaagg tggatatgga 1200
ggattaggtt cccaaggagc tggacaagga ggatatggag caggacaagg tggtactagc 1260
gccgcggcag ccgcagcagc agctggtgga caaggaggtc aaggtggata tggaggatta 1320
ggttcccaag gagctggaca aggaggatat ggagcaggac aaggtggtac tagcgccgcg 1380
gcagccgcag cagcagctgg tggacaagga ggtcaaggtg gatatggagg attaggttcc 1440
caaggagctg gacaaggagg atatggagca ggacaaggtg gtactagcgc cgcggcagcc 1500
gcagcagcag ctggtggaca aggaggtcaa ggtggatatg gaggattagg ttcccaagga 1560
gctggacaag gaggatatgg agcaggacaa ggtggtacta gcgccgcggc agccgcagca 1620
gcagctggtg gacaaggagg tcaaggtgga tatggaggat taggttccca aggagctgga 1680
caaggaggat atggagcagg acaaggtggt actagcgccg cggcagccgc agcagcagct 1740
ggtggacaag gaggtcaagg tggatatgga ggattaggtt cccaaggagc tggacaagga 1800
ggatatggag caggacaagg tggtactagt aagctt 1836
- 还没有人留言评论。精彩留言会获得点赞!