前列腺癌预后方法与流程
本发明涉及用于对前列腺癌或者前列腺癌的进展状态进行诊断、监测或者预测的方法,其中,所述方法基于磷酸二酯酶4d(pde4d)变体的表达水平来确定前列腺癌的状态。本发明还涉及一种针对个体来识别前列腺癌治疗的适合性的方法。本发明还涉及用于分析磷酸二酯酶4d(pde4d)变体的产品以及调节pde4d变体的活性和/或表达的药物成分。
背景技术
癌症是细胞群表现出不受控制的生长、入侵并且有时候转移的一种疾病。癌症的这三种恶性属性使得它们有别于良性肿瘤,良性肿瘤是自限的,不入侵,也不转移。
前列腺癌(pca)是男性最常发生的非皮肤恶性肿瘤,2008年估计全世界有9百万新确诊病例。由于人口老龄化的原因,pca的发生将在未来的数年将急剧增加。通过确定具有前列腺特异性的抗原(psa)的血液水平、数字直肠检查(dre)和经直肠超声波分析(trus)所做的例行诊断导致了对非癌变良性前列腺状况的显著的第一步过度诊断:单单在美国,在每年执行的大约1百万份前列腺活检中,发现大约25万新病例,大约75%是不必要地做的,其引发患者中大量的并发症(尿路败血症、出血、尿潴留)以及高于20亿美元(每活检过程大约2100美元)的总成本。活检为阴性的男性的100个中至少有4个可能因副作用而入院治疗,10000个被活检的患者中有9个处于由于当前使用的流程而死亡的风险。
在美国每年的大约25万新检测出的pca病例中,大约20万最初被表征为局部化疾病,即,被表征为局限于前列腺器官的癌症。这种状况通过初级处置方案(例如,放射治疗或者尤其是通过手术部分或者完全去除前列腺(前列腺切除术))在一定程度上可治愈。但是,这些介入通常伴随有严重的副作用,特别地,尿失禁和/或勃起功能障碍,作为前列腺切除术的非常常见的后果。接受根治性前列腺切除术的男性中高达50%发展为尿失禁。研究表明,在手术后一年,又15%和50%之间的男性仍报告这样的问题。勃起问题同样是根治性前列腺切除术(rp)的严重副作用。只有大约一半的接受过手术的男性能够恢复一些勃起的能力。此外,所有针对局部化pca例行实施的处置都是非常昂贵的(通常在2万到3万美元的量级),每年在美国将引发50亿美元的总直接开销。
在美国,具有临床诊断的局部化疾病的~200000男性中,有高达50%具有非常低风险的或者低风险的肿瘤。因此,nccn(美国国立综合癌症网络)最近修订了其pca治疗指南,以将主动监测(as)扩展为对具有这样的低风险疾病的患者的温和并且方便的治疗替代方案。与接受了初级治疗的男性相比,通过使适当的患者求助于as将显著提高了此类患者的生活质量,而且据报告针对as的5年成本为每位患者不到1万美元。
此外,假设手术(对比as)被选择为针对给定患者的优选治疗方案,根据患者肿瘤的潜在侵略性对手术的程度进行分级将具有非常显著的优点。例如,可以更一般地对预测具有低风险疾病的男性应用神经保留手术技术,从而使与根治性前列腺切除术的潜在相关副作用降至最低。类似地,根据欧洲泌尿学协会(eau)的最新前列腺癌指南,在预测患有高风险癌症的情况下建议扩展的淋巴结切除,但是事实是与更具限制性的流程相比该流程复杂、耗时并且与更高的并发症率相关联。因此,尽管限制性更低的淋巴结切除己经表现出遗漏了大约50%的淋巴结转移,但是对患有局部化前列腺癌的男性的管理要求对个体肿瘤的潜在侵略性进行高度准确的手术前预测,从而为每介患者提供最佳的护理。
wo2010/131194a1公开了一种用于诊断或检测恶性激素敏感前列腺癌的方法,包括确定磷酸二酯酶4d变体pde4d7的表达水平的步骤。该文献还公开了使用pde指标来有效地区分良性疾病和恶性疾病,其中,作为内部控制,根据pde4d5来对pde4d7的表达进行标准化。
wo2010/131195a1描述了一种用于诊断激素抵抗型对激素敏感型前列腺癌的方法,包括确定pde4d7的表达水平的步骤。所述pde4d7表达水平被标准化到参考基因,所述参考基因可以是pde4d5。
henderson等人在britishjournalofcancer,第110卷,第5号,第1278-1287页(2014年)上的文章“thecampphosphodiesterase-4d7(pde4d7)isdownregulatedinandrogen-independentprostatecancercellsandmediatesproliferationbycompartmentalizingcampattheplasmamembraneofvcapprostatecancercells”,提出了pde4d7在雄激素敏感型前列腺癌细胞中被高度表达而在雄激素不敏感型前列腺癌细胞中显著下调的证据,并且提出了作为雄激素不敏感型前列腺癌的生物学标记的潜在应用以及治疗可能性。
ep1471153a2涉及一种用于通过分析化合物对基因表达调节的能力来确定其生物活性的转录活性测定。pde4d同工酶是可能的目标表达产物之一。在所描述的筛选中识别出的化合物可以是抗体,其在例如乳腺癌的处置中具有治疗价值。
wo2010/059838a2涉及磷酸二酯酶-4(pde4)的抑制因子以及其在中风、心肌梗塞、心血管炎性疾病和障碍以及中枢神经系统障碍的治疗和预防中的使用。
wo2004/090157a1公开了使用pde4d,尤其是pde4d5或pde4d7作为可以用于动脉粥样硬化的处置或者再狭窄的处置的化合物的识别的靶标。
us2003/220273a1描述了用于调节磷酸二酯酶4d的表达的反义化合物、成分和方法,以及将这些化合物用于与磷酸二酯酶4d的表达相关联的疾病的处置。
merkle和hoffmann在cellularsignalling,第23卷,第3号,第507-515页(2011年)上的文章“rolesofcampandcamp-dependentproteinkinaseintheprogressionofprostatecancer:cross-talkwiththeandrogenreceptor”是对amp和camp相关的蛋白激酶在前列腺癌的进展中的作用的研究。在该研究的背景下,陈述了pde4d表达在癌症组织中增加。
技术实现要素:
本发明涉及与前列腺癌具有临床相关性的感兴趣生物标记物基因(又称为标记物基因)的基因处置表达谱、签名或模式的识别和使用。具体而言,本发明涉及从生物学样本获得的核酸(优选地生物标记基因的转录本)的基因表达分析。具体而言,对这些标记基因的表达分析被用于提供指示前列腺癌存在和/或不存在和/或前列腺癌进展状态的前列腺癌pde指标(pde-指标)。
因此,pde-指标提供了针对前列腺癌患者的诊断、预后和治疗有关的个性化药物的非常有帮助的参数。所述pde-指标可以单独使用或者可以与提供关于患者的个人疾病状态或疾病阶段的信息的其他器件和方法组合使用。
医生和/或病理学家能够有利地利用所述pde-指标来确认在其他用于对患者进行诊断、识别、预后的方法中获得的结果。因此,本发明提供的方法和器件有助于建立更好的诊断、预后等,从而为患者找到最佳的处置,并且避免不必要的手术或其他处置,所述手术或其他处置因副作用而是危险的,有时是多余的,并且造成针对公共卫生系统的巨大成本。
本发明的一个方面涉及一种方法,所述方法包括以下步骤:
a)基于包括至少两种磷酸二酯酶4d(pde4d)变体的表达水平的基因表达谱来确定前列腺癌是否存在和/或确定前列腺癌发展状态,所述至少两种磷酸二酯酶4d变体选自包括pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9的组,并且其中,所述pde4d变体中的没有任何一个被用作参考基因。
本发明的另一个方面涉及一种方法,所述方法包括以下步骤:
a)基于至少两种磷酸二酯酶4d(pde4d)变体的表达水平的基因表达谱来确定tmprss2-erg基因融合是否存在或者确定转录因子erg的表达水平,所述至少两种磷酸二酯酶4d变体选自包括pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9的组,并且其中,所述pde4d变体中的没有任何一个被用作参考基因。
在上述方面中的任何方面的一些实施例中,所述基因表达谱被转换为至少一个前列腺癌pde指标(pde-指标),所述至少一个前列腺癌pde指标指示前列腺癌是否存在和/或前列腺癌进展状态。如本文中所描述,所述pde-指标的引入在前列腺癌诊断或预后中提供了良好的预测,或者在临床应用中提供了良好的表现。
如本文中所描述,不充当参考基因的pde4d变体在前列腺癌诊断或预后中提供良好的预测,或者在临床应用中提供良好的表现。
在一些实施例中,所述pde4d变体选自包括pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9的组。如本文中所描述,所选择的基因在前列腺癌诊断或预后中提供良好的预测,或者在临床应用中提供良好的表现。
在一些实施例中,所述基因表达谱是样本(优选地来自个体的样本)的基因表达谱。
在一些实施例中,所述基因表达谱是通过使pde4d变体的表达水平相对于至少一种参考基因的表达标准化而获得的标准化基因表达谱,所述方法任选地包括在所述标准化之前确定样本中的至少一种参考基因的表达水平的步骤。
在一些实施例中,如本文中所描述的方法是用于对前列腺癌或者前列腺癌的进展状态进行诊断、监测或预后的方法。
在一些实施例中,如本文中所描述的方法还包括在个体的pde指标指示存在前列腺癌或者其中该个体的pde-指标指示非进展性或进展性前列腺癌进展状态的情况下,将该个体识别为适合于接受前列腺癌治疗。
在一些实施例中,如本文中所描述的方法还包括对适合于接受前列腺癌治疗的个体进行处置。
在一些实施例中,如本文中所描述的方法还包括在步骤a)之前的以下步骤确定从包括pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9的组中选择的至少两种磷酸二酯酶4d(pde4d)变体在样本中的表达水平以获得基因表达谱的步骤。在一个实施例中,所述pde4d变体选自包括pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d8和pde4d9的组。
在另一实施例中,所述前列腺癌进展状态是非进展性的或者进展性的。
在一个实施例中,pde4d1和pde4d2的表达水平是针对二者变体一起确定的。
在另一实施例中,所述pde4d变体选自包括pde4d5、pde4d7和pde4d9的组,优选地选自包括pde4d1、pde4d2、pde4d4、pde4d5、pde4d7和pde4d9的组。
在一个实施例中,在步骤(a)中,确定至少三种pde4d变体的表达水平。
在一些实施例中,所述至少一个pde指标选自以下项:
i)pde-指标_1:
pde4d7_exp–pde4d5_exp
ii)pde-指标_2:
mean(pde4d7_exp&pde4d5_exp)
iii)pde-指标_3:
(mean(pde4d5_exp&pde4d7_exp&pde4d9_exp))/(pde4d4_exp)
iv)pde-指标_4:
(mean(pde4d5_exp&pde4d7_exp&pde4d9_exp))/(pde4d1&pde4d2_exp)
v)pde-指标_5:
(mean(pde4d5_exp&pde4d7_exp&pde4d9_exp))
如本文中所描述,所述pde指标的计算在前列腺癌诊断或预后中提供良好的预测,或者在临床应用中提供良好的表现。
在额外的实施例中,确定pde-指标_1,从而将非癌前列腺与患癌前列腺区分开。
在另一实施例中,确定pde-指标_2、pde-指标_3、pde-指标_4和pde-指标_5中中的至少一个,从而将非进展性前列腺癌与进展性前列腺癌区分开,并且/或者其中,高于预定截止值的pde-指标_2、pde-指标_3、pde-指标_4和pde-指标_5指示非进展性前列腺癌进展状态,并且/或者低于预定截止值的pde-指标_2、pde-指标_3、pde-指标_4和pde-指标_5指示进展性前列腺癌进展状态。
在另一实施例中,确定融合基因tmprss2-erg融合基因的存在,并且/或者其中,采用融合基因tmprss2-erg阳性样本执行所述方法。
在一个实施例中,在步骤(a)中确定表达水平是通过测量核酸或蛋白水平或者通过确定pde4d变体的生物活性而完成的或者额外地完成的。
在一个实施例中,确定参考基因的表达水平是通过测量核酸或蛋白水平或者通过确定至少一种参考基因的生物活性而完成或额外地完成的。
在一些实施例中,所述至少一种参考基因为看家基因,优选为tbp、hprt1、actb、rplp0、pum1、polr2a、b2m、k-alpha-1(=tuba1b)或alas-1。
在一些实施例中,所述样本是组织样本、尿液样本、尿液沉积样本、血液样本、唾液样本、精液样本、包含循环肿瘤细胞的样本、包含前列腺分泌的外泌体的样本或者细胞系或癌细胞系。
在另一实施例中,如本文中所描述的方法包括确定pgleason评分和/或pt阶段的额外步骤。
在另一实施例中,基因表达水平是通过使用一个或多个探针以及/或者一个或多个探针集来检测mrna表达而确定的。
在另一实施例中,基因表达水平是通过基于扩增的方法和/或微阵列分析和/或rna测序来确定的。
在其他实施例中,基因表达水平是通过rna测序、pcr、qpcr或者多重pcr确定的。
在具体的实施例中,在个体的样本的pde指标指示进展性前列腺癌进展状态的情况下将该个体识别为适合接受从以下项中选择的前列腺癌治疗:前列腺手术、前列腺切除、化学治疗、放射治疗、有限的或扩展的淋巴结切除。
在另一实施例中,在步骤(c)中,在个体的样本的pde指标指示非进展性前列腺癌进展状态的情况下,将该个体识别为适合接受积极监测作为前列腺癌治疗。
本发明的另一方面涉及一种产品,所述产品包括:
用于确定从包括以下项的组中选择的至少两种磷酸二酯酶4d(pde4d)变体的表达水平的引物和/或探针:pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9;
任选地还包括用于确定参考基因(优选地,看家基因,更优选地,tbp、hprt1、actb、rplp0、pum1、polr2a、b2m、k-alpha-1或alas-1)的基因表达水平的引物和/或探针。
所述产品提供了用于执行如本文中所描述的方法的基础或输入,所述方法继而如本文中所描述在前列腺癌诊断或预后中提供良好的预测,或者在临床应用中提供良好的表现。
在一些实施例中,所述产品是一种套件,包括pcr套件、rna测序套件或者微阵列套件。在一个实施例中,所述产品为微阵列。所述产品提供了一种获得所需要的表达水平的有效方式。
在一些实施例中,所述产品是用于执行所述方法中的任一种的产品,或者所述产品是用于对前列腺癌或前列腺癌进展状态进行诊断、监测或预后的产品,或者是为个体识别前列腺癌治疗的适合性的产品。
在一些实施例中,所述产品是包含一组核酸分子的成分,所述核酸分子每个包括用于分析pde4d变体pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9的基因表达的至少两个寡核苷酸探针序列,任选地包括用于分析从tbp、hprt1、actb、rplp0、pum1、polr2a、b2m、k-alpha-1(tuba1b)或alas-1中选择的参考基因的基因表达的至少一个寡核苷酸探针序列。
在一些实施例中,所述产品是核酸阵列,其包括与pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9中的至少两种pde4d变体的编码序列互补并可与之杂交的一个或多个寡核苷酸探针,任选地包括与从tbp、hprt1、actb、rplp0、pum1、polr2a、b2m、k-alpha-1(tuba1)或alas-1中选择的参考基因中的至少一个互补并可与之杂交的一个或多个寡核苷酸探针,从而确定如前述权利要求中的一项所述的pde指标。
在一些实施例中,所述产品是对前列腺癌或前列腺癌进展状态进行诊断、监测或预后,从而为个体识别前列腺癌治疗的适合性的套件,其包括:a)如上文所定义的阵列;b)套件控件;以及c)任选的供使用的指令。
本发明的另一方面涉及一种用于对前列腺癌或者前列腺癌进展状态进行诊断、监测或预后的计算机实施的方法,其包括如文中所定义的方法的步骤。
本发明的另一方面涉及一种计算机程序产品,其包括存储在计算机可读介质上的或者可从通信网络下载的计算机可读代码,所述计算机可读代码娄在计算机上运行时,实施本文中所定义的方法中的任一项中的一个或多个步骤或者所有步骤。
本发明的另一方面涉及一种具有存储于其上的可执行程序的非瞬态计算机可读存储介质,其中,所述程序指示微处理器执行如本文中所描述的方法中的任一项的步骤中的一个或多个。
本发明的另一方面涉及一种包括如本文中所描述的产品以及如本文中所描述的计算机程序产品或非瞬态计算机可读存储介质的系统。
本发明的另一方面涉及一种在前列腺癌的处置或预防中使用的刺激药物成分,其包括选自以下组中的至少一个元:
(a)直接刺激或调节选自包括pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d8、pde4d9的组的pde4d变体的活性的化合物,优选为酶活性的变构诱导剂;
(b)间接刺激或调节(a)中的pde4d变体的活性的化合物;
(c)(a)中的pde4d变体的蛋白质或者生物活性等价物;
(d)对(a)中的pde4d变体进行编码和表达的核酸;
(e)对(a)中的pde4d变体的mirna特异的mirna抑制剂;
(f)脱甲基试剂;以及
(g)磷酸二酯酶置换因子,优选为肽、拟肽、小分子、抗体或核酸适体,其中,所述pde4d变体优选地选自包括pde4d5、pde4d8、pde4d9项的组。
本发明的又一方面涉及一种在前列腺癌的处置或预防中使用的抑制药物成分,其包括选自以下组中的至少一个元:
(a)直接抑制选自包括pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d8、pde4d9的组的pde4d变体的活性的化合物;
(b)间接抑制(a)中的pde4d变体的活性的化合物;
(c)(a)中的pde4d变体的蛋白质的显性阴性形或者生物活性等价物;
(d)对(a)中的pde4d变体的显性阴性形进行编码和表达的核酸;
(e)对(a)中的pde4d变体特异的mirna;
(f)(a)中的pde4d变体的反义分子;
(g)对(a)中的pde4d变体特异的sirna;
(h)对(a)中的pde4d变体的表达产物有特异性或者对(a)中的pde4d变体的蛋白质特异的核酸适体;
(i)能够特异性地结合到(a)中的pde4d变体的蛋白质的小分子或拟肽;以及
(j)对(a)中的pde4d变体的蛋白质特异的抗体和/或对(a)中的pde4d变体的蛋白质特异的抗体变体。
其中,所述pde4d变体优选选自包括pde4d5、pde4d8、pde4d9的组。
如本文中所描述的药物成分提供了一种对于处置一个范围内的前列腺癌的有效的方案。
在一些实施例中,所述pde4d变体选自包括pde4d5、pde4d8、pde4d9的组。
在一些实施例中,所述刺激或抑制药物成分用于前列腺癌的处置,其中,依据指示前列腺癌进展状态的pde-指标来向个体施予所述成分。
在一些实施例中,所述刺激或抑制药物成分用于前列腺癌的处置,其中,在个体的样本的pde指标指示进展性前列腺癌进展状态的情况下,向所述个体施予所述成分。
在一些实施例中,所述刺激或抑制药物成分用于前列腺癌的处置,其中,个体的样本的pde-指标_2、pde-指标_3、pde-指标_4或pde-指标_5中的至少一个低于预定阈值。
本发明的另一方面涉及一种用于处置具有前列腺癌的对象的方法,所述方法包括:
(i)选择具有前列腺癌的对象,其中,该个体的样本的pde指标指示进展性前列腺癌进展状态,并且
(ii)向所选择的对象施予如本文中所描述的刺激或抑制药物成分。
所述方法提供了一种用于处置一个范围内的前列腺癌的有效方案。
在一些实施例中,所述方法包括:
(i)选择具有前列腺癌的对象,其中,该个体的样本的pde-指标_2、pde-指标_3、pde-指标_4或pde-指标_5中的至少一个低于预定阈值,以及
(ii)向所选择的对象施予如本文中所描述的刺激或抑制药物成分。
本发明的另一方面涉及一种被用作针对前列腺癌的存在或者针对前列腺癌进展状态的标记物的从包括以下项的组中选择pde4d变体:pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d8和pde4d9。
本发明的另一方面涉及将从包括以下项的组中选择的pde4d变体用于前列腺癌或前列腺癌进展状态的诊断、监测或预后:pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d8和pde4d9。
附图说明
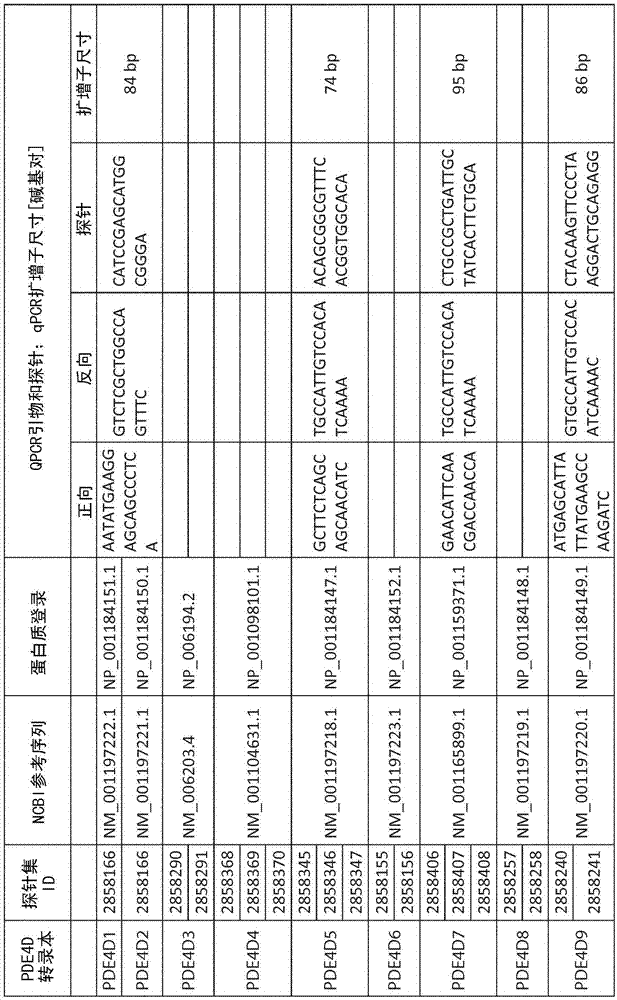
图1示出了affymetrixhumanexon1.0starray的探针组以及ncbi基因参考序列和对应的pde4d变体的ncpi蛋白质登录(accession)号以及对于pde4d变体特异的引物和探针序列。
图2列出了参考基因以及它们的转录id和蛋白质id以及对所述参考基因特异的引物和探针序列。
图3示出了pde4d1至pde4d9以及pde-指标_1至pde-指标_5对于区分非癌性组织、非进展性前列腺癌和进展性前列腺癌的表现。
图4示出了pde4d1至pde4d9以及pde-指标_1至pde-指标_5对于区分非癌性组织和非进展性前列腺癌的表现结果。
图5示出了pde-指标_1的表现结果。提供了针对总共八个前列腺癌数据集的概述,包括来自正常相邻组织、良性病变、良性增生以及肿瘤组织的类别的总共>900个患者样本。
图6示出了pde-指标_2、pde-指标_3、pde-指标_4和pde-指标_5对于区分非进展性和进展性前列腺肿瘤样本的表现结果。
图7示出了pde4d1至pde4d9以及pde-指标_1至pde-指标_5对于区分非癌性组织和非进展性前列腺肿瘤样本的表现结果。
图8示出了前列腺癌集合中pde4d1至pde4d9以及pde-指标_1至pde-指标_5与病理学gleason评分的相关性。
图9给出了pde4d1至pde4d9以及pde-指标_1至pde-指标_5的增加的值以及关于依赖于肿瘤的tmprss2-erg融合状态的与进展无关的存活的临床数据的概述。
图10示出了taylor等人在cancercell18,11-22,2010(gse21034(ncbigeo))上的数据集integrativegenomeprofilingofhumanprostatecancer中跨六种不同前列腺癌组织类型的pde4d1/2、pde4d3、pde4d4和pde4d5的标准化表达。
图11示出了taylor等人在cancercell18,11-22,2010(gse21034(ncbigeo))上数据集integrativegenomeprofilingofhumanprostatecancer中跨六种不同前列腺癌组织类型的pde4d6、pde4d7、pde4d8和pde4d9的标准化表达。.
图12示出了boormans等人在intjcancer2013jul15;133(2):335-45(gse41410(ncbigeo))上的数据集identificationoftdrd1asadirecttargetgeneoferginprimaryprostatecancer中跨越六种不同前列腺癌组织类型的pde4d1/2、pde4d3、pde4d4和pde4d5的标准化表达。
图13示出了boormans等人在intjcancer2013jul15;133(2):335-45(gse41410(ncbigeo))上的数据集identificationoftdrd1asadirecttargetgeneoferginprimaryprostatecancer中跨越六种不同前列腺癌组织类型的pde4d6、pde4d7、pde4d8和pde4d9的标准化表达。
具体实施方式
尽管将关于特定实施例描述本发明,但是不应该以限制性意义解释该描述。
在详细描述本发明的示范性实施例之前,将给出对于理解本发明而言重要的定义。
如在本说明书和所附权利要求中使用用的单数形式的“一”和“一个”也包括相应的复数,除非在上下文明确地另行指出。
在本发明的语境中,术语“约”和“大约”表示本领域技术人员将理解的仍确保所讨论的特征的技术效果的准确度区间。该术语通常指示与所指示的数值具有±20%的偏差,优选地±15%、更优选地±10%,更加优选地±5%。
应当理解,术语“包括”不是限制性的。针对本发明的目的,应当认为术语“由......构成”是术语“包括......”的优选实施例。如果在下文中一个组被定义为至少包括特定数量的实施例,那么其意味着也涵盖优选地仅由这些实施例构成的组。
此外,说明书和权利要求中的术语“第一”、“第二”、“第三”或者“(a)”、“(b)”、“(c)”、“(d)”等用于在相似的要素之间进行区分,并且不一定用于描述顺序或者时序。应当理解,在适当的情况下,这样使用的所述术语是可以互换的,并且且如本文中所描述的本发明的实施例可以按照与本文中描述或图示的所不同的其他顺序操作。
假设术语“第一”、“第二”、“第三”或者“(a)”、“(b)”、“(c)”、“(d)”等涉及方法或使用的步骤,那么在步骤之间没有时间一致性或时间间隔一致贯性,即,各步骤可以同时执行或者在这样的步骤之间可能存在数秒、数分钟、数小时、数天、数周、数月乃至数年的时间间隔,除非在本申请中如上文或下文所阐述地另行指示。应当指出本发明不限于如本文中所描述的特定方法、协议、蛋白质、细菌、载体、试剂等,因为这些可能发生变化。还应当理解,本文中采用的术语仅用于描述特定实施例的目的,并且不旨在限制本发明的范围,本发明的范围将仅由所附权利要求限定。本文中采用的所有科技术语与本领域技术人员通常理解的含义相同,除非另行定义。
本发明的一个方面涉及一种方法,所述方法包括以下步骤:
a)基于包括至少两种磷酸二酯酶4d(pde4d)变体的表达水平的基因表达谱来确定前列腺癌是否存在和/或确定前列腺癌发展状态,所述至少两种磷酸二酯酶4d变体选自包括以下项的组:pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9,并且其中,所述pde4d变体中没有任何一个被用作参考基因。
本发明的另一个方面涉及一种方法,所述方法包括以下步骤:
a)基于包括至少两种磷酸二酯酶4d(pde4d)变体的表达水平的基因表达谱来确定tmprss2-erg基因融合是否存在或者确定转录因子erg的表达水平,所述至少两种磷酸二酯酶4d变体选自包括以下项的组:pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9,并且其中,所述pde4d变体中没有任何一个被用作参考基因。
术语“pde4d转录变体”或者“pde4d同工型”或者“pde4d变体”涉及人磷酸二酯酶pde4d的pde4d剪接变体中的任何变体,即人磷酸二酯酶pde4d基因,例如,pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9。
术语“标记”、“标记基因”、“goi”或“pde4d变体标记”可以可互换地使用并且涉及上文所定义的基因、基因单元或序列(核苷酸序列或者氨基酸或蛋白质序列),在与控制水平相比时,优选在与正常组织中的表达相比时,其表达水平在恶性或者良性前列腺癌细胞或组织中或者在包含这样的细胞或组织或者其部分或片段的任何类型的样本中有所提高或下降。该术语还指所述基因单元或序列的任何表达产物,尤其是指pde4d变体mrna转录本、由pde4d变体转录本编码的多肽或蛋白质或其片段及其同源衍生物,如本文中以上所述。具体而言,术语“标记”、“标记基因”、“goi”或者“pde4d变体标记”是指人类磷酸二酯酶pde4d的pde4d剪接变体中的任何剪接变体,即人磷酸二酯酶pde4d基因,例如,pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9。
术语“磷酸二酯酶4d1”或“pde4d1”涉及人类磷酸二酯酶pde4d的剪接变体1,即,即人类磷酸二酯酶pde4d1基因,优选地涉及ncbi参考序列:nm_001197222.1中定义的序列,更优选涉及如在seqidno:1中阐述的核苷酸序列,其对应于上文所指示的pde4d1转录本的ncbi参考序列中的序列,并且术语“磷酸二酯酶4d1”或“pde4d1”还涉及如在seqidno:2中阐述的对应的氨基酸序列,其对应于对pde4d1多肽进行编码的ncbi蛋白质登录参考序列np_001184151.1中定义的蛋白质序列。术语“磷酸二酯酶4d1”或“pde4d1”还涉及能够通过引物对pde1d1d2_正向(seqidno:20)和pde1d1d2_反向(seqidno:21)来生成并且能够被探针seqidno:22检测到的扩增子。
术语“磷酸二酯酶4d2”或“pde4d2”涉及人类磷酸二酯酶pde4d的剪接变体2,即,即人类磷酸二酯酶pde4d2基因,优选地涉及ncbi参考序列:nm_001197221.1中定义的序列,更优选涉及如在seqidno:3中阐述的核苷酸序列,其对应于上文所指示的pde4d2转录本的ncbi参考序列中的序列,并且术语“磷酸二酯酶4d2”或“pde4d2”还涉及如在seqidno:4中阐述的对应的氨基酸序列,其对应于对pde4d2多肽进行编码的ncbi蛋白质登录参考序列np_001184150.1中定义的蛋白质序列。术语“磷酸二酯酶4d2”或“pde4d2”还涉及能够通过引物对pde1d1d2_正向(seqidno:20)和pde1d1d2_反向(seqidno:21)来生成并且能够被探针seqidno:22检测到的扩增子。
术语“磷酸二酯酶4d3”或“pde4d3”涉及人类磷酸二酯酶pde4d的剪接变体3,即,即人类磷酸二酯酶pde4d3基因,优选地涉及ncbi参考序列:nm_006203.4中定义的序列,更优选涉及如在seqidno:5中阐述的核苷酸序列,其对应于上文所指示的pde4d2转录本的ncbi参考序列中的序列,并且术语“磷酸二酯酶4d3”或“pde4d3”还涉及如在seqidno:6中阐述的对应的氨基酸序列,其对应于对pde4d3多肽进行编码的ncbi蛋白质登录参考序列np_006194.2中定义的蛋白质序列。
术语“磷酸二酯酶4d4”或“pde4d4”涉及人类磷酸二酯酶pde4d的剪接变体4,即,即人类磷酸二酯酶pde4d4基因,优选地涉及ncbi参考序列:nm_001104631.1中定义的序列,更优选涉及如在seqidno:7中阐述的核苷酸序列,其对应于上文所指示的pde4d4转录本的ncbi参考序列中的序列,并且术语“磷酸二酯酶4d4”或“pde4d4”还涉及如在seqidno:8中阐述的对应的氨基酸序列,其对应于对pde4d4多肽进行编码的ncbi蛋白质登录参考序列np_001098101.1中定义的蛋白质序列。
术语“磷酸二酯酶4d5”或“pde4d5”涉及人类磷酸二酯酶pde4d的剪接变体5,即,即人类磷酸二酯酶pde4d5基因,优选地涉及ncbi参考序列:nm_001197218.1中定义的序列,更优选涉及如在seqidno:9中阐述的核苷酸序列,其对应于上文所指示的pde4d4转录本的ncbi参考序列中的序列,并且术语“磷酸二酯酶4d5”或“pde4d5”还涉及如在seqidno:10中阐述的对应的氨基酸序列,其对应于对pde4d5多肽进行编码的ncbi蛋白质登录参考序列np_001184147.1中定义的蛋白质序列。术语“磷酸二酯酶4d5”或“pde4d5”还涉及能够通过引物对pde1d5_正向(seqidno:24)和pde1d5_反向(seqidno:25)来生成并且能够被探针seqidno:25检测到的扩增子。
术语“磷酸二酯酶4d6”或“pde4d6”涉及人类磷酸二酯酶pde4d的剪接变体6,即,即人类磷酸二酯酶pde4d6基因,优选地涉及ncbi参考序列:nm_001197223.1中定义的序列,更优选涉及如在seqidno:11中阐述的核苷酸序列,其对应于上文所指示的pde4d6转录本的ncbi参考序列中的序列,并且术语“磷酸二酯酶4d6”或“pde4d6”还涉及如在seqidno:12中阐述的对应的氨基酸序列,其对应于对pde4d6多肽进行编码的ncbi蛋白质登录参考序列np_001184152.1中定义的蛋白质序列。
术语“磷酸二酯酶4d7”或“pde4d7”涉及人类磷酸二酯酶pde4d的剪接变体7,即,即人类磷酸二酯酶pde4d7基因,优选地涉及ncbi参考序列:nm_001165899.1中定义的序列,更优选涉及如在seqidno:13中阐述的核苷酸序列,其对应于上文所指示的pde4d7转录本的ncbi参考序列中的序列,并且术语“磷酸二酯酶4d7”或“pde4d7”还涉及如在seqidno:14中阐述的对应的氨基酸序列,其对应于对pde4d7多肽进行编码的ncbi蛋白质登录参考序列np_001159371.1中定义的蛋白质序列。术语“磷酸二酯酶4d7”或“pde4d7”还涉及能够通过引物对pde1d7_正向(seqidno:26)和pde1d7_反向(seqidno:27)来生成并且能够被探针seqidno:28检测到的扩增子。
术语“磷酸二酯酶4d8”或“pde4d8”涉及人类磷酸二酯酶pde4d的剪接变体8,即,即人类磷酸二酯酶pde4d8基因,优选地涉及ncbi参考序列:nm_001197219.1中定义的序列,更优选涉及如在seqidno:15中阐述的核苷酸序列,其对应于上文所指示的pde4d8转录本的ncbi参考序列中的序列,并且术语“磷酸二酯酶4d8”或“pde4d8”还涉及如在seqidno:16中阐述的对应的氨基酸序列,其对应于对pde4d8多肽进行编码的ncbi蛋白质登录参考序列np_001184148.1中定义的蛋白质序列。
术语“磷酸二酯酶4d9”或“pde4d9”涉及人类磷酸二酯酶pde4d的剪接变体9,即,即人类磷酸二酯酶pde4d9基因,优选地涉及ncbi参考序列:nm_001197220.1中定义的序列,更优选涉及如在seqidno:17中阐述的核苷酸序列,其对应于上文所指示的pde4d9转录本的ncbi参考序列中的序列,并且术语“磷酸二酯酶4d9”或“pde4d9”还涉及如在seqidno:18中阐述的对应的氨基酸序列,其对应于对pde4d9多肽进行编码的ncbi蛋白质登录参考序列np_001184149.1中定义的蛋白质序列。术语“磷酸二酯酶4d9”或“pde4d9”还涉及能够通过引物对pde1d5_正向(seqidno:29)和pde1d5_反向(seqidno:30)来生成并且能够被探针seqidno:31检测到的扩增子。
术语“pde4d1”、“pde4d2”、“pde4d3”、“pde4d4”、“pde4d5”、“pde4d6”、“pde4d7”、“pde4d8”和“pde4d9”还包括表现出分别与pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9的高度同源性的核苷酸序列,例如,分别与在seqidno:1、3、5、7、9、11、13、15或17中阐述的序列至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的核酸序列,或者分别现在seqidno:2、4、6、8、10、12、14、16或18中阐述的序列至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的氨基酸序列,或者对分别与在seqidno:2、4、6、8、10、12、14、16或18中阐述的序列至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相对的氨基酸序列进行编码的核酸序列,或者由分别与在seqidno:1、3、5、7、9、11、13、15或17中阐述的序列至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的核酸序列编码的氨基酸序列。
如本文中所使用的术语“表达水平”是指能够从所定义的数量的细胞或所定义的组织部分导出的pde4d变体转录本和/或pde4d蛋白质的量,优选是指能够在标准核酸(例如,rna)或蛋白质提取过程中获得的pde4d变体转录本和/或pde4d变体蛋白质的量。合适的提取方法是本领域技术人员已知的。
如本文中所使用的术语“控制水平”(或“控制状态”)涉及可以通过使用来自其状况或疾病状态(例如,非癌症的普通或良性前列腺肿瘤、晚期前列腺癌等)已知的一个或多个对象的先前收集并存储的(一个或多个)样本与测试样本同时和/或在与测试样本类似或相当的条件下确定的表达水平。术语“疾病状态”或“癌症疾病状态”涉及处于非癌症细胞状态和晚期癌症细胞状态(包括)之间的任何状态的细胞或分子的状况或类型。优选地,该术语包括处于非癌症细胞状态(并且不包括)和晚期癌症细胞状态(包括)之间的有机体内肿瘤发展的不同癌性增生/发展阶段或水平。这样的发展阶段可以包括如uicc定义的恶性肿瘤的tnm(肿瘤、结节、转移)分类系统的所有阶段,例如,阶段0以及阶段i到iv。该术语还包括tnm阶段0之前的阶段,例如,本领域技术人员已知的癌症生物学标记表现出了修改的表达或表达模式的发展节段。
上文提及的表达水平可以优选是如本文中以上所定义的pde4d变体的表达水平。额外地或者替代地,所述表达水平还可以是在细胞中表达的任何其他适当基因或者遗传成分的表达水平,例如,看家基因的表达水平,或者看家基因的组合的表达水平,例如,tbp、hprt1、actb、rplp0、pum1、polr2a、b2m、k-alpha-1(=tuba1b)或alas-1。在优选实施例中,所述表达水平是针对参考基因的组合来确定的。
在另一优选实施例中,参考基因的组合包括tbp、hprt1以及从包括actb、rplp0、pum1、polr2a、b2m、k-alpha-1或alas-1的组中选择的至少一种、至少两种或者至少三种额外参考基因。
在另一优选实施例中,参考基因的组合包括tbp、hprt1以及从包含actb、rplp0、pum1、k-alpha-1或alas-1的组中选择的至少两种额外参考基因。
一种特别优选的组合是tbp、hprt1、actb、rplp0。另一种特别优选的组合是tbp、hprt1、pum1、k-alpha-1、alas-1。
在本发明的语境中,术语“癌症的”涉及本如本文中所定义的癌症疾病状态。
在本发明的语境中,术语“非癌的”涉及良性或恶性增生均未被检测到的状态。用于所述检测的合适手段是本领域已知的。
本发明的语境中的优选的控制水平是正常的,即健康的或者非癌组织内的pde4d变体的表达,或者是良性前列腺肿瘤组织内的pde4d变体的表达。如本文中所使用的术语“良性前列腺肿瘤”是指不存在癌症的所有三个恶性属性的前列腺肿瘤,即,不以无限的侵略方式生长,不入侵周围组织,并且不转移。通常,良性前列腺肿瘤暗指不存在癌症的侵略特性的温和非进展性的前列腺肿瘤或膨胀疾病。此外,良性前列腺肿瘤通常是被包裹的,因而抑制了其产生恶性方式行为的能力。可以通过本领域技术人员已知的任何适当的独立分子学、组织学或生理学方法来确定良性肿瘤或健康状态。
本发明的语境中的更优选控制水平是正常的,即健康的或者非癌组织内的pde4d变体的表达,或者是非进展性前列腺肿瘤组织内的pde4d变体的表达。
所述表达控制水平可以是在通过分析来自疾病状态已知的患者的样本中本发明的(一个或多个)标记基因先前确定的(一个或多个)表达水平而获得的结果的基础上通过统计方法确定的。此外,所述控制水平可以来源于来自先前测试的患者、组织或细胞的表达模式或表达水平的数据库。所述控制水平可以根据来源于已经被诊断患有前列腺癌(例如,患有激素无关或者激素抵抗型前列腺癌)的患者的参考样本确定的。此外,可以将要被测试的生物学样本中的本发明的标记基因的表达水平与多个控制水平进行比较,所述多个控制水平的控制水平是从多个参考样本确定的。预期使用由源自于与来自患者的生物学样本的组织类型相似的组织类型的参考样本确定的控制水平。特别优选的是使用源自于具有如本文中以上所定义的癌症疾病状态的患者的样本。
或者,参考样本可以包括源自于细胞系的,例如,来自于永生化癌细胞系的物质,或者可以源自于组织异种移植。优选地,源自于前列腺癌细胞系的物质或者源自于利用人前列腺组织(尤其是利用良性的并且源自于肿瘤的人类前列腺组织)的组织异种移植的物质可以被包含到根据本发明的参考样本中。优选的癌细胞系的例子包括细胞系pc346p、pc346b、lncap、vcap、ducap、pc346c、pc3、du145、pc346cdd、pc346flu1、pc346flu2。优选的异种移植的例子包括pc295、pc310、pc-ew、pc82、pc133、pc135、pc324和pc374。优选地,可以使用细胞系和异种移植的整个面板(panel),例如,人类pc346面板。
在另一种优选替代方案中,参考样本可以源自于在临床环境下获得的患者组织或者组织面板或组织收集。例如,所述样本可以是从经历手术的男性患者身上获得的。所述样本可以源自于任何适当组织类型,例如,源自于前列腺组织或淋巴结。患者组织收集的优选例子源自于手术过程(例如,前列腺切除术)。
此外,优选使用本发明的pde4d变体标记在具有已知疾病状态的群体(例如,具有非进展性前列腺肿瘤或健康群体)中的表达水平的标准值。所述标准值可以是通过本领域已知的任何方法获得的。例如,可以使用均值±2sd(标准偏差)或者均值±3sd的范围作为标准值。
此外,控制水平还可以是通过使用来自已知其疾病状态为癌症一个或多个对象(即,所述患者已经被独力地诊断为患有前列腺癌,尤其是恶性的激素敏感型前列腺癌)的先前采集并存储的(一个或多个)样本与测试样本同时和/或在与测试样本类似或相当的条件下确定的。
在本发明的语境中,根据已知非癌性的生物学样本,例如,为健康组织样本或者非进展性前列腺肿瘤样本,确定的控制水平被称为“正常控制水平”。
如果控制水样是根据癌症生物学样本,尤其是来自于被独立诊断为患有激素抵抗型癌症的对象的样本确定的,那么可以将其称为“癌症控制水平”。
术语“前列腺癌”涉及男性生殖系统中的前列腺的癌症,其在前列腺细胞变异并且开始失去控制地繁殖时发生。前列腺癌通常与前列腺特异性抗原(psa)的升高的水平相关联。在本发明的一个实施例中,术语“前列腺癌”涉及示出超过4.0的psa水平的癌症。在另一实施例中,该术语涉及示出超过2.0的psa水平。术语“psa水平”是指血液中的psa浓度,其单位为ng/ml。
术语“非进展性前列腺癌状态”是指个体的样本未呈现出指示“生物化学复发”和/或“临床复发”的参数值。
术语“进展性前列腺癌状态”是指个体的样本呈现出指示“生物化学复发”和/或“临床复发”的参数值。
在本申请的语境中,表述“生物化学复发”是指(例如)升高的psa的复发生物学值,其指示样本中存在前列腺癌细胞。但是,也可能使用其他能够用于检测所述存在或者这样的存在的提高的可疑性的标记。
在本申请的语境中,“临床复发”一词是指指示例如,如使用活体内成像测量的肿瘤细胞的存在的临床指征的存在。
因而,(可以同义使用的)术语“升高的”或者“升高的表达水平”或者“上调的表达水平”或者“表达水平的升高”在本发明的语境中表示处于要被分析的状况(例如,来源于患者样本的状况)与参考点(其可以是正常控制水平或者是本领域技术人员已知的源自于任何合适的前列腺肿瘤或癌症阶段的癌控制水平)之间的表达水平的升高。例如在要被分析的样本中的pde4d变体基因表达与控制水平相比具有5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、40%、50%或超过50%的差异(即提高)时或者与控制水平相比提高了至少0.1倍、至少0.2倍、至少1倍、至少2倍、至少5倍或者至少10倍或更高时,认为表达水平“提高”。所述控制水平可以是正常控制水平或者是癌控制水平,如本文中以上定义。如果要执行与癌控制水平的比较,那么额外地进行与正常控制水平的比较是优选的。这样的额外比较允许确定所述修饰的趋势,例如,可以观察所述表达水平的提高幅度,并且/或者可以得出对应的结论。优选的是与良性前列腺肿瘤进行比较或者与健康组织或者源自于健康个体的样本进行比较。
在另一实施例中,从对象获得的样本与本文中以上定义的癌症的参考之间的总基因表达模式的额外相似性表明对象患有前列腺癌。在本发明的另一实施例中,可以将所述诊断与额外的癌症生物学标记(尤其是前列腺癌生物学标记)表达水平的注释组合。合适的生物学标记,尤其是前列腺癌生物学标记应当是本领域技术人员已知的。例如,可以测试如psa的生物学标记的表达。
在如本文中以上所定义的本发明的pde4d变体的表达水平与正常控制水平相比提高时,可以认为诊断出恶性激素敏感型前列腺癌。
如果如本文中以上所定义的测试样本中的pde4d1表达水平与控制水平相比下降了处于20到80%之间的值,优选地下降了30%、40%、50%、60%或70%的值,那么可以指示进展性癌症。所述控制水平可以是正常控制水平或者是癌症控制水平,如本文中以上所定义。在特别优选的实施例中,如果如本文中以上所定义的pde4d1表达水平与正常控制水平(尤其是健康组织或者非进展性前列腺肿瘤)相比下降了1.5到10倍的因数,优选地下降了2到5倍的因数,那么可以指示进展性前列腺癌。
如果如本文中以上所定义的测试样本中的pde4d2表达水平与控制水平相比下降了处于20到80%之间的值,优选地下降了30%、40%、50%、60%或70%的值,那么可以指示进展性癌症。所述控制水平可以是正常控制水平或者是癌症控制水平,如本文中以上所定义。在特别优选的实施例中,如果如本文中以上所定义的pde4d2表达水平与正常控制水平(尤其是健康组织或者非进展性前列腺肿瘤)相比下降了1.5到10倍的因数,优选地下降了2到5倍的因数,那么可以认为诊断出进展性前列腺癌。
如果如本文中以上所定义的测试样本中的pde4d3表达水平与控制水平相比下降了处于20到80%之间的值,优选地下降了30%、40%、50%、60%或70%的值,那么可以指示进展性癌症。所述控制水平可以是正常控制水平或者是癌症控制水平,如本文中以上所定义。在特别优选的实施例中,如果如本文中以上所定义的pde4d3表达水平与正常控制水平(尤其是健康组织或者非进展性前列腺肿瘤)相比下降了1.5到10倍的因数,优选地下降了2到5倍的因数,那么可以指示进展性前列腺癌。
如果如本文中以上所定义的测试样本中的pde4d4表达水平与控制水平相比下降了处于20到80%之间的值,优选地下降了30%、40%、50%、60%或70%的值,那么可以指示进展性癌症。所述控制水平可以是正常控制水平或者是癌症控制水平,如本文中以上所定义。在特别优选的实施例中,如果如本文中以上所定义的pde4d4表达水平与正常控制水平(尤其是健康组织或者非进展性前列腺肿瘤)相比下降了1.5到10倍的因数,优选地下降了2到5倍的因数,那么可以指示进展性前列腺癌。
如果如本文中以上所定义的测试样本中的pde4d5表达水平与控制水平相比下降了处于20到80%之间的值,优选地下降了30%、40%、50%、60%或70%的值,那么可以指示进展性癌症。所述控制水平可以是正常控制水平或者是癌症控制水平,如本文中以上所定义。在特别优选的实施例中,如果如本文中以上所定义的pde4d5表达水平与正常控制水平(尤其是健康组织或者非进展性前列腺肿瘤)相比下降了1.5到10倍的因数,优选地下降了2到5倍的因数,那么可以指示进展性前列腺癌。
如果如本文中以上所定义的测试样本中的pde4d6表达水平与控制水平相比下降了处于20到80%之间的值,优选地下降了30%、40%、50%、60%或70%的值,那么可以指示进展性癌症。所述控制水平可以是正常控制水平或者是癌症控制水平,如本文中以上所定义。在特别优选的实施例中,如果如本文中以上所定义的pde4d6表达水平与正常控制水平(尤其是健康组织或者非进展性前列腺肿瘤)相比下降了1.5到10倍的因数,优选地下降了2到5倍的因数,那么可以指示进展性前列腺癌。
如果如本文中以上所定义的测试样本中的pde4d7表达水平与控制水平相比下降了处于20到80%之间的值,优选地下降了30%、40%、50%、60%或70%的值,那么可以指示进展性癌症。所述控制水平可以是正常控制水平或者是癌症控制水平,如本文中以上所定义。在特别优选的实施例中,如果如本文中以上所定义的pde4d7表达水平与正常控制水平(尤其是健康组织或者非进展性前列腺肿瘤)相比下降了1.5到10倍的因数,优选地下降了2到5倍的因数,那么可以指示进展性前列腺癌。
如果如本文中以上所定义的测试样本中的pde4d8表达水平与控制水平相比下降了处于20到80%之间的值,优选地下降了30%、40%、50%、60%或70%的值,那么可以指示进展性癌症。所述控制水平可以是正常控制水平或者是癌症控制水平,如本文中以上所定义。在特别优选的实施例中,如果如本文中以上所定义的pde4d8表达水平与正常控制水平(尤其是健康组织或者非进展性前列腺肿瘤)相比下降了1.5到10倍的因数,优选地下降了2到5倍的因数,那么可以指示进展性前列腺癌。
如果如本文中以上所定义的测试样本中的pde4d9表达水平与控制水平相比下降了处于20到80%之间的值,优选地下降了30%、40%、50%、60%或70%的值,那么可以指示进展性癌症。所述控制水平可以是正常控制水平或者是癌症控制水平,如本文中以上所定义。在特别优选的实施例中,如果如本文中以上所定义的pde4d9表达水平与正常控制水平(尤其是健康组织或者非进展性前列腺肿瘤)相比下降了1.5到10倍的因数,优选地下降了2到5倍的因数,那么可以指示进展性前列腺癌。
如本文中以上所定义的,在pde4d7标记与正常控制水平相比提高时,可以检测出非进展性前列腺癌进展阶段。在本发明的优选实施例中,如果pde4d7标记的表达水平与所建立的,例如,独立地建立的前列腺癌细胞或细胞系(例如,非进展性癌细胞系)的表达水平相似,那么可以检测出非进展性前列腺癌。
在pde4d7标记的表达水平与正常控制水平,尤其是健康组织或非进展性前列腺肿瘤,相比下降时,可以检测出进展性前列腺癌进展阶段。在本发明的优选实施例中,如果pde4d7标记的表达水平与所建立的,例如,独立地建立的进展性前列腺癌细胞或细胞系(例如,进展性癌细胞系)的表达水平相似,那么可以检测出进展性前列腺癌。
在pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d8和pde4d9标记中的至少一个的表达水平与如本文中以上所定义的正常控制水平相比下降时,可以检测出非进展或进展性前列腺癌。在本发明的优选实施例中,如果pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d8和pde4d9标记中的至少一个的表达水平与所建立的,例如,独立地建立的前列腺癌细胞或细胞系的表达水平相似,那么可以检测出非进展性或进展性前列腺癌。
如本文中所使用的术语“监测前列腺癌”涉及(例如)在处置流程期间或者在特定时间段期间,通常在2个月、3个月、4个月、6个月、1年、2年、3年、5年、10年或者任何其他时间段期间,伴随有诊断或检测出的前列腺癌疾病或障碍。术语“伴随”是指如本文中以上所定义的疾病的状态并且,特别是,这些疾病状态的变化,可以如本文中以上所定义的在任何类型的周期性时间段内,例如,在每周,每2击,每月、每2、3、4、5、6、7、8、9、10、11或12个月、每1.5年、每2、3、4、5、6、7、8、9或10年内,通过将样本中的本发明的pde4d变体标记的表达水平与正常控制水平,尤其是与源自于进展性肿瘤控制、非进展性肿瘤控制或者健康控制的表达水平进行比较或者与所建立的,例如,独立地建立的前列腺癌细胞或细胞系中的表达水平进行比较而被检测到。这些建立的,例如独立地建立的前列腺癌细胞或细胞系可以引起源自于对应于癌症发展的不同阶段(例如,tnm分类体系的阶段0以及i到iv)的样本的额外的控制水平。在本发明的优选实施例中,该术语涉及伴随的确诊和前列腺癌,更优选涉及伴随的进展性或非进展性前列腺癌。所述监测还可以包括检测额外的基因或遗传成分(例如,看家基因)的表达。
如本文中所使用的术语“前列腺癌预后”是指对确诊或检测到的前列腺癌在例如特定时间段期间,在处置期间或者在处置后的进程或结果的预测。该术语还表示对从该疾病中存活或者恢复的机会以及对患者的预计存活时间的确定。预后尤其可以涉及建立患者在未来的一定时间段(例如,6个月、1年、2年、3年、5年、10年或者任何其他时间段)期间存活的可能性。
如本文中所使用的术语“转录因子erg”一词是指与由癌基因erg基因(ets相关基因)编码的dna的富嘌呤序列结合的核内蛋白。erg是ets(有核红细胞转化特异的)转录因子家族的成员。需要转录调控因子erg来实现向内皮下膜的血小板粘附,并且对红细胞生成作用进行调节。其具有dna结合区和pnt(指向)区。
在一些实施例中,pde4d的上调表达指示转录因子erg的上调表达水平或者tmprss2-erg基因融合的存在。
如本文中所使用的术语“参考基因”或“控制基因”是指所选有机体中的任何适当基因,例如,是指任何稳定表达并且可连续检测的基因、基因产物、表达产物、蛋白质或蛋白质变体。该术语还包括基因产物,例如,表达的蛋白质、肽、多肽及其修饰的变体。因而,本发明还包括源自于参考基因的参考蛋白。还涵盖能够从参考基因及其修饰物导出的所有类型的转录或者与之关联的次级参数。额外地或者替代地,也可以将其他参考参数用于参考目的,例如,新陈代谢浓度、细胞大小等。
所述表达可以优选地是在相同样本中执行的,即,pde4d变体的水平和参考基因的水平是在相同样本中确定的。如果测试是在相同样本中执行的,那么可以执行如本文中所描述的单次检测或多重检测方案。为了多重检测的性能,可以对引物和/或探针寡核苷酸的浓度进行修改。例如,与制造商的指示相比,可以修改(例如,提高或降低)诸如缓冲剂、离子等的额外成分的浓度和存在。
在本发明的具体实施例中,可以确定多于一个参考基因或稳定表达基因的表达。例如,可以确定2、3、4、5、6、7、8、9、10、12、15、20、30个或者更多个参考基因的表达。可以单独计算这样的测量的结果,或者可以将所述结果组合以获得平均表达指标。此外,可以确定参考基因表达的模式,并且/或者将其用作后续步骤的基础。这样的模式可以基于特定癌症(尤其是前列腺癌)阶段或状态中的基因的己知表达行为。
此外,可以将所述表达结果与来自参考病例或数据库的已经知晓的结果进行比较。所述比较可以额外地包括标准化流程,从而改进结果的统计学相关性。
在本发明的替代实施例中,代替确定样本中的参考基因的表达水平,而是可以确定其他癌症标记或非稳定表达基因的表达。例如,可以确定已知在激素抵抗型前列腺癌中下降或者已知在激素敏感型前列腺癌中提高的基因的表达。
在另外的实施例中,也可以执行两种表达确定,即,对参考基因表达的确定以及对其他癌症基因或生物学标记基因的确定。
示范性控制基因尤其包括智人tata框结合蛋白(tbp)、智人次黄嘌呤磷酸核糖转移酶1(hprt1)、智人肌动蛋白,beta,mrna(actb)、智人60s酸性核糖体磷蛋白p0mrna(rplp0)、智人pumiliorna结合家族成员1(pum1)、聚合酶(rna)ii(dna引导的)多肽a220kda(polr2a)、beta-2-小球蛋白(b2m)、微管蛋白-alpha-1b(k-alpha-1)、氨乙酰丙酸-delta-合酶(alas-1)。
在具体实施例中,在如本文中所描述的方法中将执行下述步骤:(a2)确定样本中的参考基因的表达水平;(a3)针对参考基因的表达将步骤(a)中测得的pde4d变体的表达水平标准化,以获得标准化基因表达谱;
其中,前列腺癌进展状态和/或前列腺癌进展指标是基于以步骤(a3)中的pde4d变体的标准化基因表达谱的。
术语“其中,pde4d变体中没有任何一个被用作参考基因”意指pde4d变体未被作为参考基因以对测得表达水平进行标准化。
尤其是pde4d5未被用作参考基因。
更具体而言,pde4d变体中没有被用作参考基因以对pde4d7的表达水平标准化的。
在更具体的实施例中,pde4d5未被用作参考基因来对pde4d7的表达水平进行标准化。
可以根据本领域技术人员已知的任何适当方法将表达结果标准化。典型地,这样的为本领域技术人员所知的测试或对应的公式将被用于对表达数据进行标准化,从而能够在基因表达水平中的实际变化和由于测量过程引起的变化之间进行区分。对于微阵列而言,可以采用鲁棒的多阵列平均(rma)来作为标准化方案。
在特定实施例中,通过应用下式来生成标准化值:
n(cq感兴趣基因)=mean(cq参考基因)-(cq感兴趣基因)
其中,n(cq感兴趣基因)是针对所选择的感兴趣基因的标准化基因表达值;其中,mean(cq参考基因)是所选择的参考基因的组合的pcrcq值的算数平均;其中(cq感兴趣基因)是感兴趣基因的pcrcq值。
在特定实施例中,通过应用下式来生成标准化值:
n(cq感兴趣基因)=mean(cq参考基因)-(cq感兴趣基因)
其中,n(cq感兴趣基因)是所选择的感兴趣基因的标准化基因表达值;其中,mean(cq参考基因)是从tbp、hprt1、actb、rplp0、polr2a、b2m、pum1、k-alpha-1和alas-1中选择的至少两种参考基因的pcrcq值的算数平均;其中,(cq感兴趣基因)是感兴趣基因的pcrcq值。
在特定实施例中,通过应用下式来生成标准化值:
n(cq感兴趣基因)=mean(cq参考基因)-(cq感兴趣基因)
其中,n(cq感兴趣基因)是针对所选择的感兴趣基因的标准化基因表达值;其中,mean(cq参考基因)是参考基因tbp、hprt1、actb和rplp0的pcrcq值的算数平均;其中,(cq感兴趣基因)是感兴趣基因的pcrcq值。
在特定实施例中,通过应用下式来生成标准化值:
n(cq感兴趣基因)=mean(cq参考基因)-(cq感兴趣基因)
其中,n(cq感兴趣基因)是所选择的感兴趣基因的标准化基因表达值;其中,mean(cq参考基因)是参考基因tbp、hprt1、pum1、k-alpha-1和alas-1的pcrcq值的算数平均;其中,(cq感兴趣基因)是感兴趣基因的pcrcq值。
示范性参考基因尤其包括tata框结合蛋白(tbp)、智人次黄嘌呤磷酸核糖转移酶1(hprt1)、智人肌动蛋白,beta,mrna(actb)、智人60s酸性核糖体磷蛋白p0mrna(rplp0)、智人pumiliorna结合家族成员(pum1)、聚合酶(rna)ii(dna引导的)多肽a、220kda(polr2a)、beta-2-小球蛋白(b2m)、微管蛋白-alpha-1b(k-alpha-1)、氨乙酰丙酸-delta-合酶(alas-1)。一种尤其优选的组合是tbp、hprt1、actb、rplp0。另一种尤其优选的组合是tbp、hpt1、pum1、k-alpha-1、alas-1。
另一优选的实施例,参考基因的组合包括tbp、hprt1以及从包含actb、rplp0、pum1、polr2a、b2m、k-alpha-1(tuba1b)或alas-1的组中选择的至少一种、至少两种或者至少三种额外参考基因。
另一优选实施例,参考基因的组合包括tbp、hprt1以及从包含actb、rplp0、pum1、k-alpha-1(tuba1b)或alas-1的组中选择的至少两种额外参考基因。
一种尤其优选的组合是tbp、hprt1、actb、rplp0。另一种尤其优选的组合是tbp、hprt1、pum1、k-alpha-1、alas-1。
在图2中公开了对参考基因的详细说明,其包括参考基因的转录id(ncbirefseq)和对应的核苷酸序列的seqidno、蛋白质id(蛋白质登录)和对应的氨基酸序列的seqidno。此外,图2公开了每一参考基因的正向引物、用于生成对该参考基因特异的扩增子的反向引物以及特异地结合到所述扩增子的探针序列。
特别地,所述参考基因不是pde4d变体。
在具体实施例中,所述pde4d变体选自包括pde4d1、pde4d2、pde4d4、pde4d5、pde4d7和pde4d9的组。
在另一具体实施例中,所述pde4d变体选自包含pde4d1、pde4d2、pde4d5、pde4d7和pde4d9的组。
在另一实施例中,所述pde4d变体选自包含pde4d4、pde4d5、pde4d7和pde4d9的组。
在另一具体实施例中,所述pde4d变体选自包含pde4d5和pde4d7的组。
在另一具体实施例中,所述pde4d变体选自包含pde4d5、pde4d7和pde4d9的组。
在另一具体实施例中,所述pde4d变体选自包括pde4d5和pde4d7构成的组。
在优选和实施例中,在步骤(a)中选择至少三种pde4d变体的表达水平、至少四种pde4d变体的表达水平或者至少五种pde4d变体的表达水平。
在更优选的实施例中,在步骤(a)中选择至少三种pde4d变体的表达水平。
在另一实施例中,不同pde4d变体的表达水平是例如由一起检测几种pde4d变体的探针一起确定的。
在优选实施例中,pde4d1和pde4d2的表达水平是针对两种变体一起确定的。这意味着,仅使用单个探针一起报告这些非常密切地相关的pde4d变体(pde4d1和pde4d2)的表达。
在本发明的语境中,术语“诊断”和“预后”还旨在涵盖预测和可能性分析。因此,可以在临床上使用pde4d变体作为标记来做出与处置模态有关的决定,所述治疗模态包括治疗介入或者诊断标准,例如,对疾病的监测。根据本发明,可以提供用于检查对象的状况的中间结果。可以将这样的中间结果与额外信息组合,以辅助医生、护士或者其他从业人员诊断对象患有所述疾病。替代地,本发明可以用于检测源自于患者的组织中的癌细胞,并且为医生提供有用的信息以诊断对象患有所述疾病。
根据本发明的要接受前列腺癌或前列腺癌进展状态的诊断、监测或预后的对象或个体是动物,优选地是哺乳动物,更优选地是人。
在使用pde4d变体作为标记来对恶性激素敏感型前列腺癌或者向恶性激素敏感型前列腺癌的进展进行诊断、监测或者预后的场景中尤其优选使用本领域技术人员已知的分子成像工具,例如,磁共振成像(mri)和/或磁光子共振成像(mpi)技术。例如,可以在如允许对人类对象内的诊断标记进行在线检测的mri或mpi的方案中使用pde4d变体作为标记来对前列腺癌或者前列腺癌的进展状态进行诊断、监测或预后。
在一些实施例中,提供了一种对前列腺癌或者前列腺癌的进展状态进行诊断、监测或预后的方法,所述方法包括以下步骤:
(a)确定选自包括pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9的组的至少两种pde4d变体在样本中的表达水平,以获得基因表达谱;
(b)基于在步骤(a)中获得的基因表达谱来确定指示前列腺癌进展状态的至少一个pde指标。
在一些实施例中,提供了一种为个体识别前列腺癌治疗的适合性的方法,包括:
(a)确定在从个体获得的样本中的选自包括pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9的组的至少两种pde4d变体的表达水平,以获得基因表达谱;
(b)基于步骤(a)中的指示前列腺癌进展状态的pde4d变体的基因表达谱来确定至少一个前列腺癌进展指标;
(c)在所述个体的样本的pde-指标指示存在前列腺癌或者其中所述个体的样本的pde-指标指示非进展或进展性前列腺癌进展状态的情况下将所述个体识别为适合于接受前列腺癌治疗。
术语“pde-指标”是指至少两种pde4d同工型的表达值组合到单个数据模型中。因此所述pde-指标将提供用于预测前列腺癌进展状态的显著提高的分类能力。
在具体实施例中,所述前列腺癌进展状态为非进展性的或进展性的。
例如,所述pde-指标可以是:
i)pde-指标_1:
pde4d7_exp–pde4d5_exp,
ii)pde-指标_2:
mean(pde4d7_exp&pde4d5_exp),
iii)pde-指标_3:
(mean(pde4d5_exp&pde4d7_exp&pde4d9_exp))/(pde4d4_exp),或者
iv)pde-指标_4:
(mean(pde4d5_exp&pde4d7_exp&pde4d9_exp))/(pde4d1&pde4d2_exp)。
v)pde-指标_5:
(mean(pde4d5_exp&pde4d7_exp&pde4d9_exp))
术语“pde4d4_exp”表示pde4d4的标准化(相对于参考基因)表达水平,术语“pde4d5_exp”表示pde4d5的标准化(相对于参考基因)表达水平,术语“pde4d7_exp”表示pde4d7的标准化(相对于参考基因)表达水平,术语“pde4d9_exp”表示pde4d9的标准化(相对于参考基因)表达水平。术语“pde4d1&pde4d2_exp”表示由单次化验一起检测到的pde4d1和pde4d2的标准化(相对于参考基因)表达水平。
前列腺癌进展指标pde-指标_1是通过pde4d7_exp-pde4d5_exp确定的。pde-指标_1尤其用于将非癌前列腺与前列腺癌区分开。优选地,pde-指标_1将非癌前列腺与癌症前列腺区分开。
例如,低于预定截止值的pde-指标_1指示非癌前列腺并且高于预定截止值的pde-指标_1则指示前列腺癌。
pde-指标_2是通过mean(pde4d7_exp&pde4d5_exp)确定的。pde-指标_2将非进展癌进展状态与进展癌进展状态区分开。
例如,低于预定截止值的pde-指标_2指示进展性前列腺肿瘤状态并且高于预定截止值的pde-指标_2指示非进展性前列腺癌进展状态。
在另一实施例中,低于控制水平的pde-指标_2指示进展性前列腺肿瘤状态并且高于控制水平的pde-指标_2指示非进展性前列腺癌进展状态。
pde-指标_3是通过(mean(pde4d5_exp&pde4d7_exp&pde4d9_exp))/(pde4d4_exp)来确定的。
pde-指标_3将非进展性癌进展状态与进展性癌进展状态区分开。
例如,低于预定截止值的pde-指标_3指示进展性前列腺肿瘤状态并且高于预定截止值的pde-指标_3指示非进展性前列腺癌进展状态。
pde-指标_4是通过
(mean(pde4d5_exp&pde4d7_exp&pde4d9_exp))/(pde4d1&pde4d2_exp)来确定的。
pde-指标_4将非进展性癌进展状态与进展性癌进展状态区分开。
pde-指标_5是通过
(mean(pde4d5_exp&pde4d7_exp&pde4d9_exp))来确定的。
pde-指标_5将非进展性癌进展状态与进展性癌进展状态区分开。
例如,低于预定截止值的pde-指标_4指示进展性前列腺肿瘤状态并且高于预定截止值的pde-指标_4指示非进展性前列腺癌进展状态。
术语“预定截止值”可以基于控制水平(即,针对非癌组织或者非进展性前列腺组织确定的pde-指标)来定义。在具体实施例中,所述截止值可以被设为所述控制水平。在另一实施例中,所述截止值可以不同于所述控制水平。
在额外的实施例中,低于控制水平的pde-指标_1指示非癌前列腺并且高于控制水平的pde-指标_1指示前列腺癌。
在另外的实施例中,低于控制水平的pde-指标_1指示非癌前列腺并且高于控制水平的pde-指标_1则指示前列腺癌,其中,所述控制水平是非癌组织的pde-指标_1。
在另一实施例中,低于控制水平的pde-指标_2指示进展性前列腺肿瘤状态并且高于控制水平的pde-指标_2指示非进展性前列腺癌进展状态。
在优选实施例中,低于控制水平的pde-指标_2指示进展性前列腺肿瘤状态并且高于控制水平的pde-指标_2指示非进展性前列腺癌进展状态,其中,所述控制水平是非进展性肿瘤组织的pde-指标_2。
在另一实施例中,低于控制水平的pde-指标_3指示进展性前列腺肿瘤状态并且高于控制水平的pde-指标_3指示非进展性前列腺癌进展状态。
在优选实施例中,低于控制水平的pde-指标_3指示进展性前列腺肿瘤状态并且高于控制水平的pde-指标_3指示非进展性前列腺癌进展状态,其中,所述控制水平是非进展性肿瘤组织的pde-指标_3。
在另一实施例中,低于控制水平的pde-指标_4指示进展性前列腺肿瘤状态并且高于控制水平的pde-指标_4指示非进展性前列腺癌进展状态。
在优选实施例中,低于控制水平的pde-指标_4指示进展性前列腺肿瘤状态并且高于控制水平的pde-指标_4指示非进展性前列腺癌进展状态,其中,所述控制水平是非进展性肿瘤组织的pde-指标_4。
在另一实施例中,低于控制水平的pde-指标_5指示进展性前列腺肿瘤状态并且高于控制水平的pde-指标_5指示非进展性前列腺癌进展状态。
在优选实施例中,低于控制水平的pde-指标_5指示进展性前列腺肿瘤状态并且高于控制水平的pde-指标_5指示非进展性前列腺癌进展状态,其中,所述控制水平是非进展性肿瘤组织的pde-指标_5。
在本发明的具体实施例中,确定tmprss2-erg基因的存在,即,确定样本为tmprss2-erg阳性还是阴性。具体而言,确定tmprss2-erg是否如tomlins,s.a.等人的“recurrentfusionoftmprss2andetstranscriptionfactorgenesinprostatecancer.”science310,644–648(2005)中所述地被表达。tmprss2-erg是处于雄激素调节的丝氨酸蛋白酶tmprss2和作为ets转录本家族的成员的转录因子erg2之间的基因组重排。如本文中所描述的方法尤其提供了预测能够在其中检测到tmprss2-erg基因或者tmprss2-erg的表达的样本中的前列腺癌进展性的显著提高的分类能力。
在优选的实施例中,介绍了将本发明的方法应用于存在tmprss2-erg的样本。
如本文中所述,可以针对核酸水平、蛋白水平或活性水平来确定pde4d变体的水平。优选地确定(一个或多个)pde4d变体转录本和/或蛋白质的量。此外,可以确定样本中的参考基因的水平。
在本发明的优选实施例中,要对从个体获得的样本执行上文提及的诊断、监测或预后。如本文中所使用的术语“从个体获得的样本”涉及经由本领域技术人员已知的任何适当方法从个体获得的任何生物材料。应当按照临床可接受的方式,更优选按照保存核酸(尤其是rna)或蛋白质的方式收集本发明的场景中使用的样本。
所述生物学样本可以包括身体组织和体液,例如,血液、汗液和尿液。此外,生物学样本可以包含源自于细胞群体的细胞提取物或者包含所述细胞群体,所述细胞群体包含上皮细胞,优选包含癌上皮细胞或者源自于疑似癌症的组织的上皮细胞。更加优选地,所述生物学样本可以含有源自于腺组织的细胞群体,例如,所述样本可以源自于男性个体的前列腺。此外,如有必要,可以从所获得的身体组织和体液对细胞提纯,并且然后将其用作生物学样本。
样本,尤其是在初始处理之后,可以被合并。但是,也可以使用未合并的样本。
在本发明的具体实施例中,生物学样本的内容也可以经受富集步骤。例如,可以使样本与对特定细胞类型(例如,前列腺细胞)的细胞膜或细胞器特异的利用(例如)磁性颗粒进行了功能化的配体进行接触。如本文中的上文或下文所述,接下来可以将通过磁颗粒浓缩的材料用于检测和分析步骤。
在本发明的具体实施例中,可以获得和/或使用活检样本或切除术样本。这样的样本可以包括细胞或细胞溶解产物。
此外,可以通过流体或流体样本(例如,血液、尿液等)的过滤过程来富集细胞,例如,肿瘤细胞。这样的过滤过程也可以与如上文所述的基于具有配体特异性的相互作用的富集步骤相结合。
在本发明的尤其优选的实施例中,所述样本可以是组织样本、活检样本、尿液样本、尿液沉淀样本、血液样本、唾液样本、精液样本、包含循环肿瘤细胞的样本或者含有前列腺分泌外来体的样本。例如,血液样本可以是血清样本或血浆样本。
在本发明的实施例中,标记基因表达模式(或者pde-指标)可以与手术前或者手术后psa水平、gleason评分和pt阶段关联。
在本发明的优选实施例中,如本文中所描述的方法包括确定pgleason评分和/或pt阶段的额外步骤。
在本发明的更优选的实施例中,如本文中所描述的方法包括确定pgleason评分和/或pt阶段的额外步骤。
“gleason评分”或“pgleason”是指接受过培训的病理学家根据gleason系统对前列腺癌的样本所做分级,所述gleason系统基于前列腺组织样本中的细胞与癌组织或者正常前列腺组织的相似度来使用从1到5的数字分配gleason评分。看起来很像正常前列腺组织的组织被给予为1的评
分或等级,而缺乏正常特征的组织以及似乎在前列腺各处无规则地扩散的细胞则被给予为5的评分或等级。评分或等级2到4(包括)具有处于这些可能性之间的特征。但是,由于前列腺癌可能存在具有不同评分或等级的区域,因而为构成大部分组织的两个区域赋予分别的评分或等级。将这两个评分或等级相加以得到处于2和10之间的gleason评分(或gleason和)。
在一个额外的方面中,可以与前列腺癌的其他评估或指征相结合或者代替其执行对表达水平的分析。在一些实施例中,与确定包括来自对象的前列腺癌细胞的样本中的前列腺癌等级的方法相组合来实施所述分析。在其他实施例中,与确定样本中的前列腺癌阶段的方法进行组合。第三种可能性是与任选在用于分离前列腺癌细胞的过程之前检测或者确定对象体内的psa水平相组合。当然,与这些代表性范例中的任何一者、两者或者全部的三者相结合都是可能的。只要使用了不止一种类型的评估,结果就变成了多变量分析。本发明明确包含如本文中所描述的各种评估的所有可能组合,以作为多变量实施例。
一般而言,可以使用本领域技术人员已知的用于评定前列腺癌等级和/或阶段的任何可接受方法。在一些情况下,确定前列腺癌等级的方法包括确定gleason评分(或gleason等级)。在其他情况下,确定前列腺癌阶段的方法包括根据用于评估前列腺癌阶段的美国癌症联合委员会(ajcc)肿瘤分期系统进行的确定。并且如文中所述,可以代替gleason评分或者ajcc肿瘤阶段确定而执行对基因(序列)表达水平的分析。就psa水平而言,可以在用于提供包括如本文中所描述的任何方法使用的前列腺癌细胞的样本的前列腺切除术之前实施对所述psa水平的评估。
在本发明的另一实施例中,还可以将如本文中上文所述的方法与基于一种或多种不同生物学标记的表达的一种或多种类似识别方法进行组合。确定血液中的具有前列腺特异性的抗原(psa)的水平是优选的。因而,如果遇到血液中的psa水平所处范围为大约2到5ng/ml或更高,优选为大约2.2到4.8ng/ml或更高,2.4到4.4ng/ml或更高,2.6到4.2ng/m或更高或者2.8到4.0ng/m或更高,更优选为大约2.5到4ng/ml或更高的情况,那么认为该个体正患有恶性激素敏感型前列腺癌,或者在不久的将来(即,在接下来的1、2、3、4、5、6、12、14、48个月内)可能发展成恶性激素敏感型前列腺癌。可以根据如本文中所述的步骤执行对pde4d变体表达的测试。可以使用文中上文所述的控制作为控制或者控制样本。在尤其优选的实施例中,所述测试步骤可以基于特异地结合到一种或几种pde4d变体的抗体的使用,例如,所述抗体是可商购的抗pde4d7抗体,例如,nb300-652或gtx14629。
在一个实施例中,基因表达水平是通过使用一个或多个探针以及/或者一个或多个探针组监测mrna表达而确定的。
在一些实施例中,提供了用于对(例如)个体体内的前列腺癌或者前列腺癌进展状态进行诊断、监测或预后的方法,其至少包括确定样本中的(一个或多个)标记基因或goi的水平的步骤。术语“确定(一个或多个)标记基因或goi的水平”或者“确定基因表达水平”或者“确定pde4d变体的表达水平”是指对(一个或多个)标记基因或goi或者pde4d变体表达产物的存在或者量的确定。因而,术语“(一个或多个)标记基因或goi的水平”因此意指所述(一个或多个)标记基因或goi的表达产物(例如,转录本)的存在或量以及/或者对所述(一个或多个)标记基因或goi的存在或量的确定。对(一个或多个)标记基因或goi的表达产物的存在或量的确定可以通过本领域已知的任何手段来完成。
在本发明的优选实施例中,对(一个或多个)标记基因或goi的表达产物的存在或量的确定是通过核酸测量来完成的。因而,所述(一个或多个)表达水平可以是通过涉及对由所述基因编码的mrna的检测的方法来确定。
例如,可以通过对从样本获得的核酸分子(例如,rna或cdna)提纯,随后与本文中上文所述的专门的寡核苷酸探针杂交而对(一个或多个)标记基因或goi的表达的核酸水平的测量结果进行评估。表达水平的比较可以是视觉地或者借助于合适的设备完成的。用于监测mrna或表达产物的方法是本领域技术人员已知的。
替代地,可以通过dna阵列或微阵列方案来检测(一个或多个)标记基因或goi的表达的核酸水平。通常优选利用荧光标记来对源自于要被测试的患者的样本核酸进行处理并标记。随后,这样的核酸分子用可以在利用对应于本发明的标记基因的固定化捕获探针的杂交方案中使用。用于实施微阵列分析的适当手段是本领域技术人员已知的。
在标准设置中,dna阵列或微阵列包括用于检测若干基因的固定化高密度探针。所述阵列上的探针与标记基因的序列的一个或多个部分互补。通常,cdna、pcr产物和寡核苷酸可用作探针。
基于dna阵列或微阵列的检测方法通常包括下述步骤:(1)分离来自样本的mrna并且任选将所述mrna转换为cdna,并且随后对这一rna或cdna进行标记。用于分离rna,将其转换为cdna并对核酸进行标记的方法在微阵列技术的手册中有述。(2)使来自步骤1的核酸与针对所述标记基因的探针杂交。可以采用诸如荧光染料cy3(红色)或cy5(蓝色)的染料来对来自样本的核酸进行标记。一般而言,利用不同的染料对控制样本进行标记。(3)检测来自样本的核酸与所述探针的杂交,并且至少定性地并且尤其定量地确定针对检查的标记基因而言样本中的mrna的量。可以基于信号强度的差异来估算样本和控制之间的表达水平差异。这可以通过合适的软件(例如但不限于例如由affymetrix提供的软件)来测量和分析。
定点置于dna阵列上的对应于所使用的标记基因的探针的数量不受限制。而且,标记基因可以通过两个或更多探针表示,所述探针杂交至基因的不同部分。探针是针对每个选定的标记基因设计的。这样的探针通常是包括5-50个核苷酸残基的寡核苷酸。可以通过pcr或者以化学方式合成更长的dna。用于合成这样的寡核苷酸并将其施加到衬底上的方法是微阵列领域公知的。也可以将标记基因以外的基因定点置于dna阵列上。例如,可以将表达水平未受到显著改变的基因的探针定点置于dna阵列上,从而对阵列结果标准化,或者将多个阵列或不同试验的试验结果进行比较。
替代地,可以在对感兴趣转录本的逆转录之后通过定量rt-pcr方案,优选通过实时pcr方案,来检测标记基因或goi的表达的核酸水平。通常,第一步骤是根据本领域技术人员已知的任何适当方法将转录本逆转录为cdna分子。接下来,可以基于如上文所述地获得的第一dna链来执行定量或实时pcr方案。
优选地,可以使用这一类型的作为首要基于fret的探针的taqman或分子信标探针用于定量pcr检测。在两种情况下,所述探针均充当内部探针,其与一对处于感兴趣目标区域的侧翼的相对的引物结合使用,所述目标区域优选是如本文中以上定义对寡核苷酸特异的标记基因的集合。在目标片段的扩增时,所述探针可以选择性地结合到识别序列中处于所述引物位点之间的产物上,从而相对于目标频率中的提高引起fret信号发射的提高。
优选地,用于根据本发明的定量pcr方案的taqman探针包括如本文中以上定义具有大约20到30个碱基的特定寡核苷酸,其两端利用fret对来标记。通常,5'端将具有较短波长的荧光基团,例如,荧光素(例如,fam),而3'端则通常用较长波长荧光猝灭基团(例如,tamra)或者非荧光猝灭基团化合物(例如,blackhole猝灭基团)来标记。优选地,用于定量pcr的探针,尤其是如本文中以上定义的探针在临近报告染料的5'端上没有鸟嘌呤(g),从而避免在探针被降解之后报告荧光的猝灭。
用于根据本发明的定量pcr方案的molecularbeacon探针优选地使用fret相互作用来检测pcr产物并对其进行定量,其中,每一探针具有5'荧光标记的末端和3'带猝灭基团标记的末端。所述探针结构的这种发夹式或者茎环式配置优选包括具有两个短的自结合末端的茎和具有长的内部靶特异性区域的环,所述区域具有大约20到30个碱基。
也可以在本发明的背景下采用的替代检测机制涉及被制作为只有环结构而没有短的互补茎区域的探针。也可以在本发明的背景下使用的、用于定量pcr的、替代性的基于fret的方案是基于结合到目标上的相邻位点的两个杂交探针的使用的,其中,第一探针具有处于3'端上的荧光供体标签,第二探针具有在其5'端上的荧光受体标签。
在具体实施例中,基因表达水平是通过基于扩增的方法和/或微阵列分析和/或rna测序来确定的。
在具体实施例中,在为个体识别前列腺癌治疗的适合性的方法的步骤(c)中,在个体的样本的前列腺癌进展指标指示进展性前列腺癌进展状态的情况下将该个体识别为适合接受从前列腺手术、前列腺切除、化学治疗、放射治疗、有限的或扩展的淋巴结切除中选择的前列腺癌治疗。
在一些实施例中,提供了一种为个体识别前列腺癌治疗的适合性的方法,包括:
(a)确定从个体获得的样本中的选自包括pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9的组中的至少两种pde4d变体的表达水平,以获得基因表达谱;
(b)基于步骤(a)中的指示前列腺癌进展状态的pde4d变体的基因表达谱来确定至少一个前列腺癌进展指标;
(c)在所述个体的样本的pde-指标指示存在前列腺癌或者其中所述个体的样本的pde-指标指示非进展性或进展性前列腺癌进展状态的情况下将所述个体识别为适合于接受前列腺癌治疗。
在优选实施例中,在为个体识别前列腺癌治疗的适合性的方法的步骤(c)中,在所述个体的样本的前列腺癌进展指标指示进展性前列腺癌进展状态的情况下将所述个体识别为适合接受从前列腺手术、前列腺切除、化学治疗、放射治疗、有限的或扩展的淋巴结切除中选择的前列腺癌治疗,而在所述个体的样本的前列腺癌进展指标指示非进展性前列腺癌进展状态的情况下,则将所述个体识别为适合接受积极监测作为前列腺癌治疗。
本发明的另一方面涉及一种产品,其包括:
用于确定选自包括由pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9的组的至少两种磷酸二酯酶4d(pde4d)变体的表达水平的引物和/或探针;
任选还包括用于确定参考基因的基因表达水平的引物和/或探针,所述参考基因优选地是看家基因,更优选地是tbp、hprt1、actb、rplp0、pum1、polr2a、b2m、k-alpha-1或alas-1。
在一些实施例中,提供了一种包括核酸分子的集合的组分,所述核酸分子每者包括用于分析pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9中的至少两种pde4d变体的基因表达的至少一个寡核苷酸探针序列,任选地包括用于分析从tbp、hprt1、actb、rplp0、pum1、polr2a、b2m、k-alpha-1(tuba1b)或alas-1中选择的参考基因的基因表达的至少一个寡核苷酸探针序列。
在一些实施例中,提供了一种核酸阵列,其包括一个或多个与pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9中的至少两种pde4d变体的编码序列互补并且可与之杂交的寡核苷酸探针,任选地包括一个或多个与从tbp、hprt1、actb、rplp0、pum1、polr2a、b2m、k-alpha-1(tuba1b)或alas-1中选择的参考基因中的至少一个互补并可与之杂交的寡核苷酸探针,用于确定如文中的本文中以上定义的pde-指标。
“微阵列”是由形成于通常为固体的支座的表面上的每者具有所定义的面积的离散区域构成的线性或二维阵列,例如,所述一般为固体的支座可以是但不限于玻璃、塑料或人工膜。微阵列上的离散区域的密度由要在单个固相支座的表面上检测的固定化寡核苷酸的总数决定,例如,在一些实施例中,其为至少大约50/cm2、至少大约100/cm2、至少大约500/cm2,但是低于大约1000/cm2。所述阵列可以包含总共不到大约500个、大约1000个、大约1500个、大约2000个、大约2500个或者大约3000个固定化寡核苷酸。如本文中所使用的dna微阵列是用于与来自样本的经扩增或克隆的寡核苷酸杂交的寡核苷酸阵列或者置于芯片或其他表面上的寡核苷酸。由于阵列内的每一特定寡核苷酸群组的位置是已知的,因而可以基于样本寡核苷酸与微阵列中的特定位置的结合来确定样本寡核苷酸的身份。
“寡核苷酸”是核苷酸的多聚形,为核糖核苷酸或者脱氧核糖核苷酸。该术语只是指分子的一级结构。因而,该术语包括双链和单链dna和rna。其还包括已知类型的修饰,包括本领域已知的标签、甲基化作用、“帽”、采用类似物对自然出现的核苷酸中的一者或多者的置换,以及核苷酸间修饰,如不带电连链接(例如,硫代磷酸酯、磷酸二硫代脂等),以及寡核苷酸的未修饰形。
在广义上使用术语“扩增”是以意指建立能够以酶促的方式利用dna或rna聚合酶生成的扩增产物。如文中所使用的“扩增”一般是指生成预期序列,尤其是样本的序列的多个副本的过程。“多个副本”是指至少2个副本。“副本”未必意味着与模板序列的完美序列互补性或同一性。还有可能使用本领域已知的任何测序方法来识别goi的序列。
术语“对应”在适当的情况下可以指核酸分子与另一核酸分子共享相当大的量的序列同一性。相当大的量是指至少95%,通常至少98%,更通常至少99%,并且序列同一性是使用blast算法确定的,如altschul等人在j.mol.biol.215:403-410(1990年)中所述(使用所公开的默认设置,即,参数w=4,t=17)。用于对mrna扩增的方法一般是本领域已知的,并且包括反转录pcr(rt-pcr)以及在美国专利申请序列号10/062857(2001年10月25日提交)和美国临时专利申请60/298847(2001年6月15日提交)以及60/257801(2000年12月22日提交)中描述的方法,在此通过引用将所有这些文献的全文并入本文,就像对其进行了全面的阐述一样。可以使用的另一种方法是定量pcr(或q-pcr)。替代地,可以通过本领域已知的方法将rna直接标记为对应的cdna。
由于本发明依赖于对过度表达或表达不足的基因(或表达序列)的识别,因而本发明的一个实施例涉及通过使样本细胞的mrna或者其扩增或克隆版本(例如,dna或cdna)与对特定基因序列独有的寡核苷酸杂交来确定表达。这种类型的寡核苷酸可以含有在其他基因序列中找不到的基因序列的至少大约20个,至少大约22个,至少大约24个,至少大约26个,至少大约28个,至少大约30个或者至少大约32个相继的碱基对。上一句中使用的“大约”一词是指从所陈述的数值加减1。其他实施例可以使用具有在其他基因序列中找不到的基因序列的至少或大约50个,至少或大约100个,至少或大约150个,至少或大约200个,至少或大约250个,至少或大约300个,至少或大约350个,或者至少或大约400个碱基对的寡核苷酸。前一句中使用的“大约”一词是指从所陈述的数值加减10%。还可以将这样的寡核苷酸称为能够与如本文中所描述的基因的序列或其特有部分杂交的寡核苷酸探针。在很多情况下,杂交条件是大约55到65℃的温度上的大约30%v/v到大约50%甲酰胺、大约0.01m到大约0.15m的杂交用盐、以及大约0.01m到大约0.15m的清洗条件用盐的严格条件或与之等价的条件。
在其他实施例中,供本发明使用的寡核苷酸可以与将接受表达确定的标记基因序列之间具有大约或95%、大约或96%、大约或97%、大约或98%或者大约或99%的同一性。同一性是使用blast算法确定的,如上文所述。还可以基于在如上文所述的严格条件或与之等价的条件下与本发明的方法中使用的所表达标记基因杂交的能力来描述这些探针。
在很多情况下,所述序列是由所述标记基因编码的mrna、这样的mrna的对应cdna和/或这样的序列的扩增版本的那些序列。在本发明的一些实施例中,使所述寡核苷酸探针在阵列、其他设备或者对所述探针定位的各个点上固定化。
根据本发明可以使用的适当标签包括放射性同位素、核苷酸生色团、酶、基底、荧光分子、化学发光分子部分、磁没有货颗粒以及生物发光分子部分等等。这样,标签是能够通过光谱学手段、光化学手段、生物化学手段、免疫化学手段、电学手段、光学手段或者化学手段检测到的任何成分。术语“支撑体”是指任何常规支撑体,例如,小珠、颗粒、量杆、纤维、过滤器、膜以及硅烷或硅酸盐支撑体,例如,载玻片。
在一些实施例中,提供了一种用于对前列腺癌或前列腺癌进展状态进行诊断、监测或预后,从而为个体识别前列腺癌治疗的适合性的套件,其包括:a)阵列,其包括与pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9中的至少两种pde4d变体的编码序列互补并且能与之杂交的一个或多个寡核苷酸探针,任选地包括与从tbp、hprt1、actb、rplp0、pum1、polr2a、b2m、k-alpha-1(tuba1b)或alas-1中选择的参考基因中的至少一个互补并且能与之杂交的一个或多个寡核苷酸探针,用于确定如前述项目中的任何项目中所定义的pde-指标;b)套件控件;以及c)任选的供使用的指令。
通常,本发明的诊断套件包含一种或多种允许专门对本文中以上所定义的(一个或多个)标记基因或goi进行检测的试剂。根据本发明,诊断套件的试剂或成分可以被包含到一个或多个容器或单独实体内。试剂的性质是由意套件旨在的检测方法所决定的。
此外,所述套件可以包括一定量的已知核酸分子,其可以用于该套件的校准或者用作内部控制。通常,用于检测(一个或多个)标记基因或goi的表达产物的诊断套件可以包括辅助剂,例如,pcr缓冲剂、dntp、聚合酶、诸如二价阳离子或一价阳离子的离子、杂交溶液等。这样的成分是本领域技术人员已知的,并且可以根据所执行的方法而变化。此外,所述套件可以包括指导活页和/或可以提供关于所获得的结果的适当性的信息。
本发明的另一方面涉及一种用于执行文中所述方法的设备,其包括:a)包括记录的数据库,所述记录包括与前列腺癌进展状态相关的参考基因表达值,每一参考概况包括选自包含pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9的组的至少两种pde4d变体的表达水平;和/或b)用户接口,其能够接收和/或输入基因的集合的基因表达值以用于与数据库中的基因参考表达概况进行比较,所述集合包括选自包括pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8和pde4d9的组的至少两种pde4d变体的表达水平;c)输出,其显示根据基因所述集合的表达水平的对癌症状态的预测。
另一方面涉及一种用于对前列腺癌或前列腺癌的进展状态进行诊断、监测或预后的计算机实施的方法,其包括如本文中所描述的方法的步骤。
在本申请的语境中,“用于对前列腺癌或前列腺癌进展状态进行诊断、监测或预后的计算机实施方法”的表述是指一种方法,其中,软件算法计算pde-指标,并且基于其来提供被分析的患者的预后,其中,该方法使用在测量本文中提及的基因的基因表达水平时获得的原始数据,并且使用上文描述的方程将其转换为pde-指标。
本发明的另一方面涉及一种在前列腺癌的处置或预防中使用的刺激药物成分,其包括选自以下组的至少一个元:
(a)直接刺激或调节选自包括pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d7、pde4d8、pde4d9的组的pde4d变体的活性的化合物,优选为具有酶活性的变构诱导剂;
(b)间接刺激或调节(a)中的pde4d变体的活性的化合物;
(c)(a)中的pde4d变体的蛋白质或者生物活性等价物;
(d)对(a)中的pde4d变体进行编码和表达的核酸;
(e)对(a)中的pde4d变体的mirna特异的mirna抑制剂;
(f)脱甲基试剂;以及
(g)磷酸二酯酶置换因子,优选为肽、拟肽、小分子、抗体或核酸适体,
在一些实施例中,提供了一种用于前列腺癌的处置或预防的刺激药物成分,其包括选自以下组中的至少一个元:
(a)直接刺激或调节选自包括pde4d5、pde4d8和pde4d9的组的pde4d变体的活性的化合物,优选为具有酶活性的变构诱导剂;
(b)间接刺激或调节(a)中的pde4d变体的活性的化合物;
(c)(a)中的pde4d变体的蛋白质或者其生物活性等价物;
(d)对(a)中的pde4d变体进行编码和表达的核酸;
(e)对(a)中的pde4d变体的mirna特异的mirna抑制剂;
(f)脱甲基试剂;以及
(g)磷酸二酯酶置换因子,优选地为肽、拟肽、小分子、抗体或核酸适体。
本发明的另一方面涉及一种在前列腺癌的处置或预防中使用的刺抑制物成分,其包括选自以下组中的至少一个元:
a)直接抑制选自包括pde4d1、pde4d2、pde4d3、pde4d4、pde4d5、pde4d6、pde4d8、pde4d9的组的pde4d变体的活性的化合物;
b)间接抑制(a)中的pde4d变体的活性的化合物;
c)(a)中的pde4d变体的蛋白质的显性阴性形或其生物活性等价物;
d)对(a)中的pde4d变体的显性阴性形进行编码和表达的核酸;
e)对(a)中的pde4d变体特异的mirna;
f)(a)中的pde4d变体的反义分子;
g)对(a)中的pde4d变体特异的sirna;
h)对(a)中的pde4d变体的表达产物特异的或者对(a)中的pde4d变体的蛋白质特异的核酸适体;
i)能够特异性地结合至(a)中的pde4d变体的蛋白质的小分子或拟肽;以及
j)对(a)中的pde4d变体的蛋白质特异的抗体和/或对(a)的pde4d变体的蛋白质特异的抗体变体。
其中,所述pde4d变体优选选自包括pde4d5、pde4d8和pde4d9的组。
在一些实施例中,提供了一种用于前列腺癌的处置的刺激或抑制药物成分,其中,根据指示前列腺癌进展状态的pde-指标来向个体施予所述成分。
在一些实施例中,提供了一种用于前列腺癌的处置的刺激或抑制药物成分,其中,在个体的样本的pde-指标指示进展性前列腺癌进展状态的情况下向该个体施予所述成分。
在优选实施例中,所述个体的样本的pde-指标_2、pde-指标_3、pde-指标_4或pde-指标_5中的至少一个低于预定截止值。
在另一优选实施例中,所述个体的样本的pde-指标_2、pde-指标_3、pde-指标_4或pde-指标_5中的至少一个低于控制水平。
在另一优选实施例中,所述个体的样本的pde-指标_2、pde-指标_3、pde-指标_4或pde-指标_5中的至少一个低于控制水平,其中,所述控制水平分别是所述个体的样本的pde-指标_2、pde-指标_3、pde-指标_4或pde-指标_5。
本发明的另一方面涉及一种用于处置患有前列腺癌的对象的方法,所述方法包括:
(i)选择具有前列腺癌的对象,其中,该个体的样本的pde指标指示进展性前列腺癌进展状态,并且
(ii)施予如本文中所描述的刺激或抑制药物成分。
本发明的另一方面涉及一种用于处置具有前列腺癌的对象的方法,所述方法包括:
(i)选择具有前列腺癌的对象,其中,该个体的样本的pde指标指示进展性前列腺癌进展状态,并且
(ii)施予如本文中所描述的刺激或抑制药物成分。
一种用于治疗具有前列腺癌的对象的方法,所述方法包括:
(i)选择具有前列腺癌的对象,其中,该个体的样本的pde-指标_2、pde-指标_3、pde-指标_4或pde-指标_5中的至少一个低于预定阈值,并且
(ii)施予如本文中所描述的刺激或抑制药物成分。
一种用于处置患有前列腺癌的对象的方法,所述方法包括:
(i)选择具有前列腺癌的对象,其中,该个体的样本的pde-指标_2、pde-指标_3、pde-指标_4或pde-指标_5中的至少一个低于预定阈值,并且
(ii)施予如本文中所描述的刺激或抑制药物成分。
如文中所使用的术语“直接刺激或调节pde4d变体的活性的化合物”是指能够通过与pde4d变体的直接相互作用提高pde4d变体的活性从而使camp降解的化合物。这样的化合物可以是pde4d变体的任何直接相互作用子,其对pde4d变体的催化活性有正影响。这样的化合物可以优选为pde4d变体的催化活性的变构引导剂,例如,同向异构调节物。pde4d变体的优选变构引导剂为camp或camp类似物。本发明设想的其他直接刺激化合物为离子,优选为有生物活性的一价和二价阳离子,例如,ca2+、mg2+。
如文中所使用的术语“直接刺激或调节pde4d的活性的化合物”是指能够在不对具体的变体产生选择性的情况下通过与pde4d的直接相互作用而提高pde4d的活性从而使camp降解的化合物。这样的化合物可以是pde4d的任何直接相互作用子,其对pde4d的催化活性有正影响。这样的化合物可以优选为pde4d的催化活性的变构引导剂,例如,同向异构调节物。pde4d的优选变构引导剂为camp或camp类似物。本发明设想的其他直接刺激化合物为离子,优选为有生物活性的一价和二价阳离子,例如,ca2+、mg2+。
如文中所使用的术语“间接刺激或调节pde4d的活性的化合物”是指能够在不对具体的变体产生选择性的情况下通过与pde4d的直接相互作用子的相互作用(间接相互作用子)或者通过不涉及与pde4d的相互作用的间接作用途径来提高pde4d的活性从而使camp降解的化合物。这样的化合物可以是pde4d的相互作用子的任何直接相互作用子。pde4d的相互作用子的直接相互作用子所传达的作用可以是正的(如果pde4d的相互作用子本身对pde4d的活性产生正面作用),或者可以是负的(如果pde4d的所述相互作用子对pde4d的活性产生负面作用)。典型地,起正面作用的间接相互作用子可以刺激直接相互作用子的激动效果,例如,通过抑制pde4d7不赋予的camp降解过程,或者通过提高camp生成等等而诱发诸如camp或其类似物的变构工作化合物的浓度的提高。
替代地,这样的起正面作用的间接相互作用子可以诱发对直接结合蛋白质的结合行为的修饰,从而在不对具体变体产生选择性的情况下得到提高的pde4d活性。起负面作用的间接相互作用子通常可以对pde4d的抑制剂产生抑制效果。这样的相互作用子的例子为使pde4d抑制剂降解的酶活动或者能够结合pde4d抑制剂和使其猝灭的蛋白质。替代地,这样的相互作用子可以抑制引起pde4d的降解的活动,例如,蛋白酶抑制剂。其他例子及其实施方式对于本领域技术人员而言将是已知的。
如本文中所使用的术语“间接刺激或调节pde4d变体的活性的化合物”是指能够通过与pde4d的直接相互作用子的相互作用(间接相互作用子)或者经由不涉及与pde4d变体的相互作用的间接作用途径来提高pde4d变体的活性从而使camp降解的化合物。这样的化合物可以是pde4d变体的相互作用子的任何直接相互作用子。由pde4d变体的相互作用子的直接相互作用子所传达的作用可以是正的(如果所述pde4d变体的相互作用子本身对pde4d变体的活性产生正面作用),或者可以是负的(如果pde4d变体的所述相互作用子对pde4d变体的活性产生负面作用)。典型地,起正面作用的间接相互作用子可以刺激直接相互作用子的激动效果,例如,通过抑制pde4d7不赋予的camp降解过程或者通过提高camp生成等等而诱发诸如camp或其类似物的变构工作化合物的浓度的提高。
替代地,这样的起正面作用的间接相互作用子可以激起对直接结合蛋白质的结合行为的修饰,造成提高的pde4d变体活性。通常,起负面作用的间接相互作用子可以对pde4d变体的抑制剂产生抑制效果。这样的相互作用子的例子为使pde4d变体抑制剂降解的酶活动或者能够结合pde4d变体抑制剂并使其猝灭的蛋白质。或者,这样的相互作用子可以抑制引起pde4d变体的降解的活动,例如,蛋白酶抑制剂。其他例子及其实施方式对于本领域技术人员而言将是已知的。
替代地,可以通过激活、保护或保持内源性pde4d基因的表达的化合物来传达对pde4d活性的间接刺激。这样的化合物的例子为pde4d特异的转录因子、pde4d特异的或者pde4d变体特异的使活性稳定的mrna或者pde4d剪接因子/pde4d特异的剪接因子。其他例子及其实施方式对于本领域技术人员而言将是已知的。
在所述刺激药物成分中所包括的“pde4d变体蛋白质”可以是如本文中以上所定义的pde4d变体蛋白质。具体而言,其可以是由人类磷酸二酯酶pde4d的剪接变体1、2、4、5、6、8、9编码的蛋白质,如本文中所定义。在该语境中使用的“pde4d变体蛋白质”还包括至少60%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%等同于seqidno:2、4、6、8、10、12、16或18中阐述的序列的氨基酸序列以及由至少60%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%等同于seqidno:1、3、5、9、7、9、11、15或17中阐述的序列的核苷酸序列编码的氨基酸序列。
所述刺激药物成分中包括的“pde4d蛋白质”可以是如文中本文中以上定义的pde4d变体蛋白质、几种pde4d变体的混合物或者是至少两种pfe4d变体所共有的pde4d的截取版本。
如本文中所使用的术语“pde4d的生物活性等价物”是指能够执行几种pde4d变体所共有的pde4d功能的全部或大部分的pde4d蛋白质。其优选涉及能够使camp降解的蛋白质。
如本文中所使用的术语“pde4d变体的生物活性等价物”的表述是指能够执行pde4d变体功能的全部或者大部分的pde4d变体蛋白质。其优选涉及能够使camp降解的蛋白质。
根据本发明的pde4d、pde4d变体或者pde4d或pde4d变体的生物活性等价物可以是通过本领域技术人员已知的任何适当方法以重组方式生成的。因此,本发明还包括用于生成pde4d、pde4d变体或者pde4d或pde4d变体的生物活性等价物的方法。
相应地,本发明预期包括对如上文所定义的pde4d、pde4d变体或者pde4d或pde4d变体的生物活性等价物进行编码的寡核苷酸的载体、宿主细胞以及通过重组技术实施的pde4d或pde4d的生物活性等价物的生成。
一个适当载体可以是(例如)噬菌体、质粒、病毒或逆转录病毒载体。逆转录病毒载体可以为可复制型或复制缺陷型。在后一种情况下,病毒传播一般仅发生在互补宿主细胞中。对pde4d、pde4d变体或者pde4d或pde4d变体的生物活性等价物编码的多核苷酸可以结合至含有可选择标记的载体或携带体,从而在宿主体内传播。对应的多核苷酸嵌入体可以操作性地链接到合适的启动子,例如,黏质体pl启动子、e.colilac、trp、phoa和tac启动子、sv40早晚期启动子以及逆转录病毒ltr的启动子或者psa启动子。其他适当启动子是本领域技术人员已知的。所述表达构造还可以含有用于转录起始和转录结束的位点以及处于转录区内的用于转译的核糖体结合位点。由所述构造表达的转录本的编码部分将优选包括处于开头的转译起始密码子和大约位于要被转译的多肽的末尾的终止密码子(uaa、uga或uag)。
所述多肽或蛋白质可以是糖基化的,或者可以是非糖基化的,或者可以受到其他修饰。此外,多肽或蛋白质还可以包括初始的受到修饰的蛋氨酸残余,在一些情况下其为宿主介导过程的结果。此外,多肽、蛋白质或肽可以通过乙酰化、聚乙二醇化、羟基化、甲酰化、磷酸化、酰胺化、借助于保护/封端基团的衍生作用、特殊化学裂解、蛋白质裂解、与细胞配体或者其他蛋白质或氨基酸均聚物的链接,即与富甘氨酸的氨基酸均聚物(hap)的融合等而被修饰。这样的修饰可以是通过本领域技术人员已知的适当技术执行的。此外,多肽、肽或变体可以含有一个或多个非经典氨基酸。
此外,可以采用本领域已知的技术,例如,通过使用肽合成仪来化学地合成本发明的pde4d、pde4d变体或者pde4d或pde4d变体的生物活性等价物。
“多核苷酸”是核苷酸的多聚形,其为核苷酸或脱氧核糖核苷酸。该术语只是指分子的一级结构。因而,该术语包括双链和单链dna和rna。其还包括已知类型的修饰,包括本领域已知的标签、甲基化作用、“帽”、采用类似物对自然出现的核苷酸中的一者或多者的置换,以及核苷酸间修饰,诸如不带电链接(例如,硫代磷酸酯、磷酸二硫代脂等),以及寡核苷酸的未修饰形。
如本文中以上所定义的刺激药物成分中包含的“对pde4d进行编码和表达的核酸”是指任何包括可表达pde4d基因的适当载体元,例如,如本文中上文所描述。
如本文中以上所定义的刺激药物成分中包含的“对pde4d变体进行编码和表达的核酸”是指任何包括可表达pde4d基因的适当载体元,例如,如文中上文所述,包括可表达的pde4d基因。优选地,这样的载体元可以包括seqidno:1、3、5、7、9、11、15和17中阐述的核苷酸序列。这样的载体元还可以包括表现出与pde4d变体的高度同源性的核苷酸序列,例如,至少60%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%等同于seqidno:1、3、5、7、9、11、15或17中阐述的序列的核酸序列或者对至少60%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%等同于seqidno:2、4、6、8、10、12、12、16或18中阐述的序列的氨基酸序列进行编码的核酸序列。替代地,所述载体可以包括pde4d的基因组序列,优选地包括对应于seqidno:19的ensembl数据库条目ensg00000113448(versionensg00000113448.8,ensemblrelease53-march2009)中定义的或者源自于与genbankaccessionno.ac034234(versionac034234.4,gi:18390182,2009年3月24日)与或者源自于wang等人的2003,cellsignal.,15(9):883-91的genbankaccessionno.ac008934(versionac008934.5,gi:173862352009年3月24日)的序列的组合。更优选地,所述载体可以包括如seqidno:19中定义的pde4d的基因组序列。
此外,如本文中以上所定义的pde4d或pde4d变体的生物活性等价物可以被包含到本发明的载体中。
对pde4d或pde4d变体编码的多核苷酸可以优选结合至含有可选择标记的载体,从而在人体细胞中传播。在优选实施例中,多核苷酸嵌入物可以操作性地与psa启动子链接。
在本发明的一个实施例中,可以通过活体疗法提供如本文中以上所定义的对pde4d或pde4d变体进行编码和表达的核酸。术语“活体治疗”是指如本文中以上所定义的pde4d或者pde4d变体或者pde4d或pde4d变体的生物活性等价物被表达到任何适当的活载体中。相应地,本发明涉及适合于活细胞中的表达的对应的多核苷酸。本发明还涉及含有这样的多核苷酸的载体、适当的寄主细胞以及在所述宿主细胞中通过重组技术生成多肽。
术语“活载体”涉及本领域技术人员已知的任何适当活宿主细胞或病毒。适当的宿主的代表性例子包括但不限于诸如大肠杆菌或乳酸杆菌的细菌细胞、如酵母细胞的真菌细胞、原生动物、昆虫细胞或者动物细胞。优选地,该术语涉及减弱细菌、减弱真菌细胞或者减弱原生动物。适当病毒的代表性例子包括腺病毒、逆转录病毒或慢病毒的群组的病毒,优选为腺病毒、逆转录病毒或慢病毒的群组的减弱病毒。在优选实施例中,可以使用益生菌细菌细胞,尤其是益生菌大肠杆菌或乳酸杆菌细胞。更优选地,可以采用大肠杆菌nissle1973的细胞,更优选可以采用干酪乳杆菌或乳酸杆菌zeae393的细胞。
包含在如本文中以上所定义的刺激药物成分中的“对pde4d的mirna特异的mirna抑制剂”是指在不对具体的pde4d变体产生选择性的情况下对与pde4dmirna或microrna分子互补的核酸序列编码的核酸分子。
包含在如本文中以上所定义的刺激药物成分中的“对pde4d变体的mirna特异的mirna抑制剂”是指对与pde4d变体mirna或microrna分子互补的核酸序列编码的核酸分子。
如文中所使用的术语“互补”是指mirna抑制剂核酸(有义分子)和mirna(反义分子)之间的没有任何失配的理想互补以及所述核酸与mirna分子相比较含有任何碱基失配以及/或者额外的或缺失的核苷酸的情况。在其他实施例中,所述两种分子包括一个或多个碱基失配或者存在核苷酸总数的差异(由于添加或删除)。在其他实施例中,“互补”mirna抑制剂核酸分子含有至少十个连续的表现出与mirna分子中包含的序列的理想互补的核苷酸。
典型地,mirna抑制剂核酸分子是自然出现的dna分子或rna分子或者是在其序列中包含一个或多个受到修饰的核苷酸(同一类型或者一种或多种不同类型)的核酸分子。
例如,本发明设想这样的mirna抑制剂核酸分子包括至少一个核苷酸主链单元和至少一个脱氧核糖核苷酸主链单元。此外,mirna抑制剂核酸分子可以含有一种或多种使rna主链成为2'-o-甲基团或者2'-o-甲氧基团的修饰(又称为“2'-o-甲基化作用”),其避免了培养基中的核酸酶降解,而且重要的是还通过rna引发的沉默复合核酸酶避免了内源性核苷酸裂解,从而得到对mirna的不可逆性抑制。另一种可能的在功能上等价于2'-o-甲基化作用的修饰涉及表示含有一个或多个lna核苷酸单体的锁核酸(lna),如本文中以上所定义的。
在本发明的语境中使用的mirna表达的另一种沉默子包括被称为“antagomir”的经化学工程设计的寡核苷酸,其表示配合至胆固醇的单链rna分子。所述分子可以包括19到25个核苷酸。优选地,所述分子包括20、21、22、23或24个核苷酸。更优选地,所述分子包括23个核苷酸(进一步的细节可以从krutzfeldtetal.,2005,nature,438:685–689得知)。
在本发明的另一实施例中,可以按照将要引入到组织或细胞内的表达载体的形式提供如本文中以上所定义的mirna抑制剂。或者,这样的载体还可以被引入到如本文中以上所定义的活体治疗中。
通常可以由按照转染或者瞬时表达载体或携带体的形式提供的转基因生成rna。例如,可以将竞争性mirna抑制剂提供为由强启动子表达的转录本,其含有与感兴趣microrna的不止一个(优选多个)串联位点。ebertetal.,2007,nat.methods,4:721-726中描述的“micrornasponge”是这种技术的一种用于举例说明的非限制性实例。
如本文中以上所定义的刺激药物成分中包含的“脱甲基试剂”是指能够对染色质结构,优选对启动子区域,更优选对pde4d或pde4d变体启动子进行脱甲基的试剂。在本发明的语境中使用的脱甲基试剂的例子为5-氮杂-2'-脱氧胞苷和5-氮胞苷,所述试剂使得因涉及dna甲基化作用的结构性染色质变化而不适当地沉默的基因重新活化,并且所述试剂能够逆转这些变化,并由此恢复主要的细胞途径。这通常在基因中引起变换状态的某些方面的重新表达和逆转。5-氮胞苷和5-氮杂-2'-脱氧胞苷通常对dna胞嘧啶c5-甲基转移酶灭活,其方式是在dna中的5-氮杂-2'-脱氧胞苷残余和所述酶之间形成稳定络合物,由此模拟结合至所述甲基转移酶时的稳定过渡状态中间体。
可以包含在根据本发明的刺激药物成分中的另一种试剂本身就是或者与5-氮杂-2'脱氧胞苷和/或5-氮胞苷相结合而成为曲古抑菌素a(tsa)。
包含在如本文中以上所定义的刺激药物成分中的“磷酸二酯酶置换因子”是指能够在相对于具体的pde4d变体具有或者没有选择性的情况下阻碍或者破坏磷酸二酯酶,尤其是pde4d与相互作用伙伴或者相互作用子的相互作用的化合物。这样的过程可以最终带来pde,尤其是pde4d(相对于具体pde4d变体有或没有选择性)与较以前不同的相互作用伙伴的联合,并因此引起pde的重新分布。这样的新相互作用伙伴可以在相对于具体pde4d变体有或没有选择性的情况下螯合pde,尤其是pde4d,并对应地修改细胞行为,例如,激发对受体结合活动或者其他下游活动的影响。这样的置换反应中可能涉及的和/或能够螯合pde,尤其是pde4d7的蛋白质伙伴的例子为如akap的锚定蛋白、如disc、beta抑制蛋白或rack1的支架蛋白、如xap2/aip/ara9的调节蛋白、如pka-r亚单元或epac的camp结合蛋白或者如beta1肾上腺受体的受体以及如erk的酶。
优选的磷酸二酯酶置换因子为肽、拟肽、小分子、抗体和核酸适体。
磷酸二酯酶置换因子的语境中的“肽”是指存在于磷酸二酯酶分子内或者表示所述磷酸二酯酶分子的氨基酸的伸展(strech),所述磷酸二酯酶分子要么是几种pde4d变体共有的,要么是某一种pde4d变体特有的,或者与如本文中以上定义蛋白质相互作用或螯合。所述肽中包含的氨基酸的伸展可以具有5到100个氨基酸的长度,优选具有10到50个氨基酸的长度,更优选具有20到30个氨基酸的长度。所述伸展完全等同于pde或相互作用子蛋白质或者是其部分,或者可以包括序列变化。例如,所述肽序列可以在所有位置中的最多25%的位置上包括受到修饰的氨基酸残基,优选包括不改变分子的结构特性或者结合特性的修饰。或者,存在于肽中的氨基酸顺序可以表示pde或相互作用子蛋白的空间域,并且对应地包括在分子的初级序列中不毗连的氨基酸伸展的并置。
磷酸二酯酶置换因子语境中的“拟肽”是指被设计为模拟肽的小蛋白质类的链。这样的拟肽可以是由对现有肽(例如,如本文中以上所定义的肽)的修饰产生的,以改变分子的属性。拟肽可以是由改变分子稳定性或者结合能力的修饰产生的。这些修饰通常涉及不会自然发生的针对肽的改变。例如,根据本发明的拟肽可以具有改变的肽主链,或者可以包括非自然的氨基酸。优选地,根据本发明的拟肽可以表示磷酸二酯酶分子,所述磷酸二酯酶分子要么是几种pde4d变体共有的,要么是某一种pde4d变体特有的,或者与如本文中以上定义蛋白质相互作用或螯合。
在本发明的一个实施例中,拟肽可以阻挡pde(要么是几种pde4d变体的,要么有选择地是特定的pde4d变体的)与其相互作用子之间的相互作用。在本发明的另一实施例中,拟肽可以增强pde(要么是几种pde4d变体的,要么有选择地是特定的pde4d变体的)与其相互作用子之间的相互作用。
用于制备拟肽的方法和技术以及用于测试拟肽的试验是本领域技术人员已知的。
磷酸二酯酶移位因子语境中的“小分子”是指优选有生物活性的(即,生物分子)但是优选不是聚合物的小有机化合物。这样的有机化合物可以具有任何适当的形式或化学性质。所述化合物可以是自然化合物,例如,次级代谢产物,或者可以是重新设计并生成的人工化合物。在本发明的一个实施例中,小分子能够阻挡pde(要么是几种pde4d变体的,要么有选择地是特定的pde4d变体的)与其相互作用子之间的相互作用。在本发明的另一实施例中,小分子可以增强pde(尤其是pde4d7)与其相互作用子之间的相互作用。用于识别和制备小分子的方法和技术以及用于测试小分子的试验是本领域技术人员已知的。
磷酸二酯酶置换因子的语境中的“抗体”或“核酸适体”是指几种pde4d变体特有的或者有选择地是特定pde4d变体所特有的pde4d特异性抗体,或者是指如本文中以上所定义的抗体变体或片段,或者是指几种pde4d变体特有的或者有选择地是特定pde4d变体所特有的pde4d7特异性核酸适体,其具有妨碍或者破坏pde(要么是几种pde4d变体的,要么有选择地是特定的pde4d变体的)与其相互作用子中的一者或多者之间的相互作用的能力。或者,该术语还可以指结合至如文中上文所述的pde4d/pde4d变体相互作用子中的一者或多者的抗体或核酸适体,其同样具有妨碍或者破坏pde(要么是几种pde4d变体的,要么有选择地是特定的pde4d变体的)与其相互作用子中的一者或多者之间的相互作用的能力。用于生成或者测试抗体或核酸适体的方法已经在上文中给出了描述和/或是本领域技术人员已知的。
本发明的另一方面涉及一种计算机程序产品,其包括存储在计算机可读介质上的或者可从通信网络下载的计算机可读代码,所述计算机可读代码在计算机上运行时实施文中所述方法中的任何方法的一个或多个步骤或所有步骤。
可以利用一种或多种计算机可读媒介的任何组合。所述计算机可读介质可以是计算机可读信号介质或者是计算机可读存储介质。计算机可读存储介质可以是(例如)但不限于电子、磁、光、电磁、红外或半导体系统、设备或装置或者前述选项的任何适当组合。计算机可读存储介质的更具体的例子(非穷举清单)包括下述选项:具有一条或多条导线的电连接、便携式计算机盘、硬盘、随机存取存储器(ram)、只读存储器(rom)、可擦可编程只读存储器(eprom或闪速存储器)、光纤、便携式光盘只读存储器(cd-rom)、光存储装置、磁存储装置或者前述选项的任何适当组合。在本文的语境中,计算机可读存储介质可以是任何有形介质,其可以含有或者存储供指令运行系统、设备或装置使用的或者与之结合使用的程序。
计算机可读信号介质可以包括在基带中或者作为载波的一部分传播的数据信号,其具有包含于其内的计算机可读程序代码。这样的传播信号可以采取各种形式中的任何形式,其包括但不限于电磁信号、光信号或其任何适当组合。计算机可读信号媒介可以是非计算机可读存储介质的任何计算机可读介质,其可以传达、传播或者传送供指令执行系统、设备或装置使用的或者与之结合使用的程序。
包含在计算机可读介质上的程序代码可以采用任何适当的介质传输,其包括但不限于无线、有线、光缆、rf等或者上述选项的任何适当组合。
可以通过一种或多种程序设计语言的组合编写用于执行本发明的各个方面的操作的计算机程序代码,所述程序设计语言包括诸如java、smalltalk、c++等的面向对象程序设计语言以及诸如“c”程序设计语言或类似程序设计语言的常规过程程序设计语言。程序代码可以完全在用户计算机上运行,部分在用户计算机上运行,作为独立软件包运行,部分在用户计算机上部分在远程计算机上运行,或者完全在远程计算机或服务器上运行。在后面的情形中,远程计算机可以通过包括局域网(lan)或广域网(wan)在内的任何类型的网络连接至用户计算机,或者可以实施与外部计算机的连接(例如,利用internet服务提供商通过internet实施连接)。
也可以将这些计算机程序指令存储到计算机可读介质内,所述指令可以指引计算机、其他可编程数据处理装置或其他装置按照特定的方式工作,从而使存储在计算机可读介质内的指令生成一种包含实现文中指定的功能/操作的指令的制品。
还可以将所述计算机程序指令加载到计算机、其他可编程数据处理装置或者其他装置上,从而使一系列操作步骤得以在所述计算机、其他可编程设备或者其他装置上受到执行,以实施计算机实现过程,从而使在所述计算机或其他可编程设备上运行的指令提供用于实现文中指定的功能/操作的过程。
范例
用于建立前列腺癌pde指标(pde指标)的基因选择:
为了选择基因候选以建立所述pde指标,我们针对如wo2010131194和wo2010131195中所述的推断性预后基因标记pde4d7的相关性对各种pde4d转录本(出自当前的九种注解的pde同工型pde4d1至pde4d9)进行了研究。
为了建立前列腺癌pde指标,使用了以下数据集:
1)taylorbs等人的integrativegenomicprofilingofhumanprostatecancer.cancercell18,11–22,2010(geodatasetid:gse21032)
2)boormansjl等人的identificationoftdrd1asadirecttargetgeneoferginprimaryprostatecancer.intjcancer2013jul15;133(2):335-45(geodatasetid:gse41408)
3)brasejc等人的tmprss2-erg-specifictranscriptionalmodulationisassociatedwithprostatecancerbiomarkersandtgf-bsignaling.bmccancer2011,11,507-515(geodatasetid:gse29079)
为了进一步测试并验证所建立的前列腺癌pde指标,使用了下述数据集:1)erhon等人的discoveryandvalidationofaprostatecancergenomicclassifierthatpredictsearlymetastasisfollowingradicalprostatectomy.plosone8(6),e66855(2013)(geodatasetid:gse46691)
gse基因表达数据的处理
各cel文件是从geo(基因表达文集):http://www.ncbi.nlm.nih.gov/geo/下载的。所述cel文件数据被加载到expressionconsole(affymetrix公司,build1.3.1.187)中,并在适当的情况下采用affymetrix公司提供的适当的探针集注释文件进行了预处理,即,数据集在affymetrix公司平台:gse21032、gse41408、gse25136上运行。
各个pde4d同工型pde4d1-pde4d9的表达值是使用affymetrixhumanexon1.0starray的探针集的外显子阵列信号值估算的,图1中对此给出了概述。注意:对于非常密切相关的同工型pde4d1和pde4d2的表达的询问,仅使用了单个探针集,并且这两种同工型(pde4d1&2)的对应活性是一起报告的。对于所有的其他pde4d转录而言,使用了几个探针集计算相应的同工型表达,并且所述表达是作为针对单个pde4d变体测量的不同探针集的平均值报告的。
qrt-pcr(定量实时pcr)数据标准化流程
参考基因应当具有独立于接受处理的样本的稳定表达,因此能够被用作内部标准使pcr分析的输出cq值标准化,从而使结果可独立于所使用的输入样本的量进行比较。尽管这样的基因应当是稳定的,但是其表达总是存在一定的变化性,因而这种稳定性还可能取决于被分析的组织。出于这样的原因,建议在pcrcq值的标准化中使用不止一种参考基因并且使用一组在接受分析的具体类型的组织/样本中表现出低变化性的基因c.l.andersen,j.l.jensen,andt.f.
执行对要在这一研究中使用的9种参考基因的初始选择。对用于标准化的参考基因的最终选择是通过对所有的接受分析的临床样本运行biogazellesoftware工具(qbase+withgenormanalysisj.hellemans,g.mortier,a.d.paepe,f.speleman,andj.vandesompele,“qbaserelativequantificationframeworkandsoftwareformanagementandautomatedanalysisofreal-timequantitativepcrdata,”genomebiol.,第8卷,第2号,p.r19,2007年2月)而完成的。
pcr试验的输出cq值是具有固有的对数性(基数2),并且与存在于样本中的mrna成反比。我们使用下述公式来将原始cq值标准化:
n(cq感兴趣基因)=mean(cq参考基因)-(cq感兴趣基因)
其中,n(cq感兴趣基因)是感兴趣基因的标准化基因,mean(cq参考基因)是所选择的参考基因的组合的pcrcq值的算数平均,(cq感兴趣基因)是感兴趣基因的pcrcq值。
假设采用qrt-pcr以外的其他技术测量参考基因或感兴趣基因的表达,那么将采用相应的技术的标准化测量结果代替所述pcrcq值(例如,dna微阵列的rma(鲁棒多阵列均值)标准化基因表达值或者rna测序的fpkm(每百万测序碱基中每千个转录子测序碱基中所包含的测序片断数)标准化基因表达值)。
在图10到图13中示出了两个数据集taylor等人的integrativegenomeprofilingofhumanprostatecancer,cancercell18,11-22,2010(gse21034(ncbigeo))和boormansetal.,identificationoftdrd1asadirecttargetgeneoferginprimaryprostatecancer,intjcancer2013年7月15日;133(2):335-45(gse41410(ncbigeo))的跨越不同前列腺癌组织的pde4d转录的标准化表达水平。所述转录的表达已经相对于下述参考基因:hprt1、pum1、tbp和tuba1b被标准化。所使用的数据是以可通过公共途径获得的外显子阵列表达数据为基础的,即,对于每种基因而言,针对相应基因的各种外显子的一定范围的外显子探针集测量不同外显子的表达,如上文所概述的。在第一步骤中,采用针对参考基因的所有探针集的log2表达计算平均化的参考基因表达。对以各个4d转录本为目标的不同探针集执行同样的操作。之后,从参考基因的均值中减去平均化的4d转录表达。所述结果是标准化的pde4d转录表达。可以看出,跨越不同的组织(变动范围从正常前列腺、在初级治疗之后具有不同的进展可能性的原发性前列腺癌(bcr=生物化学复发;cr=临床复发到转移)一直到新陈代谢组织(既往未经激素治疗的,即,在任何抗雄激素治疗之前;以及激素抵抗型,即,在抗雄激素治疗之后))按照同工型特有的方式对不同的4d转录进行了调节。例如,pde4d3和pde4d6与其他4d转录相比未被高度表达;pde4d4实际上并未跨越各种组织发生变化;pde4d5和pde4d9从正常组织到激素抵抗型组织受到了下调,而pde4d7在原发性前列腺癌中则被过度表达,因而跨越其他组织则变得再次受到更多的下调。
pde指标计算(基于定量实时pcr数据)
i)pde-指标_1:pde4d7_exp–pde4d5_exp,
其中,
pde4d7_exp为(n(cqpde4d7)),并且pde4d5_exp为(n(cqpde4d5))
ii)pde-指标_2:mean(pde4d7_exp&pde4d5_exp),
其中,
pde4d7_exp为(n(cqpde4d7))并且pde4d5_exp为(n(cqpde4d5))
iii)pde-指标_3:(mean(pde4d5_exp&pde4d7_exp&pde4d9_exp))/(pde4d4_exp)
其中,
pde4d5_exp为(n(cqpde4d5)),pde4d7_exp为(n(cqpde4d7)),pde4d9_exp为(n(cqpde4d9)),并且pde4d4_exp为(n(cqpde4d4))
并且其中,
(mean(pde4d5_exp&pde4d7_exp&pde4d9_exp))是pde4d5_exp、pde4d7_exp和pde4d9_exp的算数平均
iv)pde-指标_4:(mean(pde4d5_exp&pde4d7_exp&pde4d9_exp))/(pde4d1&pde4d2_exp)
其中,
pde4d5_exp是(n(cqpde4d5)),pde4d7_exp为(n(cqpde4d7)),pde4d9_exp为(n(cqpde4d9)),并且pde4d1&pde4d2_exp为(n(cqpde4d1_2))
并且其中,
(mean(pde4d5_exp&pde4d7_exp&pde4d9_exp))是pde4d5_exp、pde4d7_exp和pde4d9_exp的算数平均
v)pde-指标_5:(mean(pde5_exp&pde7_exp&pde4d9_exp))
其中,
pde4d5_exp为(n(cqpde4d5)),pde4d7_exp为(n(cqpde4d7)),并且pde4d9_exp为(n(cqpde4d9))
并且中,
(mean(pde4d5_exp&pde4d7_exp&pde4d9_exp))是pde4d5_exp、pde4d7_exp和pde4d9_exp的算数平均
计算出的pde指标被用于进一步的统计学数据分析。
对照临床参数的pde指标与患者结果的相关性分析
对pde指标及其在对比临床参数的情况下与患者结果的相关性所做的所有统计分析(例如,逻辑回归分析、roc分析、cox回归分析等等)都是采用xlstatversion2014.1.03执行的。
结果
图3示出了对跨越两个基因表达数据集的用于实现不同患者群体比较的各pde4d同工型以及pde指标的四种变式的差异化标准化表达的概述。所分析的成对的患者比较如下:
i)nat对原发性pca,np
ii)原发性pca,np对原发性pca,bcr&cr
iii)原发性pca,np&bcr对原发性pca,cr
iv)原发性pca(所有)对转移
v)原发性pca(所有)对crpc
其中,
-nat是正常相邻组织,即,来自于患者材料的紧挨着肿瘤病变收集但是在组织结构上没有癌的组织
-原发性pca,np是从没有在临床跟踪调查中表现出肿瘤进展性的患者收集的原发肿瘤组织
-原发性pca,bcr&cr是从在临床跟踪调查中表现出直至首次生化复发和接下来的临床复发的肿瘤进展性的患者收集的原发性肿瘤组织
-原发性pca,np&bcr是从在临床跟踪调查中未表现出肿瘤进展或者表现出了首次生化复发的患者收集的原发性肿瘤组织
-原发性pca,cr是从在临床跟踪调查中表现出直至临床复发的肿瘤进展性的患者收集的原发性肿瘤组织
-转移是从既往未接受过激素治疗的患者收集的转移性肿瘤组织
-crpc是从患有去势抵抗性疾病的患者收集的组织
从所述数据可以看出,可以将各种pde指标用于前列腺癌诊断和/或前列腺癌进展性的预后中的不同应用。变体:
pde-指标变体_1:pde4d7_表达–pde4d5_表达
最常用于以非常高的鉴别能力对正常相邻组织(nat)和前列腺的原发癌组织进行区分(参考图3)。与其他pde指标变体相比(参考图4)这一指标在各种其他的用于区分nat和原发性前列腺癌的数据集中的计算结果证实了pde-指标变体_1将提供强区分能力。缩写“bl”是指良性病变,“h”是指前列腺的良性增生。
图5提供了针对总共八个前列腺癌数据集的概述,所述数据集包括来自各个类别的总共超过900份患者样本,所述类别为正常相邻组织、良性病变、良性增生以及肿瘤组织。不同组织类别之间的所有成对比较表明通过使用pde-指标变体_1获得了非常高的对组织群组进行区分的能力。
从图3还可以看出,pde-指标变体pde-指标_2、pde-指标_3和pde-指标_4与更具侵犯性的疾病有关。
pde-指标_2(pde-指标变体_2):
mean(pde4d7_exp&pde4d5_exp)
pde-指标_3(pde-指标变体_3):
(mean(pde4d5_exp&pde4d7_exp&pde4d9_exp))/(pde4d4_exp)
pde-指标_4(pde-指标变体_4):
(mean(pde4d5_exp&pde4d7_exp&pde4d9_exp))/(pde4d1&pde4d2_exp)
pde-指标_5(pde-指标变体_5):
(mean(pde4d5_exp&pde4d7_exp&pde4d9_exp))
其中,术语“pde4d_exp”表示pde4d4的表达水平,术语“pde4d5_exp”表示pde4d5的表达水平,术语“pde4d7_exp”表示pde4d7的表达水平,术语“pde4d9_exp”表示pde4d9的表达水平。术语“pde4d1&pde4d2_exp”表示由单个探针一起检测到的pde4d1和pde4d2的表达水平。
对下述患者群体的成对比较大体上提供了显著的表达差异(参考图3)。
i)原发性pca,np对原发性pca,bcr&cr
ii)原发性pca,np&bcr对原发性pca,cr
iii)原发性pca(所有)对转移
iv)原发性pca(所有)对crpc
针对图6中的pde指标2-4所概述的roc分析对此提供了进一步的支持。针对上述成对比较的roc分析的auc(曲线下面积)表示正鉴别能力。这一数据强调了各种pde4d转录的组合对进展性前列腺癌进行预测的预后能力。
我们还针对tmprss2-erg阴性肿瘤和tmrss2-erg阳性肿瘤与正常相邻组织(nat,tmrpss2-erg阴性)相比较的之间的差异化表达而对各种pde指标进行了测试。在图7中对结果进行了总结。有兴趣指出的是,我们观察到了阳性tmprss2-erg基因融合的存在与pde4d7同工型的表达之间的强相关,而其他pde4d转录本(尤其是pde4d1&2、pde4d5和pde4d9)表达则更加与tmprss2-erg基因融合的不存在相关。对于pde4d5而言,这种效应是非常强的。这一观察结果(即,pde4d7与tmprss2-erg基因融合的存在的正表达相关性以及pde4d5表达与tmprss2-erg基因融合不存在的正相关性)在四个独立的前列腺癌数据集(图7)中得到了证实,其为将pde4d5和pde4d7结合到pde-指标变体_1中以表示癌症前列腺组织和非癌前列腺组织之间的强区分指标提供了很强的合理性(还参见图5)。
此外,我们还分析了pde指标变体与前列腺癌数据集中的病理学gleason评分的相关性。所述分析是依据具有前列腺癌特异性的基因融合tmprss2-erg的状态执行的(tomlinss.等人,nature,2005)。其为雄激素调节丝氨酸蛋白酶tmprss2与作为ets转录因子家族的成员的转录因子erg2之间的基因组重排。如图8中所概述的,在pde指标2-4与tmprss2-erg融合之间存在显著的正关联。
图9表示对pde指标的增加值连同有关取决于肿瘤的tmprss2-erg融合状态的无进展存活(生化和临床)的临床数据的概述。可以从与pde-指标&pgleason&pt阶段的组合模型对比的仅来自于临床模型(pgleasonpt阶段)的roc分析中的auc的提高看出所述增加值。应当指出,只有在对于两个测试端点,即无生化进展性的存活以及无临床进展性的存活均存在tmprss2-erg融合的情况下才能检测到所调查的pde指标变式的auc的显著提高。
- 还没有人留言评论。精彩留言会获得点赞!