新型四甲酸二酐及由该四甲酸二酐衍生的聚酰亚胺以及由该聚酰亚胺构成的成形体的制作方法
本发明涉及一种由新型四甲酸二酐衍生的聚酰亚胺以及由该聚酰亚胺构成的成形体,该聚酰亚胺的加工性优异且兼具低线热膨胀系数及高光透射性(透明性)。由于该聚酰亚胺除了优异的溶液加工性之外还显示出热塑性,所以不仅可通过溶液浇铸法进行制膜,也可进行熔融成型。与以往的溶剂可溶性聚酰亚胺或热塑性聚酰亚胺相比,进一步由该聚酰亚胺构成的成形体在显示出低线热膨胀系数的同时透明性也优异。从这样的特征来看,作为需要相对于热的尺寸稳定性与透明性的液晶显示器(LCD)、有机电致发光(EL)显示器、电子纸、发光二极管(LED)装置、太阳能电池等所使用的透明基板、透明保护膜材料、粘接材料有用。
背景技术:
作为可进行成形加工的以往的透明树脂,已知有聚对苯二甲酸乙二醇酯、聚碳酸酯、聚醚砜等,虽然这些树脂的溶液加工性或熔融成形性优异,但相对于热的尺寸变化(线热膨胀系数)大。作为成形体的线热膨胀系数大时,在与LCD、有机EL显示器、电子纸、LED等显示设备或照明装置所使用的低热膨胀性无机材料积层时可能会产生各种不良,故而不优选。例如,由于在形成上述透明树脂成形体与透明电极(ITO;Indium Tin Oxide)、铜、银、铝等的配线或是薄膜晶体管(TFT;Thin-Film Transistor)等元件时的热加工,在低热膨胀性无机材料与以往的高热膨胀性树脂之间产生线热膨胀系数的不匹配,并在其接口产生应变,从而有导致层间剥离、基板应变以及元件破坏的疑虑。
另一方面,作为具有优异的热尺寸稳定性的树脂,已知有芳香族聚酰亚胺。由化学结构刚直且直线性的芳香族聚酰亚胺构成的成形体,例如聚酰亚胺膜可广泛地使用在挠性印刷电路基板的基质膜或半导体的层间绝缘膜等需要高尺寸稳定性(低线热膨胀系数)的领域。然而,由于分子内共轭及分子内·分子间电荷转移相互作用而强烈地着色,所以具有低线热膨胀系数的芳香族聚酰亚胺难以应用在上述光学用途。进而,由于聚酰亚胺的分子间力非常强,所以时常未显现出相对于溶剂的溶解性以及热塑性,从而缺乏加工性。
另一方面,提出了克服了这些缺点的聚酰亚胺。例如提出了如下方法:将氟原子导入聚酰亚胺结构中(非专利文献1);或是通过在构成聚酰亚胺的二胺成分与四甲酸二酐成分的一者或两者中使用脂环式化合物,抑制分子内共轭及电荷转移相互作用从而提高透明性(非专利文献2、3)。通过这些现有技术,虽开发出透明性与溶液加工性并存的聚酰亚胺,但除了加工性之外还兼具低热膨胀性的聚酰亚胺的报告例仍然有限。
作为该少数的报告例,提出了具有酯基的特定的聚酰亚胺(专利文献1)。该聚酰亚胺除了透明性、耐热性之外,还具有与无机材料同等的低线热膨胀系数,但相对于各种有机溶剂的溶解性不充分,在该方面仍有改善的空间。
进而,兼具热塑性的具有优异的加工性的聚酰亚胺仍未被发现。
现有技术文献
非专利文献
非专利文献1:Macromolecules,24,5001(1991)
非专利文献2:J.Polym.Sci.,PartA,Polym.Chem.,51,575(2013)
非专利文献3:Polymer,55,4693(2014)
专利文献
专利文献1:日本特开2013-082876号公报
技术实现要素:
本发明所要解决的技术课题在于提供一种由新型四甲酸二酐衍生的聚酰亚胺以及由该聚酰亚胺构成的成形体,由于该聚酰亚胺相对于各种有机溶剂的溶解性优异且兼具热塑性,因此加工性优异且兼具低线热膨胀系数及高光透射性(透明性)。
鉴于前述技术背景,本发明者反复进行了精心研究,结果发现可由下述式(1)所示的四甲酸二酐得到加工性优异的聚酰亚胺,成为在该领域中极有用的材料,因而完成了本发明。
本发明如下所述。
1.一种四甲酸二酐,其特征在于,由下述式(1)所示,
2.一种聚酰亚胺,其特征在于,具有下述式(2)所示的重复单元,
3.根据2所述的聚酰亚胺,其特征在于,相对于聚酰亚胺中的全部重复单元,式(2)所示的重复单元的含有率为55mol%以上。
4.一种聚酰亚胺溶液,含有2或3所述的聚酰亚胺与有机溶剂,其特征在于,固体成分浓度为5重量%以上。
5.一种聚酰亚胺成形体,其特征在于,为2或3所述的聚酰亚胺的成形体。
根据本发明,可通过使用以在中央亚苯基上取代有体积大的环己基为特征的四甲酸二酐来得到如下聚酰亚胺以及由该聚酰亚胺构成的成形体:具有现有技术所无法得到的特性,即由于相对于各种有机溶剂的溶解性优异且兼具热塑性,因此加工性优异并且低线热膨胀系数及高光透射性(透明性)全部兼具。
附图说明
图1为实施例2的聚酰亚胺膜的红外吸收光谱。
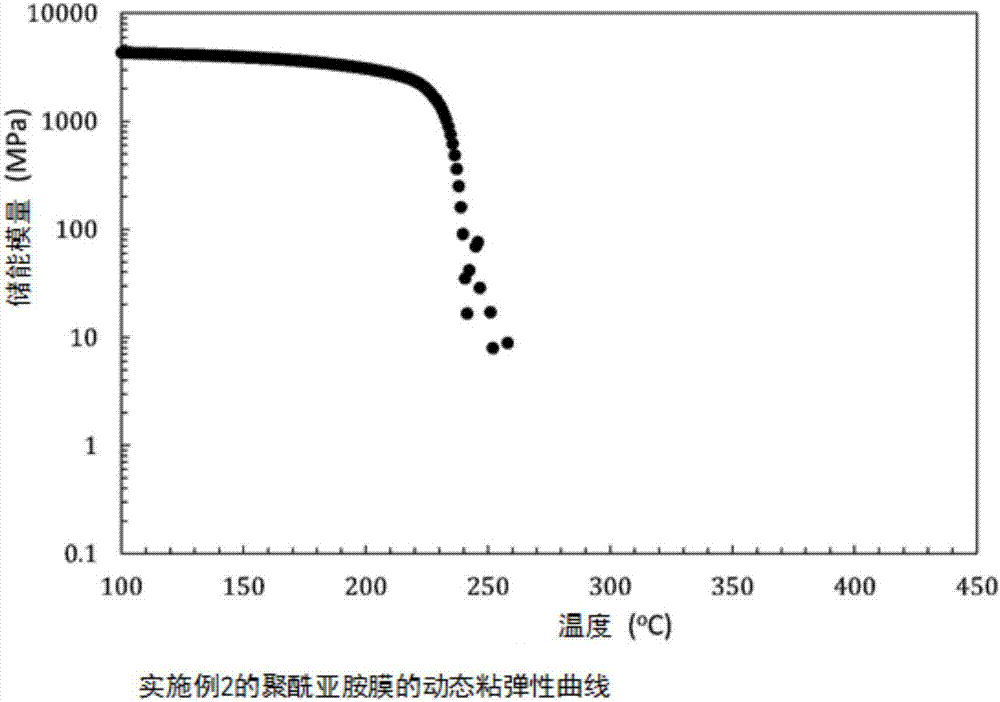
图2为实施例2的聚酰亚胺膜的动态粘弹性曲线。
图3为实施例3的聚酰亚胺膜的红外吸收光谱。
图4为实施例3的聚酰亚胺膜的动态粘弹性曲线。
图5为实施例4的聚酰亚胺膜的红外吸收光谱。
图6为实施例4的聚酰亚胺膜的动态粘弹性曲线。
图7为对比例2的聚酰亚胺膜的动态粘弹性曲线。
具体实施方式
本发明的四甲酸二酐具有下述式(1)所示的结构。
本发明所涉及的式(1)所示的四甲酸二酐(以下有时简称为TACHQ)的化学结构性特征为2个邻苯二甲酸酐结构介由酯键而键合于中央亚苯基的对位,进而在中央亚苯基取代有体积大的环己基。
本发明的式(1)所示的TACHQ的合成方法并无特别限定,例如可由下述式(3)所示的二醇即环己基对苯二酚或其二乙酸酯物与下述式(4)所示的偏苯三甲酸或其衍生物通过公知的酯化反应来合成。
作为偏苯三甲酸衍生物,可列举偏苯三甲酸酐、偏苯三甲酸酐卤化物等。
本发明的聚酰亚胺具有下述式(2)所示的重复单元。
本发明所涉及的具有式(2)所示的重复单元的聚酰亚胺的第一特征为在四甲酸二酐部位的中央亚苯基的对位存在有2个酯键,且在二胺部位具有对位键合的联亚苯结构,所以聚酰亚胺主链结构形成为直线性且刚直的结构。认为由于该特征,聚酰亚胺链高度地沿着膜平面方向取向(面内取向)并显示优异的热尺寸稳定性(低线热膨胀系数)。然而,由于聚酰亚胺链间的凝聚力强,故而具有这样的直线性且刚直结构的低热膨胀性聚酰亚胺,通常不溶于有机溶剂且也不熔融,从而缺乏加工性。因此一般采用如下方法:将硅氧烷键、醚键、间位键导入聚酰亚胺主链中从而使聚酰亚胺主链结构弯曲;或是降低聚酰亚胺重复单元中的酰亚胺基浓度;以及将体积大的取代基导入聚酰亚胺侧链来弱化聚酰亚胺链间的凝聚力从而提高加工性。然而,这些方法会阻碍聚酰亚胺成形体尤其是膜的面内取向,结果使线热膨胀系数增大。换言之,使加工性与低热膨胀性并存非常困难。
因此,通过本发明所涉及的具有式(2)所示的重复单元的聚酰亚胺的以下所记载的第二特征可解决该问题。即,通过在四甲酸二酐部位的中央亚苯基上取代体积大的环己基,且在二胺部位的侧链上取代吸电子性且体积大的三氟甲基,能够不阻碍聚酰亚胺链间的面内取向而仅弱化凝聚力。由于实现该绝妙的平衡的具有式(2)所示的重复单元的聚酰亚胺相对于各种有机溶剂的溶解性优异且兼具热塑性,因此加工性优异并且显示出原本难以并存的低线热膨胀系数,甚至还能够抑制聚酰亚胺的电荷转移相互作用从而可实现高透明性。
本发明所涉及的具有式(2)所示的重复单元的聚酰亚胺可通过将式(1)所示的TACHQ作为原料来合成具有上述优异特性的聚酰亚胺。该聚酰亚胺的制造方法并无特别限定,例如可经由如下工序来制造:使式(1)所示的TACHQ与作为二胺的下述式(5)所示的2,2’-双(三氟甲基)联苯胺(以下有时简称为TFMB)反应从而得到具有式(2)所示的重复单元的聚酰亚胺的前体(聚酰胺酸);以及使聚酰胺酸进行酰亚胺化。
使聚酰胺酸聚合时,在不显著损害聚合反应性及聚酰亚胺的所需特性的范围内,可并用式(1)所示的TACHQ以外的芳香族或脂肪族四甲酸二酐作为共聚成分。
作为此时能够使用的芳香族四甲酸二酐并无特别限定,例如可列举均苯四甲酸二酐、3,3’,4,4’-联苯四甲酸二酐、对苯二酚-双(偏苯三甲酸酐)、甲基对苯二酚-双(偏苯三甲酸酐)、1,4,5,8-萘四甲酸二酐、2,3,6,7-萘四甲酸二酐、3,3’,4,4’-二苯甲酮四甲酸二酐、3,3’,4,4’-联苯醚四甲酸二酐、3,3’,4,4’-联苯砜四甲酸二酐、4,4’-(六氟异亚丙基)二邻苯二甲酸酐、2,2’-双(3,4-二羧基苯基)丙酸二酐等。
作为脂肪族四甲酸二酐并无特别限定,例如,就脂环式而言可列举双环[2.2.2]辛-7-烯-2,3,5,6-四甲酸二酐、5-(二氧代四氢呋喃基-3-甲基-3-环己烯-1,2-二甲酸酐、4-(2,5-二氧代四氢呋喃-3-基)四氢萘-1,2-二甲酸酐、四氢呋喃-2,3,4,5-四甲酸二酐、双环-3,3’,4,4’-四甲酸二酐、1,2,3,4-环丁烷四甲酸二酐、1,2,3,4-环戊烷四甲酸二酐等。此外,还可并用2种以上这些物质。
从进一步提高聚酰亚胺的溶解性、耐热性、透明性的观点来看,4,4’-(六氟异亚丙基)二邻苯二甲酸酐(以下有时简称为6FDA)适合作为共聚成分,从进一步表现聚酰亚胺成形体的低热膨胀性的观点来看,具有刚直且直线性的结构的四甲酸二酐即均苯四甲酸二酐、3,3’,4,4’-联苯四甲酸二酐适合作为共聚成分。
当并用式(1)所示的TACHQ以外的芳香族或脂肪族四甲酸二酐作为共聚成分时,TACHQ相对于全部四甲酸二酐的比率优选为55mol%以上,更优选70mol%以上,进一步优选80mol%以上,特别优选90mol%以上为佳。
使本发明所涉及的聚酰胺酸聚合时,在不显著损害聚合反应性及聚酰亚胺的所需特性的范围内,可并用式(5)所示的TFMB以外的芳香族或脂肪族二胺作为共聚成分。
作为此时能够使用的芳香族二胺并无特别限定,例如可列举对苯二胺、间苯二胺、2,4-二氨基甲苯、2,5-二氨基甲苯、2,4-二氨基二甲苯、2,4-二氨基四甲苯、4,4’-二氨基二苯基甲烷、4,4’-亚甲基双(2-甲基苯胺)、4,4’-亚甲基双(2-乙基苯胺)、4,4’-亚甲基双(2,6-二甲基苯胺)、4,4’-亚甲基双(2,6-二乙基苯胺)、4,4’-二氨基二苯基醚、3,4’-二氨基二苯基醚、3,3’-二氨基二苯基醚、2,4’-二氨基二苯基醚、4,4’-二氨基二苯基砜、3,3’-二氨基二苯基砜、4,4’-二氨基二苯甲酮、3,3’-二氨基二苯甲酮、4,4’-二氨基苯甲酰苯胺、4-氨基苯基-4’-氨基苯甲酸酯、联苯胺、3,3’-二羟基联苯胺、3,3’-二甲氧基联苯胺、邻联甲苯胺(o-tolidine)、间联甲苯胺、1,4-双(4-氨基苯氧基)苯、1,3-双(4-氨基苯氧基)苯、1,3-双(3-氨基苯氧基)苯、4,4’-双(4-氨基苯氧基)联苯、双(4-(3-氨基苯氧基)苯基)砜、双(4-(4-氨基苯氧基)苯基)砜、2,2-双(4-(4-氨基苯氧基)苯基)丙烷、2,2-双(4-(4-氨基苯氧基)苯基)六氟丙烷、2,2-双(4-氨基苯基)六氟丙烷、对三联苯二胺(p-terphenylene diamine)等。
此外,作为脂肪族二胺为链状脂肪族或脂环式二胺,作为脂环式二胺并无特别限定,例如可列举4,4’-亚甲基双(环己基胺)、异佛尔酮二胺、反式-1,4-二氨基环己烷、顺式-1,4-二氨基环己烷、1,4-环己烷双(甲基胺)、2,5-双(氨基甲基)双环[2.2.1]庚烷、2,6-双(氨基甲基)双环[2.2.1]庚烷、3,8-双(氨基甲基)三环[5.2.1.0]癸烷、1,3-二氨基金刚烷、2,2-双(4-氨基环己基)丙烷、2,2-双(4-氨基环己基)六氟丙烷;作为链状脂肪族二胺并无特别限定,例如可列举1,3-丙烷二胺、1,4-丁二胺、1,5-戊二胺、1,6-己二胺、1,7-庚二胺、1,8-辛二胺、1,9-壬二胺、二氨基硅氧烷等。此外,还可并用2种以上这些物质。
作为聚合反应时所使用的溶剂,优选N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、N-甲基-2-吡咯烷酮、二甲基亚砜等非质子性溶剂,但只要溶解原料单体与所生成的聚酰胺酸以及经酰亚胺化的聚酰亚胺,则任意溶剂均可无问题地使用,该溶剂的结构并无特别限定。具体而言,例如可使用N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、N-甲基-2-吡咯烷酮等酰胺溶剂;γ-丁内酯、γ-戊内酯、δ-戊内酯、γ-己内酯、ε-己内酯、α-甲基-γ-丁内酯、乙酸丁酯、乙酸乙酯、乙酸异丁酯等酯溶剂;碳酸亚乙酯、碳酸亚丙酯等碳酸酯溶剂;二乙二醇二甲醚、三乙二醇、三乙二醇二甲醚等二元醇类溶剂;酚、间甲酚、对甲酚、邻甲酚、3-氯酚、4-氯酚等酚类溶剂;环戊酮、环己酮、丙酮、甲基乙基酮、二异丁基酮、甲基异丁基酮等酮类溶剂;四氢呋喃、1,4-二恶烷、二甲氧基乙烷、二乙氧基乙烷、二丁基醚等醚类溶剂;其他常用溶剂,例如可使用苯乙酮、1,3-二甲基-2-咪唑啶酮、环丁砜、二甲基亚砜、丙二醇甲基乙酸酯、乙基溶纤剂(ethylcellosolve)、丁基溶纤剂、2-甲基溶纤剂乙酸酯、乙基溶纤剂乙酸酯、丁基溶纤剂乙酸酯、丁醇、乙醇、二甲苯、甲苯、氯苯、松节油、矿油精、石脑油类溶剂等,可混合2种以上这些物质来使用。
通过使式(1)所示的TACHQ与式(5)所示的TFMB进行加聚反应而得到聚酰胺酸后,接着将其酰亚胺化,可得到在该产业上极为有用的本发明的聚酰亚胺。
从高分子主链的直线性、刚直性、在侧链上存在体积大的取代基的化学结构上的特征来看,由于本发明的聚酰亚胺在形成聚酰亚胺树脂时,相对于各种有机溶剂的溶解性优异且兼具热塑性,因此加工性优异,进而该聚酰亚胺的成形体尤其是膜可成为兼具低线热膨胀系数及高透明性的材料。
通常,四甲酸二酐与二胺的聚合反应性会对最终所得到的聚酰亚胺成形体的韧性造成较大影响。聚合反应性不足够高时无法得到高聚合物,结果聚合物链彼此的缠绕降低,从而有聚酰亚胺成形体变得脆弱的疑虑。由于本发明所使用的式(1)的TACHQ与式(5)的TFMB显示出足够高的聚合反应性,所以无此疑虑。
制造本发明的聚酰亚胺的方法并无特别限定,可适当地应用公知的方法。具体而言,例如可通过以下方法来合成。首先将式(5)的TFMB溶解于聚合溶剂,并将与式(5)的TFMB实质上等摩尔的式(1)的TACHQ粉末缓慢添加到该溶液中,使用机械搅拌器等在0~100℃的范围、优选为20~60℃的范围搅拌0.5~150小时、优选1~48小时。此时,单体浓度通常为5~50重量%的范围,优选为10~40重量%的范围。通过在这样的单体浓度范围进行聚合,可得到均匀且高聚合度的聚酰胺酸。当聚酰胺酸的聚合度过度增加而难以搅拌聚合溶液时,也可适当地用相同溶剂来稀释。从聚酰亚胺成形体的韧性的观点来看,优选聚酰胺酸的聚合度尽可能地高。通过在上述单体浓度范围进行聚合,聚合物的聚合度足够高,还可充分确保单体及聚合物的溶解性。以低于上述范围的浓度进行聚合时,聚酰胺酸的聚合度有时不够高,此外以高于上述单体浓度范围的浓度进行聚合时,单体或所生成的聚合物的溶解有时会不充分。此外,使用脂肪族二胺时,在聚合初期经常会引起盐形成而妨碍聚合,为了抑制盐形成并尽可能提高聚合度,优选将聚合时的单体浓度管理为上述适合的浓度范围。
接着说明使聚酰胺酸进行酰亚胺化的方法。本发明的聚酰亚胺可通过公知的方法进行酰亚胺化。例如可列举:通过脱水环化试剂使聚酰胺酸进行酰亚胺化的化学酰亚胺化法;使聚酰胺酸在高沸点溶剂中聚合后,接着在二甲苯等共沸剂的存在下加热至150℃以上并从系统内去除副生的水,从而以溶液状态得到高聚合度的聚酰亚胺的溶液热酰亚胺化法;或者是将聚酰胺酸溶液浇铸在玻璃基板等支撑体上进行干燥,并将所得到的聚酰胺酸的膜状成形体用加热炉等于250℃以上、优选300℃以上加热来进行酰亚胺化的热酰亚胺化法。为了得到透明性高的聚酰亚胺成形体,这些酰亚胺化方法中,优选可在稳定温和的条件下进行酰亚胺化的化学酰亚胺化法。
详细说明化学酰亚胺化方法。用与聚合时使用的溶剂为相同的溶剂来稀释通过之前记载的方法所得到的聚酰胺酸溶液。一边将已稀释为容易搅拌的适度的溶液粘度的聚酰胺酸溶液用机械搅拌器等搅拌,一边在其中滴加由有机酸的酐与作为碱性催化剂的叔胺构成的脱水闭环剂(化学酰亚胺化剂),并于0~100℃、优选10~50℃搅拌1~72小时来完成化学酰亚胺化。此时能够使用的有机酸酐并无特别限定,可列举乙酸酐、丙酸酐等。从试剂的处理或纯化容易度来看,适合使用乙酸酐。此外,碱性催化剂可使用吡啶、三乙基胺、喹啉(Quinoline)等,从试剂的处理或分离容易度来看,适合使用吡啶,但并不限定于此。化学酰亚胺化剂中的有机酸酐量为聚酰胺酸的理论脱水量的1~10倍摩尔的范围,更优选1~5倍摩尔。此外,相对于有机酸酐量,碱性催化剂的量为0.1~2倍摩尔的范围,更优选0.1~1倍摩尔的范围。
如上所述由于在化学酰亚胺化后的反应溶液中混入有化学酰亚胺化剂或羧酸等副产物(以下称为杂质),故需将这些去除并纯化聚酰亚胺。纯化可利用公知的方法。例如作为最简便的方法可应用如下方法:一边搅拌酰亚胺化的反应溶液一边滴加在大量的贫溶剂中并析出聚酰亚胺后,回收聚酰亚胺粉末并重复清洗至去除杂质为止,进行减压干燥从而得到聚酰亚胺粉末。作为此时能够使用的贫溶剂,只要是可析出聚酰亚胺并高效地去除杂质且容易干燥的溶剂,则并无特别限定,例如优选水、甲醇、乙醇、异丙醇等醇类,可混合这些物质来使用。滴加在贫溶剂中而析出时的聚酰亚胺溶液的浓度过高时析出的聚酰亚胺成为粒块,从而有在该粗大的粒子中残留杂质的可能性,或是存在使所得到的聚酰亚胺粉末溶解在溶剂中所需时间较长的疑虑。另一方面,聚酰亚胺溶液的浓度过低时需要大量的贫溶剂,废溶剂处理所造成的环境负荷增大、制造成本提高,故而不优选。因此,滴加在贫溶剂中的聚酰亚胺溶液的浓度为20重量%以下,更优选10重量%以下。此时所使用的贫溶剂的量优选为聚酰亚胺溶液的同等量以上,5~100倍的量适合。回收所得到的聚酰亚胺粉末并通过真空干燥或热风干燥等来去除残留溶剂。干燥温度与时间只要为不使聚酰亚胺变质且使残留溶剂蒸发的温度,则并没有限制,优选在30~200℃的温度范围中干燥48小时以下。
就本发明的聚酰亚胺而言,从聚酰亚胺成形体的韧性及溶液的处理性的观点来看,聚酰亚胺的固有粘度优选为0.1~10.0dL/g的范围,进一步优选0.3~5.0dL/g的范围。
由于本发明的聚酰亚胺可溶于各种有机溶剂,所以可根据使用用途或加工条件来选择溶剂。例如长时间连续涂布时,聚酰亚胺溶液中的溶剂会吸收大气中的水分从而有析出聚酰亚胺的疑虑,故而优选使用三乙二醇二甲醚、γ-丁内酯或环戊酮等低吸湿性溶剂。因此,本发明的聚酰亚胺可选择显示低吸湿性的各种溶剂或混合溶剂。所使用的低吸湿性溶剂并无特别限定,例如可使用γ-丁内酯、γ-戊内酯、δ-戊内酯、γ-己内酯、ε-己内酯、α-甲基-γ-丁内酯、乙酸丁酯、乙酸乙酯、乙酸异丁酯等酯溶剂;碳酸亚乙酯、碳酸亚丙酯等碳酸酯溶剂;二乙二醇二甲醚、三乙二醇、三乙二醇二甲醚等二元醇类溶剂;酚、间甲酚、对甲酚、邻甲酚、3-氯酚、4-氯酚等酚类溶剂;环戊酮、环己酮、丙酮、甲基乙基酮、二异丁基酮、甲基异丁基酮等酮类溶剂;四氢呋喃、1,4-二恶烷、二甲氧基乙烷、二乙氧基乙烷、二丁基醚等醚类溶剂;作为其他常用溶剂,还可使用苯乙酮、1,3-二甲基-2-咪唑啉酮、环丁砜、二甲基亚砜、丙二醇甲基乙酸酯、乙基溶纤剂、丁基溶纤剂、2-甲基溶纤剂乙酸酯、乙基溶纤剂乙酸酯、丁基溶纤剂乙酸酯、三氯甲烷、丁醇、乙醇、二甲苯、甲苯、氯苯、松节油、矿油精、石脑油类溶剂等,可混合2种以上这些物质来使用。此外,即使是吸湿性溶剂的N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、N-甲基-2-吡咯烷酮等酰胺溶剂,也可通过与上述低吸湿性溶剂混合来抑制因吸湿所导致的聚酰亚胺的析出。
作为将本发明的聚酰亚胺溶解于溶剂而形成溶液时的固体成分浓度,也取决于聚酰亚胺的分子量、制造方法或所制造的膜的厚度,但优选为5重量%以上。固体成分浓度过低时,难以形成膜厚充分的膜。作为将本发明的聚酰亚胺溶解于溶剂时的方法,例如可一边搅拌溶剂一边加入本发明的聚酰亚胺粉末,并在空气中或非活性气体中于室温~溶剂沸点以下的温度范围经1~48小时来溶解,从而形成聚酰亚胺溶液。
此外,可根据需要在本发明的聚酰亚胺中加入脱膜剂、填充材、染料、颜料、硅烷偶联剂、交联剂、末端封闭剂、抗氧化剂、消泡剂、流平剂等添加剂。
所得到的聚酰亚胺溶液可通过公知的方法制膜来形成聚酰亚胺成形体或膜。例如,通过使用刮刀(doctor blade)等将聚酰亚胺溶液浇铸在玻璃基板等支撑体上,并使用热风干燥器、红外线干燥炉、真空干燥器、惰性气氛炉等通常在40~300℃的范围、优选在50~250℃的范围进行干燥可形成聚酰亚胺膜。
实施例
以下通过实施例来具体说明本发明,但并不限定于这些实施例。
且,以下例子中的物性值可通过以下方法来测定。
〈红外吸收光谱〉
使用傅立叶变换红外分光光度计FT/IR4100(日本分光公司制),通过KBr透射法来测定四甲酸二酐的红外吸收光谱。此外,聚酰亚胺薄膜的红外吸收光谱可通过透射法来测定。
〈1H-NMR光谱〉
使用傅立叶变换核磁共振分光光度计JNM-ECP400(JEOL制),于氘代二甲基亚砜中测定四甲酸二酐及经化学酰亚胺化的聚酰亚胺粉末的1H-NMR光谱。
〈差示扫描热量分析(熔点)〉
四甲酸二酐的熔点使用差示扫描热量分析仪DSC3100(NETZSCH公司制)在氮气气氛中以升温速度5℃/分钟来测定。熔点越高且熔解峰越尖锐,表示纯度越高。
〈固有粘度〉
0.5重量%的聚酰胺酸溶液或聚酰亚胺溶液的还原粘度使用奥氏(Ostwald)粘度计于30℃来测定。将该值视为固有粘度。
〈聚酰亚胺粉末在有机溶剂中的溶解性试验〉
相对于聚酰亚胺10mg,将表1记载的有机溶剂1g(固体成分浓度1重量%)装入样本管中,使用试管混合器搅拌5分钟来目视确认溶解状态。溶剂使用三氯甲烷(CF)、丙酮、四氢呋喃(THF)、1,4-二恶烷(DOX)、乙酸乙酯、环戊酮(CPN)、环己酮(CHN)、N,N-二甲基甲酰胺(DMF)、N,N-二甲基乙酰胺(DMAc)、N-甲基-2-吡咯烷酮(NMP)、间甲酚、二甲基亚砜(DMSO)、γ-丁内酯(GBL)、三乙二醇二甲醚(Tri-GL)。
评价结果为在室温溶解时表示为++,通过加热而溶解且放冷至室温后仍保持均匀性时表示为+,膨润/一部分溶解时表示为±,不溶时表示为-。
〈玻璃化温度:Tg、热塑性〉
使用TA Instruments公司制动态粘弹性测定装置(Q800),从频率0.1Hz、振幅0.1%、升温速度5℃/分钟的损耗峰值求得聚酰亚胺膜的玻璃化温度。此外,从紧接着玻璃化温度后的储能模量曲线下降的急剧性来评价热塑性。
〈线热膨胀系数:CTE〉
聚酰亚胺膜的线热膨胀系数使用NETZSCH公司制TMA4000(样本大小宽度5mm、长度15mm),将负荷设为膜厚(μm)×0.5g,以5℃/min先暂时升温至150℃(第1次升温)后,冷却至20℃,进一步以5℃/min升温(第2次升温),并从第2次升温时的TMA曲线计算。线热膨胀系数求得100~200℃之间的平均值。
〈聚酰亚胺膜的透射率:T400〉
使用日本分光公司制紫外可见近红外分光光度计(V-650)测定聚酰亚胺膜(20μm厚)在200-700nm处的光透射率,并使用400nm波长处的光透射率作为透明性的指标。此外,也求得透射率为0.5%以下的波长(截止波长)。
〈黄色度(yellowness index):YI〉
使用紫外-可见分光光度计V-530(日本分光公司制),从波长380~780nm处的聚酰亚胺膜的光透射率(T%)通过VWCT-615型色彩诊断程序(日本分光公司制)依据JISK77373来算出黄色度(YI)。
〈总透光率及雾度〉
使用Haze Meter NDH4000(日本电色工业制)依据JISK7361来求得聚酰亚胺膜的总透光率,并依据JISK7136来求得雾度(浊度)。
〈双折射:Δn〉
使用Atago公司制阿贝折射仪(Abbe 1T),用阿贝折射仪(使用钠灯、波长589nm)来测定与聚酰亚胺膜面平行的方向(nin)以及垂直的方向(膜厚方向)(nout)的折射率,并从这些折射率的差来求得双折射(Δn=nin-nout)。双折射值越高意味着聚合物链的面内取向度越高。
〈合成例1〉
A.TAHQ的合成
下述式(6)所示的四甲酸二酐(TAHQ)如下合成。将偏苯三甲酸酐氯化物12.6751g(60.1940mmol)装在茄形烧瓶中,并于室温溶解在脱水四氢呋喃(THF)33mL中,进行隔膜(septum)密封来制备溶液A。进一步在另一烧瓶中将脱水THF 8.2mL、吡啶9.7mL(120mmol)加入到对苯二酚(HQ)2.2209g(20.1700mmol)中,进行隔膜密封来制备溶液B。一边在冰浴中冷却并搅拌,一边通过注射器经约5分钟将溶液B缓慢地滴加在溶液A中,然后于室温搅拌24小时。反应结束后过滤白色沉淀,用THF及离子交换水清洗。吡啶盐酸盐的去除以将硝酸银水溶液添加在洗液中且未观察到白色沉淀来确认。回收经清洗的生成物并于100℃进行12小时的真空干燥。所得到的生成物为白色粉末,产量为8.0287g,收率为87.6%。
B.TAHQ的鉴定
生成物通过傅立叶变换红外分光光度计FT/IR4100(日本分光公司制),于3082cm-1确认到芳香族C-H伸缩振动吸收带,于1847cm-1及1781cm-1确认到酸酐基C=O伸缩振动吸收带,于1742cm-1确认到酯基C=O伸缩振动吸收带。
此外,使用傅立叶变换核磁共振分光光度计JNM-ECP400(JEOL制)进行1H-NMR测定,结果可归属于(DMSO-d6,δ,ppm):7.54(s,4H),8.30(d,J=7.9Hz,2H),8.65(sd,J=0.72Hz,2H),8.67(dd,J=8.0Hz,1.3Hz,2H),元素分析值为推测值C:62.89%、H:2.20%,实测值C:62.69%、H:2.42%,可确认生成物为TAHQ。
且通过差示扫描热量分析仪DSC3100(NETZSCH公司制)来测定熔点,结果于272.4℃显示尖锐的熔解峰,由此提示该生成物为高纯度。
〈合成例2〉
A.四甲酸二酐TAPh的合成
下述式(7)所示的四甲酸二酐(TAPh)如下合成。将偏苯三甲酸酐氯化物15.1116g(71.8mmol)装在茄形烧瓶中,于室温溶解在脱水四氢呋喃(THF)16.5mL中,进行隔膜密封来制备溶液A。进一步在另一烧瓶中将脱水THF 23.5mL、吡啶8.7mL(108mmol)加入到2-苯基对苯二酚6.2721g(34mmol)中,进行隔膜密封来制备溶液B。一边在冰浴中冷却并搅拌,一边通过注射器经约5分钟将溶液B缓慢地滴加在溶液A中,然后于室温搅拌24小时。反应结束后过滤白色沉淀,用THF及离子交换水清洗。吡啶盐酸盐的去除以将硝酸银水溶液添加在洗液中且未观察到白色沉淀来确认。回收经清洗的生成物,于80℃进行1小时的真空干燥并进一步于100℃进行12小时的真空干燥。所得到的生成物为白色粉末,产量为17.93g,收率为98.7%。
B.TAPh的鉴定
生成物通过傅立叶变换红外分光光度计FT/IR4100(日本分光公司制),于3092、3065cm-1确认到芳香族C-H伸缩振动吸收带,于1847cm-1及1775cm-1确认到酸酐基C=O伸缩振动吸收带,于1752cm-1确认到酯基C=O伸缩振动吸收带。
此外,使用傅立叶核磁共振分光光度计JNM-ECP400(JEOL制)进行1H-NMR测定,结果可归属于(DMSO-d6,δ,ppm):7.30-7.40(m,3H),7.55-7.66(m,5H),8.23(d,J=7.8Hz,1H),8.29-8.32(m,1H),8.50-8.56(m,2H),8.66-8.70(m,2H),元素分析值为推测值C:67.42%、H:2.64%,实测值C:67.49%、H:2.82%,可确认生成物为TAPh。
此外,通过差示扫描热量分析仪DSC3100(NETZSCH公司制)来测定熔点,结果于198.4℃显示尖锐的熔解峰,由此提示该生成物为高纯度。
〈实施例1〉
A.式(1)所示的四甲酸二酐TACHQ的合成
式(1)所示的TACHQ如下合成。将偏苯三甲酸酐氯化物12.7003g(60.3137mmol)装在茄形烧瓶中,于室温溶解在脱水四氢呋喃(THF)33mL中,进行隔膜密封来制备溶液A。进一步在另一烧瓶中将脱水THF 6.5mL、吡啶9.7mL(120mmol)加入到2-环己基对苯二酚(CHQ)3.8551g(20.0661mmol)中,进行隔膜密封来制备溶液B。
一边在冰浴中冷却并搅拌,一边通过注射器经约5分钟将溶液B缓慢地滴加在溶液A中,然后于室温搅拌24小时。反应结束后过滤白色沉淀,用THF及离子交换水清洗。吡啶盐酸盐的去除以将硝酸银水溶液添加在洗液中且未观察到白色沉淀来确认。回收经清洗的粗生成物,于100℃进行12小时的真空干燥。所得到的粗生成物为白色粉末,产量为6.54g,收率为87.6%。
(纯化)
使所得到的粗生成物2.5526g于90℃溶解于乙酸酐与甲苯(体积比1:10)混合溶剂后,自然放置冷却并静置72小时。过滤所析出的白色粉末,于160℃进行12小时的真空干燥。所得到的白色粉末的产量为1.3602g,重结晶收率为53.3%。
B.TACHQ的鉴定
通过重结晶纯化的生成物通过傅立叶变换红外分光光度计FT/IR4100(日本分光公司制),于2928cm-1确认到脂肪族C-H伸缩振动吸收带,于1861cm-1及1778cm-1确认到酸酐基C=O伸缩振动吸收带,于1745cm-1确认到酯基C=O伸缩振动吸收带。
此外,使用傅立叶变换核磁共振分光光度计JNM-ECP400(JEOL制)进行1H-NMR测定,结果可归属于(DMSO-d6,δ,ppm):1.80-1.23(m,10H),2.69(t,J=12Hz,1H),7.50-7.18(m,3H),8.33-8.29(m,2H),8.71-8.65(m,4H),元素分析值为理论值C:66.67%、H:3.73%,实测值C:66.27%、H:3.78%,可确认生成物为TACHQ。
此外,通过差示扫描热量分析仪DSC3100(NETZSCH公司制)来测定熔点,结果于229.1℃显示尖锐的熔解峰,由此提示该生成物为高纯度。
〈实施例2〉
A.式(8)所示的重复单元的聚酰亚胺的合成
(聚酰胺酸的聚合)TACHQ/TFMB
使2,2’-双(三氟甲基)联苯胺(TFMB)3mmol溶解于脱水N,N-二甲基乙酰胺(DMAc)。在其中缓慢地加入实施例1记载的TACHQ粉末3mmol,于室温搅拌72小时,适当地加入DMAc来得到作为聚酰亚胺前体的聚酰胺酸(固体成分浓度16.7重量%)。所得到的聚酰胺酸的固有粘度为1.72dL/g。
(化学酰亚胺化反应)
将所得到的聚酰胺酸溶液用脱水DMAc稀释至固体成分浓度约10.0重量%后,一边将其进行搅拌,一边于室温缓慢地滴加2.8mL(30mmol)乙酸酐与1.2mL(15mmol)吡啶的混合溶液,在滴加结束后进一步搅拌24小时。将所得到的聚酰亚胺溶液缓慢地滴加在大量的甲醇中使聚酰亚胺沉淀。将所得到的白色沉淀物用甲醇充分地清洗,于100℃进行12小时的真空干燥。对所得到的纤维状聚酰亚胺粉末进行1H-NMR测定,结果并未观测到聚酰胺酸特有的COOH质子(δ=13ppm附近)以及NHCO质子(δ=11ppm附近),由此提示化学酰亚胺化反应完成。所得到的聚酰亚胺的固有粘度为2.55dL/g,为高分子量体。此外,聚酰亚胺粉末相对于溶剂的溶解性如表1所示。从表1中可知显示优异的溶剂溶解性。
B.聚酰亚胺溶液的制备及聚酰亚胺膜的制膜
将上述聚酰亚胺粉末一边加温一边再溶解于γ-丁内酯(GBL)来制备6.0重量%的均匀溶液。将该聚酰亚胺溶液浇铸在玻璃基板上,并在热风干燥器中于80℃干燥2小时。然后,连同基板在真空中、200℃干燥1小时并放置冷却至室温后,将聚酰亚胺膜从玻璃基板剥离。将该聚酰亚胺膜再次在真空中、200℃热处理1小时来去除残留应变。
所得到的聚酰亚胺膜的红外吸收光谱如图1所示,动态粘弹性曲线如图2所示,热特性·光学特性如表2所示。根据图1可鉴定为目标的聚酰亚胺。根据图2可知于225℃附近观测到储能模量的急剧下降,从而显示高热塑性。根据表2可知线热膨胀系数(CTE)低至11.9ppm/K,为无色透明膜。这些优异的特性为由式(2)的结构所带来的效果。
〈实施例3〉
A.下述式(9)所示的重复单元的聚酰亚胺的合成
(聚酰胺酸的聚合)TACHQ(80)6FDA(20)/TFMB
将2,2’-双(三氟甲基)联苯胺(TFMB)3mmol溶解于脱水N,N-二甲基乙酰胺(DMAc)。在其中缓慢地加入实施例1记载的TACHQ粉末2.4mmol与4,4’-(六氟异亚丙基)二邻苯二甲酸酐(6FDA)粉末0.6mmol,于室温搅拌72小时,适当地加入DMAc而得到作为聚酰亚胺前体的聚酰胺酸(固体成分浓度22.7重量%)。所得到的聚酰胺酸的固有粘度为0.91dL/g。
(化学酰亚胺化反应)
将所得到的聚酰胺酸溶液用脱水DMAc稀释为固体成分浓度约10.0重量%后,一边将其搅拌,一边于室温缓慢地滴加2.8mL(30mmol)乙酸酐与1.2mL(15mmol)吡啶的混合溶液,在滴加结束后再搅拌24小时。将所得到的聚酰亚胺溶液缓慢地滴加在大量的甲醇中使聚酰亚胺沉淀。将所得到的白色沉淀物用甲醇充分地清洗,于100℃进行12小时的真空干燥。对所得到的纤维状聚酰亚胺粉末进行1H-NMR测定,结果并未观测到聚酰胺酸特有的COOH质子(δ=13ppm附近)以及NHCO质子(δ=11ppm附近),由此提示化学酰亚胺化反应完成。所得到的聚酰亚胺的固有粘度为1.75dL/g,为高分子量体。此外,聚酰亚胺粉末相对于溶剂的溶解性如表1所示。从表1中可知显示优异的溶剂溶解性。
B.聚酰亚胺溶液的制备及聚酰亚胺膜的制膜
将上述聚酰亚胺粉末一边加温一边再溶解于环戊酮(CPN)来制备8.0重量%的均匀溶液。将该聚酰亚胺溶液浇铸在玻璃基板上,并在热风干燥器中于60℃干燥2小时。然后,连同基板在真空中、200℃干燥1小时并放置冷却至室温后,将聚酰亚胺膜从玻璃基板剥离。将该聚酰亚胺膜再次在真空中、200℃热处理1小时以去除残留应变。所得到的聚酰亚胺膜的红外吸收光谱如图3所示,动态粘弹性曲线如图4所示,热特性·光学特性如表2所示。根据图3可鉴定为目标的聚酰亚胺。根据图4可知于225℃附近观测到急剧的储能模量的下降,显示高热塑性。根据表2可知线热膨胀系数(CTE)低至24.7ppm/K,为无色透明膜。这些优异特性为由式(2)的结构所带来的效果。
〈实施例4〉
A.下述式(10)所示的重复单元的聚酰亚胺的合成
(聚酰胺酸的聚合)TACHQ(50)6FDA(50)/TFMB
将2,2’-双(三氟甲基)联苯胺(TFMB)2mmol溶解于脱水N,N-二甲基乙酰胺(DMAc)。在其中缓慢地加入实施例1记载的TACHQ粉末1.0mmol与4,4’-(六氟异亚丙基)二邻苯二甲酸酐(6FDA)粉末1.0mmol,于室温搅拌72小时,适当地加入DMAc而得到作为聚酰亚胺前体的聚酰胺酸(固体成分浓度30重量%)。
所得到的聚酰胺酸的固有粘度为0.56dL/g。
(化学酰亚胺化反应)
将所得到的聚酰胺酸溶液用脱水DMAc稀释为固体成分浓度约10.0重量%后,一边将其搅拌,一边于室温缓慢地滴加1.9mL(20mmol)乙酸酐与0.8mL(10mmol)吡啶的混合溶液,在滴加结束后进一步搅拌24小时。将所得到的聚酰亚胺溶液缓慢地滴加在大量的甲醇中使聚酰亚胺沉淀。将所得到的白色沉淀物用甲醇充分地清洗,于100℃进行12小时的真空干燥。对所得到的纤维状聚酰亚胺粉末进行1H-NMR测定,结果并未观测到聚酰胺酸特有的COOH质子(δ=13ppm附近)以及NHCO质子(δ=11ppm附近),由此提示化学酰亚胺化反应完成。所得到的聚酰亚胺的固有粘度为0.76dL/g。此外,聚酰亚胺粉末相对于溶剂的溶解性如表1所示。根据表1可知显示优异的溶剂溶解性。
B.聚酰亚胺溶液的制备及聚酰亚胺膜的制膜
于室温将上述聚酰亚胺粉末再溶解于环戊酮(CPN)来制备23重量%的均匀溶液。将该聚酰亚胺溶液浇铸在玻璃基板上,并在热风干燥器中于60℃干燥2小时。然后,连同基板在真空中、200℃干燥1小时并放置冷却至室温后,将聚酰亚胺膜从玻璃基板剥离。将该聚酰亚胺膜再次在真空中、200℃热处理1小时以去除残留应变。
所得到的聚酰亚胺膜的红外吸收光谱如图5所示,动态粘弹性曲线如图6所示,热特性/光学特性如表2所示。根据图5可鉴定为目标的聚酰亚胺。根据图6在230℃附近观测到储能模量的急剧下降,可知显示高热塑性,进一步根据表2可知为无色透明膜。
〈对比例1〉
A.下述式(11)所示的重复单元的聚酰亚胺的合成
(聚酰胺酸的聚合)TAPh(100)/TFMB
将2,2’-双(三氟甲基)联苯胺(TFMB)3mmol溶解于脱水N-甲基-2-吡咯烷酮(NMP)。在其中缓慢地加入合成例2记载的TAPh粉末3mmol,于室温搅拌72小时来得到作为聚酰亚胺前体的聚酰胺酸(固体成分浓度20重量%)。所得到的聚酰胺酸的固有粘度为1.6dL/g。
B.聚酰亚胺膜的制膜
将聚酰胺酸溶液浇铸在玻璃基板上,并在热风干燥器中于80℃干燥3小时。然后,连同基板在真空中于250℃进行1小时的热酰亚胺化以及于350℃进行1小时的热酰亚胺化后,将聚酰亚胺膜从玻璃基板剥离。将该聚酰亚胺膜再次在真空中、200℃热处理1小时以去除残留应变。
所得到的聚酰亚胺膜的热特性/光学特性如表2所示。根据表2可知为低光透射率,并且有激烈黄变与混浊。认为由于将式(8)的重复单元的聚酰亚胺中的环己基改变为苯基,所以式(11)的重复单元的聚酰亚胺膜的光学特性显著变差。即,可知即使是同样体积大的结构,环己基的结构极为有用。
〈对比例2〉
A.式(12)所示的重复单元的聚酰亚胺的合成
(聚酰胺酸的聚合)TAHQ/TFMB
将2,2’-双(三氟甲基)联苯胺(TFMB)2mmol溶解于脱水N,N-二甲基乙酰胺(DMAc)。在其中缓慢地加入合成例1所记载的TAHQ粉末2mmol,于室温搅拌72小时,适当地加入DMAc来得到作为聚酰亚胺前体的聚酰胺酸(固体成分浓度11.4重量%)。所得到的聚酰胺酸的固有粘度为4.45dL/g。
(化学酰亚胺化反应)
将所得到的聚酰胺酸溶液用脱水DMAc稀释为固体成分浓度约10.0重量%后,一边将其进行搅拌,一边于室温缓慢地滴加1.9mL(20mmol)乙酸酐与0.8mL(10mmol)吡啶的混合溶液,滴加结束后进一步经3小时溶液失去流动性且凝胶化。从式(8)与式(12)的重复单元的聚酰亚胺的对比,可知体积大的环己基极大地提高了相对于溶剂的溶解性。
B.聚酰亚胺膜的制膜
将上述聚酰胺酸溶液浇铸在玻璃基板上,并在热风干燥器中于60℃干燥2小时。然后,连同基板在真空中于200℃进行0.5小时的热酰亚胺化以及于250℃进行2小时的热酰亚胺化后,将聚酰亚胺膜从玻璃基板剥离。将该聚酰亚胺膜再次在真空中、300℃热处理1小时以去除残留应变。
所得到的聚酰亚胺膜的动态粘弹性曲线如图7所示,热特性·光学特性如表2所示。根据图7可知储能模量开始下降的温度高达375℃,所以与式(8)的重复单元的聚酰亚胺相比热加工性差。此外,黄色度和雾度也高,光学特性也差。
即,可知式(2)的环己基发挥极重要的作用。
表1聚酰亚胺粉末的溶解性试验结果
表2聚酰亚胺膜的热特性与光学特性
()内的数字为聚酰亚胺膜的厚度
- 还没有人留言评论。精彩留言会获得点赞!