从血浆纯化蛋白质的方法与流程
血浆含有对血液凝结途径不可或缺的许多蛋白质。在患有一种或多种这种凝结因子缺陷的患者中,血浆强化疗法可以是有效的方法。然而,灌输富含关键血浆蛋白的组合物在效率和功效方面优越。
免疫球蛋白g(igg)是血浆中最常见的抗体同种型,其浓度为每升血浆约7克。igg水平或igg功能差的患者患有各种免疫缺陷相关疾病。这些患者通常受益于经由静脉内,或iv递送(即ivig)的预防性或治疗性免疫球蛋白强化疗法,其已经成为这种情况的标准治疗。
临床感兴趣的另一种血浆蛋白是α-1蛋白酶抑制剂(a1pi,也称为α-1抗胰蛋白酶)。a1pi起阻止结构上关键的蛋白质如弹性蛋白的降解的作用,且a1pi的缺乏会导致疾病例如肺气肿的发展。患有a1pi缺陷的患者每周静脉内施用纯化的a1pi来治疗。
纤维蛋白原(fg)是具有治疗意义的另一种血浆组分。需要fg强化疗法以治疗和预防先天性和获得性fg缺乏症的出血,即损害凝结途径的低纤维蛋白原血症。出于这个原因,fg通常从供体血浆分离。由于高度追求大量纯化的血浆组分,高效地依次纯化各种所需组分的方法是合乎需要的。
用于静脉内强化疗法方案的血浆蛋白如igg、a1pi和fg通过血浆去除术从来自供体的全血浆纯化。目前的大规模纯化方法通常基于cohn分级分离的陈旧技术,其伴随多个固有的缺点。这种方法通过有时逐渐增加冷血浆样品中乙醇的浓度并通过有时从根本上改变ph来产生几种沉淀级分。乙醇可能会破坏蛋白质结构,对基于cohn分级分离的方法的效率造成内在限制。例如,来自经典cohn分级分离方案的igg产量低于总全血浆igg的50%。本领域迫切需要大规模更有效地纯化多种血浆蛋白的方法。
此外,由于传统方法仅依赖于基于ph、乙醇浓度、温度、离子强度和蛋白质浓度的血浆蛋白的差异溶解度,它们在具有类似结构的蛋白质之间缺乏特异性。
为了克服这些限制,在该领域需要可扩展的(scalable)方法,其从单一来源的全血浆有效地产生各种血浆蛋白的富集组合物。
发明概述
本发明提供用于从单一血浆来源产生多种蛋白质的改进和可扩展的方法。在一个方面中,本发明的特点在于产生富含igg的fg耗尽制剂的方法,其包括以下步骤:使fg耗尽血浆与结合igg的亲和层析吸附剂接触以产生吸附的igg和包含未吸附的蛋白质的溶液;将包含未吸附的蛋白质的溶液与所述吸附的igg分离;和从所述吸附剂洗脱吸附的igg以产生富含igg的fg耗尽制剂。
在一个实施方案中,亲和层析吸附剂结合到ch3结构域,例如人免疫球蛋白(例如igg,例如igg1、igg2、igg3或igg4)的ch3结构域。
在一个实施方案中,所述方法进一步包括以下步骤:使富含igg的fg耗尽制剂通过一个或多个离子交换柱以将igg与污染物分离;从离子交换柱回收igg以产生富含igg的纯化的fg耗尽制剂,将富集igg的fg耗尽制剂渗滤以产生渗滤液,和将所述渗滤液消毒。在一个实施方案中,污染物的一部分结合所述柱。在另一个实施方案中,igg的一部分结合所述柱。
在一个单独的方面,本发明提供一种产生富含α-1蛋白酶抑制剂(a1pi)的fg耗尽制剂的方法,包括以下步骤:使fg耗尽血浆与结合a1pi的亲和层析吸附剂接触以产生吸附的a1pi和包含未吸附的蛋白质的溶液;将包含未吸附的蛋白质的溶液与吸附的a1pi分离;从所述吸附剂洗脱吸附的a1pi以产生富含a1pi的fg耗尽制剂;使富含a1pi的fg耗尽制剂通过一个或多个离子交换柱以将a1pi与污染物分离,和从离子交换树脂回收a1pi以产生富集的a1pi的纯化的fg耗尽制剂。在一个实施方案中,污染物的一部分结合所述柱。在另一个实施方案中,a1pi的一部分结合所述柱。在一些实施方案中,可以将a1pi中的fg耗尽制剂渗滤以产生渗滤液。在其它实施方案中,可以稀释制剂以降低盐含量。
在一些实施方案中,该方法之前是渗滤或稀释fg耗尽血浆。在一些实施方案中,该方法之前是病毒上减少fg耗尽血浆(例如通过以足以失活含脂质病毒的量和持续时间用杀病毒剂溶剂/去污剂溶液孵育血浆样品)。
另一方面,本发明提供一种产生富含凝血酶原复合物的fg耗尽制剂的方法。该方法包括通过将ph降低至足够的水平(例如ph5.3)从fg耗尽血浆沉淀包含凝血酶原的蛋白质以产生凝血酶原复合物沉淀和包含未沉淀的蛋白质的溶液。然后可将凝血酶原复合物沉淀与包含未沉淀的蛋白质的上清液分离,且可溶解凝血酶原复合物沉淀以产生富含凝血酶原复合物的fg耗尽制剂。在一些实施方案中,该方法进一步包括深度过滤富集的凝血酶原复合物的fg耗尽制剂。在一些实施方案中,使富含凝血酶原复合物的所得的滤液通过一个或多个离子交换柱以将凝血酶原与污染物分离,且回收凝血酶原复合物以产生富含凝血酶原复合物的纯化的fg耗尽制剂。污染物或凝血酶原复合物可以结合所述柱。在一些情况下,柱是阴离子交换柱(例如,具有二乙基-氨基乙基(deae)树脂),且使用包含nacl(例如0.15mnacl)的缓冲液将凝血酶原复合物从柱洗脱。在一些情况下,该方法进一步包括将富集的凝血酶原复合物的纯化的fg耗尽制剂渗滤以产生渗滤液,且将该渗滤液消毒以产生经消毒的组合物。
另一方面,本发明的特点在于一种产生富含白蛋白的fg耗尽制剂的方法。在一些情况下,所述方法涉及使fg耗尽血浆制剂(例如来自上述凝血酶原纯化过程的上清液)通过一个或多个阴离子交换柱以将白蛋白与污染物分离,且回收包含白蛋白的穿流级分。可以提高包含白蛋白的穿流级分的ph(例如提高至ph7.4),且可以使含白蛋白的穿流级分再次通过一个或多个阴离子交换柱以将白蛋白与污染物分离。可以弃去来自该交换的穿流物,且可以从柱中回收白蛋白以产生富含白蛋白的纯化的fg耗尽制剂(例如,通过洗脱白蛋白,例如使用0.25mnacl缓冲液)。可以将所得的制剂渗滤和消毒。
另一方面,本发明提供一种通过首先使fg耗尽血浆与结合感兴趣的血浆蛋白的亲和层析吸附剂接触以产生感兴趣的吸附的蛋白质和包含未吸附的蛋白质的溶液,产生富含感兴趣的血浆蛋白的fg耗尽制剂的方法。接下来,该方法包括将包含未吸附的蛋白质的溶液与感兴趣的吸附的蛋白质分离,和从吸附剂洗脱感兴趣的吸附的蛋白质以产生富含感兴趣的蛋白质的fg耗尽制剂。该方法的最后步骤包括使富含感兴趣的蛋白质的fg耗尽制剂通过一个或多个离子交换柱以将感兴趣的蛋白质与污染物分离并从离子交换树脂回收感兴趣的蛋白质以产生富含感兴趣的蛋白质的fg耗尽制剂。在一个实施方案中,污染物的一部分结合所述柱。在另一个实施方案中,感兴趣的蛋白质的一部分结合所述柱。
另一方面,本发明提供一种产生富含感兴趣的第一血浆蛋白的fg耗尽制剂和富含感兴趣的第二血浆蛋白的fg耗尽制剂的方法。首先,该方法包括使fg耗尽血浆与结合感兴趣的第一血浆蛋白的第一亲和层析吸附剂接触以产生感兴趣的吸附的第一蛋白质和包含未吸附的蛋白质的第一溶液,将包含未吸附的蛋白质的第一溶液与感兴趣的吸附的第一蛋白质分离,和从吸附剂洗脱感兴趣的吸附的第一蛋白质以产生富含感兴趣的第一血浆蛋白的fg耗尽制剂。接下来,将具有未吸附的蛋白质的第一溶液与结合感兴趣的第二血浆蛋白的第二亲和层析吸附剂接触以产生感兴趣的吸附的第二蛋白质和包含未吸附的蛋白质的第二溶液。然后将包含未吸附的蛋白质的第二溶液与感兴趣的吸附的第二蛋白质分离,并将感兴趣的吸附的第二蛋白质从第二吸附剂洗脱以产生富含感兴趣的第二血浆蛋白的fg耗尽制剂。然后使富含感兴趣的第一血浆蛋白的制剂通过一个或多个离子交换柱以将感兴趣的第一蛋白质与污染物分离。然后从离子交换柱回收感兴趣的第一蛋白质以产生富含感兴趣的第一蛋白质的纯化的fg耗尽制剂。然后使富含感兴趣的第二血浆蛋白的制剂通过一个或多个离子交换柱以将感兴趣的第二蛋白质与污染物分离。在一些实施方案中,污染物的一部分结合所述柱。在其它实施方案中,感兴趣的蛋白质的一部分结合所述柱。该方法可以另外包括(或以其作为终止)从离子交换树脂洗脱感兴趣的吸附的第二蛋白质以产生富集的感兴趣的第二蛋白质的纯化的fg耗尽制剂。
在一些实施方案中,感兴趣的第一或第二血浆蛋白是igg,而感兴趣的其它蛋白质是a1pi。在一些实施方案中,第一或第二亲和层析试剂结合到ch3结构域,例如人igg1、igg2、igg3或igg4的ch3结构域。
在一些实施方案中,第一或第二离子交换柱包含阳离子树脂。在一些实施方案中,第一或第二离子交换柱包含阴离子(例如弱阴离子)树脂。另一方面,本发明提供一种产生富含感兴趣的血浆蛋白的fg耗尽制剂的方法。首先,通过加入足够量的盐从全血浆沉淀包含fg的蛋白质以产生fg沉淀和具有感兴趣的血浆蛋白的溶液。在一些实施方案中,fg沉淀含有血浆酶原。在一些实施方案中,fg沉淀含有很少血浆酶原或不含血浆酶原。接下来,将fg沉淀与具有感兴趣的血浆蛋白的上清液分离,且将具有感兴趣的血浆蛋白的上清液渗滤或稀释。接下来,使溶液与结合感兴趣的血浆蛋白的亲和层析吸附剂接触以产生感兴趣的吸附的蛋白质和包含未吸附的蛋白质的溶液,且将包含未吸附的蛋白质的溶液与感兴趣的吸附的蛋白质分离并从吸附剂洗脱以产生富含感兴趣的血浆蛋白的fg耗尽制剂。接下来,使富含感兴趣的蛋白质的fg耗尽制剂与离子交换树脂接触产生感兴趣的蛋白质和包含非感兴趣的蛋白质材料的溶液,且从离子交换树脂回收感兴趣的蛋白质以产生富含感兴趣的蛋白质的纯化的fg耗尽制剂。fg沉淀可以在合适的缓冲液中重构以产生fg溶液。此外,fg溶液可以用足以失活含脂质病毒的量的杀病毒剂溶剂/去污剂溶液孵育。接下来,该方法包括通过加入足够量的盐从溶液沉淀包含fg的蛋白质以获得fg沉淀并回收和渗滤沉淀。
另一方面,本发明提供一种产生富含感兴趣的第一血浆蛋白的fg耗尽制剂和富含感兴趣的第二血浆蛋白的fg耗尽制剂的方法。该方法包括首先通过加入足够量的盐从全血浆沉淀包含fg的蛋白质以产生fg沉淀和包含感兴趣的第一血浆蛋白和感兴趣的第二血浆蛋白的上清液。接下来,将所述fg沉淀与所述上清液分离,并将上清液渗滤或稀释。将fg耗尽血浆与结合感兴趣的第一血浆蛋白的第一亲和层析吸附剂接触以产生感兴趣的吸附的第一蛋白质和包含未吸附的蛋白质的第一溶液。接下来,将包含未吸附的蛋白质的第一溶液与感兴趣的吸附的第一蛋白质分离,并将感兴趣的吸附的第一蛋白质从吸附剂洗脱以产生富含感兴趣的第一血浆蛋白的fg耗尽制剂。接下来,将包含未吸附的蛋白质的第一溶液与结合感兴趣的第二血浆蛋白的第二亲和层析吸附剂接触以产生感兴趣的吸附的第二蛋白质和包含未吸附的蛋白质的第二溶液。将包含未吸附的蛋白质的第二溶液与感兴趣的吸附的第二蛋白质分离,并将感兴趣的吸附的第二蛋白质从第二吸附剂洗脱以产生富含感兴趣的第二血浆蛋白的fg耗尽制剂。接下来,使富含感兴趣的第一血浆蛋白的制剂通过一个或多个离子交换柱以将感兴趣的第一血浆蛋白与污染物分离。感兴趣的第一蛋白质从离子交换柱回收以产生富集的感兴趣的第一蛋白质的纯化的fg耗尽制剂。在一个实施方案中,使富含感兴趣的第二血浆蛋白的制剂通过一个或多个离子交换柱以将感兴趣的第二蛋白质与污染物分离,且感兴趣的第二蛋白质从离子交换柱回收以产生富集的感兴趣的第二蛋白质的纯化的fg耗尽制剂。
另一方面,本发明的特点在于一种产生富含感兴趣的第一蛋白质、感兴趣的第二蛋白质、感兴趣的第三蛋白质和任选的感兴趣的第四蛋白质的fg耗尽制剂的方法。该方法涉及通过上述任何方法产生富含感兴趣的第一蛋白质和感兴趣的第二蛋白质的fg耗尽制剂。在一些实施方案中,来自感兴趣的第一或第二蛋白质纯化的穿流级分可以用作可以富集第三和/或第四蛋白质的fg耗尽制剂。在一些情况下,该方法包括通过将ph降低至足够的水平从包含未吸附的蛋白质的第二溶液沉淀包含感兴趣的第三蛋白质的蛋白质以产生包含感兴趣的第三蛋白质的沉淀和包含未沉淀的蛋白质的溶液。然后可以将感兴趣的第三蛋白质与包含未沉淀的蛋白质的上清液分离(例如通过离心),且可以将沉淀溶解以产生富含感兴趣的第三蛋白质的fg耗尽制剂。任何进一步的纯化、过滤、渗滤、消毒或任何其它方法可以根据需要在感兴趣的富集的第三蛋白质上进行。在一些情况下,感兴趣的第四蛋白质可以从上清液富集。例如,可以使上清液达到期望的ph(例如,ph4.6)且通过一个或多个阴离子交换柱以将感兴趣的第四蛋白质与污染物分离,且包含感兴趣的第四蛋白质的穿流级分可以从阴离子交换柱回收。在这种情况下,柱结合污染物。接下来,可以提高包含感兴趣的第四蛋白质的穿流级分的ph(例如提高至ph7.4)并通过一个或多个另外的阴离子交换柱以将感兴趣的第四蛋白质与污染物分离。在这种情况下,穿流级分可能是废料,且柱可以结合感兴趣的第四蛋白质。因此,感兴趣的第四蛋白质可以通过例如用nacl缓冲液(例如0.25mnacl缓冲液)洗脱回收以产生富含感兴趣的第四蛋白质的纯化的fg耗尽制剂。
在任何前述方法中,感兴趣的第三蛋白质可以包括凝血酶原(例如作为凝血酶原复合物),且感兴趣的第四蛋白质可以是白蛋白。
在一个实施方案中,将fg沉淀在合适的缓冲液中重构以产生fg溶液并用足以失活含脂质病毒的量的杀病毒剂溶剂/去污剂溶液孵育。在一些实施方案中,然后可通过加入盐从溶液沉淀包含fg的蛋白质以产生fg沉淀并回收、渗滤或稀释,并消毒。
另一方面,本发明提供一种产生富含感兴趣的血浆蛋白的fg耗尽制剂的方法。在这方面,通过加入足够量的第一盐从全血浆沉淀包含fg的蛋白质以产生fg沉淀和包含感兴趣的血浆蛋白的上清液。包含感兴趣的血浆蛋白的蛋白质通过加入足够量的第二盐从上清液沉淀以产生感兴趣的蛋白质沉淀。接下来,感兴趣的蛋白质在合适的缓冲液中重构以产生溶液,其与结合感兴趣的血浆蛋白的亲和层析吸附剂接触,产生感兴趣的吸附的蛋白质和包含未吸附的蛋白质的溶液。将包含未吸附的蛋白质的溶液与感兴趣的吸附的蛋白质分离,且从吸附剂洗脱感兴趣的吸附的蛋白质以产生富含感兴趣的血浆蛋白的fg耗尽制剂。
在任何前述方法的一些实施方案中,感兴趣的血浆蛋白包含抗凝血酶iii、纤连蛋白、血浆酶原、因子vii、因子viii、因子ix、因子x、因子xi或因子xiii。在一些实施方案中,感兴趣的第一和第二血浆蛋白之一或两者是抗凝血酶iii、纤连蛋白、血浆酶原、因子vii、因子viii、因子ix、因子x、因子xi或因子xiii。
在一些实施方案中,盐包括乙酸钾或柠檬酸三钠。
如本文所用,术语“约”意指所叙述的值的±10%。
如本文所用,“fg复合物”是指通过共价或非共价相互作用物理缔合的多种蛋白质,包含fg。fg复合物可以或可以不包含相关的血浆酶原。如本文所用,“血浆酶原缔合的fg复合物”是指与血浆酶原缔合的fg复合物。如本文所用,“无血浆酶原的fg复合物”是指血浆酶原耗尽的fg复合物。
如本文所用,“上清液”是指具有沉淀材料的组合物的液相。在许多情况下,上清液是位于通过离心产生的沉淀上方的液体。或者,如本文所用,上清液可指组合物的液相,其中沉淀材料分散在整个组合物中(即,其沉淀未沉降下来)。
附图简述
附图进一步描述本发明。
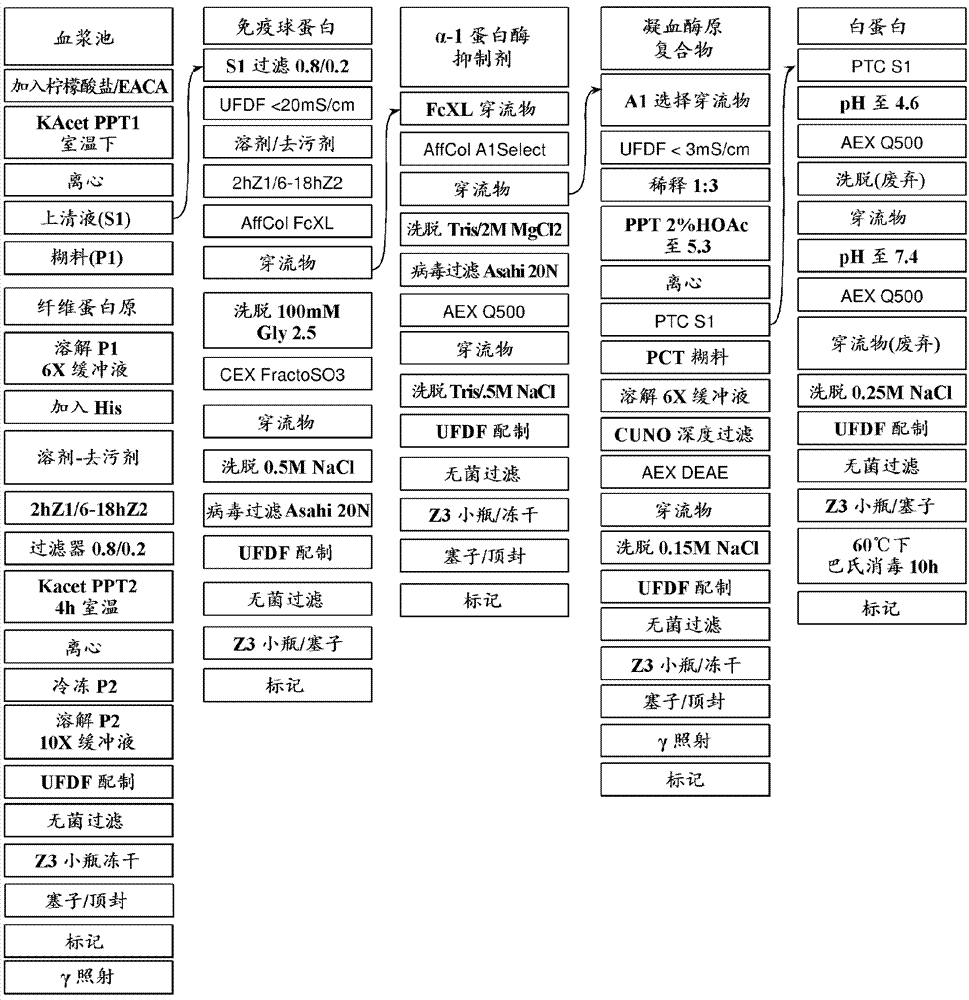
图1是显示根据本发明的一个实施方案的分离三种血浆蛋白的示例性过程步骤的流程图。
图2是显示根据本发明的第二实施方案的分离五种血浆蛋白的示例性过程步骤的流程图。
发明详述
本发明的特点在于从单一血浆样品产生各种蛋白质组合物的方法。具体而言,本发明的特点在于亲和层析步骤,其将未吸附的溶液与吸附的血浆蛋白分离,使得能够在两种级分上进行后续的纯化程序。此外,这些层析纯化步骤有效地从已经耗尽纤维蛋白原(fg)的血浆级分纯化感兴趣的蛋白质。因此,本发明的模块化方法允许从相同的血浆样品连续产生具有临床价值的多种血浆蛋白。
如图1所示的一种示例性方法包括从经血浆去除术的(plasmaphoresed)人血浆纯化fg、免疫球蛋白g(igg)和a1pi。fg通过高浓度的有机盐(盐析)从血浆溶液沉淀出来,溶剂/去污剂(s/d)处理降低病毒载量,且在第二次盐析以除去s/d后,fg准备用于配制、无菌过滤、小瓶填充和冻干。免疫球蛋白通过亲和层析从来自第一次盐沉淀的fg耗尽溶液纯化。将纯化的igg用阳离子或阴离子层析步骤精制,配制,无菌过滤并作为浓缩溶液装入小瓶。a1pi纯化遵循类似的设计,因为亲和树脂用于大部分纯化,由于配体特异性非常高。用于a1pi亲和层析的起始材料(sm)是来自igg亲和运行的穿流物(ft)。纯化的a1pi用强阴离子层析步骤精制,配制,无菌过滤,装入小瓶并冻干。重要的是要注意,亲和纯化可以按任一顺序进行:首先是igg且其次是a1pi,或首先是a1pi且其次是igg。这对任何产品的质量或产量都没有影响。
通过从由图1的方法产生的副产物纯化另外的蛋白质将如图2所示的第二示例性方法添加到图1的方法。特别地,如本文所述,a1pi分离方法的亲和层析步骤的穿流级分可用于分离凝血酶原(例如,作为凝血酶原复合物的一部分)和白蛋白。
本文描述的一些方法的备选程序是本领域技术人员已知的,且本文描述的示例性方法是非限制性的。
合并(pooling)
根据已知方法可以通过血浆去除术收集全血浆。
在该过程的示例性方法中,然后将经血浆去除术的人血浆在-30℃下储存在合格的冷冻机中。生成一个选择列表(picklist)来标识创建池所需的单元(比所需定义的体积多一个或两个单元),然后将每个单元从冷冻机中移出并置于温水浴中以使血浆解冻。水浴具有40℃的初始温度,且在与冷冻单元接触后,温度可升高最多至30℃。水浴的温度保持在30-40℃1-2小时。在一个备选的实施方案中,单元可以在4℃的步入式冷却器中解冻60-68小时。一旦解冻,目视检查血浆单元的瓶子完整性和溶血。发现不可接受的单元将被弃去,且不会进入池。每个血浆瓶喷射有无菌70%异丙醇以消毒盖子,然后将顶部机械切断或折断。将每个血浆单元旋转并倒空至具有一次性(无菌)处理袋的配衡的水套的316不锈钢容器中,且搅拌以获得均匀性直到所有血浆单元已经合并。容器的温度设定为33℃+/-3℃。一旦合并的血浆达到合适的温度,将其混合60分钟(+/-15分钟)以溶解冷冻沉淀。池的净重被标记且进行取样用于测试和保留。此时,通过以13.12mgeaca/1.0kg溶液的比率加入ε-氨基己酸(eaca,颗粒状,usp)从fg置换出血浆酶原,在合适的速度下混合并保持60分钟+/-15分钟。池的净重被标记且进行取样用于测试和保留。用于合并血浆的备选方法在本领域中是已知的。
第一次fg沉淀
本发明的特点在于从全血浆产生fg耗尽制剂以用作另外产生血浆蛋白制剂的来源的方法。从全血浆耗尽的fg可以是fg复合物的形式,且可以或可以不包括例如血浆酶原。在一种示例性方法中,将合并的血浆的温度降至20℃,且加入乙酸钾(kacet,溶液保持在室温下)直到其最终浓度为约1.31mkacet。以0.151kgkacet/1.0kg血浆池重量的比率加入沉淀溶液(10m乙酸钾,usp)。通过搅拌悬浮液不少于60分钟使沉淀完全。将悬浮液在5,000-20,000xg下离心,且在转筒中停留时间为至少10分钟(注意:转筒转速取决于池规模)。将澄清的溶液(上清液#1,super1)倾析并收集糊料(糊料#1)。将super1转移到水套容器中的新袋中。溶液的净重量被标记且进行取样用于测试和保留。本领域技术人员将理解存在用于产生fg耗尽血浆的备选方法,例如通过从全血浆纯化fg。
fg生产线
本发明提供一种产生具有高浓度的fg或其复合物的组合物的方法。在本发明的另一方面,血浆样品耗尽fg。通过制备富集的fg级分从血浆样品除去fg的各种方法在本领域中是已知的,且可以用作本发明的一部分。
在fg分离的一种方法中,进行盐沉淀方法,其中fg进一步沉淀以除去另外的污染物。以下描述示例性方法。
糊料1溶解
从离心机收集来自kacet沉淀的糊料并以10kg缓冲液/各1.0kg糊料的比率溶解在tbs-c(usp)缓冲液(50mmtris-hcl,50mm柠檬酸三钠二水合物,150mmnacl,ph=7.4)中。将糊料在40℃+/-3℃下溶解直到糊料完全溶解(如通过例如目视观察确定)。将颗粒状组氨酸(usp)以0.8g组氨酸/10.0kg溶液的比率加入到溶液中,在合适的速度下混合并保持10分钟。
糊料1s/d处理
所有包膜病毒和一些无包膜病毒通过加入双组分化学变性剂(溶剂tnbp(磷酸三正丁酯)和去污剂tween80(聚山梨醇酯80))变性。这种溶剂/去污剂(s/d)处理使包膜的脂质膜变性,使病毒体无传染性。它也减少细菌和真菌负荷,并有助于降低内毒素活性。将tnbp/tween纯净地混合(以23.09:76.91的tnbp:tween比率)以形成储备溶液;然后将13.2gs/d储备液加入到各1.0kg糊料1悬浮液中用于病毒失活。允许失活在室温下进行至少6小时(例如6-18小时,或过夜)并适当混合。在失活2小时后,将溶液转移至区域2,并使其继续直到完成。溶液的净重量被标记且进行取样用于测试和保留。
第二次fg沉淀
通过以6.56mgeaca/1.0kg溶液的比率加入ε-氨基己酸(eaca,颗粒状,usp)从fg置换出血浆酶原,在合适的速度下混合并在室温下保持60分钟+/-15分钟。溶液温度降至1℃+/-1℃,然后加入乙酸钾直到其最终浓度为约1.31mkacet。以0.151kgkacet/1.0kds/d溶液重量的比率加入沉淀溶液(10m乙酸钾,usp)。通过搅拌悬浮液2-20小时(例如4小时)使沉淀完全。将悬浮液在5,000-20,000xg下离心,且在转筒中停留时间为至少10分钟(注意:停留时间取决于转筒转速,其取决于池规模)。澄清的溶液是一种废品,并收获糊料(糊料#2)。
糊料2溶解
从离心机收集来自第二次kacet沉淀的糊料。此时,糊料可进行冷冻以供储存。可以将糊料溶解在tris/nacl/柠檬酸盐/his(usp)缓冲液(20mmtris-hcl,150mmnacl,20mm柠檬酸三钠二水合物,80mm组氨酸,ph=7.4)中直到可凝结的fg在25mg/ml的目标范围内。如果需要,可以任选将稳定剂(例如糖稳定剂)加入到适量并调节ph。
最终fg无菌过滤/填充
使配制的fg主体(bulk)通过0.2μm无菌过滤器并转移到填充套件中。将20-25毫升的无菌主体放入50ml极为干净的无菌玻璃血清小瓶中。任选地,fg主体被冻干和/或γ射线照射。将小瓶封盖并密封保存。产生的fg浓缩物产生约84%的全血浆fg浓度。
从fg耗尽血浆纯化蛋白质
本发明提供一种产生具有高浓度的感兴趣的额外血清蛋白(例如,igg,a1pi,凝血酶原复合物和/或白蛋白)的组合物的方法。该纯化可以在fg耗尽血浆级分(例如,来自先前描述的fg沉淀方法的上清液)上进行。可以根据下面提供的示例性方法使用亲和层析来纯化感兴趣的蛋白质,包括但不限于igg和a1pi。应当理解这些方法可以容易地适用于(例如通过用合适的亲和柱取代)纯化各种其它血浆蛋白,包括但不限于抗凝血酶iii、纤连蛋白、血浆酶原、因子vii、因子viii、因子ix、因子x、因子xi或因子xiii,如下所述。
在通过亲和层析纯化任何优选的血浆蛋白后,然后可根据下述方法纯化剩余的血浆蛋白,例如凝血酶原复合物和/或白蛋白。通常,白蛋白纯化被保留用于该方法的结尾,之前是凝血酶原复合物纯化,例如根据以下示例性方法。
igg生产线
病毒减少过滤
在整个方法中减少外来物是保护产品不受降解所必需的。为了澄清溶液并除去细菌和真菌(孢子和菌丝)需要进行一般性过滤以将产品从合并(区域0)移动至区域1中的类似体积容器。几家过滤公司已经为该方法的特定阶段测试他们的预过滤器和生物负载减少过滤器。重要的是注意到这种过滤不应被视为无菌过滤,因为过滤器是平均(标称)孔尺寸而不是绝对孔尺寸。本领域技术人员将理解存在减少血浆制剂中的病毒污染物(例如通过γ照射)的备选方法。
超滤/渗滤
由fg沉淀产生的上清液具有高的kacet浓度,其可以在随后的层析步骤之前降低。igg和a1pi分子都足够大,使得它们不通过30kd或50kd渗滤膜。在一些情况下,可以使用30kd膜,但选择50kd膜以最大化系统通量(通量是在各种条件下液体流动通过膜的量)。用于10l血浆批量的ufdf系统用针对3.6倍体积水的渗滤将电导率从约55-60ms/cm降低至<20ms/cm(例如约5ms/cm)。该系统运行约30l/hr/m2,表示约3.5小时以渗滤上清液1(适当的渗滤器膜尺寸的按比例缩放将保持时间恒定)。此时的目标电导率可以低于10ms/cm以允许在第一层析步骤中结合。该溶液通过30kd渗滤器且当提供背压时,溶液将携带低分子量化合物(<30kd=盐,脂质,小蛋白质)通过渗滤器膜至废弃,但保留尺寸大于30kd的蛋白质。溶液的净重量被标记且进行取样用于测试和保留。或者,可以使用本领域已知的其它方法降低盐浓度,例如在合适的缓冲液中稀释。
溶剂/去污剂病毒变性
将适量的s/d储备液(13.2gs/d储备液至1.0kg溶液)加入到super1ufdf溶液中用于病毒失活。在适当的混合下在室温下使失活进行一段时间(例如至少6小时,例如6-18小时或过夜)。在失活可接受的时间段(例如2小时)之后,将该溶液转移到区域2中并使其继续直到完成。溶液的净重量被标记且进行取样用于测试和保留。如本领域已知的,可以进行s/d病毒变性的备选方法。
igg亲和层析
可以使用已知的亲和层析方法从纤维蛋白原耗尽血浆制剂(例如通过上述方法)纯化感兴趣的蛋白质。
在一种示例性方法中,亲和柱配体结合到ch3结构域,例如人igg例如igg1、igg2、igg3或igg4的ch3结构域。这样的配体包括作为captureselecttmfcxl亲和基质(thermofisherscientific)的一部分包括的那些配体。在一些情况下,亲和柱配体是衍生自链球菌的igg结合细胞表面受体,且通过缺乏白蛋白结合结构域的大肠杆菌体系表达。它被偶联到高度交联的sepharose4fastflow树脂上。该树脂通过gehealthcare市售可得(cat#17-0618-05)。亲和柱在50mmtris-hclph=7.4溶液中运行。存在任选的200mmnacl/tris盐洗涤液来破坏非特异性离子相互作用,且igg在ph=2.50下用低ph的100mm甘氨酸-hcl从柱洗脱。取决于是否随后进行阴离子交换层析步骤,可以调节亲和柱洗出液(pge)的ph。在精制层析涉及阴离子交换的情况下,通过加入合适体积的浓缩tris溶液使洗出液达到中性酸度。或者,如果进行阳离子交换层析,则可能不需要调节ph。溶液的净重量被标记且进行取样用于测试和保留。
igg精制层析
如上文讨论,根据已知方法可以使用精制层析步骤以确保在最终容器中没有亲和配体从树脂中浸出。在一种示例性方法中,离子交换层析(例如阴离子交换层析或阳离子交换层析)可以根据已知方法进行。在某些情况下,根据常规方案或制造商的说明,例如使用强阳离子交换树脂(例如fractogel®emdso3-(s))进行阳离子层析交换。igg可以用盐从柱洗脱。溶液的净重量可以被标记且进行取样用于测试和保留。
病毒过滤
在亲和层析(以及如上所述的任选的精制层析)之后,可以进行溶液的病毒过滤以减少病毒含量。为了制备病毒过滤器(例如,asahiplanova20n或pallpegasussv),可以用灌输用水(wfi)冲洗,然后测试以确保过滤器膜完整(即没有撕裂,由于这会导致病毒过滤器无效)。膜的完整性测试使用增加的空气压力以确保没有气泡通过膜。该测试可以在病毒过滤之前进行,且在病毒过滤之后再次进行以证明过滤器的完全完整性并满足法规要求。
病毒过滤的洗出液可含有高盐浓度,其可通过例如渗滤或本领域已知的其它可接受的方法(例如简单稀释或如本文所述的ufdf系统)除去。根据已知方法可以对最终溶液进行进一步的消毒技术。在某些情况下,溶液经无菌过滤。溶液的净重量被标记且进行取样用于测试和保留。igg的最终产量可高达约80%。将含有最终igg产品的小瓶密封并标记。
a1pi生产线
a1pi亲和层析
根据已知方法(例如亲和层析),例如可以从igg亲和层析方法的穿流级分纯化a1pi。在一种示例性方法中,结合a1pi的亲和柱配体是单结构域抗体片段(例如衍生自美洲驼且通过酵母体系表达)。例如,它可以偶联到高度交联的琼脂糖树脂上。该树脂通过gehealthcare市售可得(cat#17-5472-03)。亲和柱在50mmtris-hclph=7.4溶液中运行。存在150mmnacl/tris盐洗涤液来破坏非特异性离子相互作用,且a1pi用tris缓冲液中的2mmgcl2从柱洗脱。亲和柱洗出液(ace)可以经渗滤以降低盐浓度。溶液的净重量被标记且进行取样用于测试和保留。
超滤/渗滤
所得的溶液的盐浓度可通过几种已知方法之一来降低,包括例如在合适的缓冲液中的简单稀释或ufdf系统。在示例性方法中,使用ufdf系统。ufdf系统用针对5倍体积水的渗滤将电导率从约120ms/cm降低至约5ms/cm。该系统运行约60l/hr/m2,表示约0.5小时以渗滤每批ace。此时的目标电导率需要低于10ms/cm以允许在第二层析步骤中结合。溶液的净重量被标记且进行取样用于测试和保留。
阴离子交换层析
阴离子交换层析步骤可以用于除去可能已经从树脂中浸出的任何亲和配体。在一种示例性方法中,asahiq500阴离子交换树脂(aex;cat#19907)可以用于精制步骤且针对a1pi产量优化结合和洗脱参数。q500柱在50mmtris-hclph=7.4中平衡,且a1pi用tris缓冲液中的至350mm或500mmnacl的阶梯梯度洗脱。溶液的净重量被标记且进行取样用于测试和保留。
病毒过滤
小的无包膜病毒(如细小病毒)可经由通过20纳米的小孔过滤从产品中除去。更大的无包膜病毒也将用此步骤除去。为了制备病毒过滤器(例如asahiplanova20n或pallpegasussv4),可以用灌输用水(wfi)冲洗,然后测试以确保过滤器膜完整(没有撕裂,由于这将导致病毒过滤器无效)。膜的完整性测试使用增加的空气压力以确保没有气泡通过膜。该测试可以在病毒过滤之前进行,且在病毒过滤之后再次进行以证明过滤器的完全完整性并满足法规要求。溶液的净重量被标记且进行取样用于测试和保留。本领域技术人员将理解存在从血浆制剂有效过滤病毒组分的备选方法。
ufdf制剂主体
病毒过滤的洗出液仍然可以含有高盐浓度,其可以例如通过渗滤或本领域已知的其它可接受的方法(例如简单稀释)除去。ufdf系统用针对3倍体积水的渗滤将电导率从约20ms/cm降低到约2ms/cm,并允许将缓冲液交换到tris最终制剂中。该系统运行约60l/hr/m2,表示约0.5小时以便渗滤每批q500洗出液。溶液的净重量被标记且进行取样用于测试和保留。
a1pi无菌过滤/填充
可根据已知方法进行无菌过滤/填充步骤。在一种示例性方法中,使配制的a1pi主体通过0.2μm无菌过滤器并转移到填充套件中。将约20ml无菌主体放入50ml极为干净的无菌玻璃血清小瓶中。在某些情况下,将a1pi冻干。a1pi的最终产量可以是约80%。包含最终a1pi产品的小瓶被密封并贴上标签。
备选蛋白质生产线
亲和层析
使用蛋白质特异性亲和层析方法(例如本领域已知的那些)从fg耗尽血浆制剂纯化各种其它血浆蛋白。这样的血浆蛋白包括但不限于抗凝血酶iii、纤连蛋白、血浆酶原、因子vii、因子viii、因子ix、因子x、因子xi和因子xiii,其任何一种或多种(以及任选地除了igg和/或a1pi外)可以以任何顺序纯化。通常,igg、a1pi、抗凝血酶iii、纤连蛋白、血浆酶原、因子vii、因子viii、因子ix、因子x、因子xi和因子xiii(例如通过亲和层析分离)中的任何一种或多种在任何凝血酶原复合物和/或白蛋白纯化之前,从fg耗尽血浆制剂纯化。
作为本发明的一部分用于通过亲和层析纯化抗凝血酶iii的示例性方法是本领域已知的,且例如在hoffman(theamericanjournalofmedicine,87,s23-s26,1989)中描述。抗凝血酶iii亲和层析树脂是市售可得的,例如captureelecttmantithrombiniiiaffinitymatrix(thermofisher)。作为本发明的一部分用于通过亲和层析纯化纤连蛋白的示例性方法是本领域已知的,且例如在kuyas等人(thrombosisandhaemostasis63.3,439-444,1990)中描述。作为本发明的一部分用于通过亲和层析纯化血浆酶原的示例性方法是本领域已知的,且例如在美国专利号3,943,245或deutsch等人(science,170,1095-1096,1970)中描述。用作本发明的一部分的用于通过亲和层析纯化因子vii的示例性方法是本领域已知的,且例如在wo2006/074664中描述。用作本发明的一部分的用于通过亲和层析纯化因子viii的示例性方法是本领域已知的,且例如在美国专利号5,110,907中描述。作为本发明的一部分用于通过亲和层析纯化因子ix和因子x的示例性方法是本领域已知的,且例如在ahmad等人(thrombosisresearch,55,121-133,1989)中描述。因子ix亲和层析树脂包括例如肝素-琼脂糖树脂。用作本发明的一部分的用于通过亲和层析纯化因子xi的示例性方法是本领域已知的,且例如在mashiko等人(biolchemhoppeseyler,375,481-484,1994)中描述。用作本发明的一部分的用于通过亲和层析纯化因子xiii的示例性方法是本领域已知的,且例如在美国专利号5,688,919和debacker-royer等人(internationaljournalofbiochemistry,24,91-97,1992)中描述。应当理解,igg、a1pi、抗凝血酶iii、纤连蛋白、血浆酶原、因子vii、因子viii、因子ix、因子x、因子xi和因子xiii中的任何一种或多种的任何合适的基于亲和层析的纯化方法预期用作本发明的一部分。
超滤/渗滤
上述任何方法的亲和柱洗出液的盐浓度可以通过几种已知方法之一减少,包括例如在合适的缓冲液中的简单稀释或ufdf系统。在一种示例性方法中,使用ufdf系统。ufdf系统用针对5倍体积水的渗滤将电导率从约120ms/cm降低至约5ms/cm。该系统运行约60l/hr/m2,表示约0.5小时以渗滤每批亲和柱洗出液。此时的目标电导率低于10ms/cm以允许在第二层析步骤中结合。溶液的净重量被标记且进行取样用于测试和保留。
离子交换层析
如果需要,在亲和层析之后进行离子交换层析作为精制层析步骤以除去在上述任何方法中可能已经从亲和柱的树脂中浸出的任何亲和配体。在一些实施方案中,使用阳离子交换层析。在其它实施方案中,使用阴离子交换层析。对于阳离子交换或阴离子交换,取决于被纯化的蛋白质,根据本领域已知的方法针对特定蛋白质优化结合和洗脱参数。根据已知方法,蛋白质可以用盐(例如nacl或其它合适的盐)从柱洗脱。溶液的净重量被标记且进行取样用于测试和保留。
病毒过滤
小的无包膜病毒(如细小病毒)经由通过20纳米的小孔过滤从产品中除去。更大的无包膜病毒也用该步骤除去。为了制备病毒过滤器(例如asahiplanova20n或pallpegasussv4),可以用灌输用水(wfi)冲洗,然后测试以确保过滤器膜完整(没有撕裂,由于这将导致病毒过滤器无效)。膜的完整性测试使用增加的空气压力以确保没有气泡通过膜。该测试可以在病毒过滤之前进行,且在病毒过滤之后再次进行以证明过滤器的完全完整性并满足法规要求。溶液的净重量被标记且进行取样用于测试和保留。本领域技术人员将理解存在用于从血浆制剂有效过滤病毒组分或以其它方式杀死任何污染病毒(例如通过γ照射)的备选方法。
ufdf制剂主体
病毒过滤的洗出液仍然可以包含高盐浓度,其可以例如通过渗滤或上述的其它可接受的方法或本领域已知的其它可接受的方法(例如简单稀释)除去。溶液的净重量被标记且进行取样用于测试和保留。
无菌过滤/填充
无菌过滤/填充步骤可以根据本领域已知或本文描述的方法进行。将含有最终蛋白质产物(抗凝血酶iii、纤连蛋白、血浆酶原、因子vii、因子viii、因子ix、因子x、因子xi或因子xiii)的小瓶密封并标记。
凝血酶原复合物生产线
可以进一步处理fg耗尽血浆的穿流级分,例如上述a1pi纯化方法的穿流物,以分离另外的蛋白质,例如凝血酶原复合物,然后是白蛋白。先前的穿流级分的盐浓度可通过几种已知方法之一减少,包括例如在合适的缓冲液中的简单稀释或ufdf系统。在示例性方法中,使用ufdf系统。ufdf系统可以用针对5倍体积水的渗滤将电导率从约20ms/cm降低至<4ms/cm(例如<3ms/cm)。将所得的溶液以1:3稀释并通过例如使用2%乙酸使ph达到约7.4至5.3来沉淀。
然后根据本领域已知的或上述的方法将凝血酶原复合物溶液离心以产生凝血酶原复合物糊料和上清液。从离心机收集来自凝血酶原复合物沉淀的糊料,并在40℃±3℃下将其溶解在含有20mmtris、20mm柠檬酸盐和150mmnacl、ph7.4的缓冲液中直到糊料完全溶解(如通过例如视觉观察确定)。
一旦溶解,根据本领域已知的方法使用深度过滤纯化凝血酶原复合物溶液。合适的深度过滤系统包括zetaplustm(3m)。
可以使用阴离子交换层析步骤除去可能已经从树脂中浸出的任何亲和配体。在一种示例性方法中,任选地使用二乙基-氨基乙基(deae)阴离子交换树脂且针对凝血酶原复合物产量优化结合和洗脱参数。穿流级分可以保留用于进一步纯化例如白蛋白。阴离子交换柱用150mmnacl平衡,且洗脱凝血酶原复合物。溶液的净重量被标记且进行取样用于测试和保留。
凝血酶原复合物洗出液可含有高盐浓度,其可例如通过渗滤或本领域已知的其它可接受的方法(例如根据本领域已知或上文所述的方法的简单稀释或ufdf)除去。溶液的净重量被标记且进行取样用于测试和保留。
无菌过滤/填充步骤可以根据本领域已知或本文描述的方法进行。在一种示例性方法中,使配制的凝血酶原复合物主体通过0.2μm无菌过滤器并转移到填充套件中。将约20ml无菌主体放入50ml极为干净的无菌玻璃血清小瓶中。在一些情况下,凝血酶原复合物被冻干。将含有最终凝血酶原复合物产物的小瓶密封并标记。另外,凝血酶原复合物产物可以是γ照射的。
白蛋白生产线
可以进一步处理穿流级分或上清液,例如上文所述的凝血酶原复合物离心的上清液以分离另外的蛋白质,例如白蛋白。
示例性方法涉及在两个不同ph值下的序贯的阴离子交换层析步骤。在第一阴离子交换之前,使用6nhcl将上清液(100mm乙酸盐)的ph从ph5.3调节至ph4.6以除去残留电荷。使用asahiq500阴离子交换树脂(cat#19907),且可以针对优选的白蛋白产量优化结合和洗脱参数。在第一阴离子交换步骤中,穿流级分包含白蛋白产物并保留用于进一步处理。溶液的净重量被标记且进行取样用于测试和保留。将洗出液弃去。
接下来,用tris将穿流级分的ph调节至7.4,且重复阴离子交换层析方法。弃去由第二阴离子交换产生的穿流物。使用0.25mnacl洗脱白蛋白。
根据已知方法,白蛋白洗出液的盐浓度可以通过ufdf降低。根据usp标准,ufdf系统可以用针对5倍体积缓冲液的渗滤将电导率从约20ms/cm降低到7-8。例如,具有10%白蛋白浓度的溶液含有8mm辛酸钠、8mm乙酰基d-l色氨酸钠、20mmtris-hcl和70mmnacl,ph7.4。根据已知参数,缓冲液的含量(例如辛酸钠的浓度)将取决于溶液中白蛋白的浓度。
无菌过滤/填充步骤可以根据本领域已知或本文描述的方法进行。在一种示例性方法中,使白蛋白溶液通过0.2μm无菌过滤器并转移到填充套件中。将约100ml无菌容器放入100ml极为干净的无菌玻璃血清小瓶中。将白蛋白例如在60℃下巴氏消毒10小时。含有最终白蛋白产品的小瓶被密封并贴上标签。
双盐沉淀
本发明的特点在于上文详细描述的那些的备选方法。特别是,可以进行双盐沉淀方法。单盐沉淀方法和双盐沉淀方法之间的唯一区别是在合并单元操作期间两个不同的盐浓度。两种盐沉淀的前提是第一沉淀盐析出蛋白质(例如fg)等,但不沉淀免疫球蛋白(例如igg)。第二沉淀盐析出所有免疫球蛋白(包括也被盐析出的其它物质)。净结果是免疫球蛋白盐析物为约50%纯度。如上所述,fg纯化系列(train)将包括第一糊料的溶解,s/d处理和第二kacet沉淀。fg生产线将具有相同的蛋白质分布,因为第二次沉淀具有与先前描述的单盐方法相同的参数。以下描述双盐沉淀方法的非限制性示例性方法。
第一次fg沉淀
将合并的血浆的温度降至20℃,且加入柠檬酸钠(50%柠檬酸盐溶液ph=7.00)直到最终浓度为12%。通过搅拌悬浮液不少于60分钟使沉淀完全。将悬浮液在5,000-20,000xg下离心,且在转筒中停留时间为至少10分钟(注意:转筒转速取决于池规模)。将澄清的溶液(上清液#1,super1)倾析并收集糊料(糊料#1)。将super1转移到水套容器中的新袋中。溶液的净重量被标记且进行取样用于测试和保留。
如上所述将糊料1悬浮,并进行s/d处理,随后进行第二次kacet沉淀。剩余的fg生产线与上述类似。
第二次沉淀
将25l容器的温度降至4℃(+/-3℃)并适当搅拌均匀。加入额外的柠檬酸盐溶液直到最终柠檬酸盐浓度达到22%。通过在适当搅拌下保持4℃过夜来使该悬浮液完全沉淀。免疫球蛋白将在这种22%的盐溶液中从溶液沉淀出来。将悬浮液在5000-20,000xg下离心,且在转筒中停留时间为至少10分钟(注意,转筒的转速取决于池规模)。将澄清的溶液(上清液#2,super2)倾析并收集糊料(糊料#2)。将super2转移到水套容器中的新袋中。溶液的净重量被标记且进行取样用于测试和保留。生物负载过滤允许super2进入其中udfd单元操作继续的区域1,例如进入igg生产线。
其它实施方案
本说明书中提到的所有出版物、专利和专利申请均通过引用并入本文,其程度如同每个独立的出版物或专利申请被具体地和单独地指出通过引用并入。
虽然已经结合其具体实施方案描述本发明,但应当理解它能够进一步修改,且本申请旨在覆盖本发明的任何变型、用途或适用,总体上遵循本发明的原理且包括在本发明所属领域内的已知或惯用实践内的本公开内容的这种偏离,且可以应用于前面提出的基本特点,且在权利要求的范围内遵循。
其它实施方案在权利要求内。
- 还没有人留言评论。精彩留言会获得点赞!