用于治疗性细胞活化或消除的双重控制的制作方法
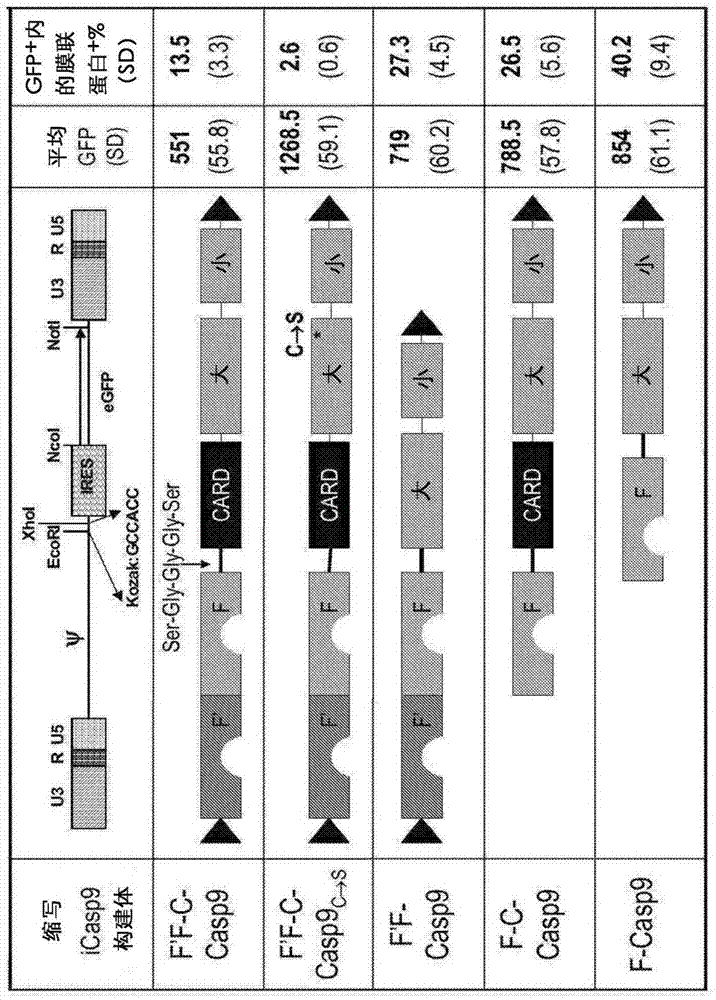
要求于2015年12月14日提交的标题为“用于治疗性细胞活化或消除的双重控制(dualcontrolsfortherapeuticcellactivationorelimination)”的美国临时专利申请序列号62/267,277的优先权,该美国临时专利申请的全部内容以引用方式被提及且并入。本技术部分涉及使用分子开关来控制治疗性细胞的活性或消除治疗性细胞的方法,所述分子开关采用不同异二聚化剂配体,结合其他多聚体配体。本技术可例如用于活化或消除用于促进植入的细胞,用于治疗疾病或病况,或用于控制或调节表达嵌合抗原受体或重组t细胞受体的治疗性细胞的活性。
背景技术:
向患者施用修饰或未修饰细胞(例如t细胞)的细胞疗法的使用越来越多。在一些示例中,将细胞遗传工程化以表达异源基因,然后向患者施用这些修饰细胞。异源基因可用于表达嵌合抗原受体(car),所述嵌合抗原受体是人工受体,其被设计为向t细胞传递抗原特异性而不需要mhc抗原呈递。它们包括抗原特异性组分、跨膜组分和胞内组分,所述胞内组分被选择用于活化t细胞并提供特异性免疫。表达car的t细胞可用于各种疗法,包括癌症疗法。这些治疗被例如用于靶向用于消除的肿瘤,以及用于治疗癌症和血液病症,但这些疗法可能具有不利的负作用。在治疗性细胞诱导的不良事件的一些情况下,需要快速且几乎完全地消除治疗性细胞。过度的中靶(on-target)效应(例如针对大肿瘤肿块的那些)可导致与肿瘤溶解综合征(tls)、细胞因子释放综合征(crs)或巨噬细胞胞活化综合征(mas)相关的细胞因子风暴(cytokinestorm)。因此,人们对开发稳定、可靠的“自杀基因”非常感兴趣,该自杀基因可在转移的t细胞或干细胞在治疗后触发严重不良事件(sae)或变得失效(obsolete)时消除它们。然而在一些情况下,对疗法的需求可能仍然存在,并且可能有方式来降低负面作用,同时维持足够的疗法水平。在一些情况下,需要增加治疗性细胞的活性。例如,共刺激多肽可用于增强t细胞的活化以及针对靶抗原的表达car的t细胞的活化,这将增加过继性免疫疗法的效力。因此,需要受控制的活化或消除治疗性细胞,以快速增强用于细胞疗法中的供体细胞的活性或去除其可能的负面作用,同时保留所述疗法的部分或全部有益作用。技术实现要素:用小分子化学诱导二聚化(cid)是用于产生蛋白质功能的开关以改变细胞生理学的有效技术。高特异性的有效二聚化剂(dimerizer)是瑞米达西(rimiducid)(ap1903),它具有两个相同尾对尾排布的蛋白质结合表面,每个表面均对fkbp12的突变体或变体fkbp12(f36v)(fkbp12v36、fv36或fv)具有高亲和力和特异性。将一个或多个fv结构域附着到一个或多个通常依赖于同二聚化的细胞信号传导分子上可将该蛋白质转化为瑞米达西对照。在诱导型胱天蛋白酶安全开关和用于细胞疗法的诱导型活化开关的背景下使用利用瑞米达西的同二聚化,其中包含myd88和cd40多肽的共刺激多肽被用于刺激免疫活性。因为这两种开关都依赖于相同的配体诱导物,因此难以在同一个细胞内使用这些开关来控制两种功能。在一些实施方案中,基于异二聚化小分子雷帕霉素(rapamycin)或雷帕霉素类似物(rapamycinanalog,“rapalog”)提供受独特二聚化剂配体控制的分子开关。雷帕霉素结合fkbp12和其变体,并且可通过结合fkbp12和含有mtor的fkbp-雷帕霉素结合(frb)结构域的多肽这两者来诱导融合到fkbp12的信号传导结构域的异二聚化。在本申请的一些实施方案中提供了分子开关,所述分子开关极大地增加了雷帕霉素、雷帕霉素类似物和瑞米达西作为用于治疗性应用的药剂的用途。在某些实施方案中,使用瑞米达西的等位基因特异性来允许fv-融合物的选择性二聚化。在其他实施方案中,雷帕霉素或雷帕霉素类似物诱导型促细胞凋亡多肽(例如胱天蛋白酶-9或雷帕霉素或雷帕霉素类似物诱导型共刺激多肽,例如myd88/cd40(mc))与瑞米达西诱导型促细胞凋亡多肽(例如胱天蛋白酶-9或瑞米达西诱导型嵌合刺激多肽,例如imc)组合使用,以产生双开关。这些双开关可用于通过施用两种不同的配体诱导物中的任一种来选择性地控制细胞增殖和细胞凋亡。在其他实施方案中,提供了分子开关,其提供了用瑞米达西或雷帕霉素或雷帕霉素类似物活化促细胞凋亡多肽(例如胱天蛋白酶-9)的选择,其中所述嵌合促细胞凋亡多肽包含瑞米达西诱导型开关和雷帕霉素或雷帕霉素类似物诱导型开关这两者。在相同的嵌合促细胞凋亡多肽上包含两个分子开关在临床环境中提供了灵活性,在所述临床环境中,临床医生可基于药物的特定药理学性质或出于其他考虑(例如可用性)来选择施用适当的药物。这些嵌合促细胞凋亡多肽可包含例如mtor的fkbp12-雷帕霉素结合结构域(frb)或frb变体和fkbp12变体多肽(例如fkbp12v36)两者。frb变体多肽意指结合雷帕霉素类似物(rapamycinanalog,rapalog)(例如本申请中所提供的雷帕霉素类似物)的frb多肽。frb变体多肽包含一个或多个氨基酸取代,结合雷帕霉素类似物,并且可结合雷帕霉素,或可不结合雷帕霉素。在双开关技术的一个实施方案(fwt.frbδc9/mc.fvfv)中,同二聚化剂(例如ap1903(瑞米达西))诱导修饰细胞的活化,并且异二聚化剂(例如雷帕霉素或雷帕霉素类似物)活化安全开关,引起修饰细胞的细胞凋亡。在该实施方案中,例如,将包含fkbp12和frb或frb变体区两者的嵌合促细胞凋亡多肽(例如胱天蛋白酶-9)(ifwtfrbc9)连同包含myd88和cd40多肽以及fkbp12v36的至少两个拷贝的诱导型嵌合myd88/cd40共刺激多肽(mc.fvfv)一起在细胞中表达。在使所述细胞与结合fv区的二聚化剂接触后,mc.fvfv二聚化或多聚化,并活化所述细胞。所述细胞例如可以是表达针对靶抗原的嵌合抗原受体(carζ)的t细胞。作为安全开关,所述细胞可与异二聚化剂(例如雷帕霉素或雷帕霉素类似物)接触,所述异二聚化剂结合ifwtfrbc9多肽上的frb区以及ifwtfrbc9多肽上的fkbp12区,引起胱天蛋白酶-9多肽的直接二聚化,并诱导细胞凋亡。(图43(2),图57)在另一种机制中,异二聚化剂结合ifwtfrbc9多肽上的frb区和mc.fvfv多肽上的fv区,引起支架诱导的二聚化,这归因于每个mc.fvfv多肽上的两个fkbp12v36多肽的支架(图43(1)),并诱导细胞凋亡。fkbp12变体多肽意指fkbp12多肽,其包含一个或多个氨基酸取代并且以比配体(例如,瑞米达西)结合所述fkbp12多肽区的亲和力高至少100倍、500倍或1000倍的亲和力结合所述配体。在双开关技术(frbfwtmc/fvc9)的另一实施方案中,异二聚化剂(例如雷帕霉素或雷帕霉素类似物)诱导修饰细胞的活化,并且同二聚化剂(例如ap1903)活化安全开关,引起修饰细胞的细胞凋亡。在该实施方案中,例如,包含fv区的嵌合促细胞凋亡多肽(例如胱天蛋白酶-9)(ifvc9)与包含myd88和cd40多肽以及fkbp12和frb或frb变体区两者的诱导型嵌合myd88/cd40共刺激多肽(ifrbfwtmc)(mc.fvfv)一起在细胞中表达。在使细胞与雷帕霉素或将fkbp12区和frb区异二聚化的雷帕霉素类似物接触之后,ifrbfwtmc将细胞二聚化或多聚化并活化。所述细胞例如可以是表达针对靶抗原的嵌合抗原受体(carζ)的t细胞。作为安全开关,所述细胞可与同二聚化剂(例如ap1903)接触,所述同二聚化剂结合ifvc9多肽,引起胱天蛋白酶-9多肽的直接二聚化并诱导细胞凋亡。(图57(右))。在本申请的双开关组合物和方法的再一实施方案中,提供了双开关细胞凋亡多肽、表达所述双开关细胞凋亡多肽的修饰细胞和编码所述双开关细胞凋亡多肽的核酸。这些双开关嵌合促细胞凋亡多肽允许选择配体诱导物。例如,在一个实施方案中,提供了表达frb.fkbpv.δc9多肽或fkbpv.frbδc9多肽的修饰细胞;可通过使所述修饰细胞与异二聚体(例如雷帕霉素或雷帕霉素类似物)或同二聚体瑞米达西接触来诱导细胞凋亡。因此,在一些实施方案中,提供了包含编码双开关嵌合促细胞凋亡多肽(例如,frb.fkbpv.δc9多肽或fkbpv.frbδc9多肽)的多核苷酸的修饰细胞,其中frb多肽区可以是frb变体多肽区,例如,frbl。应当理解,在表示frb的情况下,例如本文中的命名表,可使用其他frb衍生物,例如frbl。类似地,在提供包含frbl的多肽作为本申请的组合物或方法的示例的情况下,应当理解,除frbl之外的rb或frb变体或衍生物可与适当的配体(例如雷帕霉素或雷帕霉素类似物)使用。还应当理解,除fkbp12v36之外的fkbp12变体可视情况取代fkbp12v36。所述修饰细胞可进一步包含编码异源蛋白质的多核苷酸,例如嵌合抗原受体或重组t细胞受体。所述修饰细胞可进一步包含编码共刺激多肽的多核苷酸,所述共刺激多肽例如包含myd88多肽区的多肽或缺少tir结构域的截短的myd88多肽区,或者例如包含myd88多肽区或缺少tir结构域的截短的myd88多肽区和缺少胞外结构域的cd40胞质多肽区。在一些实施方案中还提供了包含编码双开关嵌合促细胞凋亡多肽(例如,frb.fkbpv.δc9多肽或fkbpv.frbδc9多肽)的多核苷酸的核酸,其中frb多肽区可以是frb变体多肽区,例如,frbl。所述核酸可进一步包含编码异源蛋白质的多核苷酸,例如嵌合抗原受体或重组t细胞受体。所述核酸可进一步包含编码共刺激多肽的多核苷酸,所述共刺激多肽例如包含myd88多肽区的多肽或缺少tir结构域的截短的myd88多肽区,或者例如包含myd88多肽区或缺少tir结构域的截短的myd88多肽区和缺少胞外结构域的cd40胞质多肽区。在本申请的一些实施方案中,提供了嵌合多肽,其中第一嵌合多肽包含结合第一配体的第一多聚化区;所述第一多聚化区包含第一配体结合单元和第二配体结合单元;所述第一配体是包含第一部分和第二部分的多聚体配体;所述第一配体结合单元结合所述第一配体的所述第一部分并且不显著结合所述第一配体的所述第二部分;并且所述第二配体结合单元结合所述第一配体的所述第二部分并且不显著结合所述第一配体的所述第一部分。在一些实施方案中,还提供了第二嵌合多肽,其中所述第二嵌合多肽包含结合第二配体的第二多聚化区;所述第二多聚化区包含第三配体结合单位;所述第二配体是包含第三部分的多聚体配体;并且所述第三配体结合单位结合所述第二配体的所述第三部分并且不显著结合所述第一配体的所述第二部分。第一配体结合单位的示例包括但不限于fkbp12多聚化区或变体,例如fkbp12v36,第二配体结合单位的示例是例如frb或frb变体多聚化区。第三配体结合单位的示例包括例如但不限于fkbp12多聚化区或变体,例如fkbp12v36。在某些实施方案中,第一配体结合单位是fkbp12,并且第三配体结合单位是fkbp12v36。在某些实施方案中,第一配体是雷帕霉素或雷帕霉素类似物,并且第二配体是瑞米达西(ap1903)。诸如fkbp12/frb、frb/fkbp12和fkbp12v36的多聚化区可位于促细胞凋亡多肽或共刺激多肽的氨基末端,或者在其他示例中可位于促细胞凋亡多肽或共刺激多肽的羧基末端。另外的多肽,例如接头多肽、主干多肽、间隔物多肽,或在一些示例中,标志物多肽可位于嵌合多肽中的多聚化区和促细胞凋亡多肽或共刺激多肽之间。因此,在一些实施方案中提供了修饰细胞,其包含编码嵌合促细胞凋亡多肽的第一多核苷酸,其中所述嵌合促细胞凋亡多肽包含(i)促细胞凋亡多肽区;(ii)fkbp12-雷帕霉素结合(frb)结构域多肽或frb变体多肽区;和(iii)fkbp12或fkbp12变体多肽区(fkbp12v);和编码嵌合共刺激多肽的第二多核苷酸,其中所述嵌合共刺激多肽包含一个或多个(例如1、2或3个)fkbp12变体多肽区,和i)myd88多肽区或缺少tir结构域的截短的myd88多肽区;或ii)myd88多肽区或缺少tir结构域的截短的myd88多肽区和缺少cd40胞外结构域的cd40胞质多肽区。在一些实施方案中,修饰细胞进一步包含编码嵌合抗原受体或重组t细胞受体的第三多核苷酸。在一些实施方案中还提供了一种核酸,其包含可操作地连接到以下的启动子:编码嵌合促细胞凋亡多肽的第一多核苷酸,其中所述嵌合促细胞凋亡多肽包含(i)促细胞凋亡多肽区;(ii)fkbp12-雷帕霉素结合(frb)结构域多肽或frb变体多肽区;和(iii)fkbp12或fkbp12变体多肽区(fkbp12v);和编码嵌合共刺激多肽的第二多核苷酸,其中所述嵌合共刺激多肽包含一个或多个(例如1、2或3个)fkbp12变体多肽区,和i)myd88多肽区或缺少tir结构域的截短的myd88多肽区;或ii)myd88多肽区或缺少tir结构域的截短的myd88多肽区和缺少cd40胞外结构域的cd40胞质多肽区。在一些实施方案中,嵌合共刺激多肽包含缺少tir结构域的截短的myd88多肽区和缺少cd40胞外结构域的cd40胞质多肽区。在一些实施方案中,启动子可操作地连接到第三多核苷酸,其中所述第三多核苷酸编码嵌合抗原受体或重组t细胞受体。在一些实施方案中,促细胞凋亡多肽是胱天蛋白酶-9多肽,其中所述胱天蛋白酶-9多肽缺少card结构域。在一些实施方案中,细胞是t细胞、肿瘤浸润性淋巴细胞、nk-t细胞或nk细胞。在一些实施方案中还提供了试剂盒或组合物,其包含核酸,所述核酸包含编码嵌合促细胞凋亡多肽的第一多核苷酸,其中所述嵌合促细胞凋亡多肽包含(i)促细胞凋亡多肽区;(ii)fkbp12-雷帕霉素结合(frb)结构域多肽区或其变体;和(iii)fkbp12多肽或fkbp12变体多肽区(fkbp12v);和编码嵌合共刺激多肽的第二多核苷酸,其中所述嵌合共刺激多肽包含一个或多个(例如1、2或3个)fkbp12变体多肽区,和i)myd88多肽区或缺少tir结构域的截短的myd88多肽区;或ii)myd88多肽区或缺少tir结构域的截短的myd88多肽区,和缺少cd40胞外结构域的cd40胞质多肽区。在一些实施方案中,提供用于表达嵌合促细胞凋亡多肽的方法,其中所述嵌合促细胞凋亡多肽包含促细胞凋亡多肽区;frb多肽或frb变体多肽区;和本实施方案的fkbp12多肽区,所述方法包括在一定条件下使本实施方案的核酸与细胞接触,在所述条件下将所述核酸掺入所述细胞中,由此所述细胞从所述掺入的核酸表达所述嵌合促细胞凋亡多肽。在一些实施方案中,提供用于刺激受试者中的免疫应答的方法,其包括:将本实施方案的修饰细胞移植到所述受试者中,和在(a)之后,施用有效量的结合所述嵌合共刺激多肽的所述fkbp12变体多肽区的配体以刺激细胞介导的免疫应答。在一些实施方案中,提供了用于向已经历使用修饰细胞进行细胞疗法的受试者施用配体的方法,其包括向所述人受试者施用结合嵌合共刺激多肽的fkbp变体区的配体,其中所述修饰细胞包括本实施方案的修饰细胞。还提供了用于治疗患有与由靶细胞表达的靶抗原表达升高相关的疾病或病况的受试者的方法,其包括a)将有效量的修饰细胞移植到所述受试者中;其中所述修饰细胞包括本实施方案的修饰细胞,其中所述修饰细胞包含嵌合抗原受体或重组t细胞受体,所述嵌合抗原受体或重组t细胞受体包含结合所述靶抗原的抗原识别部分,和b)在a)之后,施用有效量的结合所述嵌合共刺激多肽的所述fkbp12变体多肽区的配体,以降低所述受试者中靶抗原或靶细胞的数目或浓度。还提供了用于减小受试者中的肿瘤大小的方法,其包括a)向所述受试者施用本实施方案的修饰细胞,其中所述细胞包含嵌合抗原受体或重组t细胞受体,所述嵌合抗原受体或重组t细胞受体包含结合所述肿瘤上的抗原的抗原识别部分;和b)在a)之后,施用有效量的结合所述嵌合共刺激多肽的所述fkbp12变体多肽区的配体,以减小所述受试者中所述肿瘤的大小。还提供了用于控制受试者中移植的修饰细胞的存活的方法,其包括将本实施方案的修饰细胞移植到所述受试者中;和以有效杀伤至少30%表达所述嵌合促细胞凋亡多肽的所述修饰细胞的量,向所述受试者施用结合所述促细胞凋亡多肽的所述frb多肽或frb变体多肽区的雷帕霉素或雷帕霉素类似物。在其他实施方案中,提供了修饰细胞,其包含编码嵌合促细胞凋亡多肽的第一多核苷酸,其中所述嵌合促细胞凋亡多肽包含i)促细胞凋亡多肽区;和ii)fkbp12变体多肽区;和编码嵌合共刺激多肽的第二多核苷酸,其中所述嵌合共刺激多肽包含fkbp12-雷帕霉素结合(frb)结构域多肽或frb变体多肽区;fkbp12多肽或fkbp12变体多肽区;和myd88多肽区或缺少tir结构域的截短的myd88多肽区、或myd88多肽区或缺少tir结构域的截短的myd88多肽区和缺少cd40胞外结构域的cd40胞质多肽区。在一些实施方案中,嵌合共刺激多肽包含缺少tir结构域的截短的myd88多肽区和缺少cd40胞外结构域的cd40胞质多肽区。在一些实施方案中,细胞进一步包含第三多核苷酸,其中所述第三多核苷酸编码嵌合抗原受体或重组t细胞受体。在一些实施方案中,提供了核酸,其中所述核酸包含可操作地连接到以下的启动子:编码嵌合促细胞凋亡多肽的第一多核苷酸,其中所述嵌合促细胞凋亡多肽包含i)促细胞凋亡多肽区;和ii)fkbp12变体多肽区;和编码嵌合共刺激多肽的第二多核苷酸,其中所述嵌合共刺激多肽包含i)fkbp12-雷帕霉素结合(frb)结构域多肽或frb变体多肽区;ii)fkbp12多肽区;和iii)myd88多肽区或缺少tir结构域的截短的myd88多肽区、或myd88多肽区或缺少tir结构域的截短的myd88多肽区和缺少cd40胞外结构域的cd40胞质多肽区。在一些实施方案中,嵌合共刺激多肽包含缺少tir结构域的截短的myd88多肽区和缺少cd40胞外结构域的cd40胞质多肽区。在一些实施方案中,启动子可操作地连接到第三多核苷酸,其中所述第三多核苷酸编码嵌合抗原受体或重组t细胞受体。在一些实施方案中,促细胞凋亡多肽是胱天蛋白酶-9多肽,其中所述胱天蛋白酶-9多肽缺少card结构域。在一些实施方案中,细胞是t细胞、肿瘤浸润性淋巴细胞、nk-t细胞或nk细胞。还提供了包含含有本实施方案的多核苷酸的核酸的试剂盒或组合物。还提供了用于表达嵌合促细胞凋亡多肽和嵌合共刺激多肽的方法,其中a)所述嵌合促细胞凋亡多肽包含i)促细胞凋亡多肽区;和ii)fkbp12变体多肽区;并且b)所述嵌合共刺激多肽包含frb或frb变体多肽区;fkbp12多肽区;和myd88多肽区或缺少tir结构域的截短的myd88多肽区、或myd88多肽区或缺少tir结构域的截短的myd88多肽区和缺少cd40胞外结构域的cd40胞质多肽区,所述方法包括在一定条件下使核酸与细胞接触,在所述条件下将所述核酸掺入所述细胞中,由此所述细胞从所述掺入的核酸表达所述嵌合促细胞凋亡多肽和所述嵌合共刺激多肽,所述核酸包含可操作地连接到编码嵌合促细胞凋亡多肽的多核苷酸的启动子,其中所述嵌合促细胞凋亡多肽包含a)促细胞凋亡多肽区;b)fkbp12-雷帕霉素结合结构域(frb)多肽或frb变体多肽区;和c)fkbp12变体多肽区。在一些实施方案中,提供刺激受试者中的免疫应答的方法,其包括:a)将本实施方案的修饰细胞移植到所述受试者中,和b)在(a)之后,施用有效量的结合所述嵌合刺激多肽的所述frb多肽或frb变体多肽区的雷帕霉素或雷帕霉素类似物以刺激细胞介导的免疫应答。在一些实施方案中,提供了向已经历使用修饰细胞进行细胞疗法的受试者施用配体的方法,其包括向所述受试者施用雷帕霉素或雷帕霉素类似物,其中所述修饰细胞包括本实施方案的修饰细胞。在一些实施方案中,提供了用于治疗患有与由靶细胞表达的靶抗原表达升高相关的疾病或病况的受试者的方法,其包括a)将有效量的修饰细胞移植到所述受试者中;其中所述修饰细胞包括本实施方案的修饰细胞,其中所述修饰细胞包含嵌合抗原受体或重组t细胞受体,所述嵌合抗原受体或重组t细胞受体包含结合所述靶抗原的抗原识别部分,和b)在a)之后,施用有效量的结合所述嵌合刺激多肽的所述frb多肽或frb变体区的雷帕霉素或雷帕霉素类似物,以降低所述受试者中靶抗原或靶细胞的数目或浓度。在一些实施方案中,提供了用于减小受试者中的肿瘤大小的方法,其包括a)向所述受试者施用本实施方案的修饰细胞,其中所述细胞包含嵌合抗原受体或重组t细胞受体,所述嵌合抗原受体或重组t细胞受体包含结合所述肿瘤上的抗原的抗原识别部分;和b)在a)之后,施用有效量的结合所述嵌合刺激多肽的所述fkb或fkb变体多肽区的雷帕霉素或雷帕霉素类似物,以减小所述受试者中所述肿瘤的所述大小。在一些实施方案中,提供了用于控制受试者中移植的修饰细胞的存活的方法,其包括a)将本实施方案的修饰细胞移植到所述受试者中,和在(a)之后,以有效杀伤至少90%表达所述嵌合促细胞凋亡多肽的所述修饰细胞的量,向所述受试者施用结合所述促细胞凋亡多肽的所述fkbp12变体多肽区的配体。在本申请的一些实施方案中,嵌合共刺激多肽包含两个fkbp12变体多肽区和缺少tir结构域的截短的myd88多肽区。在一些实施方案中,嵌合共刺激多肽进一步包含缺少cd40胞外结构域的cd40胞质多肽区。在本申请的一些实施方案中,嵌合共刺激多肽包含2个fkbp12变体多肽区。在本申请中还提供了一种核酸,其包含可操作地连接到编码嵌合促细胞凋亡多肽的多核苷酸的启动子,其中所述嵌合促细胞凋亡多肽包含a)促细胞凋亡多肽区;b)fkbp12-雷帕霉素结合结构域(frb)多肽或frb变体多肽区;和c)fkbp12变体多肽区。在一些实施方案中,其中fkbp12变体包含氨基酸残基36处的氨基酸取代。在一些实施方案中,fkbp12变体多肽区是fkbp12v36多肽区。在一些实施方案中,frb变体多肽区选自由klw(t2098l)(frbl)、ktf(w2101f)和klf(t2098l、w2101f)组成的组。在一些实施方案中,提供了由本实施方案的核酸编码的嵌合促细胞凋亡多肽。在一些实施方案中,提供了用本实施方案的核酸转染或转导的修饰细胞。在一些实施方案中,修饰细胞包含编码嵌合抗原受体或重组tcr的多核苷酸。在一些实施方案中,提供了控制受试者中移植的修饰细胞的存活的方法,其包括:a)移植本实施方案的修饰细胞,其中所述修饰细胞包含一种核酸,所述核酸包含可操作地连接到编码嵌合促细胞凋亡多肽的多核苷酸的启动子,其中所述嵌合促细胞凋亡多肽包含a)促细胞凋亡多肽区;b)fkbp12-雷帕霉素结合结构域(frb)多肽或frb变体多肽区;和b)在(a)之后,向所述受试者施用i)第一配体,所述第一配体结合所述嵌合促细胞凋亡多肽的所述frb或frb变体多肽区;或ii)第二配体,其结合所述嵌合促细胞凋亡多肽的所述fkbp12变体多肽区,其中所述第一配体或所述第二配体以有效杀伤至少30%表达所述嵌合促细胞凋亡多肽的所述修饰细胞的量施用。表达针对肿瘤相关抗原(taa)的嵌合抗原受体(car)的自体t细胞在初始临床试验中对某些类型的白血病(“液体瘤”)和淋巴瘤的治疗具有转化作用,客观应答(or)率接近90%。尽管它们具有很大的临床前景和可预测的伴随热情,但这一成功被观察到的高水平的中靶、脱肿瘤(off-tumor)不良事件(细胞因子释放综合征(crs)的特征)减弱。为了维持这些革命性治疗的益处,同时将风险降到最低,已开发出可调谐安全开关,以控制表达car的t细胞的活性水平。诱导型共刺激嵌合多肽允许在细胞中共表达的嵌合抗原受体(car)的持续调节控制。配体诱导物通过使诱导型嵌合信号传导分子多聚化而活化表达car的细胞,其进而诱导nf-κb和其他胞内信号传导途径,导致靶细胞(例如t细胞、肿瘤浸润性淋巴细胞(til)、自然杀伤(nk)细胞或天然杀伤t(nk-t)细胞)的活化。在不存在配体诱导剂的情况下,t细胞是静息的,或具有基础水平的活性。在第二水平的控制下,“衰减器(dimmer)”开关可允许继续的细胞疗法,同时根据需要通过从受试者中消除治疗性细胞来降低或消除显著的副作用。该衰减器开关取决于第二个配体诱导物。在一些示例中,在需要快速消除治疗性细胞的情况下,施用适当剂量的第二配体诱导物以从患者中消除超过90%或95%的治疗性细胞。该第二水平的控制可以是“可调的”,即,可控制治疗性细胞的去除水平,使得其导致治疗性细胞的部分去除。该第二水平的控制可包括例如嵌合促细胞凋亡多肽。在一些示例中,嵌合细胞凋亡多肽包含用于雷帕霉素或雷帕霉素类似物的结合位点;还存在于治疗性细胞中的是诱导型嵌合多肽,其在被配体诱导物诱导后活化治疗性细胞;在一些示例中,诱导型嵌合多肽向治疗性细胞提供共刺激活性。car可存在于细胞中表达的单独的多肽上。在其他示例中,car可作为与诱导型嵌合多肽相同的多肽的一部分存在。使用该可控的第一水平,可使继续疗法的需要或刺激疗法的需要与消除或降低负面副作用的水平的需要平衡。在一些实施方案中,向患者施用雷帕霉素类似物,该雷帕霉素类似物然后结合胱天蛋白酶多肽和嵌合抗原受体两者,从而将胱天蛋白酶多肽募集到car的位置,并且聚集胱天蛋白酶多肽。在聚集之后,胱天蛋白酶多肽诱导细胞凋亡。向患者施用的雷帕霉素或雷帕霉素类似物的量可变化;如果期望通过细胞凋亡去除更低水平的细胞以降低副作用并继续car治疗,则可向所述患者施用更低水平的雷帕霉素或雷帕霉素类似物。在第二个水平的治疗性细胞消除中,可在表达融合到二聚体配体结合多肽(例如ap1903结合多肽fkbp12v36)的嵌合胱天蛋白酶-9多肽的细胞中通过施用瑞米达西(ap1903)来诱导选择性细胞凋亡。在一些示例中,与野生型胱天蛋白酶-9多肽相比,所述胱天蛋白酶-9多肽包含作为诱导型嵌合多肽一部分的导致更低水平的基础细胞凋亡活性的氨基酸取代。在一些实施方案中,编码本申请的嵌合多肽的核酸进一步包含编码嵌合抗原受体、t细胞受体或基于t细胞受体的嵌合抗原受体的多核苷酸。在一些实施方案中,嵌合抗原受体包含(i)跨膜区、(ii)t细胞活化分子和(iii)抗原识别部分。还提供了用本文所讨论的核酸转染或转导的修饰细胞。在本申请的一些方面,用病毒载体转导或转染细胞。病毒载体可以是例如但不限于逆转录病毒载体,例如但不限于鼠白血病病毒载体;sf载体;和腺病毒载体、或慢病毒载体。在一些实施方案中,将细胞分离。在一些实施方案中,细胞在人受试者中。在一些实施方案中,将细胞移植于人受试者中。在一些实施方案中,提供了个性化治疗,其中在施用多聚体配体之前,在施用额外剂量的多聚体配体之前,或在确定施用多聚体配体所涉及的方法或剂量之前,确定疾病或病况的分期或水平。这些方法可用于本申请的任何疾病或病况的任何方法中。在移植物抗宿主病的背景下讨论在施用配体之前评估患者的这些方法的情况下,应理解这些方法可类似地被应用于治疗其他病况和疾病。因此,例如,在本申请的一些实施方案中,所述方法包括向患者施用治疗性细胞,并且进一步包括在鉴别所述患者中存在或不存在需要从所述患者中去除转染或转导的治疗性细胞的病况;以及基于在所述患者中鉴别的所述病况的存在或不存在,施用结合所述多聚化区的多聚体配体,维持给所述患者的所述多聚体配体的后续剂量,或调整给所述患者的所述多聚体配体的后续剂量。并且,例如,在本申请的其他实施方案中,所述方法进一步包括基于患者中移植物抗宿主病症状的出现来确定是否向所述患者施用一个额外剂量或多个额外剂量的多聚体配体。在一些实施方案中,所述方法进一步包括在所述患者中鉴别移植物抗宿主病的存在、不存在或分期,以及基于在所述患者中鉴别的所述移植物抗宿主病的所述存在、不存在或分期,施用结合所述多聚化区的多聚体配体,维持给所述患者的所述多聚体配体的后续剂量,或调整给所述患者的所述多聚体配体的后续剂量。在一些实施方案中,所述方法进一步包括在所述患者中鉴别移植物抗宿主病的存在、不存在或分期,以及基于在所述患者中鉴别的所述移植物抗宿主病的所述存在、不存在或分期,确定是应向所述患者施用结合所述多聚化区的多聚体配体,还是调整向所述患者后续施用的所述多聚体配体的所述剂量。在一些实施方案中,所述方法进一步包括接收包含所述患者中移植物抗宿主病的存在、不存在或分期的信息;以及基于在所述患者中鉴别的所述移植物抗宿主病的所述存在、不存在或分期,施用结合所述多聚化区的多聚体配体,维持给所述患者的所述多聚体配体的后续剂量,或调整给所述患者的所述多聚体配体的后续剂量。在一些实施方案中,所述方法进一步包括在所述患者中鉴别移植物抗宿主病的存在、不存在或分期,以及将所述移植物抗宿主病的所述存在、不存在或分期传送给决策者,所述决策者基于在所述受试者中鉴别的所述移植物抗宿主病的存在、不存在或分期,施用结合所述多聚化区的多聚体配体,维持向所述患者施用的所述多聚体配体的后续剂量,或调整向所述患者施用的所述多聚体配体的后续剂量。在一些实施方案中,所述方法进一步包括在所述患者中鉴别移植物抗宿主病的存在、不存在或分期,以及传送指示,以基于在所述受试者中鉴别的所述移植物抗宿主病的所述存在、不存在或分期,施用结合所述多聚化体结合区的多聚体配体,维持向所述患者施用的所述多聚体配体的后续剂量,或调整向所述患者施用的所述多聚体配体的后续剂量。还提供了用于向人患者施用供体t细胞的方法,其包括向人患者施用本申请的转导或转染的t细胞,其中所述细胞是非同种异体耗竭的人供体t细胞。在一些实施方案中,向患有非恶性病症的受试者施用治疗性细胞,或者其中所述受试者已被诊断患有非恶性病症,例如原发性免疫缺陷病症(例如但不限于严重联合免疫缺陷(scid)、联合免疫缺陷(cid)、先天性t细胞缺陷/缺乏、普通变异型免疫缺陷(cvid)、慢性肉芽肿病、ipex(免疫缺陷、多内分泌腺病、肠病、x连锁)或ipex样病、威斯科特-奥尔德里奇综合征(wiskott-aldrichsyndrome)、cd40配体缺陷、白细胞粘附缺陷、dock8缺陷、il-10缺陷/il-10受体缺陷、gata2缺陷、x连锁淋巴组织增生性疾病(xlp)、软骨毛发发育不全等)、嗜血细胞性淋巴组织细胞增生症(hemophagocytosislymphohistiocytosis)(hlh)或其他噬血细胞性病症、遗传性骨髓衰竭病症(例如但不限于舒-戴二氏综合征(shwachmandiamondsyndrome)、戴-布二氏贫血(diamondblackfananemia)、先天性角化不良、范科尼贫血(fanconianemia)、先天性中性粒细胞减少等)、血红蛋白病(例如但不限于镰状细胞病、地中海贫血等)、代谢病症(例如但不限于粘多糖贮积症、鞘脂类代谢障碍等)或破骨细胞病症(例如但不限于骨硬化病)。治疗性细胞可以是例如向患者施用以获得期望治疗结果的任何细胞。细胞可以是例如t细胞、自然杀伤细胞、b细胞、巨噬细胞、外周血细胞、造血祖细胞、骨髓细胞或肿瘤细胞。修饰的胱天蛋白酶-9多肽还可用于直接杀伤肿瘤细胞。在一种应用中,将包含编码诱导型修饰的胱天蛋白酶-9多肽的多核苷酸的载体注射到肿瘤中,并且在10-24小时(以允许蛋白质表达)之后,将施用配体诱导物(例如ap1903)以触发细胞凋亡,使肿瘤抗原释放到微环境中。为了进一步改善肿瘤微环境以使其更具免疫原性,可将治疗与一种或多种佐剂(例如,il-12、tlr、ido抑制剂等)组合。在一些实施方案中,可递送所述细胞以治疗实体瘤,例如将所述细胞递送到肿瘤床。在一些实施方案中,编码嵌合胱天蛋白酶-9多肽的多核苷酸可作为疫苗的一部分或通过直接递送到肿瘤床来施用,从而导致嵌合胱天蛋白酶-9多肽在肿瘤细胞中表达,之后在施用配体诱导物后引起肿瘤细胞的细胞凋亡。因此,在一些实施方案中还提供了核酸疫苗,例如dna疫苗,其中所述疫苗包含核酸,所述核酸包含编码本申请的诱导型或修饰的诱导型胱天蛋白酶-9多肽的多核苷酸。可向受试者施用疫苗,从而在体内转化或转导靶细胞。然后依照本申请的方法施用配体诱导剂。在一些实施方案中,修饰的胱天蛋白酶-9多肽是截短的修饰的胱天蛋白酶-9多肽。在一些实施方案中,修饰的胱天蛋白酶-9多肽缺少胱天蛋白酶募集结构域。在一些实施方案中,胱天蛋白酶-9多肽包含seqidno:9的氨基酸序列或其片段,或者由seqidno:8的核苷酸序列或其片段编码。在一些实施方案中,所述方法进一步包括施用结合多聚体配体结合区的多聚体配体。在一些实施方案中,多聚体配体结合区选自由以下组成的组:fkbp、亲环蛋白受体、类固醇受体、四环素受体、重链抗体亚基、轻链抗体亚基、包含由柔性接头结构域隔开的串联的重链可变区和轻链可变区的单链抗体、以及其突变序列。在一些实施方案中,多聚体配体结合区是fkbp12区。在一些实施方案中,多聚体配体是fk506二聚体或二聚体fk506-样类似物配体。在一些实施方案中,多聚体配体是ap1903。在一些实施方案中,在施用多聚体配体之后,治疗性细胞的数目减少约60%到99%、约70%到95%、80%到90%或约90%或更多。在一些实施方案中,在施用多聚体配体之后,供体t细胞在患者中存活,所述供体t细胞能够扩增并且对病毒和真菌具有反应性。在一些实施方案中,在施用多聚体配体之后,供体t细胞在患者中存活,所述供体t细胞能够扩增并对患者中的肿瘤细胞具有反应性。在一些实施方案中,用于第二水平控制中的自杀基因是胱天蛋白酶多肽,例如胱天蛋白酶1、胱天蛋白酶2、胱天蛋白酶3、胱天蛋白酶4、胱天蛋白酶5、胱天蛋白酶6、胱天蛋白酶7、胱天蛋白酶8、胱天蛋白酶9、胱天蛋白酶10、胱天蛋白酶11、胱天蛋白酶12、胱天蛋白酶13或胱天蛋白酶14。在某些实施方案中,胱天蛋白酶多肽是胱天蛋白酶-9多肽。在某些实施方案中,胱天蛋白酶-9多肽包含本文表5或6中所提供的催化活性(非催化性死亡)胱天蛋白酶变体多肽的氨基酸序列。在其他实施方案中,胱天蛋白酶-9多肽由本文表5或6中所提供的催化活性(非催化性死亡)胱天蛋白酶变体多肽的氨基酸序列组成。在其他实施方案中,可使用在不存在配体诱导物的情况下具有较低基础活性的胱天蛋白酶多肽。例如,当被包含作为嵌合诱导型胱天蛋白酶多肽的一部分时,某些修饰的胱天蛋白酶-9多肽可在嵌合构建体中具有与野生型胱天蛋白酶-9相比更低的基础活性。例如,修饰的胱天蛋白酶-9多肽可包含与seqidno:9具有至少90%序列同一性的氨基酸序列,并且可包含至少一个氨基酸取代。在以下描述、实施例、权利要求和附图中进一步描述了某些实施方案。附图简要说明附图图释说明了本技术的实施方案,且不具有限制性。为了清楚和易于说明,附图不是按比率绘制的,并且在一些情况下,各个方面可被渲染或放大显示,以便于理解特定实施方案。图1a图释说明如本文所讨论的各种icasp9表达载体。图1b图释说明由图1a中所示表达载体产生的全长和截短的胱天蛋白酶-9蛋白质的代表性蛋白质印迹(westernblot)。图2是自杀基因产物和cid相互作用以引起细胞凋亡的示意图。图3是描绘细胞凋亡的双重调控的示意图。左侧部分描绘了雷帕霉素类似物介导的诱导型胱天蛋白酶多肽向frbi修饰的car的募集。右侧部分描绘了瑞米达西(ap1903)介导的诱导型胱天蛋白酶多肽。图4是编码frbl修饰的cd19-mc-car和诱导型胱天蛋白酶-9的载体psfg-icasp9-2a-cd19-q-cd28stm-mcz-frbl2的质粒图谱。图5是编码frbl修饰的her2-mc-car和诱导型胱天蛋白酶-9多肽的载体psfg-icasp9-2a-aher2-q_cd28stm-mmcz-frbl2的质粒图谱。图6a和图6b提供了细胞凋亡的双重活化测定结果。图6a显示用雷帕霉素对诱导型胱天蛋白酶-9多肽(ic9)的募集,导致更平缓的细胞凋亡滴定。图6b显示使用瑞米达西(ap1903)的完全细胞凋亡。图7是pbp0545载体pbp0545.psfg.icasp9.2a.her2scfv.q.cd8stm.mc-ζ的质粒图谱。图8a-8c图释说明基于frb或fkbp12的支架可使信号传导结构域多聚化。图8a.如同胱天蛋白酶-9,信号传导结构域(红色棒)的同二聚化可通过异二聚体实现,该异二聚体一侧结合frb融合的信号传导结构域并且另一侧结合fkbp12融合的结构域。图8b.通过frb(v形)的2个(左)或更多个(右)串联拷贝使信号传导结构域二聚化或多聚化。支架可包含亚细胞靶向序列以将蛋白质定位于质膜(如所描绘的)、细胞核或细胞器。图8c.类似于图8b,但结构域极性相反。图9a-9c提供了frbl2.胱天蛋白酶-9的由imc介导的搭支架(scaffolding)的示意图。图9a.在存在异二聚体药物(例如雷帕霉素)的情况下,frbl2连接的胱天蛋白酶-9与fkbp修饰的myd88/cd40(mc)信号传导分子结合并成簇。这种成簇效应导致frbl2.胱天蛋白酶-9的二聚化和随后通过细胞凋亡途径对细胞死亡的诱导。图9b.类似于图9a,然而,fkbp和frb结构域已关于相关的胱天蛋白酶-9和mc结构域被转换。在存在异二聚体药物的情况下仍然发生成簇效应。图9c.与图9a相似;然而只存在一个附接到mc的fkbp结构域。因此,在存在异二聚体的情况下,胱天蛋白酶-9不再能够成簇,因此不诱导细胞凋亡。图10a-10e提供了雷帕霉素类似物诱导的基于frb支架的诱导型胱天蛋白酶-9多肽的示意图。图10a:瑞米达西将fkbpv-连接的胱天蛋白酶-9同二聚化,导致胱天蛋白酶-9的二聚化和活化,随后通过细胞凋亡途径诱导细胞死亡。图10b:雷帕霉素类似物将fkbpv连接的胱天蛋白酶-9与frb连接的胱天蛋白酶-9异二聚化,导致胱天蛋白酶-9的二聚化和细胞死亡。图10c、图10d、图10e是图释说明在存在异二聚体药物(例如雷帕霉素)的情况下,2个或更多个frbl结构域充当支架以募集fkbpv连接的胱天蛋白酶-9的结合,从而导致胱天蛋白酶-9的二聚化或寡聚和细胞死亡的示意图。图11a是描绘通过用雷帕霉素将嵌合frb-胱天蛋白酶-9多肽和嵌合fkbp-胱天蛋白酶-9多肽(frbl-δ胱天蛋白酶-9和fkbpv-δ胱天蛋白酶-9)二聚化来活化细胞凋亡的示意图,并且图11b是描绘通过用雷帕霉素将嵌合frb-胱天蛋白酶-9多肽和嵌合fkbp-胱天蛋白酶-9多肽(frbl-δ胱天蛋白酶-9和fkbpv-δ胱天蛋白酶-9)二聚化来活化细胞凋亡的线图。图11a.用雷帕霉素将frb和fkbp12二聚化以将融合的胱天蛋白酶-9信号传导结构域聚集在一起并将细胞凋亡的活化的示意性图示。图11b.在用组成型srα-seap报告子(pbp046,1μg)、frbl(l2098)和人δ胱天蛋白酶-9的融合物(pbp0463,2μg)以及fkbp12与δ胱天蛋白酶-9的融合物(pbp0044,2μg)转染的hek-293t细胞中进行报告子测定。图12a是描绘在基于frb的支架上组装fkbp-胱天蛋白酶-9的示意图,并且图12b和图12c是描绘在基于frb的支架上组装fkbp-胱天蛋白酶-9的线图。图12a:为雷帕霉素(或雷帕霉素类似物)介导的fkbp12-胱天蛋白酶-9融合蛋白质的多聚化提供支架的重复的frb结构域的示意图。图12b:用组成型srα-seap报告质粒(pbp0046,1μg)、人fkbp12与人胱天蛋白酶-9的融合物(pbp0044,2μg)和含有frbl的四个拷贝的编码frb的表达构建体(pbp0725,2μg)或编码frbl的零个拷贝或一个拷贝的对照载体转染(通过genejuice,novagen)hek-293细胞的培养物。在转染后24小时,将细胞分布到96孔板中,并且一式三份于孔中施用对突变体frbl具有特异性的雷帕霉素或衍生物雷帕霉素类似物c7-异丙氧基雷帕霉素(liberles等,1997)。在药物施用之后24小时确定胎盘seap报告子活性。图12c:如(b)中进行报告子测定,但frb-支架是从编码具有氨基端肉豆蔻酰化靶向序列的重复frbl结构域以及frbl结构域的两个(pbp0465)或四个拷贝(pbp0721)的构建体表达的。图13a是描绘在fkbp支架上组装frb-δ胱天蛋白酶-9的示意图,并且图13b是描绘在fkbp支架上组装frb-δ胱天蛋白酶-9的线图。图13a.产生用于组装雷帕霉素(或雷帕霉素类似物)介导的frb-δ胱天蛋白酶-9融合蛋白质多聚化从而导致细胞凋亡的支架的重复的fkbp12结构域的示意图。图13b.如图12b和图12c中用hek-293t细胞的培养物进行报告子测定,所述hek-293t细胞用组成型srα-seap报告子(pbp046,1μg)、frbl(l2098)和card结构域缺失的人δ胱天蛋白酶-9的融合物(pbp0463,2μg)以及含有fkbp12的四个串联拷贝的fkbp表达构建体(pbp722,2μg)或具有fkbp的一个拷贝的对照载体(ps-sf1e)转染。图14a-14b提供了显示frbl支架与i胱天蛋白酶9的异二聚化诱导细胞死亡的线图。用分别含有ic9、cd19标志物和frbl的0-3个串联拷贝的pbp0220--psfg-ic9.t2a-δcd19、pbp0756—psfg-ic9.t2a-δcd19.p2a-frbl、pbp0755—psfg-ic9.t2a-δcd19.p2a-frbl2或pbp0757—psfg-ic9.t2a-δcd19.p2a-frbl3转导来自三个不同供体(307、582、584)的原代t细胞。将t细胞与不同浓度的雷帕霉素一起平铺,并且在24小时和48小时之后收获细胞等分试样,用apc-cd19抗体染色并通过流式细胞术分析。通过fsc相对于ssc首先在活淋巴细胞上对细胞进行门控。然后将淋巴细胞绘制为cd19直方图,并在cd19+门内针对高、中和低表达进行亚门控。线图表示表达高水平cd19的总细胞群体的相对百分比,归一化为无“0”药物对照。所有数据点都以一式两份完成。图14a:供体307,24hr;图14b:供体582,24hr;图14c:供体584,24hr;图14d:供体582,48hr;图14e:供体584,48hr。图15a-15c提供了显示雷帕霉素在存在串联的frbl结构域的情况下诱导ic9杀伤的线图和示意图。用1μgsrα-seap组成型报告质粒连同阴性(neg)对照、egfp(pbp0047)、单独的ic9(ic9/pbp0044)或ic9连同imc.frbl(pbp0655)+抗-her2.car.fpk2(pbp0488)或imc.frbl2(pbp0498)+抗-her2.car.fpk2转染hek-293细胞。然后将细胞与瑞米达西或雷帕霉素的半对数稀释物一起平铺,并如先前所述测定seap。seap活性的降低与细胞消除相关。示意图代表一种可能的雷帕霉素介导的信号传导结构域的复合物,所述结构域导致胱天蛋白酶-9成簇和细胞凋亡。图15a:瑞米达西;图15b:雷帕霉素;图15c:示意图。图16a和图16b是显示串联fkbp支架在存在雷帕霉素类似物的情况下介导frbl2.胱天蛋白酶活化的线图。图16a.用各1μg的srα-seap报告质粒、δmyr.imc.2a-抗cd19.car.cd3ζ(pbp0608)和frbl2.胱天蛋白酶-9(pbp0467)转染hek-293细胞。在24小时之后,收获转染的细胞并用不同浓度的瑞米达西、雷帕霉素或雷帕霉素类似物c7-异丙氧基(isop)-雷帕霉素处理。在on孵育之后,如先前所述,测定细胞上清液的seap活性。图16b.类似于(图16a)中所述的实验,不同之处在于用膜定位(肉豆蔻酰化的)imc.2a-cd19.car.cd3ζ(pbp0609)、而不是非肉豆蔻酰化的δmyr.imc.2a-cd19.car.cd3ζ(pbp0608)转染细胞。图17a-17e提供了线图和fac分析的结果,其显示imc“开关”fkbp2.myd88.cd40在存在雷帕霉素的情况下产生用于frbl2.胱天蛋白酶9的支架,诱导细胞死亡。图17a.用γ-rv、sfg-δmyr.imc.2a-cd19(来自pbp0606)和sfg-frbl2.胱天蛋白酶9.2a-q.8stm.ζ(来自pbp0668))转导原代t细胞(2个供体)。将细胞与雷帕霉素的5倍稀释物一起平铺。在24小时之后,收获细胞并通过流式细胞术分析imc(抗cd19-apc)、胱天蛋白酶-9(抗cd34-pe)的表达和t细胞特性(identity)(抗cd3-percpcy5.5)。首先通过fsc相对于ssc门控细胞的淋巴细胞形态,之后门控cd3表达(约99%的淋巴细胞)。绘制cd3+淋巴细胞的cd19(δmyr.imc.2a-cd19)相对于cd34(frbl2.胱天蛋白酶9.2a-q.8stm.ζ)的表达。为了使门控群体归一化,将每个样品内cd34+cd19+细胞的百分比除以cd19+cd34-细胞百分比作为内部对照。然后将这些值归一化为设定为100%的用于每次转导的无药物孔。在cd34+cd19+门内对hi-表达的细胞、med-表达的细胞和lo-表达的细胞应用类似分析。图17b.如何针对细胞的hi-表达、med-表达和lo-表达门控的代表性示例。图17c.最终的cd34门相对于cd19门的代表性散点图。随着雷帕霉素的增加,cd34+cd19+细胞%降低,指示细胞消除。图17d和图17e.用δmyr.imc.2a-cd19(pbp0606)或frbl2.胱天蛋白酶9.2a-q.8stm.ζ(pbp0668)转导来自单个供体的t细胞。将细胞连同不同量的雷帕霉素一起平铺在含有il-2的培养基中并保持24hr或48hr。如上收获细胞并分析。图18pbp0044:psh1-i胱天蛋白酶9wt的质粒图谱图19pbp0463--psh1-fpk-fpk’.ls.fpk”.fpk”’.ls.ha的质粒图谱图20pbp0725--psh1-frbl.frbl’.ls.frbl”.frbl”’的质粒图谱图21pbp0465--psh1-m-frbl.frbl’.ls.ha的质粒图谱图22pbp0721--psh1-m-frbl.frbl’.ls.frbl”.frbl”’ha的质粒图谱图23pbp0722--psh1-fpk-fpk’.ls.fpk”.fpk”’.ls.ha的质粒图谱图24pbp0220--psfg-ic9.t2a-δcd19的质粒图谱图25pbp0756--psfg-ic9.t2a-dcd19.p2a-frbl的质粒图谱图26pbp0755-psfg-ic9.t2a-dcd19.p2a-frbl2的质粒图谱图27pbp0757--psfg-ic9.t2a-dcd19.p2a-frbl3的质粒图谱图28pbp0655--psfg-δmyr.frbl.mc.2a-δcd19的质粒图谱图29pbp0498--psfg-δmyr.imc.frbl2.p2a-δcd19的质粒图谱图30pbp0488--psfg-aher2.q.8stm.cd3ζ.fpk2的质粒图谱图31pbp0467--psh1-frbl'.frbl.ls.δ胱天蛋白酶9的质粒图谱图32pbp0606--psfg-k-δmyr.imc.2a-δcd19的质粒图谱图33pbp0607--psfg-k-imc.2a-δcd19的质粒图谱图34:pbp0668--psfg-frblx2.胱天蛋白酶9.2a-q.8stm.cd3ζ的质粒图谱图35pbp0608--psfg-δmyr.imc.2a-δcd19.q.8stm.cd3ζ的质粒图谱图36pbp0609:psfg-imc.2a-δcd19.q.8stm.cd3ζ的质粒图谱图37a提供了结合嵌合胱天蛋白酶-9多肽的两个拷贝的瑞米达西的示意图,每个拷贝具有fkbp12多聚化区。图37b提供了结合两个嵌合胱天蛋白酶-9多肽的雷帕霉素的示意图,所述嵌合胱天蛋白酶-9多肽中的一个具有fkbp12多聚化区,并且另一个具有frb多聚化区。图37c提供了使用这些嵌合多肽的测定结果的图。图38a提供了结合两个嵌合胱天蛋白酶-9多肽的雷帕霉素或雷帕霉素类似物的示意图,所述嵌合胱天蛋白酶-9多肽中的一个具有fkbp12v36多聚化区,并且另一个具有frb变体(frbl)多聚化区。图38b提供了使用该嵌合多肽的测定结果的图。图39a提供了结合两个嵌合胱天蛋白酶-9多肽(每个均具有fkbp12v36多聚化区)的瑞米达西和结合具有fkbp12v36多聚化区的仅一个嵌合胱天蛋白酶-9多肽的雷帕霉素的示意图。图39b提供了比较瑞米达西和雷帕霉素的作用的测定结果的图。图40a提供了结合两个嵌合胱天蛋白酶-9多肽(每个均具有fkbp12v36多聚化区)的瑞米达西和在存在frb多聚化多肽的情况下结合具有fkbp12v36多聚化区的仅一个嵌合胱天蛋白酶-9多肽的雷帕霉素的示意图。图40b提供了使用这些多肽比较瑞米达西和雷帕霉素的作用的测定结果的图。图41提供了pbp0463.pfrbl.ls.dcasp9.t2a的质粒图谱。图42提供了pbp044-psh1.icasp9wt的质粒图谱。图43a-43c含有ifwtfrbc9或ifrbfwtc9(统称为irc9)的fwtfrbc9/mc.fvfv的示意图。在该形式的雷帕霉素诱导型嵌合促细胞凋亡多肽中,串联的fkbp.frb(或frb.fkbp)结构域融合到δ胱天蛋白酶-9。雷帕霉素或雷帕霉素类似物可诱导:1)通过融合到mc的两个fkbp结构域进行支架诱导的fkbp.frb.δc9(或frb.fkbp.δc9)二聚化;2)fkbp.frb.δc9(或frb.fkbp.δc9)的直接二聚化以诱导工程化的胱天蛋白酶-9融合蛋白质的多聚化。图44a-44cimc+carζ-t、i9+carζ+mc和fwtfrbc9/mc.fvfvt细胞的表达谱。将来自4个不同供体的pbmc活化并用含有imc+carζ-t(608)的载体、含有i9+carζ+mc(844)的载体和含有fwtfrbc9/mc.fvfv(1300)的载体转导。关于载体示意图,参见图48。(a)在转导后5天,用针对myd88、胱天蛋白酶-9和β-肌动蛋白(其用于证实所有泳道中相等的蛋白质加样量)的抗体对t细胞裂解物进行蛋白质印迹分析。注意,irc9与内源性胱天蛋白酶-9一样迁移,并且条带的增加强度表示irc9的水平。(b)用抗cd34-pe和抗cd3-percpcy5抗体转导后4天、7天、12天、21天和29天分析car表达。(c)使用cellometer和aopi存活力染料在转导后3天、5天、12天、21天和29天评估培养物中生长的细胞的t细胞存活力。图45a-45c雷帕霉素在fwtfrbc9/mc.fvfvt细胞中诱导稳健的细胞凋亡活化。将来自4个不同供体的pbmc活化并用含有imc+carζ-t(608)的载体、含有i9+carζ+mc(844)的载体和含有fwtfrbc9/mc.fvfv(1300)的载体转导。在转导之后5天,将t细胞接种到±瑞米达西、±雷帕霉素并且存在2μm胱天蛋白酶3/7绿色试剂的96孔板上。(a)将板置于incucyte内以实时监测绿色荧光,这反映被切割的胱天蛋白酶3/7试剂。(b)在48小时之后,将细胞用抗cd34-pe(fl2)pi(fl4)和膜联蛋白v-pacblue(fl9)染色,并且在galios细胞仪上在fl1通道中检测到切割的胱天蛋白酶3/7。(c)还在平铺之后48小时收集培养上清液,并且通过elisa分析il-2和il-6细胞因子的产生。图46a-46cq-lehd-oph有效地抑制由ic9和irc9诱导的胱天蛋白酶活化。将pbmc活化并用i9+carζ+mc(844)载体和fwtfrbc9/mc.fvfv(1300)载体转导。在转导后7天,将t细胞接种在96孔板上,在所述孔板中:(a)具有增加的瑞米达西/雷帕霉素浓度,(b)具有增加的q-lehd-oph浓度,和(c)具有20nm的瑞米达西/雷帕霉素和增加的q-lehd-oph浓度。另外,添加2μm胱天蛋白酶3/7绿色试剂以通过incucyte监测胱天蛋白酶切割。图47a-47dfrbl和胱天蛋白酶-9n405q突变体降低irc9活性。将pbmc活化并用质粒1300、质粒1308、质粒1316和质粒1317转导。在转导之后5天,将t细胞接种到具有0(a)、0.8(b)、4(c)和20nm(d)雷帕霉素的96孔板上。包含2μm胱天蛋白酶3/7绿色试剂以在incucyte中监测随时间推移的胱天蛋白酶活化。图48a-48dirc9是雷帕霉素诱导的细胞凋亡的有效效应物。(a)imc+carζ-t、i9+carζ+mc、ifrbc9和mc.fvfv以及fwtfrbc9/mc.fvfv构建体的示意性图示。(b-d)将活化的t细胞用编码imc+carζ-t、i9+carζ+mc、ifrbc9和mc.fvfv或fwtfrbc9/mc.fvfv的逆转录病毒转导且不用药物、用20nm雷帕霉素或20nm瑞米达西处理并且在存在2.5μm胱天蛋白酶3/7绿色试剂的情况下培养。将96孔微板置于incucyte内以将活化的胱天蛋白酶活性(绿色荧光)监测48小时。图49a-49dirc9在体内快速且有效地消除car-t细胞。(a和b)对每只小鼠用经与gfp-ffluc共转导的107个imc+carζ-t、i9+carζ+mc、ifrbc9和mc.fvfv或fwtfrbc9/mc.fvfvt细胞静脉内注射nsg小鼠。在药物治疗之前18小时(-18h),在药物治疗之前即刻(0h)以及在药物治疗后4.5h、18h、27h和45h评估cart细胞的生物发光。对于接受i9+carζ+mct细胞注射的小鼠,对每只小鼠腹膜内注射5mg/kg瑞米达西。对于接受imc+carζ-t(ifrbc9和mc.fvfv)和fwtfrbc9mc.fvfvt细胞的小鼠,对每只小鼠腹膜内注射10mg/kg雷帕霉素。在药物治疗后45h,使小鼠安乐死,并收集(c)血液和(d)脾以供用针对hcd3、hcd34和mcd45的抗体进行流式细胞术分析。图50a-50dfwtfrbc9/mc.fvfv中的接通开关和关断开关分别由瑞米达西和雷帕霉素有效控制。将来自供体920的pbmc活化并用与gfp-ffluc和编码imc+carζ-t(189)的载体、编码i9+carζ+mc(873)的载体或编码fwtfrbc9/mc.fvfv(1308)的载体共转导。在转导后7天,将t细胞与hpac-rfp细胞以1:2和1:5的e:t比接种到存在0nm、2nm或10nm瑞米达西的96孔板上,并置于incucyte中以监测t细胞-gfp和hpac-rfp生长的动力学。(a和b)在接种2天后,通过elisa分析培养上清液的il-2、il-6和ifn-γ产生。在第7天,将10nm瑞米达西添加到i9+carζ+mc培养物中,并将10nm雷帕霉素添加到gfp、imc+carζ-t和fwtfrbc9/mc.fvfv培养物中,之后通过incucyte监测直到第8天。使用用于incucyte的基础分析仪软件在第7天(ci)和第8天用0nm自杀药物(cii)和10nm自杀药物(ciii)分析e:t1:2比率的hpac-rfp和t细胞-gfp的数目。还以1:5的e:t比(d)进行类似分析。(注意:ci和di中的y轴处于对数标度)。图51a-51eirc9在fwtfrbc9/mc.fvfv中通过独立于支架诱导的二聚化的直接自二聚化来活化细胞凋亡。将来自供体920的pbmc活化并用(a)中的各种载体转导。(b)通过使用针对hmyd88、h胱天蛋白酶-9和β-肌动蛋白的抗体进行蛋白质印迹来分析cart细胞的蛋白质表达。(c-d)在转导后5天,将t细胞接种于具有增加的雷帕霉素浓度的96孔板上。另外,添加2μm胱天蛋白酶3/7绿色试剂以通过incucyte监测胱天蛋白酶切割。线图描绘了mc变体(c)和frb.fkbp.δc9相对于fkbp.frb.δc9irc9(d)在跨雷帕霉素处理后24小时中的胱天蛋白酶活化。(e)在转导后7天,将t细胞接种到具有增加的瑞米达西浓度的96孔板上,并且在瑞米达西处理后48小时通过elisa对il-2和il-6的分泌进行定量。图52a-52b活化irc9需要相对较高(>100nm)的瑞米达西浓度。将293细胞以300,000个细胞/孔接种于6孔板中并使其生长2天。在48h之后,用1μg实验质粒转染细胞。在转染之后48h收获细胞并将其稀释其原始体积的2.5x。(a)对于incucyte/casp3/7测定,每孔平铺50μl细胞,包括瑞米达西或雷帕霉素药物和胱天蛋白酶3/7绿色试剂(2.5μm的终浓度)。(b)对于seap测定,将100μl细胞平铺在具有(半对数)瑞米达西(或雷帕霉素)药物稀释物的96孔板中并且在药物暴露之后约18h,将板在底物(4-mup)添加之前热灭活。图53a-53bmc-rap(可用雷帕霉素或雷帕霉素类似物诱导的car-共刺激策略)的示意图。在该形式的诱导型共刺激分子开关中,串联的fkbp.frb(或frb.fkbp)结构域融合到myd88-cd40(mc)(右)。雷帕霉素或雷帕霉素类似物可诱导mc-fkbp-frb(或mc-frb-fkbp)中的fkbp与mc-fkbp-frb的第二分子中的frb的直接二聚化,以诱导工程化mc融合蛋白质的多聚化。注意frb可作为野生型或作为突变体存在,例如可用对mtor具有降低的亲和力的雷帕霉素类似物诱导的frbl。该策略与在imc+carζ平台(左)中由瑞米达西和fkbpv36引导的同二聚化形成对比。图54a-54b用雷帕霉素类似物和mc-rap-car诱导mc共刺激活性。将人pbmc活化并用imc+carζ构建体(bp0774和bp1433)、mc-rap-car(bp1440)或仅非诱导型mc的构建体(bp1151)转导。将细胞静置6天,然后用瑞米达西或雷帕霉素类似物c7-二甲氧基-7-异丁氧基雷帕霉素刺激等分试样。在24小时后收获上清液培养基并通过elisa确定分泌的il-6的量作为mc活性的指标。瑞米达西强烈刺激imc+carζ-t细胞中的mc活性,而雷帕霉素类似物不会。瑞米达西并不刺激mc-rap-t细胞中的mc活性,因为pbp1440中的fkbp12是野生型而非瑞米达西敏感性等位基因v36。mc-rap活性反而对异丁氧基雷帕霉素有强烈应答,其程度类似于imc+carζ-t与瑞米达西。图55a-55b来自imc+carζ的mc的蛋白质表达。将人pbmc活化并用imc+carζ构建体(bp0774、bp1433和bp1439)、mc-rap-car(bp1440)或仅非诱导型mc的构建体(于逆转录病毒的5'端定向的bp1151和相对于car于3'端定向的1414)转导。将细胞扩增2周,然后制备提取物用于sds-page。用针对myd88的抗体探测蛋白质印迹。mc-fkbp-frb融合蛋白质以与来自imc+carζ构建体的mc-fkbpv融合物类似的水平表达。图56a-56bmc-rap对雷帕霉素和雷帕霉素类似物的剂量的应答性。使用genejuice方案(novagen),用1μg报告子构建体nf-κbseap和4μgimc+carζ构建体pbp0774或mc-rap-car构建体pbp1440转染293t细胞。在转染后24小时,将细胞分配到96孔板中,并与增加浓度的瑞米达西、雷帕霉素或异丁氧基雷帕霉素孵育。在进一步孵育24小时之后,从细胞上清液中确定seap活性。用雷帕霉素类似物和雷帕霉素两者以亚纳摩尔ec50刺激nf-κb报告子活性,而最高达50nm的瑞米达西不能引导mc-rap二聚化。图57a-57bmc-rap(可用雷帕霉素或雷帕霉素类似物诱导的car-共刺激策略)的示意图。在fwtfrbc9/mc.fvfv(左)中,串联的fkbp.frb(或frb.fkbp)结构域融合到胱天蛋白酶9,并且串联的fv部分融合到mc。胱天蛋白酶9可通过借助雷帕霉素引导的frb和野生型fkbp的连接进行同二聚化来活化或通过用imc搭支架来活化。瑞米达西将fkbpv36部分二聚化以活化mc。frbfwtmc/fvc9(右)使用雷帕霉素或雷帕霉素类似物可诱导mc-rap,而由瑞米达西诱导ic9用于细胞自杀开关。图58a-58cfrbfwtmc/fvc9可有效地控制肿瘤生长,但被瑞米达西对ic9的活化所消除。将来自供体676的pbmc活化并用cd19引导的i9+carζ+mc(bp0844)、frbfwtmc/fvc9(bp1460)或fwtfrbc9/mc.fvfv(bp1300)转导。在转导后7天,将t细胞与raji-gfp细胞以1:5的e:t比接种到存在2nm瑞米达西、2nm异丁氧基雷帕霉素或2nm雷帕霉素的24孔板上。在孵育7天之后,分析活细胞的gfp标记的肿瘤细胞(左)的比例以及总t细胞(cd3+,右)的比例和转导的car-t细胞(cd34,未显示)的比例。瑞米达西与i9+carζ+mc或frbfwtmc/fvc9引起car-t细胞的细胞死亡并且肿瘤细胞在培养物中占优势,而雷帕霉素或异丁氧基雷帕霉素与fwtfrbc9/mc.fvfv引起细胞死亡。图59质粒pbp1300--psfg-fkbp.frb.δc9.t2a-αcd19.q.cd8stm.ζ.p2a-imc的示意图图60质粒pbp1308--psfg-fkbp.frb.δc9.t2a-αpsca.q.cd8stm.ζ.p2a-imc的示意图图61质粒pbp1310--psfg.frb.fkbp.δc9.t2a-δcd19的示意图图62质粒pbp1311--psfg.fkbp.frb.δc9.t2a-δcd19的示意图图63质粒pbp1316--psfg-fkbp.frbl.δc9.t2a-αpsca.q.cd8stm.ζ.p2a-imc的示意图图64质粒pbp1317--psfg-fkbp.frb.δc9q.t2a-αpsca.q.cd8stm.ζ.p2a-imc的示意图图65质粒pbp1319--psfg-fkbp.frb.δc9.t2a-αpsca.q.cd8stm.ζ.p2a-mc.fkbpv的示意图图66质粒pbp1320--psfg-fkbp.frb.δc9.t2a-αpsca.q.cd8stm.ζ.p2a-mc的示意图图67质粒pbp1321--psfg-fkbp.frb.δc9.t2a-αpsca.q.cd8stm.ζ.p2a-mc.fkbpv.fkbp的示意图图68a提供了肿瘤细胞的药物依赖性car-t细胞杀伤图。图68b提供了诱导型myd88-cd40多肽的示意图。图69a提供了表达诱导型myd88-cd40多肽的逆转录病毒载体的示意性图示。图69b提供了共刺激信号传导的报告子测定结果的条形图。图69c提供了car-t细胞的细胞因子分泌的条形图。图69d提供了car-t细胞杀伤测定的图。图70a提供了表达诱导型myd88-cd40多肽的逆转录病毒载体的示意性图示。图70b提供了共刺激信号传导的报告子测定图。图70c提供了psca-car-t细胞杀伤测定的图。图70d提供了pscacar-t细胞杀伤测定的图。图70e提供了her2-car-t细胞杀伤测定的图。图70f提供了her2-car-t细胞杀伤测定的图。图70g提供了her2-car-t细胞杀伤测定的图。图71a提供了在存在瑞米达西的情况下由诱导型胱天蛋白酶-9引导的细胞凋亡活性的图。图71b提供了在存在c7-异丁氧基雷帕霉素的情况下由诱导型胱天蛋白酶-9引导的细胞凋亡活性的图。图72a提供了在单一载体上表达的多肽的示意图,所述多肽包括car多肽、irc9多肽和imc多肽。图72b提供了在两个单独的载体上表达的多肽的示意图。图73a提供了诱导型胱天蛋白酶9逆转录病毒构建体的示意图。图73b提供了显示在雷帕霉素存在下表达胱天蛋白酶9的细胞的荧光转化的数据。图73c提供了图73b的相对细胞凋亡活性图。图73d提供了t细胞中胱天蛋白酶-9转基因表达的蛋白质印迹。图74a提供了在存在瑞米达西的情况下的il-6分泌图。图74b提供了在存在瑞米达西的情况下的il-2分泌图。图74c提供了在存在瑞米达西的情况下的ifn-γ分泌图。图74d提供了在存在瑞米达西的情况下的car-t细胞杀伤图。图74e提供了imc和irc9的表达的蛋白质印迹。图75a提供了来自未经转导的t细胞或用如所示的编码irc9、imc和car的逆转录病毒转导的t细胞的细胞分选结果。图75b提供了图75a的结果的图。图75c提供了细胞凋亡测定的细胞分选结果。图75d提供了细胞凋亡测定的图形表示。图76a提供了通过生物发光成像确定的带有肿瘤的动物的显微照片。图76b提供了平均肿瘤生长的图。图76c提供了终止时脾中人t细胞的图。图76d提供了载体拷贝数的图。图77a提供了通过生物发光成像确定的带有肿瘤的动物的显微照片。图77b提供了平均辐射率的图。图77c提供了来自图77a的卡普兰-梅尔(kaplan-meier)分析的图。图77d提供了终止处的代表性facs分析。图78a提供了通过生物发光成像确定的带有肿瘤的动物的显微照片。图78b提供了来自图78a的平均计算辐射率的图形表示。图78c提供了小鼠脾中人t细胞计数的图。图79a提供了通过生物发光成像确定的带有肿瘤的动物的显微照片。图79b提供了来自图79a的平均计算辐射率的图形表示。图79c提供了终止时小鼠脾中人t细胞数目的图。图79d提供了来源于小鼠脾的dna的载体拷贝数的图。图80提供了pbp1151--psfg--mc-t2a-αcd19.q.cd8stm.ζ的质粒图谱图81提供了pbp1152--psfg--mc-t2a-αcd19.q.cd8stm.ζ的质粒图谱图82提供了pbp1414--psfg-αcd19.q.cd8stm.ζ-p2a-mc的质粒图谱图83提供了pbp1414--psfg-αcd19.q.cd8stm.ζ-p2a-mc的质粒图谱图84提供了pbp1433--psfg—fv-fv-mc-t2a-αcd19.q.cd8stm.ζ的质粒图谱图85提供了pbp1439--psfg--mc.fkbpv-t2a-αcd19.q.cd8stm.ζ的质粒图谱图86提供了pbp1440--psfg-fkbpv.δc9.t2a-αcd19.q.cd8stm.ζ.t2a.p2a-mc.fkbpwt.frbl的质粒图谱图87提供了pbp1460--psfg-fkbpv.δc9.t2a-αcd19.q.cd8stm.ζ.t2a.p2a-mc.fkbpwt.frbl的质粒图谱图88提供了pbp1293--psfg-imc.t2a-αhcd33(my9.6).ζ的质粒图谱图89提供了pbp1296--psfg-imc.t2a-αhcd123(32716).ζ的质粒图谱图90提供了pbp1327--psfg-frb.fkbpv.δc9.2a-δcd19的质粒图谱图91提供了pbp1328--psfg-fkbpv.frb.δc9.2a-δcd19的质粒图谱图92提供了pbp1351--psfg-sp163.fkbp.frb.δc9.t2a-αhpsca.q.cd8stm.ζ.2a-imc的质粒图谱图93提供了pbp1373--psfg-sp-fkbp.frb.δc9.t2a-αhpscascfv.q.cd8stm.ζ的质粒图谱图94提供了pbp1385--psfg-frb.fkbp.δc9.t2a-δcd19的质粒图谱图95提供了pbp1455--psfg-mc.fkbpwt.frbl.t2a-αpsca.q.cd8stm.ζ的质粒图谱图96提供了pbp1466--psfg-fkbpv.δc9.t2a-psca.q.cd8stm.ζ.p2a-mc.fkbpwt.frbl的质粒图谱图97提供了pbp1474--psfg-fkbpv.δc9.t2a-αher2.q.cd8stm.ζ的质粒图谱图98提供了pbp1475--psfg-fkbpv.δc9.t2a-αpsca.q.cd8stm.ζ的质粒图谱图99提供了pbp1488--psfg-frbl.fkbpwt.mc-t2a-αpsca.q.cd8stm.ζ的质粒图谱图100提供了pbp1491--psfg--fkbpv.δc9.p2a.mc.fkbpwt.frbl.t2a-αher2.q.cd8stm.ζ的质粒图谱图101提供了pbp1493--psfg-mc.fkbpwt.frbl-p2a.fkbpv.δc9.t2a-αher2.q.cd8stm.ζ的质粒图谱图102提供了pbp1494--psfg-mc.fkbpwt.frbl-p2a.fkbpv.δc9.t2a-psca.q.cd8stm.ζ的质粒图谱图103提供了pbp1757--psfg-frbl.fkbpwt.mc-p2a.fkbpv.δc9.t2a-αpsca.q.cd8stm.ζ的质粒图谱图104提供了pbp1759--psfg--frbl.fkbpwt.mc-p2a.fkbpv.δc9.t2a-αher2.q.cd8stm.ζ的质粒图谱图105提供pbp1796--psfg--fkbpwt.frbl-mc.p2a.fkbpv.δc9.t2a-αpsca.q.cd8stm.ζ的质粒图谱图106a提供了各种诱导型嵌合胱天蛋白酶-9构建体的示意图。图106提供了胱天蛋白酶活化测定的图。图106c是显示蛋白质表达的蛋白质印迹的照片。图107a提供了胱天蛋白酶活性的图。图107b提供了seap活性的图。图108a提供了seap活性的图。图108b提供了胱天蛋白酶活性的图。图108c提供了显示蛋白质表达的蛋白质印迹。图109a提供了转导效率的facs分析。图109b提供了生物发光图。图109c提供了小鼠中的生物发光的照片。图109d提供了小鼠脾细胞的fac分析图。图110a提供了转导效率的fac分析。图110b提供了生物发光图。图110c提供了小鼠中的生物发光的照片。图110d提供了小鼠脾细胞的fac分析图。图111提供了编码cd123-car-ζ和imc多肽的载体的示意图。图112a提供了il-6产生的图;图112b提供了il-2产生的图;图112c提供了thp1-gp.fluc的总绿色荧光强度的图,图112d提供了hpac-rfp细胞数目的图。图113a提供了il-2产生的图;图113b提供了thp1-fp.fluc细胞的图;图113c提供了t细胞-frp的图;图d提供了thp1-gfp.fluc绿色荧光的图;并且图e提供了t细胞-rfp红色荧光的图。图114a提供了fac分析;图114b提供了通过ivis监测的肿瘤生长的示意图;图114c提供了小鼠中生物发光的照片;图114d提供了如通过流式细胞术测量的car-t细胞存在的图;并且图114e提供了载体拷贝数的图。图115a提供了小鼠中的生物发光的照片;图115b提供了载体拷贝数的图。图116提供了与重组tcr表达的诱导型mc的示意图。图117a提供了prametcr多肽的示意图;图117b提供了imc多肽的示意图;图117c提供了与imc多肽共表达的prame-tcr多肽的示意图;图117d提供了il-2产生的图,沿着x轴列出的项目与图例的顺序相同。图118a提供了trans-well测定装置的示意图;图118b提供了hla-a、hla-b、hla-c水平的图。图119a提供了特异性裂解的图。图119b提供了il-2产生的图。图120a提供了特异性裂解的图;图120b提供了il-2产生的图。图121a提供了免疫缺陷型nsg异种移植模型的示意图;图121b提供了未经转导细胞和经转导细胞中的平均辐射率的图;图121c提供了vβ1+cd8+细胞数/脾的图;图121d提供了vβ1+cd8+细胞数/脾的图。具体实施方式作为将信息从外部环境转移到细胞内部的机制,受调控的蛋白质-蛋白质相互作用发展为控制大部分(若非全部)信号传导途径。信号的转导受缺少固有特异性的酶促过程(例如氨基酸侧链磷酸化、乙酰化或蛋白质水解切割)支配。此外,许多蛋白质或因子以一定的细胞浓度存在或存在于一定的亚细胞位置,所述浓度或位置阻碍了自发产生足够的底物/产物关系以活化或传播信号传导。活化信号传导的重要组成部分是将这些组分募集到通过适当的上游信号有效传输(或减弱)途径的信号传导“节点”或空间信号传导中心。作为人工分离和操纵单个蛋白质-蛋白质相互作用以及因此单个信号传导蛋白质的工具,开发了化学诱导的二聚化(cid)技术,以对靶蛋白质施加同型或异型相互作用以再现天然的生物调控。在其最简单的形式中,单个蛋白质将被修饰以含有一个或多个结构相同的配体结合结构域,所述配体结合结构域随后将是在存在同族同二聚体配体的情况下分别同二聚化或寡聚化的基础(spencerdm等(93)science262,1019-24)。该概念的稍微更复杂的形式将涉及将一个或多个不同的配体结合结构域置于两种不同的蛋白质上,以使得能够使用同时结合两个不同结构域的小分子异二聚体配体使这些信号传导分子异二聚化(hosn等(96)nature382,822-6)。这种药物介导的二聚化产生非常高浓度的局部配体结合结构域标记组分,足以允许它们的诱导或自发的组装和调控。在一些实施方案中,本文提供了诱导蛋白质多聚化的方法。在这种情况下,串联的两个或更多个异二聚体配体结合区(或“结构域”)被用作“分子支架”以使第二种含有信号传导结构域的蛋白质二聚化或寡聚化,该蛋白质融合到用于异二聚体配体的第二结合位点的一个或多个拷贝。分子支架可表示为定位于细胞内或未定位(图8b、8c)的配体结合结构域的分离多聚体(图8),或者其可附接到提供结构、信号传导、细胞标记或更复杂的组合功能的另一蛋白质(图9)。“支架”意指包含至少两个(例如两个或更多个)异二聚体配体结合区的多肽;在某些示例中,配体结合区是串联的,即每个配体结合区位于紧邻下一配体结合区处。在其他示例中,每个配体结合区可位于接近下一配体结合区处,例如由约1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16,17个、18个、19个、20个、25个、30个、35个、40个、45个、50个、55个、60个、65个、70个、75个、80个或更多个氨基酸隔开,但保留了在存在二聚化剂的情况下使诱导型胱天蛋白酶分子二聚化的支架功能。支架可包含例如至少2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个或更多个配体结合区,并且还可连接到另一多肽,例如标志物多肽、共刺激分子、嵌合抗原受体、t细胞受体等。在一些实施方案中,第一多肽基本上由至少2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个或20个单位的第一多聚化区组成。在一些实施方案中,第一多肽基本上由支架区组成。在一些实施方案中,第一多肽基本上由膜缔合区或膜靶向区组成。“基本上由......组成”意指支架单元或支架可以是单独的,可任选地在支架的任一末端或单元之间包含接头多肽,并且可任选地包含小多肽,例如如图10b、图10c、图10d和图10e中所示。在一个示例中,使用衍生自蛋白质激酶mtor的约89aafk506-雷帕霉素结合(frb)结构域的串联多聚体(chenj等(95)pnas,92,4947-51)以在存在雷帕霉素或基于雷帕霉素的类似物(“雷帕霉素类似物”)的情况下募集多个fkbpv36融合的胱天蛋白酶-9(ic9/i胱天蛋白酶(liberlessd(97)pnas94,7825-30;riveravm(96)natmed2,1028-1032,stankunask(03)molcell12,1615-24;baylejh(06)chem&biol,13,99-107)(图1-3)。该募集导致自发的胱天蛋白酶二聚化和活化。在第二示例中,串联的frb结构域融合到嵌合抗原受体(car),并且这为表达两种融合蛋白质的细胞提供了雷帕霉素类似物驱动的ic9活化(图15,插图)。在第三示例中,两种蛋白质的极性是相反的,使得使用fkbp12的两个或多个拷贝在存在雷帕霉素的情况下募集frb修饰的信号传导分子并将其多聚化(图8c、图9a)。在一些示例中,嵌合多肽可包含单个配体结合区,或者包含超过一个配体结合区的支架可以是,其中所述嵌合多肽包括例如以下的多肽:myd88多肽、截短的myd88多肽、胞质cd40多肽、嵌合myd88/胞质cd40多肽或嵌合的截短myd88/胞质cd40多肽。myd88或myd88多肽意指髓样分化初次应答基因88的多肽产物,所述基因例如但不限于被引用为ncbigeneid4615的人形式。“截短”意指蛋白质不是全长,并且可能缺少例如结构域。例如,截短的myd88不是全长,并且可能例如缺失tir结构域。截短的myd88多肽氨基酸序列的示例呈现为seqidno:305。编码“截短的myd88”的核酸序列意指编码截短的myd88肽的核酸序列,该术语还可指包括编码作为克隆人工产物(artifact)添加的任何氨基酸的部分的核酸序列,包括编码接头任何氨基酸。应当理解,在方法或构建体涉及截短的myd88多肽的情况下,所述方法还可用于另一myd88多肽,例如全长myd88多肽,或者所述构建体还可被设计成用于另一myd88多肽,例如全长myd88多肽。在方法或构建体是指全长myd88多肽的情况下,所述方法还可用于截短的myd88多肽,或者所述构建体还可被设计成用于截短的myd88多肽。在本文的方法中,肽的cd40部分可位于myd88或截短的myd88多肽部分的上游或下游。在第四示例中,在施用雷帕霉素类似物之前,使用不稳定的frb变体(例如frbl2098)使信号分子不稳定(stankunask(03)molcell12,1615-24;stankunask(07)chembiochem8,1162-69)(图9、图10)。在暴露于雷帕霉素类似物后,不稳定的融合分子被稳定,导致如前所述的聚集,但具有较低的背景信号传导。使用配体来引导信号传导蛋白质通常可被应用于活化或减弱许多信号传导途径。本文提供了证实通过用“起始胱天蛋白酶”(胱天蛋白酶-9)作为主要靶标来控制细胞凋亡或程序性细胞死亡的方法的实用性的示例。通过用广泛可用的雷帕霉素或更多专有的雷帕霉素类似物使促细胞凋亡蛋白质二聚化来控制细胞凋亡应当允许实验者或临床医生紧密并快速地控制展示出不想要的效应的基于细胞的植入物的存活力。这些效应的示例包括但不限于针对脱靶组织的移植物抗宿主(gvh)免疫应答、或植入物的过度、不受控制的生长或转移。细胞凋亡的快速诱导将严重减弱不需要的细胞功能,并允许吞噬细胞(例如巨噬细胞)对死亡细胞的天然清除,而无过度炎症。细胞凋亡受到紧密调控,且天然地使用支架(例如apaf-1、cradd/raidd或fadd/mort1)来将可最终杀伤细胞的胱天蛋白酶寡聚并活化。apaf-1可将细胞凋亡蛋白酶胱天蛋白酶-9组装成潜在复合物,所述潜在复合物然后在将细胞色素c募集到支架后形成活性寡聚凋亡体。关键事件是支架单元的寡聚化,引起胱天蛋白酶的二聚化和活化。类似的衔接子,例如cradd,可使胱天蛋白酶-2寡聚,导致细胞凋亡。本文所提供的组合物和方法使用例如配体结合结构域frb或fkbp的多聚体形式作为支架,所述支架允许在用雷帕霉素募集后作为frb或fkbp融合物存在的胱天蛋白酶单元的自发二聚化和活化。使用本文实施例中所提供的某些方法,仅当存在雷帕霉素或雷帕霉素类似物以将frb或fkbp融合的胱天蛋白酶募集到支架时才发生胱天蛋白酶活化。在这些方法中,frb或fkbp多肽必须作为多聚体单元存在,而不是作为驱动fkbp-胱天蛋白酶或frb-胱天蛋白酶二聚化的单体存在(frb-胱天蛋白酶-9与fkbp-胱天蛋白酶-9二聚化时除外)。基于frb或fkbp的支架可在靶细胞中表达为与其他蛋白质的融合物并且保留其作为支架以组装并活化促细胞凋亡分子的支架的能力。frb或fkbp支架可作为可溶性实体定位在胞质溶胶内,或通过靶向信号存在于特定的亚细胞地点(locale)(例如质膜)中。用于活化细胞凋亡的组分和降解细胞的下游组分由所有细胞并且在物种间共享。关于胱天蛋白酶-9活化,这些方法可广泛用于细胞系、正常原代细胞(例如但不限于t细胞)或细胞植入物中。在用雷帕霉素将frb-胱天蛋白酶与fkbp-胱天蛋白酶直接二聚化以引导细胞凋亡的某些示例中,显示fkbp融合的胱天蛋白酶可被同二聚化剂分子(例如ap1510、ap20187或ap1903)二聚化(图6(右图))、10a(示意图)(类似的促细胞凋亡开关可经由使用雷帕霉素或雷帕霉素类似物经由二元开关的异二聚化来引导,通过使frb-胱天蛋白酶-9融合蛋白质与fkbp-胱天蛋白酶-9共表达,导致嵌合蛋白质内胱天蛋白酶结构域的同二聚化(图8a(示意图)、图10b(示意图)、图(11)。如本文所用的,当在权利要求书和/或说明书中与术语“包含”结合使用时,词语“一(a或an)”的使用可意指“一种(个)”,但其也与“一种(个)或多种(个)”、“至少一种(个)”和“一种(个)或超过一种(个)”的含义一致。另外,术语“具有”、“包括”、“含有”和“包括”可互换,并且本领域技术人员认识到这些术语是开放式术语。下表概述了本示例和以下示例中讨论的开关的一些命名和首字母缩略词的性质。如本文所用的术语“同种异体”是指抗原性不同的hla或mhc基因座。因此,从相同物种转移的细胞或组织可以是抗原性不同的。同系(syngeneic)小鼠可在一个或多个基因座(同类系)上有所不同,并且同种异体小鼠可具有相同的背景。如本文所用的术语“抗原”被定义为诱发免疫应答的分子。这种免疫应答可能涉及抗体产生,或特定的免疫活性细胞的活化,或两者。“抗原识别部分”可以是结合抗原的天然来源的或合成的任何多肽或其片段,例如,抗体片段可变结构域。抗原识别部分的示例包括但不限于衍生自抗体的多肽,例如单链可变片段(scfv)、fab、fab'、f(ab')2和fv片段;衍生自t细胞受体的多肽,例如tcr可变结构域;和结合胞外同族蛋白质的任何配体或受体片段。如本文所用的术语“癌症”被定义为其独特性状-正常控制的丧失-导致失控的生长、缺少分化、局部组织侵袭和转移的细胞过度增殖。示例包括但不限于黑色素瘤、非小细胞肺癌、小细胞肺癌、肺癌、肝癌、白血病、成视网膜细胞瘤、星形细胞瘤、成胶质细胞瘤、牙龈癌、舌癌、成神经细胞瘤、头癌、颈癌、乳腺癌、胰腺癌、前列腺癌、肾癌、骨癌、睾丸癌、卵巢癌、间皮瘤、宫颈癌、胃肠道癌、淋巴瘤、脑癌、结肠癌、肉瘤或膀胱癌。供体:术语“供体”是指不是患者接受者的哺乳动物,例如人。例如,供体可与接受者具有hla同一性,或者可与接受者具有部分或更大的hla差异。单倍体相同:关于细胞、细胞类型和/或细胞谱系使用的术语“单倍体相同”在本文中是指共享单倍型的细胞或在一条染色体上一组紧密连锁的基因上具有基本相同等位基因的细胞。单倍体相同的供体与接受者不具有完全的hla同一性,存在部分hla差异。血液疾病:如本文所用的术语“血液病(blooddisease)”、“血液病(blooddisease)”和/或“血液疾病(diseasesoftheblood)”是指影响血液和其组分(包括但不限于血细胞、血红蛋白、血液蛋白质)的产生、凝血机制、血液的产生、血液蛋白质的产生等和其组合的病况。血液病的非限制性示例包括贫血、白血病、淋巴瘤、血液肿瘤、白蛋白血症、血友病等。骨髓疾病:如本文所用的术语“骨髓疾病”是指导致血细胞和血小板产生减少的病况。在一些骨髓疾病中,正常的骨髓架构可被感染(例如结核病)或恶性肿瘤移位,这进而可导致血细胞和血小板产生的减少。骨髓疾病的非限制性示例包括白血病、细菌感染(例如结核病)、放射病或中毒、全细胞减少症(apnocytopenia)、贫血、多发性骨髓瘤等。t细胞和活化的t细胞(包括这意指cd3+细胞):t细胞(还被称为t淋巴细胞)属于被称为淋巴细胞的一组白细胞。淋巴细胞通常参与细胞介导的免疫。“t细胞”中的“t”是指来源于胸腺或成熟受胸腺影响的细胞。t细胞可通过称为t细胞受体的细胞表面蛋白质的存在而与其他淋巴细胞类型(例如b细胞和自然杀伤(nk)细胞)区分。如本文所用的术语“活化的t细胞”是指已通过识别在ii类主要组织相容性(mhc)标志物的背景下呈递的抗原决定簇而刺激产生免疫应答(例如,活化的t细胞的克隆扩增)的t细胞。t-细胞通过抗原决定簇、细胞因子和/或淋巴因子和分化细胞表面蛋白质簇(例如cd3、cd4、cd8等和其组合)的存在而被活化。表达差异蛋白质簇的细胞经常被认为对该蛋白质在t细胞表面上的表达是“阳性的”(例如,对cd3或cd4表达为阳性的细胞被称为cd3+或cd4+)。cd3和cd4蛋白质是可直接和/或间接参与t细胞中的信号转导的细胞表面受体或共受体。外周血:如本文所用的术语“外周血”是指血液的细胞组分(例如,红细胞、白细胞和血小板),其从血液循环池中获得或制备并且未被隔离在淋巴系统、脾、肝或骨髓内。脐带血:脐带血不同于外周血和淋巴系统、脾、肝或骨髓内隔离的血液。可互换使用的术语“脐带血(umbilicalcordblood)”、“脐带血(umbilicalblood)”或“脐带血(cordblood)”是指在胎儿分娩之后残留在胎盘和附着的脐带中的血液。脐血经常含有干细胞,包括造血细胞。“胞质cd40”或“缺少cd40胞外结构域的cd40”意指缺少cd40胞外结构域的cd40多肽。在一些示例中,该术语还指同时缺少cd40胞外结构域和cd40跨膜结构域的一部分或全部的cd40多肽。如例如在细胞的情况下,“获得或制备”意指从来源分离、纯化或部分纯化细胞或细胞培养物,其中所述来源可以是例如脐带血、骨髓或外周血。所述术语还可适用于其中原始来源或细胞培养物已被培养并且细胞已被复制并且其中后代细胞现在来源于原始来源的情况。如杀伤细胞百分比中的“杀伤(kill)”或“杀伤(killing)”意指细胞通过细胞凋亡而死亡,如使用已知用于测量细胞凋亡的任何方法,以及例如使用本文所讨论的测定(例如本文所讨论的seap测定或t细胞测定)所测量的。该术语还可指细胞消融。同种异体耗竭:如本文所用的术语“同种异体耗竭”是指同种异体反应性t细胞的选择性耗竭。如本文所用的术语“同种异体反应性t细胞”是指被活化以在暴露于外来细胞(例如在移植的同种异体移植物中)作出反应时产生免疫应答的t细胞。选择性耗竭通常涉及靶向用于使用免疫磁体、免疫毒素、流式分选、诱导细胞凋亡、光耗竭技术等或其组合加以去除的各种细胞表面表达的标志物或蛋白质(例如,有时为分化蛋白质簇(cd蛋白质)、cd19等)。在本方法中,可在同种异体耗竭之前或之后用编码嵌合蛋白质的载体转导或转染细胞。此外,可在不进行同种异体耗竭步骤的情况下用编码嵌合蛋白质的载体转导或转染细胞,并且可向患者施用非同种异体耗竭细胞。由于增加的“安全开关”,因此例如可能施用非同种异体耗竭的(或仅部分同种异体耗竭的)t细胞,因为诸如移植物抗宿主病的不利事件可在施用多聚体配体后被缓解。移植物抗宿主病:术语“移植物抗宿主病”或“gvhd”是指经常与同种异体骨髓移植有关并且有时与未经辐照的血液输注到免疫受损患者相关的并发症。当被移植骨髓中的功能性免疫细胞将接受者识别为“外来的”并且产生免疫应答时,有时可能发生移植物抗宿主病。gvhd可分为急性型和慢性型。急性gvhd(agvhd)经常在移植或输血后的前100天内观察到,并且可影响肝、皮肤、粘膜、免疫系统(例如造血系统、骨髓、胸腺等)、肺和胃肠道。慢性gvhd(cgvhd)经常在移植或输血后的100天或以后开始,并且可攻击与急性gvhd相同的器官,但还可影响结缔组织和外分泌腺。皮肤急性gvhd可导致弥漫性斑丘疹,有时呈花边图案。供体t细胞:如本文所用的术语“供体t细胞”是指经常在同种异体干细胞移植后施用于接受者以赋予抗病毒和/或抗肿瘤免疫的t细胞。供体t细胞经常被用于抑制骨髓移植物排斥,并增加同种异体植入(alloengraftment)的成功率,然而同一供体t细胞可引起抗宿主抗原的同种异体攻击性反应,这进而可导致移植物抗宿主病(gvhd)。某些活化的供体t细胞可引起比其他活化的t细胞更高或更低的gvhd应答。供体t细胞还可能对接受者肿瘤细胞具有反应性,引起有益的移植物抗肿瘤效应。间充质基质细胞:如本文所用的术语“间充质基质细胞”或“骨髓来源的间充质基质细胞”是指可在离体、体外和体内分化成脂肪细胞、成骨细胞和成软骨细胞的多能干细胞,并且可进一步被定义为单核骨髓细胞的一部分,所述单核骨髓细胞在标准培养条件下粘附到塑料培养皿,对于造血谱系标志物为阴性,并且对于cd73、cd90和cd105为阳性。胚胎干细胞:如本文所用的术语“胚胎干细胞”是指来源于胚泡的内细胞团的多能干细胞,即50到_150个细胞的早期胚胎。胚胎干细胞的特征在于它们能够无限期地自我更新,并且在于它们能够分化成所有三个原胚层(外胚层、内胚层和中胚层)的衍生物。多能(pluripotent)与多潜能(mutipotent)的区别在于多能细胞可产生所有细胞类型,而多潜能细胞(例如成体干细胞)只能产生有限数目的细胞类型。诱导型多能干细胞:如本文所用的术语“诱导型多能干细胞”或“诱导性多能干细胞”是指“重编程”或通过遗传(例如,基因的表达,其进行活化多能性)、生物(例如,处理病毒或逆转录病毒)和/或化学(例如,小分子、肽等)操控诱导以产生能够分化成许多(若非全部)细胞类型的细胞(如胚胎干细胞)的成体或分化细胞。诱导型多能干细胞与胚胎干细胞的区别在于它们实现了中间或终末分化状态(例如,皮肤细胞、骨细胞、成纤维细胞等),然后被诱导以去分化,从而重新获得产生多潜能或多能细胞的部分或全部能力。cd34+细胞:如本文所用的术语“cd34+细胞”是指在其细胞表面上表达cd34蛋白质的细胞。如本文所用的“cd34”是指经常充当细胞-细胞粘附因子且参与t细胞进入淋巴结中并且是“分化簇”基因家族成员的细胞表面糖蛋白(例如,唾液粘蛋白蛋白质)。cd34还可介导干细胞附着到骨髓、细胞外基质或直接附着到基质细胞。cd34+细胞经常在脐带和骨髓中作为如下细胞被发现:造血细胞、间充质干细胞亚类、内皮祖细胞、血管而不是淋巴管(胸膜淋巴管除外)的内皮细胞、肥大细胞、小间质中和皮肤真皮附属物周围的树突细胞(因子xiiia阴性)亚群,以及某些软组织肿瘤(例如,肺泡状软组织肉瘤、前b急性成淋巴细胞白血病(pre-b-all)、急性骨髓性白血病(aml)、aml-m7、隆凸性皮肤纤维肉瘤、胃肠道间质瘤、巨细胞成纤维细胞瘤、粒细胞肉瘤、卡波西氏肉瘤(kaposi’ssarcoma)、脂肪肉瘤、恶性纤维组织细胞瘤、恶性周围神经鞘瘤、脑膜血管外皮细胞瘤、脑膜瘤、神经纤维瘤、神经鞘瘤和乳头状甲状腺癌)中的细胞。基因表达载体:在整个文件中可互换使用的如本文所用的术语“基因表达载体”、“核酸表达载体”或“表达载体”通常是指可在宿主细胞中复制并且可用于将一种或多种基因导入宿主细胞中的核酸分子(例如质粒、噬菌体、自主复制序列(ars)、人工染色体、酵母人工染色体(例如yac))。引入表达载体上的基因可以是内源基因(例如,通常在宿主细胞或生物体中发现的基因)或异源基因(例如,通常不在宿主细胞或生物体的基因组中或染色体外核酸上发现的基因)。通过表达载体引入细胞中的基因可以是天然基因或已经修饰或工程化的基因。基因表达载体还可被工程化为含有5'和3'非翻译调控序列,所述非翻译调控序列有时可用作增强子序列、启动子区和/或终止子序列,其可促进或增强承载于所述表达载体上的一个或多个基因的有效转录。基因表达载体有时还被工程化用于特定细胞类型、细胞位置或组织类型中的复制和/或表达功能性(例如转录和翻译)。表达载体有时包括用于在宿主或接受者细胞中维持载体的可选标志物。发育调控型启动子:如本文所用的术语“发育调控型启动子”是指充当rna聚合酶的初始结合位点以转录在受发育程序或途径控制、起始或影响的某些条件下表达的基因的启动子。发育调控型启动子经常在启动子区处或附近具有额外的控制区,用于结合可影响作为发育程序或途径的一部分的基因的转录的转录活化剂或阻遏物。发育调控型启动子有时参与转录基因产物影响细胞发育分化的基因。发育分化细胞:如本文所用的术语“发育分化细胞”是指已经历经常涉及特定发育调控基因的表达的过程的细胞,所述细胞通过该过程从较不特化的形式演化为较特化的形式以执行特定的功能。发育分化细胞的非限制性示例是肝细胞、肺细胞、皮肤细胞、神经细胞、血细胞等。发育分化的变化通常涉及基因表达的变化(例如,基因表达模式的变化)、遗传重组(例如,染色质重塑以隐藏或暴露将分别沉默或表达的基因),且偶尔涉及dna序列的变化(例如,免疫多样性分化)。发育期间的细胞分化可被理解为基因调控网络的结果。调控基因和其顺式调控模块是基因调控网络中的节点,其接收输入(例如,在发育途径或程序中上游表达的蛋白质)并且在网络中的其他地方产生输出(例如,表达的基因产物作用于发育途径或程序中下游的其他基因)。如本文所用的术语“细胞”、“细胞系”和“细胞培养物”可互换使用。所有这些术语还包括它们的后代,即任何和所有的后续代。应当理解,由于有意或无意的突变,所有后代可能并不相同。如这里所用的术语“雷帕霉素类似物”意指天然抗生素雷帕霉素的类似物。本实施方案中的某些雷帕霉素类似物具有诸如以下的性质:在血清中的稳定性、对野生型frb的差亲和力(及因此对亲本蛋白质mtor的差亲和力,导致免疫抑制性质的降低或消除)和对突变型frb结构域的相对高亲和力。出于商业目的,在某些实施方案中,雷帕霉素类似物具有有用的按比例缩放和生产的性质。雷帕霉素类似物的示例包括但不限于s-o,p-二甲氧基苯基(dmop)-雷帕霉素:ec50(wtfrb(k2095t2098w2101)约1000nm)、ec50(frb-klw约5nm)luengoji(95)chem&biol2:471-81;luengoji(94)j.orgchem59:6512-6513;美国专利6187757;r-异丙氧基雷帕霉素:ec50(wtfrb(k2095t2098w2101)约300nm)、ec50(frb-plf约8.5nm);liberless(97)pnas94:7825-30;和s-丁烷磺酰氨基(butanesulfonamidorap)(ap23050):ec50(wtfrb(k2095t2098w2101)约2.7nm)、ec50(frb-ktf约>200nm)bayle(06)chem&bio.13:99-107。术语“frb”是指fkbp12-雷帕霉素结合(frb)结构域(在mtor内编码的残基2015-2114)和其类似物。在某些实施方案中,提供了frb类似物或变体。frb类似物或变体变体的性质是稳定性(一些变体比其他变体更不稳定)和结合各种雷帕霉素类似物的能力。在某些实施方案中,frb类似物或变体结合c7雷帕霉素类似物,例如本申请中所提供的那些,以及以引用方式并入本文的出版物中提及的那些。在某些实施方案中,frb类似物或变体包含位置t2098处的氨基酸取代。基于与雷帕霉素缀合的晶体结构,存在已被最多分析的3个雷帕霉素相互作用的关键残基,即k2095、t2098和w2101。所有三个的突变导致可在雷帕霉素或一些雷帕霉素类似物存在下稳定的不稳定蛋白质。该特征可被用于在一些应用中进一步增加信噪比。突变体的示例论述于bayle等(06)chem&bio13:99-107;stankunas等(07)chembiochem8:1162-1169;和liberless(97)pnas94:7825-30)中。本实施方案的frb变体多肽区的示例包括但不限于klw(具有l2098);ktf(具有f2101);和klf(l2098、f2101)。frb变体klw对应于例如由seqidno:303的氨基酸组成的frbl多肽,并且具有在位置2098处的l残基的取代。通过比较seqidno:303的klw变体与野生型frb多肽,例如由seqidno:304的氨基酸序列组成的多肽,可确定本文所列出的其他frb变体的序列。每个配体可包含两个或更多个部分(例如,限定部分、不同部分),并且有时包含两个、三个、四个、五个、六个、七个、八个、九个、十个或更多个部分。第一配体和第二配体各自独立地可由两个部分组成(即二聚体),由三个部分组成(即三聚体)或由四个部分组成(即四聚体)。第一配体有时包含第一部分和第二部分,并且第二配体有时包含第三部分和第四部分。第一部分和第二部分经常不同(即,异源(例如,异二聚体)),第一部分和第三部分有时不同且有时相同,并且第三部分和第四部分经常相同(即同源(例如同二聚体))。不同的部分有时具有不同的功能(例如,结合第一多聚化区,结合第二多聚化区,不显著结合第一多聚化区,不显著结合第二多聚化区(例如,第一部分结合第一多聚化区,但不显著结合第二多聚化区),并且有时具有不同的化学结构。不同的部分有时具有不同的化学结构,但可结合相同的多聚化区(例如,第二部分和第三部分可结合第二多聚化区,但可具有不同的结构)。第一部分有时结合第一多聚化区,并且有时不显著结合第二多聚化区。每个部分有时被称为“单体”(例如,分别跟随第一部分、第二部分、第三部分和第四部分的第一单体、第二单体、第三单体和第四单体)每个部分有时被称为“侧面”。配体的侧面有时可能彼此相邻,并且有时可能位于配体上的相对位置。如在结合多聚化区或配体结合区的多聚体配体或异二聚体配体的示例中,“能够结合”意指配体结合配体结合区,例如配体的一部分或多个部分结合多聚化区,并且该结合可通过包括但不限于生物测定、化学测定或物理检测手段(例如x射线晶体照相术)在内的测定方法来检测。另外,在配体被认为“不显著结合”的情况下,意指可对配体与配体结合区的结合进行较小的检测,但该结合量或结合的稳定性并不是显著可检测的,并且当在本实施方案的细胞中发生时,并不活化修饰细胞或引起细胞凋亡。在某些示例中,在配体不“显著结合”的情况下,在施用配体之后,经历细胞凋亡的细胞的量小于10%、5%、4%、3%、2%或1%。“区域”或“结构域”意指当涉及本申请的嵌合多肽时维持多肽的功能的多肽或其片段。即,例如,fkbp12结合结构域、fkbp12结构域、fkbp12区、fkbp12多聚化区等是指结合cid配体(例如,瑞米达西或雷帕霉素)以引起或允许嵌合多肽的二聚化或多聚化的fkbp12多肽。促细胞凋亡多肽(例如,本申请的胱天蛋白酶-9多肽或截短的胱天蛋白酶-9多肽)的“区域”或“结构域”意指胱天蛋白酶-9区在作为嵌合多肽或嵌合促细胞凋亡多肽的一部分二聚化或多聚化后,二聚化或多聚化的嵌合多肽可参与胱天蛋白酶级联,允许或引起细胞凋亡。如本文所用的术语“i胱天蛋白酶-9”分子、多肽或蛋白质被定义为诱导型胱天蛋白酶-9。术语“i胱天蛋白酶-9”涵盖i胱天蛋白酶-9核酸、i胱天蛋白酶-9多肽和/或i胱天蛋白酶-9表达载体。该术语还涵盖天然i胱天蛋白酶-9核苷酸或氨基酸序列,或缺少card结构域的截短序列。如本文所用的术语“i胱天蛋白酶1分子”、“i胱天蛋白酶3分子”或“i胱天蛋白酶8分子”分别被定义为诱导型胱天蛋白酶1、诱导型胱天蛋白酶3或诱导型胱天蛋白酶8。术语i胱天蛋白酶1、i胱天蛋白酶3或i胱天蛋白酶8分别涵盖i胱天蛋白酶1核酸、i胱天蛋白酶3核酸或i胱天蛋白酶8核酸、i胱天蛋白酶1多肽、i胱天蛋白酶3多肽或i胱天蛋白酶8多肽和/或i胱天蛋白酶1表达载体、i胱天蛋白酶3表达载体或i胱天蛋白酶8表达载体。该术语还涵盖分别的天然胱天蛋白酶i胱天蛋白酶-1、i胱天蛋白酶-3或i胱天蛋白酶-8核苷酸或氨基酸序列,或缺少card结构域的截短序列。在本文所提供的实验细节的背景下,“野生型”胱天蛋白酶-9意指缺少card结构域的胱天蛋白酶-9分子。在包含修饰的胱天蛋白酶-9多肽的嵌合多肽中,修饰的胱天蛋白酶-9多肽包含至少一个影响基础活性或ic50的氨基酸取代。本文讨论了用于测试基础活性和ic50的方法。未修饰的胱天蛋白酶-9多肽不包含这种类型的氨基酸取代。修饰的胱天蛋白酶-9多肽和未修饰的胱天蛋白酶-9多肽两者均可被截短以例如去除card结构域。“功能保守变体”是蛋白质或酶,其中已改变给定的氨基酸残基,而不改变该蛋白质或酶的总体构象和功能,包括但不限于用具有相似性质(包括极性或非极性特性、大小、形状和电荷)的氨基酸替代氨基酸。许多通常已知的非遗传编码氨基酸的保守氨基酸取代是本领域众所周知的。其他非编码氨基酸的保守取代可基于它们与遗传编码氨基酸的性质相比的物理性质来确定。除了指示为保守的氨基酸之外的氨基酸可在蛋白质或酶中不同,使得具有相似功能的任两种蛋白质之间的蛋白质或氨基酸序列相似性百分比可变化,并且可以是例如至少70%、至少80%、至少90%和至少95%,如根据比对方案所确定的。如本文所提及的“序列相似性”意指核苷酸或蛋白质序列相关的程度。两个序列之间的相似性程度可基于序列同一性和/或保守性的百分比。本文中的“序列同一性”意指两个核苷酸或氨基酸序列不变的程度。“序列比对”意指出于评估相似性程度的目的而排列两个或多个序列以达到最大水平的同一性(以及在氨基酸序列的情况下为保守性)的过程。用于比对序列和评估相似性/同一性的许多方法是本领域已知的,例如,其中相似性基于megalign算法的聚类法,以及blastn、blastp和fasta。当使用这些程序中的任一个时,可选择产生最高序列相似性的设置。本文所提及的氨基酸残基编号反映了非截短和未修饰的胱天蛋白酶-9多肽中的氨基酸位置,例如seqidno:9的氨基酸位置。seqidno:9提供了截短的胱天蛋白酶-9多肽的氨基酸序列,其不包含card结构域。因此,参考全长胱天蛋白酶-9氨基酸序列,seqidno:9以氨基酸残基编号135开始,并且以氨基酸残基编号416结束。如果期望,本领域普通技术人员可将序列与胱天蛋白酶-9多肽的其他序列比对,以例如使用本文所讨论的序列比对方法关联氨基酸残基编号。如本文所用的术语“cdna”意在指使用信使rna(mrna)作为模板制备的dna。与从基因组、未加工或部分加工的rna模板聚合的基因组dna或dna相反,使用cdna的优点在于cdna主要含有相应蛋白质的编码序列。有时使用全部或部分基因组序列,例如在非编码区是最佳表达所需的情况下,或者在非编码区(例如内含子)将在反义策略中被靶向的情况下。如本文所用的术语“表达构建体”或“转基因”被定义为含有编码基因产物的核酸的任何类型的遗传构建体可被插入到载体中,其中部分或全部核酸编码序列能够被转录。转录物被翻译成蛋白质,但未必如此。在某些实施方案中,表达包括基因的转录和mrna翻译成基因产物两者。在其他实施方案中,表达仅包括编码目标基因的核酸的转录。术语“治疗性构建体”也可用于指表达构建体或转基因。表达构建体或转基因可用作例如治疗过度增殖性疾病或病症(例如癌症)的疗法,因此所述表达构建体或转基因是治疗性构建体或预防性构建体。如本文所用的术语“表达载体”是指含有编码能够被转录的至少部分基因产物的核酸序列的载体。在一些情况下,rna分子然后被翻译成蛋白质、多肽或肽。在其他情况下,这些序列不被翻译,例如在反义分子或核酶的产生中。表达载体可含有多种控制序列,所述控制序列是指特定宿主生物体中操作性地连接的编码序列的转录和可能的翻译所需的核酸序列。除了控制转录和翻译的控制序列之外,载体和表达载体还可含有还发挥其他功能并且在下文中讨论的核酸序列。如本文所用的术语“离体”是指机体“之外”。术语“离体”和“体外”在本文中可互换使用。如本文所用的术语“功能上等同”,在其涉及胱天蛋白酶-9或截短的胱天蛋白酶-9时,例如是指胱天蛋白酶-9核酸片段、变体或类似物时,是指编码刺激细胞凋亡应答的胱天蛋白酶-9多肽的核酸,或刺激细胞凋亡应答的胱天蛋白酶-9多肽。“功能等同”是指例如缺少card结构域、但能够诱导细胞凋亡性细胞应答的胱天蛋白酶-9多肽。当术语“功能上等同”被应用于其他核酸或多肽,例如cd19、5'ltr、多聚体配体结合区或cd3时,它是指具有与本文方法的参考多肽具有相同或相似的活性的片段、变体等。如本文所用的术语“基因”被定义为功能性蛋白质、多肽或肽的编码单元。如将理解的,该功能性术语包括表达或适于表达蛋白质、多肽、结构域、肽、融合蛋白质和突变体的基因组序列、cdna序列和更小的工程化基因区段。术语“过度增殖性疾病”被定义为由细胞过度增殖引起的疾病。示例性的过度增殖性疾病包括但不限于癌症或自身免疫疾病。其他过度增殖性疾病可包括血管闭塞、再狭窄、动脉粥样硬化或炎性肠病。术语“免疫原性组合物”或“免疫原”是指能够诱发免疫应答的物质。免疫原的示例包括例如抗原、在诱导自身免疫疾病中起作用的自身抗原和在癌细胞上表达的肿瘤相关抗原。如本文所用的术语“免疫受损”被定义为免疫系统降低或减弱的受试者。免疫受损病况可能归因于免疫系统的缺陷或功能障碍,或归因于增加对感染和/或疾病的易感性的其他因素。尽管这样的分类可为评价提供概念基础,但免疫受损个体经常并不完全适合于一个组或另一组。机体防御机制中的超过一个的缺陷可能受到影响。例如,患有由hiv引起的特异性t淋巴细胞缺陷的个体还可能患有由用于抗病毒疗法的药物引起的中性粒细胞减少,或由于皮肤和粘膜完整性的破坏而免疫受损。免疫受损状态可由留置中枢线或归因于静脉内药物滥用的其他类型损伤引起;或由继发性恶性肿瘤、营养不良或已感染其他传染原(infectiousagent)(例如结核病或性传播疾病(例如梅毒或肝炎))引起。如本文所用的术语“药学上或药理学上可接受的”是指当向动物或人施用时不产生不利的、过敏的或其他不良反应的分子实体和组合物。如本文所用的“药学上可接受的运载体(carrier)”包括任何和所有的溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等。此类介质和试剂用于药物活性物质的用途是本领域熟知的。除了任何常规介质或试剂与本文中所呈现的载体或细胞不相容之外,涵盖其在治疗性组合物中的用途。还可将补充活性成分掺入组合物中。如本文所用的术语“多核苷酸”被定义为核苷酸链。此外,核酸是核苷酸的聚合物。因此,如本文所用的核酸和多核苷酸可互换。核酸是可水解成单体“核苷酸”的多核苷酸。单体核苷酸可水解成核苷。如本文所用的多核苷酸包括但不限于通过本领域可用的任何手段(包括但不限于重组手段,即使用常规克隆技术和pcrtm等从重组文库或细胞基因组克隆核酸序列)和通过合成手段所获得的所有核酸序列。此外,多核苷酸包含多核苷酸的突变,包括但不限于通过本领域众所周知的方法获得的核苷酸或核苷的突变。核酸可包含一个或多个多核苷酸。如本文所用的术语“多肽”被定义为通常具有限定序列的氨基酸残基链。如本文所用的术语多肽与术语“肽”和“蛋白质”可互换。如本文所用的术语“启动子”被定义为起始基因特异性转录所需的由细胞合成机器或引入的合成机器识别的dna序列。术语“转染”和“转导”可互换,并且是指将外源dna序列引入真核宿主细胞的过程。转染(或转导)可通过多种手段中的任何一种来实现,包括电穿孔、显微注射、基因枪递送、逆转录病毒感染、脂质体转染(lipofection)、超染(superfection)等。如本文所用的术语“同系”是指基因型相同或足够密切相关而允许组织移植或者免疫相容的细胞、组织或动物。例如,相同近交系的同卵双胎或动物。同系和同基因(isogeneic)可互换使用。术语“患者”或“受试者”可互换,并且如本文所用,包括但不限于生物体或动物;哺乳动物,包括例如人、非人灵长类动物(例如猴)、小鼠、猪、牛、山羊、兔、大鼠、豚鼠、仓鼠、马、猴、羊或其他非人哺乳动物;非哺乳动物,包括例如非哺乳动物脊椎动物,例如鸟(例如鸡或鸭)或鱼;和非哺乳动物无脊椎动物。“t细胞活化分子”意指当掺入表达嵌合抗原受体的t细胞中时增强t细胞活化的多肽。示例包括但不限于含有itam的信号1赋予分子,例如cd3ζ多肽,和fc受体γ,例如fcε受体γ(fcεr1γ)亚基(haynes,n.m.等,j.immunol.166:182-7(2001))j.immunology)。如本文所用的术语“在转录控制下”或“操作性地连接”被定义为启动子相对于核酸处于正确的位置和定向以控制rna聚合酶起始和基因表达。如本文所用的术语“治疗(treatment)”、“治疗(treat)”、“治疗(treated)”或“治疗(treating)”是指预防和/或疗法。如本文所用的术语“疫苗”是指含有本文所呈现的组合物的制剂,其呈能够向动物施用的形式。通常,疫苗包含其中悬浮或溶解组合物的常规盐水或缓冲水溶液介质。在这种形式下,所述组合物可方便地用于预防、改善或以其他方式治疗病况。在引入受试者中之后,疫苗能够诱发免疫应答,包括但不限于抗体、细胞因子和/或其他细胞应答的产生。在一些实施方案中,核酸包含在病毒载体内。在某些实施方案中,病毒载体是逆转录病毒载体。在某些实施方案中,病毒载体是腺病毒载体或慢病毒载体。应当理解,在一些实施方案中,使抗原呈递细胞与病毒载体离体接触,并且在一些实施方案中,使抗原呈递细胞与病毒载体在体内接触。造血干细胞和细胞疗法造血干细胞包括造血祖细胞、可分化成成熟血细胞类型的未成熟多能细胞。这些干细胞和祖细胞可从骨髓和脐带血中分离,并且在一些情况下可从外周血中分离。其他干细胞和祖细胞包括例如间充质基质细胞、胚胎干细胞和诱导型多能干细胞。骨髓来源的间充质基质细胞(msc)已被定义为单核骨髓细胞的一部分,所述单核骨髓细胞在标准培养条件下粘附到塑料培养皿,对于造血谱系标志物为阴性,对于cd73、cd90和cd105为阳性,并且能够在体外分化成脂肪细胞、成骨细胞和成软骨细胞。推测一种生理作用是支持血细胞生成,而数项报道还证实,msc能够在诸如瘢痕组织和肿瘤组织的活跃生长区域中并入且可能增殖,并且能够归巢到它们的天然微环境并替代患病细胞的功能。msc的分化潜力和归巢能力使它们成为用于细胞疗法的有吸引力的媒介物(vehicle),无论是以它们的天然形式用于再生应用,还是通过它们的遗传修饰用于将活性生物制剂递送到特定的微环境,例如患病骨髓或转移性沉积物。另外,msc具有有效的内在免疫抑制活性,并且迄今为止已发现它们在移植物抗宿主病和自身免疫疾病的实验性治疗中最频繁的应用(pittenger,m.f.等,(1999).science284:143-147;dominici,m.等,(2006).cytotherapy8:315-317;prockop,d.j.(1997).science276:71-74;lee,r.h.等,(2006).procnatlacadsciusa103:17438-17443;studeny,m.等,(2002).cancerres62:3603-3608;studeny,m.等,(2004).jnatlcancerinst96:1593-1603;horwitz,e.m.等,(1999).natmed5:309-313;chamberlain,g.等,(2007).stemcells25:2739-2749;phinney,d.g.和prockop,d.j.(2007).stemcells25:2896-2902;horwitz,e.m.等,(2002).procnatlacadsciusa99:8932-8937;hall,b.等,(2007).intjhematol86:8-16;nauta,a.j.和fibbe,w.e.(2007).blood110:3499-3506;leblanc,k.等,(2008).lancet371:1579-1586;tyndall,a.和uccelli,a.(2009).bonemarrowtransplant)。已在数百名患者中输注msc,报道了最小的副作用。然而,随访是有限的,长期的副作用是未知的,并且对于将与将来的努力相关的后果所知甚少,所述努力为诱导msc体内分化为例如软骨或骨骼,或对它们进行遗传修饰以增强它们的功能性。数种动物模型已引发安全担忧。例如,已在来源于小鼠的msc中观察到培养物中的骨肉瘤自发形成。此外,异位骨化和钙化病灶已在局部注射msc之后的心肌梗塞小鼠和大鼠模型中加以讨论,并且它们的致心律失常潜力在与新生大鼠心室肌细胞的共培养实验中也已经是显而易见的。此外,已在狗中进行骨髓移植之后观察到双侧弥漫性肺骨化,推测这归因于移植的基质组分(horwitz,e.m.等,(2007).biolbloodmarrowtransplant13:53-57;tolar,j.等,(2007).stemcells25:371-379;yoon,y.-s.等,(2004).circulation109:3154-3157;breitbach,m.等,(2007).blood110:1362-1369;chang,m.g.等,(2006).circulation113:1832-1841;sale,g.e.和storb,r.(1983).exphematol11:961-966)。在细胞疗法的另一示例中,已向患者施用用编码嵌合抗原受体的核酸转导的t细胞以治疗癌症(zhong,x.-s.,(2010)molecuartherapy18:413-420)。嵌合抗原受体(car)是人工受体,其被设计为向t细胞传递抗原特异性而不需要mhc抗原呈递。它们包括抗原特异性组分、跨膜组分和胞内组分,所述胞内组分被选择用于活化t细胞并提供特异性免疫。表达嵌合抗原受体的t细胞可用于各种疗法,包括癌症疗法。共刺激多肽可用于增强针对靶抗原的表达car的t细胞的活化,并因此增加过继性免疫疗法的效力。例如,表达基于人源化单克隆抗体曲妥珠单抗(trastuzumab)(赫赛汀(herceptin))的嵌合抗原受体的t细胞已被用于治疗癌症患者。然而,可能发生不良事件,并且在至少一个报道的病例中,所述疗法对患者具有致命的后果(morgan,r.a.等,(2010)moleculartherapy18:843-851)。用如本文所呈现的基于嵌合胱天蛋白酶-9的安全开关转导细胞将提供可阻止不利事件发展的安全开关。因此,在一些实施方案中提供了核酸、细胞和方法,其中修饰的t细胞还表达诱导型胱天蛋白酶-9多肽。如果需要例如减少嵌合抗原受体修饰的t细胞的数目,则可向患者施用诱导型配体,从而诱导修饰的t细胞的细胞凋亡。由于car分子已掺入了另外的信号传导结构域以提高它们的效力,因此来自用经工程化以表达嵌合抗原受体(car)的t细胞进行的免疫疗法的抗肿瘤功效已稳步改善。用仅含有cd3ζ胞内信号传导分子的第一代car转导的t细胞已证实在过继性转移后在体内的差持久性和扩增性(tillbg,jensenmc,wangj等:使用具有cd28和4-1bb结构域的嵌合抗原受体对淋巴瘤的cd20特异性过继性免疫疗法:先导临床试验结果(cd20-specificadoptiveimmunotherapyforlymphomausingachimericantigenreceptorwithbothcd28and4-1bbdomains:pilotclinicaltrialresults).blood119:3940-50,2012;pulema,savoldob,myersgd等:经工程化以共表达肿瘤特异性受体的病毒特异性t细胞:在成神经细胞瘤个体中的持久性和抗肿瘤活性(virus-specifictcellsengineeredtocoexpresstumor-specificreceptors:persistenceandantitumoractivityinindividualswithneuroblastoma).natmed14:1264-70,2008;kershawmh,westwoodja,parkerll等:关于使用基因修饰的t细胞对卵巢癌进行过继性免疫疗法的1期研究(aphase1studyonadoptiveimmunotherapyusinggene-modifiedtcellsforovariancancer).clincancerres12:6106-15,2006),因为肿瘤细胞经常缺少完整t细胞活化所必需的必不可少的共刺激分子。第二代cart细胞被设计用于改善细胞的增殖和存活。掺入来自cd28或4-1bb的胞内共刺激结构域的第二代cart细胞(carpenitoc,milonemc,hassanr等:用含有cd28和cd137结构域的遗传重靶向的人t细胞控制大的已建立的肿瘤异种移植物(controloflarge,establishedtumorxenograftswithgeneticallyretargetedhumantcellscontainingcd28andcd137domains).procnatlacadsciusa106:3360-5,2009;songdg,yeq,poussinm等:cd27共刺激增强重定向人t细胞在体内的存活和抗肿瘤活性(cd27costimulationaugmentsthesurvivalandantitumoractivityofredirectedhumantcellsinvivo).blood119:696-706,2012)显示过继性转移后改善的存活和体内扩增,并且使用含有这些共刺激分子的抗cd19car-修饰的t细胞的最近临床试验已显示出对于治疗cd19+白血病的显著功效。(kalosm,levinebl,porterdl等:具有嵌合抗原受体的t细胞具有有效的抗肿瘤作用并且可在晚期白血病患者中建立记忆(tcellswithchimericantigenreceptorshavepotentantitumoreffectsandcanestablishmemoryinpatientswithadvancedleukemia).scitranslmed3:95ra73,2011;porterdl,levinebl,kalosm等:慢性淋巴样白血病中的嵌合抗原受体修饰的t细胞(chimericantigenreceptor-modifiedtcellsinchroniclymphoidleukemia).nengljmed365:725-33,2011;brentjensrj,davilaml,rivierei等:cd19靶向t细胞快速诱导化疗难治性急性成淋巴细胞性白血病成人的分子缓解(cd19-targetedtcellsrapidlyinducemolecularremissionsinadultswithchemotherapy-refractoryacutelymphoblasticleukemia).scitranslmed5:177ra38,2013)。虽然其他人已探索来自肿瘤坏死因子(tnf)家族蛋白质的另外的信号传导分子,例如ox40和4-1bb,称为“第三代”cart细胞(finneyhm,akbaran,lawsonad:用嵌合受体活化静息人原代t细胞:与来自tcrζ链的信号串联的来自cd28、诱导型共刺激物、cd134和cd137的共刺激(activationofrestinghumanprimarytcellswithchimericreceptors:costimulationfromcd28,induciblecostimulator,cd134,andcd137inserieswithsignalsfromthetcrzetachain).jimmunol172:104-13,2004;guedans,chenx,madara等:基于icos的嵌合抗原受体程序双极性th17/th1细胞(icos-basedchimericantigenreceptorsprogrambipolarth17/th1cells).blood,2014),但诱导不同于cd3ζ活化t细胞核因子(nfat)途径的t细胞信号转导的其他分子可为t细胞存活和增殖提供必要的共刺激,并且可赋予cart细胞不是由更常规的共刺激分子提供的另外有价值的功能。已表明一些第二代和第三代cart细胞由于高活化t细胞引起的细胞因子风暴和肿瘤溶解综合征而与患者死亡有关。“嵌合抗原受体”或“car”意指例如嵌合多肽,其包含连接到跨膜多肽的识别靶抗原的多肽序列(抗原识别结构域)和胞内结构域多肽,所述胞内结构域多肽被选择用于活化t细胞并提供特异性免疫。抗原识别结构域可以是单链可变片段(scfv),或者可例如来源于其他分子,例如t细胞受体或模式识别受体。胞内结构域包含引起t细胞活化的至少一种多肽,例如但不限于cd3ζ,以及例如共刺激分子,例如但不限于cd28、ox40和4-1bb。术语“嵌合抗原受体”还可指不来源于抗体但为嵌合t细胞受体的嵌合受体。这些嵌合t细胞受体可包含识别靶抗原的多肽序列,其中识别序列可以是例如但不限于来源于t细胞受体或scfv的识别序列。胞内结构域多肽是起活化t细胞作用的那些。嵌合t细胞受体在例如gross,g.和eshar,z.,fasebjournal6:3370-3378(1992);和zhang,y.等,plospathogens6:1-13(2010)中有讨论。在一种类型的嵌合抗原受体(car)中,肿瘤特异性单克隆抗体的可变重链(vh)和轻链(vl)与来自t细胞受体复合物的cd3ζ链(ζ)符合读框地融合。通常使用柔性甘氨酸-丝氨酸接头将vh和vl连接在一起,然后通过间隔物(ch2ch3)将其附接到跨膜结构域,以使scfv远离细胞表面延伸,使得其可与肿瘤抗原相互作用。在转导后,t细胞现在在其表面上表达car,并且在与肿瘤抗原接触并连接后,通过cd3ζ链发出信号,诱导细胞毒性和细胞活化。研究人员已指出,通过cd3ζ活化t细胞足以诱导肿瘤特异性杀伤,但不足以诱导t细胞增殖和存活。使用仅表达ζ链的第一代car修饰的t细胞的早期临床试验显示基因修饰的t细胞在体内展示出差的存活和增殖。由于通过b7轴的共刺激对于完全t细胞活化是必需的,因此研究人员将共刺激多肽cd28信号传导结构域添加到car构建体。该区域通常含有跨膜区(代替cd3ζ形式)和用于结合pi3k和lck的ymnm基序。表达仅具有ζ的car的t细胞或表达具有ζ和cd28两者的t细胞之间的体内比较证实cd28增强体内扩增,这部分归因于活化后il-2产生增加。包含cd28被称为第二代car。最常用的共刺激分子包括cd28和4-1bb,它们在肿瘤识别后可起始信号传导级联,导致nf-κb活化,从而促进t细胞增殖和细胞存活两者。在car设计中使用共刺激多肽4-1bb或ox40进一步改善了t细胞存活和功效。特别是4-1bb似乎极大地增强t细胞增殖和存活。该第三代设计(具有3个信号传导结构域)已被用于psmacar(zhongxs等,molther.2010年2月;18(2):413-20)和cd19car中,最显著地用于治疗cll(milone,m.c.等,(2009)mol.ther.17:1453-1464;kalos,m.等,sci.transl.med.(2011)3:95ra73;porter,d.等,(2011)n.engl.j.med.365:725-533)。这些细胞在3名患者中显示出令人印象深刻的功能,在体内扩增超过1000倍,并且在所有三名患者中产生持久的缓解。应当理解,“衍生”意指核苷酸序列或氨基酸序列可衍生自所述分子的序列。胞内结构域包含引起t细胞活化的至少一种多肽,例如但不限于cd3ζ,以及例如共刺激分子,例如但不限于cd28、ox40和4-1bb。t细胞受体是由t细胞表面上的两种不同多肽构成的分子。它们识别结合主要组织相容性复合物分子的抗原;在用抗原识别后,t细胞被活化。“识别”意指例如t细胞受体或其一个或多个片段(例如tcrα多肽和tcrβ一起)能够接触抗原并将其鉴别为靶标。tcr可包含α和β多肽或链。α多肽和β多肽包含两个胞外结构域,即可变结构域和恒定结构域。α多肽和β多肽的可变结构域具有三个互补决定区(cdr);cdr3被认为是负责识别表位的主要cdr。α多肽包括由vj重组产生的v区和j区,并且β多肽包括由vdj重组产生的v区、d区和j区。vj区和vdj区的交点对应于cdr3区。经常使用国际免疫遗传学(internationalimmunogenetics)(imgt)tcr命名法(imgt数据库,www.imgt.org;giudicelli,v.等,imgt/ligm-db,免疫球蛋白和t细胞受体核苷酸序列的综合数据库(comprehensivedatabaseofimmunoglobulinandtcellreceptornucleotidesequences),nucl.acidsres.,34,d781-d784(2006).pmid:16381979;t细胞受体概况(tcellreceptorfactsbook),lefranc和lefranc,academicpressisbn0-12-441352-8)来命名tcr。嵌合t细胞受体可结合例如抗原性多肽,例如bob-1、prame和ny-eso-1。(2015年11月2日提交的标题为“针对抗bob1的t细胞受体和其用途(tcellreceptorsdirectedagainstbob1andusesthereof)”的美国专利申请号14/930,572以及2015年3月10日提交的标题为“针对黑色素瘤的优先表达抗原的t细胞受体和其用途(tcellreceptorsdirectedagainstthepreferentially-expressedantigenofmelanomaandusesthereof)”的美国临时专利申请号62/130,884,所述专利申请中的每一个的全部内容均以引用方式并入本文)。在细胞疗法的另一示例中,t细胞被修饰成使得它们表达非功能性tgf-β受体,使它们抵抗对tgf-β。这允许修饰的t细胞避免由tgf-β引起的细胞毒性,并允许将所述细胞用于细胞疗法(bollard,c.j.等,(2002)blood99:3179-3187;bollard,c.m.等,(2004)j.exptl.med.200:1623-1633)。然而,它还可能导致t细胞淋巴瘤或其他不良作用,因为修饰的t细胞现在缺少正常细胞控制的一部分;这些治疗性t细胞本身可能变成恶性。用如本文所呈现的基于嵌合胱氨酸蛋白酶-9的安全开关转导这些修饰的t细胞将提供可避免该结果的安全开关。在其他示例中,天然杀伤细胞被修饰以表达膜靶向多肽。在某些实施方案中,代替嵌合抗原受体,异源膜结合多肽是nkg2d受体。nkg2d受体可结合肿瘤细胞上的应激蛋白质(例如mica/b),并且可由此活化nk细胞。胞外结合结构域还可融合到信号传导结构域(barber,a.等,cancerres2007;67:5003–8;barbera等,exphematol.2008;36:1318-28;zhangt.等,cancerres.2007;67:11029-36.),并且这进而可连接到frb结构域,类似于frb连接的car。此外,其他细胞表面受体(例如vegf-r)可用作用于frb结构域的对接(docking)位点,以在存在在许多肿瘤内以高水平发现的缺氧触发的vegf的情况下增强肿瘤依赖性成簇。用于细胞疗法中的表达异源基因(例如修饰受体或嵌合受体)的细胞可在用所述异源基因转导所述细胞之前、之后或同时用编码嵌合胱天蛋白酶-9安全开关的核酸转导。单倍体相同的干细胞移植尽管干细胞移植已被证明是治疗涉及造血干细胞和其后代的众多种疾病的有效手段,但组织相容性供体的短缺已被证明是所述方法最广泛应用的主要障碍。引入大批无关的干细胞供体和/或脐带血库已帮助缓解了这一问题,但许多患者仍然不适合于两种来源中的任一种。即使在可找到匹配的供体时,开始搜寻和收集干细胞之间的耗用时间也通常超过三个月,这是可能使许多最需要的患者死亡的延迟。因此,在利用hla单倍体相同的家族供体方面已经引起了相当大的兴趣。此类供体可以是父母、兄弟姐妹或二级亲属。移植物排斥的问题可通过适当的调理和大剂量的干细胞的组合来克服,而移植物抗宿主病(gvhd)可通过供体移植物的广泛t细胞耗竭来预防。此类程序的直接结局令人满意,对于成人和儿童两者来说,植入率>90%且严重gvhd率<10%,甚至不存在移植后免疫抑制。不幸的是,移植程序的深度免疫抑制,联同供体和接受者之间广泛的t细胞耗竭和hla错配,导致移植后感染并发症的极高比率,并且导致疾病复发的高发生率。供体t细胞输注是用于在同种异体干细胞移植后赋予抗病毒和抗肿瘤免疫的有效策略。然而,在单倍体相同移植之后将t细胞简单回加(addback)到患者不能起作用;同种异体反应性t细胞的频率比例如病毒特异性t淋巴细胞的频率高数个数量级。正在开发通过施用首先被耗竭同种异体反应性细胞的供体t细胞来加速免疫重建的方法。实现这一点的一种方法是用接受者ebv转化的b成淋巴细胞样细胞系(lcl)刺激供体t细胞。同种异体反应性t细胞上调cd25表达,并且被cd25mab免疫毒素缀合物rft5-smpt-dga消除。该化合物由通过异双官能交联剂[n-琥珀酰亚胺基氧基羰基-α-甲基-d-(2-吡啶基硫基)甲苯]缀合到化学去糖基化蓖麻毒蛋白a链(dga)的鼠igg1抗cd25(il-2受体α链)组成。在lcl刺激之后用cd25免疫毒素治疗耗竭>90%的同种异体反应性细胞。在1期临床研究中,在以两种剂量水平将同种异体耗竭的供体t细胞输注到耗竭t细胞的单倍体相同sct的接受者中之后,使用cd25免疫毒素耗竭同种异体淋巴细胞进行免疫重建。对8名患者以104个细胞/kg/剂量治疗,并且8名患者接受105个细胞/kg/剂量。与接受104个细胞/kg/剂量的患者相比,接收105个细胞/kg/剂量的患者显示出在sct之后3个月、4个月和5个月显著改善的t细胞恢复(p<.05)。由于效应记忆(cd45ra(-)ccr-7(-))群体的扩增(p<.05)而发生加速的t细胞恢复,表明保护性t细胞应答可能是长期的。在剂量水平2的患者中重建的t细胞中未检测到t细胞受体信号接合切除环(t-cell-receptorsignaljointexcisioncircle)(trec),表明它们可能来源于输注的同种异体耗竭细胞。在4个月时对t细胞进行的谱型分析(spectratyping)证实多克隆vβ谱。使用四聚体和酶联免疫斑点(elispot)测定,早在移植后2到4个月时,在剂量水平2的6名可评价患者中的4名中出现巨细胞病毒(cmv)特异性应答和爱泼斯坦巴尔病毒(epstein-barrvirus)(ebv)特异性应答,而在剂量水平1的患者中直到6到12个月才观察到此类反应。显著急性(16名中有2名)和慢性移植物抗宿主病(gvhd;15名中有2名)的发生率很低。这些数据证实,同种异体耗竭的供体t细胞可被安全地用于改善单倍体相同的sct之后的t细胞恢复。随后在没有gvhd迹象的情况下,将输注的细胞量逐步升高到106个细胞/kg。尽管这种方法重建抗病毒免疫,但复发仍然是主要问题,并且出于高风险白血病而移植的6名患者复发并死于疾病。因此,更高的t细胞剂量可用于重建抗肿瘤免疫并提供所希望的抗肿瘤作用,因为肿瘤反应性前体的估计频率比病毒反应性前体的频率小1到2个对数。然而,在一些患者中,这些剂量的细胞即使在同种异体耗竭后也足以触发gvhd(hurleyck等,biolbloodmarrowtransplant2003;9:610-615;deybr等,br.jhaematol.2006;135:423-437;aversaf等,nengljmed1998;339:1186-1193;aversaf等,jclin.oncol.2005;23:3447-3454;langp,mol.dis.2004;33:281-287;kolbhj等,blood2004;103:767-776;gottschalks等,annu.rev.med2005;56:29-44;bleakleym等,nat.rev.cancer2004;4:371-380;andre-schmutzi等,lancet2002;360:130-137;solomonsr等,blood2005;106:1123-1129;amroliapj等,blood2006;108:1797-1808;amroliapj等,blood2003;ghetiev等,jimmunolmethods1991;142:223-230;molldremjj等,cancerres1999;59:2675-2681;rezvanik等,ciin.cancerres.2005;11:8799-8807;rezvanik等,blood2003;102:2892-2900)。移植物抗宿主病(gvhd)移植物抗宿主病是在将供体免疫活性细胞(例如t细胞)移植到接受者中之后有时发生的病况。移植细胞将接受者的细胞识别为外来的,并且攻击并摧毁它们。这种情况可能是t细胞移植的危险效应,尤其是当与单倍体相同的干细胞移植相关时。应输注足够的t细胞以提供有益作用,例如免疫系统的重建和移植物抗肿瘤作用。但可移植的t细胞的数目可能受到移植会导致严重移植物抗宿主病的担忧的限制。移植物抗宿主病可如下表中所示分期:分期急性gvhd分级可通过共识会议准则(przepiorkad等,1994年急性gvhd分级共识会议(consensusconferenceonacutegvhdgrading).bonemarrowtransplant1995;15:825-828)进行。急性gvhd的分级指数皮肤肝肠道上消化道0没有和没有和没有和无i1-2期和没有和无无ii3期和/或1期和/或1期和/或1期iii非3期与2-3期或2-4期n/aiv4期或4期n/an/a作为用于细胞疗法和用于遗传工程化细胞移植的“安全开关”的诱导型胱天蛋白酶-9降低移植物抗宿主病的作用意指例如gvhd症状降低而使得可将患者指派为更低水平的分期,或者例如移植物抗宿主病症状降低至少20%、30%、40%、50%、60%、70%、80%、90%、95%或99%。还可通过检测参与gvhd反应的活化t细胞的减少(例如表达标志物蛋白质(例如cd19)且表达cd3的细胞(例如cd3+cd19+细胞)减少至少30%、40%、50%、60%、70%、75%、80%、85%、90%、95%或99%)来测量移植物抗宿主病作用的降低。本文提供了一种替代的自杀基因策略,其基于与fkbp变体融合的人促细胞凋亡分子,所述fkbp变体经过优化以结合二聚化化学诱导物(cid)。变体可包含例如具有位置36处的氨基酸取代的fkbp区,所述氨基酸取代选自由缬氨酸、亮氨酸、异亮氨酸和丙氨酸组成的组(clacksont等,procnatlacadsciusa.1998,95:10437-10442)。ap1903是已在健康志愿者中证明安全的合成分子(iuliuccijd等,jclinpharmacol.2001,41:870-879)。该小分子的施用导致促细胞凋亡靶分子的交联和活化。已使用fas或含有fas相关的死亡结构域的蛋白质(fadd)的死亡效应物结构域(ded)作为促细胞凋亡分子探索了该诱导型系统在人t淋巴细胞中的应用。在施用cid之后,用这些诱导型死亡分子转导的最高达90%的t细胞经受细胞凋亡(thomisdc等,blood.2001,97:1249-1257;spencerdm等,currbiol.1996,6:839-847;fanl等,humgenether.1999,10:2273-2285;bergerc等,blood.2004,103:1261-1269;junkerk等,genether.2003,10:1189-197)。该自杀基因策略可用于任何用于细胞疗法的适当细胞,包括例如造血干细胞和其他祖细胞,包括例如间充质基质细胞、胚胎干细胞和诱导型多能干细胞。ap20187和ap1950(ap1903的合成形式)也可用作配体诱导物。(amarajf(97)pnas94:10618-23,clontechlaboratories-takarabio)。因此,在细胞疗法患者中存在需要去除转染或转导的治疗性细胞的病况的情况下,可使用由胱天蛋白酶-9催化的这种安全开关。可能需要去除细胞的病况包括例如gvhd、细胞不适当地分化成错误组织或细胞类型的更成熟细胞以及其他毒性。为了在不适当的分化的情况下活化胱天蛋白酶-9开关,可能使用组织特异性启动子。例如,在祖细胞分化成骨细胞和脂肪细胞并且不期望脂肪细胞的情况下,用于转染或转导祖细胞的载体可具有可操作地连接到胱天蛋白酶-9核苷酸序列的脂肪细胞特异性启动子。以这种方式,如果细胞分化成脂肪细胞,则在施用多聚体配体后,应当导致不适当分化的脂肪细胞的细胞凋亡。所述方法可用于例如可通过细胞疗法缓解的任何病症,包括癌症、血液或骨髓中的癌症、其他血液或骨髓源疾病,例如镰状细胞贫血和异染性脑白质营养不良,以及可通过干细胞移植缓解的任何病症,例如血液或骨髓疾病,例如镰状细胞贫血或异染性脑白质营养不良。过继性免疫疗法的功效可通过使治疗性t细胞抵抗由肿瘤细胞所采用的免疫逃避策略而得到增强。体外研究已显示,这可通过用显性负性(dominant-negative)受体或免疫调节细胞因子转导来实现(bollardcm等,blood.2002,99:3179-3187;wagnerhj等,cancergenether.2004,11:81-91)。此外,抗原特异性t细胞受体的转移允许将t-细胞疗法应用于更宽范围的肿瘤(pulem等,cytotherapy.2003,5:211-226;schumachertn,natrevimmunol.2002,2:512-519)。工程化人t细胞的自杀系统被开发并测试以允许其随后用于临床研究中。胱天蛋白酶-9已被修饰并显示在人t淋巴细胞中稳定表达,而不损害其功能和表型特征,同时证实对cid的敏感性,即使在具有上调的抗细胞凋亡分子的t细胞中。(straathof,k.c.等,2005,blood105:4248-54)。在用于基因疗法的遗传修饰细胞中,基因可以是来源于除了用于表达该基因的细胞以外的来源的异源多核苷酸序列。所述基因来源于原核或真核生物来源,例如细菌、病毒、酵母、寄生虫、植物或甚至动物。异源dna也来源于超过一种来源,即多基因构建体或融合蛋白质。异源dna还可包括来源于一个来源的调控序列和来自不同来源的基因。或者,异源dna可包括用于改变细胞内源基因的正常表达的调控序列。其他胱天蛋白酶分子可由当前技术的嵌合多肽编码的胱天蛋白酶-9以外的胱天蛋白酶多肽包括例如胱天蛋白酶-1、胱天蛋白酶-3和胱天蛋白酶-8。这些胱天蛋白酶多肽的讨论可见于例如maccorkle,r.a.等,proc.natl.acad.sci.u.s.a.(1998)95:3655-3660;和fan,l.等(1999)humangenetherapy10:2273-2285)。工程化表达构建体表达构建体编码多聚体配体结合区和胱天蛋白酶-9多肽,或者在某些实施方案中,编码多聚体配体结合区和连接到标志物多肽的胱天蛋白酶-9多肽,全部可操作地连接。一般来说,术语“可操作地连接”意在指示启动子序列功能性地连接到第二序列,其中例如启动子序列起始并介导对应于第二序列的dna的转录。胱天蛋白酶-9多肽可以是全长或截短的。在某些实施方案中,标志物多肽连接到胱天蛋白酶-9多肽。例如,标志物多肽可通过多肽序列(例如可切割的2a样序列)连接到胱天蛋白酶-9多肽。标志物多肽可以是例如cd19,或者可以是例如异源蛋白质,其被选择为不影响嵌合胱天蛋白酶多肽的活性。在一些实施方案中,多核苷酸可编码胱天蛋白酶-9多肽和异源蛋白质,所述异源蛋白质可以是例如标志物多肽并且可以是例如嵌合抗原受体。异源多肽(例如嵌合抗原受体)可通过多肽序列(例如可切割的2a样序列)连接到胱天蛋白酶-9多肽。在某些示例中,包含编码嵌合抗原受体的多核苷酸的核酸作为编码第二多肽的多核苷酸被包含在相同的载体(例如病毒载体或质粒载体)中。该第二多肽可以是例如本文所讨论的胱天蛋白酶多肽或标志物多肽。在这些示例中,构建体可被设计成具有一个可操作地连接到核酸的启动子,所述核酸包含编码两个多肽的多核苷酸,所述两个多肽由可切割的2a多肽连接。在该示例中,第一多肽和第二多肽在翻译期间被隔开,产生嵌合抗原受体多肽和第二多肽。在其他示例中,所述两个多肽可与相同的载体隔开表达,其中包含编码多肽之一的多核苷酸的每个核酸可操作地连接到单独的启动子。在其他示例中,一个启动子可以可操作地连接到两个核酸,指导两个单独的rna转录物的产生,并因此指导两个多肽的产生。因此,本文所讨论的表达构建体可包含至少一个或至少两个启动子。2a样序列或“可切割”2a序列来源于例如许多不同的病毒,包括例如来自明脉扁刺蛾β四体(thoseaasigna)。这些序列有时也被称为“肽跳行(skipping)序列”。当这种类型的序列被置于欲隔开的两个肽之间的顺反子内时,核糖体似乎跳过明脉扁刺蛾β四体序列的情况下的肽键,gly和pro氨基酸之间的键被省略。这留下了两个多肽,在这种情况下是胱天蛋白酶-9多肽和标志物多肽。当使用该序列时,在2a序列的5'编码的肽可在另外氨基酸的羧基末端终止,包括gly残基和2a序列中的任何上游残基。在2a序列的3'编码的肽可在另外氨基酸的氨基末端终止,包括pro残基和2a序列中的任何下游残基。“2a”或“2a样”序列是可引起肽键跳行的肽的一大家族的一部分。各种2a序列已被表征(例如f2a、p2a、t2a),并且是可用于本申请的多肽中的2a样序列的示例。在某些实施方案中,2a接头包含seqidno:306的氨基酸序列;在某些实施方案中,2a接头由seqidno:306的氨基酸序列组成。在一些实施方案中,2a接头包含seqidno:307的氨基酸序列;在一些实施方案中,2a接头由seqidno:307的氨基酸序列组成。在某些实施方案中,2a接头进一步包含在多肽的氨基末端处的gsg氨基酸序列,在其他实施方案中,2a接头包含在多肽的氨基末端处的gsgpr氨基酸序列。因此,就“2a”序列来说,该术语可指如本文所列的2a序列,或者还可指如本文所列的2a序列,其进一步包含在接头的氨基末端处的gsg或gsgpr序列。可将表达构建体插入载体(例如病毒载体或质粒)中。所提供的方法的步骤可使用任何适合的方法来进行;这些方法包括但不限于本文所呈现的转导、转化或以其他方式将核酸提供给抗原呈递细胞的方法。在一些实施方案中,截短的胱天蛋白酶-9多肽由seqidno8、seqidno:23、seqidno:25、seqidno:27的核苷酸序列或其功能等同片段编码,有或无dna接头,或具有seqidno:9、seqidno:24、seqidno:26或seqidno:28的氨基酸序列或其功能等同片段。在一些实施方案中,cd19多肽由seqidno14的核苷酸序列或其功能等同片段编码,有或无dna接头,或具有seqidno:15的氨基酸序列或其功能等同片段。胱天蛋白酶-9多肽的功能等同片段具有与seqidno:9的多肽基本上相同的诱导细胞凋亡的能力,其具有seqidno:9的多肽的至少50%、60%、70%、80%、90%或95%活性。cd19多肽的功能等同片段具有与seqidno:15的多肽基本上相同的充当待用于鉴别和选择转导细胞或转染细胞的标志物的能力,其中当与seqidno:15的多肽比较时,使用标准检测技术检测到至少50%、60%、70%、80%、90%或95%的标志物多肽。更特别地,超过一个配体结合结构域或多聚化区可被用于表达构建体中。此外,表达构建体含有膜靶向序列。适当的表达构建体可包含上述fkbp配体结合元件的任一侧上的共刺激多肽元件。在某些示例中,编码诱导型胱天蛋白酶多肽的多核苷酸作为编码嵌合抗原受体的多核苷酸被包含在相同的载体(例如病毒载体或质粒载体)中。在这些示例中,构建体可被设计成具有一个可操作地连接到核酸的启动子,所述核酸包含编码两个多肽的核苷酸序列,所述两个多肽由可切割的2a多肽连接。在该示例中,第一多肽和第二多肽在表达之后被切割,产生嵌合抗原受体多肽和诱导型胱天蛋白酶-9多肽。在其他示例中,所述两个多肽可与相同的载体隔开表达,其中包含编码多肽之一的核苷酸序列的每个核酸可操作地连接到单独的启动子。在其他示例中,一个启动子可以可操作地连接到两个核酸,指导两个单独的rna转录物的产生,并因此指导两个多肽的产生。因此,本文所讨论的表达构建体可包含至少一个或至少两个启动子。在其他示例中,可使用两个独立的载体在细胞中表达两种多肽。可将细胞与载体共转染或共转化,或者可在不同时间将载体引入细胞中。配体结合区表达构建体的配体结合(“二聚化”)结构域或多聚化区可以是允许使用天然或非天然配体(例如非天然合成配体)进行诱导的任何方便的结构域。多聚化区可在细胞膜的内部或外部,这取决于构建体的性质和配体的选择。已知众多种配体结合蛋白质,包括受体,包括与上述胞质区相关的配体结合蛋白质。如本文所用的术语“配体结合结构域”可与术语“受体”互换。特别感兴趣的是配体结合蛋白质,其配体(例如小有机配体)是已知的或可容易地产生。这些配体结合结构域或受体包括fkbp和亲环蛋白受体、类固醇受体、四环素受体、上述其他受体等,以及“非天然”受体,其可获自抗体、特别是重链或轻链亚基、其突变序列、通过随机程序获得的随机氨基酸序列、组合合成物等。在某些实施方案中,配体结合区选自由以下组成的组:fkbp配体结合区、亲环蛋白受体配体结合区、类固醇受体配体结合区、亲环蛋白受体配体结合区和四环素受体配体结合区。经常,所述配体结合区包含fv’fvls序列。有时,fv’fvls序列进一步包括另外的fv’序列。示例包括例如以下文献中所讨论的那些:kopytek,s.j.等,chemistry&biology7:313-321(2000)和gestwicki,j.e.等,combinatorialchem.&highthroughputscreening10:667-675(2007);clacksont(2006)chembioldrugdes67:440-2;clackson,t.,化学生物学:从小分子到系统生物学和药物设计(chemicalbiology:fromsmallmoleculestosystemsbiologyanddrugdesign)(schreiber,s.等编辑,wiley,2007))。多数情况下,配体结合结构域或受体结构域将有至少约50个氨基酸且少于约350个氨基酸、通常少于200个氨基酸,作为天然结构域或其截短活性部分。结合结构域可以是例如小的(<25kda,以允许病毒载体中的有效转染)、单体、非免疫原性,具有可合成获得的、可渗透细胞的非毒性配体,其可被配置用于二聚化。受体结构域可以是胞内或胞外的,这取决于表达构建体的设计和适合配体的可用性。对于疏水性配体,结合结构域可在膜的任一侧,但对于亲水性配体,特别是蛋白质配体,结合结构域通常将在细胞膜外部,除非有转运系统将配体内在化为可用于结合的形式。对于胞内受体,所述构建体可编码受体结构域序列的5'或3'的信号肽和跨膜结构域,或可具有受体结构域序列的5'的脂质附着信号序列。在受体结构域在信号肽和跨膜结构域之间的情况下,受体结构域将是细胞外。编码受体的表达构建体的部分可出于各种原因进行诱变。诱变的蛋白质可提供更高的结合亲和力,允许区分天然存在的受体的配体和诱变受体的配体,提供设计受体-配体对的机会等。受体的变化可涉及已知在结合位点的氨基酸的变化,使用组合技术的随机诱变,其中与结合位点相关的氨基酸或与构象变化相关的其他氨基酸的密码子可通过改变(已知的变化或随机地)特定氨基酸的密码子而进行诱变,在适当的原核宿主中表达所得蛋白质,然后筛选所得蛋白质的结合。抗体和抗体亚基,例如重链或轻链、特别是片段、更特别是全部或部分可变区,或重链和轻链的融合物(以产生高亲和力结合)可用作结合结构域。所涵盖的抗体包括为异位表达的人产物的抗体,例如不会触发免疫应答并且通常不在外周(即,在cns/脑区域之外)表达的胞外结构域。此类示例包括但不限于低亲和力神经生长因子受体(lngfr)和胚胎表面蛋白质(即癌胚抗原)。此外,可制备生理上可接受的针对半抗原分子的抗体和筛选结合亲和力的单个抗体亚基。编码亚基的cdna可通过缺失恒定区、部分可变区、诱变可变区等来分离和修饰,以获得具有对配体的适当亲和力的结合蛋白结构域。以这种方式,几乎任何生理上可接受的半抗原化合物均可用作配体或用于提供用于配体的表位。代替抗体单位,可采用天然受体,其中结合结构域是已知的并且有用于结合的有用配体。寡聚尽管其他结合事件(例如变构活化)可用于起始信号,但转导的信号通常将由配体介导的嵌合蛋白质分子的寡聚产生,即配体结合后的寡聚的结果。嵌合蛋白质的构建体将根据各个结构域的顺序和单个结构域的重复数目而变化。为了使受体多聚化,嵌合表面膜蛋白质的配体结合结构域/受体结构域的配体通常将是多聚体的,意义在于它将具有至少两个结合位点,每个结合位点能够结合配体受体结构域。“多聚体配体结合区”意指结合多聚体配体的配体结合区。术语“多聚体配体”包括二聚体配体。二聚体配体将具有能够结合配体受体结构域的两个结合位点。理想地,主题配体将是小合成有机分子的二聚体或更高级的寡聚物,通常不大于约四聚体,单个分子通常为至少约150da且小于约5kda,通常小于约3kda。可采用各种成对的合成配体和受体。例如,在涉及天然受体的实施方案中,二聚体fk506可与fkbp12受体使用,二聚化环孢菌素a可与亲环蛋白受体使用,二聚化雌激素可与雌激素受体使用,二聚化糖皮质激素可与糖皮质激素受体使用,二聚化四环素可与四环素受体使用,二聚化维生素d可与维生素d受体使用等。或者,可使用更高级的配体,例如三聚体。对于涉及非天然受体(例如抗体亚基、修饰的抗体亚基、包含串联的重链可变区和轻链可变区并由柔性接头结构域隔开的单链抗体、或修饰的受体和其突变序列等)的实施方案来说,可采用各种化合物中的任一种。这些配体单元的显著特征是每个结合位点能够以高亲和力结合受体,并且它们能够被化学二聚化。此外,有方法可用于平衡配体的疏水性/亲水性,使得它们能够以功能水平溶解于血清中,并在多数应用中扩散穿过质膜。在某些实施方案中,本方法利用化学诱导二聚化(cid)技术来产生条件控制的蛋白质或多肽。该技术除了是可诱导的之外,由于不稳定的二聚化剂的降解或单体竞争性抑制剂的施用,它还是可逆的。cid系统使用合成的二价配体来快速交联融合到配体结合域的信号传导分子。该系统已被用于触发细胞表面蛋白质的寡聚和活化(spencer,d.m.等,science,1993.262:第1019-1024页;spencerd.m.等,currbiol1996,6:839-847;blau,c.a.等,procnatlacad.sci.usa1997,94:3076-3081)或胞质蛋白质的寡聚和活化(luo,z.等,nature1996,383:181-185;maccorkle,r.a.等,procnatlacadsciusa1998,95:3655-3660)、将转录因子募集到dna元件以调节转录(ho,s.n.等,nature1996,382:822-826;rivera,v.m.等,nat.med.1996,2:1028-1032)或将信号传导分子募集到质膜以刺激信号传导(spencerd.m.等,proc.natl.acad.sci.usa1995,92:9805-9809;holsinger,l.j.等,proc.natl.acad.sci.usa1995,95:9810-9814)。cid系统基于表面受体聚集有效活化下游信号传导级联的概念。在最简单的实施方案中,cid系统使用可渗透脂质的免疫抑制剂药物fk506的二聚体类似物,其丧失其正常生物活性,而获得使遗传融合到fk506结合蛋白质fkbp12的分子交联的能力。通过将一个或多个fkbp融合到胱天蛋白酶-9,可以依赖于二聚化剂药物、但不依赖于胞外结构域的方式刺激胱天蛋白酶-9活性。这为系统提供了时间控制、使用单体药物类似物的可逆性和增强的特异性。第三代ap20187/ap1903cid对其结合结构域fkbp12的高亲和力允许重组受体体内特异性活化,而不会通过内源性fkbp12诱导非特异性副作用。还可使用具有氨基酸取代和缺失的fkbp12变体,例如fkbp12v36,其结合二聚化剂药物。包括但不限于fkbp12变体包括但不限于具有位置36处的氨基酸取代的那些,所述氨基酸取代选自由缬氨酸、亮氨酸、异亮氨酸和丙氨酸组成的组。另外,合成的配体抵抗蛋白酶降解,使它们比多数递送的蛋白质试剂更有效地体内活化受体。fkbp12意指野生型fkbp12多肽或其可包含氨基酸取代的类似物或衍生物,其维持与雷帕霉素的fkbp12结合活性;fkbp12多肽或多肽区以比fkbp12v36多肽小至少100倍的亲和力结合瑞米达西。在一些示例中,fkbp12多肽以比由seqidno:302的氨基酸序列组成的fkbp12变体多肽小至少100倍的亲和力结合配体,例如瑞米达西。fkbp12变体多肽意指以比野生型fkbp12多肽(例如由seqidno:301的氨基酸序列组成的野生型fkbp12多肽)高至少100倍的亲和力结合配体(例如瑞米达西)的fkbp12多肽。所用的配体能够结合两个或更多个配体结合结构域。当嵌合蛋白质含有超过一个配体结合结构域时,嵌合蛋白质可能能够结合超过一个配体。所述配体通常是非蛋白质或化学品。示例性的配体包括但不限于fk506(例如fk1012)。其他配体结合区可以是例如二聚体区或具有摆动取代的修饰的配体结合区,例如fkbp12(v36):f36取代为v的人12kdafk506结合蛋白质(完整的成熟编码序列(氨基酸1-107))提供了用于合成的二聚化剂药物ap1903的结合位点(jemal,a.等cacancerj.clinic.58,71-96(2008);scher,h.i.和kelly,w.k.,journalofclinicaloncology11,1566-72(1993))。所述蛋白质的两个串联拷贝也可用于构建体中,使得通过ap1903交联后诱导更高级的寡聚物。fkbp12变体也可用于fkbp12/frb多聚化区中。在一些实施方案中,用于这些融合物中的变体将结合雷帕霉素或雷帕霉素类似物,但将以比例如fkbp12v36小的亲和力结合瑞米达西。fkbp12变体的示例包括来自许多物种的那些,包括例如酵母。在一个实施方案中,fkbp12变体是fkbp12.6(calstablin)。在本申请中涵盖其他异二聚体。在一个实施方案中,钙调磷酸酶-a多肽或区域可用于代替frb多聚化区。在一些实施方案中,第一多聚化区的第一单元是钙调磷酸酶-a多肽。在一些实施方案中,第一多聚化区的第一单元是钙调磷酸酶-a多肽区,并且第一多聚化区的第二单元是fkbp12或fkbp12变体多聚化区。在一些实施方案中,第一多聚化区的第一单元是fkbp12或fkbp12变体多聚化区,并且第一多聚化区的第二单元是钙调磷酸酶-a多肽区。在这些实施方案中,第一配体包含例如环孢菌素。f36v'-fkbp:f36v'-fkbp是f36v-fkbp的密码子摆动形式。它编码与f36v-fkpb相同的多肽序列,但在核苷酸水平上仅具有62%的同源性。设计f36v'-fkbp以减少逆转录病毒载体中的重组(schellhammer,p.f.等,j.urol.157,1731-5(1997))。通过pcr组装程序构建f36v'-fkbp。所述转基因含有f36v'-fkbp的一个拷贝,所述拷贝直接连接到f36v-fkbp的一个拷贝。在一些实施方案中,配体是小分子。可选择用于所选配体结合区的适当配体。经常,配体是二聚体,有时配体是二聚体fk506或二聚体fk506样类似物。在某些实施方案中,配体是ap1903(cas索引名:2-哌啶羧酸,1-[(2s)-1-氧代-2-(3,4,5-三甲氧基苯基)丁基]-1,2-乙烷二基双[亚氨基(2-氧代-2,1-乙烷二基)氧基-3,1-亚苯基[(1r)-3-(3,4-二甲氧基苯基)亚丙基]]酯,[2s-[1(r*),2r*[s*[s*[1(r*),2r*]]]]]-(9ci)cas登记号:195514-63-7;分子式:c78h98n4o20分子量:1411.65)。在某些实施方案中,配体是ap20187。在某些实施方案中,配体是ap20187类似物,例如ap1510。在一些实施方案中,某些类似物将适于fkbp12,并且某些类似物将适于fkbp12的摆动形式。在某些实施方案中,在嵌合蛋白质中包含一个配体结合区。在其他实施方案中,包含两个或更多个配体结合区。例如,在配体结合区是fkbp12的情况下,在包括这些区域中的两个的情况下,一个区域例如可以是摆动形式。所涵盖的其他二聚化系统包括香豆霉素/dna促旋酶b系统。香豆霉素诱导的二聚化活化修饰的raf蛋白质并刺激map激酶级联。参见farrar,m.a.等,(1996)nature383,178–181。在其他实施方案中,可使用由grcrabtree和同事(liangfs等,scisignal.2011年3月15日;4(164):rs2)开发的脱落酸(aba)系统,但像dna促旋酶b,这依赖于将有免疫原性的外来蛋白质。膜靶向膜靶向序列或区域提供嵌合蛋白质向细胞表面膜的转运,其中相同序列或其他序列可编码嵌合蛋白质与细胞表面膜的结合。与细胞膜缔合的分子含有促进膜缔合的某些区域,并且可将此类区域掺入嵌合蛋白质分子中以产生膜靶向分子。例如,一些蛋白质在n-末端或c-末端含有被酰化的序列,并且这些酰基部分促进膜缔合。此类序列被酰基转移酶识别并且经常符合特定的序列基序。某些酰化基序能够用单个酰基部分(经常跟有数个带正电荷的残基(例如人c-src:m-g-s-n-k-s-k-p-k-d-a-s-q-r-r-r)修饰以改善与阴离子脂质头部基团的缔合),并且其他能够用多个酰基部分修饰。例如,蛋白质酪氨酸激酶src的n-末端序列可包含单个肉豆蔻酰基部分。双酰化区位于某些蛋白质激酶的n末端区内,例如src家族成员的亚类(例如yes、fyn、lck)和g蛋白质α亚基。此类双酰化区经常位于此类蛋白质的前18个氨基酸内,且符合序列基序met-gly-cys-xaa-cys,在met被切割的情况下,gly被n-酰化,并且cys残基之一被s-酰化。gly经常是肉豆蔻酰化的,并且cys可以是棕榈酰化的。还可利用来自g蛋白质γ亚基的c末端和其他蛋白质(例如万维网地址ebi.ac.uk/interpro/displayiproentry?ac=ipr001230)的与序列基序cys-ala-ala-xaa(所谓的“caax盒”)一致的酰化区域(其可用c15或c10异戊烯基部分进行修饰)。这些和其他酰化基序包括例如在gauthier-campbell等,molecularbiologyofthecell15:2205-2217(2004);glabati等,biochem.j.303:697-700(1994)和zlakine等,j.cellscience110:673-679(1997)中讨论的那些,并且可被掺入嵌合分子中以诱导膜定位。在某些实施方案中,将来自含有酰化基序的蛋白质的天然序列掺入嵌合蛋白质中。例如,在一些实施方案中,lck、fyn或yes或g蛋白质α亚基的n末端部分,例如来自此类蛋白质的前25个n末端氨基酸或更少氨基酸(例如具有任选突变的天然序列的约5到约20个氨基酸、约10个到约19个氨基酸或约15个到约19个氨基酸)可被掺入嵌合蛋白质的n末端内。在某些实施方案中,来自g蛋白质γ亚基的含caax盒基序序列的约25个氨基酸或更少氨基酸的c末端序列(例如具有任选突变的天然序列的约5到约20个氨基酸、约10到约18个氨基酸或约15到约18个氨基酸)可连接到嵌合蛋白质的c末端。在一些实施方案中,酰基部分具有+1到+6的logp值,并且有时具有+3到+4.5的logp值。logp值是疏水性的量度,并且经常来源于辛醇/水分配研究,其中具有更高疏水性的分子以更高频率分配到辛醇中并且被表征为具有更高的logp值。公布了许多亲脂性分子的logp值,并且可使用已知的分配方法计算logp值(例如chemicalreviews,第71卷,第6期,第599页,其中条目4493显示具有4.2的logp值的月桂酸)。任何酰基部分均可连接到上述肽组合物,并使用已知方法和下文所讨论的方法测试抗微生物活性。酰基部分有时是例如c1-c20烷基、c2-c20烯基、c2-c20炔基、c3-c6环烷基、c1-c4卤代烷基、c4-c12环烷基烷基、芳基、取代的芳基或芳基(c1-c4)烷基。任一含酰基部分有时是脂肪酸,并且脂肪酸部分的示例是丙基(c3)、丁基(c4)、戊基(c5)、己基(c6)、庚基(c7)、辛基(c8)、壬基(c9)、癸基(c10)、十一烷基(c11)、月桂基(c12)、肉豆蔻基(c14)、棕榈基(c16)、硬脂基(c18)、花生基(c20)、山嵛基(c22)和木蜡基(lignoceryl)部分(c24),并且每个部分可含有0个、1个、2个、3个、4个、5个、6个、7个或8个不饱和度(即双键)。酰基部分有时是脂质分子,例如磷脂酰脂(例如,磷脂酰丝氨酸、磷脂酰肌醇、磷脂酰乙醇胺、磷脂酰胆碱)、鞘脂(例如,鞘磷脂、鞘氨醇、神经酰胺、神经节苷脂、脑苷脂)或其修饰形式。在某些实施方案中,一个、两个、三个、四个或五个或更多个酰基部分连接到膜缔合区。本文中的嵌合蛋白质还可包含单遍次(single-pass)或多遍次(multiplepass)跨膜序列(例如,在嵌合蛋白质的n末端或c末端)。在某些cd分子、酪氨酸激酶受体、丝氨酸/苏氨酸激酶受体、tgfβ、bmp、活化素和磷酸酶中发现单遍次跨膜区。单遍次跨膜区经常包括信号肽区和约20到约25个氨基酸的跨膜区,其中许多氨基酸是疏水性氨基酸并可形成α螺旋。带正电荷的氨基酸的短轨迹经常跟随跨膜跨距(span)以将蛋白质锚定在膜中。多遍次蛋白质包括离子泵、离子通道和转运体,并且包括两个或更多个跨膜多次的螺旋。全部或基本上全部的多遍次蛋白质有时被掺入嵌合蛋白质中。单遍次和多遍次跨膜区的序列是已知的,并且可被选择用于掺入嵌合蛋白质分子中。可采用在宿主中有功能的任何膜靶向序列,并且其可或可不与嵌合蛋白质的其他结构域之一缔合。在一些实施方案中,此类序列包括但不限于肉豆蔻酰化靶向序列、棕榈酰化靶向序列、异戊二烯化序列(即法尼基化、香叶基香叶基化(geranyl-geranylation)、caax盒)、蛋白质-蛋白质相互作用基序或来自受体的跨膜序列(利用信号肽)。示例包括在例如tenkloosterjp等,biologyofthecell(2007)99,1-12;vincent,s.等,naturebiotechnology21:936-40,1098(2003)中讨论的那些。存在另外的蛋白质结构域,其可增加各种膜处的蛋白质保留。例如,在超过200种通常参与胞内信号传导的人蛋白质中发现约120个氨基酸的普列克底物蛋白(pleckstrin)同源性(ph)结构域。ph结构域可结合膜内的各种磷脂酰肌醇(pi)脂质(例如pi(3,4,5)-p3、pi(3,4)-p2、pi(4,5)-p2),因此在将蛋白质募集到不同的膜或细胞区室方面起关键作用。经常pi脂质的磷酸化状态受到调控,例如通过pi-3激酶或pten,因此膜与ph结构域的相互作用不如酰基脂质那样稳定。注射用ap1903ap1903api由alphoraresearch公司制造,并且注射用ap1903药物产品由formatech公司制备。它被配制为ap1903在非离子增溶剂solutolhs15(250mg/ml,basf)的25%溶液中的5mg/ml溶液。在室温下,该制剂是澄清的微黄色溶液。在制冷后,该制剂经历可逆的相变,产生乳状溶液。当再升温到室温时,这种相变被逆转。在3ml玻璃小瓶中填充2.33ml(每小瓶总计约10mg注射用ap1903)。将ap1903在给予患者之前的晚上从冰箱中取出并在大约21℃的温度下储存过夜,使得溶液在稀释前澄清。在开始输注后的30分钟内在玻璃瓶或聚乙烯瓶或非dehp袋中制备溶液,并将其在给予前储存在约21℃。所有研究用药均维持在2℃到8℃的温度,防止过度的光和热,并储存在限制接触的锁定区中。在确定需要施用ap1903并诱导诱导型胱天蛋白酶-9多肽后,可例如使用非dehp、非环氧乙烷灭菌输注器具在2小时内通过静脉内输注向患者施用单一固定剂量的注射用ap1903(0.4mg/kg)。ap1903的剂量针对所有患者单独计算,且除非体重波动≥10%,否则不重新计算。在输注之前,将计算的剂量在100ml0.9%生理盐水中稀释。在ap1903的先前1期研究中,用在2小时内以0.01mg/kg、0.05mg/kg、0.1mg/kg、0.5mg/kg和1.0mg/kg的剂量水平静脉内输注的单剂量的注射用ap1903处理24名健康志愿者。ap1903血浆水平与剂量成正比,在约0.01–1.0mg/kg剂量范围内,平均cmax值在大约10–1275ng/ml范围。在初始输注期后,血液浓度表现出快速分布期,血浆水平在给药后0.5小时、2小时和10小时分别降低到最大浓度的大约18%、7%和1%。注射用ap1903显示在所有剂量水平下均安全且良好耐受,并且证实有利的药物代谢动力学概况。iuliuccijd等,jclinpharmacol.41:870-9,2001。例如,所用的注射用ap1903的固定剂量可以是在2小时内静脉内输注的0.4mg/kg。体外用于细胞有效信号传导所需的ap1903的量为10–100nm(1600damw)。这等同于16-160μg/l或约0.016-1.6mg/kg(1.6-160μg/kg)。最高达1mg/kg的剂量在上文所讨论的ap1903的1期研究中良好耐受。因此,0.4mg/kg可能是与治疗性细胞组合的用于该i期研究的ap1903的安全且有效的剂量。可选标志物在某些实施方案中,表达构建体含有核酸构建体,其表达通过在表达构建体中包含标记而体外或体内鉴别。此类标志物将赋予细胞可识别的变化,从而允许容易鉴别含有表达构建体的细胞。通常包含药物选择标志物有助于克隆和转化体的选择。例如,赋予对新霉素、嘌呤霉素、潮霉素、dhfr、gpt、吉欧霉素(zeocin)和组氨醇的抗性的基因是有用的可选标志物。或者,采用诸如单纯疱疹病毒-i胸苷激酶(tk)的酶。还可采用含有胞外非信号传导结构域或各种蛋白质(例如cd34、cd19、lngfr)的免疫表面标志物,这允许用于磁性或荧光抗体介导的分选的直接方法。相信所采用的可选标志物并不重要,只要它能够与编码基因产物的核酸同时表达即可。可选标志物的其他示例包括例如报告子,例如gfp、egfp、β-gal或氯霉素乙酰基转移酶(cat)。在某些实施方案中,标志物蛋白质(例如cd19)被用于(例如在免疫磁性选择中)选择输注用细胞。如本文所讨论的,cd19标志物不同于抗cd19抗体,或例如结合cd19的scfv、tcr或其他抗原识别部分。在一些实施方案中,可在表达载体中包含多肽以有助于分选细胞。例如,可将cd34最小表位掺入载体中。在一些实施方案中,用于表达本文所提供的嵌合抗原受体或嵌合刺激分子的表达载体进一步包含编码16个氨基酸的cd34最小表位的多核苷酸。在一些实施方案(例如本文实施例中所提供的某些实施方案)中,将cd34最小表位并入cd8茎的氨基末端位置。跨膜区本文中的嵌合抗原受体可包含单遍次或多遍次跨膜序列(例如,在嵌合蛋白质的n末端或c末端)。在某些cd分子、酪氨酸激酶受体、丝氨酸/苏氨酸激酶受体、tgfβ、bmp、活化素和磷酸酶中发现单遍次跨膜区。单遍次跨膜区经常包括信号肽区和约20到约25个氨基酸的跨膜区,其中许多氨基酸是疏水性氨基酸并可形成α螺旋。带正电荷的氨基酸的短轨迹经常跟随跨膜跨距以将蛋白质锚定在膜中。多遍次(multiplepass)蛋白质包括离子泵、离子通道和转运体,并且包括两个或更多个跨膜多次的螺旋。全部或基本上全部的多遍次蛋白质有时被掺入嵌合蛋白质中。单遍次和多遍次跨膜区的序列是已知的,并且可被选择用于掺入嵌合蛋白质分子中。在一些实施方案中,跨膜结构域融合到car的胞外结构域。在一个实施方案中,使用与car中的一个结构域天然缔合的跨膜结构域。在其他实施方案中,使用与car中的一个结构域天然不缔合的跨膜结构域。在一些情况下,跨膜结构域可通过氨基酸取代(例如,通常被加载到疏水性残基)来选择或修饰,以避免此类结构域结合相同或不同表面膜蛋白质的跨膜结构域,以将与受体复合物的其他成员的相互作用最小化。跨膜结构域可例如来源于t细胞受体的α链、β链或ζ链、cd3-ε、cd3ζ、cd4、cd5、cd8、cd8α、cd9、cd16、cd22、cd28、cd33、cd38、cd64、cd80、cd86、cd134、cd137或cd154。或者,在一些示例中,跨膜结构域可从头合成,主要包含疏水性残基,例如亮氨酸和缬氨酸。在某些实施方案中,短多肽接头可在嵌合抗原受体的跨膜结构域和胞内结构域之间形成连接。嵌合抗原受体可进一步包含茎,即胞外结构域和跨膜结构域之间的氨基酸胞外区。例如,茎可以是与所选跨膜结构域天然缔合的氨基酸序列。在一些实施方案中,嵌合抗原受体包含cd8跨膜结构域,在某些实施方案中,嵌合抗原受体包含cd8跨膜结构域和跨膜结构域的胞外部分上的另外的氨基酸,在某些实施方案中,嵌合抗原受体包含cd8跨膜结构域和cd8茎。嵌合抗原受体可进一步包含跨膜结构域和胞质结构域之间的氨基酸区,所述氨基酸与跨膜结构域所来源的多肽天然缔合。控制区启动子相信用于控制目标多核苷酸序列表达的特定启动子并不重要,只要它能够指导多核苷酸在目标细胞中的表达即可。因此,在靶向人细胞的情况下,多核苷酸序列编码区可例如被置于能够在人细胞中表达的启动子附近并在其控制之下。一般来说,此类启动子可包括人启动子或病毒启动子。在各种实施方案中,可使用人巨细胞病毒(cmv)即早期基因启动子、sv40早期启动子、劳氏肉瘤病毒(roussarcomavirus)长末端重复、β-肌动蛋白、大鼠胰岛素启动子和甘油醛-3-磷酸脱氢酶来获得目标编码序列的高水平表达。还预期使用本领域熟知的其他病毒或哺乳动物细胞或细菌噬菌体启动子来实现目标编码序列的表达,条件是表达水平对于给定目的足够。通过采用具有熟知性质的启动子,可优化转染或转化后目标蛋白质的表达水平和模式。选择应答于特定的生理或合成信号而调控的启动子可允许基因产物的诱导型表达。例如,在当利用多顺反子载体时一种或多种转基因的表达对其中产生该载体的细胞有毒性的情况下,期望抑制或降低一种或多种转基因的表达。对生产细胞系(producercellline)有毒的转基因的示例是促细胞凋亡基因和细胞因子基因。数种诱导型启动子系统可用于生产转基因产物有毒的病毒载体(加入更多诱导型启动子)。蜕皮激素系统(invitrogen,carlsbad,ca)是一种此类系统。该系统被设计成允许目标基因在哺乳动物细胞中的调控表达。它由严格调控的表达机制组成,所述表达机制实际上允许转基因的无基底水平表达,但允许超过200倍的可诱导性。该系统基于果蝇的异二聚体蜕皮激素受体,并且当蜕皮激素或类似物(例如幕黎甾酮(muristerone)a)结合该受体时,该受体活化启动子以开启下游转基因的表达,获得高水平的mrna转录物。在该系统中,异二聚体受体的两个单体由一个载体组成型表达,而驱动目标基因表达的蜕皮激素应答启动子在另一质粒上。因此将该类系统工程化到目标基因转移载体中将是有用的。然后在生产细胞系中共转染含有目标基因的质粒和受体单体将允许产生基因转移载体而不表达潜在毒性的转基因。在适当时间,可用蜕皮激素或幕黎甾酮a活化转基因的表达。另一种可用的诱导型系统是最初由gossen和bujard(gossen和bujard,proc.natl.acad.sci.usa,89:5547-5551,1992;gossen等,science,268:1766-1769,1995)开发的tet-offtm或tet-ontm系统(clontech,paloalto,ca)。该系统还允许应答四环素或四环素衍生物(例如强力霉素)而调控高水平的基因表达。在tet-ontm系统中,在存在强力霉素的情况下开启基因表达,而在tet-offtm系统中,在不存在强力霉素的情况下开启基因表达。这些系统基于来源于大肠杆菌(e.coli)的四环素抗性操纵子的两个调控元件,即四环素阻遏物结合的四环素操纵子序列和四环素阻遏蛋白质。目标基因被克隆到质粒中启动子之后,其中存在四环素应答元件。第二质粒含有称为四环素控制的反式活化子的调控元件,所述调控元件在tet-offtm系统中由来自单纯疱疹病毒的vp16结构域和野生型四环素阻遏物组成。因此,在不存在强力霉素的情况下,转录组成型开启。在tet-ontm系统中,四环素阻遏物不是野生型,并且在存在强力霉素的情况下活化转录。对于基因疗法载体的生产,可使用tet-offtm系统,使得生产细胞可在存在四环素或强力霉素的情况下生长并阻止潜在毒性转基因的表达,但当所述载体被引入患者中时,基因表达将组成型开启。在一些情况下,期望调控转基因在基因疗法载体中的表达。例如,取决于期望的表达水平而利用具有各种活性强度的不同病毒启动子。在哺乳动物细胞中,cmv即早期启动子经常用于提供强转录活化。cmv启动子综述于donnelly,j.j.等,1997.annu.rev.immunol.15:617-48中。当期望降低水平的转基因表达时,还使用cmv启动子的效力较弱的修饰形式。当期望在造血细胞中表达转基因时,经常使用逆转录病毒启动子,例如来自mlv或mmtv的ltr。取决于期望作用而使用的其他病毒启动子包括sv40、rsvltr、hiv-1和hiv-2ltr、腺病毒启动子(例如来自e1a、e2a或mlp区)、aavltr、hsv-tk和禽肉瘤病毒。在其他示例中,可选择受发育调控且在特定分化细胞中有活性的启动子。因此,例如,启动子可不在多能干细胞中有活性,但例如在多能干细胞分化成更成熟细胞的情况下,所述启动子则可被活化。类似地,组织特异性启动子用于在特定组织或细胞中实现转录,以降低对非靶向组织的潜在毒性或不期望的作用。与更强的启动子(例如cmv启动子)相比,这些启动子可导致降低的表达,而且还可导致更有限的表达和免疫原性(bojak,a.等,2002.vaccine.20:1975-79;cazeaux.,n.等,2002.vaccine20:3322-31)。例如,可在适当的情况下使用组织特异性启动子(例如psa相关启动子)或前列腺特异性腺体激肽释放酶或肌肉肌酸激酶基因。组织特异性或分化特异性启动子的示例包括但不限于以下:b29(b细胞);cd14(单核细胞);cd43(白细胞和血小板);cd45(造血细胞);cd68(巨噬细胞);结蛋白(肌肉);弹性蛋白酶-1(胰腺腺泡细胞);内皮联蛋白(内皮细胞);纤连蛋白(分化细胞、愈合组织);和flt-1(内皮细胞);gfap(星形胶质细胞)。在某些适应症中,需要在施用基因疗法载体之后的特定时间活化转录。这是利用诸如激素或细胞因子可调控的启动子的启动子完成的。可使用的细胞因子和炎性蛋白质应答启动子包括k和t激肽原(kageyama等,(1987)j.biol.chem.,262,2345-2351)、c-fos、tnf-α、c-反应性蛋白质(arcone等,(1988)nucl.acidsres.,16(8)、3195-3207)、触珠蛋白(oliviero等,(1987)emboj.,6,1905-1912)、血清淀粉样a2、c/ebpα、il-1、il-6(poli和cortese,(1989)proc.nat'lacad.sci.usa,86,8202-8206)、补体c3(wilson等,(1990)mol.cell.biol.,6181-6191)、il-8、α-1酸性糖蛋白(prowse和baumann,(1988)molcellbiol,8,42-51)、α-1抗胰蛋白酶、脂蛋白脂肪酶(zechner等,mol.cell.biol.,2394-2401,1988)、血管紧张肽原(ron等,(1991)mol.cell.biol.,2887-2895)、纤维蛋白原、c-jun(可由佛波醇酯、tnf-α、uv辐射、视黄酸和过氧化氢诱导)、胶原酶(由佛波醇酯和视黄酸诱导)、金属硫蛋白(重金属和糖皮质激素可诱导)、溶基质蛋白酶(可由佛波醇酯、白介素-1和egf诱导)、α-2巨球蛋白和α-1抗糜蛋白酶。其他启动子包括例如sv40、mmtv、人免疫缺陷病毒(mv)、莫洛尼病毒(moloneyvirus)、alv、爱泼斯坦巴尔病毒、劳氏肉瘤病毒、人肌动蛋白、肌球蛋白、血红蛋白和肌酸。预想任何上述启动子单独或与另一启动子组合均可取决于所期望的作用而使用。启动子和其他调控元件被选择为使得它们在期望的细胞或组织中有功能。另外,该启动子列表不应被理解为穷尽性的或限制性的;与本文所公开的启动子和方法结合使用的其他启动子。增强子增强子是增加位于相同dna分子上的远端位置的启动子转录的遗传元件。早期的示例包括与免疫球蛋白和t细胞受体相关的增强子,它们都在编码序列的两侧并且出现在数个内含子内。许多病毒启动子,例如cmv、sv40和逆转录病毒ltr与增强子活性密切相关,并且经常被当作单一元件。增强子的组构很像启动子。即,它们由许多单个的元件构成,每个元件都结合一个或多个转录蛋白质。增强子和启动子之间的基本区别是可操纵性。增强子区作为整体刺激远处转录,并且经常不依赖于定向;启动子区或其组成元件未必如此。另一方面,启动子具有在特定位点且以特定定向指导rna合成的起始的一个或多个元件,而增强子缺少这些特异性。启动子和增强子经常是重叠和连续的,经常看起来具有非常相似的模块化组织。增强剂亚类是基因座控制区(lcr),其不仅可增加转录活性,而且(连同绝缘子元件一起)还可在整合到基因组中时帮助隔离转录元件与相邻序列。任何启动子/增强子组合(按照真核启动子数据库(eukaryoticpromoterdatabase)epdb)均可用于驱动基因的表达,虽然许多将表达限制于特定的组织类型或组织亚类(综述于例如kutzler,m.a.和weiner,d.b.,2008.naturereviewsgenetics9:776-88中)。示例包括但不限于来自人肌动蛋白序列、人肌球蛋白序列、人血红蛋白序列、人肌肉肌酸激酶序列的增强子以及来自病毒cmv、rsv和ebv的增强子。可针对特定应用选择适当的增强子。如果作为递送复合物的一部分或作为另外的遗传表达构建体提供适当的细菌聚合酶,则真核细胞可支持来自某些细菌启动子的胞质转录。多聚腺苷酸化信号在使用cdna插入的情况下,通常将期望包括多聚腺苷酸化信号以实现基因转录物的适当多聚腺苷酸化。相信多聚腺苷酸化信号的性质对本方法的成功实施并非关键,并且采用任何此类序列,例如人或牛生长激素和sv40多聚腺苷酸化信号和ltr多聚腺苷酸化信号。一个非限制性示例是存在于pcep3质粒(invitrogen,carlsbad,california)中的sv40多聚腺苷酸化信号。还预期作为表达盒的元件的是终止子。这些元件可用来增强消息水平和将从所述盒向其他序列的通读最小化。终止序列或聚(a)信号序列可例如位于mrna3'末端的保守序列(aauaaa)下游约11-30个核苷酸处(montgomery,d.l.等,1993.dnacellbiol.12:777-83;kutzler,m.a.和weiner,d.b.,2008.naturerev.gen.9:776-88)。4.起始信号和内部核糖体结合位点编码序列的有效翻译也可能需要特定的起始信号。这些信号包括atg起始密码子或相邻序列。可能需要提供外源翻译控制信号,包括atg起始密码子。将起始密码子与期望的编码序列的阅读框符合读框放置,以确保整个插入片段的翻译。外源翻译控制信号和起始密码子可以是天然的或合成的。可通过包含适当的转录增强子元件来增强表达效率。在某些实施方案中,使用内部核糖体进入位点(ires)元件来产生多基因或多顺反子信息(polycistronicmessage)。ires元件能够绕开5'甲基化帽依赖性翻译的核糖体扫描模型并开始在内部位点翻译(pelletier和sonenberg,nature,334:320-325,1988)。讨论了来自小rna病毒家族的两个成员(脊髓灰质炎和脑心肌炎)的ires元件(pelletier和sonenberg,1988)以及来自哺乳动物信息的ires(macejak和sarnow,nature,353:90-94,1991)。ires元件可连接到异源开放阅读框。多个开放阅读框架(各由ires分隔)可一起转录,产生多顺反子信息。借助ires元件,每个开放阅读框均为核糖体可及,以用于有效翻译。使用单个启动子/增强子来转录单个信息可有效表达多个基因(参见美国专利号5,925,565和5,935,819,各自以引用方式并入本文)。序列优化还可通过优化转基因中的密码子来增加蛋白质产生。物种特异性密码子变化可用于增加蛋白质产生。此外,可优化密码子以产生优化的rna,这可产生更有效的翻译。通过优化待掺入rna中的密码子,可去除诸如导致引起不稳定性的二级结构的元件、可例如抑制核糖体结合的二级mrna结构、或可抑制mrna核输出的隐蔽序列(kutzler,m.a.和weiner,d.b.,2008.naturerev.gen.9:776-88;yan,j.等,2007.mol.ther.15:411-21;cheung,y.k.等,2004.vaccine23:629-38;narum.,d.l.等,2001.69:7250-55;yadava,a.和ockenhouse,c.f.,2003.infect.immun.71:4962-69;smith.,j.m.等,2004.aidsres.hum.retroviruses20:1335-47;zhou,w.等,2002.vet.microbiol.88:127-51;wu,x.等,2004.biochem.biophys.res.commun.313:89-96;zhang,w.等,2006.biochem.biophys.res.commun.349:69-78;deml,l.a.等,2001.j.virol.75:1099-11001;schneider,r.m.等,1997.j.virol.71:4892-4903;wang,s.d.等,2006.vaccine24:4531-40;zurmegede,j.等,2000.j.virol.74:2628-2635)。例如,fbp12、胱天蛋白酶多肽和cd19序列可通过密码子的变化来优化。前导序列可添加前导序列以增强mrna的稳定性并产生更有效的翻译。前导序列通常参与将mrna靶向内质网。示例包括用于hiv-1包膜糖蛋白(env)的信号序列(其延迟其自身切割),和ige基因前导序列(kutzler,m.a.和weiner,d.b.,2008.naturerev.gen.9:776-88;li,v.等,2000.virology272:417-28;xu,z.l.等,2001.gene272:149-56;malin,a.s.等,2000.microbesinfect.2:1677-85;kutzler,m.a.等,2005.j.immunol.175:112-125;yang,j.s.等,2002.emerg.infect.dis.8:1379-84;kumar.,s.等,2006.dnacellbiol.25:383-92;wang,s.等,2006.vaccine24:4531-40)。ige前导序列可用于增强向内质网的插入(tepler,i等,(1989)j.biol.chem.264:5912)。可通过选择用于优化表达的适当方法来优化和/或控制转基因的表达。这些方法包括例如优化启动子、递送方法和基因序列(例如,如以下文献中所呈现:d.j.等,2008.plos.one3e2517;kutzler,m.a.和weiner,d.b.,2008.naturerev.gen.9:776-88)。核酸如本文所用的“核酸”通常是指dna、rna或其包括核碱基的衍生物或类似物的分子(一条、两条或更多条链)。核碱基包括例如在dna(例如,腺嘌呤“a”、鸟嘌呤“g”、胸腺嘧啶“t”或胞嘧啶“c”)或rna(例如,a、g、尿嘧啶“u”或c)中发现的天然存在的嘌呤或嘧啶碱基。术语“核酸”涵盖术语“寡核苷酸”和“多核苷酸”,各为术语“核酸”的亚属。核酸可以是至少、至多或约3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、31个、32个、33个、34个、35个、36个、37个、38个、39个、40个、41个、42个、43个、44个、45个、46个、47个、48个、49个、50个、51个、52个、53个、54个、55个、56个、57个、58个、59个、60个、61个、62个、63个、64个、65个、66个、67个、68个、69个、70个、71个、72个、73个、74个、75个、76个、77个、78个、79个、80个、81个、82个、83个、84个、85个、86个、87个、88个、89个、90个、91个、92个、93个、94个、95个、96个、97个、98个、99个、100个、101个、102个、103个、104个、105个、106个、107个、108个、109个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个、250个、260个、270个、280个、290个、300个、310个、320个、330个、340个、350个、360个、370个、380个、390个、400个、410个、420个、430个、440个、441个、450个、460个、470个、480个、490个、500个、510个、520个、530个、540个、550个、560个、570个、580个、590个、600个、610个、620个、630个、640个、650个、660个、670个、680个、690个、700个、710个、720个、730个、740个、750个、760个、770个、780个、790个、800个、810个、820个、830个、840个、850个、860个、870个、880个、890个、900个、910个、920个、930个、940个、950个、960个、970个、980个、990个或1000个核苷酸,或可从中推导出的任何范围。本文所提供的核酸可具有与另一种核酸具有同一性或互补性的区域。预期互补性或同一性的区域可以是至少5个邻接残基,尽管特别预期该区域为至少、至多或约6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、31个、32个、33个、34个、35个、36个、37个、38个、39个、40个、41个、42个、43个、44个、45个、46个、47个、48个、49个、50个、51个、52个、53个、54个、55个、56个、57个、58个、59个、60个、61个、62个、63个、64个、65个、66个、67个、68个、69个、70个、71个、72个、73个、74个、75个、76个、77个、78个、79个、80个、81个、82个、83个、84个、85个、86个、87个、88个、89个、90个、91个、92个、93个、94个、95个、96个、97个、98个、99个、100个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个、250个、260个、270个、280个、290个、300个、310个、320个、330个、340个、350个、360个、370个、380个、390个、400个、410个、420个、430个、440个、441个、450个、460个、470个、480个、490个、500个、510个、520个、530个、540个、550个、560个、570个、580个、590个、600个、610个、620个、630个、640个、650个、660个、670个、680个、690个、700个、710个、720个、730个、740个、750个、760个、770个、780个、790个、800个、810个、820个、830个、840个、850个、860个、870个、880个、890个、900个、910个、920个、930个、940个、950个、960个、970个、980个、990个或1000个邻接核苷酸。如本文所用的“杂交(hybridization)”、“杂交(hybridizes)”或“能够杂交”应理解为意指形成双链或三链分子或具有部分双链或三链性质的分子。如本文所用的术语“退火”与“杂交”同义。术语“杂交(hybridization)”、“杂交(hybridize(s))”或“能够杂交”涵盖术语“严谨条件”或“高严谨性”和术语“低严谨性”或“低严谨条件”。如本文所用的“严谨条件”或“高严谨性”是允许在含有互补序列的一条或多条核酸链之间或之内杂交,但排除随机序列的杂交的条件。严谨条件容许核酸和靶链之间很少的(如果有)错配。此类条件是已知的,并且经常用于需要高选择性的应用。非限制性应用包括分离核酸,例如基因或其核酸片段,或检测至少一种特异mrna转录物或其核酸片段等。严谨条件可包括低盐和/或高温条件,例如通过在约42℃到约70℃的温度下约0.02m到约0.5mnacl所提供的条件。应当理解,期望严谨性的温度和离子强度部分由以下决定:特定核酸的长度、靶序列的长度和核碱基含量、核酸的电荷组成和杂交混合物中甲酰胺、四甲基氯化铵或其他溶剂的存在或浓度。应当理解,这些范围、组成和杂交条件仅以非限制性示例的方式提及,并且经常通过与一种或多种阳性或阴性对照相比较根据经验确定对于特定杂交反应的期望严谨性。取决于预想期的应用,可采用各种杂交条件来实现核酸对靶序列的各种程度的选择性。在非限制性示例中,在严谨条件下不与核酸杂交的相关靶核酸的鉴别或分离可通过在低温和/或高离子强度下的杂交来实现。此类条件被称为“低严谨性”或“低严谨性条件”,低严谨性的非限制性示例包括在约0.15m到约0.9mnacl下在约20℃到约50℃的温度范围进行的杂交。低或高严谨性条件可进一步经修改以适应特定的应用。核酸修饰以下讨论的任何修饰均可应用于核酸。修饰的示例包括对rna或dna主链、糖或碱基和其各种组合的改变。核酸中任何适合数目的主链连接、糖和/或碱基均可被修饰(例如,独立地约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、最高达100%)。未修饰的核苷是接合到β-d-核糖-呋喃糖的1'碳上的碱基(腺嘌呤、胞嘧啶、鸟嘌呤、胸腺嘧啶或尿嘧啶)中的任何一种。修饰的碱基是除了1'位置处的腺嘌呤、鸟嘌呤、胞嘧啶和尿嘧啶之外的核苷酸碱基。修饰碱基的非限制性示例包括肌苷、嘌呤、吡啶-4-酮、吡啶-2-酮、苯基、假尿嘧啶、2,4,6-三甲氧基苯、3-甲基尿嘧啶、二氢尿苷、萘基、氨基苯基、5-烷基胞苷(例如,5-甲基胞苷)、5-烷基尿苷(例如,核糖胸苷)、5-卤代尿苷(例如,5-溴尿苷)或6-氮杂嘧啶或6-烷基嘧啶(例如6-甲基尿苷)、丙炔等。修饰碱基的其他非限制性示例包括硝基吡咯基(例如,3-硝基吡咯基)、硝基吲哚基(例如,4-,5-,6-硝基吲哚基)、次黄嘌呤基、异肌苷酸基、2-氮杂-肌苷酸基、7-脱氮-肌苷酸基、硝基咪唑基、硝基吡唑基、硝基苯并咪唑基、硝基吲唑基、氨基吲哚基、吡咯嘧啶基、二氟甲苯基、4-氟-6-甲基苯并咪唑、4-甲基苯并咪唑、3-甲基异喹诺酮基(isocarbostyrilyl)、5-甲基异喹诺酮基、3-甲基-7-丙炔基异喹诺酮基、7-氮杂吲哚基、6-甲基-7-氮杂吲哚基、咪唑并吡啶基、9-甲基-咪唑并吡啶基、吡咯并吡啶基(pyrrolopyrizinyl)、异喹诺酮基、7-丙炔基异喹诺酮基、丙炔基-7-氮杂吲哚基、2,4,5-三甲基苯基、4-甲基吲哚基、4,6-二甲基吲哚基、苯基、萘基、蒽基、苯蒽基(phenanthracenyl)、芘基、芪基、并四苯基(tetracenyl)、并五苯基(pentacenyl)等。在一些实施方案中,例如,核酸可包括具有磷酸主链修饰的修饰的核酸分子。主链修饰的非限制性示例包括硫代磷酸酯、二硫代磷酸酯、甲基膦酸酯、磷酸三酯、吗啉代、酰胺化物、氨基甲酸、羧甲基、乙酰胺化物(acetamidate)、聚酰胺、磺酸酯、磺酰胺、氨基磺酸酯、甲缩醛(formacetal)、硫代甲缩醛(thioformacetal)和/或烷基甲硅烷基修改。在某些情况下,天然存在于核苷中的核糖部分被己糖、多环杂烷基环或环己烯基替代。在某些情况下,己糖为阿洛糖、阿卓糖、葡萄糖、甘露糖、古洛糖、艾杜糖、半乳糖、塔罗糖或其衍生物。己糖可以是d-己糖、葡萄糖或甘露糖。在某些情况下,多环杂烷基可以是在环中含有一个氧原子的二环。在某些情况下,多环杂烷基是二环[2.2.1]庚烷、二环[3.2.1]辛烷或二环[3.3.1]壬烷。硝基吡咯基和硝基吲哚基核碱基是被称为通用碱基的化合物种类的成员。通用碱基是可替代四种天然存在的碱基中的任何一种而基本上不影响寡核苷酸双链体的解链行为或活性的那些化合物。与天然存在的核碱基相关的稳定化氢键相互作用不同,含有3-硝基吡咯基核碱基的寡核苷酸双链体可仅通过堆叠相互作用来稳定。利用硝基吡咯基核碱基而没有显著的氢键相互作用避免了对特定互补碱基的特异性。另外,4-硝基吲哚基、5-硝基吲哚基和6-硝基吲哚基展示对四种天然碱基非常小的特异性。在gaubert,g.;wengel,j.tetrahedronletters2004,45,5629中讨论了用于制备1-(2'-o-甲基-.β.-d-呋喃核糖基)-5-硝基吲哚的程序。其他通用碱基包括次黄嘌呤基、异肌苷酸基、2-氮杂-肌苷酸基、7-脱氮-肌苷酸基、硝基咪唑基、硝基吡唑基、硝基苯并咪唑基、硝基吲唑基、氨基吲哚基、吡咯并嘧啶基和其结构衍生物。二氟甲苯基是起通用碱基作用的非天然核碱基。二氟甲苯基是天然核碱基胸腺嘧啶的电子等排体。但与胸腺嘧啶不同,二氟甲苯基显示对任何天然碱基都没有显著的选择性。用作通用碱基的其他芳族化合物是4-氟-6-甲基苯并咪唑和4-甲基苯并咪唑。另外,与仅含天然碱基的寡核苷酸序列相比,相对疏水的异喹诺酮基衍生物(3-甲基异喹诺酮基、5-甲基异喹诺酮基、3-甲基-7-丙炔基异喹诺酮基)是仅引起寡核苷酸双链体轻微去稳定的通用碱基。其他非天然核碱基包括7-氮杂吲哚基、6-甲基-7-氮杂吲哚基、咪唑并吡啶基、9-甲基-咪唑并吡啶基、吡咯并吡啶基、异喹诺酮基、7-丙炔基异喹诺酮基、丙炔基-7-氮杂吲哚基、2,4,5-三甲基苯基、4-甲基吲哚基、4,6-二甲基吲哚基、苯基、萘基、蒽基、苯蒽基、芘基、芪基、并四苯基、并五苯基和其结构衍生物。关于二氟甲苯基、4-氟-6-甲基苯并咪唑、4-甲基苯并咪唑和上述其他非天然碱基的更详细讨论(包括合成程序),参见:schweitzer等,j.org.chem.,59:7238-7242(1994);另外,可使用化学取代基(例如交联剂)来给反应增加进一步的稳定性或不可逆性。交联剂的非限制性示例包括例如1,1-双(重氮乙酰基)-2-苯乙烷、戊二醛、n-羟基琥珀酰亚胺酯(例如与4-叠氮基水杨酸的酯)、同双功能亚氨酸酯,包括二琥珀酰亚胺基酯,例如3,3'-二硫代双(琥珀酰亚胺基丙酸酯)、双功能马来酰亚胺,例如双-n-马来酰亚胺基-1,8-辛烷和试剂例如甲基-3-[(对叠氮基苯基)二硫代]丙亚氨酸酯(propioimidate)。核苷酸类似物还可包括“锁定”核酸。某些组合物可用于将内源核酸基本上“锚定”或“锁定”到特定结构中。锚定序列用于防止核酸复合物的解离,因此不仅可防止复制,而且还可使得能够进行内源序列的标记、修饰和/或克隆。锁定结构可调控基因表达(即抑制或增强转录或复制),或者可用作稳定结构,所述稳定结构可用于标记或以其他方式修饰内源核酸序列,或可用于分离内源序列,即用于克隆。核酸分子不必限于仅含有rna或dna的那些分子,而是进一步涵盖化学修饰的核苷酸和非核苷酸。非核苷酸或修饰的核苷酸的百分比可以是1%到100%(例如,约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%)。核酸制备在一些实施方案中,提供用作例如测定或治疗中的对照或标准的核酸。可通过本领域已知的任何技术(例如化学合成、酶促生产或生物生产)来制备核酸。可从生物样品中回收或分离核酸。核酸可以是重组的,或者它还可以是天然的或细胞内源的(从细胞基因组产生的)。预期生物样品可以增强小核酸分子回收的方式进行处理。通常,方法可涉及用具有胍和洗涤剂的溶液裂解细胞。还可根据标准方法进行核酸合成。合成核酸(例如合成寡核苷酸)的非限制性示例包括通过使用磷酸三酯、亚磷酸酯或亚磷酰胺化学和固相技术或通过脱氧核苷h-膦酸酯中间体的体外化学合成制成的核酸。其他地方已经公开了各种不同的寡核苷酸合成机制。可使用已知技术分离核酸。在具体的实施方案中,可采用用于分离小核酸分子和/或分离rna分子的方法。色谱是用于从蛋白质或从其他核酸隔开或分离核酸的方法。此类方法可涉及用凝胶基质电泳、过滤柱、醇沉淀和/或其他色谱法。如果待使用或评价来自细胞的核酸,则方法通常涉及在实施用于分离特定rna群体的方法之前,用离液剂(例如异硫氰酸胍)和/或洗涤剂(例如n-月桂酰肌氨酸)裂解细胞。方法可涉及使用有机溶剂和/或醇来分离核酸。在一些实施方案中,添加到细胞裂解物中的醇的量达到约55%到60%的醇浓度。虽然可采用不同的醇,但乙醇很有效。固体支持物可以是任何结构,并且其包括珠、过滤器和柱,可包括具有负电基团的矿物或聚合物支持物。玻璃纤维过滤器或柱对于此类分离程序是有效的。核酸分离过程有时可包括:a)用包含胍的裂解溶液裂解样品中的细胞,其中产生浓度为至少约1m胍的裂解物;b)用包含酚的萃取溶液从所述裂解物中萃取核酸分子;c)向所述裂解物中添加醇溶液以形成裂解物/醇混合物,其中所述混合物中醇的浓度为约35%到约70%;d)将所述裂解物/醇混合物施加到固体支持物;e)用离子溶液从所述固体支持物上洗脱所述核酸分子;和f)捕获所述核酸分子。可将样品干透并再悬浮于液体中并且体积适于后续操纵。本文提供了包含核酸的组合物或试剂盒,所述核酸包含本申请的多核苷酸。因此,组合物或试剂盒可例如包含编码第一嵌合多肽和第二嵌合多肽的第一核苷酸和第二多核苷酸两者。所述核酸可包含超过一种核酸种类,即,例如,第一核酸种类包含第一多核苷酸,并且第二核酸种类包含第二多核苷酸。在其他示例中,所述核酸可包含第一多核苷酸和第二多核苷酸两者。所述试剂盒另外可包含第一配体或第二配体或两者。在一些实施方案中,所述试剂盒可提供包含至少两种多核苷酸的核酸组合物,例如病毒,例如逆转录病毒,其中所述多核苷酸例如表达诱导型促细胞凋亡多肽和嵌合抗原受体;诱导型促细胞凋亡多肽和重组tcr;诱导型促细胞凋亡多肽和嵌合共刺激多肽,例如诱导型嵌合myd88多肽、诱导型嵌合的截短myd88多肽和任选的cd40多肽。核酸组合物可包含编码诱导型促细胞凋亡多肽、诱导型嵌合myd88多肽或诱导型嵌合的截短myd88多肽和任选的cd40多肽以及嵌合抗原受体或重组t细胞受体的多核苷酸。因此,在某些实施方案中,提供了包含核酸组合物的试剂盒,所述核酸组合物例如病毒,例如逆转录病毒,其包含多核苷酸,所述多核苷酸编码1)irc9或irmc9多肽和im(myd88fvfv)或imc多肽;2)rc9或irmc9多肽和嵌合抗原受体;3)irc9或irmc9多肽和重组tcr;4)ic9多肽和irmc或irm(irmyd88)多肽;5)ic9多肽和irmc或irm(irmyd88)多肽和嵌合抗原受体;或6)ic9多肽和irmc或irm(irmyd88)多肽和重组t细胞受体。基因转移方法为了介导转基因表达在细胞中的作用,将有必要将表达构建体转移到细胞中。这种转移可采用病毒或非病毒的基因转移方法。本部分提供基因转移的方法和组合物的讨论。包含表达载体的转化细胞通过将表达载体引入细胞而产生。用于转化细胞器、细胞、组织或生物体以供与本方法一起使用的多核苷酸递送的适合方法实际上包括可将多核苷酸(例如dna)引入细胞器、细胞、组织或生物体中的任何方法。宿主细胞可以并且已被用作用于载体的接受者。取决于期望的结果是载体的复制,还是载体编码的多核苷酸序列的部分或全部的表达,宿主细胞可来源于原核生物或真核生物。许多细胞系和培养物可用作宿主细胞,并且它们可通过美国典型培养物保藏中心(americantypeculturecollection)(atcc)获得,atcc是用作用于活培养和遗传材料的档案库的组织。可确定适当的宿主。通常,这是基于载体主链和期望的结果。例如,可将质粒或粘粒引入原核宿主细胞中用于复制许多载体。用作用于载体复制和/或表达的宿主细胞的细菌细胞包括dh5α、jm109和kc8,以及许多市售的细菌宿主,例如感受态细胞和solopackgold细胞(lajolla,ca)。或者,细菌细胞(例如大肠杆菌le392)可用作用于噬菌体病毒的宿主细胞。可用作宿主细胞的真核细胞包括但不限于酵母、昆虫和哺乳动物。用于载体的复制和/或表达的哺乳动物真核宿主细胞的示例包括但不限于hela、nih3t3、jurkat、293、cos、cho、saos和pc12。酵母菌株的示例包括但不限于yph499、yph500和yph501。核酸疫苗可包括例如非病毒dna载体、“裸”dna和rna以及病毒载体。用这些疫苗转化细胞和用于优化包含在这些疫苗中的基因的表达的方法是已知的并且也在本文中加以讨论。核酸或病毒载体转移方法的示例可使用任何适当的方法来转染或转化细胞,或者施用本方法的核苷酸序列或组合物。本文呈现了某些示例,并且进一步包括诸如使用阳离子聚合物、脂质样分子和某些商业产品(例如in-vivo-jetpei)进行递送的方法。离体转化各种方法可用于在离体环境中转染从生物体移出的血管细胞和组织。例如,犬内皮细胞已通过体外逆转录病毒基因转移进行遗传改变并移植到犬内(wilson等,science,244:1344-1346,1989)。在另一示例中,通过逆转录病毒体外转染yucatan迷你猪内皮细胞并使用双气囊导管将其移植到动脉中(nabel等,science,244(4910):1342-1344,1989)。因此,预期可将细胞或组织移出并使用本文所呈现的多核苷酸离体转染。在特定方面,可将移植的细胞或组织放置到生物体中。注射在某些实施方案中,抗原呈递细胞或核酸或病毒载体可通过一次或多次注射(即针头注射)递送到细胞器、细胞、组织或生物体,所述注射例如皮下、皮内、肌内、静脉内、前列腺内、肿瘤内、腹膜内等。注射方法包括例如注射包含盐水溶液的组合物。另外的实施方案包括通过直接显微注射引入多核苷酸。所用表达载体的量可根据抗原的性质以及所用的细胞器、细胞、组织或生物体而变化。真皮内注射、结节内注射或淋巴内注射是一些更常用的dc施用方法。真皮内注射的特征在于低速率吸收到血流中,但快速摄入淋巴系统中。真皮中存在大量朗格汉斯(langerhans)树突细胞会将完整抗原以及加工的抗原转运到引流淋巴结。需要适当的部位准备以正确进行该操作(即剪除毛发以观察适当的针头放置)。结节内注射允许将抗原直接递送到淋巴组织。淋巴内注射允许直接施用dc。电穿孔在某些实施方案中,通过电穿孔将多核苷酸引入细胞器、细胞、组织或生物体中。电穿孔涉及将细胞和dna的悬浮液暴露于高电压放电。在该方法的一些变型中,采用某些细胞壁降解酶,例如果胶降解酶,以使目标接受者细胞比未处理的细胞更易于通过电穿孔转化(美国专利号5,384,253,以引用方式并入本文)。使用电穿孔转染真核细胞已相当成功。以这种方式,已用人κ-免疫球蛋白基因转染小鼠前b淋巴细胞(potter等,(1984)proc.nat'lacad.sci.usa,81,7161-7165),并且已用氯霉素乙酰基转移酶基因转染大鼠肝细胞(tur-kaspa等,(1986)mol.cellbiol.,6,716-718)。临床上通过简单的注射技术来实施用于疫苗的体内电穿孔或evac。将编码多肽的dna载体经真皮内注射到患者内。然后电极向真皮内空间施加电脉冲,使得位于那里的细胞,尤其是驻留的真皮树突细胞吸收dna载体并表达编码的多肽。这些通过局部炎症活化的表达多肽的细胞然后可迁移到淋巴结,例如呈递抗原。当在例如但不限于注射核酸或可通过电穿孔将核酸递送到细胞的任何其他施用手段后,使用电穿孔施用核酸时,以电穿孔方式施用该核酸。电穿孔方法在例如sardesai,n.y.和weiner,d.b.,currentopinioninimmunotherapy23:421-9(2011)和ferraro,b.等,humanvaccines7:120-127(2011)中有讨论,这些文献的全部内容在此以引用方式并入本文。磷酸钙在其他实施方案中,使用磷酸钙沉淀将多核苷酸引入细胞中。已用腺病毒5dna(graham和vandereb,(1973)virology,52,456-467)使用该技术转染人kb细胞。同样以这种方式,用新霉素标志物基因转染小鼠l(a9)、小鼠c127、cho、cv-1、bhk、nih3t3和hela细胞(chen和okayama,mol.cellbiol.,7(8):2745-2752,1987),并用各种标志物基因转染大鼠肝细胞(rippe等,cellbiol.,10:689-695,1990)。deae-右旋糖酐在另一实施方案中,使用deae-右旋糖酐,之后使用聚乙二醇将多核苷酸递送到细胞中。以这种方式,将报告质粒引入小鼠骨髓瘤和红白血病细胞中(gopal,t.v.,molcellbiol.1985年5月;5(5):1188-90)。声波处理加载另外的实施方案包括通过直接声波加载引入多核苷酸。已经通过声波处理加载用胸苷激酶基因转染ltk-成纤维细胞(fechheimer等,(1987)proc.nat'lacad.sci.usa,84,8463-8467)。脂质体介导的转染在又一实施方案中,可将多核苷酸包埋在脂质复合物(例如脂质体)中。脂质体是特征在于磷脂双层膜和内部含水介质的囊泡结构。多层脂质体具有由含水介质隔开的多个脂质层。当磷脂悬浮在过量的水溶液中时,它们自发形成。脂质组分在封闭结构形成之前经历自我重排,并将水和溶解的溶质包埋在脂质双层之间(ghosh和bachhawat,(1991):肝病、使用特异性受体和配体的靶向诊断和治疗(liverdiseases,targeteddiagnosisandtherapyusingspecificreceptorsandligands).第87-104页)。还涵盖与lipofectamine(gibcobrl)或superfect(qiagen)复合的多核苷酸。受体介导的转染再进一步地,可通过受体介导的递送媒介物将多核苷酸递送到靶细胞。这些利用了将在靶细胞中发生的通过受体介导的胞吞对大分子的选择性摄取。鉴于各种受体的细胞类型特异性分布,这种递送方法增加了另一种程度的特异性。某些受体介导的基因靶向媒介物包含细胞受体特异性配体和多核苷酸结合剂。其他包括细胞受体特异性配体,待递送的多核苷酸已与其操作性地附接。数种配体已被用于受体介导的基因转移(wu和wu,(1987)j.biol.chem.,262,4429-4432;wagner等,proc.natl.acad.sci.usa,87(9):3410-3414,1990;perales等,proc.natl.acad.sci.usa,91:4086-4090,1994;myers,epo0273085),这建立了该技术的可操作性。已经讨论了在另一种哺乳动物细胞类型背景下的特异性递送(wu和wu,adv.drugdeliveryrev.,12:159-167,1993;以引用方式并入本文)。在某些方面,选择配体以对应于在靶细胞群体上特异性表达的受体。在其他实施方案中,细胞特异性多核苷酸靶向媒介物的多核苷酸递送媒介物组分可包括与脂质体组合的特异性结合配体。待递送的一种或多种多核苷酸被容纳在脂质体内,并且特异性结合配体被功能性地掺入脂质体膜中。因此脂质体将特异性地结合靶细胞的受体并将内容物递送到细胞。已使用例如表皮生长因子(egf)用于受体介导的多核苷酸向展现出egf受体下调的细胞的递送中的系统证明此类系统有功能。在其他实施方案中,靶向递送媒介物的多核苷酸递送载体组分可以是脂质体自身,其可例如包含指导细胞特异性结合的一种或多种脂质或糖蛋白。例如,乳糖基神经酰胺(半乳糖末端的无唾液酸神经节苷脂)已被掺入脂质体中并且观察到肝细胞对胰岛素基因的摄取增加(nicolau等,(1987)methodsenzymol.,149,157-176)。预期可以类似方式将组织特异性转化构建体特异性地递送到靶细胞中。微粒轰击(microprojectilebombardment)可使用微粒轰击技术将多核苷酸引入至少一种细胞器、细胞、组织或生物体中(美国专利号5,550,318;美国专利号5,538,880;美国专利号5,610,042;和pct申请wo94/09699;各自以引用方式并入本文)。所述方法取决于将dna包被的微粒加速到高速,从而允许它们刺穿细胞膜并进入细胞而不杀伤细胞的能力(klein等,(1987)nature,327,70-73)。本领域已知有众多种微粒轰击技术,其中许多适用于本方法。在该微粒轰击中,一个或多个粒子可用至少一种多核苷酸包被并通过推进力递送到细胞中。已开发出数种用于加速小粒子的装置。一种此类装置依赖于高电压放电以产生电流,所述电流进而提供原动力(yang等,(1990)proc.nat'lacad.sci.usa,87,9568-9572)。所用的微粒由生物惰性物质(例如钨或金的粒子或珠粒)组成。示例性的粒子包括包含钨、铂和(在某些示例中)金的那些,包括例如纳米粒子。预期在某些情况下,将dna沉淀到金属粒子上对于使用微粒轰击将dna递送到接受者细胞来说将不是必需的。然而,预期粒子可含有dna而不是被dna包被。dna包被的粒子可通过粒子轰击增加dna递送的水平,但它们本身不是必需的。病毒载体介导的转移方法的示例适于向细胞或受试者施用核苷酸序列或包含核苷酸序列的组合物的任何病毒载体均可用于本方法中,使得受试者中的一个或多个细胞可表达由该核苷酸序列编码的基因。在某些实施方案中,将转基因掺入病毒粒子中以介导基因转移到细胞。通常,病毒将在生理条件下简单暴露于适当的宿主细胞,允许病毒的摄取。有利地采用使用如下所述的多种病毒载体的本方法。腺病毒腺病毒由于其中等大小的dna基因组、易操控性、高滴度、广泛的靶细胞范围和高感染性而特别适合用作基因转移载体。大约36kb的病毒基因组由100-200碱基对(bp)的反向末端重复(itr)所限定,其中含有病毒dna复制和包装所必需的顺式作用元件。含有不同转录单元的基因组的早期(e)和晚期(l)区由病毒dna复制的开始而分开。e1区(e1a和e1b)编码负责病毒基因组和少量细胞基因的转录调控的蛋白质。e2区(e2a和e2b)的表达导致用于病毒dna复制的蛋白质的合成。这些蛋白质参与dna复制、晚期基因表达和宿主细胞关闭(renan,m.j.(1990)radiotheroncol.,19,197-218)。晚期基因(l1、l2、l3、l4和l5)的产物(包括大部分病毒衣壳蛋白质)仅在由主要晚期启动子(mlp)引发的单个初级转录物的重要加工后表达。mlp(位于16.8图距单位)在感染的晚期特别有效,并且从该启动子引发的所有mrna均具有5'三联前导(tl)序列,这使得它们对翻译有用。为了针对基因疗法对腺病毒进行优化,需要将携带能力最大化,使得可包括大区段dna。也非常期望降低与某些腺病毒产物相关的毒性和免疫反应。这两个目标在一定程度上是一致的,因为消除腺病毒基因可作用于这两个目的。通过实施本方法,可能实现这两个目标,同时保留相对容易地操控治疗构建体的能力。可能发生dna的大置换(displacement),因为病毒dna复制所需的顺式元件都位于线性病毒基因组任一端的反向末端重复(itr)(100-200bp)中。含有itr的质粒可在非缺陷型腺病毒存在下复制(hay,r.t.等,jmolbiol.1984年6月5日;175(4):493-510)。因此,将这些元件包含在腺病毒载体中可允许复制。另外,用于病毒封装的包装信号位于病毒基因组左端的194-385bp(0.5-1.1个图距单位)之间(hearing等,j.(1987)virol.,67,2555-2558)。该信号模拟噬菌体λdna中的蛋白质识别位点,其中靠近左端但在粘性末端序列之外的特定序列介导与将dna插入头部结构中所需的蛋白质的结合。ad的e1取代载体已证实病毒基因组左端的450bp(0-1.25个图距单位)片段可指导293细胞中的包装(levrero等,gene,101:195-202,1991)。先前,已显示腺病毒基因组的某些区域可被掺入哺乳动物细胞的基因组中,并使编码的基因由此表达。这些细胞系能够支持由所述细胞系编码的在腺病毒功能方面有缺陷的腺病毒载体的复制。还有通过“帮助”载体(例如野生型病毒或条件缺陷型突变体)互补复制缺陷型腺病毒载体的报道。复制缺陷型腺病毒载体可通过辅助病毒反式补充。然而,仅这一观察并不允许分离复制缺陷型载体,因为提供复制功能所需的辅助病毒的存在会污染任何制剂。因此,需要增加对复制缺陷型载体的复制和/或包装的特异性的另外元件。该元件来源于腺病毒的包装功能。已显示,用于腺病毒的包装信号存在于常规腺病毒图谱的左端(tibbetts等,(1977)cell,12,243-249)。后来的研究显示,在基因组的e1a(194-358bp)区域中具有缺失的突变体即使在补充早期(e1a)功能的细胞系中,也生长不良(hearing和shenk,(1983)j.mol.biol.167,809-822)。当补偿性腺病毒dna(0-353bp)重组到突变体的右端中时,病毒被正常包装。进一步的突变分析鉴别了ad5基因组左端的一个短的、重复的位置依赖性元件。发现所述重复的一个拷贝如果存在于基因组的任一端,则对于有效包装是足够的,但当移向ad5dna分子的内部时,对于有效包装是不足够的(hearing等,j.(1987)virol.,67,2555-2558)。通过使用包装信号的突变形式,可能产生以不同效率包装的辅助病毒。通常,突变是点突变或缺失。当具有低效率包装的辅助病毒在辅助细胞中生长时,所述病毒被包装(尽管与野生型病毒相比其速率降低),从而允许所述辅助病毒的增殖。然而,当这些辅助病毒连同含有野生型包装信号的病毒一起在细胞中生长时,野生型包装信号优先于突变形式被识别。考虑到有限量的包装因子,当与辅助病毒比较时,含有野生型信号的病毒被选择性包装。如果偏好足够大,则可实现接近均一性的原料。为了改善adv构建体对特定组织或物种的趋向性,受体结合纤维序列经常可在腺病毒分离物之间被取代。例如,在腺病毒5中发现的柯萨奇(coxsackie)-腺病毒受体(car)配体可取代来自腺病毒35的cd46结合纤维序列,从而制成对人造血细胞的结合亲和力大大改善的病毒。所得“假型”病毒ad5f35已成为数种临床开发的病毒分离物的基础。此外,存在各种生物化学方法来修饰纤维以允许将病毒重新靶向靶细胞。方法包括使用双功能抗体(一端结合car配体,一端结合靶序列)和纤维的代谢生物素化以允许与定制的基于抗生物素蛋白的嵌合配体缔合。或者,可通过异双功能接头(例如含peg)将配体(例如抗cd205)附着到腺病毒粒子。逆转录病毒逆转录病毒是一组单链rna病毒,其特征在于能够在受感染细胞中通过逆转录过程将它们的rna转化为双链dna(coffin,(1990):virology,编辑,newyork:ravenpress,第1437-1500页)。然后所得dna作为原病毒稳定地整合到细胞染色体中,并指导病毒蛋白质的合成。整合导致病毒基因序列保留在接受者细胞和其后代中。逆转录病毒基因组含有三个基因-gag、pol和env-分别编码衣壳蛋白质、聚合酶和包膜组分。在gag基因上游发现的称为psi的序列起到将基因组包装到病毒体中的信号的作用。两个长末端重复(ltr)序列存在于病毒基因组的5'端和3'端。它们含有强的启动子和增强子序列,并也是整合到宿主细胞基因组中所需的(coffin,1990)。因此,例如,本技术包括例如细胞,其中用于转导细胞的多核苷酸被整合到细胞的基因组中。为了构建逆转录病毒载体,将编码启动子的核酸插入病毒基因组中以代替某些病毒序列,以产生复制缺陷型病毒。为了产生病毒体,构建含有gag、pol和env基因但不含ltr和psi组分的包装细胞系(mann等,(1983)cell,33,153-159)。当将含有人cdna连同逆转录病毒ltr和psi序列的重组质粒引入该细胞系(例如通过磷酸钙沉淀)中时,psi序列允许将重组质粒的rna转录物包装到病毒粒子中,然后将其分泌到培养基中(nicolas,j.f.和rubenstein,j.l.r.,(1988):载体:分子克隆载体和其应用的调查(vectors:asurveyofmolecularcloningvectorsandtheiruses),rodriquez和denhardt编辑)。nicolas和rubenstein;temin等,(1986):基因转移(genetransfer),kucherlapati(编辑),以及newyork:plenumpress,第149-188页;mann编辑,1983)。收集含有重组逆转录病毒的培养基,将其任选地浓缩并用于基因转移。逆转录病毒载体能够感染众多种细胞类型。然而,许多类型的逆转录病毒的整合和稳定表达需要宿主细胞的分裂(paskind等,(1975)virology,67,242-248)。最近基于通过向病毒包膜化学添加半乳糖残基对逆转录病毒进行的化学修饰开发了设计成允许逆转录病毒载体的特异性靶向的方法。该修饰可允许通过无唾液酸糖蛋白受体来特异性感染细胞(例如肝细胞),这可能是所期望的。设计了重组逆转录病毒靶向的不同方法,其使用针对逆转录病毒包膜蛋白且针对特定细胞受体的生物素化抗体。通过使用抗生蛋白链菌素经由生物素组分偶联抗体(roux等,(1989)proc.nat'lacad.sci.usa,86,9079-9083)。使用针对i类和ii类主要组织相容性复合物抗原的抗体,在体外用亲嗜性病毒证实带有那些表面抗原的各种人细胞的感染(roux等,1989)。腺相关病毒aav利用约4700个碱基对的线性单链dna。反向末端重复在所述基因组两侧。所述基因组内存在两个基因,产生许多不同的基因产物。第一个是cap基因,其产生三种不同的病毒体蛋白质(vp),被命名为vp-1、vp-2和vp-3。第二个是rep基因,其编码四种非结构蛋白质(ns)。这些rep基因产物中的一个或多个负责反式活化aav转录。aav中的三个启动子由它们在基因组中以图距单位表示的位置来指明。这些从左到右是p5、p19和p40。转录产生六种转录物,两种在三个启动子中的每一个处启动,其中每对中的一个被剪接。来源于图距单位42-46的剪接位点对于每个转录物是相同的。四种非结构蛋白质明显来源于转录物中较长的一种,并且三种病毒体蛋白质均由最小的转录物产生。aav与人的任何病理状态无关。有趣的是,为了有效复制,aav需要来自病毒的“辅助”功能,所述病毒例如单纯疱疹病毒i和ii、巨细胞病毒、假性狂犬病病毒以及(当然)腺病毒。特征最佳的辅助病毒是腺病毒,并且该病毒的许多“早期”功能显示出有助于aav复制。相信aavrep蛋白质的低水平表达能够保持aav结构表达受控,并且认为辅助病毒感染去除该封阻。aav载体的末端重复可通过限制性内切酶消化aav或含有修饰的aav基因组的质粒(例如p201)(samulski等,j.virol.,61:3096-3101(1987))或通过其他方法获得,所述其他方法包括但不限于基于已公开的aav序列化学或酶促合成末端重复。可例如通过缺失分析来确定允许功能(即稳定且位点特异性的整合)所需的aavitr的最小序列或部分。还可确定可耐受序列的哪些微小修饰,同时维持末端重复指导稳定的位点特异性整合的能力。基于aav的载体已被证明是用于体外基因递送的安全且有效的媒介物,并且这些媒介物正在针对潜在离体和体内基因疗法中的广泛应用进行临床前和临床阶段的开发和测试(carter和flotte,(1995)ann.n.y.acad.sci.,770;79-90;chatteijee等,(1995)ann.n.y.acad.sci.,770,79-90;ferrari等,(1996)j.virol.,70,3227-3234;fisher等,(1996)j.virol.,70,520-532;flotte等,proc.nat'lacad.sci.usa,90,10613-10617,(1993);goodman等(1994),blood,84,1492-1500;kaplitt等,(1994)nat'lgenet.,8,148-153;kaplitt,m.g.等,annthoracsurg.1996dec;62(6):1669-76;kessler等,(1996)proc.nat'lacad.sci.usa,93,14082-14087;koeberl等,(1997)proc.nat'lacad.sci.usa,94,1426-1431;mizukami等,(1996)virology,217,124-130)。aav介导的肺中有效基因转移和表达已步入用于治疗囊性纤维化的临床试验(carter和flotte,1995;flotte等,proc.nat'lacad.sci.usa,90,10613-10617,(1993))。类似地,通过aav介导的基因递送肌营养不良蛋白基因到骨骼肌对肌营养不良的治疗预期、通过酪氨酸羟化酶基因递送到大脑对帕金森氏病(parkinson'sdisease)的治疗预期、通过因子ix基因递送到肝脏对b型血友病的治疗预期、以及潜在地通过血管内皮生长因子基因递送到心脏对心肌梗塞的治疗预期看起来很有前景,因为最近显示aav介导的在这些器官中的转基因非常有效(fisher等,(1996)j.virol.,70,520-532;flotte等,1993;kaplitt等,1994;1996;koeberl等,1997;mccown等,(1996)brainres.,713,99-107;ping等,(1996)microcirculation,3,225-228;xiao等,(1996)j.virol.,70,8098-8108)。其他病毒载体在本方法和组合物中采用其他病毒载体作为表达构建体。采用从病毒例如牛痘病毒(ridgeway,(1988):载体:分子克隆载体和其应用的调查(vectors:asurveyofmolecularcloningvectorsandtheiruses),第467-492页;baichwal和sugden,(1986),基因转移,第117-148页;coupar等,基因(gene),68:1-10,1988)金丝雀痘病毒(canarypoxvirus)和疱疹病毒获得的载体。这些病毒提供了用于将基因转移到不同哺乳动物细胞中的数个特征。在所述构建体已被递送到细胞中之后,编码转基因的核酸被定位在不同位点并表达。在某些实施方案中,编码转基因的核酸稳定整合到细胞的基因组中。该整合通过同源重组(基因替代)而处于同族位置和定向,或者其被整合于随机的非特定性位置中(基因增强)。在又一些实施方案中,核酸作为dna的单独的附加型区段稳定保维持在细胞中。此类核酸区段或“附加体”编码足以允许独立于宿主细胞周期或与宿主细胞周期同步的维持和复制的序列。表达构建体如何被递送到细胞以及核酸在细胞中的保留的位置取决于所用表达构建体的类型。用于治疗疾病的方法本发明方法还涵盖治疗或预防通过例如输注施用细胞可能有益的疾病的方法。细胞,例如t细胞、肿瘤浸润性淋巴细胞、天然杀伤细胞、天然杀伤t细胞或祖细胞,例如造血干细胞、间充质基质细胞、干细胞、多能干细胞和胚胎干细胞可用于细胞疗法。所述细胞可来自供体,或者可以是从患者获得的细胞。所述细胞可例如用于再生,例如以替代患病细胞的功能。所述细胞还可被修饰以表达异源基因,使得可将生物制剂递送到特定的微环境,例如患病骨髓或转移性沉积。例如,间充质基质细胞也已被用于提供免疫抑制活性,并且可用于治疗移植物抗宿主病和自身免疫病症。本申请中所提供的细胞含有安全开关,所述安全开关在细胞疗法后需要增加或降低治疗性细胞的活性的情况下可能有价值。例如,当向患者提供表达嵌合抗原受体的t细胞时,在一些情况下可能存在不良事件,例如脱靶毒性。停止施用所述配体将使治疗性t细胞恢复到未活化状态,保持在低的、无毒的表达水平。或者,例如,治疗性细胞可起作用以减小肿瘤细胞或肿瘤大小,并且可能不再需要。在这种情况下,配体的施用可能停止,并且治疗性细胞将不再被活化。如果肿瘤细胞恢复,或者肿瘤大小在初始治疗后增加,则可再次施用所述配体,以活化表达嵌合抗原受体的t细胞,并再次治疗患者。“治疗性细胞”意指用于细胞疗法的细胞,即向受试者施用以治疗或预防病况或疾病的细胞。在此类情况下,当细胞具有负面作用时,本方法可用于通过选择性细胞凋亡来去除治疗性细胞。在其他示例中,t细胞被用于治疗各种疾病和病况,并且用作干细胞移植的一部分。在单倍体相同的t细胞移植之后可能发生的不良事件是移植物抗宿主病(gvhd)。gvhd发生的可能性随着移植的t细胞数目的增加而增加。这限制了可能被输注的t细胞的数目。通过在患者中发生gvhd的情况下具有选择性去除输注的t细胞的能力,可输注更大数目的t细胞,将数目增加到大于106个、大于107个、大于108个或大于109个细胞。可施用的t细胞/kg体重的数目可以是例如约1×104个t细胞/kg体重到约9×107个t细胞/kg体重,例如约1×104个、2×104个、3×104个、4×104个、5×104个、6×104个、7×104个、8×104个或9×104个;约1×105个、2×105个、3×105个、4×105个、5×105个、6×105个、7×105个、8×105个或9×105个;约1×106个、2×106个、3×106个、4×106个、5×106个、6×106个、7×106个、8×106个或9×106个;或约1×107个、2×107个、3×107个、4×107个、5×107个、6×107个、7×107个、8×107个或9×107个t细胞/kg体重。在其他示例中,可使用除t细胞以外的治疗性细胞。可施用的治疗性细胞/kg体重的数目可以是例如约1×104个t细胞/kg体重到约9×107个t细胞/kg体重,例如约1×104个、2×104个、3×104个、4×104个、5×104个、6×104个、7×104个、8×104个或9×104个;约1×105个、2×105个、3×105个、4×105个、5×105个、6×105个、7×105个、8×105个或9×105个;约1×106个、2×106个、3×106个、4×106个、5×106个、6×106个、7×106个、8×106个或9×106个;或约1×107个、2×107个、3×107个、4×107个、5×107个、6×107个、7×107个、8×107个或9×107个治疗性细胞/kg体重。当涉及接种物时,术语“单位剂量”是指适合作为用于哺乳动物的单位剂量的物理离散单位,每个单位含有经计算与所需稀释剂联合产生期望的免疫原性作用的预定量的药物组合物。接种物的单位剂量的规格决定于并且取决于药物组合物的独特特征和待实现的特定免疫作用。药物组合物(例如本文呈现的多聚体配体)的有效量将是实现选择性去除包含胱天蛋白酶-9载体的细胞,使得超过60%、70%、80%、85%、90%、95%或97%表达胱天蛋白酶-9的细胞被杀伤的这一所选结果的量。该术语还与“足够量”同义。用于任何特定应用的有效量可取决于诸如所治疗的疾病或病况、所施用的特定组合物、受试者的大小和/或疾病或病况的严重程度的因素而变化。可根据经验确定本文所呈现的特定组合物的有效量,而不需要过度的实验。当应用于细胞、组织或生物体时,术语“接触”和“暴露”在本文中用于讨论将药物组合物和/或另一试剂(例如化学治疗剂或放射治疗剂)递送到靶细胞、组织或生物体或与靶细胞、组织或生物体直接并列放置的过程。为了实现细胞杀伤或停滞,将药物组合物和/或另外的试剂以有效杀伤细胞或防止其分裂的组合量递送到一个或多个细胞。药物组合物的施用可在其他试剂之前,与其他试剂同时和/或在其他试剂之后,间隔范围数分钟到数周。在向细胞、组织或生物体分开施加药物组合物和其他试剂的实施方案中,通常将确保在每次递送的时间之间有相当长的时间不会过期,使得所述药物组合物和试剂仍将能够对细胞、组织或生物体发挥有利的组合作用。例如,在此类情况下,预期可将细胞、组织或生物体以两种、三种、四种或更多种模式与药物组合物基本上同时(即,在少于约1分钟内)接触。在其他方面,一种或多种试剂可在施用表达载体之前和/或之后,在基本上同时、约1分钟到约24小时到约7天到约1周到约8周或更长以及可从其中推导出的任何范围内施用。另外,可采用本文所呈现的药物组合物和一种或多种试剂的各种组合方案。优化和个性化的治疗性治疗施用二聚体之后细胞凋亡的诱导可通过确定移植物抗宿主病的分期或残留在患者体内的期望的治疗性细胞的数目来优化。例如,确定患者具有gvhd和gvhd的分期向临床医生提供可能需要通过施用多聚体配体来诱导胱天蛋白酶-9相关细胞凋亡的指示。在另一示例中,确定患者在用多聚体配体治疗之后具有降低水平的gvhd可向临床医生指示不需要额外剂量的多聚体配体。类似地,在用多聚体配体治疗之后,确定患者继续展现出gvhd症状或罹患gvhd复发可向临床医生指示可能需要施用至少一个额外剂量的多聚体配体。术语“剂量(dosage)”意在包括用药(dose)的量和施用的频率,例如下次用药的时间安排(timing)。在其他实施方案中,在施用治疗性细胞(例如除了诱导型胱天蛋白酶-9多肽之外还表达嵌合抗原受体的治疗性细胞)之后,在需要减少修饰细胞或体内修饰细胞的数目的情况下,可向所述患者施用多聚体配体。在这些实施方案中,所述方法包括确定负性症状或病况(例如移植物抗宿主病或脱靶毒性)的存在或不存在,以及施用一定剂量的多聚体配体。所述方法可进一步包括监测症状或病况以及在症状或病况持久存在的情况下施用额外剂量的多聚体配体。当表达嵌合抗原受体或嵌合信号分子的治疗性细胞仍留在患者体内时,可继续该监测和治疗时间表。可以任何方便的方式提供调整或维持后续药量(例如多聚体配体的后续剂量和/或后续药物剂量)的指示。在一些实施方案中,可以表格形式(例如,在物理或电子介质中)提供指示。例如,可将移植物抗宿主病观察到的症状提供在表格中,并且临床医生可将症状与疾病的分期列表或表格进行比较。临床医生然后可从表中鉴别关于后续药物剂量的指示。在某些实施方案中,可在将症状或gvhd分期提供给计算机(例如,输入到计算机上的存储器中)之后,由计算机呈现(例如,显示)指示。例如,可将该信息提供给计算机(例如,由用户输入到计算机存储器中或经由计算机网络中的远程装置传输到计算机),并且计算机中的软件可生成关于调整或维持后续药物剂量和/或提供后续药物剂量的指示。在基于指示确定后续剂量后,临床医生可施用后续剂量或向他人或另一实体提供调整剂量的指令。如本文所用的术语“临床医生”是指决策者,并且临床医生在某些实施方案中是医学专业人员。在一些实施方案中,决策者可以是计算机或显示的计算机程序输出,并且健康服务提供者可遵循由计算机显示的指示或后续药物剂量。决策者可直接(例如,将后续剂量输注到受试者中)或远程(例如,可由决策者远程改变泵参数)施用后续剂量。在一些示例中,可在gvhd的临床表现或其他症状(例如crs症状)明显之前施用单剂量或多剂量的配体。在该示例中,在负性症状出现之前终止细胞疗法。在其他实施方案(例如用于治疗遗传疾病的造血细胞移植)中,可在移植已向植入进展之后,但可出现在临床上可观察到的gvhd或其他负性症状之前,终止所述疗法。在其他示例中,可施用配体以消除修饰细胞,以消除中靶/脱肿瘤细胞,例如共表达b细胞相关靶抗原的健康b细胞。如本文所呈现的方法包括但不限于递送有效量的活化细胞、核酸或编码核酸的表达构建体。通常将药物组合物的“有效量”定义为足以可检测地且重复地实现所述期望结果(例如改善、降低、最小化或限制疾病或其症状的程度)的量。其他更严格的定义可能适用,包括疾病的消除、根除或治愈。在一些实施方案中,可存在监测生物标志物以评价治疗的有效性和控制毒性的步骤。用于受控疗法的治疗性细胞和细胞凋亡的异二聚化剂控制的双重控制本文所提供的核酸和细胞可用于实现用于受控疗法的治疗性细胞的双重控制。例如,受试者可能被诊断患有需要递送靶向嵌合抗原受体疗法的病况,例如肿瘤。本文所讨论的方法提供了实现以下目的的方式的数个示例:控制疗法以诱导表达car的治疗性细胞的活性,以及如果需要完全中止治疗或减少受试者中治疗性细胞的数目或百分比,则提供安全开关。在某些示例中,向表达以下多肽的受试者施用修饰的t细胞:1.包含两个或更多个fkbp12配体结合区和一个或多个共刺激多肽(例如myd88或截短的myd88和cd40)的嵌合多肽(imyd88/cd40或“imc”);2.包含一个或多个frb配体结合区和胱天蛋白酶-9多肽的嵌合促细胞凋亡多肽;3.包含结合靶抗原的抗原识别部分的嵌合抗原受体多肽。在该示例中,靶抗原是存在于受试者中的肿瘤细胞上的肿瘤抗原。在施用后,可向受试者施用诱导car-t细胞的imc活化的配体ap1903。监测疗法,例如,可在治疗过程期间评估肿瘤大小或生长。可在治疗过程期间施用一个或多个剂量的配体。可通过中止施用ap1903来调节疗法,所述ap1903可降低car-t细胞的活化水平。为了中止car-t细胞疗法,可通过施用结合frb配体结合区的雷帕霉素类似物来活化安全开关-嵌合型胱天蛋白酶-9多肽。雷帕霉素类似物的量和给药时间表可基于所需的car-t细胞疗法的水平来确定。作为安全开关,雷帕霉素类似物的剂量是有效去除至少90%、95%、97%、98%或99%所施用的修饰细胞的量。在其他示例中,如果需要降低car-t细胞疗法的水平,但不完全终止疗法,则所述剂量是有效去除最多达30%、40%、50%、60%、70%、80%、90%、95%或100%表达嵌合胱天蛋白酶多肽的细胞的量。这可例如通过以下方式来测量:在施用雷帕霉素或雷帕霉素类似物之前,在诱导安全开关之前从受试者获得样品,并在施用雷帕霉素或雷帕霉素类似物之后,例如在施用后0.5小时、1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时或1天、2天、3天、4天、5天获得样品,并且通过例如任何可用的方法(包括例如检测标志物的存在)在这两个样品之间比较表达嵌合胱天蛋白酶的细胞的数目或浓度。在诱导配体是ap1903或结合fkbp12或fkbp12变体多聚化区的情况下,也可使用确定细胞的去除百分比的这种方法。在一些示例中,诱导型myd88/cd40嵌合多肽还包含嵌合抗原受体。在这些示例中,当两个多肽存在于同一分子上时,嵌合多肽可包含一个或多个配体结合区。蛋白质二聚化的化学诱导(cid)已被有效地应用于使得可用小分子同二聚化配体瑞米达西(ap1903)诱导细胞自杀或细胞凋亡。该技术是细胞移植物中作为基因疗法辅助手段掺入的“安全开关”的基础(1,2)。该技术的核心宗旨是,如果使用小分子二聚化药物来控制蛋白质-蛋白质寡聚化事件,则依赖于作为信号传导途径一部分的蛋白质-蛋白质相互作用的正常细胞调控途径可适应配体依赖性的条件控制(3-5)。使用同二聚化配体(例如瑞米达西、ap1510或ap20187)对包含胱天蛋白酶-9和fkbp12或fkbp12变体的融合蛋白质的诱导二聚化(即“i胱天蛋白酶9/icasp9/ic9)可快速实现细胞死亡。胱天蛋白酶-9是用作细胞凋亡过程的“门卫(gate-keeper)”的初始性胱天蛋白酶(6)。通常,从凋亡细胞的线粒体释放的促细胞凋亡分子(例如细胞色素c)改变了apaf-1(胱天蛋白酶-9结合支架)的构象,导致其寡聚化和“凋亡体”的形成。这种改变有助于胱天蛋白酶-9二聚化并将其潜在形式切割成活性分子,进而切割“下游”细胞凋亡效应物胱天蛋白酶-3,导致不可逆的细胞死亡。瑞米达西直接与两个fkbp12-v36部分结合并可指导包括fkbp12-v36的融合蛋白质的二聚化(1,2)。ic9与瑞米达西的接合避免了apaf1转化为活性凋亡体的需要。在该示例中,测定胱天蛋白酶-9与接合异二聚化配体的蛋白质部分的融合物指导其活化和细胞死亡的能力,功效与瑞米达西介导的ic9活化相似。选择myd88和cd40作为imc活化开关的基础。myd88在通过抗原呈递细胞(apc)如树突细胞(dc)检测病原体或细胞损伤方面起中央信号传导作用。在暴露于病原体或坏死细胞来源的“危险”分子后,被称为toll样受体(tlr)的“模式识别受体”亚类被活化,导致衔接分子myd88通过两种蛋白质上的同源tlr-il1ra(tir)结构域的聚集和活化。myd88进而通过蛋白质的其余部分活化下游信号传导。这导致共刺激蛋白质(如cd40)和抗原加工和呈递所需的其他蛋白质(如mhc和蛋白酶)的上调。来自myd88和cd40的信号传导结构域与两个fv结构域的融合提供imc(也被称为mc.fvfv),其在暴露于瑞米达西后有效活化dc(7)。后来发现imc也是用于t细胞的有效共刺激蛋白质。雷帕霉素是天然产物大环内酯,其以高亲和力(<1nm)结合fkbp12,并一起起始与mtor的fkbp-雷帕霉素-结合(frb)结构域的高亲和力的抑制相互作用(8)。frb很小(89个氨基酸),因此当被附加到许多蛋白质时可用作蛋白质“标签”或“手柄(handle)”(9-11)。frb融合蛋白质与fkbp12融合蛋白质的共表达使得它们的近似是雷帕霉素诱导型的(12-16)。本实施例和下面的实施例提供了实验和结果,其被设计成测试与fkbp和frb串联结合的胱天蛋白酶-9的表达是否也可指导细胞凋亡并且用作由口服可用配体雷帕霉素调控的细胞安全开关的基础。此外,通过将fkbp和frb与myd88/cd40多肽串联融合来开发诱导型myd88/cd40雷帕霉素敏感性共刺激多肽。对于fkbp和frb的这种串联融合,还可使用在低治疗剂量下不抑制mtor的雷帕霉素衍生物(雷帕霉素类似物)。例如,可使用异二聚化剂以使两个mc-fkbp-frb多肽同二聚化来将雷帕霉素或这些雷帕霉素类似物与所选的mc-fkbp-融合突变frb结构域结合。以下参考文献在本部分中被提及,并且其全部内容在此以引用方式并入本文。1.straathofkc,pulema,yotndap,dottig,vaninef,brennermk,heslophe,spencerdm和rooneycm.用于t细胞疗法的诱导型胱天蛋白酶9安全开关(aninduciblecaspase9safetyswitchfort-celltherapy).blood.2005;105(11):4247-54.2.fanl,freemankw,khant,phame和spencerdm.基于胱天蛋白酶和fadd的改善的人工死亡开关(improvedartificialdeathswitchesbasedoncaspasesandfadd).humgenether.1999;10(14):2273-85.3.spencerdm,wandlesstj,schreibersl和crabtreegr.用合成的配体控制信号传导(controllingsignaltransductionwithsyntheticligands).science.1993;262(5136):1019-24.4.acevedovd,gangulard,freemankw,lir,zhangy,wangf,ayalage,petersonle,ittmannm和spencerdm.诱导型fgfr-1活化导致不可逆的前列腺腺癌和上皮-间质转化(induciblefgfr-1activationleadstoirreversibleprostateadenocarcinomaandanepithelial-to-mesenchymaltransition).cancercell.2007;12(6):559-71.5.spencerdm,belshawpj,chenl,hosn,randazzof,crabtreegr和schreibersl.使用合成的二聚化诱导物对体内fas信号传导的功能分析(functionalanalysisoffassignalinginvivousingsyntheticinducersofdimerization).currbiol.1996;6(7):839-47.6.strassera,corys和adamsjm.破译程序性细胞死亡的规则以改善癌症和其他疾病的疗法(decipheringtherulesofprogrammedcelldeathtoimprovetherapyofcancerandotherdiseases).emboj.2011;30(18):3667-83.7.narayananp,laptevan,seethammagarim,levittjm,slawinkm和spencerdm.复合myd88/cd40开关协同活化小鼠和人树突细胞用于增强抗肿瘤功效(acompositemyd88/cd40switchsynergisticallyactivatesmouseandhumandendriticcellsforenhancedantitumorefficacy).jclininvest.2011;121(4):1524-34.8.sabatinidm,erdjument-bromageh,luim,tempstp和snydersh.raft1:以雷帕霉素依赖性方式结合fkbp12且与酵母tor同源的哺乳动物蛋白质(raft1:amammalianproteinthatbindstofkbp12inarapamycin-dependentfashionandishomologoustoyeasttors).cell.1994;78(1):35-43.9.brownej,albersmw,shintb,ichikawak,keithct,lanews和schreibersl.g1阻遏性雷帕霉素受体复合物所靶向的哺乳动物蛋白质(amammalianproteintargetedbyg1-arrestingrapamycin-receptorcomplex).nature.1994;369(6483):756-8.10.chenj,zhengxf,brownej和schreibersl.289-kdafkbp12-雷帕霉素缔合蛋白质内的11-kdafkbp12-雷帕霉素结合结构域的鉴别和关键的丝氨酸残基的表征(identificationofan11-kdafkbp12-rapamycin-bindingdomainwithinthe289-kdafkbp12-rapamycin-associatedproteinandcharacterizationofacriticalserineresidue).procnatlacadsciusa.1995;92(11):4947-51.11.choij,chenj,schreibersl和clardyj.与人frap的结合结构域相互作用的fkbp12-雷帕霉素复合物的结构(structureofthefkbp12-rapamycincomplexinteractingwiththebindingdomainofhumanfrap).science.1996;273(5272):239-42.12.hosn,biggarsr,spencerdm,schreibersl和crabtreegr.二聚体配体限定转录活化结构域在再起始中的作用(dimericligandsdefinearolefortranscriptionalactivationdomainsinreinitiation).nature.1996;382(6594):822-6.13.klemmjd,bealscr和crabtreegr.核蛋白质快速靶向细胞质(rapidtargetingofnuclearproteinstothecytoplasm).currbiol.1997;7(9):638-44.14.baylejh,grimleyjs,stankunask,gestwickije,wandlesstj和crabtreegr.具有差异结合特异性的雷帕霉素类似物允许对蛋白质活性的正交控制(rapamycinanalogswithdifferentialbindingspecificitypermitorthogonalcontrolofproteinactivity).chembiol.2006;13(1):99-107.15.stankunask,baylejh,gestwickije,linym,wandlesstj和crabtreegr.使用基因敲入小鼠和二聚化化学诱导物的条件蛋白质等位基因(conditionalproteinallelesusingknockinmiceandachemicalinducerofdimerization).molcell.2003;12(6):1615-24.16.stankunask,baylejh,havranekjj,wandlesstj,bakerd,crabtreegr和gestwickije.用化学配体拯救fk506-雷帕霉素结合(frb)蛋白质的易降解突变体(rescueofdegradation-pronemutantsofthefk506-rapamycinbinding(frb)proteinwithchemicalligands).chembiochem.2007.双开关的嵌合促细胞凋亡多肽应答于异二聚体雷帕霉素或同二聚体瑞米达西中的任一种测定嵌合多肽frb.fkbpv.δc9(双重控制)、fkbpv.δc9和或frb.fkbp.δc9的活性。用小分子化学诱导二聚化(cid)是用于产生蛋白质功能的开关以改变细胞生理学的有效技术。瑞米达西或ap1903是高特异性且有效的二聚化剂,由尾对尾排布的两个相同的蛋白质结合表面(基于fk506)构成,每个表面均对fkbp突变体(fkbp12v36或fkbpv)具有高亲和力和特异性。fkbp12v36是fkbp12的修饰形式,其中苯丙氨酸36被更小的疏水性残基缬氨酸替代,所述缬氨酸适应ap1903的fkbp12结合位点上的庞大修饰[1]。该变化增加了ap1903与fkbp12v36的结合(约0.1nm),而ap1903与天然fkbp12的结合相对于fk506降低了约100倍[1,2]。将一个或多个fv结构域附着到一个或多个通常依赖于同二聚化的细胞信号传导分子上可将该蛋白质转化为瑞米达西诱导的信号传导对照。用瑞米达西进行同二聚化是用于细胞疗法的诱导型胱天蛋白酶-9(i胱天蛋白酶-9)“安全开关”和诱导型myd88/cd40(imc)“活化开关”两者的基础。雷帕霉素结合fkbp12,但与瑞米达西不同,雷帕霉素还结合mtor的fkbp12-雷帕霉素结合(frb)结构域,并且可诱导融合到fkbp12的信号传导结构域与含有frb的融合物的异二聚化。与fkbp和frb串联融合的胱天蛋白酶-9(两个定向:fkbp.frb.δc9或frb.fkbp.δc9)的表达可指导细胞凋亡并用作由口服可用配体雷帕霉素调控的细胞安全开关的基础。重要的是,由于瑞米达西在fkbp12-结合位点上含有庞大的修饰,因此该二聚化剂不能结合野生型fkbp12。frb.fkbpv.δc9开关提供用瑞米达西或雷帕霉素通过使fkbp结构域突变为fkbpv来活化胱天蛋白酶9的选项。这种在选择活化药物方面的灵活性在临床医生可基于药物的特定药理学性质来选择施用药物的临床环境中可能是重要的。另外,这种开关提供了一种分子,以允许直接比较瑞米达西和雷帕霉素的药物活化动力学,其中效应物包含在单个分子中。1.d.spencer等,science,第262卷,第1019-1024页,1993.2.t.clackson等,procnatlacadsciusa,第95卷,第10437-10442页,1998.用于向患者施用的制剂和途径在预期临床应用的情况下,将需要以适于预定应用的形式制备药物组合物-表达构建体、表达载体、融合蛋白质、转染或转导的细胞。通常,这将需要制备基本上不含热原以及可能对人或动物有害的其他杂质的组合物。多聚体配体,例如ap1903(inn瑞米达西)可例如以如下剂量被递送:约0.1到10mg/kg受试者重量、约0.1到5mg/kg受试者重量、约0.2到4mg/kg受试者重量、约0.3到3mg/kg受试者重量、约0.3到2mg/kg受试者重量或约0.3到1mg/kg受试者重量,例如约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.5、2、2.5、3、3.5、4、4.5、5、6、7、8、9或10mg/kg受试者重量。在一些实施方案中,所述配体以每剂量0.4mg/kg提供,例如以5mg/ml的浓度提供。可提供容纳配体的小瓶或其他容器,所述配体的体积为例如每小瓶约0.25ml到约10ml,例如,约0.25ml、0.5ml、1ml、1.5ml、2ml、2.5ml、3ml、3.5ml、4ml、4.5ml、5ml、5.5ml、6ml、6.5ml、7ml、7.5ml、8ml、8.5ml、9ml、9.5ml或10ml,例如约2ml。可能通常期望采用适当的盐和缓冲剂来使递送载体稳定并允许被靶细胞摄取。当将重组细胞引入患者中时也可采用缓冲剂。含水组合物包含溶解或分散于药学上可接受的运载体或含水介质中的有效量的细胞载体。此类组合物也被称为接种物。药学上可接受的运载体包括任何和所有的溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等。此类介质和试剂用于药物活性物质的用途是已知的。除了任何常规介质或试剂与载体或细胞不相容之外,涵盖其在治疗性组合物中的用途。还可将补充活性成分掺入组合物中。活性组合物可包括经典的药物制剂。这些组合物的施用将通过任何常规的途径进行,只要可通过该途径到达靶组织即可。这包括例如口服、鼻、颊、直肠、阴道或局部。或者,可通过原位、皮内、皮下、肌内、腹膜内或静脉内注射施用。此类组合物通常会作为本文所讨论的药学上可接受的组合物施用。适于注射使用的药物形式包括无菌水溶液或分散液和用于当场制备无菌注射溶液或分散液的无菌粉末。在所有情况下,所述形式都是无菌的并且流动达到存在易注射性的程度。它在制造和储存的条件下稳定并且针对诸如细菌和真菌的微生物的污染作用被防腐保存。运载体可以是含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)、其适合的混合物以及植物油的溶剂或分散介质。可例如通过使用例如卵磷脂的包衣、在分散液的情况下通过维持所需的粒度和通过使用表面活性剂来维持适当的流动性。防止微生物的作用可通过各种抗细菌剂和抗真菌剂(例如,对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸、硫柳汞(thimerosal)等)来实现。在某些示例中,可包含等渗剂,例如糖或氯化钠。可通过在组合物中使用延迟吸收的试剂(例如,单硬脂酸铝和明胶)来产生可注射组合物的延长吸收。对于口服施用,组合物可与赋形剂掺入并且以不可摄取的漱口剂和洁齿剂的形式使用。可将所需量的活性成分掺入适当的溶剂(例如硼酸钠溶液(多贝耳氏溶液(dobell'ssolution)))中来制备漱口剂。或者,可将活性成分掺入含有硼酸钠、甘油和碳酸氢钾的防腐洗液中。活性成分还可分散在洁牙剂中,所述洁牙剂包括例如:凝胶、糊剂、粉末和浆液。可将活性成分以治疗有效量添加到糊料洁牙剂中,所述糊料洁牙剂可包含例如水、粘合剂、研磨剂、调味剂、发泡剂和湿润剂。所述组合物可以中性或盐形式配制。药学上可接受的盐包括例如酸加成盐(用蛋白质的游离氨基形成),并且其用无机酸(例如盐酸或磷酸)或有机酸(例如乙酸、草酸、酒石酸、扁桃酸等)形成。用游离羧基形成的盐还可衍生自无机碱,例如钠、钾、铵、钙或铁的氢氧化物,和有机碱,例如异丙胺、三甲胺、组氨酸、普鲁卡因(procaine)等。在配制后,溶液将以与剂量制剂相容的方式并以诸如治疗有效的量被施用。所述制剂易于以各种剂型(例如可注射溶液、药物释放胶囊等)施用。例如,对于在水溶液中的肠胃外施用,如果需要,所述溶液可经适当缓冲,并且首先用足够的盐水或葡萄糖使液体稀释剂等渗。这些特定的水溶液尤其适于静脉内、肌肉内、皮下和腹膜内施用。关于这一点,可采用无菌含水介质。例如,可将一个剂量溶解在1ml等渗nacl溶液中,并将其添加到1000ml皮下灌注液中或在提议的输注位点注射(参见例如“雷明顿药物科学(remington'spharmaceuticalsciences)”第15版,第1035-1038页和第1570-1580页)。取决于所治疗受试者的状况,将必然发生剂量的一些变化。负责施用的人将在任何情况下确用于个体受试者的适当剂量。定此外,对于人施用来说,制剂可满足fda生物制品标准局(fdaofficeofbiologicsstandards)所要求的对无菌性、致热原性和一般安全性以及纯度的标准。实施例以下所述的实施例说明某些实施方案,且并不限制本技术。已研究选择性消融供体细胞的机制作为用于细胞疗法的安全开关,但已存在并发症。迄今为止已在t淋巴细胞中获得关于安全开关基因的一些经验,因为用这些细胞的免疫疗法已被证明作为针对病毒感染和恶性肿瘤的治疗有效(walter,e.a.等,n.engl.j.med.1995,333:1038-44;rooney,c.m.等,blood.1998,92:1549-55;dudley,m.e.等,science2002,298:850-54;marjit,w.a.等,proc.natl.acad.sci.usa2003,100:2742-47)。单纯疱疹病毒i型来源的胸苷激酶(hsvtk)基因已被用作供体t细胞输注中的体内自杀开关,以治疗造血干细胞移植之后的复发性恶性肿瘤和爱泼斯坦巴尔病毒(ebv)淋巴增殖(boninic等,science.1997,276:1719-1724;tiberghienp等,blood.2001,97:63-72)。然而,引起移植物抗宿主病的t细胞的破坏是不完全的,并且使用丙氧鸟苷(gancyclovir)(或类似物)作为前药以活化hsv-tk阻碍施用丙氧鸟苷作为针对巨细胞病毒感染的抗病毒药物。这种作用机制还需要干扰dna合成,依赖于细胞分裂,以致细胞杀伤可能延长数天并且不完全,造成临床益处的长时间延迟(ciceri,f.等,lancetoncol.2009,262:1019-24)。此外,即使在免疫抑制的人免疫缺陷病毒和骨髓移植患者中,hsv-tk引导的免疫应答已导致hsv-tk转导的细胞的消除,从而损害了输注的t细胞的持久性和由此的功效。hsv-tk也是病毒来源的,因此具有潜在免疫原性(boninic等,science.1997,276:1719-1724;riddellsr等,natmed.1996,2:216-23)。大肠杆菌来源的胞嘧啶脱氨酶基因也已被临床使用(freytagso等,cancerres.2002,62:4968-4976),但作为异种抗原,它可能是免疫原性的,因此与需要长期持续的基于t细胞的疗法不相容。已提出可通过单克隆嵌合抗cd20抗体活化的转基因人cd20作为非免疫原性安全系统(intronam等,humgenether.2000,11:611-620)。以下章节提供使用胱天蛋白酶-9嵌合蛋白质在用于细胞疗法的细胞中提供安全开关的方法的实施例。实施例1:胱天蛋白酶-9自杀性开关表达载体的构建和评价载体建设和表达的确认本文呈现了可在人体t细胞中稳定且高效地表达的安全开关。该系统包括具有低潜在免疫原性的人基因产物,所述基因产物已被修饰以与小分子二聚化剂药物相互作用,该小分子二聚化剂能够引起表达该修饰基因的转导t细胞的选择性消除。另外,诱导型胱天蛋白酶-9维持在过表达抗细胞凋亡分子的t细胞中的功能。构建适合用作治疗剂的表达载体,其包含融合到人fk506结合蛋白(fkbp)(例如fkbp12v36)的修饰的人胱天蛋白酶-9活性。胱天蛋白酶-9/fk506杂合活性可使用小分子药物进行二聚化。将胱天蛋白酶-9活性的全长形式、截短形式和修饰形式融合到配体结合结构域或多聚化区,并插入到逆转录病毒载体mscv.ires.grp中,该载体还允许表达荧光标志物gfp。图1a图释说明了作为用于诱导细胞凋亡的自杀开关构建并评价的全长、截短和修饰的胱天蛋白酶-9表达载体。全长诱导型胱天蛋白酶-9分子(f'-fc-casp9)包含用gly-ser-gly-gly-gly-ser接头连接到胱天蛋白酶分子的小亚基和大亚基的2种、3种或更多种fk506结合蛋白质(fkbp-例如fkbp12v36变体)(参见图1a)。全长诱导型胱天蛋白酶-9(f'f-c-casp9.i.gfp)具有全长胱天蛋白酶-9,还包含连接到含有f36v突变的2种12-kda人fk506结合蛋白质(fkbp12;genbankah002818)的胱天蛋白酶募集结构域(card;genbanknm001229)(图1a)。使一个或多个fkbp(f')的氨基酸序列进行密码子摆动(例如,通过维持最初编码的氨基酸的沉默突变改变每个氨基酸密码子的第3个核苷酸)以防止在逆转录病毒中表达时的同源重组。f'f-c-casp9c3s包含位置287处的半胱氨酸向丝氨酸的突变,所述突变破坏其活化位点。在构建体f'f-casp9、f-c-casp9和f'-casp9中,分别缺失胱天蛋白酶活化结构域(card)、一个fkbp或两者。将所有构建体作为ecori-xhoi片段克隆到mscv.ires.gfp中。用这些构建体中的每一种转染293t细胞,并且在转导之后48小时,通过流式细胞术分析标志物基因gfp的表达。另外,在转染之后24小时,将293t细胞与100nmcid孵育过夜,随后用细胞凋亡标志物膜联蛋白v染色。来自4次单独实验的转基因表达水平的平均偏差和标准偏差(平均gfp)以及暴露于二聚化化学诱导物(cid)之前和之后的凋亡细胞数(gfp细胞内的膜联蛋白v%)显示于图1a的表的第二到第五列中。除了分析gfp表达水平和膜联蛋白v的染色外,还通过蛋白质印迹分析全长、截短和修饰的胱天蛋白酶-9的表达基因产物以确认胱天蛋白酶-9基因被表达并且表达产物为预计大小。蛋白质印迹的结果呈现于图1b中。通过使用对氨基酸残基299-318特异性的胱天蛋白酶-9抗体以及gfp特异性抗体进行蛋白质印迹来确认预计大小的诱导型胱天蛋白酶-9构建体与标志物基因gfp在转染的293t细胞中的共表达,所述氨基酸残基299-318存在于全长和截短的胱天蛋白酶分子二者中。如本文所呈现的进行蛋白质印迹。将转染的293t细胞再悬浮于含有抑肽酶、亮抑蛋白酶肽和苯基甲基磺酰氟(boehringer,ingelheim,germany)的裂解缓冲液(50%tris/gly、10%十二烷基硫酸钠[sds]、4%β-巯基乙醇、10%甘油、12%水和4%溴酚蓝,以0.5%)中并在冰上孵育30分钟。在离心30分钟之后,收获上清液;与laemmli缓冲液(bio-rad,hercules,ca)1:2混合,煮沸并加样于10%sds-聚丙烯酰胺凝胶上。用兔抗胱天蛋白酶-9(氨基酸残基299-318)免疫球蛋白g(igg;affinitybioreagents,golden,co;1:500稀释)和用小鼠抗gfpigg(covance,berkeley,ca;1:25,000稀释)对膜进行探测。然后将印迹暴露于适当的过氧化物酶偶联的二级抗体,并用增强的化学发光(ecl;amersham,arlingtonheights,il)检测蛋白质表达。然后对膜进行洗脱并用山羊多克隆抗肌动蛋白(santacruzbiotechnology;1:500稀释)再次探测以检查加样的相等性。图1b中所见的另外较小尺寸的带可能代表降解产物。f'f-c-casp9和f'f-casp9构建体的降解产物可能由于这些构建体因其基础活性所致的较低表达水平而未被检测到。通过蛋白质印迹每条泳道底部显示的基本相等量的肌动蛋白(指示在每条泳道中加样了基本上相似量的蛋白质)确认每个样品的相等加样。本文提供了可在修饰细胞中表达的嵌合多肽的示例。在本实施例中,单个多肽由核酸载体编码。由于跳过肽键,因此诱导型胱天蛋白酶-9多肽在翻译期间与car多肽分离。(donnelly,ml2001,j.gen.virol.82:1013-25)。胱天蛋白酶-9自杀性开关表达构建体的评价。细胞系在含有10%胎牛血清(fbs;hyclone)的rpmi1640(hyclone,logan,ut)中培养b95-8ebv转化的b细胞系(lcl)、jurkat和mt-2细胞(由美国德克萨斯州休斯顿贝勒医学院(baylorcollegeofmedicine,houston,tx)的s.marriott博士友情提供)。在45%rpmi/45%clicks(irvinescientific,santaana,ca)/10%fbs中培养多克隆ebv特异性t细胞系,并如先前报道的那样产生。简单地说,用以4000拉德照射的自体lcl以40:1的应答物对刺激物(r/s)比率刺激外周血单核细胞(24孔板每孔2×106个)。在9到12天之后,将活细胞用辐照的lcl以4:1的r/s比再刺激。随后,通过在40u/ml到100u/ml重组人白细胞介素-2(rhil-2;proleukin;chiron,emeryville,ca)存在下用lcl每周再刺激来扩增细胞毒性t细胞(ctl)。逆转录病毒转导为了瞬时产生逆转录病毒,使用genejuice转染试剂(novagen,madison,wi),用icasp9/ifas构建体连同编码gag-pol和rd114包膜的质粒转染293t细胞。在转染之后48到72小时收获病毒,将其速冻,并在约80℃储存直到使用。通过用vsv-g假型瞬时逆转录病毒上清液进行多重转导来产生稳定的flyrd18来源的逆转录病毒生产系。对具有最高转基因表达的flyrd18细胞进行单细胞分选,并对产生最高病毒滴度的克隆扩增且用于产生用于淋巴细胞转导的病毒。该克隆的转基因表达、功能和逆转录病毒滴度在连续培养期间维持超过8周。为了转导人淋巴细胞,用重组纤连蛋白片段(fnch-296;retronectin;takarashuzo,otsu,japan;4μg/ml于pbs中,在4℃过夜)包被非组织培养物处理的24孔板(bectondickinson,sanjose,ca),并在37℃将其与每孔0.5ml逆转录病毒孵育30分钟,两次。随后,在100u/mlil-2存在下,使用每孔1ml病毒将每孔3×105到5×105个t细胞转导48到72小时。通过在facscan流式细胞仪(bectondickinson)上分析共表达标志物基因绿色荧光蛋白质(gfp)的表达来确定转导效率。对于功能研究,不对转导的ctl进行选择,或使用如所示的moflo细胞仪(dakocytomation,ftcollins,co)将其分离成具有低、中等或高gfp表达的群体。细胞凋亡的诱导和分析将所示浓度的cid(ap20187;ariadpharmaceuticals)添加到转染的293t细胞或转导的ctl中。收获粘附细胞和非粘附细胞并用膜联蛋白结合缓冲液(bdpharmingen,sanjose,ca)洗涤。根据制造商的说明(bdpharmingen)用膜联蛋白-v和7-氨基-放线菌素d(7-aad)将细胞染色15分钟。在染色之后1小时内,使用cellquest软件(bectondickinson)通过流式细胞术分析细胞。细胞毒性测定如先前所呈现的,在标准的4小时51cr释放测定中评价每个ctl细胞系的细胞毒性活性。靶细胞包括自体lcl、人白细胞抗原(hla)i类错配lcl和淋巴因子活化的杀伤细胞敏感性t细胞淋巴瘤系hsb-2。在完全培养基或1%tritonx-100(sigma,stlouis,mo)中孵育的靶细胞分别用于确定自发51cr释放和最大51cr释放。将一式三份孔的特异性裂解的平均百分比计算为100×(实验释放-自发释放)/(最大释放-自发释放)。基因分型使用以下单克隆抗体研究细胞表面表型:cd3、cd4、cd8(bectondickinson)以及cd56和tcr-α/β(immunotech,miami,fl)。使用抗ngfr抗体(chromaprobe,aptos,ca)检测δngfr-ifas。在每次实验中使用适当的匹配同种型对照(bectondickinson)。利用facsscan流式细胞仪(bectondickinson)分析细胞。细胞因子产生的分析使用人th1/th2细胞因子细胞计数珠阵列(bdpharmingen)测量ctl培养上清液中干扰素-γ(ifn-γ)、il-2、il-4、il-5、il-10和肿瘤坏死因子-α(tnfα)的浓度,并且根据制造商的说明,通过酶联免疫吸附测定(elisa;r&dsystems,minneapolis,mn)测量培养上清液中il-12的浓度。体内实验对6到8周龄的非肥胖糖尿病严重联合免疫缺陷(nod/scid)小鼠进行辐照(250拉德),并在右侧皮下注射再悬浮于matrigel(bdbioscience)中的10×106到15×106个lcl。在两周后,用未经转导的和icasp9.i.gfp高转导的ebvctl(总共15×106个)的1:1混合物注射到带有直径大约0.5cm的肿瘤的小鼠的尾静脉中。在ctl输注前4到6小时并且在ctl输注后3天,用重组hil-2(2000u;proleukin;chiron)腹膜内注射小鼠。在第4天,将小鼠随机分成两组:1组接受cid(50μgap20187,腹膜内)并且1组仅接受运载体(16.7%丙二醇、22.5%peg400和1.25%tween80,腹膜内)。在第7天,杀死所有小鼠。将肿瘤均质化并用抗人cd3(bdpharmingen)染色。通过facs分析,评价门控cd3+群体内gfp+细胞的数目。将来自仅接受未经转导的ctl(总共15×106个)的对照组小鼠的肿瘤用作cd3+/gfp+细胞分析中的阴性对照。诱导型胱天蛋白酶-9的表达和功能的优化在转染的293t细胞和转导的人t细胞两者中针对作为诱导型安全开关分子的适合性来筛选胱天蛋白酶3、胱天蛋白酶7和胱天蛋白酶9。仅诱导型胱天蛋白酶-9(icasp9)以足以赋予对所选cid(例如二聚化化学诱导物)的敏感性的水平表达。初始筛选指示全长icasp9不能在t细胞中以高水平稳定维持,可能归因于转导的细胞被转基因的基础活性消除。通过细胞色素c和三磷酸腺苷(atp)驱动的与细胞凋亡蛋白酶活化因子1(apaf-1)的相互作用,card结构域参与胱天蛋白酶-9分子的生理二聚化。由于使用cid诱导自杀开关的二聚化和活化,因此在这种情况下card结构域的功能是多余的,并且研究了card结构域的去除作为降低基础活性的方法。考虑到活化胱天蛋白酶-9仅需要二聚化而非多聚化,因此还研究了单个fkbp12v36结构域作为实现活化的方法。比较所得截短和/或修饰形式的胱天蛋白酶-9(例如,card结构域、或2个fkbp结构域之一、或二者)的活性。具有破坏的活化位点的构建体f'f-c-casp9c->s提供了无功能对照(参见图1a)。将所有构建体克隆到逆转录病毒载体mscv26中,其中逆转录病毒长末端重复(ltr)引导转基因表达并且通过使用内部核糖体进入位点(ires)从相同的mrna共表达增强的gfp。在转染的293t细胞中,通过蛋白质印迹证实了预计大小的所有诱导型胱天蛋白酶-9构建体的表达以及gfp的共表达(参见图1b)。蛋白质表达(通过gfp的平均荧光估计并在蛋白质印迹上显现)在非功能性构建体f'f-c-casp9c->s中最高,并且在全长构建体f'f-c-casp9中大大降低。去除card(f'f-casp9)、一个fkbp(f-c-casp9)或二者(f-casp9)导致诱导型胱天蛋白酶-9和gfp的渐进升高的表达,以及对cid的相应增强的敏感性(参见图1a)。基于这些结果,将f-casp9构建体(以下被称为icasp9m)用于人t淋巴细胞中的进一步研究。icasp9m在人t淋巴细胞中的稳定表达自杀基因表达的长期稳定性至关重要,这是因为只要遗传工程化细胞持久存在,则自杀基因就必须被表达。对于t细胞转导,产生flyrd18来源的逆转录病毒生产克隆以促进t细胞的转导,该克隆产生高滴度rd114假型病毒。评价ebv特异性ctl系(ebv-ctl)中的icasp9m表达,这是因为ebv特异性ctl系具有充分表征的功能和特异性并且已被用作用于预防和治疗ebv相关恶性肿瘤的体内疗法。在用逆转录病毒单次转导之后,获得ebv-ctl的超过70%(平均值为75.3%;5个不同供体中的范围为71.4%-83.0%)的一致转导效率。icasp9m在ebv-ctl中的表达在转导之后稳定至少4周而无转基因功能的选择或损失。icasp9m不改变转导的t细胞特征为了确保icasp9m的表达不改变t细胞特征,将未经转导或非功能性icasp9c->s-转导的ebv-ctl的表型、抗原特异性、增殖潜力和功能与icasp9m转导的ebv-ctl的表型、抗原特异性、增殖潜力和功能进行比较。在4个单独的供体中,转导和未经转导的ctl由相同数目的cd4+、cd8+、cd56+和tcrα/β+细胞组成。类似地,细胞因子(包括ifn-γ、tnfα、il-10、il-4、il-5和il-2)的产生未被icasp9m表达改变。icasp9m转导的ebv-ctl特异性地裂解与未经转导的ctl和对照转导的ctl相当的自体lcl。icasp9m的表达不影响指数生长的ctl的生长特征,并且重要的是,保持了对抗原和il-2的增殖依赖性。在转导之后的第21天,继续或中止使用自体lcl和il-2进行的正常每周抗原刺激。中止抗原刺激导致t细胞的稳定下降。被选择用于体外高转基因表达的超过99%的t淋巴细胞的消除通过监测在施用cid之后表达gfp的细胞的损失来测试诱导型icasp9m对ctl的熟悉度(proficiency);单个10nm剂量的cid之后,消除91.3%(在5个不同供体中的范围为89.5%-92.6%)的gfp+细胞。无论暴露于cid的时间(范围,1小时-连续)如何,均获得类似的结果。在所有实验中,cid处理后存活的ctl具有低转基因表达,cid后gfp的平均荧光强度降低70%(范围,55%-82%)。通过抗原刺激,之后进行第二个10nm剂量的cid,不能进一步消除存活的gfp+t细胞。因此,无应答的ctl最可能表达对于通过cid进行功能活化来说不足的icasp9m。为了研究低表达水平和ctl对cid无应答之间的相关性,针对低表达、中表达和高表达的连锁的标志物基因gfp对ctl进行分选,并将其与来自相同供体的未经转导的ctl1:1混合以允许准确定量对cid诱导的细胞凋亡应答的转导的t细胞的数目。消除的转导t细胞的数目随着gfp转基因表达的水平而增加(参见图4a、图4b和图4c)。为了确定icasp9m的转基因表达和功能之间的相关性,针对低(平均21)、中(平均值80)和高(平均189)的gfp表达,选择icasp9mires.gfp转导的ebv-ctl。将所选的t细胞与10nmcid孵育过夜,随后用膜联蛋白v和7-aad染色。指示膜联蛋白v+/7-aad-和膜联蛋白v+/7-aad+t-的百分比。将所选的t细胞与未经转导的t细胞以1:1混合,并在抗原刺激之后与10nmcid一起孵育。指示第7天时残余的gfp阳性t细胞的百分比。对于gfp高选择的细胞,10nmcid导致99.1%(范围,98.7%-99.4%)的经转导细胞的去除。在抗原刺激当天,f-casp9m.i.gfp-转导的ctl未经处理或用10nmcid处理。在七天后,通过流式细胞术测量gfp对cid的应答。将转导的t细胞的百分比调整到50%以允许在cid处理之后准确测量残余gfp+细胞。比较未选择的ctl(顶行)和gfp高选择的ctl(底行)中对cid的应答。指示残余的gfp+细胞的百分比。通过细胞凋亡特征(例如cid施用的14小时内的细胞皱缩和碎片化)来证实gid高选择细胞中细胞凋亡的快速诱导。在与10nmcid一起孵育过夜之后,f-casp9m.i.gfp高-转导的t细胞有通过显微评价的细胞凋亡特征,例如细胞皱缩和碎片化。在针对高表达选择的t细胞中,64%(范围,59%-69%)有细胞凋亡(膜联蛋白-v++/7-aad-)且30%(范围:26%-32%)有坏死(膜联蛋白v+/7-aad+)表型。用细胞凋亡标志物染色显示,64%的t细胞有细胞凋亡表型(膜联蛋白v+,7-aad-,右下象限)且32%有坏死表型(膜联蛋白v+,7-aad+,右上象限)。显示了3个单独实验的代表性实施例。相比之下,在针对中或低gfp表达选择的t细胞中,细胞凋亡的诱导显著更低(参见图4a、图4b和图4c)。因此,对于临床应用,可能期望具有可选标志物的表达构建体的形式,所述可选标志物允许选择高拷贝数、高表达水平或高拷贝数和高表达水平二者。cid诱导的细胞凋亡在添加cid之前被泛胱天蛋白酶(pancaspase)抑制剂zvad-fmk(100μm)抑制1小时。cid的滴定显示1nmcid足以获得最大的去除作用。使用指示量的cid(ap20187)的剂量-应答曲线显示f-casp9m.i.gfp高对cid的敏感性。在施用指示量的cid之后第7天测量gfp+细胞的存活。给出每个点的平均值和标准偏差。使用另一种二聚化化学诱导物(cid)(ap1903)获得类似的结果,临床证明其在向健康志愿者施用时基本上没有不利影响。剂量应答在转导之后保持至少4周不变。icasp9m在表达抗细胞凋亡分子的恶性细胞中起作用选择胱天蛋白酶-9作为用于临床用途的诱导型促细胞凋亡分子,而不是先前呈现的ifas和ifadd,这是因为胱天蛋白酶-9在细胞凋亡信号传导中相对较晚起作用,因此预期其较不易受细胞凋亡抑制剂所抑制。因此,不仅在表达抗细胞凋亡分子的恶性的、转化的t细胞系中,而且在表达升高的抗细胞凋亡分子的正常t细胞亚群中,都应当保持自杀功能作为所述过程的一部分以确保记忆细胞的长期保持。为了进一步研究该假说,首先在ebv-ctl中比较了icasp9m和ifas的功能。为了消除任何潜在的基于载体的差异,使诱导型fas也如icasp9在mscv.ires.gfp载体中表达。对于这些实验,针对gfp高表达对δngfr.ifas.i.gfp转导的ctl和icasp9m.i.gfp转导的ctl二者进行分选,并将其与未经转导的ctl以1:1比率混合,以获得以相等比例和相似水平表达ifas或icasp9m的细胞群体。如所呈现的,将ebv-ctl针对高gfp表达进行分选并与未经转导的ctl1:1混合。指示δngfr+/gfp+和gfp+t细胞的百分比。施用10nmcid之后对gfp+细胞的消除在icasp9m转导的ctl中比在ifas转导的ctl中更快速且更有效(99.2%+/-0.14%的icasp9m转导细胞,相比于89.3%+/-4.9%的ifas转导细胞,在cid之后第7天;p<.05)。在lcl刺激当天,施用10nmcid,并在所指示的时间点测量gfp以确定对cid的应答。黑色菱形表示δngfr-ifas.i.gfp的数据;黑色正方形表示icasp9m.i.gfp的数据。显示了3次实验的平均值和标准偏差。还在以下2种恶性t细胞系中比较icasp9m和ifas的功能:jurkat(细胞凋亡敏感性t细胞白血病系)和mt-2(抗细胞凋亡的t细胞系),归因于c-flip和bcl-xl表达。将jurkat细胞和mt-2细胞用具有相似效率(在jurkat中92%相对于84%,在mt-2中76%相对于70%)的ifas和icasp9m转导,并在存在10nmcid的情况下培养8小时。膜联蛋白-v染色显示,虽然ifas和icasp9m诱导相当数目的jurkat细胞的细胞凋亡(分别为56.4%+/-15.6%和57.2%+/-18.9%),但仅icasp9m的活化导致mt-2细胞的细胞凋亡(对于ifas和icasp9m,分别为19.3%+/-8.4%和57.9%+/-11.9%;参见图5c)。用δngfr-ifas.i.gfp或icasp9m.i.gfp转导人t细胞系jurkat(左)和mt-2(右)。用每个自杀基因转导相等百分比的t细胞:在jurkat中,92%(对于δngfr-ifas.i.gfp)相对于84%(对于icasp9m.i.gfp),以及在mt-2中,76%(对于δngfr-ifas.i.gfp)相对于70%(对于icasp9m.i.gfp)。t细胞未经处理或与10nmcid孵育。在暴露于cid之后8小时,通过针对膜联蛋白v和7-aad染色来测量细胞凋亡。显示了3次实验的代表性实施例。pe指示藻红蛋白。这些结果证实,在过表达细胞凋亡抑制分子的t细胞中,ifas的功能可被阻断,而icasp9m仍然可有效地诱导细胞凋亡。表达免疫调节转基因的t细胞的由icasp9m介导的消除为了确定icasp9m是否可有效地破坏经遗传修饰以表达活性转基因产物的细胞,测量icasp9m消除稳定表达il-12的ebv-ctl的能力。在未经转导的ctl和icasp9m.ires.gfp-转导的ctl的上清液中检测不到il-12,而icasp9m.ires.il-12转导的细胞的上清液含有324pg/ml到762pg/ml的il-12。然而,在施用10nmcid之后,上清液中的il-12降到不可检测的水平(<7.8pg/ml)。因此,即使没有对高转基因表达细胞的预先分选,icasp9m的活化也足以完全消除产生生物相关水平的il-12的所有t细胞。icasp9gfpm.i.gfp构建物中的标志物基因gfp被编码人il-12的p40和p35亚基的flexiil-12替代。将icasp9m.i.gfp转导的ebv-ctl和icasp9m.i.il-12转导的ebv-ctl用lcl刺激,然后不处理或暴露于10nmcid。在第二次抗原刺激之后三天,通过il-12elisa(该测定的检测极限为7.8pg/ml)测量培养上清液中il-12的水平。指示一式三份孔的平均值和标准偏差。显示了用来自2个不同供体的ctl进行的2次实验中的1个的结果。针对体内高转基因表达选择的t细胞超过99%的消除还在转导的ebv-ctl体内评价了icasp9m的功能。scid小鼠-人异种移植模型被用于过继性免疫疗法。在将未经转导的ctl和icasp9m.ires.gfp高转导的ctl的1:1混合物静脉内输注到带有自体lcl异种移植物的scid小鼠中之后,用单剂量的cid或仅运载体治疗小鼠。在施用cid/运载体之后三天,针对人cd3+/gfp+细胞分析肿瘤。使用人抗cd3抗体检测输注产品的未经转导的组分证实了接受cid的小鼠中尾静脉输注的成功。与仅用运载体治疗的输注小鼠相比,在cid治疗的小鼠中,人cd3+/gfp+t细胞的数目减少99%,证实icasp9m-转导的t细胞在体内和体外的同样高敏感性。测定icasp9m在体内的功能。对nod/scid小鼠进行辐照并用10×106到15×106个lcl皮下注射。在14天之后,带有直径0.5cm的肿瘤的小鼠接受总共15×106个ebv-ctl(这些细胞的50%未经转导,50%用icasp9m.i.gfp转导并针对高gfp表达加以分选)。在ctl施用之后第3天,小鼠接受cid(50μgap20187;(黑色菱形,n=6)或仅运载体(黑色正方形,n=5),并在第6天分析肿瘤中的人cd3+/gfp+t细胞的存在。将从仅接受未经转导的ctl(15×106个ctl;n=4)的对照组小鼠的肿瘤中分离的人cd3+t细胞用作用于分析肿瘤内的cd3+/gfp+t细胞的阴性对照。讨论在一些实施方案中,本文呈现了表达适于在体内消除基因修饰的t细胞的自杀基因的表达载体。本文所呈现的自杀基因表达载体具有某些非限制性有利特征,包括携带修饰基因的所有细胞中的稳定共表达、高到足以诱发细胞死亡的水平的表达、低基础活性、高比活性和对内源性抗细胞凋亡分子的最小易感性。在某些实施方案中,本文呈现诱导型胱天蛋白酶-9(icasp9m),其具有允许在人t细胞稳定表达超过4周的低基础活性。单个10nm剂量的二聚化(cid)的小分子化学诱导物足以杀伤针对体外和体内高转基因表达选择的超过99%的icasp9m转导细胞。此外,当与th1细胞因子il-12共表达时,即使没有针对高转基因表达进行选择,icasp9m的活化也消除所有可检测的il-12产生细胞。胱天蛋白酶-9在大多数抗细胞凋亡分子的下游起作用,因此,无论是否存在增加水平的bcl-2家族抗细胞凋亡分子,都保持了对cid的高敏感性。因此,icasp9m还可被证明可用于诱导甚至对于相对抗细胞凋亡的转化t细胞和记忆t细胞的破坏。与其他胱天蛋白酶分子不同,蛋白质水解似乎不足以活化胱天蛋白酶-9。晶体学和功能数据指示,无活性的胱天蛋白酶-9单体的二聚化导致构象变化诱导的活化。前胱天蛋白酶-9在生理环境中的浓度在约20nm的范围内,远低于二聚化所需的阈值。不受限于理论,相信二聚化的能量屏障可通过由细胞色素c和atp驱动的apaf-1和胱天蛋白酶-9的card结构域之间的亲同种抗原性相互作用来克服。接合到2个fkbp的胱天蛋白酶-9的过表达可允许发生自发二聚化并且可导致初始全长胱天蛋白酶-9构建体的所观察到的毒性。在去除一个fkbp后观察到毒性降低和基因表达增加,最可能归因于与自发二聚化相关的毒性降低。尽管多聚化通常参与表面死亡受体的活化,但胱天蛋白酶-9的二聚化应足以介导活化。本文所呈现的数据指示,具有单一fkbp的icasp9构建体像具有2个fkbp的那些一样有效地起使用。通过去除card结构域增加对cid的敏感性可表示一旦cid结合,二聚化的能量阈值降低。病毒或细菌来源的致死基因(例如hsv-tk和胞嘧啶脱氨酶)的持久性和功能可能被针对表达所述病毒或细菌来源的致死基因的细胞的不想要的免疫应答损害。形成icasp9m的组分的fkbp和促细胞凋亡分子是人源分子,因此不太可能诱导免疫应答。尽管fkbp和胱天蛋白酶-9之间的接头以及fkbp结构域中的单点突变引入了新的氨基酸序列,但所述序列并未被ifas转导的t细胞的猕猴接受者免疫识别。另外,由于icasp9m的组分是人源分子,因此与病毒来源的蛋白质(例如hsv-tk)不同,对接合序列具有特异性的记忆t细胞应当不存在于接受者中,由此降低免疫应答介导的消除icasp9m转导的t细胞的风险。使用诱导型fas或fas相关死亡结构域蛋白质(fadd)的死亡效应物结构域(ded)的先前研究显示,大约10%的经转导细胞对破坏性基因的活化无应答。如这里呈现的实验中所观察到的,对cid无应答性的可能解释是转基因的低表达。在cid施用之后存活的我们研究中的icasp9m转导的t细胞和他人研究中的ifas转导的t细胞具有低水平的转基因表达。为了克服感知到的逆转录病毒“位置效应”,通过用鸡β-珠蛋白染色质绝缘子(insulator)侧接逆转录病毒整合体,实现转基因的均一表达水平的增加。添加染色质绝缘子显著增加了转导的293t细胞中表达的均一性,但在转导的原代t细胞中没有显著影响。选择具有高表达水平的t细胞使对二聚化剂的应答的可变性最小化。在10nmcid单剂量之后,消除超过99%的针对高gfp表达分选的转导的t细胞。该证实支持可使用可选标志物分离表达高水平自杀基因的细胞的假设。极少量的抗性残余细胞可引起毒性的再现,最高达2log的去除效率将显著降低这种可能性。对于临床用途,与非免疫原性可选标志物(例如截短的人ngfr、cd20或cd34(例如,代替gfp))的共表达将允许选择高表达转基因的t细胞。自杀开关(例如,icasp9m)和适合的可选标志物(例如,截短的人ngfr、cd20、cd34等及其组合)的共表达可使用内部核糖体进入位点(ires)或含有自切割序列(例如,2a)的融合蛋白质的翻译后修饰获得。相比之下,在唯一的安全担忧是转基因介导的毒性(例如,人工t细胞受体、细胞因子等或其组合)的情况下,该选择步骤可能是不必要的,这是因为icasp9m和转基因表达之间的紧密关联使得能够消除表达生物相关水平的治疗性转基因的基本上全部细胞。这通过共表达icasp9m与il-12来证实。icasp9m的活化基本上消除了任何可测量的il-12产生。“自杀开关”的转基因表达和随后活化的成功可取决于转基因的功能和活性。对cid无应答性的另一可能的解释在于高水平的细胞凋亡抑制剂可能减弱cid介导的细胞凋亡。细胞凋亡抑制剂的示例包括c-flip、bcl-2家族成员和细胞凋亡蛋白抑制剂(iap),其通常调控细胞凋亡和存活之间的平衡。例如,c-flip和bcl-2的上调使得t细胞亚群抗应答于同族靶或抗原呈递细胞的经活化诱导的细胞死亡,该t细胞亚群为注定要建立记忆库(memorypool)的。在数种t淋巴瘤中,细胞凋亡与存活之间的生理平衡被破坏,有利于细胞存活。自杀基因应当去除基本上全部转导的t细胞,包括记忆细胞和恶性地转化的细胞。因此,在存在增加水平的抗细胞凋亡分子的情况下,所选的诱导型自杀基因应该保留其相当大部分(如果不是基本上全部)的活性。ifas(或ifadd)在细胞凋亡信号传导途径中的顶端位置可使其特别容易受到细胞凋亡抑制剂的影响,因此使得这些分子不太适合作为细胞凋亡安全开关的关键组分。胱天蛋白酶3或7似乎非常适合作为末端效应分子;然而,两者都不能在原代人t细胞中以功能水平表达。因此,选择胱天蛋白酶-9作为自杀基因,这是因为capsase-9在细胞凋亡途径中足够晚地起作用,以致其避开了c-flip和抗细胞凋亡bcl-2家族成员的抑制作用,并且胱天蛋白酶-9还可以功能水平稳定表达。尽管x连锁的细胞凋亡抑制剂(xiap)理论上可降低自发性胱天蛋白酶-9活化,但ap20187(或ap1903)对fkbpv36的高亲和力可使这种非共价缔合的xiap移位。与ifas相反,icasp9m在过表达抗细胞凋亡分子(包括bcl-xl)的转化t细胞系中保持功能。本文呈现了专门设计用于由人t细胞从致癌逆转录病毒载体表达的诱导型安全开关。icasp9m可被ap1903(或类似物)活化,ap1903是二聚化的小化学诱导物,其已被证明在最佳去除作用所需剂量安全,且与更昔洛韦(ganciclovir)或利妥昔单抗(rituximab)不同,在体内没有其他生物学作用。因此,该自杀基因在用于过继性转移的t细胞中的表达可增加安全性并且还可拓宽临床应用的范围。实施例2:使用icasp9自杀基因来改善在单倍体相同的干细胞移植之后同种异体耗竭(allodepleted)t细胞的安全性本实施例中呈现了表达构建体和使用表达构建体来改善单倍体相同干细胞移植之后的同种异体耗竭t细胞安全性的方法。产生编码icasp9和可选标志物(截短的cd19)的逆转录病毒载体作为用于供体t细胞的安全开关。即使在同种异体耗竭(使用抗cd25免疫毒素)之后,供体t细胞也可被有效地转导、扩增,并随后通过cd19免疫磁性选择富集到>90%的纯度。工程化细胞保留了抗病毒特异性和功能性,并且含有具有调控表型和功能的亚类。用小分子二聚化剂活化icasp9快速产生>90%的细胞凋亡。尽管转基因表达在静息t细胞中下调,但icasp9仍然是有效的自杀基因,因为表达在活化的(同种异体反应性)t细胞中快速上调。材料和方法同种异体耗竭的t细胞的产生如先前所呈现的,从健康志愿者产生同种异体耗竭的细胞。简单地说,将来自健康供体的外周血单核细胞(pbmc)与受辐照的接受者爱泼斯坦巴尔病毒(ebv)转化的成淋巴细胞样细胞系(lcl)以40:1的应答物对刺激物比率在无血清培养基(aimv;invitrogen,carlsbad,ca)中共培养。在72小时之后,通过在rft5-smpt-dga免疫毒素中过夜孵育,从共培养物中耗竭表达cd25的活化t细胞。如果残余的cd3+cd25+群体<1%并且通过3h-胸苷并入得到的残余增殖<10%,则认为同种异体耗竭是充分的。质粒和逆转录病毒sfg.icasp9.2a.cd19由诱导型胱天蛋白酶-9(icasp9)组成,该诱导型胱天蛋白酶-9通过可切割的2a样序列连接到截短的人cd19。icasp9由具有f36v突变的人fk506结合蛋白质(fkbp12;genbankah002818)组成,该人fk506结合蛋白质通过ser-gly-gly-gly-ser接头连接到人胱天蛋白酶-9(casp9;genbanknm001229)。f36v突变增加fkbp12与合成的同二聚化剂ap20187或ap1903的结合亲和力。由于胱天蛋白酶募集结构域(card)的生理功能已被fkbp12替代,则该结构域已从人胱天蛋白酶-9序列中缺失,并且其去除增加了转基因表达和功能。2a样序列编码来自明脉扁刺蛾β四体昆虫病毒的20个氨基酸的肽,该肽介导甘氨酸和末端脯氨酸残基之间>99%的切割,产生icasp9的c端中的19个额外氨基酸和cd19的n端中的一个额外脯氨酸残基。cd19由在氨基酸333处截短的全长cd19(genbanknm001770)(tdptrrf)组成,这将胞质内结构域从242个氨基酸缩短到19个氨基酸,并且去除了作为用于磷酸化的潜在位点的所有保守酪氨酸残基。通过用sfg.icasp9.2a.cd19瞬时转染phoenixeco细胞系(atcc产品编号sd3444;atcc,manassas,va)制成产生长臂猿(gibbonape)白血病病毒(gal-v)假型逆转录病毒的稳定pg13克隆。这产生了eco-假型逆转录病毒。将pg13包装细胞系(atcc)用eco-假型逆转录病毒转导三次以产生每个细胞含有多个sfg.icasp9.2a.cd19原病毒整合体的生产细胞系。进行单细胞克隆,并扩增产生最高滴度的pg13克隆并且将其用于载体生产。逆转录病毒转导用于t细胞活化和扩增的培养基由45%rpmi1640(hyclone,logan,ut)、45%clicks(irvinescientific,santaana,ca)和10%胎牛血清(fbs;hyclone)组成。在用逆转录病毒载体转导之前,通过固定化的抗cd3(okt3;orthobiotech,bridgewater,nj)将同种异体耗竭的细胞活化48小时。通过将供体pbmc与接受者ebv-lcl共培养以活化同种异体反应性细胞来进行选择性同种异体耗竭:活化的细胞表达cd25并随后被抗cd25免疫毒素消除。同种异体耗竭的细胞被okt3活化并且在48小时后用逆转录病毒载体转导。在转导的第4天进行免疫磁性选择;将阳性级分进一步扩增4天并冷冻保存。在小规模实验中,在37℃用okt31g/ml将非组织培养物处理的24孔板(bectondickinson,sanjose,ca)包被2到4小时。以每孔1×106个细胞添加同种异体耗竭的细胞。在24小时,添加100u/ml重组人白细胞介素-2(il-2)(proleukin;chiron,emeryville,ca)。在活化之后48小时进行逆转录病毒转导。用3.5μg/cm2重组纤连蛋白片段(ch-296;retronectin;takaramirusbio,madison,wi)包被非组织培养物处理的24孔板,并且用含有逆转录病毒载体的上清液以每孔0.5ml在37℃将各孔加样两次持续30分钟,之后将okt3活化的细胞以每孔5×105个细胞平铺在补充有100u/mlil-2的含逆转录病毒载体的新鲜上清液和t细胞培养基(3:1比率)中。在2到3天之后收获细胞并将其在存在50u/mlil-2的情况下扩增。基因修饰的同种异体耗竭细胞的按比例放大生产用于临床应用的转导过程的按比例放大使用非组织培养物处理的t75烧瓶(nunc,rochester,ny),所述烧瓶在4℃用10mlokt3(1μg/ml)或10ml纤连蛋白(7μg/ml)包被过夜。还使用了经电晕处理以增加细胞粘附的氟化乙烯丙烯袋(2pf-0072ac,americanfluoroseal公司,gaithersburg,md)。将同种异体耗竭的细胞以1×106个细胞/ml接种于okt3包被的烧瓶中。在第二天添加100u/mlil-2。对于逆转录病毒转导,将纤维连接蛋白(retronectin)包被的烧瓶或袋用10ml含有逆转录病毒的上清液加样一次持续2到3小时。将okt3活化的t细胞以1×106个细胞/ml接种于补充有100u/mlil-2的含逆转录病毒载体的新鲜培养基和t细胞培养基(3:1比率)中。第二天早晨收获细胞并将其在组织培养物处理的t75或t175烧瓶中在补充有约50到100u/mlil-2的培养基中以约5×105个细胞/ml到8×105个细胞/ml的接种密度扩增。cd19免疫磁性选择在转导之后4天进行针对cd19的免疫磁性选择。将细胞用缀合到单克隆小鼠抗人cd19抗体(miltenyibiotech,auburn,ca)的顺磁性微珠标记,并且在小规模实验中在ms或ls柱上以及在大规模实验中在clinimacsplus自动化选择装置上进行选择。将cd19选择的细胞进一步扩增4天,并在转导后第8天冷冻保存。这些细胞被称为“基因修饰的同种异体耗竭细胞”。免疫分型和五聚体分析使用以下抗体进行流式细胞计数分析(facscalibur和cellquest软件;bectondickinson):cd3、cd4、cd8、cd19、cd25、cd27、cd28、cd45ra、cd45ro、cd56和cd62l。发现cd19-pe(clone4g7;bectondickinson)得到最佳染色并且被用于所有后续分析。使用未经转导的对照来设置用于cd19的负门。使用hla五聚体(hla-b8-rakfkqll)(proimmune,springfield,va)来检测识别来自ebv裂解抗原(bzlf1)的表位的t细胞。使用hla-a2-nlvpmvatv五聚体来检测识别来自cmv-pp65抗原的表位的t细胞。用于抗病毒应答的干扰素-elispot测定用已知方法进行用于评估对ebv、cmv和腺病毒抗原的应答的干扰素-elispot。在转导后8天将冷冻保存的基因修饰的同种异体耗竭细胞解冻并在被用作应答细胞之前在不含il-2的完全培养基中静置过夜。使用来自相同供体的冷冻保存的pbmc作为比较物。将应答细胞以每孔2×105个、1×105个、5×104个和2.5×104个细胞的连续稀释一式两份或一式三份进行平铺。将刺激细胞以每孔1×105个平铺。对于针对ebv的应答,使用以40gy辐照的供体来源的ebv-lcl作为刺激物。对于针对腺病毒的应答,使用感染ad5f35腺病毒的供体来源的活化单核细胞。简单地说,将供体pbmc平铺于24孔板中的x-vivo15(cambrex,walkersville,md)中过夜,在第二天早晨收获,用ad5f35以200的感染复数(moi)感染2小时,洗涤,以30gy辐照,并用作刺激物。对于抗cmv应答,使用以5000的moi利用编码cmvpp65转基因的ad5f35腺病毒(ad5f35-pp65)的类似方法。通过从测试孔中减去来自仅应答物孔和仅刺激物孔的sfu来计算特定斑点形成单位(specificspot-formingunit)(sfu)。对cmv的应答是ad5f35-pp65孔和ad5f35孔之间的sfu差异。ebv特异性细胞毒性用40gy辐照供体来源的ebvlcl以40:1的应答物:刺激物比率刺激基因修饰的同种异体耗竭细胞。在9天之后,以4:1的应答物:刺激物比率再刺激培养物。如所示每周进行再刺激。在两轮或三轮刺激之后,使用供体ebv-lcl作为靶细胞和供体okt3原始细胞作为自体对照,在4小时51cr释放测定中测量细胞毒性。通过添加30倍过量的冷k562细胞来抑制nk活性。用二聚化的化学诱导物ap20187诱导细胞凋亡通过在cd19免疫磁性选择后当天添加10nm终浓度的合成的小分子同二聚化剂ap20187(ariadpharmaceuticals;cambridge,ma)来评估自杀基因功能性。将细胞在24小时用膜联蛋白v和7-氨基放线菌素(7-aad)(bdpharmingen)染色并通过流式细胞术分析。认为对膜联蛋白v和7-aad两者为阴性的细胞是活的,膜联蛋白v阳性的细胞是细胞凋亡的,并且膜联蛋白v和7-aad二者都为阳性的细胞是坏死的。通过二聚化诱导的杀伤百分比针对基线存活力校正如下:杀伤百分比=100%-(ap20187处理的细胞的存活力%÷未处理细胞的存活力%)。对延长培养和再活化后转基因表达的评估将细胞维持在含有50u/mlil-2的t细胞培养基中直到转导之后22天。将一部分细胞在包被有1g/mlokt3和1μg/ml抗cd28(clonecd28.2,bdpharmingen,sanjose,ca)的24孔板上再活化48到72小时。在转导后第24天或第25天测量再活化细胞和非再活化细胞二者中的cd19表达和自杀基因功能。在一些实验中,还将细胞在转导后培养3周,并用30g辐照的同种异体pbmc以1:1的应答物:刺激物比率刺激。在共培养4天之后,用10nmap20187处理一部分细胞。在24小时通过膜联蛋白v/7-aad染色测量杀伤,并且通过对ap20187处理的细胞和未处理的细胞进行五聚体分析来评估二聚化剂对旁邻病毒特异性t细胞的作用。调控性t细胞使用流式细胞术在基因修饰的同种异体耗竭细胞中分析cd4、cd25和foxp3的表达。对于人foxp3染色,使用ebioscience(sandiego,ca)染色组与适当的大鼠igg2a同种型对照。将这些细胞用表面cd25-fitc和cd4-pe共染色。通过共培养在同种异体耗竭和基因修饰后选择的cd4+25+细胞与羧基荧光素二乙酸n-琥珀酰亚胺基酯(cfse)-标记的自体pbmc进行功能分析。通过首先使用抗cd8微珠(miltenyibiotec,auburn,ca)耗竭cd8+细胞,之后使用抗cd25微珠(miltenyibiotec,auburn,ca)进行阳性选择来进行cd4+25+选择。通过将自体pbmc以2×107个/ml在含有1.5μmcfse的磷酸盐缓冲盐水中孵育10分钟来进行cfse标记。通过添加当量体积的fbs并在37℃孵育10分钟来终止反应。在使用前之将细胞洗涤两次。用okt3500ng/ml和40g辐照的同种异体pbmc饲养细胞以5:1的pbmc:同种异体饲养细胞比率刺激cfse标记的pbmc。然后在有或没有相同数目的自体cd4+25+基因修饰的同种异体耗竭细胞的情况下培养所述细胞。在培养5天之后,通过流式细胞术分析细胞分裂;cd19被用于门控出非cfse标记的cd4+cd25+基因修饰的t细胞。统计分析使用配对的双尾学生t检验(student’sttest)来确定样品之间差异的统计显著性。所有数据均以平均值±1标准偏差表示。结果选择性地同种异体耗竭的t细胞可用icasp9有效地转导并扩增根据临床方案程序进行选择性同种异体耗竭。简单地说,共培养3/6到5/6hla错配的pbmc和成淋巴细胞样细胞系(lcl)。在共培养72小时之后施加rft5-smpt-dga免疫毒素并可靠地产生具有<10%残余增殖(平均4.5±2.8%;范围0.74%到9.1%;10次实验)且含有<1%残余cd3+cd25+细胞(平均0.23±0.20%;范围0.06%到0.73%;10次实验)的同种异体耗竭细胞,由此满足选择性同种异体耗竭的释放准则,并且用作用于后续操控的起始材料。在固定化的okt3上活化48小时的同种异体耗竭细胞可用编码sfg.icasp9.2a.cd19的gal-v假型逆转录病毒载体有效地转导。在转导之后2到4天,通过对cd19表达的facs分析所评估的转导效率为约53%±8%,小规模(24孔板)和大规模(t75烧瓶)转导的结果相当(在6次和4次实验中分别为约55±8%相对于约50%±10%)。在okt3活化后的前2天细胞数目缩小(contract)使得在转导当天仅恢复约61%±12%(约45%到80%的范围)的同种异体耗竭细胞。此后,细胞显示显著扩增,在随后的8天内平均扩增范围约94±46倍(约40到约153的范围),导致58±33倍的净扩增。小规模实验和大规模实验二者中的细胞扩增相似,在5次小规模实验中的净扩增为约45±29倍(约25到约90的范围),而在3次大规模实验中的净扩增为约79±34倍(约50到约116的范围)。δcd19使得能够在免疫磁性柱上进行经转导细胞的有效且选择性的富集自杀基因活化的效率有时取决于自杀基因本身的功能性,且有时取决于用于富集基因修饰细胞的选择系统。研究cd19作为可选标志物的用途以确定cd19选择是否能够使得选择具有足够纯度和产率的基因修饰细胞,以及选择是否对后续细胞生长具有任何有害作用。根据制造商的说明进行小规模选择;然而,确认当每1.3×107个细胞使用10lcd19微珠时,大规模选择是最佳的。在免疫磁性选择之后24小时进行facs分析,以使来自抗cd19微珠的干扰最小化。免疫磁性选择之后细胞的纯度始终大于90%:cd19+细胞的平均百分比在小规模选择中在约98.3%±0.5%(n=5)的范围,并且在大规模clinimacs选择中在约97.4%±0.9%(n=3)的范围。在校正转导效率之后,小规模选择和大规模选择的绝对产率分别为约31%±11%和约28%±6%。经转导细胞的平均恢复在小规模选择中为约54%±14%,且在大规模选择中为约72%±18%。选择过程对后续细胞扩增没有任何可辨别的有害影响。在4次实验中,cd19免疫磁性选择后3天内的平均细胞扩增为约3.5倍(对于cd19阳性级分)相对于约4.1倍(对于非选择的经转导细胞)(p=0.34)和约3.7倍(对于未经转导的细胞)(p=0.75)。基因修饰的同种异体耗竭细胞的免疫表型对最终细胞产物(已在转导之后8天冷冻保存的基因修饰的同种异体耗竭细胞)进行免疫表型分析,并发现其含有cd4细胞和cd8细胞,cd8细胞占优势,62%±11%cd8+相对于23%±8%cd4+,如下表中所示。ns=不显著,sd=标准偏差。表1大多数细胞为cd45ro+,并且具有效应记忆t细胞的表面免疫表型。记忆标志物(包括cd62l、cd27和cd28)的表达是异源的。大约24%的细胞表达cd62l,这是主要在中央记忆细胞上表达的淋巴结归巢分子。基因修饰的同种异体耗竭细胞保留的抗病毒谱(repertoire)和功能性通过干扰素-elispot、细胞毒性测定和五聚体分析来评估最终产物细胞介导抗病毒免疫的能力。冷冻保存的基因修饰的同种异体耗竭细胞被用于所有分析,因为它们代表了目前正在针对临床研究中的用途而被评价的产品。尽管与未被操控的pbmc相比,在基因修饰的同种异体耗竭细胞中存在趋向降低的抗ebv应答的趋势,但保持了对应答于供体细胞所呈递的腺病毒、cmv或ebv抗原的干扰素-γ分泌。在4对未被操控的pbmc和基因修饰的同种异体耗竭细胞(gmac)中通过elispot评估对病毒抗原的应答。腺病毒和cmv抗原分别由供体来源的活化单核细胞通过用ad5f35空载体和ad5f35-pp65载体感染而呈递。ebv抗原由供体ebv-lcl呈递。针对单独刺激物和单独应答物的孔校正斑点形成单位(sfu)的数目。四名供体中只有三名可评价cmv应答,一名血清阴性供者被排除。使用供体来源的ebv-lcl作为靶标来评估细胞毒性。已用供体来源的ebv-lcl进行2轮或3轮刺激的基因修饰的同种异体耗竭细胞可有效地裂解病毒感染的自体靶细胞。用供体ebv-lcl将基因修饰的同种异体耗竭细胞刺激2或3个周期。使用供体来源的ebv-lcl和供体okt3原始细胞作为靶标进行51cr释放测定。用30倍过量的冷k562封阻nk活性。左图显示使用完全或部分错配的供体-接受者对的5次独立实验的结果。右图显示使用无关的hla单倍体相同的供体-接受者对的3次实验的结果。误差棒指示标准偏差。在选择性同种异体耗竭期间将ebv-lcl用作抗原呈递细胞,因此可能当供体和接受者是单倍体相同时,ebv特异性t细胞可被显著耗竭。为了研究该假设,包括了使用无关的hla-单倍体相同的供体-接受者对的三次实验,并且结果显示保留了针对供体来源的ebv-lcl的细胞毒性。在两名知情供体中,在针对hla-b8阴性单倍体相同接受者的同种异体耗竭后,通过对识别hla-b8-rakfkqll(ebv裂解抗原(bzlf1)表位)的t细胞进行五聚体分析确证所述结果。未被操控的pbmc用作比较物。rak-五聚体阳性群体在基因修饰的同种异体耗竭细胞中保留,并且可在用供体来源的ebv-lcl进行数轮体外刺激后扩增。总之,这些结果指示基因修饰的同种异体耗竭细胞保留了显著的抗病毒功能性。基因修饰的同种异体耗竭细胞群体中的调控性t细胞使用流式细胞术和功能分析来确定调控性t细胞是否保留在我们的同种异体耗竭的、基因修饰的t细胞产物中。发现foxp3+cd4+25+群体。在免疫磁性分离后,在存在okt3和同种异体饲养细胞的情况下,当与cfse标记的自体pbmc共培养时,cd4+cd25+富集级分显示抑制剂功能。用cfse标记供体来源的pbmc,并用okt3和同种异体饲养细胞刺激。从基因修饰的细胞群体中免疫磁性选择cd4+cd25+细胞并将其以1:1比率添加到测试孔中。在5天之后进行流式细胞术。通过cd19表达门控出基因修饰的t细胞。添加cd4+cd25+基因修饰细胞(下排)显著减少细胞增殖。因此,即使在暴露于cd25耗竭性免疫毒素之后,同种异体耗竭的t细胞也可重新获得调控表型。通过添加二聚化的化学诱导物,有效地且快速地消除基因修饰的同种异体耗竭细胞在免疫磁性选择后的第二天,添加10nm二聚化化学诱导物ap20187以诱导细胞凋亡,所述细胞凋亡在24小时内出现。在24小时用膜联蛋白v和7-aad染色进行的facs分析显示仅约5.5%±2.5%的经ap20187处理的细胞保持活力,而约81.0%±9.0%的未处理细胞有活力。校正基线存活力之后的杀伤效率为约92.9%±3.8%。大规模的cd19选择产生以与小规模选择相似的效率被杀伤的细胞:大规模和小规模中有和没有ap20187的平均存活力以及杀伤百分比分别为约3.9%、约84.0%、约95.4%(n=3)和约6.6%、约79.3%、约91.4%(n=5)。ap20187对未经转导的细胞无毒性:有或没有ap20187的存活力分别为约86%±9%和87%±8%(n=6)。转基因的表达和功能随着培养扩大而降低,但在细胞再活化后恢复为了评估转基因表达和功能的稳定性,将细胞维持在t细胞培养基和低剂量il-2(50u/ml)中直到转导后24天。然后用okt3/抗cd28再活化一部分细胞。在48到72小时后通过流式细胞术分析cd19表达,并且通过用10nmap20187处理来评估自杀基因功能。获得转导之后第5天(即cd19选择之后第1天)和转导之后第24天的细胞,有或无48-72小时的再活化(5次实验)。在2次实验中,在okt3/acd28活化之后进行cd25选择以进一步富集活化的细胞。误差棒表示标准偏差。*指示与转导后第5天的细胞相比时p<0.05。到第24天,表面cd19表达从约98%±1%下降到约88%±4%(p<0.05),平均荧光强度(mfi)从793±128平行降低到478±107(p<0.05)(参见图13b)。类似地,自杀基因功能显著降低:用ap20187处理后的残余存活力为19.6±5.6%;校正基线存活力后的为54.8±20.9%,这等同于仅63.1±6.2%的杀伤效率。为了确定转基因表达随时间降低是归因于t细胞静息后转录降低还是经转导细胞的消除,将一部分细胞在转导后第22天用okt3和抗cd28抗体再活化。在48到72小时之后(转导后第24天或25天),okt3/acd28-再活化的细胞具有比非再活化的细胞显著更高的转基因表达。cd19表达从约88%±4%增加到约93%±4%(p<0.01),并且cd19mfi从478±107增加到643±174(p<0.01)。另外,自杀基因功能也从约63.1%±6.2%的杀伤效率显著增加到约84.6%±8.0%(p<0.01)的杀伤效率。此外,如果将细胞针对活化标志物cd25进行免疫磁性分选,则杀伤效率完全恢复:cd25阳性细胞的杀伤效率为约93%.2±1.2%,这与转导后第5天的杀伤效率(93.1±3.5%)相同。cd25阴性级分的杀伤为78.6±9.1%。值得注意的观察结果是,当使用二聚化剂来耗竭已用同种异体pbmc而非通过非特异性促有丝分裂刺激物再活化的基因修饰细胞时,回避(spare)了许多病毒特异性t细胞。如图14a和图14b中所示,在用同种异体细胞再活化4天之后,用ap20187处理回避了(并由此富集)病毒反应性亚群,如通过与hla五聚体具有反应性的t细胞的比例所测量,所述hla五聚体对来源于ebv和cmv的肽具有特异性。将基因修饰的同种异体耗竭细胞在转导后维持培养3周以允许转基因下调。用同种异体pbmc将细胞刺激4天,之后用10nmap20187处理一部分。ebv特异性t细胞和cmv特异性t细胞的频率通过以下来定量:在同种异体刺激之前、在同种异体刺激之后以及用二聚化剂处理经同种异体刺激的细胞之后进行五聚体分析。在同种异体刺激之后,病毒特异性t细胞的百分比降低。在用二聚化剂处理后,病毒特异性t细胞部分地且优先地保留。讨论本文已证实用两种不同的安全机制(选择性同种异体耗竭和自杀基因修饰)来工程化同种异体t细胞的可行性。组合起来,这些修饰可增强和/或能够实现大量具有抗病毒和抗肿瘤活性的t细胞的回加,即使在单倍体相同移植之后也是如此。本文所呈现的数据显示自杀基因icasp9有效地起作用(用二聚化剂处理之后>90%凋亡),并且随时间而发生的转基因表达的下调在t细胞活化后快速逆转,如当同种异体反应性t细胞遇到它们的靶标时会发生的。本文中所呈现的数据还显示cd19是使得能够将经转导的细胞有效且选择性地富集到>90%纯度的适合可选标志物。此外,本文所呈现的数据指示,这些操控对保持抗病毒活性的工程化t细胞的免疫能力以及具有treg活性的cd4+cd25+foxp3+群体的再生没有可辨别的作用。考虑到自杀基因的总体功能性取决于自杀基因本身和用于选择经转导细胞的标志物两者,因此转化为临床应用需要优化两种组分以及用于偶联两种基因表达的方法。目前在临床实践中两种最广泛使用的可选标志物各有缺点。新霉素磷酸转移酶(neo)编码潜在免疫原性的外来蛋白质,并且需要在选择培养基中培养7天,这不仅增加了系统的复杂性,而且还潜在地损害了病毒特异性t细胞。广泛使用的表面选择标志物lngfr最近在小鼠模型中引起了对其致癌能力和与白血病的潜在相关性的担忧,尽管其显而易见的临床安全性。此外,lngfr选择并非广泛可用,因为它几乎排他性地用于基因疗法中。已提出了许多替代的可选标志物。尽管cd34已在体外得到充分研究,但优化主要针对选择稀有造血祖细胞配制的系统所需的步骤,以及更关键的是改变体内t细胞归巢的潜力,使得cd34并非最适合用作针对自杀开关表达构建体的可选择标志物。选择cd19作为替代性可选标志物,因为临床级cd19选择容易作为用于干细胞自体移植物的b细胞耗竭的方法利用。本文所呈现的结果证实了可以以高纯度和高产率来进行cd19富集,此外,选择过程对后续细胞生长和功能性没有可辨别的作用。cd19选择的icasp9细胞中自杀基因活化的有效性与经转导以表达hsvtk基因的neo-或lngfr-选择的细胞相比非常有利。较早几代的hsvtk构建体提供了对3h-胸苷摄取的80%-90%抑制,并且显示在延长的体外培养后类似的杀伤效率降低,但仍然在临床上有效。已报道急性gvhd和慢性gvhd二者的完全消退,循环的基因修饰细胞体内降低了少到80%。这些数据支持如下假设,即体外观察到的转基因下调不太可能成为问题,这是因为负责gvhd的活化t细胞将上调自杀基因表达并因此将在体内被选择性地消除。将在临床环境中测试这种效应是否足以允许体内保留病毒特异性t细胞和白血病特异性t细胞。通过在自杀基因修饰之前组合体外选择性同种异体耗竭,可显著减少活化自杀基因机制的需要,由此将基于回加t细胞的疗法的益处最大化。已在体内复现在体外见到的高效率的icasp9介导的自杀。在scid小鼠-人异种移植模型中,在单剂量的二聚化剂之后,消除超过99%的icasp9修饰的t细胞。ap1903与ap20187具有极其密切的功能和化学等同性,且目前被提议用于临床应用,已在健康的人志愿者身上进行了安全性测试,并被证明是安全的。在以2小时静脉内输注施用的0.01mg/kg到1.0mg/kg的剂量范围,获得约10ng/ml到约1275ng/mlap1903(等同于约7nm到约892nm)的最大血浆水平。基本上没有显著的不利作用。在允许快速血浆再分布之后,体外使用的二聚化剂的浓度在体内仍然可容易实现。必须针对安全开关、可选标志物和细胞类型的每种组合确定和定义用于维持自杀基因修饰的t细胞的免疫能力的最佳培养条件,因为表型、谱系和功能性全部可能受到用于多克隆t细胞活化的刺激、用于选择经转导细胞的方法和培养持续时间影响。添加cd28共刺激和使用细胞大小的顺磁珠来产生基因修饰细胞(在cd4:cd8比率和记忆亚类标志物(包括淋巴结归巢分子cd62l和ccr7)的表达方面更接近地类似于未被操控的pbmc)可改善基因修饰的t细胞的体内功能性。cd28共刺激还可增加逆转录病毒转导和扩增的效率。然而,有趣的是,发现添加cd28共刺激对于同种异体耗竭细胞的转导没有影响,并且所展示的细胞扩增程度与其他研究中的仅抗cd3组相比更高。此外,icasp9修饰的同种异体耗竭细胞保留显著的抗病毒功能性,并且大约四分之一保留cd62l表达。还见到cd4+cd25+foxp3+调控性t细胞的再生。用作针对t细胞的活化和转导的起始材料的同种异体耗竭细胞可能对添加作为共刺激的抗cd28抗体较不敏感。耗竭cd25的pbmc/ebv-lcl共培养物含有已经以比未被操控的pbmc显著更高的水平表达cd86的t细胞和b细胞,并且它们可提供共刺激。已报道在用抗cd3活化多克隆t细胞之前耗竭cd25+调控性t细胞以增强最终t细胞产物的免疫能力。为了使体外培养和扩增对功能性能力的作用最小化,在本文所呈现的一些实验中使用相对短暂的培养时期,其中将细胞在转导后扩增总共8天,cd19选择在第4天进行。最后,按比例放大的生产被证实为使得可生产足够的细胞产物以便以最高达107个细胞/kg的剂量治疗成年患者:同种异体耗竭细胞可被活化并以每个烧瓶4×107个细胞进行转导,并且可在转导后第8天获得cd19选择的最终细胞产物的最少8倍回报,以生产每个原始烧瓶至少3×108个同种异体耗竭的基因修饰细胞。增加的培养体积容易容纳在另外的烧瓶或袋中。本文所呈现的同种异体耗竭和icasp9修饰可显著改善加回t细胞的安全性,特别是在单倍体相同干细胞同种异体移植之后。这应当进而能够实现更大的剂量递增,产生抗白血病作用的机率更高。实施例3:单倍体相同干细胞移植后用诱导型胱天蛋白酶-9自杀基因转导的同种异体耗竭t细胞的caspallo-1期临床试验本实施例呈现了使用图2中所示的替代性自杀基因策略的1期临床试验的结果。简单地说,将供体外周血单核细胞与接受者经辐照的ebv转化的成淋巴细胞样细胞(40:1)共培养72hr,用cd25免疫毒素进行同种异体耗竭,然后用携带icasp9自杀基因和可选标志物(δcd19)的逆转录病毒上清液转导;δcd19允许通过免疫磁性选择富集到>90%的纯度。本文提供了用于产生细胞疗法产品的方案的示例。源材料根据已建立的方案从移植供体获得最多达240ml(在两次收集中)的外周血。在一些情况下,取决于供体和接受者的大小,进行白细胞单采术(leukopheresis)以分离足够的t细胞。还从接受者抽取10cc-30cc血液并将其用于产生经爱泼斯坦巴尔病毒(ebv)转化的成淋巴细胞样细胞系,用作刺激细胞。在一些情况下,取决于医疗史和/或低b细胞计数的指示,使用适当的1级亲属(例如,父母、同胞或后代)的外周血单核细胞产生lcl。同种异体耗竭细胞的生成从如本文所呈现的移植供体产生同种异体耗竭细胞。将来自健康供体的外周血单核细胞(pbmc)与受辐照的接受者经爱泼斯坦巴尔病毒(ebv)转化的成淋巴细胞样细胞系(lcl)以40:1的应答物对刺激物比率在无血清培养基(aimv;invitrogen,carlsbad,ca)中共培养。在72小时之后,通过在rft5-smpt-dga免疫毒素中过夜孵育,从共培养物中耗竭表达cd25的活化t细胞。如果残余的cd3+cd25+群体<1%并且通过3h-胸苷掺入实现的残余增殖<10%,则认为同种异体耗竭是充分的。逆转录病毒产生针对icasp9-cd19构建体产生逆转录病毒生产系克隆。还产生了生产者的主细胞库。进行主细胞库的测试以排除有复制能力的逆转录病毒的产生和被支原体、hiv、hbv、hcv等感染。使生产系生长到汇合,收获上清液,将其过滤、等分并快速冷冻且储存在-80℃。依照方案对所有批次的逆转录病毒上清液进行附加测试以排除有复制能力的逆转录病毒(rcr)并发放分析证明书。同种异体耗竭细胞的转导使用纤连蛋白转导同种异体耗竭的t-淋巴细胞。用重组纤连蛋白片段ch-296(retronectintm,takarashuzo,otsu,japan)包被板或袋。通过在包被的板或袋中孵育生产者上清液来将病毒附接到纤维连接蛋白(retronectin)。然后将细胞转移到病毒包被的板或袋中。在转导之后,扩增同种异体耗竭的t细胞,依照方案每周供给两次il-2以达到足够数目的细胞。cd19免疫磁性选择在转导之后4天进行针对cd19的免疫磁性选择。将细胞用缀合到单克隆小鼠抗人cd19抗体(miltenyibiotech,auburn,ca)的顺磁性微珠标记,并在clinimacsplus自动化选择装置上进行选择。取决于临床输注所需细胞的数目,将细胞在clinimacs选择之后冷冻保存,或用il-2进一步扩增并在转导后第6天或第8天冷冻保存。冷冻按照fda对最终出厂测试的要求,取出细胞的等分试样用于测试转导效率、同一性、表型和微生物培养。在根据方案施用之前将细胞冷冻保存。研究药物rft5-smpt-dgarft5-smpt-dga是通过异双官能交联剂[n-琥珀酰亚胺基氧基羰基-α-甲基-d-(2-吡啶基硫基)甲苯](smpt)缀合到化学去糖基化蓖麻毒蛋白a链(dga)的鼠igg1抗cd25(il-2受体α链)。rft5-smpt-dga被配制成0.5mg/ml的无菌溶液。合成的同二聚化剂ap1903作用机制:通过表达嵌合蛋白质来实现ap1903诱导型细胞死亡,所述嵌合蛋白质包含人(胱天蛋白酶-9蛋白)受体的胞内部分,所述胞内部分发出细胞凋亡性细胞死亡的信号,融合到来源于人fk506结合蛋白质(fkbp)的药物结合结构域。该嵌合蛋白质在细胞内保持静息,直到施用交联fkbp结构域的ap1903,起始胱天蛋白酶信号传导和细胞凋亡。毒理学:ap1903已被fda评价为研究用新药(ind),并且已成功地完成1期临床安全性研究。当在0.01mg/kg到1.0mg/kg的剂量范围施用ap1903时,没有观察到显著的不利作用。药理学/药物代谢动力学:基于公布的pk数据,患者接受0.4mg/kg的ap1903作为2h输注,所述pk数据显示,在0.01mg/kg到1.0mg/kg的剂量范围,血浆浓度为10ng/ml-i275ng/ml,在给药后0.5hr和2hr,血浆浓度分别下降到最大值的18%和7%。人体副作用分布:志愿者1期研究期间未发生严重不良事件。每次治疗后不良事件的发生率非常低,所有不良事件的严重程度都很轻。只有一起不利事件被认为可能与ap1903有关。这是1名志愿者在1.0mg/kgap1903剂量下呈现为“面部潮红”的血管舒张发作。该事件发生在输注开始之后3分钟并且在32分钟持续时间之后消除。在研究期间报告的所有其他不良事件均被研究者认为是与研究药物无关的或与研究药物不可能的相关。这些事件包括胸痛、流感综合征、口臭、头痛、注射部位疼痛、血管舒张、咳嗽增加、鼻炎、皮疹、牙龈出血和瘀斑。用0.4mg/kgap1903作为2小时输注来治疗发展为1级gvhd的患者。如下建立向1级gvhd患者施用ap1903的方案。对输注同种异体耗竭的t细胞之后发展为gvhd的患者进行活检以确认诊断,并接受0.4mg/kg的ap1903作为2h输注。具有i级gvhd的患者最初没有接受其他疗法,但如果他们显示gvhd的进展,则依照机构指南施用常规的gvhd疗法。除了ap1903二聚化剂药物之外,还依照机构指南向发展为2-4级gvhd的患者施用标准的系统性免疫抑制疗法。制备和输注说明:注射用ap1903是以浓度为5mg/ml的于3ml小瓶中的2.33ml浓缩溶液(即每小瓶11.66mg)获得的。ap1903还可例如以每瓶8ml,以5mg/ml提供。在施用之前,将计算的剂量在0.9%生理盐水中稀释到100ml用于输注。使用非dehp、非环氧乙烷灭菌的输注器具和输注泵,在2小时内通过静脉内输注施用体积为100ml的注射用ap1903(0.4mg/kg)。图24中所示的icasp9自杀基因表达构建体(例如,sfg.icasp9.2a.δcd19)由经由可切割的2a样序列连接到截短的人cd19(δcd19)的诱导型胱天蛋白酶-9(icasp9)组成。icasp9包含通过ser-gly-gly-gly-ser-gly接头连接到人胱天蛋白酶-9(casp9;genbanknm00122)的具有f36v突变的人fk506结合蛋白质(fkbp12;genbankah002818)。f36v突变可增加fkbp12与合成的同二聚化剂ap20187或ap1903的结合亲和力。胱天蛋白酶募集结构域(card)已从人胱天蛋白酶-9序列中缺失,并且其生理功能已被fkbp12替代。用fkbp12替代card增加转基因表达和功能。2a样序列编码来自明脉扁刺蛾β四体昆虫病毒的18个氨基酸的肽,该肽介导甘氨酸和末端脯氨酸残基之间>99%的切割,产生icasp9的c端中的17个额外氨基酸和cd19的n端中的一个额外脯氨酸残基。δcd19由在氨基酸333处截短的全长cd19(genbanknm001770)(tdptrrf)组成,这将胞质内结构域从242个氨基酸缩短到19个氨基酸,并且去除了作为用于磷酸化的可能位点的所有保守酪氨酸残基。体内研究三名患者在单倍体cd34+干细胞移植(sct)之后以约1×106个细胞/kg到约3×106个细胞/kg的剂量水平接受icasp9+t细胞。表2:患者的特征和临床结局。早在输注之后第7天即通过流式细胞术(cd3+δcd19+)或qpcr在体内检测输注的t细胞,最大扩增倍数为170±5(输注之后第29±9天),如图27、图28和图29中所图释说明的。两名患者发展为i/ii级agvhd(参见图31-32)并且在输注的30分钟内,ap1903施用引起cd3+δcd19+细胞的>90%消融(参见图30、图33和图34),在24小时内对数进一步减小,并在24hr内皮肤和肝agvhd消退,显示icasp9转基因在体内有功能。对于患者2,观察到治疗后24小时内皮疹消失。表3:gvhd患者(剂量水平1)患者sct到gvhd(天)t细胞到gvhd(天)gvhd(等级/部位)177142(肝、皮肤)212445/132(皮肤)体外实验确认了该数据。此外,残余的同种异体耗竭t细胞能够扩增并且对病毒(cmv)和真菌(烟曲霉(aspergillusfumigatus))(ifn-γ产生)具有反应性。这些体内研究发现,单剂量的二聚化剂药物可减少或消除引起gvhd的t细胞亚群,但可回避病毒特异性ctl,所述特异性ctl然后可被再扩增。免疫重建取决于患者细胞和试剂的可用性,免疫重建研究(免疫分型、t和b细胞功能)可在移植后以连续间隔获得。将分析测量免疫重建的数个参数,所述免疫重建由i胱天蛋白酶转导的同种异体耗竭t细胞产生。分析包括总淋巴细胞计数、t细胞和cd19b细胞数目的重复测量,以及t细胞亚类(cd3、cd4、cd8、cd16、cd19、cd27、cd28、cd44、cd62l、ccr7、cd56、cd45ra、cd45ro、α/β和γ/δt细胞受体)的facs分析。取决于患者t细胞的可用性,还分析了t调控性细胞标志物,例如cd41、cd251和foxp3。在可能时,在输注之后4小时,每周一次持续1个月,每月一次×9个月,然后以1年和2年,获取大约10-60ml患者血液。取血量取决于接受者的大小,并且在任何一次抽血时总计不超过1-2cc/kg(允许取血用于临床护理和研究评价)。转导的同种异体耗竭t细胞的持久性和安全性还对外周血样品进行了以下分析以监测经转导的t细胞在研究日程表中所指示的时间点处的功能、持久性和安全性:通过流式细胞术分析表型以检测转基因细胞的存在。通过pcr进行rcr测试。用于检测逆转录病毒整合体的定量实时pcr。在研究前,在3个月、6个月和12个月,然后每年一次持续总共15年,通过pcr进行rcr检测。根据fda的要求,将组织、细胞和血清样品存档以用于rcr的未来研究。统计分析和停止规则。mtd被定义为在至多25%的合格病例中引起iii/iv级急性gvhd的剂量。所述确定基于修改的连续再评估方法(crm),其中使用具有大小为2的组群(cohort)的逻辑斯谛模型(logisticmodel)。评价了三个剂量组,即1×106、3×106、1×107,其中毒性的先验概率分别被估计为10%、15%和30%。所提出的crm设计采用通过以下方式对原始crm修改:在每个组群中累计超过一名受试者,将剂量递增限制为不超过一个剂量水平,并且以显示对于未经转导的细胞安全的最低剂量水平开始患者招募。最低剂量组群中的毒性结局被用于更新剂量-毒性曲线。将下一患者组群分配至最接近25%的目标概率的毒性相关概率的剂量水平。该过程持续直到至少有10名患者已被累计到该剂量递增研究中。取决于患者的可用性,至多18名患者可被招募到1期临床试验中或直到6名患者已被以当前的mtd治疗为止。最终mtd将是概率最接近这些终止点处的靶毒性比率的剂量。进行模拟以确定所提出的设计的操作特征,并将其与标准的3+3剂量递增设计进行比较。所提出的设计基于将适当剂量水平宣布为mtd的更高可能性而实现对mtd的更好估计,提供以更低且可能无效的剂量水平累计的更小患者数目,并且维持试验所需的更低的平均患者总数。预计在本文所提出的剂量范围具有浅的剂量-毒性曲线,因此可在不包含患者安全性的情况下加速剂量递增。所进行的模拟指示,当与标准设计比较时,修改的crm设计不会产生更大平均数的总毒性(总毒性分别等于1.9和2.1)。在初始输注同种异体耗竭的t细胞之后45天内发生的iii/iv级gvhd将被计入crm计算中,以确定用于后续组群的推荐剂量。在研究期间进行患者毒性结果的实时监测,以实施对剂量-毒性曲线的估计,并使用预先指定的剂量水平之一确定用于下一患者组群的剂量水平。治疗限制性毒性将包括:与输注有关的4级反应,输注tc-t之后30天内发生移植失败(被定义为在不同日的连续三次测量的anc随后下降到<500/mm3,对持续至少14天的生长因子疗法无应答)输注之后30天内发生4级非血液学和非感染性不良事件输注tc-t之后45天发生3-4级急性gvhd输注之后30天内发生与治疗有关的死亡使用描述性统计数据连同其他安全性和毒性指标来总结gvhd比率。同样,将计算描述性统计以总结由于大于1级gvhd而接受ap1903的患者中的临床和生物学反应。将分析测量由i胱天蛋白酶转导的同种异体耗竭t细胞产生的免疫重建的数个参数。这些包括总淋巴细胞计数、t细胞和cd19b细胞数目的重复测量,以及t细胞亚类(cd3、cd4、cds、cd16、cd19、cd27、cd44、cd62l、ccr7、cd56、cd45ra、cd45ro、α/β和γ/δt细胞受体)的facs分析。如果残留足够的t细胞用于分析,则还将分析t调控性细胞标志物,例如cd4/cd25/foxp3。如上文所呈现的,将在输注前和输注后的多个时间点测量每个受试者。将呈现全部患者组和剂量组以及测量的时间中的这些参数的描述性总结。将生成代表患者内随时间的测量的生长曲线以显现免疫重建的一般模式。还将在每个时间点总结icasp9阳性细胞的比例。将使用配对t检验或威尔科克森符号秩检验(wilcoxonsigned-rankstest),实施对这些终点与输注前相比的随时间的变化的配对比较。将使用随机系数模型对每个重复测量的免疫重建参数进行纵向分析。纵向分析允许构建每个患者免疫重建的模型模式,同时允许改变患者内的截距和斜率。还将使用作为模型中的独立变量的剂量水平以说明由患者接受的不同剂量水平。使用本文所呈现的模型,将有可能测试免疫功能随时间是否有显著改善,以及基于斜率和其标准误差的估计值来估计这些改善的幅度。还将对跨不同剂量水平的ctl的免疫重建率的差异的任何指征进行评价。具有恒等联连(identitylink)的正态分布将用于这些模型中,并使用sasmixed程序实施。将评估免疫重建参数的正态性假设,并且如果需要,可进行转换(例如对数、平方根)以实现正态性。可采用类似于上文所呈现的策略来评估t细胞存活、扩增和持久性的动力学。将确定绝对t细胞数目与标志物基因阳性细胞数目的比率并且随着时间纵向地建模。对斜率的正估计将指示t细胞对免疫恢复的作用增加。将通过使用纵向模型基于离体刺激病毒特异性ctl分析释放ifnγ的t细胞的数量来评价icasp9t细胞的病毒特异性免疫。将生成单独的模型用于分析ebv、cmv和腺病毒的免疫评价。最后,将使用卡普兰-梅尔乘积极限(product-limit)法概述整个患者组群中的总存活和无病存活。可由卡普兰-梅尔曲线估计在移植后100天和1年内存活且无疾病的患者的比例。总之,在单倍体cd34+sct之后回加icasp9+同种异体耗竭的t细胞可实现功能性供体淋巴细胞的体内显著扩增和同种异体反应性t细胞的快速清除与agvhd的消除。实施例4:体内t细胞同种异体耗竭实施例1-3中所提供的方案也可被修改以提供体内t细胞同种异体耗竭。为了将所述方法延伸到可能受益于免疫重建而没有急性gvhd的更大组的受试者,可通过提供体内t细胞耗竭方法来简化所述方案。在如本文所讨论的预治疗的同种异体耗竭方法中,首先从接受者制备ebv转化的成淋巴细胞样细胞系,所述细胞系然后用作同种异体抗原呈递细胞。该程序可能需要最长达8周的时间,并可能在广泛预治疗的恶性肿瘤患者中失败,特别是如果他们接受了利妥昔单抗作为其初始疗法的一部分。随后,将供体t细胞与接受者ebv-lcl共培养,然后用cd25-蓖麻毒蛋白缀合的单克隆抗体处理同种异体反应性t细胞(其表达活化抗原cd25)。对于每个受试者来说,该程序可能需要许多额外的实验室工作日。该过程可通过使用体内同种异体耗竭方法来简化,所述方法基于所观察到的二聚化剂药物对同种异体反应性t细胞的快速体内消耗以及未受刺激但有病毒/真菌反应性的t细胞的回避。如果发展为i级或更大的急性gvhd,则施用单剂量的二聚化剂药物,例如以0.4mg/kgap1903的剂量作为2小时静脉内输注。如果急性gvhd持久存在,则可以48小时间隔施用最多达3次额外剂量的二聚化剂药物。在患有ii级或更大的急性gvhd的患者中,这些额外剂量的二聚化剂药物可与类固醇组合。对于由于对二聚化剂的iii级或iv级反应而不能接受额外剂量的二聚化剂化合物的持久性gvhd患者来说,可在0剂量或1剂量的二聚化剂化合物之后单独用类固醇治疗所述患者。治疗性t细胞的产生依照获取同意书(procurementconsent),从移植供体获得最多达240ml(在两次收集中)的外周血。如果需要,使用白细胞单采术来获得足够的t细胞;(在干细胞动员之前或在最后一剂g-csf之后7天)。还可收集额外10-30ml血液以测试传染性疾病,例如肝炎和hiv。在第0天使用抗人cd3抗体(例如来自orthotech或miltenyi)活化外周血单核细胞,并且在第2天在存在重组人白细胞介素-2(rhil-2)的情况下扩增。在用重组纤连蛋白片段ch-296(retronectintm,takarashuzo,otsu,japan)包被的培养瓶或板上通过i胱天蛋白酶-9逆转录病毒载体转导cd3抗体活化的t细胞。通过在纤维连接蛋白(retronectin)包被的板或烧瓶中孵育生产者上清液来将病毒附接到纤维连接蛋白(retronectin)。然后将细胞转移到病毒包被的组织培养装置。在转导之后,依照方案通过每周供给两次rhil-2来扩增t细胞,以达到足够数目的细胞。为了确保大部分输注的t细胞携带自杀基因,可使用可选标志物(截短的人cd19(δcd19))和商业选择装置将转导的细胞选择为>90%的纯度。可在转导之后4天进行针对cd19的免疫磁性选择。将细胞用缀合到单克隆小鼠抗人cd19抗体(miltenyibiotech,auburn,ca)的顺磁性微珠标记,并在clinimacsplus自动化选择装置上进行选择。取决于临床输注所需细胞的数目,可将细胞在clinimacs选择之后冷冻保存,或用il-2进一步扩增,并且一旦已扩增出足够的细胞(从产物起始直到第14天)即冷冻保存。可按照fda对最终出厂测试的要求,取出细胞的等分试样用于测试转导效率、同一性、表型、自主生长和微生物检查。在施用之前将细胞冷冻保存。t细胞的施用在例如干细胞移植后的30天到120天向患者施用转导的t细胞。将冷冻保存的t细胞解冻并通过导管管线以生理盐水输注。对于儿童来说,按重量给予前驱用药。细胞的剂量可在以下范围:例如约1×104个细胞/kg到1×108个细胞/kg,例如约1×105个细胞/kg到1×107个细胞/kg、约1×106个细胞/kg到5×106个细胞/kg、约1×104个细胞/kg到5×106个细胞/kg,例如约1×104个细胞/kg、约1×105个细胞/kg、约2×105个细胞/kg、约3×105个细胞/kg、约5×105个细胞/kg、6×105个细胞/kg、约7×105个细胞/kg、约8×105个细胞/kg、约9×105个细胞/kg、约1×106个细胞/kg、约2×106个细胞/kg、约3×106个细胞/kg、约4×106个细胞/kg或约5×106个细胞/kg。gvhd的治疗用0.4mg/kgap1903作为2小时输注治疗发展为≥1级的急性gvhd的患者。注射用ap1903可例如以浓度为5mg/ml的于3ml小瓶中的2.33ml浓缩溶液(即每小瓶11.66mg)提供。ap1903还可以不同大小的小瓶提供,例如,可以8ml、5mg/ml提供。在施用之前,将计算的剂量在0.9%生理盐水中稀释到100ml用于输注。可使用非dehp、非环氧乙烷灭菌输注器具和输注泵,在2小时内通过静脉内输注施用体积为100ml的注射用ap1903(0.4mg/kg)。表4:样品处理时间表之后可进行用于如例如本文实施例1-3中所提供的临床疗法和评估的其他方法。实施例5:使用icasp9自杀基因来改善间充质基质细胞疗法的安全性迄今为止,已将间充质基质细胞(msc)输注到数百名患者中,报道了最小的有害副作用。由于从msc被用于治疗疾病起随访有限且时间相对较短,因此长期副作用是未知的。数种动物模型已显示存在副作用的可能性,因此期望允许控制治疗上使用的msc的生长和存活的系统。本文所呈现的诱导型胱天蛋白酶-9自杀开关表达载体构建体作为体内和体外消除msc的方法被研究。材料和方法msc分离从健康供体分离msc。简单地说,用rpmi1640(hyclone,logan,ut)洗涤输注后丢弃的健康供体骨髓收集袋和过滤器,并将其平铺在组织培养瓶上具有10%胎牛血清(fbs)、2mm丙氨酰-谷氨酰胺(glutamax,invitrogen)、100单位/ml青霉素和100μg/ml链霉素(invitrogen)的dmem(invitrogen,carlsbad,ca)中。在48小时之后,丢弃上清液并将细胞在具有16.5%fbs、2mm丙氨酰-谷氨酰胺、100单位/ml青霉素和100μg/ml链霉素的完全培养基(ccm):α-mem(invitrogen)中培养。使细胞生长到小于80%汇合并在适当时以更低的密度重新平铺。免疫分型使用藻红蛋白(pe)、异硫氰酸荧光素(fitc)、多甲藻素叶绿素蛋白质(percp)或别藻蓝蛋白(apc)缀合的cd14、cd34、cd45、cd73、cd90、cd105和cd133单克隆抗体将msc染色。除非指明,否则所有抗体均来自bectondickinson-pharmingen(sandiego,ca)。在每次实验中包括用适当的同种型匹配抗体标记的对照样品。通过装配有用于4个荧光信号的滤波器组的荧光活化细胞分选facscan(bectondickinson)分析细胞。体外分化研究脂肪细胞分化。将msc(7.5×104个细胞)平铺于6孔板的各孔中的nhadipodiff培养基(miltenyibiotech,auburn,ca)中。每三天更换培养基,持续21天。将细胞用磷酸盐缓冲盐水(pbs)中的4%甲醛固定之后,用油红o溶液(通过将0.5%w/v油红o在3:2比率的异丙醇与水中稀释获得)染色。成骨分化。将msc(4.5×104个细胞)平铺于6孔板的nhosteodiff培养基(miltenyibiotech)中。每三天更换培养基,持续10天。在将细胞用冷甲醇固定之后,依照制造商的说明,使用sigmafastbcip/nbt底物(sigma-aldrich,st.louis,mo)针对碱性磷酸酶活性进行染色。成软骨细胞分化。通过在15ml或1.5ml聚丙烯锥形管中离心获得含有2.5×105到5×105个细胞的msc沉淀,并在nhchondrodiff培养基(miltenyibiotech)中培养。每三天更换培养基,持续共24天。将细胞团在pbs中的4%福尔马林中固定,并加工用于常规石蜡切片。将切片用阿辛蓝(alcianblue)染色,或在用胃蛋白酶(thermoscientific,fremont,ca)进行抗原恢复之后,使用针对ii型胶原(小鼠抗胶原ii型单克隆抗体mab8887,millipore,billerica,ma)的间接免疫荧光染色。icasp9-δcd19逆转录病毒的产生和msc的转导sfg.icasp9.2a.δcd19(icasp-δcd19)逆转录病毒由通过可切割的2a样序列连接到截短的人cd19(δcd19)的icasp9组成。如上所述,icasp9是具有f36v突变的人fk506-结合蛋白质(fkbp12),所述f36v突变增加了所述蛋白质与合成的同二聚化剂(ap20187或ap1903)的结合亲和力,所述合成的同二聚化剂通过ser-gly-gly-gly-ser-gly接头连接到人胱天蛋白酶-9,人胱天蛋白酶-9的募集结构域(card)已缺失,其功能被fkbp12替代。2a样序列编码来自明脉扁刺蛾β四体昆虫病毒的20个氨基酸的肽,该肽介导甘氨酸和末端脯氨酸残基之间超过99%的切割,以确保翻译后icasp9和δcd19的分离。δcd19由在氨基酸333处截短的人cd19组成,其去除了作为磷酸化的可能位点的所有保守胞质内酪氨酸残基。通过用产生eco-假型逆转录病毒的sfg.icasp9.2a.δcd19瞬时转染phoenixeco细胞系(atcc产品编号sd3444;atcc,manassas,va)制成产生长臂猿白血病病毒(gal-v)假型逆转录病毒的稳定pg13克隆。将pg13包装细胞系(atcc)用eco-假型逆转录病毒转导3次以产生生产细胞系,该生产细胞系的每个细胞含有多个sfg.icasp9.2a.δcd19原病毒整合体。进行单细胞克隆,并扩增产生最高滴度的pg13克隆并且将其用于载体生产。通过在具有10%fbs、2mm丙氨酰-谷氨酰胺、100单位/ml青霉素和100μg/ml链霉素的imdm(invitrogen)中培养生产细胞系获得逆转录病毒上清液。在初始培养之后48小时和72小时收集含有逆转录病毒的上清液。对于转导,将大约2×104个msc/cm2平铺于6孔板、t75或t175烧瓶中的cm中。在24小时之后,将培养基用稀释10倍的病毒上清液连同聚凝胺(最终浓度为5μg/ml)一起替代,并将细胞在37℃于5%co2中孵育48小时,此后将细胞维持在完整培养基中。细胞富集对于用于体外实验的诱导型icasp9-δcd19阳性msc选择,依照制造商的说明,使用与抗cd19(克隆4g7)缀合的磁珠(miltenyibiotec),使逆转录病毒转导的msc富集cd19阳性细胞。用与pe或apc缀合的cd19(克隆sj25c1)抗体将细胞样品染色以评估细胞级分的纯度。体外细胞凋亡研究未分化的msc。将二聚化化学诱导物(cid)(ap20187;ariadpharmaceuticals,cambridge,ma)以50nm添加到完全培养基中的icasp9转导的msc培养物中。在细胞收获并用膜联蛋白v结合缓冲液(bdbiosciences,sandiego,ca)中的膜联蛋白v-pe和7-aad染色之后,在24小时后通过facs分析评价细胞凋亡。在不暴露于cid的情况下培养维持对照(icasp9转导的msc)。分化的msc。如上文所呈现的分化经转导的msc。在分化期结束时,将cid以50nm添加至分化培养基中。如上文所呈现的,针对所研究的组织对细胞进行适当地染色,并使用对比染色剂(亚甲天蓝(methyleneazur)或亚甲蓝)评价细胞核和细胞质的形态。平行地,依据制造商的说明(原位细胞死亡检测试剂盒,rochediagnostics,mannheim,germany),将组织加工用于末端脱氧核苷酰转移酶dutp缺口末端标记(tunel)测定。对于每个时间点,以40×的最终放大倍数拍摄四个随机视野,并利用imagej软件1.43o版(nih,bethesda,md)分析图像。每单位表面积(mm2)的细胞核(dapi阳性)的数目来计算细胞密度计算。以具有阳性tunel信号(fitc阳性)的细胞核的数目与细胞核的总数的比率确定凋亡细胞的百分比。在没有cid的情况下培养维持对照。鼠模型中的体内杀伤研究所有的小鼠实验均根据贝勒医学院畜牧业指南进行。为了评估修饰的msc在体内的持久性,将scid小鼠模型与体内成像系统结合使用。用编码单独或连同icasp9-δcd19基因一起的增强型绿色荧光蛋白质-萤火虫荧光素酶(egfp-ffluc)基因的逆转录病毒转导msc。通过使用moflo流式细胞仪(beckmancoulter,fullerton,ca)的荧光活化细胞分选对细胞进行egfp阳性分选。还用pe缀合的抗cd19将经双重转导的细胞染色并进行pe阳性分选。对scid小鼠(8-10周龄)在相对侧皮下注射5×105个msc,有和无icasp9-δcd19。小鼠接受一周后开始间隔24小时的50μgcid的两次腹膜内注射。对于表达egfp-ffluc的msc的体内成像,对小鼠腹膜内注射d-荧光素(150mg/kg)并使用xenogen-ivis成像系统进行分析。通过在msc植入部位上自动定义目标区域(roi)来计算每个时间点的总发光(与总标记的沉积msc成比例的测量值)。这些roi包括发光信号高于背景至少5%的所有区域。对每个roi的总光子计数进行积分并计算平均值。将结果归一化,使得时间零将对应于100%的信号。在第二组实验中,在右侧皮下注射2.5×106个经egfp-ffluc标记的msc和2.5×106个经egfp-ffluc标记的icasp9-δcd19转导的msc的混合物,并且开始7天后小鼠接受间隔24小时的50μgcid的两次腹膜内注射。在注射cid之后的数个时间点,使用组织发光收获msc的皮下小团以鉴别和收集整个人样本并使小鼠组织污染最小化。然后使用dnamini(qiagen,valencia,ca)分离基因组dna。将100ngdna的等分试样用于定量pcr(qpcr),以使用特异性引物和探针(对于egfp-ffluc构建体:正向引物5'–tccgccctgagcaaagac–3',反向5'–acgaactccagcaggaccat–3',探针5'fam,6-羧基荧光素–acgagaagcgcgatc–3'mgbnfq,小沟结合非荧光猝灭剂;icasp9-δcd19:正向5'–ctggaatctggcggtggat–3',反向5'–caaactctcaagagcaccgacat–3',探针5'fam–cggagtcgacggatt–3'mgbnfq)来确定每个转基因的拷贝数。使用已知数目的含有每个转基因单拷贝的质粒来建立标准曲线。已确定,从经单个egfp-ffluc-转导或经双重的egfp-ffluc-和icasp9-转导的msc的“纯”群体分离的大约100ngdna具有相似数目的egfp-ffluc基因拷贝(大约3.0×104个),以及分别零个和1.7×103个icasp9-δcd19基因拷贝。未经转导的人细胞和小鼠组织具有100ng基因组dna中的任一基因的零个拷贝。由于从任一msc群体(icasp9阴性或icasp9阳性)分离的相同量的dna上egfp基因的拷贝数相同,因此从任何细胞混合物分离的dna中该基因的拷贝数将与egfp-ffluc阳性细胞(icasp9阳性msc加icasp9阴性msc)的总数成比例。此外,由于icasp9阴性组织对icasp9拷贝数没有贡献,因此任何dna样品中icasp9基因的拷贝数将与icasp9阳性细胞的总数成比例。因此,如果g是gfp阳性细胞和icasp9阴性细胞的总数并且c是gfp阳性细胞和icasp9阳性细胞的总数,则对于任何dna样品,negfp=g·(c+g)且nicasp9=k·c,其中n表示基因拷贝数,且g和k分别是与egfp基因和icasp9基因的拷贝数和细胞数有关的常数。因此nicasp9/negfp=(k/g)·[c/(c+g)],即icasp9拷贝数与egfp拷贝数之间的比率与经双重转导的(icasp9阳性)细胞在所有的egfp阳性细胞中的分数成比例。尽管nicasp9和negfp的绝对值将随着每个msc外植体中受鼠细胞污染的增加而降低,但对于每个时间点,无论所包含的鼠组织的量如何,该比率都将是恒定的,因为两种类型的人细胞都是物理混合的。假设两个群体中自发性细胞凋亡的相似率(如通过体外培养所记录的),任何时间点的nicasp9/negfp和零时的nicasp9/negfp之间的商将表示暴露于cid之后存活的icasp9阳性细胞的百分比。所有拷贝数的确定均以一式三份进行。统计分析使用配对的双尾学生t检验来确定样品之间的差异的统计显著性。所有数值数据均以平均值±1标准偏差表示。结果msc容易被以icasp9-δcd19转导并维持它们的基本表型对来自3名健康供体的msc的流式细胞计数分析显示它们对于cd73、cd90和cd105均为阳性,并且对于造血标志物(cd45、cd14、cd133和cd34)为阴性。从骨髓分离的单核粘附级分对于cd73、cd90和cd105均为阳性,且对造血标志物为阴性。分离的msc分化成脂肪细胞、成骨细胞和成软骨细胞的可能性在特定测定中被确认,证实这些细胞是真正的msc。用编码胱天蛋白酶-9的可诱导形式的icasp9-δcd19逆转录病毒载体转导早期传代msc。在最佳的单一转导条件下,47±6%的细胞表达cd19,所述cd19的截短形式与icasp9顺式转录,用作用于成功转导的替代物并允许选择转导的细胞。cd19阳性细胞的百分比在培养物中稳定超过两周,表明构建体对msc没有有害或生长有利的作用。cd19阳性细胞(用icasp9成功转导的替代物)的百分比保持恒定超过2周。为了进一步解决构建体的稳定性,培养维持通过荧光活化细胞分选仪(facs)纯化的icasp9阳性细胞群体:在6周内未观察到cd19阳性细胞的百分比的显著差异(基线时的96.5±1.1%相对于43天之后为97.4±0.8%,p=0.46)。icasp9-cd19阳性细胞的表型与未经转导的细胞的表型原本基本相同,实际上所有细胞都对cd73、cd90和cd105为阳性,并且对造血标志物为阴性,确认msc的遗传操控不改变它们的基本特征。icasp9-δcd19转导的msc在体外暴露于cid之后经历选择性细胞凋亡促细胞凋亡基因产物icasp9可被二聚化的小化学诱导物(cid)ap20187活化,ap20187是结合存在于icasp9产物中的fk506结合结构域的他克莫司(tacrolimus)类似物。未经转导的msc具有在培养中大约18%(±7%)的自发细胞凋亡率,在基线的icasp9阳性细胞也如此(15±6%,p=0.47)。在用icasp9-δcd19转导之后将cid(50nm)添加到msc培养物中导致24hr内超过90%的icasp9阳性细胞的细胞凋亡性死亡(93±1%,p<0.0001),而icasp9阴性细胞保留与未经转导的对照相似的细胞凋亡指数(20±7%,p=0.99和p=0.69,分别相对于有或无cid的未经未经转导的对照)(参见图17a和图70b)。在用icasp9转导msc之后,将二聚化化学诱导物(cid)以50nm添加到完全培养基中的培养物中。在细胞收获并用膜联蛋白v-pe和7-aad染色之后,在24小时后通过facs分析评价细胞凋亡。93%的icasp9-cd19阳性细胞(icasppos/cid)变成膜联蛋白阳性,相比之下,阴性群体(icaspneg/cid)仅19%,该比例与暴露于相同化合物的未经转导的对照msc(对照/cid,15%)和未暴露于cid的icasp9-cd19阳性细胞(icasppos/无cid,13%)相当,并且与未经转导的msc的基线细胞凋亡率(对照/无cid,16%)相似。icap9-cd19阳性细胞的磁性免疫选择可达到高纯度。在暴露于cid之后,超过95%的所选细胞变得凋亡。在单次暴露于cid之后的稍后时间点对高度纯化的icasp9阳性群体的分析显示小部分icasp9阴性细胞扩增并且icasp9阳性细胞群体仍然存在,但后者可被再暴露于cid杀伤。因此,没有检测到抵抗cid进一步杀伤的icasp9阳性群体。早在引入cid之后24小时就会出现icasp9-cd19阴性msc群体。预计到icasp9-cd19阴性msc的群体,因为实现具有100%纯度的群体是不现实的,并且因为msc在有利于其体外快速扩增的条件下培养。一部分icasp9-cd19阳性群体持久存在,如通过杀伤并不是100%有效的事实所预测的(假设例如99%纯群体的99%杀伤,则所得群体将具有49.7%的icasp9阳性细胞和50.3%的icasp9阴性细胞)。然而,存活的细胞可通过再暴露于cid而在稍后的时间点被杀伤。icasp9-δcd19转导的msc维持未修饰的msc的分化潜力并且它们的后代被暴露于cid杀伤为了确定cid是否可选择性地杀伤icasp9阳性msc的分化后代,使用针对cd19的免疫磁性选择来增加修饰群体的纯度(在一轮选择之后>90%)。如此选择的icasp9阳性细胞能够在体内分化成所有研究的结缔组织谱系(参见图19a-19q)。针对cd19(因此icasp9)表达对人msc进行免疫磁性选择,纯度大于91%。在特定分化培养基中培养之后,icasp9阳性细胞能够产生脂肪细胞系(a,油红和亚甲天蓝)、成骨细胞系(b,碱性磷酸酶-bcip/nbt和亚甲蓝)和成软骨细胞系(c,阿辛蓝和核红)。这些分化的组织通过暴露于50nmcid而被驱使至细胞凋亡(d-n)。注意许多细胞凋亡小体(箭头)、胞质膜起泡(小图)和细胞架构丧失(d和e);在软骨细胞结节(f-h)、脂肪形成培养物(i-k)和成骨培养物(l-n)中广泛分部的tunel阳性,这与未处理的icasp9转导对照(所示的脂肪形成条件,o-q)中所见的形成对比(f、i、l、o,dapi;g、j、m、p,tunel-fitc;h、k、n、q,覆盖图)。在暴露于50nmcid24小时之后,观察到细胞凋亡的显微证据:膜起泡、细胞皱缩和脱离,以及在整个脂肪形成培养物和成骨培养物中存在细胞凋亡小体。tunel分析显示脂肪形成培养物和成骨培养物以及软骨细胞结节(参见图19a-19q)中随时间而增加的广泛阳性。在脂肪细胞分化培养基中培养之后,icasp9阳性细胞产生脂肪细胞。在暴露于50nmcid之后,观察到渐进性细胞凋亡,如通过tunel阳性细胞的比例增加所证明的。在24小时之后,细胞密度有显著降低(从584个细胞/mm2到<14个细胞/mm2),几乎所有的凋亡细胞均已与载玻片脱离,阻碍了凋亡细胞比例的进一步可靠计算。因此,icasp9即使在msc分化之后仍保持功能,并且其活化导致分化后代的死亡。icasp9-δcd19转导的msc在体内暴露于cid之后经历选择性细胞凋亡尽管静脉内注射的msc已似乎具有短的体内存活时间,但局部注射的细胞可存活更长时间并且产生相应更严重的副作用。为了评估icasp9自杀系统在这种环境下的体内功能性,对scid小鼠皮下注射msc。用egfp-ffluc(先前所呈现的)和icasp9-δcd19基因双重转导msc。还用egfp-ffluc单一地转导msc。通过荧光活化细胞分选分离egfp阳性(和cd19阳性,如果适用的话)级分,纯度>95%。对每只动物在相对侧皮下注射icasp9阳性msc和对照msc(均为egfp-ffluc阳性)。使用xenogen-ivis成像系统评价msc的定位。在另一组实验中,在右侧皮下注射单一转导的msc和双重转导的msc的1:1混合物,并且小鼠如上所述接受cid。在不同时间点收获msc的皮下细胞团,分离基因组dna并使用qpcr来确定egfp-ffluc和icasp9-δcd19基因的拷贝数。在这些条件下,icasp9基因拷贝数与egfp基因拷贝数的比率与总人细胞中icasp9阳性细胞的分数成比例(详见上文方法)。将比率归一化,使得时间零对应于100%的icasp9阳性细胞。在皮下接种msc之后(在cid注射之前)对动物进行的系列检查显示两种细胞群体中的自发性细胞凋亡的证据(如通过总体发光信号下降到基线的约20%所证实的)。先前已在异种模型中全身性和局部性递送msc之后观察到了这种情况。发光数据显示,即使在施用cid之前,在局部递送msc之后的前96h内,人msc也大量损失,只有大约20%的细胞在一周之后存活。然而,从该时间点起,icasp9阳性msc在有二聚化剂药物下的存活和无二聚化剂药物下的存活之间存在显著差异。在msc植入之后7天,间隔24小时向动物给予50μgcid的两次注射。用icasp9转导的msc迅速被药物杀伤,如通过其发光信号消失所证实的。对icasp9为阴性的细胞不受所述药物影响。未注射所述药物的动物显示在msc植入之后最长达一个月内在两个群体中信号持久存在。为了进一步定量细胞杀伤,开发qpcr测定以测量egfp-ffluc基因和icasp9-δcd19基因的拷贝数。向小鼠皮下注射双重转导的msc和单一转导的msc的1:1混合物,并且在msc植入之后一周,如上所述施用cid。在数个时间点收集msc外植体,从样品中分离基因组dna,并且对基本上相同量的dna进行qpcr测定。在这些条件(参见方法)下,在任何时间点,icasp9-δcd19拷贝数与egfp-ffluc拷贝数的比率与存活的icasp9阳性细胞的分数成比例。观察到icasp9阳性细胞的渐进性杀伤(>99%),使得存活的icasp9阳性细胞的比例在一周之后降低到原始群体的0.7%。因此,用icasp9转导的msc可在暴露于cid之后在体内被选择性杀伤,否则会持久存在。讨论本文证实使用诱导型自杀蛋白质将人msc工程化以表达安全机制的可行性。本文所呈现的数据显示msc可容易地用与可选表面标志物cd19偶联的自杀基因icasp9转导。共转导基因的表达在msc和它们的分化后代两者中均稳定,并且不明显改变它们的表型或分化潜力。当暴露于与icasp9结合的适当的二聚化小分子化学诱导物时,这些转导的细胞可在体外和体内被杀伤。为了使基于细胞的疗法成功,移植的细胞必须在它们的收获和它们的最终体内临床应用之间的时期存活。另外,基于细胞的安全疗法还应当包括控制成功移植的细胞的不想要的生长和活性的能力。尽管已向许多患者施用msc而没有显著的副作用,但最近的报道指示,额外的保护,例如本文所呈现的安全开关,可提供对基于细胞的疗法的另外的控制方法,因为移植的msc被遗传和表观遗传修饰以增强它们的功能性以及分化成包括骨和软骨在内的谱系的潜力进一步被研究和利用。接受经基因修饰以释放生物活性蛋白质的msc的受试者可能特别受益于自杀基因所提供的附加安全性。本文所呈现的自杀系统提供了优于其他已知自杀系统的几个潜在优点。涉及核苷类似物的策略,例如将单纯疱疹病毒胸苷激酶(hsv-tk)与丙氧鸟苷(gcv)和细菌或酵母胞嘧啶脱氨酶(cd)与5-氟胞嘧啶(5-fc)组合的策略是细胞周期依赖性的,并且不可能在有丝分裂后组织中有效,该有丝分裂组织可能于msc应用于再生医学期间形成。此外,即使在增殖性组织中,有丝分裂部分也不包含所有细胞,并且移植物的绝大部分可存活并保持功能失调。在一些情况下,自杀所需的前药本身可能或者由于它们被非靶器官代谢(例如,许多细胞色素p450底物),或者由于在被靶细胞活化之后扩散到相邻组织(例如,cb1954,针对细菌硝基还原酶的底物),而具有因此被排除(例如,gcv)或可能有毒(例如,5-fc)的治疗用途。相比之下,本文所呈现的二聚化的小分子化学诱导物即使在为活化icasp9所需剂量的10倍的剂量也显示没有毒性迹象。另外,非人酶促系统,例如hsv-tk和dc,带有针对经转导的细胞的破坏性免疫应答的高风险。icasp9自杀基因和选择标志物cd19二者都是人来源的,因此应当不太可能诱导不想要的免疫应答。尽管可选标志物通过非人来源的2a样可切割肽与自杀基因的表达的关联可能造成问题,但2a样接头长20个氨基酸,并且可能免疫原性低于非人蛋白质。最后,icasp9阳性细胞中自杀基因活化的有效性与杀伤表达其他自杀系统的细胞相比有利,在单剂量二聚化剂(可能的临床有效水平)之后90%或更高的经icasp9修饰的t细胞被消除。本文所呈现的icasp9系统还可避免伴随其他基于细胞的疗法和/或基于自杀开关的疗法所见到的额外限制。常常在哺乳动物细胞的逆转录病毒转导之后观察到由于转导构建体的沉默所致的表达损失。本文所呈现的表达构建体未显示出此类作用的迹象。即使在培养一个月后,表达的降低或诱导的死亡也不明显。在其他基于细胞的疗法和/或基于自杀开关的疗法中有时观察到的另一潜在问题是在具有上调抗细胞凋亡基因的细胞中产生抗性。已在涉及程序性细胞死亡途径(例如fas)的不同元件的其他自杀系统中观察到该效应。选择icasp9作为用于本文所呈现的表达构建体的自杀基因,因为它不太可能具有该限制。与细胞凋亡级联的其他成员相比,胱天蛋白酶-9的活化在细胞凋亡途径的晚期发生,因此应当会绕过许多(若非全部)抗细胞凋亡调节剂(例如c-flip和bcl-2家族成员)的作用。本文所呈现的系统所特有的潜在限制可以是icasp9的自发二聚化,这进而可引起不想要的细胞死亡和差的持久性。已在利用fas的某些其他诱导型系统中观察到该作用。在经转导细胞中的低自发性死亡率和体内转基因细胞长期持久性的观察结果指示,当使用基于icasp9的表达构建体时,这种可能性不是重要的考虑因素。来源于msc的逆转录病毒转导的整合事件可潜在地驱动有害的诱变,尤其是当存在逆转录病毒载体的多个插入,从而引起不想要的拷贝数作用和/或其他不期望的作用时。这些不想要的作用可抵消逆转录病毒转导自杀系统的益处。使用从稳定生产细胞系获得的临床级逆转录病毒上清液和相似的培养条件来转导t淋巴细胞,经常可将这些作用最小化。本文所转导并评价的t细胞含有范围在约1到3个的整合体(上清液含有范围在约1×106个的病毒粒子/ml)。慢病毒取代逆转录病毒载体可进一步降低遗传毒性的风险,尤其是在具有高自我更新和分化潜力的细胞中。虽然小比例的icasp9阳性msc在单次暴露于cid之后持久存在,但这些存活细胞随后可在再暴露于cid之后被杀伤。在体内,用两次剂量则有>99%的耗竭,但可能重复给予cid将是临床环境中最大耗竭所需的。当使用诱导型自杀开关系统时提供额外安全性的另外的非限制性方法包括额外轮次的细胞分选以进一步增加所施用的细胞群体的纯度,以及使用超过一种自杀基因系统以增强杀伤效率。选择由b淋巴细胞生理表达的cd19分子作为针对经转导细胞的可选标志物,因为它潜在优于其他可用的选择系统,例如新霉素磷酸转移酶(neo)和截短的低亲和力神经生长因子受体(δlngfr)。“neo”编码潜在免疫原性的外来蛋白质,并且需要在选择培养基中培养7天,增加了系统的复杂性并且潜在地损害了所选细胞。δlngfr表达应当允许与其他表面标志物相似的分离策略,但这些未被广泛用于临床用途,并且持续的担忧仍然是关于δlngfr的致癌潜力。相比之下,使用临床级装置通过cd19表达对icasp9阳性细胞的磁性选择是容易获得的,并且已显示对随后的细胞生长或分化没有显著的作用。用于制备和施用包含胱天蛋白酶-9安全开关的间充质基质细胞的程序还可用于制备胚胎干细胞和诱导型多能干细胞。因此,对于本实施例中所概述的程序,胚胎干细胞或诱导型多能干细胞可替代实施例中所提供的间充质基质细胞。在这些细胞中,可使用逆转录病毒载体和慢病毒载体,这些载体具有例如cmv启动子或ronin启动子。实施例6:具有较低的基础活性和配体ic50的最小损失的修饰的胱天蛋白酶-9多肽基础信号传导(在不存在激动剂或活化剂的情况下的信号传导)在大量生物分子中普遍存在。例如,已在来自多个亚家族的超过60种野生型g蛋白质偶联受体(gpcr)[1]、激酶(例如erk和abl)[2]、表面免疫球蛋白[3]和蛋白酶中观察到基础信号传导。基础信号传导已被假设为有助于从胚胎干细胞多能性的维持、b细胞发育和分化[4-6]、t细胞分化[2,7]、胸腺细胞发育[8]、胞吞和药物耐受性[9]、自身免疫[10]到植物生长和发育[11]的众多种生物事件。虽然其生物学意义并不始终完全被理解或显而易见,但有缺陷的基础信号传导可能导致严重后果。有缺陷的基础gs蛋白质传导信号已导致疾病,例如视网膜色素变性、色盲、肾性尿崩症、家族性acth抗性和家族性低钙尿高钙血症[12,13]。即使野生型引发剂胱天蛋白酶-9的同二聚化在能量上是不利的,使得它们大部分是溶液中的单体[14-16],未加工的胱天蛋白酶9的低水平固有基础活性[15,17]在其天然变构调控物(基于apaf-1的“凋亡体”)存在下仍被增强[6]。此外,超生理表达水平和/或共定位可导致邻近驱动的二聚化,从而进一步增强基础活化。在嵌合未修饰的胱天蛋白酶-9多肽中,通过去除胱天蛋白酶-募集-前结构域(card)[18],用同族高亲和力ap1903结合结构域fkbp12-f36v替代它而显著降低先天性胱天蛋白酶-9基础活性。其作为用于细胞疗法的促细胞凋亡“安全开关”的有用性已在多项研究中得到充分证实[18-20]。虽然它的高特异性和低基础活性已使其成为细胞疗法中的强大工具,但与g蛋白质偶联受体相反,目前没有“反向激动剂”[21]来消除基础信号传导,这对于制造以及在一些应用中可能是期望的。由于嵌合多肽的低水平基础活性的高度放大,主细胞库的制备已被证明具有挑战性。另外,一些细胞比其他细胞对胱天蛋白酶-9的低水平基础活性更敏感,导致经转导细胞的非预期凋亡[18]。为了改良嵌合胱天蛋白酶-9多肽的基础活性,基于已知在同二聚化、xiap介导的抑制或磷酸化(下表)中发挥关键作用的残基,使用“基于合理设计”的方法来工程化75icasp9突变体,而不是使用多轮筛选作为对随机产生的突变体的选择性压力的“定向进化”[22]。二聚化驱动的胱天蛋白酶-9活化已被认为是引发剂胱天蛋白酶活化的主要模式[15,23,24]。为了降低自发二聚化,对于对同二聚化及由此的基础胱天蛋白酶-9信号传导至关重要的残基进行定点诱变。用组成型二聚体效应物胱天蛋白酶-3的五个关键残基(c264-ivs-m268)替代β6链中的五个关键残基(g402-cfn-f406)(胱天蛋白酶-9的关键二聚化界面)将其转换为对apaf-1活化无应答的组成型二聚体蛋白质而无重大结构重排[25]。为了修改自发的同二聚化,基于氨基酸化学,并且基于主要作为溶液中的单体存在的引发剂胱天蛋白酶-2、胱天蛋白酶-8、胱天蛋白酶-9和胱天蛋白酶-10的相应残基进行了5个残基的系统诱变[14,15]。在制备28个icasp9突变体并通过基于分泌型碱性磷酸酶(seap)的替代性杀伤测定(下表)进行测试之后,发现n405q突变以对ap1903的较高ic50的中等(<10倍)代价降低基础信号传导。由于胱天蛋白酶活化通常需要的蛋白质水解不是胱天蛋白酶-9活化所绝对需要的[26],因此增加了热力学“障碍”以抑制自体蛋白质水解。另外,由于xiap介导的胱天蛋白酶-9结合捕获了呈单体状态的胱天蛋白酶-9以减弱其催化活性活性和基础活性[14],因此努力通过诱变对于与xiap相互作用至关重要的四肽(a316-tp-f319、d330-ais-s334)来加强xiap和胱天蛋白酶-9之间的相互作用。从这些icasp-9突变体中的17个,确定d330a突变以最低(<5倍)ap1903ic50代价降低基础信号传导。第三种方法基于先前所报道的发现,即胱天蛋白酶-9在通过pkc-ζ将s144磷酸化[27]、通过蛋白质激酶a将s183磷酸化[28]、通过akt1将s196磷酸化[29]后被激酶抑制,并且在通过c-abl将y153磷酸化[30]后被激活。这些“制动(brake)”可改善ic50,或用磷酸化模拟(“磷酸模拟”)残基取代可增加这些“制动”以降低基础活性。然而,基于这些残基的15个单残基突变体均未成功地降低对ap1903的ic50。诸如在例如实施例1-5和整个本申请中所讨论的方法的方法可在需要时经适当修改应用于嵌合修饰的胱天蛋白酶-9多肽以及各种治疗性细胞。实施例7:材料和方法胱天蛋白酶-9的pcr定点诱变:为了改良胱天蛋白酶-9的基础信号传导,用含有突变的寡核苷酸和kapa(kapabiosystems,woburn,ma)完成基于pcr的定点诱变[31]。在18个循环的扩增之后,用甲基化依赖性dpni限制酶去除亲本质粒,该酶使pcr产物保持完整。使用2μl所得反应物化学转化xl1-蓝或dh5α。随后通过测序(seqwright,houston,tx)鉴别阳性突变体。细胞系维持和转染:在加湿的37℃、5%co2/95%空气气氛中将早期传代的hek293t/16细胞(atcc,manassas,va)在补充有10%fbs、100u/ml青霉素和100u/ml链霉素的imdm,glutamaxtm(lifetechnologies,carlsbad,ca)中维持直到转染。在15ml锥形管中用每百万个细胞800ng到2μg编码icasp9突变体的表达质粒和500ng编码srα启动子驱动的seap的表达质粒瞬时转染处于对数生长期的细胞。使用催化无活性的胱天蛋白酶-9(c285a)(无fkbp结构域)或“空”表达质粒(“psh1-空”)来保持转染之间总质粒水平恒定。使用以每μg质粒dna3μl的比率的转染试剂,在不存在抗生素的情况下瞬时转染hek293t/16细胞。将100μl或2ml的转染混合物分别添加到96孔板或6孔板的每个孔中。对于seap测定,在转染后至少3孵育小时之后添加ap1903的对数稀释物。对于蛋白质印迹,在收获前将细胞与ap1903(10nm)一起孵育20分钟。分泌型碱性磷酸酶(seap)测定:在ap1903处理之后24到48小时,将约100μl上清液收获到96孔板中并如所讨论的那样测定seap活性[19,32]。简单地说,在65℃热变性45分钟以降低由对热敏感的内源性(和血清来源的)碱性磷酸酶引起的背景之后,将5μl上清液添加到95μlpbs中,并且添加到100μl底物缓冲液中,所述底物缓冲液含有再悬浮于2m二乙醇胺中的1μl100mm4-甲基伞形酮酰基磷酸酯(4-methylumbelliferylphosphate,4-mup;sigma,st.louis,mo)。通过seap水解4-mup产生具有可容易地测量的激发/发射(355/460nm)的荧光底物。在黑色不透明的96孔板中进行测定以将孔之间的荧光渗漏最小化。为了检查基础信号传导和ap1903诱导的活性二者,将106个早期传代的hek293t/16细胞用各种量的野生型胱天蛋白酶和500ng表达质粒共转染,所述表达质粒使用srα启动子驱动seap,即细胞存活力的标志物。依照制造商的建议,向每种混合物添加1ml不含抗生素的imdm+10%fbs。将1000μl混合物接种到96孔板的每个孔上。在转染之后至少3小时添加100μl的ap1903。在添加ap1903达至少24小时之后,将100μl上清液转移到96孔板中并在68℃加热变性30分钟以使内源碱性磷酸酶失活。对于所述测定,通过seap将4-甲基伞形酮酰基磷酸酯底物水解成4-甲基伞形酮,所述4-甲基伞形酮是可用364nm激发并用448nm的发射滤光片检测的代谢物。由于seap被用作细胞存活力的标志物,因此降低的seap读数与增加的i胱天蛋白酶-9活性相对应。因此,在不存在ap1903的情况下更高的seap读数将指示更低的基础活性。期望的胱天蛋白酶突变体将具有降低的基础信号传导与对ap1903增加的敏感性(即,更低的ic50)。该研究的目标是降低基础信号传导而不显著损害ic50。蛋白质印迹分析:将用2μg质粒瞬时转染48-72小时的hek293t/16细胞在37℃用ap1903处理7.5到20分钟(如所示的),且随后在具有halttm蛋白酶抑制剂混合剂的500μlripa缓冲液(0.01mtris·hcl,ph8.0/140mmnacl/1%tritonx-100/1mm苯基甲基磺酰氟/1%脱氧胆酸钠/0.1%sds)中裂解。收集裂解物并在冰上裂解30min。在将细胞碎片沉淀之后,如制造商所推荐的,利用bcatm蛋白质测定在96孔板中测量来自上覆上清液的蛋白质浓度。将30μg蛋白质在具有2.5%2-巯基乙醇的laemmli样品缓冲液(bio-rad,hercules,ca)中于95℃煮沸5min,然后通过criteriontgx10%tris/甘氨酸蛋白质凝胶分离。用1/1000兔抗人胱天蛋白酶-9多克隆抗体,之后用1/10,000hrp缀合的山羊抗兔iggf(ab')2二级抗体(bio-rad)探针探测膜。使用supersignalwestfemto化学发光底物检测蛋白质带。为了确保等同的样品加载,在用1/10,000兔抗肌动蛋白多克隆抗体标记之前,使用restoreplus蛋白质印迹剥离缓冲液(westernblotstrippingbuffer)将印迹在65℃下剥离1小时。除非另有说明,否则所有试剂均购自thermoscientific。在实施例1-5和整个本说明书中讨论的方法和构建体还可用于测定和使用经修饰的胱天蛋白酶-9多肽。实施例8:嵌合修饰的胱天蛋白酶-9多肽的评价和活性基础活性和ap1903诱导活性的比较:为了检查嵌合修饰的胱天蛋白酶-9多肽的基础活性和ap1903诱导的活性二者,检查了用seap和不同量的icasp9突变体共转染的hek293t/16细胞的seap活性。对于用每百万个细胞1μgicasp9(148928、179081、205772相对于114518的相对seap活性单位)或每百万个细胞2μgicasp9(136863、175529、174366相对于98889)转染的细胞,icasp9d330a、n405q和d330a-n405q显示比未修饰的icasp9显著更小的基础活性。当以2μg/百万细胞转染时,所有三种嵌合修饰的胱天蛋白酶-9多肽的基础信号传导均显著更高(p值<0.05)。icasp9d330a、n405q和d330a-n405q还显示针对ap1903的预期ic50增加,但与wt的1pm相比,它们都仍然小于6pm(基于seap测定),使得它们成为可能有用的细胞凋亡开关。蛋白质表达水平和蛋白质水解的评价:为了排除所观察到的嵌合修饰的胱天蛋白酶-9多肽的降低基础活性可归因于蛋白质稳定性降低或转染效率变化的可能性,并且为了检查icasp9的自体蛋白质水解,测定在经转染的hek293t/16细胞中的胱天蛋白酶-9的变体的蛋白质表达水平。在用于本研究中的转染条件下,嵌合未修饰的胱天蛋白酶-9多肽、icasp9d330a和icasp9d330a-n405q的蛋白质水平都显示出相似的蛋白质水平。相比之下,icasp9n405q带显得比其他带更暗,特别是当使用2μg表达质粒时。在所用转染条件下不易检测到自体蛋白质水解,可能是因为仅收集到活细胞。抗肌动蛋白质再次印迹(reblotting)确认相当的裂解物量被加载到每个泳道中。这些结果支持通过seap测定观察到的icasp9d330a、n405q和d330a-n405q突变体中观察到的较低的基础信号传导。讨论:基于seap筛选测定,这三种嵌合修饰的胱天蛋白酶-9多肽显示与icasp9wt转染子相比更高的不依赖于ap1903的seap活性,和因此更低的基础信号传导。然而,双重突变(d330-n405q)与单个氨基酸突变体相比未能进一步降低基础活性或ic50(0.05nm)。所观察到的差异似乎并非归因于蛋白质不稳定或转染期间使用的质粒量不同。实施例9:嵌合修饰的胱天蛋白酶-9多肽的评价和活性诱导型胱天蛋白酶-9以ap1903依赖性方式提供快速、不依赖于细胞周期的细胞自主杀伤。改善该诱导型胱天蛋白酶-9多肽的特征将允许更广泛的适用性。期望降低蛋白质的不依赖配体的细胞毒性,并增加其在低水平表达的杀伤力。尽管不依赖于配体的细胞毒性在相对较低的表达水平不是问题,但倘若表达水平可达到比在原代靶细胞中高一个或多个数量级,例如在载体生产期间,则其可能具有重大影响。此外,由于细胞表达的细胞凋亡抑制剂(例如xiap和bcl-2)的水平,细胞对低水平的胱天蛋白酶表达可能具有不同的敏感性。因此,为了将胱天蛋白酶多肽重新工程化成具有更低的基础活性和对ap1903配体可能更高的敏感性,设计了四种诱变策略。二聚化结构域:尽管胱天蛋白酶-9在生理水平是溶液中的单体,但在高水平的表达下,例如在促细胞凋亡的、apaf驱动的“凋亡体”中发生,胱天蛋白酶-9可二聚化,导致在d315处的自体蛋白质水解和催化活性的大增加。由于c285是活性位点的一部分,因此突变c285a是催化无活性的,并被用作阴性对照构建体。二聚化特别涉及五个残基(即g402、c403、f404、n405和f406)的非常紧密的相互作用。对于每个残基,构建代表不同氨基酸类别(例如疏水性、极性等)的各种氨基酸取代。有趣的是,g402处的所有突变体(即,g402a、g402i、g402q、g402y)和c403p导致催化无活性的胱天蛋白酶多肽。另外的c403突变(即,c403a、c403s和c403t)类似于野生型胱天蛋白酶,且不被进一步探究。f404处的突变全部降低了基础活性,但也反映出对ic50的降低的敏感性(从约1log到不可测量的)。按照功效顺序,它们是:f404y>f404t、f404w>>f404a、f404s。n405处的突变或者没有作用(如n405a),或者增加基础活性(如n405t中那样),或者降低基础活性,伴随着对ic50的小的(约5倍)或更大的有害作用(分别如n405q和n405f一样)。最后,与f404一样,f406处的突变全部降低了基础活性,并且反映出对ic50的降低敏感性(从约1log到不可测量的)。按照功效顺序,它们是:f406a、f406w、f406y>f406t>>f406l。构建并测试了一些多肽,其在二聚化结构域内具有化合物突变,但取代来自已知为溶液中的单体(例如胱天蛋白酶-2、胱天蛋白酶-8、胱天蛋白酶-10)或二聚体(例如胱天蛋白酶-3)的其他胱天蛋白酶的类似的5个残基。含有来自胱天蛋白酶-2、胱天蛋白酶-3和胱天蛋白酶-8的5个残基改变连同aaaaa丙氨酸取代的胱天蛋白酶-9多肽都是催化无活性的,而来自胱天蛋白酶-10的等同残基(isaqt)导致降低的基础活性,但更高的ic50。总之,基于始终降低的基础活性,联合对ic50仅轻微作用的组合,选择n405q用于进一步实验。为了改善功效,测试了具有n405q取代的修饰的胱天蛋白酶-9多肽的密码子优化形式,称为n405qco。与野生型n405q取代的胱天蛋白酶-9多肽相比,该多肽显得对ap1903略微更敏感。切割位点突变体:胱天蛋白酶-9聚集在凋亡体内后,或通过ap1903-强制同二聚化,在d315处发生自体蛋白质水解。这在a316处至少短暂地产生新的氨基末端。有趣的是,新揭示的四肽316atpf319结合胱天蛋白酶-9抑制剂xiap,后者在上述二聚化基序gcfnf处与胱天蛋白酶-9本身竞争二聚化。因此,d315切割的初始结局是xiap结合,进一步减弱了胱天蛋白酶-9的活化。然而,在d330处存在第二个胱天蛋白酶切割位点,它是下游效应物胱天蛋白酶(胱天蛋白酶-3)的靶标。随着促细胞凋亡压力积聚,d330变得越来越多地被切割,释放残基316-330内的xiap-结合小肽,并因此去除该缓和的胱天蛋白酶-9抑制剂。构建了d330a突变体,其降低了基础活性,但不如n405q那样低。通过在高拷贝数的seap测定,它也揭示了ic50略有增加,但在原代t细胞中的低拷贝数,ic50实际上略有增加,伴随改善的对靶细胞的杀伤作用。自体蛋白质水解位点d315处的突变也降低基础活性,但这导致ic50的大增加,可能是因为d330裂解则是蛋白酶活化所必需的。d315a和d330a处的双重突变导致不能被恰当加工的非活性“锁定的”胱天蛋白酶-9。产生了其他d330突变体,包括d330e、d330g、d330n、d330s和d330v。d327处的突变也阻止了d330处的切割,因为共有的胱天蛋白酶-3切割位点是dxxd,但与d330突变不同,数个d327突变(即d327g、d327k和d327r)连同f326k、q328k、q328r、l329k、l329g和a331k并不降低基础活性且不再继续研究。xiap结合突变体:如上文所讨论的,d315处的自体蛋白质水解揭示了将xiap“诱入”胱天蛋白酶-9复合物中的xiap结合四肽316atpf319。用来自线粒体来源的抗xiap抑制剂smac/diablo的类似的xiap结合四肽avpi取代atpf可更紧密地结合xiap并降低基础活性。然而,该4残基取代没有作用。atpf基序内的其他取代在无作用(即t317c、p318a、f319a)到较低的基础活性的范围,ic50有非常轻微的增加(即t317s)、轻微的增加(即t317a)到大的增加(即a316g、f319w)。总之,改变xiap结合四肽的作用是轻微的;尽管如此,t317s被选择用于测试双重突变(下文讨论),因为对ic50的作用是所述组中最轻微的。磷酸化突变体:少量的胱天蛋白酶-9残基被报道为抑制磷酸化(例如s144、s183、s195、s196、s307、t317)或活化磷酸化(即y153)的靶标。因此,测试了通过用酸性残基(例如asp)取代来模拟磷酸化(“磷酸化模拟物”)或消除磷酸化的突变。一般来说,大多数突变,无论是否尝试磷酸化模拟,都会降低基础活性。在具有较低基础活性的突变体中,s144处的突变(即,s144a和s144d)和s1496d对ic50没有可辨别的作用,突变体s183a、s195a和s196a轻微地增加ic50,并且突变体y153a、y153a和s307a对ic50有大的有害作用。鉴于较低的基础活性和最小活性的组合,如果对ic50有任何作用,则选择s144a用于双重突变(下文讨论)。双重突变体:为了将略微改善功效的d330a变体与可进一步降低基础活性的可能残基组合,构建并测试了许多d330a双重突变体。通常,它们维持较低的基础活性,ic50仅略微增加,包括n405q、s144a、s144d、s183a和s196a处的第二突变。双重突变体d330a-n405t具有较高的基础活性,并且d330a与y153a、y153f和t317e处的双重突变体是无催化活性的。测试了一系列具有低基础活性n405q的双重突变体,旨在改善功效或降低ic50。这些全部在低基础活性方面以及相对于ic9-1.0略有增加的ic50方面显得与n405q相似,,并且包括n405q与s144a、s144d、s196d和t317s。进行seap测定以研究一些二聚化结构域突变体的基础活性和cid敏感性。n405q是所测试的基因活性低于wt胱天蛋白酶-9的突变体中ap1903敏感性最高的,如通过不依赖于ap1903的信号传导的上调所确定的。f406t是该组中对cid最不敏感的。测定突变体胱天蛋白酶多肽(d330a和n405q)连同双重突变体(d330a-n405q)的二聚体非依赖性seap活性。多次转染(n=7到13)的结果发现n405q具有比d330a更低的基础活性,并且双重突变体是居间。获得突变体胱天蛋白酶多肽(d330a和n405q)连同双重突变体(d330a-n405q)的平均(+标准偏差,n=5)ic50显示在瞬时转染测定中,d330a比n405q突变体对ap1903稍敏感,但比wt胱天蛋白酶-9敏感性低约2倍。使用野生型(wt)胱天蛋白酶-9、n405q、无活性的c285a和数个t317突变体在xiap结合结构域内进行seap测定。结果显示,t317s和t317a可降低基础活性,而对apf1903的ic50没有大的变化。因此,选择t317s来与n405q一起制备双重突变体。来自以上seap测定的ic50显示,t317a和t317s具有与野生型胱天蛋白酶-9多肽相似的ic50,尽管具有较低的基础活性。来自数种d330突变体的二聚体非依赖性seap活性显示,所测试的这种类别的所有成员(包括d330a、d330e、d330n、d330v、d330g和d330s)具有比野生型胱天蛋白酶-9更小的基础活性。测定d330a变体的基础活性和ap1903诱导的活性。在转染后72小时,对用每百万个hek293细胞1或2μg突变体胱天蛋白酶多肽和0.5μgpsh1-kseap瞬时转染的hek293/16细胞进行seap测定。将基于2μg每种表达质粒(包括wt)的归一化数据与来自基于1μg的转染的归一化数据混合。icasp9-d330a、icasp9-d330e和icasp9-d330s显示与野生型胱天蛋白酶-9相比在统计学上更低的基础信号传导。蛋白质印迹结果显示d330突变阻断d330处的切割,导致略大(较慢迁移)的小带(<20kda标志物)。其他印迹显示d327突变也阻断切割。测量了用编码所示胱天蛋白酶-9多肽的逆转录病毒转导5×的多个pg13克隆的平均荧光强度。较低的基础活性通常意味着胱天蛋白酶-9基因连同遗传连锁的报告子cd19的较高表达水平。结果显示,平均来说,表达n405q突变体的克隆表达更高水平的cd19,反映了n405q比d330突变体或wt胱天蛋白酶-9更低的基础活性。测定各种胱天蛋白酶突变对来源于pg13包装细胞的病毒滴度的作用,该pg13包装细胞经基于vsv-g包膜的逆转录病毒上清液交叉转导。为了检查ic9来源的基础信号传导对逆转录病毒主细胞系生产的作用,在存在4μg/ml转染增强剂凝聚胺的情况下,将逆转录病毒包装细胞系pg13用基于vsv-g的逆转录病毒上清液交叉转导5次。随后用pe缀合的抗人cd19抗体将ic9转导的pg13细胞染色,作为转导的指示。ic9-d330a转导的pg13细胞、ic9-d330e转导的pg13细胞和ic9-n405q转导的pg13细胞显示增强的cd19平均荧光强度(mfi),指示较高的逆转录病毒拷贝数,意味着较低的基础活性。为了更直接地检查pg13转导子的病毒滴度,用病毒上清液和8ug/ml聚凝胺处理ht1080细胞。如在ht1080细胞中所观察到的,icasp9-d330a、icasp9-n405q和icasp9-d330e转导子相对于wticasp9在pg13细胞中增强的cd19mfi与较高的病毒滴度正相关。由于初始低病毒滴度(大约1e5转导单位(tu)/ml),因此在不存在增加病毒产率的hat处理的情况下未观察到病毒滴度的差异。在hat培养基处理后,用ic9-d330a、ic9--n405q或ic9--d330e转导的pg13细胞表现出更高的病毒滴度。用下式计算病毒滴度(转导单位):病毒滴度=(转导当天的细胞数)*(cd19+%)/上清液的体积(ml)。为了进一步研究具有较低基础活性的ic9突变体的作用,选择ic9转导的pg13细胞的单个克隆(集落)并扩增。观察到具有比其他组群更高的cd19mfi的ic9-n405q克隆。测定大部分为单拷贝的各种胱天蛋白酶多肽在原代t细胞中的作用。这可能更准确地反映这些自杀基因将如何在治疗上使用。令人惊讶的是,数据显示d330a突变体在低滴度下实际上对ap1903更敏感,并且当在24小时测定中测试时至少与wt胱天蛋白酶-9一样地杀伤。n405q突变体对ap1903较不敏感,并且不能在24小时内同样有效地杀伤靶细胞。转导来自单个健康供体的6个独立t细胞样品的结果显示d330a突变体(mut)比野生型胱天蛋白酶-9多肽对ap1903更敏感。图57显示了来自图56中所示的6名健康供体的平均ic50、范围和标准偏差。该数据显示,所述改善是统计学显著的。icasp9-d330a突变体在经转导的t细胞中表现出改善的ap1903依赖性细胞毒性。用编码突变型或野生型icasp9或icasp9-d330a和δcd19细胞表面标志物的逆转录病毒转导来自健康供体(n=6)的原代t细胞。在转导之后,使用cd19-微珠和磁性柱纯化icasp9转导的t细胞。然后将t细胞暴露于ap1903(0-100nm),并在24小时之后通过流式细胞术测量cd3+cd19+t细胞。icasp9-d330a的ic50显著低于野生型icasp9(p=0.002)。数种d330突变体的结果揭示,所测试的所有六种d330突变体(d330a、d330e、d330n、d330v、d330g和d330s)均比野生型胱天蛋白酶-9多肽对ap1903更敏感。n405q突变体连同其他二聚化结构域突变体(包括n404y和n406y)可在10天内杀伤与野生型胱天蛋白酶-9多肽或d330a无法区别的靶t细胞。在第0天接受ap1903的细胞在第4天接受第二剂量的ap1903。该数据支持使用敏感性降低的胱天蛋白酶-9突变体(如n405q)作为受调控功效开关的一部分。称为“n405qco”的n405q胱天蛋白酶多肽的密码子优化结果揭示,可能导致表达的增加的密码子优化仅对诱导型胱天蛋白酶功能具有非常微小的作用。这可能反映了共同密码子在原始胱天蛋白酶-9基因中的用途。胱天蛋白酶-9多肽具有体内剂量应答曲线,该曲线可用于消除表达胱天蛋白酶-9多肽的t细胞的可变级分。所述数据还显示0.5mg/kgap1903的剂量足以消除体内大多数经修饰的t细胞。测定用d330eicasp9转导的t细胞的ap1903剂量依赖性体内消除。用sfg-icasp9-d330e-2a-δcd19逆转录病毒转导t细胞,并将其静脉内注射到免疫缺陷小鼠(nsg)中。在24小时之后,用ap1903(0-5mg/kg)腹膜内注射小鼠。再过24小时之后,将小鼠处死,分离来自脾(a)的淋巴细胞并通过流式细胞术分析人cd3+cd19+t细胞的频率。这显示icasp9-d330e表现出与野生型icasp9相似的应答于ap1903的体内细胞毒性谱。结论:如所讨论的,从迄今为止的78个突变体的这一分析来看,在单个突变体突变中,d330突变组合了略微改善的功效与稍微降低的基础活性。n405q突变体也具有吸引力,因为它们具有非常低的基础活性,有仅轻微降低的功效,反映为ic50的4-5倍增加。原代t细胞中的实验已显示,n405q突变体可有效地杀伤靶细胞,但动力学比d330突变体稍慢,使得这对于在初始剂量的ap1903之后部分杀伤的累进(graduated)自杀开关可能非常有用,并且直到可在第二剂量的ap1903后实现完全杀伤。下表提供了根据本文所讨论的方法制备和测定的各种嵌合修饰的胱天蛋白酶-9多肽的基础活性和ic50的概述。结果基于除了被测试一次的一个亚类(即a316g、t317e、f326k、d327g、d327k、d327r、q328k、q328r、l329g、l329k、a331k、s196a、s196d和以下双重突变体:d330a与s144a、s144d或s183a;以及n405q与s144a、s144d、s196d或t317s)之外最少两次独立的seap测定。采取四种多面向(multi-pronged)方法来产生经测试的嵌合修饰的胱天蛋白酶-9多肽。“死亡”修饰的胱天蛋白酶-9多肽不再对ap1903应答。双重突变体由连字号指示,例如,d330a-n405q表示修饰的胱天蛋白酶-9多肽,其具有位置330处的取代和位置405处的取代。表5胱天蛋白酶突变体类别实施例6-9中引用的文献参考1.seifert,r.和k.wenzel-seifert,g-蛋白质偶联受体的组成型活性:患病原因和野生型受体的共同性质(constitutiveactivityofg-protein-coupledreceptors:causeofdiseaseandcommonpropertyofwild-typereceptors).naunynschmiedebergsarchpharmacol,2002.366(5):第381-416页.2.roose,j.p.等,通过erk和abl激酶的t细胞受体非依赖性基础信号传导抑制rag基因表达(tcellreceptor-independentbasalsignalingviaerkandablkinasessuppressesraggeneexpression).plosbiol,2003.1(2):第e53页.3.tze,l.e.等,基础免疫球蛋白信号传导在未成熟的b细胞中积极维持发育阶段(basalimmunoglobulinsignalingactivelymaintainsdevelopmentalstageinimmaturebcells).plosbiol,2005.3(3):第e82页.4.schram,b.r.等,b细胞受体基础信号传导调控抗原诱导的ig轻链重排(bcellreceptorbasalsignalingregulatesantigen-inducediglightchainrearrangements).jimmunol,2008.180(7):第4728-41页.5.randall,k.l.等,dock8突变削弱b细胞免疫突触、生发中心和长寿抗体产生(dock8mutationscripplebcellimmunologicalsynapses,germinalcentersandlong-livedantibodyproduction).natimmunol,2009.10(12):第1283-91页.6.kouskoff,v.等,b细胞受体表达水平决定发育性b淋巴细胞的命运:受体编辑与选择(bcellreceptorexpressionleveldeterminesthefateofdevelopingblymphocytes:receptoreditingversusselection).procnatlacadsciusa,2000.97(13):第7435-9页.7.hong,t.等,用于理解cd4+t细胞异质分化的简单理论框架(asimpletheoreticalframeworkforunderstandingheterogeneousdifferentiationofcd4+tcells).bmcsystbiol,2012.6:第66页.8.rudd,m.l.,a.tua-smith和d.b.straus,lcksh3结构域功能是调控胸腺细胞发育的t细胞受体信号所必需的(lcksh3domainfunctionisrequiredfort-cellreceptorsignalsregulatingthymocytedevelopment).molcellbiol,2006.26(21):第7892-900页.9.sorkin,a.和m.vonzastrow,胞吞和信号传导:交织在一起的分子网络(endocytosisandsignalling:intertwiningmolecularnetworks).natrevmolcellbiol,2009.10(9):第609-22页.10.luningprak,e.t.,m.monestier和r.a.eisenberg,耐受和自身免疫中的b细胞受体编辑(bcellreceptoreditingintoleranceandautoimmunity).annnyacadsci,2011.1217:第96-121页.11.boss,w.f.等,基础信号调控植物生长和发育(basalsignalingregulatesplantgrowthanddevelopment).plantphysiol,2010.154(2):第439-43页.12.tao,y.x.,g蛋白质偶联受体的组成型活化和疾病:对活化和治疗机制的认识(constitutiveactivationofgprotein-coupledreceptorsanddiseases:insightsintomechanismsofactivationandtherapeutics).pharmacolther,2008.120(2):第129-48页.13.spiegel,a.m.,g蛋白质偶联信号转导在人疾病中的缺陷(defectsingprotein-coupledsignaltransductioninhumandisease).annurevphysiol,1996.58:第143-70页.14.shiozaki,e.n.等,xiap介导的胱天蛋白酶-9抑制机制(mechanismofxiap-mediatedinhibitionofcaspase-9).molcell,2003.11(2):第519-27页.15.renatus,m.等,二聚体形成驱动细胞死亡蛋白酶胱天蛋白酶-9的活化(dimerformationdrivestheactivationofthecelldeathproteasecaspase-9).procnatlacadsciusa,2001.98(25):第14250-5页.16.shi,y.,胱天蛋白酶在细胞凋亡期间活化和抑制的机制(mechanismsofcaspaseactivationandinhibitionduringapoptosis).molcell,2002.9(3):第459-70页.17.shiozaki,e.n.,j.chai和y.shi,apaf-1card诱导的胱天蛋白酶-9的寡聚和活化(oligomerizationandactivationofcaspase-9,inducedbyapaf-1card).procnatlacadsciusa,2002.99(7):第4197-202页.18.straathof,k.c.等,用于t细胞疗法的诱导型胱天蛋白酶-9安全开关.blood,2005.105(11):第4247-54页.19.maccorkle,r.a.,k.w.freeman和d.m.spencer,半胱天蛋白酶:人工死亡开关的合成活化(syntheticactivationofcaspases:artificialdeathswitches).procnatlacadsciusa,1998.95(7):第3655-60页.20.distasi,a.等,作为用于过继性细胞疗法的安全开关的诱导型细胞凋亡(inducibleapoptosisasasafetyswitchforadoptivecelltherapy).nengljmed,2011.365(18):第1673-83页.21.chang,w.c.等,修饰人5-ht4受体的配体诱导的和组成型的信号转导(modifyingligand-inducedandconstitutivesignalingofthehuman5-ht4receptor).plosone,2007.2(12):第e1317页.22.bloom,j.d.和f.h.arnold,鉴于定向进化:适应性蛋白质进化的途径(inthelightofdirectedevolution:pathwaysofadaptiveproteinevolution).procnatlacadsciusa,2009.106suppl1:第9995-10000页.23.boatright,k.m.和g.s.salvesen,胱天蛋白酶活化机制(mechanismsofcaspaseactivation).curropincellbiol,2003.15(6):第725-31页.24.boatright,k.m.等,用于顶端胱天蛋白酶活化的统一模型(aunifiedmodelforapicalcaspaseactivation).molcell,2003.11(2):第529-41页.25.chao,y.等,工程化二聚体胱天蛋白酶-9:用于胱天蛋白酶活化的诱导邻近模型的再评价(engineeringadimericcaspase-9:are-evaluationoftheinducedproximitymodelforcaspaseactivation).plosbiol,2005.3(6):第e183页.26.stennicke,h.r.等,胱天蛋白酶-9可在没有蛋白水解加工的情况下被活化(caspase-9canbeactivatedwithoutproteolyticprocessing).jbiolchem,1999.274(13):第8359-62页.27.brady,s.c.,l.a.allan和p.r.clarke,通过蛋白质激酶cζ对高渗应激的应答加以磷酸化来调控胱天蛋白酶-9(regulationofcaspase-9throughphosphorylationbyproteinkinaseczetainresponsetohyperosmoticstress).molcellbiol,2005.25(23):第10543-55页.28.martin,m.c.等,蛋白质激酶a通过细胞色素c下游的apaf-1调控胱天蛋白酶-9活化(proteinkinasearegulatescaspase-9activationbyapaf-1downstreamofcytochromec).jbiolchem,2005.280(15):第15449-55页.29.cardone,m.h.等,通过磷酸化调控细胞死亡蛋白酶胱天蛋白酶-9(regulationofcelldeathproteasecaspase-9byphosphorylation).science,1998.282(5392):第1318-21页.30.raina,d.等,c-abl酪氨酸激酶调控对dna损伤的细胞凋亡应答中的胱天蛋白酶-9自切割(c-abltyrosinekinaseregulatescaspase-9autocleavageintheapoptoticresponsetodnadamage).jbiolchem,2005.280(12):第11147-51页.31.papworth,c.,bauer,j.c.,braman,j.和wright,d.a.,具有>80%效率的一天内定点诱变(site-directedmutagenesisinonedaywith>80%efficiency).strategies,1996.9(3):第3-4页.32.spencer,d.m.等,使用合成的二聚化诱导物体内fas信号传导的功能分析.currbiol,1996.6(7):第839-47页.33.hsiao,e.c.等,在胚胎干细胞和小鼠中使用单一构建四环素诱导型表达系统的组成性gs活化(constitutivegsactivationusingasingle-constructtetracycline-inducibleexpressionsysteminembryonicstemcellsandmice).stemcellresther,2011.2(2):第11页.34.waldner,c.等,基于flp和phic31介导的转基因整合的双条件人胚胎肾细胞系(doubleconditionalhumanembryonickidneycelllinebasedonflpandphic31mediatedtransgeneintegration).bmcresnotes,2011.4:第420页.嵌合胱天蛋白酶多肽可包含氨基酸取代,包括导致具有较低基础活性的胱天蛋白酶多肽的氨基酸取代。这些可包括例如icasp9d330a、icasp9n405q和icasp9d330an405q,分别表现出低到不可检测的基础活性,在基于seap报告子的替代杀伤测定中对其ap1903ic50具有最小的有害作用。实施例10:特定核酸和氨基酸序列的示例以下是核苷酸序列提供了可用于表达嵌合蛋白质和cd19标志物的构建体的示例。该图呈现了sfg.ic9.2a.2cd19.gcs构建体seqidno:1,5'ltr序列的核苷酸序列tgaaagaccccacctgtaggtttggcaagctagcttaagtaacgccattttgcaaggcatggaaaaatacataactgagaatagaaaagttcagatcaaggtcaggaacagatggaacagctgaatatgggccaaacaggatatctgtggtaagcagttcctgccccggctcagggccaagaacagatggaacagctgaatatgggccaaacaggatatctgtggtaagcagttcctgccccggctcagggccaagaacagatggtccccagatgcggtccagccctcagcagtttctagagaaccatcagatgtttccagggtgccccaaggacctgaaatgaccctgtgccttatttgaactaaccaatcagttcgcttctcgcttctgttcgcgcgcttatgctccccgagctcaataaaagagcccacaacccctcactcggggcgccagtcctccgattgactgagtcgcccgggtacccgtgtatccaataaaccctcttgcagttgcatccgacttgtggtctcgctgttccttgggagggtctcctctgagtgattgactacccgtcagcgggggtctttcaseqidno:2,fv(人fkbp12v36)的核苷酸序列ggagtgcaggtggaaaccatctccccaggagacgggcgcaccttccccaagcgcggccagacctgcgtggtgcactacaccgggatgcttgaagatggaaagaaagttgattcctcccgggacagaaacaagccctttaagtttatgctaggcaagcaggaggtgatccgaggctgggaagaaggggttgcccagatgagtgtgggtcagagagccaaactgactatatctccagattatgcctatggtgccactgggcacccaggcatcatcccaccacatgccactctcgtcttcgatgtggagcttctaaaactggaaseqidno:3fv(人fkbp12v36)的氨基酸序列gvqvetispgdgrtfpkrgqtcvvhytgmledgkkvdssrdrnkpfkfmlgkqevirgweegvaqmsvgqrakltispdyaygatghpgiipphatlvfdvellkleseqidno:4,gs接头核苷酸序列tctggcggtggatccggaseqidno:5,gs接头氨基酸序列sgggsgseqidno:6,接头核苷酸序列(在gs接头和casp9之间)gtcgacseqidno:7,接头氨基酸序列(在gs接头和casp9之间)vdseqidno:8,casp9(截短的)核苷酸序列ggatttggtgatgtcggtgctcttgagagtttgaggggaaatgcagatttggcttacatcctgagcatggagccctgtggccactgcctcattatcaacaatgtgaacttctgccgtgagtccgggctccgcacccgcactggctccaacatcgactgtgagaagttgcggcgtcgcttctcctcgctgcatttcatggtggaggtgaagggcgacctgactgccaagaaaatggtgctggctttgctggagctggcgcagcaggaccacggtgctctggactgctgcgtggtggtcattctctctcacggctgtcaggccagccacctgcagttcccaggggctgtctacggcacagatggatgccctgtgtcggtcgagaagattgtgaacatcttcaatgggaccagctgccccagcctgggagggaagcccaagctctttttcatccaggcctgtggtggggagcagaaagaccatgggtttgaggtggcctccacttcccctgaagacgagtcccctggcagtaaccccgagccagatgccaccccgttccaggaaggtttgaggaccttcgaccagctggacgccatatctagtttgcccacacccagtgacatctttgtgtcctactctactttcccaggttttgtttcctggagggaccccaagagtggctcctggtacgttgagaccctggacgacatctttgagcagtgggctcactctgaagacctgcagtccctcctgcttagggtcgctaatgctgtttcggtgaaagggatttataaacagatgcctggttgctttaatttcctccggaaaaaacttttctttaaaacatcaseqidno:9,胱天蛋白酶-9(截短的)氨基酸序列-card结构域缺失gfgdvgaleslrgnadlayilsmepcghcliinnvnfcresglrtrtgsnidceklrrrfsslhfmvevkgdltakkmvlallelaqqdhgaldccvvvilshgcqashlqfpgavygtdgcpvsvekivnifngtscpslggkpklffiqacggeqkdhgfevastspedespgsnpepdatpfqeglrtfdqldaisslptpsdifvsystfpgfvswrdpksgswyvetlddifeqwahsedlqslllrvanavsvkgiykqmpgcfnflrkklffktsseqidno:10,接头核苷酸序列(在胱天蛋白酶-9和2a之间)gctagcagaseqidno:11,接头氨基酸序列(在胱天蛋白酶-9和2a之间)asrseqidno:12,来自衣壳蛋白前体核苷酸序列的明脉扁刺蛾β四体病毒-2agccgagggcaggggaagtcttctaacatgcggggacgtggaggaaaatcccgggcccseqidno:13,来自衣壳蛋白前体氨基酸序列的明脉扁刺蛾β四体病毒-2aaegrgslltcgdveenpgpseqidno:14,人cd19(δ胞质结构域)核苷酸序列(跨膜结构域以粗体表示)atgccacctcctcgcctcctcttcttcctcctcttcctcacccccatggaagtcaggcccgaggaacctctagtggtgaaggtggaagagggagataacgctgtgctgcagtgcctcaaggggacctcagatggccccactcagcagctgacctggtctcgggagtccccgcttaaacccttcttaaaactcagcctggggctgccaggcctgggaatccacatgaggcccctggccatctggcttttcatcttcaacgtctctcaacagatggggggcttctacctgtgccagccggggcccccctctgagaaggcctggcagcctggctggacagtcaatgtggagggcagcggggagctgttccggtggaatgtttcggacctaggtggcctgggctgtggcctgaagaacaggtcctcagagggccccagctccccttccgggaagctcatgagccccaagctgtatgtgtgggccaaagaccgccctgagatctgggagggagagcctccgtgtctcccaccgagggacagcctgaaccagagcctcagccaggacctcaccatggcccctggctccacactctggctgtcctgtggggtaccccctgactctgtgtccaggggccccctctcctggacccatgtgcaccccaaggggcctaagtcattgctgagcctagagctgaaggacgatcgcccggccagagatatgtgggtaatggagacgggtctgttgttgccccgggccacagctcaagacgctggaaagtattattgtcaccgtggcaacctgaccatgtcattccacctggagatcactgctcggccagtactatggcactggctgctgaggactggtggctggaagcaaagagccctggtcctgaggaggaaaagaaagcgaatgactgaccccaccaggagattcseqidno:15,人cd19(δ胞质结构域)氨基酸序列mppprllffllfltpmevrpeeplvvkveegdnavlqclkgtsdgptqqltwsresplkpflklslglpglgihmrplaiwlfifnvsqqmggfylcqpgppsekawqpgwtvnvegsgelfrwnvsdlgglgcglknrssegpsspsgklmspklyvwakdrpeiwegeppclpprdslnqslsqdltmapgstlwlscgvppdsvsrgplswthvhpkgpksllslelkddrpardmwvmetglllprataqdagkyychrgnltmsfhleitarpvlwhwllrtggwkvsavtlaylifclcslvgilhlqralvlrrkrkrmtdptrrfseqidno:16,3'ltr核苷酸序列tgaaagaccccacctgtaggtttggcaagctagcttaagtaacgccattttgcaaggcatggaaaaatacataactgagaatagagaagttcagatcaaggtcaggaacagatggaacagctgaatatgggccaaacaggatatctgtggtaagcagttcctgccccggctcagggccaagaacagatggaacagctgaatatgggccaaacaggatatctgtggtaagcagttcctgccccggctcagggccaagaacagatggtccccagatgcggtccagccctcagcagtttctagagaaccatcagatgtttccagggtgccccaaggacctgaaatgaccctgtgccttatttgaactaaccaatcagttcgcttctcgcttctgttcgcgcgcttctgctccccgagctcaataaaagagcccacaacccctcactcggggcgccagtcctccgattgactgagtcgcccgggtacccgtgtatccaataaaccctcttgcagttgcatccgacttgtggtctcgctgttccttgggagggtctcctctgagtgattgactacccgtcagcgggggtctttcaseqidno:17,表达载体构建体核苷酸序列—编码嵌合蛋白质以及5'和3'ltr序列以及额外的载体序列的核苷酸序列。tgaaagaccccacctgtaggtttggcaagctagcttaagtaacgccattttgcaaggcatggaaaaatacataactgagaatagaaaagttcagatcaaggtcaggaacagatggaacagctgaatatgggccaaacaggatatctgtggtaagcagttcctgccccggctcagggccaagaacagatggaacagctgaatatgggccaaacaggatatctgtggtaagcagttcctgccccggctcagggccaagaacagatggtccccagatgcggtccagccctcagcagtttctagagaaccatcagatgtttccagggtgccccaaggacctgaaatgaccctgtgccttatttgaactaaccaatcagttcgcttctcgcttctgttcgcgcgcttatgctccccgagctcaataaaagagcccacaacccctcactcggggcgccagtcctccgattgactgagtcgcccgggtacccgtgtatccaataaaccctcttgcagttgcatccgacttgtggtctcgctgttccttgggagggtctcctctgagtgattgactacccgtcagcgggggtctttcatttgggggctcgtccgggatcgggagacccctgcccagggaccaccgacccaccaccgggaggtaagctggccagcaacttatctgtgtctgtccgattgtctagtgtctatgactgattttatgcgcctgcgtcggtactagttagctaactagctctgtatctggcggacccgtggtggaactgacgagttcggaacacccggccgcaaccctgggagacgtcccagggacttcgggggccgtttttgtggcccgacctgagtcctaaaatcccgatcgtttaggactctttggtgcaccccccttagaggagggatatgtggttctggtaggagacgagaacctaaaacagttcccgcctccgtctgaatttttgctttcggtttgggaccgaagccgcgccgcgcgtcttgtctgctgcagcatcgttctgtgttgtctctgtctgactgtgtttctgtatttgtctgaaaatatgggcccgggctagcctgttaccactcccttaagtttgaccttaggtcactggaaagatgtcgagcggatcgctcacaaccagtcggtagatgtcaagaagagacgttgggttaccttctgctctgcagaatggccaacctttaacgtcggatggccgcgagacggcacctttaaccgagacctcatcacccaggttaagatcaaggtcttttcacctggcccgcatggacacccagaccaggtggggtacatcgtgacctgggaagccttggcttttgacccccctccctgggtcaagccctttgtacaccctaagcctccgcctcctcttcctccatccgccccgtctctcccccttgaacctcctcgttcgaccccgcctcgatcctccctttatccagccctcactccttctctaggcgcccccatatggccatatgagatcttatatggggcacccccgccccttgtaaacttccctgaccctgacatgacaagagttactaacagcccctctctccaagctcacttacaggctctctacttagtccagcacgaagtctggagacctctggcggcagcctaccaagaacaactggaccgaccggtggtacctcacccttaccgagtcggcgacacagtgtgggtccgccgacaccagactaagaacctagaacctcgctggaaaggaccttacacagtcctgctgaccacccccaccgccctcaaagtagacggcatcgcagcttggatacacgccgcccacgtgaaggctgccgaccccgggggtggaccatcctctagactgccatgctcgagggagtgcaggtggaaaccatctccccaggagacgggcgcaccttccccaagcgcggccagacctgcgtggtgcactacaccgggatgcttgaagatggaaagaaagttgattcctcccgggacagaaacaagccctttaagtttatgctaggcaagcaggaggtgatccgaggctgggaagaaggggttgcccagatgagtgtgggtcagagagccaaactgactatatctccagattatgcctatggtgccactgggcacccaggcatcatcccaccacatgccactctcgtcttcgatgtggagcttctaaaactggaatctggcggtggatccggagtcgacggatttggtgatgtcggtgctcttgagagtttgaggggaaatgcagatttggcttacatcctgagcatggagccctgtggccactgcctcattatcaacaatgtgaacttctgccgtgagtccgggctccgcacccgcactggctccaacatcgactgtgagaagttgcggcgtcgcttctcctcgctgcatttcatggtggaggtgaagggcgacctgactgccaagaaaatggtgctggctttgctggagctggcgcagcaggaccacggtgctctggactgctgcgtggtggtcattctctctcacggctgtcaggccagccacctgcagttcccaggggctgtctacggcacagatggatgccctgtgtcggtcgagaagattgtgaacatcttcaatgggaccagctgccccagcctgggagggaagcccaagctctttttcatccaggcctgtggtggggagcagaaagaccatgggtttgaggtggcctccacttcccctgaagacgagtcccctggcagtaaccccgagccagatgccaccccgttccaggaaggtttgaggaccttcgaccagctggacgccatatctagtttgcccacacccagtgacatctttgtgtcctactctactttcccaggttttgtttcctggagggaccccaagagtggctcctggtacgttgagaccctggacgacatctttgagcagtgggctcactctgaagacctgcagtccctcctgcttagggtcgctaatgctgtttcggtgaaagggatttataaacagatgcctggttgctttaatttcctccggaaaaaacttttctttaaaacatcagctagcagagccgagggcaggggaagtcttctaacatgcggggacgtggaggaaaatcccgggcccatgccacctcctcgcctcctcttcttcctcctcttcctcacccccatggaagtcaggcccgaggaacctctagtggtgaaggtggaagagggagataacgctgtgctgcagtgcctcaaggggacctcagatggccccactcagcagctgacctggtctcgggagtccccgcttaaacccttcttaaaactcagcctggggctgccaggcctgggaatccacatgaggcccctggccatctggcttttcatcttcaacgtctctcaacagatggggggcttctacctgtgccagccggggcccccctctgagaaggcctggcagcctggctggacagtcaatgtggagggcagcggggagctgttccggtggaatgtttcggacctaggtggcctgggctgtggcctgaagaacaggtcctcagagggccccagctccccttccgggaagctcatgagccccaagctgtatgtgtgggccaaagaccgccctgagatctgggagggagagcctccgtgtctcccaccgagggacagcctgaaccagagcctcagccaggacctcaccatggcccctggctccacactctggctgtcctgtggggtaccccctgactctgtgtccaggggccccctctcctggacccatgtgcaccccaaggggcctaagtcattgctgagcctagagctgaaggacgatcgcccggccagagatatgtgggtaatggagacgggtctgttgttgccccgggccacagctcaagacgctggaaagtattattgtcaccgtggcaacctgaccatgtcattccacctggagatcactgctcggccagtactatggcactggctgctgaggactggtggctggaaggtctcagctgtgactttggcttatctgatcttctgcctgtgttcccttgtgggcattcttcatcttcaaagagccctggtcctgaggaggaaaagaaagcgaatgactgaccccaccaggagattctaacgcgtcatcatcgatccggattagtccaatttgttaaagacaggatatcagtggtccaggctctagttttgactcaacaatatcaccagctgaagcctatagagtacgagccatagataaaataaaagattttatttagtctccagaaaaaggggggaatgaaagaccccacctgtaggtttggcaagctagcttaagtaacgccattttgcaaggcatggaaaaatacataactgagaatagagaagttcagatcaaggtcaggaacagatggaacagctgaatatgggccaaacaggatatctgtggtaagcagttcctgccccggctcagggccaagaacagatggaacagctgaatatgggccaaacaggatatctgtggtaagcagttcctgccccggctcagggccaagaacagatggtccccagatgcggtccagccctcagcagtttctagagaaccatcagatgtttccagggtgccccaaggacctgaaatgaccctgtgccttatttgaactaaccaatcagttcgcttctcgcttctgttcgcgcgcttctgctccccgagctcaataaaagagcccacaacccctcactcggggcgccagtcctccgattgactgagtcgcccgggtacccgtgtatccaataaaccctcttgcagttgcatccgacttgtggtctcgctgttccttgggagggtctcctctgagtgattgactacccgtcagcgggggtctttcacacatgcagcatgtatcaaaattaatttggttttttttcttaagtatttacattaaatggccatagtacttaaagttacattggcttccttgaaataaacatggagtattcagaatgtgtcataaatatttctaattttaagatagtatctccattggctttctactttttcttttatttttttttgtcctctgtcttccatttgttgttgttgttgtttgtttgtttgtttgttggttggttggttaatttttttttaaagatcctacactatagttcaagctagactattagctactctgtaacccagggtgaccttgaagtcatgggtagcctgctgttttagccttcccacatctaagattacaggtatgagctatcatttttggtatattgattgattgattgattgatgtgtgtgtgtgtgattgtgtttgtgtgtgtgactgtgaaaatgtgtgtatgggtgtgtgtgaatgtgtgtatgtatgtgtgtgtgtgagtgtgtgtgtgtgtgtgtgcatgtgtgtgtgtgtgactgtgtctatgtgtatgactgtgtgtgtgtgtgtgtgtgtgtgtgtgtgtgtgtgtgtgtgtgtgttgtgaaaaaatattctatggtagtgagagccaacgctccggctcaggtgtcaggttggtttttgagacagagtctttcacttagcttggaattcactggccgtcgttttacaacgtcgtgactgggaaaaccctggcgttacccaacttaatcgccttgcagcacatccccctttcgccagctggcgtaatagcgaagaggcccgcaccgatcgcccttcccaacagttgcgcagcctgaatggcgaatggcgcctgatgcggtattttctccttacgcatctgtgcggtatttcacaccgcatatggtgcactctcagtacaatctgctctgatgccgcatagttaagccagccccgacacccgccaacacccgctgacgcgccctgacgggcttgtctgctcccggcatccgcttacagacaagctgtgaccgtctccgggagctgcatgtgtcagaggttttcaccgtcatcaccgaaacgcgcgatgacgaaagggcctcgtgatacgcctatttttataggttaatgtcatgataataatggtttcttagacgtcaggtggcacttttcggggaaatgtgcgcggaacccctatttgtttatttttctaaatacattcaaatatgtatccgctcatgagacaataaccctgataaatgcttcaataatattgaaaaaggaagagtatgagtattcaacatttccgtgtcgcccttattcccttttttgcggcattttgccttcctgtttttgctcacccagaaacgctggtgaaagtaaaagatgctgaagatcagttgggtgcacgagtgggttacatcgaactggatctcaacagcggtaagatccttgagagttttcgccccgaagaacgttttccaatgatgagcacttttaaagttctgctatgtggcgcggtattatcccgtattgacgccgggcaagagcaactcggtcgccgcatacactattctcagaatgacttggttgagtactcaccagtcacagaaaagcatcttacggatggcatgacagtaagagaattatgcagtgctgccataaccatgagtgataacactgcggccaacttacttctgacaacgatcggaggaccgaaggagctaaccgcttttttgcacaacatgggggatcatgtaactcgccttgatcgttgggaaccggagctgaatgaagccataccaaacgacgagcgtgacaccacgatgcctgtagcaatggcaacaacgttgcgcaaactattaactggcgaactacttactctagcttcccggcaacaattaatagactggatggaggcggataaagttgcaggaccacttctgcgctcggcccttccggctggctggtttattgctgataaatctggagccggtgagcgtgggtctcgcggtatcattgcagcactggggccagatggtaagccctcccgtatcgtagttatctacacgacggggagtcaggcaactatggatgaacgaaatagacagatcgctgagataggtgcctcactgattaagcattggtaactgtcagaccaagtttactcatatatactttagattgatttaaaacttcatttttaatttaaaaggatctaggtgaagatcctttttgataatctcatgaccaaaatcccttaacgtgagttttcgttccactgagcgtcagaccccgtagaaaagatcaaaggatcttcttgagatcctttttttctgcgcgtaatctgctgcttgcaaacaaaaaaaccaccgctaccagcggtggtttgtttgccggatcaagagctaccaactctttttccgaaggtaactggcttcagcagagcgcagataccaaatactgtccttctagtgtagccgtagttaggccaccacttcaagaactctgtagcaccgcctacatacctcgctctgctaatcctgttaccagtggctgctgccagtggcgataagtcgtgtcttaccgggttggactcaagacgatagttaccggataaggcgcagcggtcgggctgaacggggggttcgtgcacacagcccagcttggagcgaacgacctacaccgaactgagatacctacagcgtgagcattgagaaagcgccacgcttcccgaagggagaaaggcggacaggtatccggtaagcggcagggtcggaacaggagagcgcacgagggagcttccagggggaaacgcctggtatctttatagtcctgtcgggtttcgccacctctgacttgagcgtcgatttttgtgatgctcgtcaggggggcggagcctatggaaaaacgccagcaacgcggcctttttacggttcctggccttttgctggccttttgctcacatgttctttcctgcgttatcccctgattctgtggataaccgtattaccgcctttgagtgagctgataccgctcgccgcagccgaacgaccgagcgcagcgagtcagtgagcgaggaagcggaagagcgcccaatacgcaaaccgcctctccccgcgcgttggccgattcattaatgcagctggcacgacaggtttcccgactggaaagcgggcagtgagcgcaacgcaattaatgtgagttagctcactcattaggcaccccaggctttacactttatgcttccggctcgtatgttgtgtggaattgtgagcggataacaatttcacacaggaaacagctatgaccatgattacgccaagctttgctcttaggagtttcctaatacatcccaaactcaaatatataaagcatttgacttgttctatgccctagggggcggggggaagctaagccagctttttttaacatttaaaatgttaattccattttaaatgcacagatgtttttatttcataagggtttcaatgtgcatgaatgctgcaatattcctgttaccaaagctagtataaataaaaatagataaacgtggaaattacttagagtttctgtcattaacgtttccttcctcagttgacaacataaatgcgctgctgagcaagccagtttgcatctgtcaggatcaatttcccattatgccagtcatattaattactagtcaattagttgatttttatttttgacatatacatgtgaaseqidno:18,(具有xhoi/sali接头的fv'fvls的核苷酸序列,(在fv'中摆动密码子小写))ctcgagggcgtccaagtcgaaaccattagtcccggcgatggcagaacatttcctaaaaggggacaaacatgtgtcgtccattatacaggcatgttggaggacggcaaaaaggtggacagtagtagagatcgcaataaacctttcaaattcatgttgggaaaacaagaagtcattaggggatgggaggagggcgtggctcaaatgtccgtcggccaacgcgctaagctcaccatcagccccgactacgcatacggcgctaccggacatcccggaattattccccctcacgctaccttggtgtttgacgtcgaactgttgaagctcgaagtcgagggagtgcaggtggaaaccatctccccaggagacgggcgcaccttccccaagcgcggccagacctgcgtggtgcactacaccgggatgcttgaagatggaaagaaagttgattcctcccgggacagaaacaagccctttaagtttatgctaggcaagcaggaggtgatccgaggctgggaagaaggggttgcccagatgagtgtgggtcagagagccaaactgactatatctccagattatgcctatggtgccactgggcacccaggcatcatcccaccacatgccactctcgtcttcgatgtggagcttctaaaactggaatctggcggtggatccggagtcgagseqidno:19,(fv'fvls氨基酸序列)glyvalglnvalgluthrileserproglyaspglyargthrpheprolysargglyglnthrcysvalvalhistyrthrglymetleugluaspglylyslysvalaspserserargaspargasnlysprophelysphemetleuglylysglngluvalileargglytrpglugluglyvalalaglnmetservalglyglnargalalysleuthrileserproasptyralatyrglyalathrglyhisproglyileileproprohisalathrleuvalpheaspvalgluleuleulysleuglu(valglu)glyvalglnvalgluthrileserproglyaspglyargthrpheprolysargglyglnthrcysvalvalhistyrthrglymetleugluaspglylyslysvalaspserserargaspargasnlysprophelysphemetleuglylysglngluvalileargglytrpglugluglyvalalaglnmetservalglyglnargalalysleuthrileserproasptyralatyrglyalathrglyhisproglyileileproprohisalathrleuvalpheaspvalgluleuleulysleuglu-serglyglyglyserglyseqidno:20,fkbp12v36(res.2-108)sgggsg接头(6个aa)δcasp9(res.135—416)atgctcgagggagtgcaggtggagactatctccccaggagacgggcgcaccttccccaagcgcggccagacctgcgtggtgcactacaccgggatgcttgaagatggaaagaaagttgattcctcccgggacagaaacaagccctttaagtttatgctaggcaagcaggaggtgatccgaggctgggaagaaggggttgcccagatgagtgtgggtcagagagccaaactgactatatctccagattatgcctatggtgccactgggcacccaggcatcatcccaccacatgccactctcgtcttcgatgtggagcttctaaaactggaaagtcgacggatttggtgatgtcggtgctcttgagagtttgaggggaaatgcagatttggcttacatcctgagcatggagccctgtggccactgcctcattatcaacaatgtgaacttctgccgtgagtccgggctccgcacccgcactggctccaacatcgactgtgagaagttgcggcgtcgcttctcctcgctgcatttcatggtggaggtgaagggcgacctgactgccaagaaaatggtgctggctttgctggagctggcgcggcaggaccacggtgctctggactgctgcgtggtggtcattctctctcacggctgtcaggccagccacctgcagttcccaggggctgtctacggcacagatggatgccctgtgtcggtcgagaagattgtgaacatcttcaatgggaccagctgccccagcctgggagggaagcccaagctctttttcatccaggcctgtggtggggagcagaaagaccatgggtttgaggtggcctccacttcccctgaagacgagtcccctggcagtaaccccgagccagatgccaccccgttccaggaaggtttgaggaccttcgaccagctggacgccatatctagtttgcccacacccagtgacatctttgtgtcctactctactttcccaggttttgtttcctggagggaccccaagagtggctcctggtacgttgagaccctggacgacatctttgagcagtgggctcactctgaagacctgcagtccctcctgcttagggtcgctaatgctgtttcggtgaaagggatttataaacagatgcctggttgctttaatttcctccggaaaaaacttttctttaaaacatcaseqidno:21,fkbp12v36(res.2-108)gvqvetispgdgrtfpkrgqtcvvhytgmledgkkvdssrdrnkpfkfmlgkqevirgweegvaqmsvgqrakltispdyaygatghpgiipphatlvfdvellkleseqidno:22,δcasp9(res.135-416)gfgdvgaleslrgnadlayilsmepcghcliinnvnfcresglrtrtgsnidceklrrrfsslhfmvevkgdltakkmvlallelarqdhgaldccvvvilshgcqashlqfpgavygtdgcpvsvekivnifngtscpslggkpklffiqacggeqkdhgfevastspedespgsnpepdatpfqeglrtfdqldaisslptpsdifvsystfpgfvswrdpksgswyvetlddifeqwahsedlqslllrvanavsvkgiykqmpgcfnflrkklffktsseqidno:23,δcasp9(res.135-416)d330a,核苷酸序列ggatttggtgatgtcggtgctcttgagagtttgaggggaaatgcagatttggcttacatcctgagcatggagccctgtggccactgcctcattatcaacaatgtgaacttctgccgtgagtccgggctccgcacccgcactggctccaacatcgactgtgagaagttgcggcgtcgcttctcctcgctgcatttcatggtggaggtgaagggcgacctgactgccaagaaaatggtgctggctttgctggagctggcgcggcaggaccacggtgctctggactgctgcgtggtggtcattctctctcacggctgtcaggccagccacctgcagttcccaggggctgtctacggcacagatggatgccctgtgtcggtcgagaagattgtgaacatcttcaatgggaccagctgccccagcctgggagggaagcccaagctctttttcatccaggcctgtggtggggagcagaaagaccatgggtttgaggtggcctccacttcccctgaagacgagtcccctggcagtaaccccgagccagatgccaccccgttccaggaaggtttgaggaccttcgaccagctggccgccatatctagtttgcccacacccagtgacatctttgtgtcctactctactttcccaggttttgtttcctggagggaccccaagagtggctcctggtacgttgagaccctggacgacatctttgagcagtgggctcactctgaagacctgcagtccctcctgcttagggtcgctaatgctgtttcggtgaaagggatttataaacagatgcctggttgctttaatttcctccggaaaaaacttttctttaaaacatcaseqidno:24,δcasp9(res.135-416)d330a,氨基酸序列gfgdvgaleslrgnadlayilsmepcghcliinnvnfcresglrtrtgsnidceklrrrfsslhfmvevkgdltakkmvlallelarqdhgaldccvvvilshgcqashlqfpgavygtdgcpvsvekivnifngtscpslggkpklffiqacggeqkdhgfevastspedespgsnpepdatpfqeglrtfdqlaaisslptpsdifvsystfpgfvswrdpksgswyvetlddifeqwahsedlqslllrvanavsvkgiykqmpgcfnflrkklffktsseqidno:25,δcasp9(res.135-416)n405q核苷酸序列ggatttggtgatgtcggtgctcttgagagtttgaggggaaatgcagatttggcttacatcctgagcatggagccctgtggccactgcctcattatcaacaatgtgaacttctgccgtgagtccgggctccgcacccgcactggctccaacatcgactgtgagaagttgcggcgtcgcttctcctcgctgcatttcatggtggaggtgaagggcgacctgactgccaagaaaatggtgctggctttgctggagctggcgcggcaggaccacggtgctctggactgctgcgtggtggtcattctctctcacggctgtcaggccagccacctgcagttcccaggggctgtctacggcacagatggatgccctgtgtcggtcgagaagattgtgaacatcttcaatgggaccagctgccccagcctgggagggaagcccaagctctttttcatccaggcctgtggtggggagcagaaagaccatgggtttgaggtggcctccacttcccctgaagacgagtcccctggcagtaaccccgagccagatgccaccccgttccaggaaggtttgaggaccttcgaccagctggacgccatatctagtttgcccacacccagtgacatctttgtgtcctactctactttcccaggttttgtttcctggagggaccccaagagtggctcctggtacgttgagaccctggacgacatctttgagcagtgggctcactctgaagacctgcagtccctcctgcttagggtcgctaatgctgtttcggtgaaagggatttataaacagatgcctggttgctttcagttcctccggaaaaaacttttctttaaaacatcaseqidno:26,δcasp9(res.135-416)n405q氨基酸序列gfgdvgaleslrgnadlayilsmepcghcliinnvnfcresglrtrtgsnidceklrrrfsslhfmvevkgdltakkmvlallelarqdhgaldccvvvilshgcqashlqfpgavygtdgcpvsvekivnifngtscpslggkpklffiqacggeqkdhgfevastspedespgsnpepdatpfqeglrtfdqldaisslptpsdifvsystfpgfvswrdpksgswyvetlddifeqwahsedlqslllrvanavsvkgiykqmpgcfqflrkklffktsseqidno:27,δcasp9(res.135-416)d330an405q核苷酸序列ggatttggtgatgtcggtgctcttgagagtttgaggggaaatgcagatttggcttacatcctgagcatggagccctgtggccactgcctcattatcaacaatgtgaacttctgccgtgagtccgggctccgcacccgcactggctccaacatcgactgtgagaagttgcggcgtcgcttctcctcgctgcatttcatggtggaggtgaagggcgacctgactgccaagaaaatggtgctggctttgctggagctggcgcggcaggaccacggtgctctggactgctgcgtggtggtcattctctctcacggctgtcaggccagccacctgcagttcccaggggctgtctacggcacagatggatgccctgtgtcggtcgagaagattgtgaacatcttcaatgggaccagctgccccagcctgggagggaagcccaagctctttttcatccaggcctgtggtggggagcagaaagaccatgggtttgaggtggcctccacttcccctgaagacgagtcccctggcagtaaccccgagccagatgccaccccgttccaggaaggtttgaggaccttcgaccagctggccgccatatctagtttgcccacacccagtgacatctttgtgtcctactctactttcccaggttttgtttcctggagggaccccaagagtggctcctggtacgttgagaccctggacgacatctttgagcagtgggctcactctgaagacctgcagtccctcctgcttagggtcgctaatgctgtttcggtgaaagggatttataaacagatgcctggttgctttcagttcctccggaaaaaacttttctttaaaacatcaseqidno:28,δcasp9(res.135-416)d330an405q氨基酸序列gfgdvgaleslrgnadlayilsmepcghcliinnvnfcresglrtrtgsnidceklrrrfsslhfmvevkgdltakkmvlallelarqdhgaldccvvvilshgcqashlqfpgavygtdgcpvsvekivnifngtscpslggkpklffiqacggeqkdhgfevastspedespgsnpepdatpfqeglrtfdqlaaisslptpsdifvsystfpgfvswrdpksgswyvetlddifeqwahsedlqslllrvanavsvkgiykqmpgcfqflrkklffktsseqidno:29,fkbpv36(fv1)核苷酸序列ggcgttcaagtagaaacaatcagcccaggagacggaaggactttccccaaacgaggccaaacatgcgtagttcattatactgggatgctcgaagatggaaaaaaagtagatagtagtagagaccgaaacaaaccatttaaatttatgttgggaaaacaagaagtaataaggggctgggaagaaggtgtagcacaaatgtctgttggccagcgcgcaaaactcacaatttctcctgattatgcttacggagctaccggccaccccggcatcataccccctcatgccacactggtgtttgacgtcgaattgctcaaactggaaseqidno:30,fkbpv36(fv1)氨基酸序列gvqvetispgdgrtfpkrgqtcvvhytgmledgkkvdssrdrnkpfkfmlgkqevirgweegvaqmsvgqrakltispdyaygatghpgiipphatlvfdvellkleseqidno:31,fkbpv36(fv2)核苷酸序列ggagtgcaggtggagacgattagtcctggggatgggagaacctttccaaagcgcggtcagacctgtgttgtccactacaccggtatgctggaggacgggaagaaggtggactcttcacgcgatcgcaataagcctttcaagttcatgctcggcaagcaggaggtgatccgggggtgggaggagggcgtggctcagatgtcggtcgggcaacgagcgaagcttaccatctcacccgactacgcgtatggggcaacggggcatccgggaattatccctccccacgctacgctcgtattcgatgtggagctcttgaagcttgagseqidno:32,fkbpv36(fv2)氨基酸序列gvqvetispgdgrtfpkrgqtcvvhytgmledgkkvdssrdrnkpfkfmlgkqevirgweegvaqmsvgqrakltispdyaygatghpgiipphatlvfdvellkleseqidno:33,δcd19核苷酸序列atgccccctcctagactgctgtttttcctgctctttctcaccccaatggaagttagacctgaggaaccactggtcgttaaagtggaagaaggtgataatgctgtcctccaatgccttaaagggaccagcgacggaccaacgcagcaactgacttggagccgggagtcccctctcaagccgtttctcaagctgtcacttggcctgccaggtcttggtattcacatgcgcccccttgccatttggctcttcatattcaatgtgtctcaacaaatgggtggattctacctttgccagcccggccccccttctgagaaagcttggcagcctggatggaccgtcaatgttgaaggctccggtgagctgtttagatggaatgtgagcgaccttggcggactcggttgcggactgaaaaataggagctctgaaggaccctcttctccctccggtaagttgatgtcacctaagctgtacgtgtgggccaaggaccgccccgaaatctgggagggcgagcctccatgcctgccgcctcgcgattcactgaaccagtctctgtcccaggatctcactatggcgcccggatctactctttggctgtcttgcggcgttcccccagatagcgtgtcaagaggacctctgagctggacccacgtacaccctaagggccctaagagcttgttgagcctggaactgaaggacgacagacccgcacgcgatatgtgggtaatggagaccggccttctgctccctcgcgctaccgcacaggatgcagggaaatactactgtcatagagggaatctgactatgagctttcatctcgaaattacagcacggcccgttctttggcattggctcctccggactggaggctggaaggtgtctgccgtaacactcgcttacttgattttttgcctgtgtagcctggttgggatcctgcatcttcagcgagcccttgtattgcgccgaaaaagaaaacgaatgactgaccctacacgacgattctgaseqidno:34,δcd19氨基酸序列mppprllffllfltpmevrpeeplvvkveegdnavlqclkgtsdgptqqltwsresplkpflklslglpglgihmrplaiwlfifnvsqqmggfylcqpgppsekawqpgwtvnvegsgelfrwnvsdlgglgcglknrssegpsspsgklmspklyvwakdrpeiwegeppclpprdslnqslsqdltmapgstlwlscgvppdsvsrgplswthvhpkgpksllslelkddrpardmwvmetglllprataqdagkyychrgnltmsfhleitarpvlwhwllrtggwkvsavtlaylifclcslvgilhlqralvlrrkrkrmtdptrrf*密码子优化的icasp9-n405q-2a-δcd19序列:(在核苷酸序列名称后的.co指示它是密码子优化的(或由密码子优化的核苷酸序列编码的氨基酸序列)。seqidno:35,fkbpv36.co(fv3)核苷酸序列atgctggagggagtgcaggtggagactattagccccggagatggcagaacattccccaaaagaggacagacttgcgtcgtgcattatactggaatgctggaagacggcaagaaggtggacagcagccgggaccgaaacaagcccttcaagttcatgctggggaagcaggaagtgatccggggctgggaggaaggagtcgcacagatgtcagtgggacagagggccaaactgactattagcccagactacgcttatggagcaaccggccaccccgggatcattccccctcatgctacactggtcttcgatgtggagctgctgaagctggaaseqidno:36,fkbpv36.co(fv3)氨基酸序列mlegvqvetispgdgrtfpkrgqtcvvhytgmledgkkvdssrdrnkpfkfmlgkqevirgweegvaqmsvgqrakltispdyaygatghpgiipphatlvfdvellkleseqidno:37,接头.co核苷酸序列agcggaggaggatccggaseqidno:38,接头.co氨基酸序列sgggsgseqidno:39,胱天蛋白酶-9.co核苷酸序列gtggacgggtttggagatgtgggagccctggaatccctgcggggcaatgccgatctggcttacatcctgtctatggagccttgcggccactgtctgatcattaacaatgtgaacttctgcagagagagcgggctgcggaccagaacaggatccaatattgactgtgaaaagctgcggagaaggttctctagtctgcactttatggtcgaggtgaaaggcgatctgaccgctaagaaaatggtgctggccctgctggaactggctcggcaggaccatggggcactggattgctgcgtggtcgtgatcctgagtcacggctgccaggcttcacatctgcagttccctggggcagtctatggaactgacggctgtccagtcagcgtggagaagatcgtgaacatcttcaacggcacctcttgcccaagtctgggcgggaagcccaaactgttctttattcaggcctgtggaggcgagcagaaagatcacggcttcgaagtggctagcacctcccccgaggacgaatcacctggaagcaaccctgagccagatgcaacccccttccaggaaggcctgaggacatttgaccagctggatgccatctcaagcctgcccacaccttctgacattttcgtctcttacagtactttccctggatttgtgagctggcgcgatccaaagtcaggcagctggtacgtggagacactggacgatatctttgagcagtgggcccattctgaagacctgcagagtctgctgctgcgagtggccaatgctgtctctgtgaaggggatctacaaacagatgccaggatgcttccagtttctgagaaagaaactgttctttaagacctccgcatctagggccseqidno:40,胱天蛋白酶-9.co氨基酸序列vdgfgdvgaleslrgnadlayilsmepcghcliinnvnfcresglrtrtgsnidceklrrrfsslhfmvevkgdltakkmvlallelarqdhgaldccvvvilshgcqashlqfpgavygtdgcpvsvekivnifngtscpslggkpklffiqacggeqkdhgfevastspedespgsnpepdatpfqeglrtfdqldaisslptpsdifvsystfpgfvswrdpksgswyvetlddifeqwahsedlqslllrvanavsvkgiykqmpgcfqflrkklffktsasraseqidno:41,接头.co核苷酸序列ccgcggseqidno:42,接头.co氨基酸序列prseqidno:42:t2a.co核苷酸序列gaaggccgagggagcctgctgacatgtggcgatgtggaggaaaacccaggaccaseqidno:43:t2a.co氨基酸序列egrgslltcgdveenpgpseqidno:43:δcd19.co核苷酸序列atgccaccacctcgcctgctgttctttctgctgttcctgacacctatggaggtgcgacctgaggaaccactggtcgtgaaggtcgaggaaggcgacaatgccgtgctgcagtgcctgaaaggcacttctgatgggccaactcagcagctgacctggtccagggagtctcccctgaagccttttctgaaactgagcctgggactgccaggactgggaatccacatgcgccctctggctatctggctgttcatcttcaacgtgagccagcagatgggaggattctacctgtgccagccaggaccaccatccgagaaggcctggcagcctggatggaccgtcaacgtggaggggtctggagaactgtttaggtggaatgtgagtgacctgggaggactgggatgtgggctgaagaaccgctcctctgaaggcccaagttcaccctcagggaagctgatgagcccaaaactgtacgtgtgggccaaagatcggcccgagatctgggagggagaacctccatgcctgccacctagagacagcctgaatcagagtctgtcacaggatctgacaatggcccccgggtccactctgtggctgtcttgtggagtcccacccgacagcgtgtccagaggccctctgtcctggacccacgtgcatcctaaggggccaaaaagtctgctgtcactggaactgaaggacgatcggcctgccagagacatgtgggtcatggagactggactgctgctgccacgagcaaccgcacaggatgctggaaaatactattgccaccggggcaatctgacaatgtccttccatctggagatcactgcaaggcccgtgctgtggcactggctgctgcgaaccggaggatggaaggtcagtgctgtgacactggcatatctgatcttttgcctgtgctccctggtgggcattctgcatctgcagagagccctggtgctgcggagaaagagaaagagaatgactgacccaacaagaaggttttgaseqidno:43:δcd19.co氨基酸序列mppprllffllfltpmevrpeeplvvkveegdnavlqclkgtsdgptqqltwsresplkpflklslglpglgihmrplaiwlfifnvsqqmggfylcqpgppsekawqpgwtvnvegsgelfrwnvsdlgglgcglknrssegpsspsgklmspklyvwakdrpeiwegeppclpprdslnqslsqdltmapgstlwlscgvppdsvsrgplswthvhpkgpksllslelkddrpardmwvmetglllprataqdagkyychrgnltmsfhleitarpvlwhwllrtggwkvsavtlaylifclcslvgilhlqralvlrrkrkrmtdptrrf*表6:胱天蛋白酶-9变体的另外示例编码多肽的质粒插入物的部分序列,其编码由2a接头隔开的诱导型胱天蛋白酶-9多肽和结合cd19的嵌合抗原受体,其中两个胱天蛋白酶-9多肽和嵌合抗原受体在翻译期间隔开。本文所提供的嵌合抗原受体的示例可通过包含共刺激多肽(例如但不限于cd28、4-1bb和ox40)来进一步修饰。本文所提供的诱导型胱天蛋白酶-9多肽可被诱导型修饰的胱天蛋白酶-9多肽(例如本文所提供的那些)取代。seqidno:130fkbpv36atgctggagggagtgcaggtggagactattagccccggagatggcagaacattccccaaaagaggacagacttgcgtcgtgcattatactggaatgctggaagacggcaagaaggtggacagcagccgggaccgaaacaagcccttcaagttcatgctggggaagcaggaagtgatccggggctgggaggaaggagtcgcacagatgtcagtgggacagagggccaaactgactattagcccagactacgcttatggagcaaccggccaccccgggatcattccccctcatgctacactggtcttcgatgtggagctgctgaagctggaaseqidno:131fkbpv36mlegvqvetispgdgrtfpkrgqtcvvhytgmledgkkvdssrdrnkpfkfmlgkqevirgweegvaqmsvgqrakltispdyaygatghpgiipphatlvfdvellkleseqidno:132接头agcggaggaggatccggaseqidno:133接头sgggsgseqidno:134胱天蛋白酶-9gtggacgggtttggagatgtgggagccctggaatccctgcggggcaatgccgatctggcttacatcctgtctatggagccttgcggccactgtctgatcattaacaatgtgaacttctgcagagagagcgggctgcggaccagaacaggatccaatattgactgtgaaaagctgcggagaaggttctctagtctgcactttatggtcgaggtgaaaggcgatctgaccgctaagaaaatggtgctggccctgctggaactggctcggcaggaccatggggcactggattgctgcgtggtcgtgatcctgagtcacggctgccaggcttcacatctgcagttccctggggcagtctatggaactgacggctgtccagtcagcgtggagaagatcgtgaacatcttcaacggcacctcttgcccaagtctgggcgggaagcccaaactgttctttattcaggcctgtggaggcgagcagaaagatcacggcttcgaagtggctagcacctcccccgaggacgaatcacctggaagcaaccctgagccagatgcaacccccttccaggaaggcctgaggacatttgaccagctggatgccatctcaagcctgcccacaccttctgacattttcgtctcttacagtactttccctggatttgtgagctggcgcgatccaaagtcaggcagctggtacgtggagacactggacgatatctttgagcagtgggcccattctgaagacctgcagagtctgctgctgcgagtggccaatgctgtctctgtgaaggggatctacaaacagatgccaggatgcttcaactttctgagaaagaaactgttctttaagacctccgcatctagggccseqidno:135胱天蛋白酶-9vdgfgdvgaleslrgnadlayilsmepcghcliinnvnfcresglrtrtgsnidceklrrrfsslhfmvevkgdltakkmvlallelarqdhgaldccvvvilshgcqashlqfpgavygtdgcpvsvekivnifngtscpslggkpklffiqacggeqkdhgfevastspedespgsnpepdatpfqeglrtfdqldaisslptpsdifvsystfpgfvswrdpksgswyvetlddifeqwahsedlqslllrvanavsvkgiykqmpgcfnflrkklffktsasraseqidno:136接头ccgcggseqidno:137接头prseqidno:138t2agaaggccgagggagcctgctgacatgtggcgatgtggaggaaaacccaggaccaseqidno:139t2aegrgslltcgdveenpgpseqidno:140接头ccatggseqidno:141接头pwseqidno:142信号肽atggagtttggactttcttggttgtttttggtggcaattctgaagggtgtccagtgtagcaggseqidno:143信号肽mefglswlflvailkgvqcsrseqidno:144fmc63可变轻链(抗cd19)gacatccagatgacacagactacatcctccctgtctgcctctctgggagacagagtcaccatcagttgcagggcaagtcaggacattagtaaatatttaaattggtatcagcagaaaccagatggaactgttaaactcctgatctaccatacatcaagattacactcaggagtcccatcaaggttcagtggcagtgggtctggaacagattattctctcaccattagcaacctggagcaagaagatattgccacttacttttgccaacagggtaatacgcttccgtacacgttcggaggggggactaagttggaaataacaseqidno:145fmc63可变轻链(抗cd19)diqmtqttsslsaslgdrvtiscrasqdiskylnwyqqkpdgtvklliyhtsrlhsgvpsrfsgsgsgtdysltisnleqediatyfcqqgntlpytfgggtkleitseqidno:146柔性接头ggcggaggaagcggaggtgggggcseqidno:147柔性接头gggsggggseqidno:148fmc63可变重链(抗cd19)gaggtgaaactgcaggagtcaggacctggcctggtggcgccctcacagagcctgtccgtcacatgcactgtctcaggggtctcattacccgactatggtgtaagctggattcgccagcctccacgaaagggtctggagtggctgggagtaatatggggtagtgaaaccacatactataattcagctctcaaatccagactgaccatcatcaaggacaactccaagagccaagttttcttaaaaatgaacagtctgcaaactgatgacacagccatttactactgtgccaaacattattactacggtggtagctatgctatggactactggggtcaaggaacctcagtcaccgtctcctcaseqidno:149fmc63可变重链(抗cd19)evklqesgpglvapsqslsvtctvsgvslpdygvswirqpprkglewlgviwgsettyynsalksrltiikdnsksqvflkmnslqtddtaiyycakhyyyggsyamdywgqgtsvtvssseqidno:150接头ggatccseqidno:151接头gsseqidno:152cd34最小表位gaacttcctactcaggggactttctcaaacgttagcacaaacgtaagtseqidno:153cd34最小表位elptqgtfsnvstnvsseqidno:154cd8α茎结构域cccgccccaagaccccccacacctgcgccgaccattgcttctcaacccctgagtttgagacccgaggcctgccggccagctgccggcggggccgtgcatacaagaggactcgatttcgcttgcgacseqidno:155cd8α茎结构域paprpptpaptiasqplslrpeacrpaaggavhtrgldfacdseqidno:156cd8α跨膜结构域atctatatctgggcacctctcgctggcacctgtggagtccttctgctcagcctggttattactctgtactgtaatcaccggaatcgccgccgcgtttgtaagtgtcccaggseqidno:157cd8α跨膜结构域iyiwaplagtcgvlllslvitlycnhrnrrrvckcprseqidno:158接头gtcgacseqidno:159接头vdseqidno:160cd3ζagagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgcseqidno:161cd3ζrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr下面提供了编码结合her2/neu的嵌合抗原受体的质粒插入物的示例。嵌合抗原受体可通过包含共刺激多肽(例如但不限于cd28、ox40和4-1bb)来进一步修饰。seqidno:162信号肽atggagtttggactttcttggttgtttttggtggcaattctgaagggtgtccagtgtagcaggseqidno:163信号肽mefglswlflvailkgvqcsrseqidno:164frp5可变轻链(抗her2)gacatccaattgacacaatcacacaaatttctctcaacttctgtaggagacagagtgagcataacctgcaaagcatcccaggacgtgtacaatgctgtggcttggtaccaacagaagcctggacaatccccaaaattgctgatttattctgcctctagtaggtacactggggtaccttctcggtttacgggctctgggtccggaccagatttcacgttcacaatcagttccgttcaagctgaagacctcgctgtttatttttgccagcagcacttccgaaccccttttacttttggctcaggcactaagttggaaatcaaggctttgseqidno:165frp5可变轻链(抗her2)diqltqshkflstsvgdrvsitckasqdvynavawyqqkpgqspklliysassrytgvpsrftgsgsgpdftftissvqaedlavyfcqqhfrtpftfgsgtkleikalseqidno:166柔性接头ggcggaggaagcggaggtgggggcseqidno:167柔性接头gggsggggseqidno:168frp5可变重链(抗her2/neu)gaagtccaattgcaacagtcaggccccgaattgaaaaagcccggcgaaacagtgaagatatcttgtaaagcctccggttacccttttacgaactatggaatgaactgggtcaaacaagcccctggacagggattgaagtggatgggatggatcaatacatcaacaggcgagtctaccttcgcagatgatttcaaaggtcgctttgacttctcactggagaccagtgcaaataccgcctaccttcagattaacaatcttaaaagcgaggatatggcaacctacttttgcgcaagatgggaagtttatcacgggtacgtgccatactggggacaaggaacgacagtgacagttagtagcseqidno:169frp5可变重链(抗her2/neu)evqlqqsgpelkkpgetvkisckasgypftnygmnwvkqapgqglkwmgwintstgestfaddfkgrfdfsletsantaylqinnlksedmatyfcarwevyhgyvpywgqgttvtvssseqidno:170接头ggatccseqidno:171接头gsseqidno:172cd34最小表位gaacttcctactcaggggactttctcaaacgttagcacaaacgtaagtseqidno:173cd34最小表位elptqgtfsnvstnvsseqidno:174cd8α茎cccgccccaagaccccccacacctgcgccgaccattgcttctcaacccctgagtttgagacccgaggcctgccggccagctgccggcggggccgtgcatacaagaggactcgatttcgcttgcgacseqidno:175cd8α茎paprpptpaptiasqplslrpeacrpaaggavhtrgldfacdseqidno:176cd8α跨膜区atctatatctgggcacctctcgctggcacctgtggagtccttctgctcagcctggttattactctgtactgtaatcaccggaatcgccgccgcgtttgtaagtgtcccaggseqidno:177cd8α跨膜区iyiwaplagtcgvlllslvitlycnhrnrrrvckcprseqidno:178接头ctcgagseqidno:179接头leseqidno:180cd3ζ胞质结构域agagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgcseqidno:181cd3ζ胞质结构域rvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr另外的序列seqidno:182,cd28ntttctgggtactggttgtagtcggtggcgtacttgcttgttattctcttcttgttaccgtagccttcattatattctgggtccgatcaaagcgctcaagactcctccattccgattatatgaacatgacacctcgccgacctggtcctacacgcaaacattatcaaccctacgcacccccccgagacttcgctgcttatcgatccseqidno:183,cd28aafwvlvvvggvlacysllvtvafiifwvrskrsrllhsdymnmtprrpgptrkhyqpyapprdfaayrsseqidno:184,ox40ntgttgccgccatcctgggcctgggcctggtgctggggctgctgggccccctggccatcctgctggccctgtacctgctccgggaccagaggctgccccccgatgcccacaagccccctgggggaggcagtttccggacccccatccaagaggagcaggccgacgcccactccaccctggccaagatcseqidno:185,ox40aavaailglglvlgllgplaillalyllrrdqrlppdahkppgggsfrtpiqeeqadahstlakiseqidno:186,4-1bbntagtgtagttaaaagaggaagaaaaaagttgctgtatatatttaaacaaccatttatgagaccagtgcaaaccacccaagaagaagacggatgttcatgcagattcccagaagaagaagaaggaggatgtgaattgseqidno:187,4-1bbaasvvkrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelmyd88/cd40嵌合抗原受体和嵌合刺激分子的表达以下实施例讨论了如本申请中所提供的与myd88/cd40嵌合抗原受体和嵌合刺激分子有关的组合物和方法。还包括与基于胱天蛋白酶-9的安全开关有关的组合物和方法,以及其在表达myd88/cd40嵌合抗原受体或嵌合刺激分子的细胞中的用途。实施例11:myd88/cd40嵌合抗原受体的设计和活性mc-car构建体的设计基于来自诱导型myd88/cd40实验的活化数据,检查了mc信号传导在car分子中代替常规内结构域(endodomain)(例如cd28和4-1bb)的潜力。将mc(不结合ap1903的fkbpv36区)亚克隆到psca.ζ中以效仿cd28内结构域的位置。针对三种构建体中的每一种产生逆转录病毒,转导人t细胞,并随后测量转导效率,证实可表达psca.mc.ζ。为了确认带有这些car构建体中的每一种的t细胞保留其识别psca+肿瘤细胞的能力,进行6小时细胞毒性测定,其显示capan-1靶细胞的裂解。因此,将mc添加到car分子的胞质区中不影响car表达或靶细胞上抗原的识别。mc共刺激增强经car修饰的t细胞中的t细胞杀伤、增殖和存活如在短期细胞毒性测定中所证实的,三种car设计中的每一种均显示识别并裂解capan-1肿瘤细胞的能力。效应t细胞中的细胞溶解效应物功能由肿瘤识别后释放预形成的颗粒酶和穿孔素介导,且通过cd3ζ的活化足以诱导该过程而不需要共刺激。第一代cart细胞(例如,仅用cd3ζ胞质区构建的car)可裂解肿瘤细胞;然而,存活和增殖由于缺少共刺激而受损。因此,添加cd28或4-1bb共刺激结构域构建体已显著改善cart细胞的存活和增殖能力。为了检查mc是否可类似地提供影响存活和增殖的共刺激信号,在高肿瘤:t细胞比率(1:1、1:5、1:10t细胞对肿瘤细胞)条件下用psca+capan-1肿瘤细胞进行共培养物测定。当t细胞和肿瘤细胞数目相等(1:1)时,与未经转导的对照t细胞相比,来自所有三种构建体的capan-1-gfp细胞均存在有效杀伤。然而,当cart细胞被大量肿瘤细胞(1:10)攻击时,仅当car分子含有mc或cd28时,capan-1-gfp肿瘤细胞显著减少。为了进一步检查通过这两种car进行共刺激的机制,测定细胞存活力和增殖。与未经转导的t细胞和仅cd3ζ的car相比,含有mc或cd28的pscacar显示改善的存活,并且t细胞增殖被psca.mc.ζ和psca.28.ζ显著增强。由于其他组已显示含有共刺激信号传导区的car产生il-2(用于t细胞的关键存活和生长分子)(4),因此对来自用capan-1肿瘤细胞攻击的cart细胞的上清液进行elisa。尽管psca.28.ζ产生高水平的il-2,但psca.mc.ζ信号也产生显著水平的il-2,这可能有助于在这些测定中观察到的t细胞存活和扩增。另外,检查了car修饰的t细胞的il-6产生,因为已表明il-6为经car修饰的t细胞的效能和功效中的关键细胞因子(15)。与il-2相反,psca.mc.ζ与psca.28.ζ相比产生更高水平的il-6,这与原代t细胞中的imc活化诱导il-6的观察结果一致。总之,这些数据表明,通过mc的共刺激产生与cd28相似的作用,由此在肿瘤细胞识别后,car-修饰的t细胞产生增强t细胞存活的il-2和il-6。使用经car修饰的t细胞的免疫疗法对于各种恶性肿瘤的治疗具有很大的前景。尽管car首次被设计成具有单一信号结构域(如cd3ζ)(16-19),但评价car免疫疗法可行性的临床试验显示有限的临床益处(1,2,20,21)。这主要归因于肿瘤识别后t细胞的不完全活化,这导致体内有限的持久性和扩增(22)。为了解决这一缺陷,car已被工程化为包含另一刺激结构域,该结构域经常来源于包括cd28、4-1bb、ox40、icos和dap10在内的t细胞共刺激分子的胞质部分(4,23-30),它们允许cart细胞在接合靶抗原后接受适当的共刺激。实际上,用带有cd28或4-1bb信号传导结构域的抗cd19car进行的治疗难治性急性成淋巴细胞性白血病(all)的临床试验证实在过继性转移后令人印象深刻的t细胞持久性、扩增和连续肿瘤杀伤。(6-8)cd28共刺激为cd19+淋巴瘤的治疗提供了明确的临床优势。savoldo和其同事进行了比较第一代car(cd19.ζ)和第二代car(cd19.28.ζ)的car-t细胞临床试验,并发现cd28增强过继性转移后的t细胞持久性和扩增(31)。第二代car的主要功能之一是通过由cd3ζ(信号1)活化nfat转录因子以及由cd28或4-1bb活化nf-κb(信号2)产生支持t细胞存活和生长的il-2的能力(32)。这表明类似活化nf-κb的其他分子可与car分子内的cd3ζ链配对。我们的方法采用了最初作为用于树突细胞(dc)疫苗的佐剂开发的t细胞共刺激分子(12,33)。对于dc的完全活化或许可,tlr信号传导通常参与tnf家族成员cd40的上调,所述cd40与抗原引发的cd4+t细胞上的cd40l相互作用。由于imc是dc中nf-κb的有效活化剂,因此用掺入myd88和cd40的car转导t细胞可能为t细胞提供所需的共刺激(信号2)并增强它们的存活和增殖。进行一组实验以检查使用imc分子进行的最佳t细胞刺激是否需要myd88、cd40或这两种组分。值得注意的是,如通过细胞因子产生(il-2和il-6)所测量的,发现myd88和cd40均不能充分诱导t细胞活化,但当组合为单一融合蛋白质时,可诱导有效的t细胞活化。构建掺入mc的pscacar并且随后将其功能与第一个(psca.ζ)和第二代(psca.28.ζ)car进行比较。在这里,发现mc增强cart细胞的存活和增殖到与cd28内结构域相当的水平,表明共刺激是足够的。虽然经psca.mc.ζcar转导的t细胞比psca.28.ζ产生更低水平的il-2,但分泌水平显著高于未经转导的t细胞和用psca.ζcar转导的t细胞。另一方面,psca.mc.ζcar转导的t细胞比psca.28.ζ转导的t细胞分泌显著更高水平的il-6(与t细胞活化相关的重要细胞因子),指示mc赋予car功能以可在体内转化为改善的肿瘤细胞杀伤的独特性质。这些实验指示,在通过胞外car结构域进行抗原识别之后,mc可活化nf-κb(信号2)。mc-car的设计和功能验证。设计了三种pscacar构建体,其仅掺入cd3ζ或具有cd28或mc内结构域。通过抗car-apc(识别igg1ch2ch3结构域)测量转导效率(百分比)。c)证实psca.mc.ζcar对t细胞的高转导效率的流式细胞术分析。d)在6小时ldh释放测定中以1:1t细胞与肿瘤细胞的比率分析经car修饰的t细胞对psca+capan-1肿瘤细胞的特异性裂解。经mc-car修饰的t细胞在长期共培养物测定中杀伤capan-1肿瘤细胞。在以1:1比率培养7天后与capan-1-gfp肿瘤细胞一起培养的经car修饰的t细胞和未经转导的t细胞的流式细胞计数分析。在1:1和1:10t细胞与肿瘤细胞比率的共培养物测定中通过流式细胞术对存活的gfp+细胞进行定量。mc和cd28共刺激增强t细胞存活、增殖和细胞因子产生。测定从1:10t细胞与肿瘤细胞的共培养物测定分离的t细胞的细胞存活力和细胞数目,以评估应答于肿瘤细胞暴露的存活和增殖。随后通过elisa测量来自共培养物测定的上清液的il-2和il-6产生。诱导型共刺激分子的设计和对t细胞活化的作用。设计了四个载体,其仅掺入fkbpv36ap1903结合结构域(fv'.fv),或具有myd88、cd40或myd88/cd40融合蛋白质。使用cd3+cd19+流式细胞计数分析活化的原代t细胞的转导效率。分析用和不用10nmap1903活化后经修饰的t细胞的ifn-γ产生。分析用和不用10nmap1903活化后经修饰的t细胞的il-6产生。除了存活和生长优点之外,mc诱导的共刺激还可为经car修饰的t细胞提供额外的功能。medzhitov和同事最近证实myd88信号传导对th1应答和th17应答二者都至关重要,并且它通过il-1作用,以使得cd4+t细胞可抵抗调控性t细胞(treg)驱动的抑制(34)。用imc进行的实验显示在ap1903活化之后分泌il-1α和il-1β。另外,martin等证实cd8+t细胞中通过ras、pi3k和蛋白质激酶c进行的cd40信号传导导致nf-κb依赖性诱导裂解cd4+cd25+treg细胞的细胞毒性介质(颗粒酶和穿孔素)(35)。因此,myd88和cd40共活化可能使car-t细胞抵抗treg细胞的免疫抑制作用,这是可能在治疗实体瘤和其他类型的癌症方面至关重要的功能。总之,可将mc掺入car分子中,用逆转录病毒转导的原代t细胞可表达psca.mc.ζ而无明显的毒性或car稳定性问题。此外,mc似乎提供与cd28相似的共刺激,其中与用第一代car转导的t细胞相比,经转导的t细胞显示改善的存活、增殖和肿瘤杀伤。实施例12:参考文献以下参考文献在实施例11中被引用,或提供了包括例如实施例11中可能相关的额外信息。1.tillbg,jensenmc,wangj等:使用具有cd28和4-1bb结构域的嵌合抗原受体对淋巴瘤的cd20特异性过继性免疫疗法:先导临床试验结果.blood119:3940-50,2012.2.pulema,savoldob,myersgd等:经工程化以共表达肿瘤特异性受体的病毒特异性t细胞:在成神经细胞瘤个体中的持久性和抗肿瘤活性.natmed14:1264-70,2008.3.kershawmh,westwoodja,parkerll等:关于使用基因修饰的t细胞对卵巢癌进行过继性免疫疗法的1期研究.clincancerres12:6106-15,2006.4.carpenitoc,milonemc,hassanr等:用含有cd28和cd137结构域的遗传重靶向的人t细胞控制大的已建立的肿瘤异种移植物.procnatlacadsciusa106:3360-5,2009.5.songdg,yeq,poussinm等:cd27共刺激增强重定向人t细胞在体内的存活和抗肿瘤活性.blood119:696-706,2012.6.kalosm,levinebl,porterdl等:具有嵌合抗原受体的t细胞具有有效的抗肿瘤作用并且可在晚期白血病患者中建立记忆.scitranslmed3:95ra73,2011.7.porterdl,levinebl,kalosm等:慢性淋巴样白血病中的嵌合抗原受体修饰的t细胞.nengljmed365:725-33,2011.8.brentjensrj,davilaml,rivierei等:cd19靶向t细胞快速诱导化疗难治性急性成淋巴细胞性白血病成人的分子缓解.scitranslmed5:177ra38,2013.9.pulema,straathofkc,dottig等:增加细胞因子释放并支持原代人t细胞的克隆扩增的嵌合t细胞抗原受体(achimerictcellantigenreceptorthataugmentscytokinereleaseandsupportsclonalexpansionofprimaryhumantcells)。molther12:933-41,2005.10.finneyhm,akbaran,lawsonad:用嵌合受体活化静息人原代t细胞:与来自tcrζ链的信号串联的来自cd28、诱导型共刺激物、cd134和cd137的共刺激.jimmunol172:104-13,2004.11.guedans,chenx,madara等:基于icos的嵌合抗原受体程序双极性th17/th1细胞.blood,2014.12.narayananp,laptevan,seethammagarim等:复合myd88/cd40开关协同活化小鼠和人树突细胞用于增强抗肿瘤功效.jclininvest121:1524-34,2011.13.anurathapanu,chanrc,hindihf等:嵌合抗原受体修饰的t细胞的肿瘤破坏动力学(kineticsoftumordestructionbychimericantigenreceptor-modifiedtcells).molther22:623-33,2014.14.craddockja,lua,beara等:通过表达趋化因子受体ccr2b增强gd2嵌合抗原受体t细胞的肿瘤运输(enhancedtumortraffickingofgd2chimericantigenreceptortcellsbyexpressionofthechemokinereceptorccr2b).jimmunother33:780-8,2010.15.leedw,gardnerr,porterdl等:细胞因子释放综合征的诊断和管控的现行构想(currentconceptsinthediagnosisandmanagementofcytokinereleasesyndrome).blood124:188-95,2014.16.beckerml,nearr,mudgett-hunterm等:杂合免疫球蛋白-t细胞受体蛋白质在转基因小鼠中的表达(expressionofahybridimmunoglobulin-tcellreceptorproteinintransgenicmice).cell58:911-21,1989.17.govermanj,gomezsm,segesmankd等:嵌合免疫球蛋白-t细胞受体蛋白质形成功能性受体:t细胞受体复合物形成和活化的意义(chimericimmunoglobulin-tcellreceptorproteinsformfunctionalreceptors:implicationsfortcellreceptorcomplexformationandactivation).cell60:929-39,1990.18.grossg,wakst,eshharz:免疫球蛋白-t细胞受体嵌合分子作为具有抗体型特异性的功能性受体的表达(expressionofimmunoglobulin-t-cellreceptorchimericmoleculesasfunctionalreceptorswithantibody-typespecificity).procnatlacadsciusa86:10024-8,1989.19.kuwanay,asakuray,utsunomiyan等:由免疫球蛋白来源的v区和t细胞受体来源的c区构成的嵌合受体的表达(expressionofchimericreceptorcomposedofimmunoglobulin-derivedvregionsandt-cellreceptor-derivedcregions).biochembiophysrescommun149:960-8,1987.20.jensenmc,popplewelll,cooperlj等:抗转基因排斥反应导致人中过继性转移的cd20/cd19特异性嵌合抗原受体重定向t细胞的持久性减弱(antitransgenerejectionresponsescontributetoattenuatedpersistenceofadoptivelytransferredcd20/cd19-specificchimericantigenreceptorredirectedtcellsinhumans).biolbloodmarrowtransplant16:1245-56,2010.21.parkjr,digiustodl,slovakm等:成神经细胞瘤患者中嵌合抗原受体重定向的细胞溶解性t淋巴细胞克隆的过继性转移(adoptivetransferofchimericantigenreceptorre-directedcytolytictlymphocyteclonesinpatientswithneuroblastoma).molther15:825-33,2007.22.ramosca,dottig:用于癌症疗法的嵌合抗原受体(car)-工程化的淋巴细胞(chimericantigenreceptor(car)-engineeredlymphocytesforcancertherapy).expertopinbiolther11:855-73,2011.23.finneyhm,lawsonad,bebbingtoncr等:由单一基因产物提供t细胞中的主要信号传导和共刺激性信号传导的嵌合受体(chimericreceptorsprovidingbothprimaryandcostimulatorysignalingintcellsfromasinglegeneproduct).jimmunol161:2791-7,1998.24.hombacha,wieczarkowiecza,marquardtt等:通过重组免疫受体活化肿瘤特异性t细胞:cd3ζ信号传导和cd28共刺激是有效的il-2分泌同时需要的,并且可被整合到一个组合的cd28/cd3ζ信号传导受体分子中(tumor-specifictcellactivationbyrecombinantimmunoreceptors:cd3zetasignalingandcd28costimulationaresimultaneouslyrequiredforefficientil-2secretionandcanbeintegratedintoonecombinedcd28/cd3zetasignalingreceptormolecule).jimmunol167:6123-31,2001.25.maherj,brentjensrj,gunsetg等:由单一嵌合tcrζ/cd28受体指定的人t淋巴细胞细胞毒性和增殖(humant-lymphocytecytotoxicityandproliferationdirectedbyasinglechimerictcrzeta/cd28receptor).natbiotechnol20:70-5,2002.26.imaic,miharak,andreanskym等:具有4-1bb信号传导能力的嵌合受体诱发对急性成淋巴细胞性白血病的有效细胞毒性(chimericreceptorswith4-1bbsignalingcapacityprovokepotentcytotoxicityagainstacutelymphoblasticleukemia).leukemia18:676-84,2004.27.wangj,jensenm,liny等:使用具有cd28和cd137共刺激结构域的嵌合t细胞受体优化淋巴瘤的过继性多克隆t细胞免疫疗法(optimizingadoptivepolyclonaltcellimmunotherapyoflymphomas,usingachimerictcellreceptorpossessingcd28andcd137costimulatorydomains).humgenether18:712-25,2007.28.zhaoy,wangqj,yangs等:具有修饰的信号传导结构域的基于赫赛汀的嵌合抗原受体导致转导的t淋巴细胞存活和抗肿瘤活性增强(aherceptin-basedchimericantigenreceptorwithmodifiedsignalingdomainsleadstoenhancedsurvivaloftransducedtlymphocytesandantitumoractivity).jimmunol183:5563-74,2009.29.milonemc,fishjd,carpenitoc等:含有cd137信号转导结构域的嵌合受体体内介导增强的t细胞存活和增加的抗白血病功效(chimericreceptorscontainingcd137signaltransductiondomainsmediateenhancedsurvivaloftcellsandincreasedantileukemicefficacyinvivo).molther17:1453-64,2009.30.yvone,delvecchiom,savoldob等:使用遗传工程化的gd2特异性t细胞对转移性黑色素瘤的免疫疗法(immunotherapyofmetastaticmelanomausinggeneticallyengineeredgd2-specifictcells).clincancerres15:5852-60,2009.31.savoldob,ramosca,liue等:cd28共刺激改善淋巴瘤患者中嵌合抗原受体修饰的t细胞的扩增和持久性(cd28costimulationimprovesexpansionandpersistenceofchimericantigenreceptor-modifiedtcellsinlymphomapatients).jclininvest121:1822-6,2011.32.kalinskip,hilkenscm,wierengaea等:由1型和2型极化树突细胞引发的t细胞:第三信号的概念(t-cellprimingbytype-1andtype-2polarizeddendriticcells:theconceptofathirdsignal).immunoltoday20:561-7,1999.33.kemnadejo,seethammagarim,narayananp等:通过肿瘤抗原和imyd88/cd40佐剂的双顺反子表达进行现有腺病毒介导的免疫疗法(off-the-shelfadenoviral-mediatedimmunotherapyviabicistronicexpressionoftumorantigenandimyd88/cd40adjuvant).molther,2012.34.schentend,nishsa,yus等:需要cd4+t细胞中通过衔接分子myd88的信号传导以克服调控性t细胞的抑制(signalingthroughtheadaptormoleculemyd88incd4+tcellsisrequiredtoovercomesuppressionbyregulatorytcells).immunity40:78-90,2014.35.martins,paharis,sudanr等:cd8+cd40+t细胞中的cd40信号传导开启了反式调控性t细胞功能(cd40signalingincd8+cd40+tcellsturnsoncontra-tregulatorycellfunctions).jimmunol184:5510-8,2010实施例13:mc共刺激增强cd19car的功能和增殖使用识别cd19抗原的抗原识别部分提供与本文所讨论的实验类似的实验。应当理解,本文所提供的载体可被修饰以构建靶向cd19+肿瘤细胞的myd88/cd40car构建体,所述构建体还掺入诱导型胱天蛋白酶-9安全开关。为了检查mc共刺激是否在靶向其他抗原的car中起作用,用cd19.ζ或cd19.mc.ζ修饰t细胞。测定经修饰细胞针对cd19+伯基特氏(burkitt’s)淋巴瘤细胞系(raji和daudi)的细胞毒性、活化和存活。在共培养物测定中,用car转导的t细胞显示以低到1:1的效应物与靶标比杀伤cd19+raji细胞。然而,来自共培养物测定的细胞因子产生的分析显示经cd19.mc.ζ转导的t细胞与cd19.ζ相比产生更高水平的il-2和il-6,这与用含有mc信号传导结构域的imc和pscacar所观察到的共刺激作用一致。此外,用cd19.mc.ζ转导的t细胞在被raji肿瘤细胞活化之后显示出增强的增殖。这些数据支持早期的实验,证实car分子中的mc信号传导改善接合到肿瘤细胞上表达的靶抗原之后的t细胞活化、存活和增殖。pbp0526-sfg.icasp9wt.2a.cd19scfv.cd34e.cd8stm.mc.ζseqidno:116fkbpv36atgctggagggagtgcaggtggagactattagccccggagatggcagaacattccccaaaagaggacagacttgcgtcgtgcattatactggaatgctggaagacggcaagaaggtggacagcagccgggaccgaaacaagcccttcaagttcatgctggggaagcaggaagtgatccggggctgggaggaaggagtcgcacagatgtcagtgggacagagggccaaactgactattagcccagactacgcttatggagcaaccggccaccccgggatcattccccctcatgctacactggtcttcgatgtggagctgctgaagctggaaseqidno:117fkbpv36mlegvqvetispgdgrtfpkrgqtcvvhytgmledgkkvdssrdrnkpfkfmlgkqevirgweegvaqmsvgqrakltispdyaygatghpgiipphatlvfdvellkleseqidno:118接头agcggaggaggatccggaseqidno:119接头sgggsgseqidno:120胱天蛋白酶-9gtggacgggtttggagatgtgggagccctggaatccctgcggggcaatgccgatctggcttacatcctgtctatggagccttgcggccactgtctgatcattaacaatgtgaacttctgcagagagagcgggctgcggaccagaacaggatccaatattgactgtgaaaagctgcggagaaggttctctagtctgcactttatggtcgaggtgaaaggcgatctgaccgctaagaaaatggtgctggccctgctggaactggctcggcaggaccatggggcactggattgctgcgtggtcgtgatcctgagtcacggctgccaggcttcacatctgcagttccctggggcagtctatggaactgacggctgtccagtcagcgtggagaagatcgtgaacatcttcaacggcacctcttgcccaagtctgggcgggaagcccaaactgttctttattcaggcctgtggaggcgagcagaaagatcacggcttcgaagtggctagcacctcccccgaggacgaatcacctggaagcaaccctgagccagatgcaacccccttccaggaaggcctgaggacatttgaccagctggatgccatctcaagcctgcccacaccttctgacattttcgtctcttacagtactttccctggatttgtgagctggcgcgatccaaagtcaggcagctggtacgtggagacactggacgatatctttgagcagtgggcccattctgaagacctgcagagtctgctgctgcgagtggccaatgctgtctctgtgaaggggatctacaaacagatgccaggatgcttcaactttctgagaaagaaactgttctttaagacctccgcatctagggccseqidno:121胱天蛋白酶-9vdgfgdvgaleslrgnadlayilsmepcghcliinnvnfcresglrtrtgsnidceklrrrfsslhfmvevkgdltakkmvlallelarqdhgaldccvvvilshgcqashlqfpgavygtdgcpvsvekivnifngtscpslggkpklffiqacggeqkdhgfevastspedespgsnpepdatpfqeglrtfdqldaisslptpsdifvsystfpgfvswrdpksgswyvetlddifeqwahsedlqslllrvanavsvkgiykqmpgcfnflrkklffktsasraseqidno:122接头ccgcggseqidno:123接头prseqidno:124t2agaaggccgagggagcctgctgacatgtggcgatgtggaggaaaacccaggaccaseqidno:125t2aegrgslltcgdveenpgpseqidno:126接头ccatggseqidno:127接头pwseqidno:128信号肽atggagtttggactttcttggttgtttttggtggcaattctgaagggtgtccagtgtagcaggseqidno:129信号肽mefglswlflvailkgvqcsrseqidno:130fmc63可变轻链(抗cd19)gacatccagatgacacagactacatcctccctgtctgcctctctgggagacagagtcaccatcagttgcagggcaagtcaggacattagtaaatatttaaattggtatcagcagaaaccagatggaactgttaaactcctgatctaccatacatcaagattacactcaggagtcccatcaaggttcagtggcagtgggtctggaacagattattctctcaccattagcaacctggagcaagaagatattgccacttacttttgccaacagggtaatacgcttccgtacacgttcggaggggggactaagttggaaataacaseqidno:131fmc63可变轻链(抗cd19)diqmtqttsslsaslgdrvtiscrasqdiskylnwyqqkpdgtvklliyhtsrlhsgvpsrfsgsgsgtdysltisnleqediatyfcqqgntlpytfgggtkleitseqidno:132柔性接头ggcggaggaagcggaggtgggggcseqidno:133柔性接头gggsggggseqidno:134fmc63可变重链(抗cd19)gaggtgaaactgcaggagtcaggacctggcctggtggcgccctcacagagcctgtccgtcacatgcactgtctcaggggtctcattacccgactatggtgtaagctggattcgccagcctccacgaaagggtctggagtggctgggagtaatatggggtagtgaaaccacatactataattcagctctcaaatccagactgaccatcatcaaggacaactccaagagccaagttttcttaaaaatgaacagtctgcaaactgatgacacagccatttactactgtgccaaacattattactacggtggtagctatgctatggactactggggtcaaggaacctcagtcaccgtctcctcaseqidno:135fmc63可变重链(抗cd19)evklqesgpglvapsqslsvtctvsgvslpdygvswirqpprkglewlgviwgsettyynsalksrltiikdnsksqvflkmnslqtddtaiyycakhyyyggsyamdywgqgtsvtvssseqidno:136接头ggatccseqidno:137接头gsseqidno:138cd34最小表位gaacttcctactcaggggactttctcaaacgttagcacaaacgtaagtseqidno:139cd34最小表位elptqgtfsnvstnvsseqidno:140cd8α茎结构域cccgccccaagaccccccacacctgcgccgaccattgcttctcaacccctgagtttgagacccgaggcctgccggccagctgccggcggggccgtgcatacaagaggactcgatttcgcttgcgacseqidno:141cd8α茎结构域paprpptpaptiasqplslrpeacrpaaggavhtrgldfacdseqidno:142cd8α跨膜结构域atctatatctgggcacctctcgctggcacctgtggagtccttctgctcagcctggttattactctgtactgtaatcaccggaatcgccgccgcgtttgtaagtgtcccaggseqidno:143cd8α跨膜结构域iyiwaplagtcgvlllslvitlycnhrnrrrvckcprseqidno:144接头gtcgacseqidno:145接头vdseqidno:146缺少tir结构域的截短的myd88atggccgctgggggcccaggcgccggatcagctgctcccgtatcttctacttcttctttgccgctggctgctctgaacatgcgcgtgagaagacgcctctccctgttccttaacgttcgcacacaagtcgctgccgattggaccgcccttgccgaagaaatggactttgaatacctggaaattagacaacttgaaacacaggccgaccccactggcagactcctggacgcatggcagggaagacctggtgcaagcgttggacggctcctggatctcctgacaaaactgggacgcgacgacgtactgcttgaactcggacctagcattgaagaagactgccaaaaatatatcctgaaacaacaacaagaagaagccgaaaaacctctccaagtcgcagcagtggactcatcagtaccccgaacagctgagcttgctgggattactacactcgacgacccactcggacatatgcctgaaagattcgacgctttcatttgctattgcccctctgacataseqidno:147缺少tir结构域的截短的myd88maaggpgagsaapvsstsslplaalnmrvrrrlslflnvrtqvaadwtalaeemdfeyleirqletqadptgrlldawqgrpgasvgrlldlltklgrddvllelgpsieedcqkyilkqqqeeaekplqvaavdssvprtaelagittlddplghmperfdaficycpsdiseqidno:148无胞外结构域的cd40aagaaagttgcaaagaaacccacaaataaagccccacaccctaaacaggaaccccaagaaatcaatttcccagatgatctccctggatctaatactgccgccccggtccaagaaaccctgcatggttgccagcctgtcacccaagaggacggaaaagaatcacggattagcgtacaagagagacaaseqidno:149无胞外结构域的cd40kkvakkptnkaphpkqepqeinfpddlpgsntaapvqetlhgcqpvtqedgkesrisvqerqseqidno:150cd3ζagagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgcseqidno:151cd3ζrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr实施例14:共表达myd88/cd40嵌合抗原受体和诱导型胱天蛋白酶-9多肽的t细胞的细胞因子产生产生各种嵌合抗原受体构建体以比较经转导的t细胞在暴露于抗原之后的细胞因子产生。嵌合抗原受体构建体都具有与结合cd19的抗原识别区。应当理解,本文所提供的载体可被修饰以构建还掺入诱导型胱天蛋白酶-9安全开关的car构建体。应当进一步理解,car构建体可进一步包含frb结构域。实施例15:用于靶向her2+肿瘤细胞的myd88/cd40car构建体的示例,应当理解,本文所提供的载体可被修饰以构建靶向her2+肿瘤细胞的myd88/cd40car构建体,所述构建体还掺入诱导型胱天蛋白酶-9安全开关。应当进一步理解,car构建体可进一步包含frb结构域。sfg-her2scfv.cd34e.cd8stm.mc.ζ序列seqidno:152信号肽atggagtttggactttcttggttgtttttggtggcaattctgaagggtgtccagtgtagcaggseqidno:153信号肽mefglswlflvailkgvqcsrseqidno:154frp5可变轻链(抗her2)gacatccaattgacacaatcacacaaatttctctcaacttctgtaggagacagagtgagcataacctgcaaagcatcccaggacgtgtacaatgctgtggcttggtaccaacagaagcctggacaatccccaaaattgctgatttattctgcctctagtaggtacactggggtaccttctcggtttacgggctctgggtccggaccagatttcacgttcacaatcagttccgttcaagctgaagacctcgctgtttatttttgccagcagcacttccgaaccccttttacttttggctcaggcactaagttggaaatcaaggctttgseqidno:155frp5可变轻链(抗her2)diqltqshkflstsvgdrvsitckasqdvynavawyqqkpgqspklliysassrytgvpsrftgsgsgpdftftissvqaedlavyfcqqhfrtpftfgsgtkleikalseqidno:156柔性接头ggcggaggaagcggaggtgggggcseqidno:157柔性接头gggsggggseqidno:158frp5可变重链(抗her2/neu)gaagtccaattgcaacagtcaggccccgaattgaaaaagcccggcgaaacagtgaagatatcttgtaaagcctccggttacccttttacgaactatggaatgaactgggtcaaacaagcccctggacagggattgaagtggatgggatggatcaatacatcaacaggcgagtctaccttcgcagatgatttcaaaggtcgctttgacttctcactggagaccagtgcaaataccgcctaccttcagattaacaatcttaaaagcgaggatatggcaacctacttttgcgcaagatgggaagtttatcacgggtacgtgccatactggggacaaggaacgacagtgacagttagtagcseqidno:159frp5可变重链(抗her2/neu)evqlqqsgpelkkpgetvkisckasgypftnygmnwvkqapgqglkwmgwintstgestfaddfkgrfdfsletsantaylqinnlksedmatyfcarwevyhgyvpywgqgttvtvssseqidno:160接头ggatccseqidno:161接头gsseqidno:162cd34最小表位gaacttcctactcaggggactttctcaaacgttagcacaaacgtaagtseqidno:163cd34最小表位elptqgtfsnvstnvsseqidno:164cd8α茎cccgccccaagaccccccacacctgcgccgaccattgcttctcaacccctgagtttgagacccgaggcctgccggccagctgccggcggggccgtgcatacaagaggactcgatttcgcttgcgacseqidno:165cd8α茎paprpptpaptiasqplslrpeacrpaaggavhtrgldfacdseqidno:166cd8α跨膜区atctatatctgggcacctctcgctggcacctgtggagtccttctgctcagcctggttattactctgtactgtaatcaccggaatcgccgccgcgtttgtaagtgtcccaggseqidno:167cd8α跨膜区iyiwaplagtcgvlllslvitlycnhrnrrrvckcprseqidno:168接头ctcgagseqidno:169接头leseqidno:170截短的myd88atggccgctgggggcccaggcgccggatcagctgctcccgtatcttctacttcttctttgccgctggctgctctgaacatgcgcgtgagaagacgcctctccctgttccttaacgttcgcacacaagtcgctgccgattggaccgcccttgccgaagaaatggactttgaatacctggaaattagacaacttgaaacacaggccgaccccactggcagactcctggacgcatggcagggaagacctggtgcaagcgttggacggctcctggatctcctgacaaaactgggacgcgacgacgtactgcttgaactcggacctagcattgaagaagactgccaaaaatatatcctgaaacaacaacaagaagaagccgaaaaacctctccaagtcgcagcagtggactcatcagtaccccgaacagctgagcttgctgggattactacactcgacgacccactcggacatatgcctgaaagattcgacgctttcatttgctattgcccctctgacataseqidno:171截短的myd88maaggpgagsaapvsstsslplaalnmrvrrrlslflnvrtqvaadwtalaeemdfeyleirqletqadptgrlldawqgrpgasvgrlldlltklgrddvllelgpsieedcqkyilkqqqeeaekplqvaavdssvprtaelagittlddplghmperfdaficycpsdiseqidno:172cd40胞质结构域aagaaagttgcaaagaaacccacaaataaagccccacaccctaaacaggaaccccaagaaatcaatttcccagatgatctccctggatctaatactgccgccccggtccaagaaaccctgcatggttgccagcctgtcacccaagaggacggaaaagaatcacggattagcgtacaagagagacaaseqidno:173cd40胞质结构域kkvakkptnkaphpkqepqeinfpddlpgsntaapvqetlhgcqpvtqedgkesrisvqerqseqidno:174接头gcggccgcagtcgagseqidno:175接头aaaveseqidno:176cd3ζ胞质结构域agagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgcseqidno:177cd3ζ胞质结构域rvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr实施例16:另外的序列seqidno:178,δcasp9(res.135-416)gfgdvgaleslrgnadlayilsmepcghcliinnvnfcresglrtrtgsnidceklrrrfsslhfmvevkgdltakkmvlallelarqdhgaldccvvvilshgcqashlqfpgavygtdgcpvsvekivnifngtscpslggkpklffiqacggeqkdhgfevastspedespgsnpepdatpfqeglrtfdqldaisslptpsdifvsystfpgfvswrdpksgswyvetlddifeqwahsedlqslllrvanavsvkgiykqmpgcfnflrkklffktsseqidno:179,δcasp9(res.135-416)d330a,核苷酸序列ggatttggtgatgtcggtgctcttgagagtttgaggggaaatgcagatttggcttacatcctgagcatggagccctgtggccactgcctcattatcaacaatgtgaacttctgccgtgagtccgggctccgcacccgcactggctccaacatcgactgtgagaagttgcggcgtcgcttctcctcgctgcatttcatggtggaggtgaagggcgacctgactgccaagaaaatggtgctggctttgctggagctggcgcggcaggaccacggtgctctggactgctgcgtggtggtcattctctctcacggctgtcaggccagccacctgcagttcccaggggctgtctacggcacagatggatgccctgtgtcggtcgagaagattgtgaacatcttcaatgggaccagctgccccagcctgggagggaagcccaagctctttttcatccaggcctgtggtggggagcagaaagaccatgggtttgaggtggcctccacttcccctgaagacgagtcccctggcagtaaccccgagccagatgccaccccgttccaggaaggtttgaggaccttcgaccagctggccgccatatctagtttgcccacacccagtgacatctttgtgtcctactctactttcccaggttttgtttcctggagggaccccaagagtggctcctggtacgttgagaccctggacgacatctttgagcagtgggctcactctgaagacctgcagtccctcctgcttagggtcgctaatgctgtttcggtgaaagggatttataaacagatgcctggttgctttaatttcctccggaaaaaacttttctttaaaacatcaseqidno:180,δcasp9(res.135-416)d330a,氨基酸序列gfgdvgaleslrgnadlayilsmepcghcliinnvnfcresglrtrtgsnidceklrrrfsslhfmvevkgdltakkmvlallelarqdhgaldccvvvilshgcqashlqfpgavygtdgcpvsvekivnifngtscpslggkpklffiqacggeqkdhgfevastspedespgsnpepdatpfqeglrtfdqlaaisslptpsdifvsystfpgfvswrdpksgswyvetlddifeqwahsedlqslllrvanavsvkgiykqmpgcfnflrkklffktsseqidno:181,δcasp9(res.135-416)n405q核苷酸序列ggatttggtgatgtcggtgctcttgagagtttgaggggaaatgcagatttggcttacatcctgagcatggagccctgtggccactgcctcattatcaacaatgtgaacttctgccgtgagtccgggctccgcacccgcactggctccaacatcgactgtgagaagttgcggcgtcgcttctcctcgctgcatttcatggtggaggtgaagggcgacctgactgccaagaaaatggtgctggctttgctggagctggcgcggcaggaccacggtgctctggactgctgcgtggtggtcattctctctcacggctgtcaggccagccacctgcagttcccaggggctgtctacggcacagatggatgccctgtgtcggtcgagaagattgtgaacatcttcaatgggaccagctgccccagcctgggagggaagcccaagctctttttcatccaggcctgtggtggggagcagaaagaccatgggtttgaggtggcctccacttcccctgaagacgagtcccctggcagtaaccccgagccagatgccaccccgttccaggaaggtttgaggaccttcgaccagctggacgccatatctagtttgcccacacccagtgacatctttgtgtcctactctactttcccaggttttgtttcctggagggaccccaagagtggctcctggtacgttgagaccctggacgacatctttgagcagtgggctcactctgaagacctgcagtccctcctgcttagggtcgctaatgctgtttcggtgaaagggatttataaacagatgcctggttgctttcagttcctccggaaaaaacttttctttaaaacatcaseqidno:182,δcasp9(res.135-416)n405q氨基酸序列gfgdvgaleslrgnadlayilsmepcghcliinnvnfcresglrtrtgsnidceklrrrfsslhfmvevkgdltakkmvlallelarqdhgaldccvvvilshgcqashlqfpgavygtdgcpvsvekivnifngtscpslggkpklffiqacggeqkdhgfevastspedespgsnpepdatpfqeglrtfdqldaisslptpsdifvsystfpgfvswrdpksgswyvetlddifeqwahsedlqslllrvanavsvkgiykqmpgcfqflrkklffktsseqidno:183,δcasp9(res.135-416)d330an405q核苷酸序列ggatttggtgatgtcggtgctcttgagagtttgaggggaaatgcagatttggcttacatcctgagcatggagccctgtggccactgcctcattatcaacaatgtgaacttctgccgtgagtccgggctccgcacccgcactggctccaacatcgactgtgagaagttgcggcgtcgcttctcctcgctgcatttcatggtggaggtgaagggcgacctgactgccaagaaaatggtgctggctttgctggagctggcgcggcaggaccacggtgctctggactgctgcgtggtggtcattctctctcacggctgtcaggccagccacctgcagttcccaggggctgtctacggcacagatggatgccctgtgtcggtcgagaagattgtgaacatcttcaatgggaccagctgccccagcctgggagggaagcccaagctctttttcatccaggcctgtggtggggagcagaaagaccatgggtttgaggtggcctccacttcccctgaagacgagtcccctggcagtaaccccgagccagatgccaccccgttccaggaaggtttgaggaccttcgaccagctggccgccatatctagtttgcccacacccagtgacatctttgtgtcctactctactttcccaggttttgtttcctggagggaccccaagagtggctcctggtacgttgagaccctggacgacatctttgagcagtgggctcactctgaagacctgcagtccctcctgcttagggtcgctaatgctgtttcggtgaaagggatttataaacagatgcctggttgctttcagttcctccggaaaaaacttttctttaaaacatcaseqidno:184,δcasp9(res.135-416)d330an405q氨基酸序列gfgdvgaleslrgnadlayilsmepcghcliinnvnfcresglrtrtgsnidceklrrrfsslhfmvevkgdltakkmvlallelarqdhgaldccvvvilshgcqashlqfpgavygtdgcpvsvekivnifngtscpslggkpklffiqacggeqkdhgfevastspedespgsnpepdatpfqeglrtfdqlaaisslptpsdifvsystfpgfvswrdpksgswyvetlddifeqwahsedlqslllrvanavsvkgiykqmpgcfqflrkklffktsseqidno:185,胱天蛋白酶-9.co核苷酸序列gtggacgggtttggagatgtgggagccctggaatccctgcggggcaatgccgatctggcttacatcctgtctatggagccttgcggccactgtctgatcattaacaatgtgaacttctgcagagagagcgggctgcggaccagaacaggatccaatattgactgtgaaaagctgcggagaaggttctctagtctgcactttatggtcgaggtgaaaggcgatctgaccgctaagaaaatggtgctggccctgctggaactggctcggcaggaccatggggcactggattgctgcgtggtcgtgatcctgagtcacggctgccaggcttcacatctgcagttccctggggcagtctatggaactgacggctgtccagtcagcgtggagaagatcgtgaacatcttcaacggcacctcttgcccaagtctgggcgggaagcccaaactgttctttattcaggcctgtggaggcgagcagaaagatcacggcttcgaagtggctagcacctcccccgaggacgaatcacctggaagcaaccctgagccagatgcaacccccttccaggaaggcctgaggacatttgaccagctggatgccatctcaagcctgcccacaccttctgacattttcgtctcttacagtactttccctggatttgtgagctggcgcgatccaaagtcaggcagctggtacgtggagacactggacgatatctttgagcagtgggcccattctgaagacctgcagagtctgctgctgcgagtggccaatgctgtctctgtgaaggggatctacaaacagatgccaggatgcttccagtttctgagaaagaaactgttctttaagacctccgcatctagggccseqidno:186,胱天蛋白酶-9.co氨基酸序列vdgfgdvgaleslrgnadlayilsmepcghcliinnvnfcresglrtrtgsnidceklrrrfsslhfmvevkgdltakkmvlallelarqdhgaldccvvvilshgcqashlqfpgavygtdgcpvsvekivnifngtscpslggkpklffiqacggeqkdhgfevastspedespgsnpepdatpfqeglrtfdqldaisslptpsdifvsystfpgfvswrdpksgswyvetlddifeqwahsedlqslllrvanavsvkgiykqmpgcfqflrkklffktsasraseqidno:187:胱天蛋白酶9d330e核苷酸序列gtcgacggatttggtgatgtcggtgctcttgagagtttgaggggaaatgcagatttggcttacatcctgagcatggagccctgtggccactgcctcattatcaacaatgtgaacttctgccgtgagtccgggctccgcacccgcactggctccaacatcgactgtgagaagttgcggcgtcgcttctcctcgctgcatttcatggtggaggtgaagggcgacctgactgccaagaaaatggtgctggctttgctggagctggcgcggcaggaccacggtgctctggactgctgcgtggtggtcattctctctcacggctgtcaggccagccacctgcagttcccaggggctgtctacggcacagatggatgccctgtgtcggtcgagaagattgtgaacatcttcaatgggaccagctgccccagcctgggagggaagcccaagctctttttcatccaggcctgtggtggggagcagaaagaccatgggtttgaggtggcctccacttcccctgaagacgagtcccctggcagtaaccccgagccagatgccaccccgttccaggaaggtttgaggaccttcgaccagctggccgccatatctagtttgcccacacccagtgacatctttgtgtcctactctactttcccaggttttgtttcctggagggaccccaagagtggctcctggtacgttgagaccctggacgacatctttgagcagtgggctcactctgaagacctgcagtccctcctgcttagggtcgctaatgctgtttcggtgaaagggatttataaacagatgcctggttgctttaatttcctccggaaaaaacttttctttaaaacatcagctagcagagccseqidno:188:胱天蛋白酶9d330e氨基酸序列vdgfgdvgaleslrgnadlayilsmepcghcliinnvnfcresglrtrtgsnidceklrrrfsslhfmvevkgdltakkmvlallelarqdhgaldccvvvilshgcqashlqfpgavygtdgcpvsvekivnifngtscpslggkpklffiqacggeqkdhgfevastspedespgsnpepdatpfqeglrtfdqleaisslptpsdifvsystfpgfvswrdpksgswyvetlddifeqwahsedlqslllrvanavsvkgiykqmpgcfnflrkklffktsasrapbpo509的序列pbp0509-sfg-pscascfv.ch2ch3.cd28tm.ζ.myd88/cd40序列seqidno:189信号肽atggagtttggactttcttggttgtttttggtggcaattctgaagggtgtccagtgtagcaggseqidno:190信号肽mefglswlflvailkgvqcsrseqidno:191bm2b3可变轻链gacatccagctgacacaaagtcccagtagcctgtcagccagtgtcggcgatagggtgacaattacatgctccgcaagtagtagcgtcagattcatacactggtaccagcagaagcctgggaaggccccaaagaggcttatctacgataccagtaaactcgcctctggagttcctagccggttttctggatctggcagcggaactagctacaccctcacaatctccagtctgcaaccagaggactttgcaacctactactgccagcaatggagcagctcccctttcacctttgggcagggtactaaggtggagatcaagseqidno:192bm2b3可变轻链diqltqspsslsasvgdrvtitcsasssvrfihwyqqkpgkapkrliydtsklasgvpsrfsgsgsgtsytltisslqpedfatyycqqwssspftfgqgtkveikseqidno:193柔性接头ggcggaggaagcggaggtgggggcseqidno:194柔性接头gggsggggseqidno:195bm2b3可变重链gaggtgcagcttgtagagagcgggggaggcctcgtacagccagggggctctctgcgcctgtcatgtgcagcttcaggattcaatataaaggactattacattcactgggtacggcaagctcccggtaagggcctggaatggatcggttggatcgaccctgaaaacggagatacagaatttgtgcccaagttccagggaaaggctaccatgtctgccgatacttctaagaatacagcataccttcagatgaattctctccgcgccgaggacacagccgtgtattattgtaaaacgggagggttctggggtcagggtacccttgtgactgtgtcttccseqidno:196bm2b3可变重链evqlvesggglvqpggslrlscaasgfnikdyyihwvrqapgkglewigwidpengdtefvpkfqgkatmsadtskntaylqmnslraedtavyycktggfwgqgtlvtvssseqidno:197接头ggggatcccgccseqidno:198接头gdpaseqidno:199igg1铰链区gagcccaaatctcctgacaaaactcacacatgcccaseqidno:200igg1铰链区epkspdkthtcpseqidno:201igg1ch2区ccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaagacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtatgtggacggcgtggaggtgcataatgcaaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaaseqidno:202igg1ch2区pcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakseqidno:203igg1ch3区gggcagccccgagaaccacaggtgtacaccctgcccccatcccgggatgagctgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcaaccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaaseqidno:204igg1ch3区gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkseqidno:205接头aaagatcccaaaseqidno:206接头kdpkseqidno:207cd28跨膜区ttttgggtgctggtggtggttggtggagtcctggcttgctatagcttgctagtaacagtggcctttattattseqidno:208cd28跨膜区fwvlvvvggvlacysllvtvafiiseqidno:209接头gccggcseqidno:210接头agseqidno:211cd3ζagagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgcseqidno:212cd3ζrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalpprseqidno:213myd88gccgctgggggcccaggcgccggatcagctgctcccgtatcttctacttcttctttgccgctggctgctctgaacatgcgcgtgagaagacgcctctccctgttccttaacgttcgcacacaagtcgctgccgattggaccgcccttgccgaagaaatggactttgaatacctggaaattagacaacttgaaacacaggccgaccccactggcagactcctggacgcatggcagggaagacctggtgcaagcgttggacggctcctggatctcctgacaaaactgggacgcgacgacgtactgcttgaactcggacctagcattgaagaagactgccaaaaatatatcctgaaacaacaacaagaagaagccgaaaaacctctccaagtcgcagcagtggactcatcagtaccccgaacagctgagcttgctgggattactacactcgacgacccactcggacatatgcctgaaagattcgacgctttcatttgctattgcccctctgacataseqidno:214myd88aaggpgagsaapvsstsslplaalnmrvrrrlslflnvrtqvaadwtalaeemdfeyleirqletqadptgrlldawqgrpgasvgrlldlltklgrddvllelgpsieedcqkyilkqqqeeaekplqvaavdssvprtaelagittlddplghmperfdaficycpsdiseqidno:215cd40aagaaagttgcaaagaaacccacaaataaagccccacaccctaaacaggaaccccaagaaatcaatttcccagatgatctccctggatctaatactgccgccccggtccaagaaaccctgcatggttgccagcctgtcacccaagaggacggaaaagaatcacggattagcgtacaagagagacaatagseqidno:216cd40kkvakkptnkaphpkqepqeinfpddlpgsntaapvqetlhgcqpvtqedgkesrisvqerq*pbpo425的序列pbp0521-sfg-cd19scfv.ch2ch3.cd28tm.myd88/cd40.ζ序列seqidno:217信号肽atggagtttggactttcttggttgtttttggtggcaattctgaagggtgtccagtgtagcaggseqidno:218信号肽mefglswlflvailkgvqcsrseqidno:219fmc63可变轻链gacatccagatgacacagactacatcctccctgtctgcctctctgggagacagagtcaccatcagttgcagggcaagtcaggacattagtaaatatttaaattggtatcagcagaaaccagatggaactgttaaactcctgatctaccatacatcaagattacactcaggagtcccatcaaggttcagtggcagtgggtctggaacagattattctctcaccattagcaacctggagcaagaagatattgccacttacttttgccaacagggtaatacgcttccgtacacgttcggaggggggactaagttggaaataacaseqidno:220fmc63可变轻链diqmtqttsslsaslgdrvtiscrasqdiskylnwyqqkpdgtvklliyhtsrlhsgvpsrfsgsgsgtdysltisnleqediatyfcqqgntlpytfgggtkleitseqidno:221柔性接头ggcggaggaagcggaggtgggggcseqidno:222柔性接头gggsggggseqidno:223fmc63可变重链gaggtgaaactgcaggagtcaggacctggcctggtggcgccctcacagagcctgtccgtcacatgcactgtctcaggggtctcattacccgactatggtgtaagctggattcgccagcctccacgaaagggtctggagtggctgggagtaatatggggtagtgaaaccacatactataattcagctctcaaatccagactgaccatcatcaaggacaactccaagagccaagttttcttaaaaatgaacagtctgcaaactgatgacacagccatttactactgtgccaaacattattactacggtggtagctatgctatggactactggggtcaaggaacctcagtcaccgtctcctcaseqidno:224fmc63可变重链evklqesgpglvapsqslsvtctvsgvslpdygvswirqpprkglewlgviwgsettyynsalksrltiikdnsksqvflkmnslqtddtaiyycakhyyyggsyamdywgqgtsvtvssseqidno:225接头ggggatcccgccseqidno:226接头gdpaseqidno:227igg1铰链gagcccaaatctcctgacaaaactcacacatgcccaseqidno:228igg1铰链epkspdkthtcpseqidno:229igg1ch2区ccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaagacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtatgtggacggcgtggaggtgcataatgcaaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaaseqidno:230igg1ch2区pcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakseqidno:231igg1ch3区gggcagccccgagaaccacaggtgtacaccctgcccccatcccgggatgagctgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcaaccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaaseqidno:232igg1ch3区gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkseqidno:233接头aaagatcccaaaseqidno:234接头kdpkseqidno:235cd28跨膜区ttttgggtgctggtggtggttggtggagtcctggcttgctatagcttgctagtaacagtggcctttattattseqidno:236cd28跨膜区fwvlvvvggvlacysllvtvafiiseqidno:237接头ctcgagseqidno:238接头leseqidno:239myd88atggccgctgggggcccaggcgccggatcagctgctcccgtatcttctacttcttctttgccgctggctgctctgaacatgcgcgtgagaagacgcctctccctgttccttaacgttcgcacacaagtcgctgccgattggaccgcccttgccgaagaaatggactttgaatacctggaaattagacaacttgaaacacaggccgaccccactggcagactcctggacgcatggcagggaagacctggtgcaagcgttggacggctcctggatctcctgacaaaactgggacgcgacgacgtactgcttgaactcggacctagcattgaagaagactgccaaaaatatatcctgaaacaacaacaagaagaagccgaaaaacctctccaagtcgcagcagtggactcatcagtaccccgaacagctgagcttgctgggattactacactcgacgacccactcggacatatgcctgaaagattcgacgctttcatttgctattgcccctctgacataseqidno:240myd88maaggpgagsaapvsstsslplaalnmrvrrrlslflnvrtqvaadwtalaeemdfeyleirqletqadptgrlldawqgrpgasvgrlldlltklgrddvllelgpsieedcqkyilkqqqeeaekplqvaavdssvprtaelagittlddplghmperfdaficycpsdiseqidno:241cd40aagaaagttgcaaagaaacccacaaataaagccccacaccctaaacaggaaccccaagaaatcaatttcccagatgatctccctggatctaatactgccgccccggtccaagaaaccctgcatggttgccagcctgtcacccaagaggacggaaaagaatcacggattagcgtacaagagagacaaseqidno:242cd40kkvakkptnkaphpkqepqeinfpddlpgsntaapvqetlhgcqpvtqedgkesrisvqerqseqidno:243接头gcggccgcagtcgagseqidno:244接头aaaveseqidno:245cd3ζ链agagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgctaaseqidno:246cd3ζ链rvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr*sfg-myr.mc-2a-cd19.scfv.cd34e.cd8stm.ζ的序列sfg-myr.mc.2a.cd19scfv.cd34e.cd8stm.ζ序列seqidno:247肉豆蔻酰化(myristolation)atggggagtagcaagagcaagcctaaggaccccagccagcgcseqidno:248肉豆蔻酰化mgsskskpkdpsqrseqidno:249接头ctcgacseqidno:250接头ldseqidno:251myd88atggctgcaggaggtcccggcgcggggtctgcggccccggtctcctccacatcctcccttcccctggctgctctcaacatgcgagtgcggcgccgcctgtctctgttcttgaacgtgcggacacaggtggcggccgactggaccgcgctggcggaggagatggactttgagtacttggagatccggcaactggagacacaagcggaccccactggcaggctgctggacgcctggcagggacgccctggcgcctctgtaggccgactgctcgatctgcttaccaagctgggccgcgacgacgtgctgctggagctgggacccagcattgaggaggattgccaaaagtatatcttgaagcagcagcaggaggaggctgagaagcctttacaggtggccgctgtagacagcagtgtcccacggacagcagagctggcgggcatcaccacacttgatgaccccctggggcatatgcctgagcgtttcgatgccttcatctgctattgccccagcgacatcseqidno:252myd88maaggpgagsaapvsstsslplaalnmrvrrrlslflnvrtqvaadwtalaeemdfeyleirqletqadptgrlldawqgrpgasvgrlldlltklgrddvllelgpsieedcqkyilkqqqeeaekplqvaavdssvprtaelagittlddplghmperfdaficycpsdiseqidno:253接头gtcgagseqidno:254接头veseqidno:255cd40aaaaaggtggccaagaagccaaccaataaggccccccaccccaagcaggagccccaggagatcaattttcccgacgatcttcctggctccaacactgctgctccagtgcaggagactttacatggatgccaaccggtcacccaggaggatggcaaagagagtcgcatctcagtgcaggagagacagseqidno:256cd40kkvakkptnkaphpkqepqeinfpddlpgsntaapvqetlhgcqpvtqedgkesrisvqerqseqidno:257接头ccgcggseqidno:258接头prseqidno:259t2a序列gaaggccgagggagcctgctgacatgtggcgatgtggaggaaaacccaggaccaseqidno:260t2a序列egrgslltcgdveenpgpseqidno:261信号肽atggagtttggactttcttggttgtttttggtggcaattctgaagggtgtccagtgtagcaggseqidno:262信号肽mefglswlflvailkgvqcsrseqidno:263fmc63可变轻链gacatccagatgacacagactacatcctccctgtctgcctctctgggagacagagtcaccatcagttgcagggcaagtcaggacattagtaaatatttaaattggtatcagcagaaaccagatggaactgttaaactcctgatctaccatacatcaagattacactcaggagtcccatcaaggttcagtggcagtgggtctggaacagattattctctcaccattagcaacctggagcaagaagatattgccacttacttttgccaacagggtaatacgcttccgtacacgttcggaggggggactaagttggaaataacaseqidno:264fmc63可变轻链diqmtqttsslsaslgdrvtiscrasqdiskylnwyqqkpdgtvklliyhtsrlhsgvpsrfsgsgsgtdysltisnleqediatyfcqqgntlpytfgggtkleitseqidno:265柔性接头ggcggaggaagcggaggtgggggcseqidno:266柔性接头gggsggggseqidno:267fmc63可变重链gaggtgaaactgcaggagtcaggacctggcctggtggcgccctcacagagcctgtccgtcacatgcactgtctcaggggtctcattacccgactatggtgtaagctggattcgccagcctccacgaaagggtctggagtggctgggagtaatatggggtagtgaaaccacatactataattcagctctcaaatccagactgaccatcatcaaggacaactccaagagccaagttttcttaaaaatgaacagtctgcaaactgatgacacagccatttactactgtgccaaacattattactacggtggtagctatgctatggactactggggtcaaggaacctcagtcaccgtctcctcaseqidno:268fmc63可变重链evklqesgpglvapsqslsvtctvsgvslpdygvswirqpprkglewlgviwgsettyynsalksrltiikdnsksqvflkmnslqtddtaiyycakhyyyggsyamdywgqgtsvtvssseqidno:269接头ggatccseqidno:270接头gsseqidno:271cd34最小表位gaacttcctactcaggggactttctcaaacgttagcacaaacgtaagtseqidno:272cd34最小表位elptqgtfsnvstnvsseqidno:273cd8α茎结构域cccgccccaagaccccccacacctgcgccgaccattgcttctcaacccctgagtttgagacccgaggcctgccggccagctgccggcggggccgtgcatacaagaggactcgatttcgcttgcgacseqidno:274cd8α茎结构域paprpptpaptiasqplslrpeacrpaaggavhtrgldfacdseqidno:275cd8α跨膜结构域atctatatctgggcacctctcgctggcacctgtggagtccttctgctcagcctggttattactctgtactgtaatcaccggaatcgccgccgcgtttgtaagtgtcccaggseqidno:276cd8α跨膜结构域iyiwaplagtcgvlllslvitlycnhrnrrrvckcprseqidno:277接头gtcgacseqidno:278接头vdseqidno:279cd3ζagagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgcseqidno:280cd3ζrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalpprseqidno:281(myd88核苷酸序列)atggctgcaggaggtcccggcgcggggtctgcggccccggtctcctccacatcctcccttcccctggctgctctcaacatgcgagtgcggcgccgcctgtctctgttcttgaacgtgcggacacaggtggcggccgactggaccgcgctggcggaggagatggactttgagtacttggagatccggcaactggagacacaagcggaccccactggcaggctgctggacgcctggcagggacgccctggcgcctctgtaggccgactgctcgagctgcttaccaagctgggccgcgacgacgtgctgctggagctgggacccagcattgaggaggattgccaaaagtatatcttgaagcagcagcaggaggaggctgagaagcctttacaggtggccgctgtagacagcagtgtcccacggacagcagagctggcgggcatcaccacacttgatgaccccctggggcatatgcctgagcgtttcgatgccttcatctgctattgccccagcgacatccagtttgtgcaggagatgatccggcaactggaacagacaaactatcgactgaagttgtgtgtgtctgaccgcgatgtcctgcctggcacctgtgtctggtctattgctagtgagctcatcgaaaagaggtgccgccggatggtggtggttgtctctgatgattacctgcagagcaaggaatgtgacttccagaccaaatttgcactcagcctctctccaggtgcccatcagaagcgactgatccccatcaagtacaaggcaatgaagaaagagttccccagcatcctgaggttcatcactgtctgcgactacaccaacccctgcaccaaatcttggttctggactcgccttgccaaggccttgtccctgcccseqidno:282(myd88氨基酸序列)maaggpgagsaapvsstsslplaalnmrvrrrlslflnvrtqvaadwtalaeemdfeyleirqletqadptgrlldawqgrpgasvgrllelltklgrddvllelgpsieedcqkyilkqqqeeaekplqvaavdssvprtaelagittlddplghmperfdaficycpsdiqfvqemirqleqtnyrlklcvsdrdvlpgtcvwsiaseliekrcrrmvvvvsddylqskecdfqtkfalslspgahqkrlipikykamkkefpsilrfitvcdytnpctkswfwtrlakalslp实施例17:改善的治疗性细胞衰减器开关的开发使用表达针对肿瘤相关抗原(taa)的嵌合抗原受体(car)的自体t细胞的疗法已对某些类型的白血病(“液体瘤”)和淋巴瘤的治疗具有转化作用,客观应答(or)率接近90%。尽管它们具有很大的临床前景和可预测的随之而来的热情,但这一成功被所观察到的高水平的中靶(on-target)、脱肿瘤(off-tumor)不良事件(细胞因子释放综合征(crs)的特征)减弱。为了维持这些革命性治疗的益处同时使风险最小化,已开发了基于嵌合胱天蛋白酶多肽的自杀基因系统,其基于合成的配体介导的对经修饰的胱天蛋白酶-9蛋白质的二聚化,所述蛋白质与称为fkbp12v36的配体结合结构域融合。在fkbp12v36与小分子二聚化剂瑞米达西(ap1903)的结合的情况下,胱天蛋白酶-9被活化,导致靶细胞的快速细胞凋亡。添加降低水平的瑞米达西可导致减弱的杀伤率,允许t细胞消除的量从嵌合的经胱天蛋白酶修饰的t细胞几乎没有被调控到其几乎完全被消除。为了使该“衰减器”开关的效用最大化,剂量-应答曲线的斜率应当尽可能渐进;否则,正确剂量的施用是具有挑战性的。利用当前的第一代临床i胱天蛋白酶-9构建体,已观察到覆盖约1.5到2log的剂量应答曲线。为了改善治疗性细胞衰减器功能,可将第二水平的控制添加到胱天蛋白酶-9聚集中,将雷帕霉素驱动的低水平聚集与瑞米达西驱动的高水平二聚化分离。在第一水平的控制中,嵌合胱天蛋白酶多肽通过雷帕霉素/西罗莫司(sirolimus)(或非免疫抑制剂类似物)募集到嵌合抗原受体(car),所述嵌合抗原受体经修饰以含有在其羧基端上的89-氨基酸fkbp12-雷帕霉素结合(frb)结构域(在mtor内编码)的一个或多个拷贝(图3,左图)。相对于瑞米达西驱动的i胱天蛋白酶-9的同二聚化,预测胱天蛋白酶-9寡聚的水平将会降低,这既归因于雷帕霉素结合的fkbp12v36对frb(kd为约4nm)相对于瑞米达西结合的fkbp12v36(约0.1nm)的相对亲和力,也归因于交联蛋白质的“交错”几何形状。可通过改变融合到每个car的frb结构域的数目,在car对接位点提供额外水平的“微调”。同时,靶标依赖的特异性将由正常的靶标驱动的car成簇提供,而该car成簇进而应当在存在雷帕霉素的情况下转换成嵌合胱天蛋白酶多肽成簇。当需要最大水平的细胞消除时,瑞米达西也可按照当前的方案(即当前在2小时输注中为0.4mg/kg)施用(图3,右图)。方法:雷帕霉素类似物调控的嵌合胱天蛋白酶多肽的载体:schreiber实验室最初鉴别出来自mtor/frap的最小fkbp12-雷帕霉素结合(frb)结构域(残基2025-2114),确定其具有约4nm的雷帕霉素解离常数(kd)(chenj等(95)pnas92,4947-51)。随后的研究鉴别出frb的正交突变体,例如frbl(l2098),其以相对高的亲和力与非免疫抑制剂“凸起”雷帕霉素类似物(“雷帕霉素类似物(rapalog)”)结合(liberlessd(97)pnas94,7825-30;baylejh(06)chem&biol13,99-107)。为了开发可募集ic9的经修饰的mc-car,使用商业合成的含有myd88、cd40和cd3ζ结构域的sali-mlui片段将羧基端cd3ζ结构域(来自pbp0526和pbp0545,图7)融合到1或2个串联的frbl结构域以分别产生载体pbp0612和pbp0611(图4和图5)以及表7和表8。所述方法还应当适用于任何car构建体,包括标准的“非myd88/cd40”构建体,例如包含cd28、ox40和/或4-1bb以及cd3ζ的那些。结果:作为主要证据,将两个串联的frbl结构域融合到第1代her2-car或共表达诱导型胱天蛋白酶-9的第1代cd19-car。用组成型报告质粒srα-seap连同归一化水平的编码her2-car-frbl2、i胱天蛋白酶-9、her2-car-frbl2+icasp9、ic9-car(19).frbl2(共表达cd19-car-frbl2和i胱天蛋白酶9二者)的表达质粒或对照载体瞬时转染293细胞。在24小时之后,将细胞洗涤并分布到具有雷帕霉素或瑞米达西的半对数稀释物的一式两份孔中。在与药物孵育过夜之后,确定seap活性。有趣的是,雷帕霉素的添加导致seap活性最高达约50%降低的大幅度减弱(图6)。该剂量依赖性降低需要frb标记的car和fkbp标记的胱天蛋白酶-9的存在。相比之下,ap1903在低得多的药物水平将seap活性降低到约20%的正常水平,与先前的经历相当。可能可用雷帕霉素降低细胞存活力,并且如果需要,可转换为瑞米达西以实现更有效的体内杀伤。此外,中靶或脱靶介导的car成簇应当增加主要在scfv接合位点杀伤的敏感性。异质开关(hetero-switch)的另外排列:尽管诱导型胱天蛋白酶-9已被发现是在一大组群诱导型信号传导分子中测试的最快且最cid敏感的自杀基因,但导致细胞凋亡(或触发炎症和坏死作为细胞死亡手段的相关坏死性凋亡(necroptosis))的许多其他蛋白质或蛋白质结构域可适于使用该方法进行的基于同二聚体或异二聚体的杀伤。可通过雷帕霉素(或雷帕霉素类似物)介导的膜募集活化的蛋白质的一部分列表包括:其他胱天蛋白酶(即,已在哺乳动物中鉴别的胱天蛋白酶1到14)其他胱天蛋白酶缔合的衔接分子,例如fadd(ded)、apaf1(card)、cradd/raidd(card)和asc(card),其作为天然胱天蛋白酶二聚化剂起作用(括号内为二聚化结构域)。促细胞凋亡bcl-2家族成员,例如bax和bak,其可引起线粒体去极化(或抗细胞凋亡家族成员如bcl-xl或bcl-2的错误定位)。ripk3或ripk1-rhim结构域,其由于mlkl介导的膜裂解而可触发相关形式的促炎性细胞死亡,称为坏死性凋亡。car受体由于其靶标依赖性聚集水平而应为雷帕霉素介导的促细胞凋亡分子募集提供理想的对接位点。然而,存在含有frb结构域的多价对接位点的许多示例,所述frb结构域可在存在共表达的嵌合诱导型胱天蛋白酶样分子的情况下提供雷帕霉素类似物介导的细胞死亡。表7:icasp9-2a-δcd19-q-cd28stm-mcz-frbl2表8表9pbp0545.psfg.icasp9.2a.her2scfv.q.cd8stm.mc-ζ本文所讨论的方法,包括但不限于用于构建载体的方法、用于活性或功能的测定、向患者的施用、转染或转化细胞、测定和用于监测患者的方法也可在以下专利和专利申请中找到,所述专利和专利申请的全部内容在此以引用方式并入本文。美国专利申请序列号14/210,034,其于2014年3月13日提交,标题为用于控制t细胞增殖的方法(methodsforcontrollingtcellproliferation);美国专利申请序列号13/112,739,其于2011年5月20日提交,于2015年7月28日作为美国专利9,089,520颁布,且标题为用于诱导选择性细胞凋亡的方法(methodsforinducingselectiveapoptosis);美国专利申请序列号14/622,018,其于2014年2月13日提交,标题为用于使用诱导型嵌合多肽活化t细胞的方法(methodsforactivatingtcellsusinganinduciblechimericpolypeptide);美国专利申请序列号13/112,739,其于2011年5月20日提交,标题为用于诱导选择性细胞凋亡的方法;美国专利申请序列号13/792,135,其于2013年3月10日提交,标题为修饰的胱天蛋白酶多肽和其用途(modifiedcaspasepolypeptidesandusesthereof);美国专利申请序列号14/296,404,其于2014年6月4日提交,标题为用于使用胱天蛋白酶多肽诱导部分细胞凋亡的方法(methodsforinducingpartialapoptosisusingcaspasepolypeptides);于2014年9月2日提交的美国临时专利申请序列号62/044,885和于2015年9月1日提交的美国专利申请14/842,710,各自标题为通过myd88和cd40多肽对嵌合抗原受体的共刺激(costimulationofchimericantigenreceptorsbymyd88andcd40polypeptides);美国专利申请序列号14/640,554,其于2015年3月6日提交,标题为具有改进的活性的胱天蛋白酶多肽和其用途(caspasepolypeptideshavingmodifiedactivityandusesthereof);于2008年6月29日颁予spencer,d.等的美国专利号7,404,950、于2010年10月26日提交的spencer,d.等的美国专利申请12/445,939;于2009年9月21日提交的spencer,d.等的美国专利申请12/563,991;于2011年4月14日提交的slawin,k.,等的美国专利申请13/087,329;于2013年2月8日提交的spencer,d.等的美国专利申请13/763,591;和国际专利申请号pct/us2014/022004,其于2014年3月7日提交,作为pct/us2014/022004以9102014公开,标题为修饰的胱天蛋白酶多肽和其用途。实施例18:i胱天蛋白酶-9的基于frb的支架组装和活化。为了确定i胱天蛋白酶-9是否可通过frbl的串联多聚体聚集,将frbl的1到4个串联拷贝亚克隆到表达载体psh1中,从srα启动子驱动转基因表达。构建体的亚类还包含来自用于frb支架的膜定位的v-src的肉豆蔻酰化靶向结构域(图12a)。用srα-seap报告质粒连同fkbp12-δ胱天蛋白酶-9(i胱天蛋白酶-9/ic9)加上数种基于frb的非肉豆蔻酰化支架蛋白质中的一种转染293细胞,该基于frb的非肉豆蔻酰化支架蛋白质含有frbl的0个、1个或4个串联拷贝。当存在4×frb构建体时,添加雷帕霉素或通过luengo等(luengoji(95)chem&biol2,471-81.luengoji(94)j.orgchem59:6512-13)的方法产生的类似物c7-异丙氧基雷帕霉素导致报告子活性的降低,这与在约3nm的ic50(图12b)所预测(图8b、图10d、图10e)的细胞死亡一致。当仅存在1个(或0个)frb结构域时,添加雷帕霉素对报告子活性没有影响,这将阻止icasp9的寡聚(图10c)。当frb-支架被肉豆蔻酰化(图12c)以将所述支架定位于质膜时获得相似的结果。因此,当在基于frb的支架上寡聚化时,可用雷帕霉素或类似物活化胱天蛋白酶-9多肽。实施例19:基于fkbp12的支架组装并活化frb-δ胱天蛋白酶-9。为了确定是否可逆转异二聚化的极性和胱天蛋白酶-9组装,如上将fkbp12的1到4个串联拷贝亚克隆到表达载体psh1中。(图13a)。如上用srα-seap报告质粒连同frbl-δ胱天蛋白酶-9加上含有fkbp12的1个或4个串联拷贝的非肉豆蔻酰化支架蛋白质转染293细胞。当存在4×frbl构建体时,添加雷帕霉素或类似物c7-异丙氧基雷帕霉素导致报告子活性的降低,这与在约3nm的ic50(图13b)下的细胞死亡一致。当仅存在1个(或0个)fkbp结构域时,添加雷帕霉素对报告子活性没有影响,这类似于图12中的结果。因此,当在基于frb或fkbp12的支架上寡聚化时,可用雷帕霉素或类似物活化胱天蛋白酶-9。实施例20:原代t细胞中i胱天蛋白酶-9的基于frb的支架组装和活化。为了确定i胱天蛋白酶-9是否可通过原代未经转化的t细胞中frbl的串联多聚体聚集,将frbl的零到三个串联拷贝亚克隆到编码胱天蛋白酶-9(ic9)连同用作表面标志物的非信号截短形式的cd19的逆转录病毒表达载体pbp0220-psfg-ic9.t2a-δcd19中。所得统一质粒载体(命名为pbp0756—ic9.t2a-δcd19.p2a-frbl、pbp0755—ic9.t2a-δcd19.p2a-frbl2和pbp0757—ic9.t2a-δcd19.p2a-frbl3)随后分别用于制备编码1个、2个或3个串联frbl结构域的支架的感染性γ-逆转录病毒(γ-rv)。将来自3个不同供体的t细胞用载体转导并与不同的雷帕霉素稀释物平铺。在24小时和48小时之后,收获细胞等分试样,用抗cd19apc染色并通过流式细胞术分析。通过fsc相对于ssc首先在活淋巴细胞上对细胞进行门控,然后将淋巴细胞绘制为cd19直方图,并在cd19+门内针对高、中和低表达进行亚门控。制备线图以表示归一化为无“0”药物对照的表达高水平cd19的总细胞群体的相对百分比(图14)。与在经转化的上皮细胞中进行的替代seap报告子测定相似,随着雷帕霉素浓度增加,cd19hi细胞在表达胱天蛋白酶-9和frbl2或frbl3的细胞中的百分比降低,但在表达胱天蛋白酶-9连同0个或1个frbl结构域的细胞中未降低,指示雷帕霉素诱导基于frb的支架和i胱天蛋白酶9之间的异二聚化,导致胱天蛋白酶-9二聚化和细胞死亡。当用c7-异丙氧基雷帕霉素替代雷帕霉素时见到相似结果。实施例21:附接到信号传导分子的基于frb的支架可将i胱天蛋白酶-9二聚化并活化。为了确定frb的多聚体是否仍然用作募集支架以使得当附接到另一信号传导结构域时能够进行雷帕霉素类似物介导的胱天蛋白酶-9二聚化,将1或2个frbl结构域融合到有效的嵌合刺激分子myd88/cd40以分别获得imc.frbl(pbp0655)和imc.frbl2(pbp0498)(图9b)。作为初始测试,用报告质粒srα-seap、胱天蛋白酶9、第1代抗her2car(pbp0488)和(pbp0655或pbp0498)瞬时转染293细胞(图15)。对照转染物含有单独的胱天蛋白酶-9(pbp0044)或egfp表达载体(pbp0047)。在存在瑞米达西的情况下,含有胱天蛋白酶-9的细胞而不是对照egfp-细胞通常被胱天蛋白酶-9同二聚化剂杀伤,反映为seap活性降低(图15,左图);然而,雷帕霉素仅在表达imc.frbl2和胱天蛋白酶-9的细胞中触发seap减少,而在表达imc.frbl和胱天蛋白酶-9的细胞或对照细胞中并不如此。因此,在含有融合到不同蛋白质(例如myd88/cd40)的frbl的多聚体的细胞中,异二聚化剂介导的胱天蛋白酶-9的活化是可能的。在用于雷帕霉素类似物介导的对胱天蛋白酶-9的基于支架的活化的第二测试中,用srα-seap报告质粒,加上与第一代抗cd19car共表达的肉豆蔻酰化或非肉豆蔻酰化的诱导型imc,加上frbl2融合的胱天蛋白酶-9(质粒pbp0467)瞬时转染293细胞(图16)。在24小时之后,用瑞米达西、雷帕霉素或c7-异丙氧基(isop)-雷帕霉素的对数稀释物处理细胞。与fkbp12连接的胱天蛋白酶-9(ic9)不同,frbl2-胱天蛋白酶-9不被瑞米达西活化;然而,当存在串联fkbp时,它被雷帕霉素或c7-异丙氧基-雷帕霉素活化。因此,雷帕霉素和类似物可通过包含frb或fkbp12结构域的分子支架活化胱天蛋白酶-9。实施例22:imc“开关”fkbpx2.myd88.cd40在雷帕霉素存在下产生针对frbl2.胱天蛋白酶9的支架以诱导细胞死亡。在原代t细胞中测试使用imc作为用于活化frbl2-胱天蛋白酶-9的基于fkbp12的支架(图17)。用来源于sfg-δmyr.imc.2a-cd19(pbp0606)和sfg-frbl2.胱天蛋白酶9.2a-q.8stm.ζ(pbp0668)的γ-rv转导原代t细胞(2个供体)。然后将经转导的t细胞与雷帕霉素的5倍稀释物平铺。在24小时之后,收获细胞并通过流式细胞术分析imc(通过抗cd19-apc)、胱天蛋白酶-9(通过抗cd34-pe)的表达和t细胞同一性(通过抗cd3-percpcy5.5)。首先通过fsc相对于ssc门控细胞的淋巴细胞形态,之后门控cd3表达(约99%的淋巴细胞)。为了集中于经双重转导的细胞,针对cd19+(δmyr.imc.2a-cd19)和cd34+(frbl2.胱天蛋白酶9.2a-q.8stm.ζ)的表达对cd3+淋巴细胞进行门控。为了使门控群体归一化,将每个样品内cd34+cd19+细胞的百分比除以cd19+cd34-细胞百分比作为内部对照。然后将这些值归一化为设定为100%的针对每次转导的无药物孔。结果显示在存在相对低(2nm)水平的雷帕霉素的情况下对双重转导细胞的快速且有效的消除(图17a、图17c)。在cd34+cd19+门内对hi表达的细胞、med表达的细胞和lo表达的细胞应用类似分析(图17b)。随着雷帕霉素的浓度增加,cd34+cd19+细胞%降低,指示细胞消除。最后,用δmyr.imc.2a-cd19(pbp0606)和frbl2.胱天蛋白酶9.2a-q.8stm.ζ(pbp0668)转导来自单个供体的t细胞,并将其平铺于含有il-2连同不同浓度的雷帕霉素的培养基中,且保持24或48hr。在24或48hr之后,如上所述收获细胞并通过流式细胞术分析。有趣的是,尽管表达高水平的两种转基因的细胞的消除在24小时时接近完成,但到48小时时,甚至表达低水平的两种转基因的细胞也被雷帕霉素杀伤,显示了所述方法在原代t细胞中的效率(图17d)。实施例23:实施例17-21中讨论的质粒和序列的示例pbp0044:psh1-i胱天蛋白酶9wtpbp0463--psh1-fpk-fpk’.ls.fpk”.fpk”’.ls.hapbp0725--psh1-frbl.frbl’.ls.frbl”.frbl”’pbp0465--psh1-m-frbl.frbl’.ls.hapbp0722--psh1-fpk-fpk’.ls.fpk”.fpk”’.ls.hapbp0220--psfg-ic9.t2a-δcd19pbp0756--psfg-ic9.t2a-dcd19.p2a-frblpbp0755--psfg-ic9.t2a-dcd19.p2a-frbl2pbp0757--psfg-ic9.t2a-dcd19.p2a-frbl3pbp0655--psfg-δmyr.frbl.mc.2a-δcd19pbp0498--psfg-δmyr.imc.frbl2.p2a-δcd19pbp0488--psfg-aher2.q.8stm.cd3ζ.fpk2pbp0467--psh1-frbl’.frbl.ls.δ胱天蛋白酶9pbp0606--psfg-k-δmyr.imc.2a-δcd19pbp0607--psfg-k-imc.2a-δcd19pbp0668--psfg-frblx2.胱天蛋白酶9.2a-q.8stm.cd3ζpbp0608-psfg-δmyr.imc.2a-δcd19.q.8stm.cd3ζpbp0609:psfg-imc.2a-δcd19.q.8stm.cd3ζ实施例24:由异二聚化配体引导的诱导型细胞死亡开关方法细胞的转染将hek293t细胞(5×105个)接种在100-mm组织培养皿上补充有谷氨酰胺、青霉素/链霉素和10%胎牛血清的10mldmem4500中。在孵育16-30小时之后,使用novagen's方案转染细胞。简单地说,对于每次转染,将0.5mloptimem吸移到1.5ml微量离心管中,并添加15μlgenejuice试剂,之后涡旋5秒。将样品静置5分钟以使genejuice悬浮液沉降。将dna(总共5μg)添加到每个管中并通过上下吸移4次来混合。使样品静置5分钟以形成genejuice-dna复合物,并将悬浮液逐滴添加到一个293t细胞平皿中。典型的转染含有1μgsrα-seap(pbp0046)(3)、2μgfrb-胱天蛋白酶-9(pbp0463)和2μgfkbpv12-胱天蛋白酶-9(pbp0044)(7)。用二聚化药物刺激细胞在转染后24小时(4.1),将293t细胞分配到96孔板中并与二聚化药物的稀释物孵育。简单地说,将100μl培养基添加到96孔平底板的每个孔中。将药物在管中稀释到浓度为待放置在板上的梯度中最高浓度的4倍。将100μl二聚化配体(瑞米达西、雷帕霉素、异丙氧基雷帕霉素)添加到板最右侧上的三个孔中的每一个孔中(由此以一式三份进行测定)。然后将来自每个含有药物的孔的100μl转移到相邻孔中,并且该循环重复10次以产生连续的两倍步骤梯度。最后几个孔未经处理,并用作用于基础报告子活性的对照。然后将经转染的293细胞用胰蛋白酶消化,用完全培养基洗涤,悬浮于培养基中,并将100μl等分到含有药物(或无药物)的每个孔中。将细胞孵育24小时。报告子活性的测定srα启动子是一种杂交转录元件,其包含sv40早期区(其驱动t抗原转录)和人嗜t淋巴细胞病毒(htlv-1)的长末端重复(ltr)的部分(r和u5)。该启动子驱动分泌型碱性磷酸盐(seap)报告子的高组成性水平。胱天蛋白酶-9通过二聚化活化快速导致细胞死亡,并且细胞死亡比例随着药物量的增加而增加。当细胞死亡时,报告子的转录和翻译终止,但已分泌的报告子蛋白质在培养基中持久存在。因此,组成型seap活性的损失是细胞死亡活化的药物依赖性的有效指标(proxy)。在药物刺激之后24小时,将96孔板包裹以防止蒸发,并在65℃孵育2小时以使内源性和血清磷酸酶失活,同时热稳定的seap报告子保留(1,4,12)。将来自每个孔的100μl样品加样到具有黑色侧的96孔测定板的各个孔中。将样品与ph为10.0的0.5mm二乙醇胺中的0.5mm磷酸4-甲基伞形酮酯(4-mup)孵育4到16小时。通过具有在355nm处激发和在460nm处发射的荧光来测量磷酸酶活性。数据被转移到microsoftexcel电子表格中进行制表,并用graphpadprism绘图。异丙氧基雷帕霉素的生产采用luengo等((j.org.chem59:6512,(1994)),(16,17))的方法。简单地说,将20mg雷帕霉素溶解于3ml异丙醇中,并添加22.1mg对甲苯磺酸,并且在室温下在搅拌下孵育4-12小时。在完成时,添加5ml乙酸乙酯并将产物用饱和碳酸氢钠萃取5次,并且用盐水(饱和氯化钠)萃取3次。将有机相干燥并再溶解于乙酸乙酯:己烷(3:1)中。通过在3-4kpa压力下在10到15ml硅胶柱上用3:1乙酸乙酯:己烷进行快速色谱来拆分立体异构体和次要产物,并将级分干燥。在237nm、267nm、278nm和290nm处通过分光光度法测定级分,并测试frb等位基因特异性转录开关中的结合特异性。用雷帕霉素将frb-胱天蛋白酶与fkbp-胱天蛋白酶直接二聚化引导细胞凋亡。fkbp融合的胱天蛋白酶的二聚化可被同二聚化剂分子(例如ap1510、ap20187或ap1903)二聚化。可经由使用雷帕霉素,通过使frb-胱天蛋白酶-9融合蛋白质连同fkbp-胱天蛋白酶-9共表达,导致胱天蛋白酶结构域的同二聚化,使二元开关异二聚化来引导类似的促细胞凋亡开关。在图37中,将组成型活化的seap报告质粒连同胱天蛋白酶构建体一起共转染到293t细胞中。经转染的细胞大量产生seap,所述seap易于在没有药物的情况下测量,并且在实验中用作100%归一化标准物。两种融合蛋白质与瑞米达西孵育产生仅fkbp12-胱天蛋白酶9的剂量依赖性同二聚化,导致二聚化和细胞凋亡的活化,而frb-胱天蛋白酶9仍然被排除在瑞米达西驱动的复合物之外(左)。相比之下,与雷帕霉素孵育使frb和fkbp直接缔合,并且连接的胱天蛋白酶-9部分缔合并活化。通过seap报告子产生随着细胞死亡所发生的损失来间接测量细胞死亡。该实验证实与雷帕霉素的异二聚化产生剂量依赖性细胞死亡,揭示具有纳摩尔药物敏感性的新型安全开关。图37-药物通过使标记的胱天蛋白酶9同二聚化或异二聚化来诱导程序性细胞死亡。用srα-seap(pbp0046)、psh1-fkbpv12-胱天蛋白酶9(pbp0044)和psh1-frbl-胱天蛋白酶9(pbp0463)转染293t细胞。在24hr孵育之后,将细胞分配并与增加浓度的雷帕霉素(蓝色)、瑞米达西(红色)或乙醇(含有原料雷帕霉素的溶剂)孵育。报告子活性的损失是细胞存活力损失的指标。报告子活性表示为不含药物的8个对照孔的平均值的百分比。一式三份进行药物测定。可通过雷帕霉素或雷帕霉素类似物引导细胞死亡。雷帕霉素是一种有效的异二聚化剂,但由于引起fkbp12与蛋白质激酶mtor的对接,因此雷帕霉素也是信号转导的有效抑制剂,导致蛋白质翻译减少和细胞生长减少。雷帕霉素在c3或c7环位置的衍生物具有对mtor降低的亲和力,但保留对frb结构域的“螺旋4”中的突变体的高亲和力。质粒pbp0463含有在frb结构域中的位置2098处用亮氨酸取代野生型苏氨酸(使用mtor编号)并且适应c7处的衍生物的突变。用frbl-胱天蛋白酶9、fkbpv12-胱天蛋白酶9和组成型seap报告子转染的293t细胞与雷帕霉素或雷帕霉素类似物(c7-异丙基氧基雷帕霉素)的孵育产生剂量依赖性高效细胞死亡开关(图38)。图38-雷帕霉素类似物诱导的细胞死亡开关。用srα-seap(pbp0046)、psh1-fkbpv12-胱天蛋白酶9(pbp0044)和psh1-frbl-胱天蛋白酶9(pbp0463)转染293t细胞。在24hr孵育之后,将细胞分配并与增加浓度的雷帕霉素(蓝色)、c7-异丙氧基雷帕霉素(绿色)或乙醇(含药物原料的溶剂)孵育。报告子活性的损失是细胞存活力损失的指标。报告子活性表示为不含药物的8个孔的平均值的百分比。一式三份进行含药物测定。雷帕霉素诱导的细胞死亡需要frb-胱天蛋白酶-9的存在。为了证实雷帕霉素诱导的细胞死亡是由分别与frb和fkbp12连接的胱天蛋白酶-9分子的二聚化产生的,进行了两个对照实验(图39和图40)。将ic9(fkbpv12-胱天蛋白酶-9)与仅表达表位标签的对照载体(图39)或没有胱天蛋白酶融合物而是具有短的不相关标签的含frb载体(图40)共转染。在每种情况下,与瑞米达西孵育均有效地允许胱天蛋白酶-9的同二聚化和诱导,但雷帕霉素孵育不促进细胞死亡。这些发现支持以下结论:雷帕霉素/雷帕霉素类似物介导的细胞死亡的机制是二聚化的c9分子的活化,而非mtor募集到胱天蛋白酶-9,或归因于涉及内源性mtor抑制的间接机制。图39-雷帕霉素诱导的细胞死亡开关需要frb-胱天蛋白酶-9。用srα-seap(pbp0046)、ps-nls-e和psh1-fkbpv12-胱天蛋白酶9(pbp0044)转染293t细胞。图40-雷帕霉素诱导的细胞死亡开关需要胱天蛋白酶-9与frb的融合物。用srα-seap(pbp0046)、psh1-frbl-vp16(pbp0731)(4)和psh1-fkbpv12-胱天蛋白酶9(pbp0044)转染293t细胞。在24hr孵育之后,将细胞分配并与增加浓度的雷帕霉素(蓝色)、c7-异丙氧基雷帕霉素(红色)、瑞米达西(绿色)或乙醇(含药物原料的溶剂)孵育。报告子活性的损失是细胞存活力损失的指标。报告子活性表示为不含药物的8个孔的平均值的百分比。在一式三份的孔中测定含药物的孔。以下参考文献在本实施例中被提及,并且其全部内容在此以引用方式并入本文:1.spencerdm,wandlesstj,schreibersl和crabtreegr.用合成配体控制信号传导.science.1993;262(5136):1019-24.2.acevedovd,gangulard,freemankw,lir,zhangy,wangf,ayalage,petersonle,ittmannm和spencerdm.诱导型fgfr-1活化导致不可逆的前列腺腺癌和上皮-间质转化.cancercell.2007;12(6):559-71.3.spencerdm,belshawpj,chenl,hosn,randazzof,crabtreegr和schreibersl.使用合成的二聚化诱导物对体内fas信号传导的功能分析.currbiol.1996;6(7):839-47.4.baylejh,grimleyjs,stankunask,gestwickije,wandlesstj和crabtreegr.具有差异结合特异性的雷帕霉素类似物允许对蛋白质活性的正交控制.chembiol.2006;13(1):99-107.5.strassera,corys和adamsjm.破译程序性细胞死亡的规则以改善癌症和其他疾病的疗法.emboj.2011;30(18):3667-83.6.fanl,freemankw,khant,phame和spencerdm.基于胱天蛋白酶和fadd的改善的人工死亡开关.humgenether.1999;10(14):2273-85.7.straathofkc,pulema,yotndap,dottig,vaninef,brennermk,heslophe,spencerdm和rooneycm.用于t细胞疗法的诱导型胱天蛋白酶9安全开关.blood.2005;105(11):4247-54.8.sabatinidm,erdjument-bromageh,luim,tempstp和snydersh.raft1:以雷帕霉素依赖性方式结合fkbp12且与酵母tor同源的哺乳动物蛋白质.cell.1994;78(1):35-43.9.brownej,albersmw,shintb,ichikawak,keithct,lanews和schreibersl.g1阻遏性雷帕霉素受体复合物所靶向的哺乳动物蛋白质.nature.1994;369(6483):756-8.10.chenj,zhengxf,brownej和schreibersl.289-kdafkbp12-雷帕霉素缔合蛋白质内的11-kdafkbp12-雷帕霉素结合结构域的鉴别和关键的丝氨酸残基的表征.procnatlacadsciusa.1995;92(11):4947-51.11.choij,chenj,schreibersl和clardyj.与人frap的结合结构域相互作用的fkbp12-雷帕霉素复合物的结构.science.1996;273(5272):239-42.12.hosn,biggarsr,spencerdm,schreibersl和crabtreegr.二聚体配体限定转录活化结构域在再起始中的作用.nature.1996;382(6594):822-6.13.klemmjd,bealscr和crabtreegr.核蛋白质快速靶向细胞质.currbiol.1997;7(9):638-44.14.stankunask,baylejh,gestwickije,linym,wandlesstj和crabtreegr.使用基因敲入小鼠和二聚化化学诱导物的条件蛋白质等位基因.molcell.2003;12(6):1615-24.15.stankunask,baylejh,havranekjj,wandlesstj,bakerd,crabtreegr和gestwickije.用化学配体拯救fk506-雷帕霉素结合(frb)蛋白质的易降解突变体.chembiochem.2007.16.liberlessd,diverst,austindj和schreibersl.使用通过哺乳动物三杂交筛选所鉴别的无毒配体的诱导型基因表达和蛋白质易位(induciblegeneexpressionandproteintranslocationusingnontoxicligandsidentifiedbyamammalianthree-hybridscreen).procnatlacadsciusa.1997;94(15):7825-30.17.luengoji,yamashitads,dunningtond,beckak,rozamuslw,yenhk,bossardmj,levyma,handa,newman-tarrt等,雷帕霉素类似物的结构活性研究:c-7甲氧基是效应物结构域的一部分并且位于fkbp12-frap界面处的证据(structure-activitystudiesofrapamycinanalogs:evidencethatthec-7methoxygroupispartoftheeffectordomainandpositionedatthefkbp12-frapinterface).chembiol.1995;2(7):471-81.pbp0463--psh1-frbl.d胱天蛋白酶9.t2a(来自图41)。pbp0044--psh1-fkbpv36.d胱天蛋白酶9.t2a(来自图42)实施例25:修饰细胞的双重控制蛋白质二聚化的化学诱导(cid)已被有效地应用于使得可用小分子同二聚化配体瑞米达西(ap1903)诱导细胞自杀或细胞凋亡。该技术是细胞移植物中作为基因疗法辅助手段掺入的“安全开关”的基础(1,2)。使用该技术,如果使用小分子二聚化药物来控制蛋白质-蛋白质寡聚化事件,则依赖于作为信号传导途径一部分的蛋白质-蛋白质相互作用的正常细胞调控途径可适应配体依赖性的、条件性控制(3-5)。使用同二聚化配体(例如瑞米达西(ap1903)、ap1510或ap20187)对包含胱天蛋白酶-9和fkbp12或fkbp12变体的融合蛋白质诱导二聚化(即“i胱天蛋白酶9/icasp9/ic9)可快速实现细胞死亡。(amarajf(97)pnas94:10618-23).胱天蛋白酶-9是用作细胞凋亡过程的“门卫”的初始性胱天蛋白酶(6)。从凋亡细胞的线粒体释放的促细胞凋亡分子(例如细胞色素c)改变了apaf-1(胱天蛋白酶-9结合支架)的构象,导致其寡聚化和“凋亡体”的形成。这种改变有助于胱天蛋白酶-9二聚化并将其潜在形式切割成活性分子,进而切割“下游”细胞凋亡效应物胱天蛋白酶-3,导致不可逆的细胞死亡。瑞米达西直接与两个fkbp12-v36部分结合并可引导包括fkbp12-v36的融合蛋白质的二聚化(1,2)。ic9与瑞米达西的接合避免了apaf1转化为活性凋亡体的需要。在本实施例中,测定胱天蛋白酶-9与接合异二聚化配体的蛋白质部分的融合物引导其活化和细胞死亡的能力,功效与瑞米达西介导的ic9活化相似。选择myd88和cd40作为imc活化开关的基础。myd88在通过抗原呈递细胞(apc)(如树突细胞(dc))检测病原体或细胞损伤方面起中央信号传导作用。在暴露于病原体或坏死细胞来源的“危险”分子后,被称为toll样受体(tlr)的“模式识别受体”亚类被活化,导致衔接分子myd88通过两种蛋白质上的同源tlr-il1ra(tir)结构域的聚集和活化。myd88进而通过蛋白质的其余部分活化下游信号传导。这导致共刺激蛋白质(如cd40)和抗原加工和呈递所需的其他蛋白质(如mhc和蛋白酶)的上调。来自myd88和cd40的信号传导结构域与两个fv结构域的融合提供imc(也被称为mcfvvmc.fvfv),其在暴露于瑞米达西后有效活化dc(7)。后来发现imc也是针对t细胞的有效共刺激蛋白质。雷帕霉素是天然产物大环内酯,其以高亲和力(<1nm)结合fkbp12,并一起起始与mtor的fkbp-雷帕霉素-结合(frb)结构域的高亲和力的抑制相互作用(8)。frb很小(89个氨基酸),因此当被附加到许多蛋白质时可用作蛋白质“标签”或“手柄”(9-11)。frb融合蛋白质与第二fkbp12融合蛋白质的共表达使得它们的近似是雷帕霉素诱导型的(12-16)。本实施例和下面的实施例提供了实验和结果,其被设计成测试frb-结合的胱天蛋白酶-9(irc9)与fkbp-结合的胱天蛋白酶-9(ic9)的共表达是否也可引导细胞凋亡并且用作由口服可用的配体雷帕霉素或雷帕霉素衍生物(雷帕霉素类似物)调控的细胞安全开关的基础,所述雷帕霉素衍生物在低治疗剂量下不抑制mtor,而是与所选则的胱天蛋白酶-9融合的突变体frb结构域结合。在这些实施例还提供了双开关技术的另一实施方案(fwtfrbc9/mcfvfv),其中同二聚化剂(例如ap1903(瑞米达西))诱导经修饰细胞的活化,并且异二聚化剂(例如雷帕霉素或雷帕霉素类似物)活化安全开关,引起经修饰细胞的细胞凋亡。在该实施方案中,例如,将包含fkbp12和frb或frb可变区二者的嵌合促细胞凋亡多肽(例如胱天蛋白酶-9)(fwtfrbc9)连同包含myd88和cd40多肽以及fkbp12v36的至少两个拷贝的诱导型嵌合myd88/cd40共刺激多肽(mc.fvfv)一起在细胞中表达。在使所述细胞与结合fv区的二聚化剂接触后,mc.fvfv二聚化或多聚化,并活化所述细胞。所述细胞例如可以是表达针对靶抗原的嵌合抗原受体(carζ)的t细胞。作为安全开关,所述细胞可与异二聚化剂(例如雷帕霉素或雷帕霉素类似物)接触,所述异二聚化剂结合fwtfrb.c9多肽上的frb区以及fwtfrb.c9多肽上的fkbp12区,引起胱天蛋白酶-9多肽的直接二聚化,并诱导细胞凋亡。(图43(2),图57)。在另一种机制中,异二聚化剂结合fwtfrbc9多肽上的frb区和mc.fvfv多肽上的fv区,引起支架诱导的二聚化,这归因于每个mc.fvfv多肽上的两个fkbp12v36多肽的支架(图43(1)),并诱导细胞凋亡。出于这些实施例的目的,含有mc.fvfv和fwtfrbc9二者的核酸构建体已被命名为fwtfrbc9/mc.fvfv。在双开关技术(frbfwtmc/fvc9)的另一实施方案中,异二聚化剂(例如雷帕霉素或雷帕霉素类似物)诱导经修饰细胞的活化,并且同二聚化剂(例如ap1903)活化安全开关,引起经修饰细胞的细胞凋亡。在该实施方案中,例如,将包含fv区的嵌合促细胞凋亡多肽(例如胱天蛋白酶-9)(ifvc9)连同包含myd88和cd40多肽以及fkbp12和frb或frb可变区二者的诱导型嵌合myd88/cd40共刺激多肽(fwtfrbmc)(mc.fvfv)一起在细胞中表达。在使细胞与将fkbp12区和frb区异二聚化的雷帕霉素或雷帕霉素类似物接触之后,fwtfrbmc二聚化或多聚化并将细胞并活化。所述细胞例如可以是表达针对靶抗原的嵌合抗原受体(carζ)的t细胞。作为安全开关,所述细胞可与同二聚化剂(例如ap1903)接触,所述同二聚化剂结合ifvc9多肽,引起胱天蛋白酶-9多肽的直接二聚化并诱导细胞凋亡。(图57(右))。出于这些实施例.xxx的目的,含有ifvc9和fwtfrbmc二者的核酸构建体已被命名为fwtfrbmc/fvc9。材料和方法逆转录病毒的产生和外周血单核细胞(pbmc)的转导将hek293t细胞(1.5×105个)接种在100-mm组织培养皿上补充有谷氨酰胺、青霉素/链霉素和10%胎牛血清的10mldmem4500中。在孵育16-30小时之后,使用novagen's方案转染细胞。简单地说,对于每次转染,将0.5mloptimem(lifetechnologies)吸移到1.5ml微量离心管中,并添加30μlgenejuice试剂,之后涡旋5秒。将样品静置5分钟以使genejuice悬浮液沉降。将dna(总共15μg)添加到每个管中并通过上下吸移4次来混合。使样品静置5分钟以形成genejuice-dna复合物,并将悬浮液逐滴添加到一个293t细胞平皿中。典型的转染包括如下这些质粒以产生无复制能力的逆转录病毒:3.75μg含有gag-pol的质粒(peq-pam3(-e))、2.5μg含病毒包膜(例如rd114)的质粒、含目标基因的逆转录病毒(3=3.75μg)。用预包被到组织培养板的各孔中的抗cd3抗体和抗cd28抗体刺激pbmc。在平铺之后24小时,将100u/mlil-2添加到培养物中。在第2天或第3天,将含有来自经转染的293t细胞的逆转录病毒的上清液以0.45μm过滤并且在用retronectin(于1mlpbs中每1cm2表面每孔10μl)预涂覆的非tc处理板上离心。在室温将板以2000g离心2小时。将cd3/cd28原始细胞以2.5×105个细胞/ml再悬浮于补充有100u/mlil-2的完全培养基中,并在板上于室温以1000×g离心10分钟。在孵育3-4天之后,对细胞进行计数并使用适当的标志物抗体(通常为cd34或cd19)通过流式细胞术测量转导效率。将细胞维持在补充有100u/mlil-2的完全培养基中,每2-3天用新鲜培养基和il-2重新供给细胞并根据需要分配以扩增细胞。培养的细胞中的t细胞胱天蛋白酶测定在用适当的逆转录病毒转导之后,在存在或不存在自杀药物(瑞米达西素或雷帕霉素)的情况下,将50,000个t接种在96孔板的每孔的无il-2的ctl培养基中。为了使得能够使用incucyte仪器检测细胞凋亡,将2μmincucytetm动力学胱天蛋白酶-3/7细胞凋亡试剂(essenbioscience,4440)添加到每个孔中以达到200μl的总体积。将板以400×g离心5min并置于incucyte(双色模型4459)内以在10×物镜下每2-3小时监测绿色荧光,总共持续48小时。使用“tcells_caspreagent_phase_green_10x_mld”加工定义进行图像分析。使用“总绿色物体积分强度(totalgreenobjectintegratedintensity)”度量来对胱天蛋白酶活化进行定量。每个条件以一式两份进行,且使每个孔在4个不同位置成像。t细胞抗肿瘤测定使用nuclighttm红色慢病毒试剂(essenbioscience,4625)将hpacpsca+肿瘤细胞用核定位的rfp蛋白质稳定标记。为了建立共培养物,将4000hpac-rfp细胞接种于96孔板的每孔的100μl不含il-2的ctl培养基中并保持至少4小时,以使肿瘤细胞粘附。在用适当的逆转录病毒转导并在培养物中静置至少7天之后,根据各种e:t比将t接种到含有hpac-rfp的96孔板中。还将瑞米达西添加到培养物中以达到每孔300μl总体积。将每个板以一式两份设置,一个板用incucyte细胞成像系统监测,一个板用于上清液收集以供在第二天进行elisa测定。将板以400×g离心5min并置于incucyte(essenbioscience,双色模型4459)内以在10×物镜下每2-3小时监测红色荧光(并且如果用gfp-ffluc标记t细胞,则为绿色荧光),总共持续7天。使用“hpac-rfp_tcellsgfp_10x_mld”加工定义进行图像分析。在第7天,使用“红色物体计数(redobjectcount)(1/孔)”度量分析hpac-rfp细胞。同样在第7天,将0或10nm自杀药物添加到共培养物的每个孔中并放回incucyte中以监测t细胞消除。在第8天,使用“总绿色物体积分强度”度量分析t细胞-gfp细胞。每个条件至少以一式两份进行,且使每个孔在4个不同位置成像。为了测量raji细胞的抗肿瘤活性,通过流式细胞术,而非incucyte确定细胞群体,因为细胞不粘附到板上。通过稳定表达的绿色荧光蛋白质标记的raji细胞(atcc)(raji-gfp)是伯基特氏淋巴瘤细胞系,其在细胞表面上表达cd19并且是抗cd19car的靶标。将50000个raji-gfp细胞与10000个car-t细胞以1:5e:t比接种在24孔板上。在48小时时取出培养基上清液用于确定活化的car-t细胞的细胞因子释放。在7天和14天,通过流式细胞术(galeos,beckman-coulter)以gfp标记的肿瘤细胞和cd3标记的t细胞的比例确定肿瘤杀伤程度。ivis成像用异氟烷(isofluorane)麻醉具有标记的t细胞的nsg小鼠,并通过腹膜内(i.p.)途径在下腹部注射100μld-荧光素(pbs中的15mg/ml储液)。在10分钟之后,将动物从麻醉室转移到ivis平台。利用ivis成像仪(perkin-elmer)从背侧和腹侧采集图像,并且利用livingimage软件(ivis成像系统)定量并记录bli。蛋白质印迹在用适当的逆转录病毒转导之后,将6,000,000个t细胞接种在6孔板的每孔的3mlctl培养基中。在24小时后,收集细胞,在冷pbs中洗涤,并在冰上在含有1×halt蛋白酶抑制剂混合剂(thermo,87786)的ripa裂解和提取缓冲液(thermo,89901)中裂解30min。在平铺的。在4℃将裂解物以16,000×g离心20min并将上清液转移到新的埃彭道夫管(eppendorftube)中。依照制造商的推荐,使用piercebca蛋白质测定试剂盒(thermo,23227)进行蛋白质测定。为了制备用于sds-page的样品,将50μg裂解物与4×laemmli样品缓冲液(biorad,1610747)混合,并在95℃加热10min。同时,使用biorad浇注设备和30%丙烯酰胺/双溶液(biorad,160158)制备10%sds凝胶。将样品连同precisionplus蛋白质双色标准品(precisionplusproteindualcolorstandards)(biorad,1610374)一起加样并在1×tris/甘氨酸运行缓冲液(biorad,1610771)中在140v运行90min。在蛋白质分离之后,在iblot2装置(thermo,ib21001)中使用程序0(总共7min)将凝胶转移到pvdf膜上。根据制造商的推荐,使用ibindflexwesterndevice(thermo,slf2000)用一级抗体和二级抗体探测膜。以1:200稀释度使用抗myd88抗体(sigma,sab1406154),并且以1:500稀释度使用二级hrp缀合的山羊抗小鼠igg抗体(thermo,a16072)。以1:200稀释度使用胱天蛋白酶-9抗体(thermo,pa1-12506),并且以1:500稀释度使用二级hrp缀合的山羊抗兔igg抗体(thermo,a16104)。以1:1000稀释度使用β-肌动蛋白抗体(thermo,pa1-16889),并且以1:1000稀释度使用二级hrp缀合的山羊抗兔igg抗体(thermo,a16104)。使用supersignalwestfemto最大灵敏度底物试剂盒(thermo,34096)使膜显色并使用gellogic6000pro照相机和carestreammi软件(v.5.3.1.16369)成像。用于报告子测定的细胞的转染将hek293t细胞(1.5×105个)接种在100-mm组织培养皿上补充有谷氨酰胺、青霉素/链霉素和10%胎牛血清的10mldmem4500中。在孵育16-30小时之后,使用novagen's方案转染细胞。简单地说,对于每次转染,将0.5mloptimem吸移到1.5ml微量离心管中,并添加15μlgenejuice试剂,之后涡旋5秒。将样品静置5分钟以使genejuice悬浮液沉降。将dna(总共5μg)添加到每个管中并通过上下吸移4次来混合。使样品静置5分钟以形成genejuice-dna复合物,并将悬浮液逐滴添加到一个293t细胞平皿中。典型的转染含有1μgnfkb-seap(5)、4μgimc+carζ(pbp0774)或4μgmc-rap-car(pbp1440)(1)。用二聚化药物刺激细胞在转染后24小时(4.1),将293t细胞分配到96孔板中并与二聚化药物的稀释物一起孵育。简单地说,将100μl培养基添加到96孔平底板的每个孔中。将药物在管中稀释到浓度为待放置在板上的梯度中最高浓度的4倍。将100μl二聚化配体(瑞米达西、雷帕霉素、异丙氧基雷帕霉素)添加到板最右侧上的三个孔中的每一个孔中(由此以一式三份进行测定)。然后将来自每个含有药物的孔的100μl转移到相邻孔中,并且该循环重复10次以产生连续的两倍步骤梯度。最后几个孔未经处理,并用作用于基础报告子活性的对照。然后将转染的293细胞用胰蛋白酶消化,用完全培养基洗涤,悬浮于培养基中,并将100μl等分到含有药物(或无药物)的每个孔中。将细胞孵育24小时。报告子活性的测定srα启动子是一种杂交转录元件,其包含sv40早期区(其驱动t抗原转录)和人嗜t淋巴细胞病毒(htlv-1)的长末端重复(ltr)的部分(r和u5)。该启动子驱动分泌型碱性磷酸盐(seap)报告子的高组成型水平。胱天蛋白酶-9通过二聚化的活化快速导致细胞死亡,并且细胞死亡比例随着药物量的增加而增加。当细胞死亡时,报告子的转录和翻译终止,但已分泌的报告子蛋白质在培养基中持久存在。因此,组成型seap活性的损失是细胞死亡的药物依赖性活化的有效指标。在药物刺激之后24小时,将96孔板包裹以防止蒸发,并在65℃孵育2小时以使内源性和血清磷酸酶失活,同时热稳定的seap报告子保留(3,12,14)。将来自每个孔的100μl样品加样到具有黑色侧面的96孔测定板的各个孔中。将样品与ph为10.0的0.5mm二乙醇胺中的0.5mm磷酸4-甲基伞形酮酯(4-mup)孵育4到16小时。通过具有在355nm处激发和在460nm处发射的荧光来测量磷酸酶活性。数据被转移到microsoftexcel电子表格中进行制表,并用graphpadprism绘图。异丙氧基雷帕霉素的生产采用luengo等((j.org.chem59:6512,(1994)),(17,18))的方法。简单地说,将20mg雷帕霉素溶解于3ml异丙醇中,并添加22.1mg对甲苯磺酸,并且在室温下在搅拌下孵育4-12小时。在完成时,添加5ml乙酸乙酯并将产物用饱和碳酸氢钠萃取5次,并且用盐水(饱和氯化钠)萃取3次。将有机相干燥并再溶解于乙酸乙酯:己烷(3:1)中。通过在3-4kpa压力下在10到15ml硅胶柱上用3:1乙酸乙酯:己烷进行快速色谱来拆分立体异构体和次要产物,并将级分干燥。在237nm、267nm、278nm和290nm处通过分光光度法测定级分,并测试frb等位基因特异性转录开关中的结合特异性。活化开关技术组分的表达建立逆转录病毒构建体以表达有frb和无frb的fkbp12与诱导型靶蛋白质之间的融合蛋白质。所述构建体共表达作为引导肿瘤特异性免疫的基因疗法策略一部分的嵌合抗原受体(car)。诱导型(mc.fvfv)或组成型(mc)共刺激分子也与胱天蛋白酶-9安全开关一起存在。用来源于小rna病毒的2a共翻译切割位点隔开每种组分。为了更好地理解这些分子如何一起在靶t细胞中起作用,确定t细胞中稳态蛋白质水平是重要的。为了确定“imc+carζ-t”(pbp0608;mc.fvfv+carζ)、“i9+carζ+mc”(pbp0844;ifvcasp9+carζ+组成型活性“mc”)和(pbp1300;fwtfrbc9/mc.fvfv+carζ+imc)载体的所有组分的相对蛋白质表达水平,使用对myd88、胱天蛋白酶-9和α-肌动蛋白具有特异性的抗体对来自四个不同供体的经转导的t细胞进行蛋白质印迹分析(图44a)。结果揭示imc+carζ-tt细胞以与表达mc(无融合fkbp12)的i9+carζ+mct细胞相似的水平表达mc.fvfv组分。然而,fwtfrbc9/mc.fvfvt细胞中mc.fvfv表达的水平显著低于其他两种car修饰的t细胞。类似地,与fwtfrbc9/mc.fvfv构建体中的ifwtfrbc9组分(fkbp.frb.δc9)相比,i9+carζ+mc构建体中的ifvc9组分以高得多的水平表达,表明较大的多顺反子插入物限制蛋白质表达,或来自mc的高基础信号传导活性消除表达高水平的这些嵌合蛋白质的细胞。为了区分这些可能性,评估体外延长培养中t细胞中car表达和基础毒性的稳定性。使用抗体qbend-10(biolegend)通过流式细胞术分析car表达,所述抗体对来源于掺入到第一代car-ζ的胞外部分中的人cd34的表位具有特异性,并且利用吖啶橙染色的细胞和碘化丙啶细胞通过nexeloncellometer评估t细胞存活力。通过流式细胞术进行的表达分析(galleos,beckman)证实与i9+carζ+mc和t细胞相比,imc+carζ-t细胞表达高得多的car水平(图44b)。然而,在已用所有三种cart细胞类型修饰的细胞之间,培养生长的细胞的生存力相对没有差异(图44c)。因此,嵌合蛋白质表达的差异可能基于所用病毒载体的限制性包装能力。用fwtfrbc9/mc.fvfv构建体诱导细胞凋亡为了确定尽管每个细胞的蛋白质表达稍低,fwtfrbc9/mc.fvfv构建体是否仍然具有功能性,在不存在靶肿瘤细胞的情况下检查并入fwtfrbc9/mc.fvfv构建体设计中的接通开关和关断开关的功能性。通过使来自4个不同供体的用imc+carζ-t、i9+carζ+mc和fwtfrbc9/mc.fvfv载体转导的t细胞经受使用“胱天蛋白酶3/7绿色”试剂进行的基于胱天蛋白酶的杀伤测定,测试由雷帕霉素诱导的fkbp.frb.δc9二聚化活化的关断开关(ifwtfrbc9)(图45a)。在该测定中,将对胱天蛋白酶3或胱天蛋白酶7敏感的肽与潜在荧光dna嵌入染料连接。在细胞凋亡期间胱天蛋白酶3/7的活化释放了允许dna结合和绿色细胞荧光的染料。将含有细胞的96孔微板置于incucyte机器内以监测经活化的胱天蛋白酶的活性(切割的胱天蛋白酶3/7试剂=绿色荧光)48小时。incucyte是可在延长的时间段内观察、定量并记录使用或不使用荧光标记的板上培养的活细胞的自动化显微镜。在不存在药物的情况下,fwtfrbc9/mc.fvfvt细胞展示出最高水平的基础毒性,其次分别是imc+carζ-t和i9+carζ+mc-t细胞。在所有配体浓度(0.8nm、4nm、20nm),瑞米达西以与雷帕霉素诱导ifwtfrbc9相似的效率诱导ic9(在i9+carζ+mc中)的活化。然而,ic9活化的动力学似乎比ifwtfrbc9活化的动力学略快。在48小时的自杀药物处理之后,通过流式细胞术针对以下标志物分析细胞:cd34(工程的cart细胞)、碘化丙啶(pi)、膜联蛋白v和经切割的胱天蛋白酶3/7(绿色荧光)(图45b)。在药物处理后48小时,在(fwtfrbc9/mc.fvfv)修饰的t细胞(60%)中观察到比在i9+carζ+mc-t细胞(20%)中高得多百分比的死亡(pi+/annv+)细胞,与使用基于incucyte的胱天蛋白酶测定在(fwtfrbc9/mc.fvfv)修饰的t细胞中在后期时间点独立观察到的高胱天蛋白酶活化水平一致。为了检查被瑞米达西诱导的mc.fkbpv.fkbpv(mcfvfv)的二聚化活化的接通开关,用各种浓度的瑞米达西处理imc+carζ-t细胞和(fwtfrbc9/mc.fvfv)t细胞,并且通过elisa分析il-2和il-6细胞因子释放(图45c)。imc+carζ-t细胞显示随着瑞米达西浓度增加的诱导型il-2和il-6产生,而(fwtfrbc9/mc.fvfv)t细胞的细胞因子产生相对较弱。i9+carζ+mc(具有mc)的基础的配体非依赖性il-6产生以与瑞米达西刺激的imc+carζt细胞的水平相似的水平存在。i9+carζ+mc在病毒或t细胞生产期间,高的基础胱天蛋白酶活性可能会呈现制造挑战。因此,测定了胱天蛋白酶-9抑制剂q-lehd-oph抵消基础胱天蛋白酶活性的能力。用q-lehd-oph可有效地抑制活化的ic9和irc9(fwtfrbc9),q-lehd-oph似乎在高达100μm的水平对t细胞无毒(图46)。此外,低到4μm的q-lehd-oph能够有效地抑制ic9和irc9(fwtfrbc9)对胱天蛋白酶-9的活化(当将它们与20nm各自的活化配体一起孵育时)(图46c)。减弱高基础胱天蛋白酶活性的另一种方法是利用使irc9(fwtfrbc9)构建体中的蛋白质表达不稳定的frb-t2098l(“frbl”)突变体(15,16)。另外,胱天蛋白酶9突变体(n405q,δcasp9q)也降低了ic9中的基础胱天蛋白酶活性。当使用incucyte和胱天蛋白酶3/7绿色试剂研究时,frbl和δcasp9q突变体irc9(fwtfrbc9)二者均展现出与野生型irc9(fwtfrbc9)相比更低的基础胱天蛋白酶活性(图47a)。然而,将frb从野生型(苏氨酸2098)改变为frbl突变体(亮氨酸2098)使irc9(fwtfrbc9)的最大杀伤效率降低大约50%。类似地,将δ胱天蛋白酶-9从野生型改变为n405q突变体使irc9(fwtfrbc9)活性降低到甚至比frbl突变更低的水平。通过二聚化剂介导的结合或间接募集到支架的细胞凋亡诱导的效率在本实施例中,在也表达mc.fvfv的经修饰细胞中测试了包含frb区的可诱导胱天蛋白酶-9多肽(ifrbc9)。这里,在irc9中,雷帕霉素诱导的frb.δc9二聚化仅仅依赖于由在相同构建体内共表达的mc.fkbpv.fkbpv(imc)中的串联fkbp12蛋白质提供的基于fkbp的支架(示意图参见图48a)。在该策略中,将多个ifrbc9分子募集到fkbp的支架(例如fkbp12v36的支架)促进其间接自发缔合和活化。为了在ic9(pbp0844)、irc9(pbp1116)和irc9(pbp1300)之间直接比较胱天蛋白酶的活化程度,将活化的t细胞用编码imc+carζ-t、i9+carζ+mc、ifrbc9和mc.fvfv或(fwtfrbc9/mc.fvfv)的逆转录病毒转导且以不用药物、用20nm雷帕霉素或20nm瑞米达西处理并且在存在胱天蛋白酶3/7绿色试剂的情况下培养(图48b-d)。尽管在所有构建体中存在通常较低的基础胱天蛋白酶活性,但用(fwtfrbc9/mc.fvfv)转导的细胞相对于其他cart细胞展现最高的基础胱天蛋白酶活性(图48b)。当用20nm雷帕霉素诱导时,(ifrbc9和mc.fvfv)表现出适度的胱天蛋白酶活化,而在t细胞(fwtfrbc9/mc.fvfv)中有稳健的胱天蛋白酶活性诱导。(图48c)。这种细胞凋亡的诱导在用20nm瑞米达西处理的表达i9+carζ+mc的t细胞中是相似的(图48d)。在该测定中,20nm的瑞米达西不能诱导fkbp.frb.δcasp9(irc9)的二聚化。这是由于瑞米达西对irc9(ifwtfrbc9)中存在的野生型fkbp的亲和力相对于其对fkbpv36的亲和力降低了1000倍。完整动物模型测定为了证实irc9(fwtfrbc9)的体内功能性,对每只小鼠用经gfp-ffluc共转导的1×107个imc+carζ-t、i9+carζ+mc、ifrbc9和mc.fvfv或(fwtfrbc9/mc.fvfv)t细胞静脉内注射nod-scid-il-2受体-/-小鼠(nsg,jacksonlabs)。在药物治疗之前18小时(-18h),在药物治疗之前即刻(0h)以及在药物治疗后4.5h、18h、27h和45h评估cart细胞的生物发光成像(bli)(图49a和图49b)。用5mg/kg瑞米达西腹膜内治疗已接受i9+carζ+mct细胞注射的小鼠亚组,而用10mg/kg雷帕霉素腹膜内治疗已接受imc+carζ-t(ifrbc9和mc.fvfv)和imc+carζ-2.0t细胞的小鼠亚组。所有其他小鼠只接受腹膜内媒介物。在药物治疗后45h,使小鼠安乐死,并收集血液和脾以供用针对人(h)cd3或cd34和鼠(m)cd45的抗体进行流式细胞术分析。与ic9类似,irc9(ifwtfrbc9)快速且有效地消除fwtfrbc9/mc.fvfvt细胞,如通过bli以及血液和脾组织的分析所评估的(图49c和图49d)。与i9+carζ+mc和fwtfrbc9/mc.fvfv相比,(ifrbc9和mc.fvfv)t细胞凋亡的诱导为适度的且具有延迟的动力学,与图48中所呈现的体外细胞死亡数据一致。fwtfrbc9/mc.fvfv含有双刺激接通开关和细胞凋亡关断开关为了检查在存在靶肿瘤细胞的情况下,fwtfrbc9/mc.fvfv构建体中的接通开关和关断开关的功能性,将t细胞用gfp-ffluc(表达作为体内细胞标志物的与萤火虫荧光素酶融合的绿色荧光蛋白质)标记,并且用编码psca-imc+carζ-t(pbp0189)的载体、编码i9+carζ+mc(pbp0873)的载体或编码fwtfrbc9/mc.fvfv(pbp1308)的载体共转导(图50)。在转导后10天,将t细胞与用rfp组成型地标记的hpac胰腺癌细胞以1:2和1:5的效应物与肿瘤靶标(e:t)比率接种到存在0nm、2nm或10nm瑞米达西的96孔板中,并置于incucyte机器中以监测hpac-rfp和t细胞-gfp生长的动力学。在接种后两天,通过elisa分析培养上清液的il-2、il-6和ifn-γ产生。总之,在所有瑞米达西浓度和两种e:t比,与fwtfrbc9/mc.fvfvt细胞相比,imc+carζ-t细胞产生大约3倍更高水平的il-2、il-6和ifn-γ(图50a和图50b)。另外,i9+carζ+mc构建体中mc共刺激组分的基础活性以与在瑞米达西刺激的imc+carζ-t细胞中测量的水平相似的水平诱导il-6和ifn-γ细胞因子产生。如图50c和图50d中所见,小于5%和10%的hpac-rfp细胞分别以1:2和1:5的比率保持。(fwtfrbc9/mc.fvfv)t细胞在两种比率均表现出依赖于瑞米达西的肿瘤细胞杀伤,而imc+carζ-t细胞似乎在这些比率不依赖于瑞米达西,并且具有与i9+carζ+mct细胞相似的靶标杀伤效率。当分析t细胞扩增时,fwtfrbc9/mc.fvfv.0t细胞随着瑞米达西浓度增加而增殖并扩增,而imc+carζ-t细胞不能在10nm瑞米达西刺激后以相同程度扩增。在共培养的第7天施用10nm雷帕霉素导致在24小时内超过60%的(fwtfrbc9/mc.fvfv)t细胞的消除,而10nm瑞米达西引起大约50%的i9+carζ+mct细胞的减少,表明安全开关在fwtfrbc9/mc.fvfv中也起作用。fwtfrbc9/mc.fvfv中的胱天蛋白酶-9活化fwtfrbc9/mc.fvfv修饰的t细胞内irc9(ifwtfrbc9)的活化可通过fkbp.frb.δc9同二聚化和支架介导的募集来介导,所述募集通过将fkbp.frb.c9中的frb募集到mc.fkbpv.fkbpv中的fkbp而被驱动。为了破坏irc9(ifwtfrbc9)被支架介导的募集活化的能力,产生fwtfrbc9/mc.fvfv-相关家族载体,其含有mc.fkbpv.fkbpv(pbp1308,“imc”)、mc.fkbpv(pbp1319,1个fkbpv)、mc(pbp1320,无fkbp)和mc.fkbpv.fkbp(pbp1321,1个fkbpv和1个非ap1903结合的野生型fkbp)(构建体的示意性参见图51a)。psca-i9+carζ+mc载体(pbp0873)用作用于关断开关的阳性对照,并且cd19-imc+carζ-t载体(具有mc.fkbpv.fkbpv的pbp0608和具有mc.fkbpv的pbp1439)用作接通开关的阳性对照。确定使用抗myd88抗体的car-t细胞的蛋白质表达。从imc中去除fkbpv的1个拷贝导致fwtfrbc9/mc.fvfv平台(比较pbp1308与pbp1319)和imc+carζ-t平台(比较pbp0608与pbp1439)中的mc融合蛋白质表达增加(图51b)。然而,mc表达在含有mc.fkbpv.fkbp(比较pbp1319与pbp1321)的构建体中降低,表明额外的fkbp结构域使mc-融合蛋白质不稳定。最有趣的是,当用抗myd88抗体探测时,i9+carζ+mc平台构建体(即含有ic9的pbp0873和含有irc9(ifwtfrbc9)的pbp1320)的表达模式揭示了另外的缓慢迁移带。除了预测的27kdamc融合蛋白质带之外,还在90kda、80kda和50kda处检测到另外3个带。基于i9+carζ+mc载体中的高基础mc信号传导,该数据可支持在第二“2a”位点存在不完全蛋白质分离、产生以下候选蛋白质产物的假设:αpsca.q.cd8stm.ζ.2a-mc和cd8stm.ζ.2a-mc,后者丢失scfv结构域。就胱天蛋白酶-9-融合蛋白质表达来说,在mc-融合蛋白质的不同变化形式之间嵌合胱天蛋白酶蛋白质水平没有显著差异(比较pbp1308、pbp1319、pbp1320和pbp1321)。为了测试关断开关,对用上述载体转导的t细胞进行胱天蛋白酶活化测定,其中用0nm、0.8nm、4nm、20nm雷帕霉素处理。用瑞米达西处理用i9+carζ+mc载体(pbp0873)转导的t细胞。确定雷帕霉素(或瑞米达西)暴露后24小时的胱天蛋白酶活化并以线图描绘(图51c)。从imc中去除fkbpv的1个拷贝实际上使得fwtfrbc9/mc.fvfv平台(ifwtfrbc9)中的胱天蛋白酶活化得以改善(比较pbp1308与pbp1319)。当fkbpv的两个拷贝均被去除时,胱天蛋白酶活性在动力学方面类似于ic9,但幅度高得多(比较pbp0873与pbp1320)。在含有mc.fkbpv.fkbp的构建体中,胱天蛋白酶活性恢复到与编码原始“imc”mc.fkbpv.fkbpv的构建体中的水平相当的水平(比较pbp1308与pbp1321)。irc9(ifwtfrbc9)中frb和fkbp的拓扑结构由于信号传导元件和结合结构域的顺序和间隔可能会影响结局,因此测试了具有ifwtfrbc9分子的配体结合结构域的顺序。上文所讨论的irc9(ifwtfrbc9)含有氨基端fkbp,之后是frb结构域,如在fkbp.frb.δc9(pbp1308和pbp1311)中。为了研究相反构型的功效,构建frb.fkbp.δc9/(pbp1310)(图51a)。胱天蛋白酶活化测定揭示了frb.fkbp.δc9在雷帕霉素起始的细胞凋亡方面比fkbp.frb.δc9稍微更敏感(图51d)。这种适度的差异与相较于fkbp.frb.δc9更高的frb.fkbp.δc9蛋白质水平一致(图51b)。此外,由于这两种质粒不含有稀释性imc相关支架,因此这些数据还提供了irc9不需要支架来有效活化胱天蛋白酶信号传导的证据。就接通开关来说,即使在用瑞米达西进行刺激时,所有fwtfrbc9/mc.fvfv构建体(pbp1308、pbp1319和pbp1321)在不存在肿瘤的情况下仍展现出低的il-2和il-6细胞因子产生,而瑞米达西诱导型imc+carζ-t构建体(pbp0608和pbp1439)表现出配体依赖性活化,如所预计的(图51e)。此外,含有mc的两种i9+carζ+mc构建体(pbp0873和pbp1320)均诱导高基础性的il-6产生。由于irc9含有野生型fkbp结构域,因此测定了能够触发二聚化和irc9活化的瑞米达西的浓度,以精确计量使用瑞米达西作为t细胞刺激性药物的安全治疗窗口。在该测定中,用表达ic9和两种相似的irc9变体(frb.fkbp.δc9和fkbp.frb.δc9)的载体瞬时转染293细胞(图52),并用雷帕霉素或瑞米达西的半对数稀释物处理。对细胞进行在存在胱天蛋白酶3/7绿色试剂的情况下且通过incucyte监测的胱天蛋白酶活化测定(图52a),或使用组成型srα报告子的分泌型碱性磷酸酶(seap)测定(图52b)。对于图52b的左图,如x轴的103点处所指示的图线从上到下为:阴性对照、fkbp.frb.c9、frb.fkbp.c9、ic9。对于图52b的右图,x轴的103点处的图线从上到下为:阴性对照、ic9、fkbp.frb.c9和frb.fkbp.c9。在功能上,irc9和ic9当被它们各自的自杀药物活化时,似乎以相似的动力学和阈值诱导胱天蛋白酶切割。甚至在存在少到100pm的雷帕霉素的情况下,irc9也是高活性的,在甚至更低的药物水平,尽管动力学降低,也有一定功效。当比较frb.fkbp.δc9与fkbp.frb.δc9时,frb.fkbp.δc9在与fkbp.frb.δc9的雷帕霉素浓度相比更低的雷帕霉素浓度有活性,与图51d中获得的数据一致。此外,irc9对低于100nm的瑞米达西不敏感,这为使用瑞米达西来诱导t细胞活化提供了大的安全窗口(通常为1到10nm)。该实验还证实了(ifwtfrbc9)是有效的细胞凋亡活化剂,其独立于由mc.fvfv提供的搭支架诱导的二聚化。mc-rap:由雷帕霉素类似物引导的诱导型共刺激多肽为了证实利用fkbp和frb的串联融合物以促进利用雷帕霉素或雷帕霉素类似物的同二聚化的通用性,制成mc-rap(ifrbfwtmc)构建体,其具有与野生型fkbp和frbl的myd88/cd40融合物。mc-rap连同针对cd19的car一起表达,其中两个顺反子由2a序列隔开(图53)。利用该构建体,选择雷帕霉素类似物以结合存在于mc-rap上的野生型fkbp并一起促进与存在于第二个mc-rap上的frb二聚化。为了确定利用该技术对mc-rap的二聚化是否可引导mc的活化和共刺激功能,将含有mc-rap的逆转录病毒构建体1440与含有相同car、但包含瑞米达西敏感性fv的两个串联拷贝的两种imc+carζ构建体或仅非诱导型mc的构建体(1151)进行比较。当转导到t细胞中时,依赖于mc功能的il-6的表达在仅有mc活性下以中等水平被观察到,并且未被雷帕霉素类似物c7-异丁氧基雷帕霉素或瑞米达西诱导(图54)。来自imc+carζ-t细胞(含有具有融合到mc羧基端的fv.fv的bp0774或具有氨基端fv融合物的bp1433)的il-6诱导在存在异丁氧基雷帕霉素的情况下分泌高水平的il-6。图54中的术语“系连(tethered)”是指系连到myd88-cd40多肽的frb和fkbp多肽。相比之下,表达具有野生型fkbp与frbl串联的羧基端融合物的mc的bp1440对瑞米达西无应答,但通过活化mc强烈诱导il-6分泌。当在蛋白质印迹中用针对myd88的抗体探测时,mc.fkwt.frbl的表达水平与1433(也是羧基端融合物,但具有fvs)和单独的mc所表达的那些相似(图55)。在敏感性报告子测定中确定imc+carζ和mc-rap-car构建体的剂量应答性,其中通过mc的信号传导活化转录因子nf-kb(图56)。bp774被亚纳摩尔浓度的瑞米达西强烈诱导,但不被雷帕霉素或异丁氧基雷帕霉素诱导。相比之下,亚纳摩尔浓度的雷帕霉素或异丁氧基雷帕霉素足以诱导bp1440中的mc-rap,但瑞米达西由于该药物对fv的特异性而即使在50nm下也对mc功能保持惰性。(frbfwtmc/fvc9):用雷帕霉素类似物活化共刺激且用瑞米达西活化细胞凋亡的双开关mc-rap对用雷帕霉素类似物活化的特异性,而对用瑞米达西活化没有特异性允许其用作第二双开关(frbfwtmc/fvc9)(图57)。在该策略中,mc-rap与第一代car和ic9共表达。瑞米达西用于活化作为安全开关的胱天蛋白酶-9,而雷帕霉素类似物异丁氧基雷帕霉素可特异性活化mc-rap,所述异丁氧基雷帕霉素以比mtor中野生型frb低20倍的浓度与frbl结合(这将抑制t细胞功能)。该方案与(fwtfrbc9/mc.fvfv)相反,(fwtfrbc9/mc.fvfv)利用雷帕霉素(或雷帕霉素类似物)活化细胞凋亡并且用imc和瑞米达西活化共刺激。在培养物中的细胞杀伤测定中证实了该两种策略的药物特异性(图58)。将编码具有ic9和组成型mc的cd19car的i9+carζ+mc构建体bp0844或表达frbfwtmc/fvc9的bp1160或表达fwtfrbc9/mc.fvfv的bp1300与表达cd19的raji伯基特淋巴瘤细胞系共培养。在i9+carζ+mc或frbfwtmc/fvc9两种形式下,通过用瑞米达西活化安全开关均消除肿瘤杀伤。相比之下,雷帕霉素或异丁氧基雷帕霉素活化fwtfrbc9/mc.fvfv中的irc9并特异性地消除对肿瘤的免疫应答。参考文献以下参考文献在本实施例中被提及,并且其全部内容在此以引用方式并入本文申请中。1.straathofkc,pulema,yotndap,dottig,vaninef,brennermk,heslophe,spencerdm和rooneycm.用于t细胞疗法的诱导型胱天蛋白酶9安全开关.blood.2005;105(11):4247-54.2.fanl,freemankw,khant,phame和spencerdm.基于胱天蛋白酶和fadd的改善的人工死亡开关.humgenether.1999;10(14):2273-85.3.spencerdm,wandlesstj,schreibersl和crabtreegr.用合成配体控制信号传导.science.1993;262(5136):1019-24.4.acevedovd,gangulard,freemankw,lir,zhangy,wangf,ayalage,petersonle,ittmannm和spencerdm.诱导型fgfr-1活化导致不可逆的前列腺腺癌和上皮-间质转化.cancercell.2007;12(6):559-71.5.spencerdm,belshawpj,chenl,hosn,randazzof,crabtreegr和schreibersl.使用合成的二聚化诱导物对体内fas信号传导的功能分析.currbiol.1996;6(7):839-47.6.strassera,corys和adamsjm.破译程序性细胞死亡的规则以改善癌症和其他疾病的疗法.emboj.2011;30(18):3667-83.7.narayananp,laptevan,seethammagarim,levittjm,slawinkm和spencerdm.复合myd88/cd40开关协同活化小鼠和人树突细胞用于增强抗肿瘤功效.jclininvest.2011;121(4):1524-34.8.sabatinidm,erdjument-bromageh,luim,tempstp和snydersh.raft1:以雷帕霉素依赖性方式结合fkbp12且与酵母tor同源的哺乳动物蛋白质.cell.1994;78(1):35-43.9.brownej,albersmw,shintb,ichikawak,keithct,lanews和schreibersl.g1阻遏性雷帕霉素受体复合物所靶向的哺乳动物蛋白质.nature.1994;369(6483):756-8.10.chenj,zhengxf,brownej和schreibersl.289-kdafkbp12-雷帕霉素缔合蛋白质内的11-kdafkbp12-雷帕霉素结合结构域的鉴别和关键的丝氨酸残基的表征.procnatlacadsciusa.1995;92(11):4947-51.11.choij,chenj,schreibersl和clardyj.与人frap的结合结构域相互作用的fkbp12-雷帕霉素复合物的结构.science.1996;273(5272):239-42.12.hosn,biggarsr,spencerdm,schreibersl和crabtreegr.二聚体配体限定转录活化结构域在再起始中的作用.nature.1996;382(6594):822-6.13.klemmjd,bealscr和crabtreegr.核蛋白质快速靶向细胞质.currbiol.1997;7(9):638-44.14.baylejh,grimleyjs,stankunask,gestwickije,wandlesstj和crabtreegr.具有差异结合特异性的雷帕霉素类似物允许对蛋白质活性的正交控制.chembiol.2006;13(1):99-107.15.stankunask,baylejh,gestwickije,linym,wandlesstj和crabtreegr.使用基因敲入小鼠和二聚化化学诱导物的条件蛋白质等位基因.molcell.2003;12(6):1615-24.16.stankunask,baylejh,havranekjj,wandlesstj,bakerd,crabtreegr和gestwickije.用化学配体拯救fk506-雷帕霉素结合(frb)蛋白质的易降解突变体.chembiochem.2007.17.liberlessd,diverst,austindj和schreibersl.使用通过哺乳动物三杂交筛选所鉴别的无毒配体的诱导型基因表达和蛋白质易位.procnatlacadsciusa.1997;94(15):7825-30.18.luengoji,yamashitads,dunningtond,beckak,rozamuslw,yenhk,bossardmj,levyma,handa,newman-tarrt等,雷帕霉素类似物的结构活性研究:c-7甲氧基是效应物结构域的一部分并且位于fkbp12-frap界面处的证据.chembiol.1995;2(7):471-81.本实施例的附录:附录1:pbp1300--psfg-fkbp.frb.δc9.t2a-αcd19.q.cd8stm.ζ.p2a-imc附录2:pbp1308--psfg-fkbp.frb.δc9.t2a-αpsca.q.cd8stm.ζ.p2a-imc附录3:pbp1310--psfg.frb.fkbp.δc9.t2a-δcd19附录4:pbp1311--psfg.fkbp.frb.δc9.t2a-δcd19附录5:pbp1316--psfg-fkbp.frbl.δc9.t2a-αpsca.q.cd8stm.ζ.p2a-imc附录6:pbp1317--psfg-fkbp.frb.δc9q.t2a-αpsca.q.cd8stm.ζ.p2a-imc附录7:pbp1319--psfg-fkbp.frb.δc9.t2a-αpsca.q.cd8stm.ζ.p2a-mc.fkbpv附录8:pbp1320--psfg-fkbp.frb.δc9.t2a-αpsca.q.cd8stm.ζ.p2a-mc附录9:pbp1321--psfg-fkbp.frb.δc9.t2a-αpsca.q.cd8stm.ζ.p2a-mc.fkbpv.fkbp附录10:pbp1151--psfg--mc-t2a-αcd19.q.cd8stm.ζ附录11:pbp1152--psfg--mc-t2a-αcd19.q.cd8stm.ζ附录12:pbp1414--psfg-αcd19.q.cd8stm.ζ-p2a-mc附录13:pbp1414--psfg-αcd19.q.cd8stm.ζ-p2a-mc附录14:pbp1433--psfg—fv-fv-mc-t2a-αcd19.q.cd8stm.ζ附录15:pbp1439--psfg--mc.fkbpv-t2a-αcd19.q.cd8stm.ζ附录16:pbp1440--psfg-fkbpv.δc9.t2a-αcd19.q.cd8stm.ζ.t2a.p2a-mc.fkbpwt.frbl附录17:pbp1460--psfg-fkbpv.δc9.t2a-αcd19.q.cd8stm.ζ.t2a.p2a-mc.fkbpwt.frbl实施例26:控制被靶向的治疗性细胞的活化和消除的双开关本实施例提供涉及控制被靶向的治疗性细胞的活化和消除的方法。免疫或治疗性细胞可用于免疫疗法,其中治疗性细胞被靶向至例如实体瘤或白血病细胞。在某些方法提供涉及使用表达嵌合抗原受体的t细胞的数据的情况下,应当理解,可修改这些方法以用于其他治疗性细胞和异源多肽,例如重组t细胞受体。因此,例如,在本实施例中所提供的载体和细胞可包括使用具有针对特定抗原或细胞的抗原识别部分的car的情况下,可通过例如用编码重组tcr的多核苷酸取代编码car的多核苷酸对所述载体和细胞进行修饰以包括使用针对特定抗原或细胞的重组tcr。图68提供了比较在t细胞中共表达第一代car和雷帕霉素/雷帕霉素类似物或瑞米达西诱导型嵌合截短的myd88/cd40多肽(mc)的t细胞的共刺激能力的测定结果。对于这些测定,雷帕霉素类似物诱导型mc(mc-rap或irmc)包含野生型fkbp12多肽(fwt)和frbl多肽(fl);瑞米达西诱导型mc(imc+carζ、或imc)包含两个fkbp12v36多肽(fv)(图68b)。该测定比较mcrap和imc引导的对肿瘤细胞的car-t细胞杀伤的共刺激。将主要含有t细胞的人pbmc活化,并用逆转录病毒载体pbp1455(其编码在雷帕霉素类似物应答性共刺激结构域(myd88-cd40-fkbp-frbl,称为mc-rap)下游的由psca引导的第一代car)、逆转录病毒pbp0189(其中通过imc(myd88-cd40-fkbpv36-fkbpv36)赋予共刺激)或用编码car、但无共刺激分子的对照逆转录病毒构建体转导。在用il-2静息7天之后,将car-t细胞与用红色荧光蛋白质(rfp)标记的表达psca的hpac肿瘤细胞以1:30的效应物与靶标比共培养。在incucyte室中用显微镜测量标记细胞在一周内的生长。在存在2nmc7-异丁氧基雷帕霉素(iburap)的情况下,含有mc-rap的细胞能够像含有瑞米达西刺激的imc的imc+carζ-t细胞一样有效地控制肿瘤细胞。图69提供了比较从相同载体共表达第一代car、mcrap多肽和瑞米达西诱导型嵌合胱天蛋白酶-9多肽(ic9)的t细胞的共刺激能力的测定结果,其中表达mcrap多肽的多核苷酸的放置是变化的。该测定中所提供的结果证实mcrap在三基因统一载体内的放置影响共刺激活性的程度。图69提供了各种逆转录病毒载体的示意性图示。pbp1466将mc-rap(mc-fkbp-frbl)置于car和ic9安全开关的3'端。pbp1491将mc-rap置于ic9和car之间。pbp1494将mc-rap置于ic9和car的5'端。car在每种情况下都含有靶向psca抗原的scfv。2a共翻译切割序列将mc-rap与car和ic9细胞凋亡开关隔开。图69b:提供了共刺激信号传导的报告子测定。用1μgnf-κb-seap报告子和3μg所示的dna构建体转染293细胞。在24小时之后,将培养物分配到96孔板的12个孔中,并用2nm的瑞米达西或2nm的c7-异丁氧基雷帕霉素以一式四份模拟刺激或处理。每次转染在没有刺激的情况下均展现出最小的基础活性,而具有位于逆转录病毒构建体5'端的mc-rap的构建体1494在用iburap刺激时展现出增强的活性。图69c提供了car-t细胞因子分泌测定结果。将主要含有t细胞的人pbmc活化并用(a)中所示的逆转录病毒载体转导。在用il-2静息7天之后,将car-t细胞与用红色荧光蛋白质(rfp)标记的表达psca的hpac肿瘤细胞以1:5的效应物与靶标比共培养。在建立共培养之后24小时,去除培养基并通过elisa确定干扰素-γ水平。该细胞因子的分泌受到来自car的tcrζ组分以及通过诱导的mc活性进行的共刺激的信号1影响。这种共刺激对具有位于逆转录病毒构建体的5'端的mc-rap的1494构建体中的iburap最稳健。图69d提供了car-t杀伤测定结果。将包含具有所示拓扑定向的多肽的经修饰的转导或转染t细胞与hpac-rfp肿瘤靶标以1:20的e:t比培养,并且在incucyte室中用显微镜测量标记细胞在一周内的生长。在存在2nmc7-异丁氧基雷帕霉素(iburap)的情况下,具有位于5'端的mc-rap的构建体1494在药物依赖性的肿瘤控制方面最有效。(未显示)在每种情况下,与瑞米达西孵育活化安全开关ic9引起car-t细胞凋亡和肿瘤控制的丧失。图70提供了比较从相同载体共表达第一代car、mcrap多肽和瑞米达西诱导型嵌合胱天蛋白酶-9多肽(ic9)的t细胞的共刺激能力的测定结果,其中表达mcrap多肽的多核苷酸的定向和定位是变化的。frb和fkbp的定向和定位被修改以比较在表达所述载体的t细胞中的mc共刺激活性。图70a提供了逆转录病毒载体的示意性图示。bp1493和bp1494将fkbp和frbl置于mc的3’端并呈该定向。pbp1796维持fkbp相对于frb的相同定向,但将这些药物结合组分置于构建体的5'端,由此形成氨基端融合物。构建体bp1757和bp1759反转frb和fkbp的定向,将frbl置于氨基端。指示car的scfv单位所靶向的抗原。图70b提供了共刺激信号传导的报告子测定结果。用1μgnf-κb-seap报告子和3μg所示的dna构建体转染293细胞。在24小时之后,将培养物分配到96孔板中,并以一式四份添加c7-异丁氧基雷帕霉素的稀释系列。每次转染在没有刺激的情况下均表现出最小的基础活性,而构建体1757展现出用雷帕霉素类似物时的增强刺激。图70c和图70d提供了psca-car-t杀伤测定结果。将具有frbl、fkbp和mc的所示拓扑定向的t细胞与hpac-rfp肿瘤靶标以1:20(c)或1:30(d)的e:t比培养,并且在incucyte室中用显微镜测量标记细胞在一周内的生长。在存在2nmc7-异丁氧基雷帕霉素(iburap)的情况下,具有位于5'端的mc-rap的构建体1757在不添加药物的情况下在肿瘤控制方面最有效。以1:30的高e:t指示在有药物的情况下的增加效力,其中只有1757能够充分增殖以维持肿瘤控制。图70e、图70f和图70g提供了her2-car-t杀伤测定结果。将具有frbl、fkbp和mc的所示拓扑定向的t细胞与hpac-rfp肿瘤靶标以1:15的e:t比(图70e)、skov3卵巢癌细胞(e:t=1:10)(图70f)或skbr3-gfp乳腺癌细胞(e:t=1:1)(图70g)培养,并且在incucyte室中用显微镜测量标记细胞在一周内的生长。在存在2nmc7-异丁氧基雷帕霉素(iburap)的情况下,具有位于5'端的mc-rap的构建体1759在不添加药物的情况下在肿瘤控制方面最有效。以1:30的高e:t指示在有药物的情况下的增加效力,其中只有1757能够充分增殖以维持肿瘤控制。从这些数据推断,通过将frb、然后fkbp定位在mc的氨基端实现最大药物依赖性mc-rap效力。图71提供了测定共表达第一代car、mcrap多肽和ic9多肽的t细胞的细胞凋亡活性的测定结果。所述测定提供的结果显示,在这些细胞中,诱导型细胞凋亡仅通过用瑞米达西将ic9二聚化来引导。将主要含有t细胞的pbmc活化,并用所示逆转录病毒构建体和对照构建体bp1488转导,该对照构建体仅携带具有car而无ic9的mc-rap。将细胞与胱天蛋白酶3/7活性指示剂试剂(essenbiosciences)在incucyte孵育箱/显微镜中与增加量的瑞米达西(图71a)或c7-异丁氧基雷帕霉素(图71b)一起孵育。在非常低浓度的瑞米达西(<100pm),观察到fkbpv36-胱天蛋白酶9(ic9)组分从每个构建体活化,但不从不含ic9的mc-rapcar-t细胞(1488)活化。甚至高于用于活化mc-rap的水平(通常使用1nm)超过100倍的高浓度iburap也不足以活化细胞凋亡,指示共表达的mc-fkbp-frbl和fkbp-胱天蛋白酶之间由复合雷帕霉素引导的在理论上可能的异二聚化事件在该测定中不明显。图72提供了单逆转录病毒载体或双逆转录病毒载体形式的双开关imc加irc9的示意图。图72a提供了统一载体设计的示意图,所述设计整合了imc活化开关(fvfv)(存在于载体的3'端)和irc9(frb和fkbpwt)(其存在于载体中的5'端)二者。用来源于cd34的q-bend10(q)表位标记经转导的t细胞。combicar平台(图72b)包含相同的蛋白质组分,但所述蛋白质组分由两种逆转录病毒表达以增加imc的表达水平并由此增加构建体的效力。irc9的标志在于cd19的截短形式的表达,所述截短形式仅含有胞外结构域且不含有胞内信号传导结构域。imc+carζ组分并入用于共刺激的imc和car顺反子,所述car顺反子含有紧随scfv之后的q表位标志物。图73a提供了表达irc9多肽的细胞中细胞凋亡活性的测定结果,其中frb和fkbpwt的定向和定位是变化的。图73a提供了irc9逆转录病毒构建体的示意性图示,bp1501是仅含有胱天蛋白酶9组分而无药物结合部分的阴性对照。bp0220是fkbpv附接到胱天蛋白酶9以产生ic9的ic9构建体。该构建体应答于瑞米达西而非雷帕霉素。构建体bp1310和bp1311具有在所示定向上的野生型fkbp(瑞米达西对其具有差的亲和力)和frb。图73b提供了用图73a的各种逆转录病毒构建体转导的t细胞的测定结果。将主要含有t细胞的pbmc活化并用所示逆转录病毒构建体转导,并且将细胞与胱天蛋白酶3/7活性指示剂试剂(essenbiosciences)在incucyte孵育箱/显微镜中与增加量的雷帕霉素一起孵育24h。细胞的荧光转化指示胱天蛋白酶3/7试剂切割以随时间标记细胞凋亡。图73c是相对于来自图73b的测定的药物治疗的起始,随雷帕霉素浓度而变化的最大凋亡活性的图形表示。当frb位于fkbp12和胱天蛋白酶-9的氨基端时,irc9是最有效的。图73d提供了t细胞中胱天蛋白酶-9转基因表达的蛋白质印迹。将用所示逆转录病毒载体转导的来自两个供体的细胞裂解并提取蛋白质,在sds聚丙烯酰胺凝胶上分离,转移到pvdf过滤器并通过蛋白质印迹显现胱天蛋白酶-9表达。与较高的雷帕霉素诱导的bp1310的细胞凋亡活性一致,表达略高于bp1311。图74提供了比较imc+carζ-t细胞(细胞表达imc和car)与combicar-t细胞(细胞表达imc、car和irc9)的活化特征的测定结果。为了确定包含来自bp1311的嵌合胱天蛋白酶多肽是否损害imc+carζ-t细胞功效,将人pbmc活化并用所示逆转录病毒载体转导。在用il-2静息7天之后,将car-t细胞与用红色荧光蛋白质(rfp)标记的表达psca的hpac肿瘤细胞以1:10的效应物与靶标比共培养。在建立共培养之后48小时,去除培养基并通过elisa确定白介素-6(il-6,图74a)、il-2(图74b)和干扰素-γ(ifn-γ,图74c)的水平。细胞因子分泌通过瑞米达西处理以剂量依赖性方式增加,并且在imc+carζ形式和combicar形式之间非常相似。有趣的是,combicar刺激ifn分泌的效果稍差。图74d提供了car-t杀伤测定结果。将具有所示拓扑定向的指示形式的car-t细胞与hpac-rfp肿瘤靶标以1:10的e:t比培养。在incucyte室中用显微镜测量标记细胞在一周内的生长。在该水平的car-t包含下,杀伤不取决于药物,而是被imc的基础活性增强(比较每种car形式与缺少imc的bp1373)。图74e提供了每种car形式中imc和嵌合胱天蛋白酶多肽的表达的蛋白质印迹。将用所示逆转录病毒载体转导的t细胞裂解并提取蛋白质,在sds聚丙烯酰胺凝胶上分离,转移到pvdf过滤器并通过蛋白质印迹探测所示蛋白质的表达。粘着斑蛋白表达表示凝胶中每条泳道的加样相等性。imc的表达在imc+carζ和combicar形式之间类似。图75提供了统一的单载体和双载体形式内的雷帕霉素诱导型胱天蛋白酶-9(irc9)的测定结果。将来自两个单独供体(877和904)的t细胞(抗cd3/cd28)活化,并且未经转导的(nt)或用编码cd34表位标记的imc+carζ-t(imc-2a-car-ζ)、(imc-2a-irc9-2a-car-ζ)或combicar的逆转录病毒转导(用编码imc+carζ-t和irc9的病毒共转导)。通过用cd34微珠试剂盒(miltenyi)纯化使5×107个imc+carζ-t细胞(1463)和t细胞(1358)的群体针对经转导细胞富集,同时用鉴别来自嵌合胱天蛋白酶构建体的标志物的cd19微珠选择combicar细胞。高转导细胞的这种富集程序或“分选”产生了大于95%的标志物阳性。在图75a中,将细胞与胱天蛋白酶3/7活性指示剂(essenbiosciences)在incucyte板孵育箱/显微镜中与0nm、1nm或10nm雷帕霉素一起孵育。每4小时自动进行细胞凋亡(通过胱天蛋白酶-3/7活化)的读数,并针对未分选(上图)和分选(下图)细胞显示。图75b提供了在未分选(左图)和分选(右图)细胞的12小时时间点,两个供体的数据的图形表示(和平均值)。对于图75c,将类似地经转导的t细胞在存在0nm、1nm或10nm雷帕霉素的情况下孵育24小时,并用膜联蛋白v和碘化丙啶(pi)针对细胞死亡染色。显示来自1个供体的未分选细胞的代表图。图75d提供了来自如图75c中处理24小时的未分选(左图)和分选(右图)细胞的两个供体的结果的图形表示。图76提供了评估与针对急性骨髓性白血病肿瘤的抗cd123car在t细胞中共表达的不同形式的imc的功效的体内实验的结果。以不表达irc9安全开关的imc+carζ-t细胞的形式并且以双开关combicar平台(其中所述细胞还表达irc9)的形式评估imc。图76a提供了通过生物发光(bli)成像确定的带有肿瘤的动物的显微照片。将1.0×106个表达gfp-荧光素酶的thp-1肿瘤细胞静脉内注射到年龄匹配的nsg小鼠中。在7天后(第0天),将2.5×106个未经转导(nt)的t细胞、imc+carζ转导的t细胞或combicar转导的t细胞(即具有分别通过cd34或cd19来源的表位标记的imc+carζ-t载体和irc9载体的双重转导细胞)注射到带有肿瘤的动物中。在第1天和第15天用瑞米达西(1mg/kg)注射各组(n=5)。从t细胞注射当天(第0天)开始每周对动物成像。经转导的combicar细胞经cd19选择并通过cd34针对car表达归一化。图76b提供了显示经由bli(辐射率)(左图)或t细胞注射后的重量变化%(右图)反映的每组平均肿瘤生长的数据,。图76c提供了显示终止(第28天)时脾中人t细胞数目的数据。左图显示注射瑞米达西(ap)之前或之后的人(鼠(m)cd45-cd3+)t细胞的总数。中图显示具有可检测的car表达(通过cd34表位)的人t细胞的%。右图显示具有可检测的irc9(通过cd19表位)的人t细胞的%。*=p<0.05,通过学生t检验确定。图76d提供了显示从来源于脾(顶部)或骨髓(底部)的dna通过qpcr确定的载体拷贝数(vcn)的数据。选择对imc(左图)或i胱天蛋白酶-9(右图)具有特异性的引物。*=p<0.05,通过学生t检验确定。图77提供了评估与针对molm13肿瘤的抗cd33car在t细胞中共表达的不同形式的imc的功效的体内实验的结果。以不表达irc9安全开关的imc+carζ-t细胞的形式并且以双开关combicar平台(其中所述细胞还表达irc9)的形式评估imc。图77a提供了通过bli成像确定的带有肿瘤的动物的显微照片。将pbmc活化并用来源于抗cd33imc+carζ-t载体(pbp1293)和irc9载体(pb1385)的逆转录病毒共转导。对nsg小鼠静脉内植入1×106个molm13-gfp.fluc细胞,持续6天,之后静脉内输注5×106个表达irc9或cd33-combicar的t细胞。在以1mg/kg输注t细胞之后每周腹膜内给予瑞米达西或安慰剂。在图77a中,使用ivis生物发光(bli)测量gfp.fluc生长并计算平均辐射率(图77b)。图77c提供了来自图77a的体内测定的卡普兰-梅尔分析的结果。图77d提供了在t细胞注射之后第32天结束时,瑞米达西治疗的cd33combicar组的代表性facs分析结果。图78提供了比较在完整动物模型中瑞米达西诱导型ic9细胞凋亡开关和雷帕霉素诱导型(irc9)细胞凋亡开关的特异性和功效的测定的结果。将用bp220(含有ic9)或bp1310(含有irc9)和用gfp-萤光素酶载体转导的1.0×107个t细胞静脉内植入8周龄的雌性免疫缺陷小鼠(nod.cgprkdcscidil2rgtm1wjl/szj;nsg)中。使小鼠在t细胞注射之后约4hr(在药物施用后-14hr)经受ivis成像。第二天,在即将药物注射前(0hr)对小鼠进行成像,然后用媒介物、在solutol和pbs中稀释的瑞米达西或在10%peg、17%tween-80中稀释的雷帕霉素腹膜内注射。在药物注射之后5-6hr和24hr再次对小鼠进行成像。将小鼠处死并取出脾用于facs分析。图78a提供了bli测定结果。通过ivis将小鼠针对来源于萤火虫荧光素酶的生物发光成像。在相对于药物或媒介物施用的所示时间点对小鼠进行成像。由于瑞米达西对fkbp12的f36v突变体是特异性的并且ic9利用野生型fkbp12,因此只有用瑞米达西处理带有ic9而不是带有ic9的动物才观察到t细胞凋亡的辐射损失。图78b提供了来自图78a的平均计算辐射率的图形表示。图78c提供了显示图78a的体内测定的独立定量分析结果的数据。分离小鼠脾中的人t细胞,并通过用基于氯化铵/钾(ack)的裂解缓冲液裂解红细胞,之后通过70μm尼龙过滤器进行机械解离来制备单细胞悬浮液。随后用以下抗体对细胞进行染色:抗-hcd3-percp.cy5.5、抗-hcd19-apc和抗-mcd45ra-bv510。将人t细胞计数归一化为存在于脾制备物中的表达小鼠cd45的细胞的数目。图79提供了在完整动物模型中雷帕霉素诱导的ic9细胞凋亡开关的剂量应答性测定的结果。将用bp1385(含有irc9)和用gfp-萤光素酶载体转导的1.0×107个t细胞静脉内植入8周龄的雌性免疫缺陷小鼠(nod.cgprkdcscidil2rgtm1wjl/szj;nsg)中。使小鼠在t细胞注射之后约4hr(在药物施用后-24hr)经受ivis成像。第二天,在即将药物注射前(0hr)对小鼠进行成像,然后用媒介物、在solutol和pbs中稀释的瑞米达西或在5%peg、2.5%tween-80中稀释的雷帕霉素腹膜内注射,所述稀释是从10mg/kg体重以阶梯式(step)对数稀释进行。在药物注射之后5-6hr和24hr再次对小鼠进行成像。将小鼠处死并取出脾用于facs分析。图79a提供了bl1成像的图片表示。图79b提供了来自图79a的平均计算辐射率的图形表示。图79c提供了终止(24小时)时脾中人t细胞数目的图。左图显示用指示存在细胞凋亡开关的cd19标记的人(鼠(m)cd45-cd3+)的总数。中图显示脾中保留的人t细胞中cd19标志物的平均荧光强度。右图显示具有可检测的ic9(通过cd19表位)的人t细胞的总数。*=p<0.05,通过学生t检验确定。图79d提供了由来源于脾的dna通过qpcr确定的载体拷贝数(vcn)的图。选择对imc(左图,本实验中的阴性对照)或i胱天蛋白酶-9和gfp-luc(中图和右图)特异性的引物。实施例27:用两种独立的、无毒的蛋白质二聚化化学诱导物来控制car-t细胞功效和安全性的双开关平台本实施例讨论使用单一逆转录病毒载体来表达irmc多肽、第一代car和ic9安全开关。对于本实施例,使用雷帕霉素类似物c7-异丁氧基雷帕霉素(ibu-rap)来诱导mc活性。应当理解,野生型frb和雷帕霉素也可用于本实施例中。此外,对于本实施例,irmc包含称为frbklw或“klw”的经修饰的frb多肽。在本技术的其他实施例中,irc9和irmc多肽可包含经修饰的frb多肽,而不是本文所提供的野生型frb。此外,结合野生型frb多肽或经修饰的frb多肽的各种雷帕霉素类似物可用于活化irc9或irmc。嵌合抗原受体(car)t细胞策略已被证实对多种播散性癌症有效,但实体瘤仍然是一个挑战。为了改善功效,开发了一种平台,以将肿瘤抗原特异性第一代car与胞质共刺激组分irmc隔开,该胞质共刺激组分irmc由雷帕霉素非免疫抑制类似物c7-异丁氧基雷帕霉素(iburap)调控。为了减轻脱肿瘤细胞毒性或过度的细胞因子释放的风险,将irmc与基于胱天蛋白酶-9的开关ic9组合,通过瑞米达西调控的同二聚化和活化引导快速t细胞凋亡。为了产生非免疫抑制性雷帕霉素类似物,用异丁氧基部分替代酸敏感性c7-甲氧基。该“凸起”的增加体积降低了对mtor/torc1的亲和力和抑制,但保留了来源于mtor的称为klw的突变体fkbp-雷帕霉素结合(frb)结构域的亚纳摩尔亲和力。将klw与野生型fkbp12和共刺激信号传导结构域(myd88和cd40)串联融合以产生irmc。以稳健且依赖于剂量的方式(ec50<1nm)用iburap刺激nf-κb活性。当并入到逆转录病毒(irmc-2a-ic9-2a-car)形式中并与car特异性肿瘤细胞孵育时,iburap的添加刺激t细胞增殖、细胞因子产生和剂量依赖性肿瘤细胞杀伤。在7天的共培养中,雷帕霉素类似物/irmc刺激的her2特异性irmc-2a-ic9-2a-cart细胞优先增殖,导致消除>90%的skbr3乳腺癌细胞(e:t,1:1)、skov3卵巢癌(e:t,1:5)或hpac(e:t,1:15)胰腺癌细胞。如果irmc-2a-ic9-2a-car-t培养物中包含瑞米达西,则快速诱导t细胞凋亡(对于荧光胱天蛋白酶-3底物的显微镜观察,t1/2=6小时)。尽管有irmc和ic9二者者都并入fkbp12结构域的事实,但由于瑞米达西对fkbp12的f36v变体具有高度特异性,因此共刺激且安全的开关被正交调节。实施例28:靶向实体瘤的双开关本实施例讨论两种逆转录病毒载体的用途,其中第一载体表达imc和第一代car,并且第二载体表达irc9安全开关。虽然嵌合抗原受体(car)t免疫疗法已显示出针对白血病和淋巴瘤的显著功效,但需要改善的car-t功效和持久性而不危害安全性来攻克实体瘤。开发了两种独立调控的分子开关,其可在暴露于其同族配体后诱发特异且快速诱导的细胞应答。细胞活化受同二聚化剂瑞米达西控制,所述瑞米达触发myd88和cd40(imc)下游的信号传导级联。共同表达雷帕霉素控制的促细胞凋亡开关,其诱导胱天蛋白酶-9的二聚化以减轻来自过量car-t功能(irc9)的可能毒性。当与第一代car组合时,这些分子开关允许对工程化t细胞进行特异且有效的调控。将t细胞活化并与“imc+carζ”、sfg-imc-2a-car.ζ载体和ic9-x载体(sfg-frb.fkbp12.c9-2a-δcd19)共转导以产生combicar。通过胱天蛋白酶-3活化和膜联蛋白v转化来确定雷帕霉素依赖性细胞死亡的观察到的快速动力学和约95%效率。在nsg小鼠中用egfp萤光素酶(egfpluc)标记的t细胞进行ic9-x功能性的体内评估,显示雷帕霉素处理在24小时内在90%的含irmc的t细胞中引起细胞死亡,类似于临床验证的瑞米达西调控的ic9。在7天的肿瘤细胞共培养中通过细胞因子产生、t细胞生长和肿瘤细胞杀伤进一步评价imc共刺激。添加ic9-x不会有害地影响瑞米达西处理的含imc的car-t细胞的抗肿瘤功效(其在共同培养物测定中以1:20的效应物与靶标比消除oe-19食管肿瘤细胞(3.9±4.3%oe19-gfp.fluc细胞保留在imc+carζ修饰的培养物中,对于combicar,为1.1±0.1%))或t细胞扩增(针对imc+carζ的53.4±9.4%car+,相对于针对combicar的44.6±13.2%)。在植入egfpluc标记的肿瘤负荷的nsg小鼠中每周评价combicar-t细胞的体内功效,并且对于t细胞的持久性,通过海肾荧光素酶标志物进行评价。当在带有oe9肿瘤的小鼠模型中受到攻击时,抗her2双开关t细胞以瑞米达西依赖性的方式控制肿瘤生长,该方式是多种肿瘤模型的代表。当通过瑞米达西的系统性施用提供共刺激时,包含单独的配体依赖性活化和细胞凋亡以及第一代car的双开关平台有效控制t细胞生长和肿瘤消除。布置ic9-x导致combicar-t细胞的快速且有效的消除,提供用于管理肿瘤抗原特异性car-t细胞的持久性和安全性的用户控制系统。实施例29:活化重组tcr表达细胞的双开关本实施例讨论两种逆转录病毒载体的用途,其中第一载体表达imc和针对prame的重组tcr,并且第二载体表达irc9安全开关。经工程化以表达抗原特异性t细胞受体(tcr)的α链和β链的t细胞已显示出作为癌症免疫疗法治疗的前景;然而,耐久应答已受到经基因修饰的t细胞的差持久性限制。另外,输注大量tcr修饰的t细胞后,发生严重的毒性,包括患者死亡。为了增强t细胞持久性,同时提供抵抗危及生命的毒性的保护,开发了双开关αβtcr平台,其使用雷帕霉素(rap)诱导的胱天蛋白酶-9(irc9)连同瑞米达西(rim)-控制的活化开关(诱导型myd88/cd40(imc))。合成来源于hla-a2限制性的、prame特异性t细胞克隆的αβtcr序列,并将其与imc符合读框放置,以产生imc-prametcr,所述imc包含来自融合到串联rim结合突变体fkbp12v36结构域的myd88和cd40的信号传导结构域。将胱天蛋白酶-9融合到frb和野生型fkbp结构域,并与可选标志物(截短的cd19(δcd19))符合读框克隆以产生irc9-δcd19逆转录病毒。所有模块被2a多肽序列隔开。用imc-prametcr和irc9-δcd19病毒双重转导活化的人t细胞,随后用针对cd19表达使用磁性柱富集。通过将经转导的t细胞分别暴露于10nmrim或rap来活化imc和irc9。在具有u266(骨髓瘤)和thp-1(aml)细胞的共培养物测定中,在存在或不存在诱导型配体的情况下评估tcr修饰的t细胞的增殖、细胞因子产生和细胞毒性。用imc-prametcr和irc9-δcd19转导的t细胞显示在cd19选择后的tcr和δcd19的有效且稳定的表达(82±9%cd3+vβ1+,96±2%cd3+cd19+)。在共培养物测定中,与具有或不具有imc活化的不相关tcr(cmvpp65)相比,双开关prametcr表现出对hla-a2+prame+thp-1和u266肿瘤细胞的特异性裂解。然而,rim暴露诱导il-2的42倍诱导(9±0.3相对于385±180pg/mlil-2)并且导致tcr-修饰的t细胞的13倍扩增。irc9的表达不干扰tcr功能,也不干扰tcr和imc活化之间的协同作用。此外,暴露于rap触发双开关tcr修饰的t细胞的快速凋亡(有rap的72±5%膜联蛋白-v+相对于无药物的14±4%),指示自杀开关也有功能。imc利用瑞米达西为tcr工程化t细胞提供共刺激。另外,irc9提供可在严重毒性的情况下消除t细胞的雷帕霉素诱导型自杀开关。这种imc增强的irc9并入性tcr是新型双开关tcr工程化t细胞疗法的原型,其可增加过继性t细胞疗法的功效、耐久性和安全性。以下附录提供了本文所提供的实施例中提到的序列和质粒:附录18:pbp1293--psfg-imc.t2a-αhcd33(my9.6).ζ附录19:pbp1296--psfg-imc.t2a-αhcd123(32716).ζ附录20:pbp1327--psfg-frb.fkbpv.δc9.2a-δcd19附录21:pbp1328--psfg-fkbpv.frb.δc9.2a-δcd19附录22:pbp1351--psfg-sp163.fkbp.frb.δc9.t2a-αhpsca.q.cd8stm.ζ.2a-imc附录23:pbp1373--psfg-sp-fkbp.frb.δc9.t2a-αhpscascfv.q.cd8stm.ζ附录24:pbp1385--psfg-frb.fkbp.δc9.t2a-δcd19附录25:pbp1455--psfg-mc.fkbpwt.frbl.t2a-αpsca.q.cd8stm.ζ附录26:pbp1466--psfg-fkbpv.δc9.t2a-psca.q.cd8stm.ζ.p2a-mc.fkbpwt.frbl附录27:pbp1474--psfg-fkbpv.δc9.t2a-αher2.q.cd8stm.ζ附录28:pbp1475--psfg-fkbpv.δc9.t2a-αpsca.q.cd8stm.ζ附录29:pbp1488--psfg-frbl.fkbpwt.mc-t2a-αpsca.q.cd8stm.ζ附录30:pbp1491--psfg--fkbpv.δc9.p2a.mc.fkbpwt.frbl.t2a-αher2.q.cd8stm.ζ附录31:pbp1493--psfg-mc.fkbpwt.frbl-p2a.fkbpv.δc9.t2a-αher2.q.cd8stm.ζ附录32:pbp1494--psfg-mc.fkbpwt.frbl-p2a.fkbpv.δc9.t2a-psca.q.cd8stm.ζ附录33:pbp1757--psfg-frbl.fkbpwt.mc-p2a.fkbpv.δc9.t2a-αpsca.q.cd8stm.ζ附录34:pbp1759--psfg--frbl.fkbpwt.mc-p2a.fkbpv.δc9.t2a-αher2.q.cd8stm.ζ附录35:pbp1796--psfg--fkbpwt.frbl-mc.p2a.fkbpv.δc9.t2a-αpsca.q.cd8stm.ζ实施例30:细胞凋亡的双重控制本实施例提供了包含双分子开关的嵌合促细胞凋亡多肽的示例,提供了用于活化细胞凋亡的配体的选择。制备嵌合双重控制的胱天蛋白酶-9多肽并测定其细胞凋亡活性。在本实施例中,提供体外数据,其比较了在293和原代人t细胞中应答于瑞米达西和雷帕霉素处理的各种胱天蛋白酶-9分子开关的细胞凋亡诱导。表达这三种胱天蛋白酶-9开关的t细胞当被引入nsg小鼠中时,在暴露于它们各自的活化配体后24小时内被有效地消除。最后,体内frb.fkbpv.δc9开关的剂量滴定证实,瑞米达西和雷帕霉素二者均在低到1mg/kg的药物浓度刺激t细胞的有效去除。方法从通过墨西哥湾沿岸地区血液中心(gulfcoastregionalbloodcenter)获得的血沉棕黄层分离的外周血单核细胞(pbmc)。血沉棕黄层对传染性病毒病原体测试为阴性。t细胞的活化和转导基本上如本文所讨论的那样通过瞬时转染293t产生逆转录病毒并活化t细胞。用pbp1501、pbp0220、pbp1310、pbp1311、pbp1327、pbp1328载体转导t细胞。分型和体内细胞计数使用抗cd3-percp.cy5.5抗体和抗-cd19-apc抗体通过流式细胞术确定转导效率。在处死小鼠后,通过对总的脾细胞数计数并乘以通过流式细胞术观察到的cd3+cd34+t细胞的百分比来计算脾中总的经转导的t细胞数。为了检查小鼠中的t细胞的表型,分离脾并通过用基于氯化铵/钾(ack)的裂解缓冲液裂解红细胞,之后通过70μm尼龙过滤器进行机械解离来制备单细胞悬浮液。随后用以下抗体对细胞进行染色:抗-hcd3-percp.cy5.5、抗-hcd19-apc和抗-mcd45ra-bv510。293细胞中的srαseap测定在第0天,将5×105个293细胞接种到6孔板上的2mldmem培养基(10%fbs+1%pen/strep)中。在第1天,用各1μg的pbp1501、pbp0220、pbp1310、pbp1311、pbp1327、pbp1328载体和srα-seap报告质粒(pbp0046)共转染细胞。在第2天,收集细胞,并将其接种到含有2×浓缩的半对数药物稀释物的96孔板上,并且也通过facs分析转染效率。在第3天,将药物处理的细胞在68℃热灭活1小时,将上清液添加到含有在2m二乙醇胺中稀释的1mmmup底物(2×浓度)的黑色96孔板上。将板在37℃孵育30min,并测量405nm处的吸光度。蛋白质印迹分析在用适当的逆转录病毒转导之后,将6×106个t细胞接种在6孔板的每孔的3mlctl培养基中。在24小时后,收集细胞,在冷pbs中洗涤,并在冰上在含有1×halt蛋白酶抑制剂混合剂(thermo,87786)的ripa裂解和提取缓冲液(thermo,89901)中裂解30min。在4℃将裂解物以16,000×g离心20min并将上清液转移到新的埃彭道夫管中。依照制造商的推荐,使用piercebca蛋白质测定试剂盒(thermo,23227)进行蛋白质测定。为了制备用于sds-page的样品,将50μg裂解物与4×laemmli样品缓冲液(biorad,1610747)混合,并在95℃加热10min。同时,使用biorad浇注设备和30%丙烯酰胺/双溶液(biorad,160158)制备10%sds凝胶。将样品以等水平的总蛋白质连同precisionplus蛋白质双色标准品(precisionplusproteindualcolorstandards)(biorad,1610374)一起加样并在1×tris/甘氨酸运行缓冲液(biorad,1610771)中在140v运行90min。在蛋白质分离之后,在iblot2装置(thermo,ib21001)中使用程序0(总共7min)将凝胶转移到pvdf膜上。随后根据制造商的推荐,使用ibindflexwesterndevice(thermo,slf2000)用一级抗体和二级抗体探测膜。以1:200稀释度使用抗胱天蛋白酶-9抗体(thermo,pa1-12506),并且以1:500稀释度使用二级hrp缀合的山羊抗兔igg抗体(thermo,a16104)。以1:1000稀释度使用β-肌动蛋白抗体(thermo,pa1-16889),并且以1:1000稀释度使用二级hrp缀合的山羊抗兔igg抗体(thermo,a16104)。使用supersignalwestfemto最大灵敏度底物试剂盒(thermo,34096)使膜显色并使用gellogic6000pro照相机和carestreammi软件(v.5.3.1.16369)成像。使用incucyte的体外t细胞胱天蛋白酶活化测定在用适当的逆转录病毒转导之后,将5×104个t细胞接种到存在或不存在药物(瑞米达西或雷帕霉素)的96孔板的每孔的存在il-2的ctl培养基中。为了使得能够使用incucyte仪器检测细胞凋亡,将2μmincucytetm动力学胱天蛋白酶-3/7细胞凋亡试剂(essenbioscience,4440)添加到每个孔中以达到200μl的总体积。将板以400×g离心5min并置于incucyte(双色模型4459)内以在10×物镜下每2-3小时监测绿色荧光,总共持续48小时。使用“tcells_caspreagent_phase_green_10x_mld”加工定义进行图像分析。使用“总绿色对象积分强度”度量(“totalgreenobjectintegratedintensity”metric)和“相位对象汇合(phaseobjectconfluence(percent))(百分比)”来对胱天蛋白酶活化进行定量。每个条件以一式两份进行,且使每个孔在4个不同位置成像。动物模型用100μlpbs中的1×106个t细胞静脉内注射8周龄的雌性免疫缺陷小鼠(nod.cgprkdcscidil2rgtm1wjl/szj;nsg)。使小鼠在t细胞注射之后约4hr(在药物施用后-14hr)经受ivis成像。第二天,在即将药物注射前(0hr)对小鼠进行成像,然后用媒介物、在solutol和pbs中稀释的瑞米达西或在“pt”中稀释的雷帕霉素腹膜内注射。在药物注射之后5-6hr和24hr再次对小鼠进行成像。将小鼠处死并取出脾用于facs分析。体内生物发光成像在相对于药物或媒介物施用的所示时间点针对萤火虫荧光素酶来源的生物发光对小鼠进行成像。结果嵌合胱天蛋白酶-9多肽中frb和fkbp的拓扑结构由于信号传导元件和结合结构域的顺序和间隔可能会影响结果,因此检查了具有诱导型嵌合胱天蛋白酶-9多肽的配体结合结构域的顺序(frb.fkbp.δc9(pbp1310)和fkbp.frb.δc9(pbp1311))(图106a)。利用胱天蛋白酶3/7绿色试剂的胱天蛋白酶活化测定(其中胱天蛋白酶活性通过释放绿色荧光团的肽试剂的切割被捕获,绿色荧光发射由此标记经历细胞凋亡的细胞)揭示frb.fkbp.δc9比fkbp.frb.δc9对t细胞中由雷帕霉素介导的细胞凋亡的起始稍微更敏感(图106b)。这种适度的差异可能归因于相较于fkbp.frb.δc9的蛋白水平,frb.fkbp.δc9蛋白水平更高(图106c)。由于嵌合irc9胱天蛋白酶多肽含有野生型fkbp结构域,因此需要确定能够触发二聚化和胱天蛋白酶活化的瑞米达西的浓度。在该测定中,用表达fkbpv36胱天蛋白酶-9(ic9)和两种相似的雷帕霉素诱导型变体(frb.fkbp.δc9和fkbp.frb.δc9)的载体瞬时转染293细胞(图107),并用雷帕霉素或瑞米达西的半对数稀释物处理。对细胞进行在存在胱天蛋白酶3/7绿色试剂的情况下的胱天蛋白酶活化测定且通过incucyte监测,或者通过使用组成型srα-seap报告子的分泌型碱性磷酸酶(seap)测定来间接测量雷帕霉素介导的细胞死亡。在功能上,雷帕霉素诱导型嵌合胱天蛋白酶-9多肽和瑞米达西诱导型嵌合胱天蛋白酶-9多肽当被它们各自的自杀药物活化时,似乎以相似的动力学和阈值诱导胱天蛋白酶切割(图107a)。相比之下,从seap测定获得的数据证实,与在低雷帕霉素浓度下的雷帕霉素诱导型胱天蛋白酶-9开关(irc9)相比,ic9嵌合胱天蛋白酶多肽中的瑞米达西诱导型开关在低瑞米达西浓度下对活化更敏感(图107b)。甚至在存在少到100pm的雷帕霉素的情况下,雷帕霉素诱导型嵌合胱天蛋白酶-9多肽irc9也是高活性的,在甚至更低的药物水平下,尽管动力学更慢,也有一定功效。当比较两种irc9多肽(frb.fkbp.δc9与fkbp.frb.δc9)时,与fkbp.frb.δc9相比,frb.fkbp.δc9在更低的雷帕霉素浓度下有活性,与图106b中获得的数据一致。最后,irc9嵌合胱天蛋白酶-9多肽对于低于100nm的瑞米达西不敏感,这使得将该雷帕霉素诱导的关断开关与另一瑞米达西介导的开关(例如,imc)组合是可行的。表达嵌合irmc9的t细胞可在体外被瑞米达西和雷帕霉素二者活化。通过使irc9内的fkbp结构域突变为f36v来产生irmc9(frb.fv.δc9(pbp1327)和fv.frb.δc9(pbp1328)),以适应瑞米达西结合。进行srα-seap测定以评估3种关断开关(ic9(pbp220)、irc9(pbp1310和pbp1311)和irmc9(pbp1327和pbp1328))的药物特异性。质粒pbp1501仅含有c9结构域,并用作药物诱导的阴性对照(图106a)。瑞米达西可活化ic9和irmc9开关二者,但要求>100nm配体来活化irc9开关(图108a)。相反,雷帕霉素可活化irc9和irmc9开关二者,但即使在1000nm浓度下也不能诱导ic9的二聚化。为了确定这些开关在活化的t细胞中的功能性,产生了逆转录病毒上清液并将其转导到从3个独立供体活化的pbmc中。对表达不同胱天蛋白酶-9开关的t细胞进行在存在胱天蛋白酶3/7绿色试剂的情况下,使用增加剂量的瑞米达西和雷帕霉素且通过incucyte监测的杀伤测定(图108b)。如通过srα-seap测定所观察到的,瑞米达西可活化ic9和irmc9,但不能活化包含野生型fkbp12的irc9,而雷帕霉素能活化irc9和irmc9,但不能活化ic9。单独的阴性对照δc9(pbp1501)在瑞米达西或雷帕霉素存在下不起作用。值得注意的是,瑞米达西以大于活化fv.frb.δc9(pbp1328)的效率活化frb.fv.δc9(pbp1327),可能是由于fv结构域邻近胱天蛋白酶-9。通过蛋白质印迹确定诱导型胱天蛋白酶的蛋白质水平。与irc9和irmc9两者相比,ic9以更高的水平表达(图108c)。基于这些数据,选择以下质粒进行进一步体内测试:ic9(pbp0220)、irc9(pbp1310)和irmc9(pbp1327)。irmc9t细胞可在体内被瑞米达西和雷帕霉素二者活化。将来自供体676的pbmc活化,并用关断开关中的一种和gfp-fluc逆转录病毒共转导。在转导之后11天,用gfp和抗cd3/抗cd19抗体分析细胞的转导效率(图109a)。该分析显示ic9t细胞为41%gfp+/cd19+,irc9t细胞为65%gfp+/cd19+并且irmc9t细胞为51%gfp+/cd19+。不同t细胞群体的cd19+mfi为:ic9=15.07,irc9=14.38,并且irmc9=13.39。将细胞收集,计数,洗涤并以1×106个细胞再悬浮于100μlpbs中,用于每个尾静脉小鼠注射(表10)(时间=-18hr)。第二天,将5mg/kg瑞米达西(溶解在solutol和pbs中)或10mg/kg雷帕霉素(溶解基于洗涤剂的赋形剂“pt”中)10%peg-400+17%tween-80)腹膜内注射到各个相应组中(时间=0hr)。在-14小时、0小时、5小时、24小时和29小时进行ivis成像。将小鼠处死并收集脾以供用hcd3、hcd19和mcd45抗体进行facs分析。瑞米达西施用诱导ic9和irmc9t细胞的显著去除,而雷帕霉素诱导irc9和irmc9t细胞的去除(图109b和图109c)。用瑞米达西处理的ic9组中检测到的相对高水平的bli信号可能归因于经转导的t细胞中的高单一gfp+群体(41%)(图109a)。有趣的是,在用雷帕霉素处理的表达ic9的t细胞组中,ivis成像显示出与各自的无药物组相比更高的信号,表明由pt构成的雷帕霉素媒介物可促进检测到的生物发光。脾细胞的分析揭示,与无药物组或雷帕霉素处理组相比,约20%的ic9t细胞在瑞米达西处理后保留(图109d)。类似地,在24小时时,与无药物组和瑞米达西处理组中的那些相比,大约25%的irc9t细胞在雷帕霉素处理后保留。在irmc9组中,约50%和约40%的irmc9t细胞分别在施用瑞米达西或雷帕霉素后保留。所观察到的较高百分比的保留的irmc9t细胞可归因于使无药物组归一化的人工因素。在绘制脾细胞的cd19+mfi的图(图109d,右图)中,irmc9t细胞具有与其他组相比在注射前所见的更低cd19+mfi,并且药物处理后的脾中保留的t细胞具有与ic9处理组和irc9处理组相似的cd19+mfi。瑞米达西和雷帕霉素在带有irmc9t细胞的小鼠中的药物滴定。irmc9构建体代表理想的开关,其可允许直接比较在同一分子中瑞米达西相对于雷帕霉素诱导的杀伤动力学。在该实验中,通过由供体584用pbp1327和gfp-fluc逆转录病毒共转导来产生irmc9t细胞。在转导后10天,facs分析指示73%的细胞是gfp+/cd19+并且cd19+mfi是15.23(图110a)。每只小鼠静脉内注射1000万个irmc9t细胞(表10)(时间=-14hr)。第二天,将瑞米达西(溶解在solutol和pbs中)或雷帕霉素(溶解在pt中)腹膜内注射到各个相应组中(时间=0hr)。媒介物组接受pbs、pbs中的25%solutol或pt中的5%dma。在-10小时、0小时、6小时和24小时进行ivis成像。将小鼠处死并收集脾以供用hcd3、hcd19和mcd45抗体进行facs分析。瑞米达西剂量滴定的ivis成像显示irmc9t细胞的剂量依赖性去除(图110b和图110c)。相比之下,雷帕霉素给予组中的ivis成像显示所检测到的ivis信号的意外增加,所述增加在媒介物治疗组中最显著,但在pbs处理组中未观察到(图110b)。这一观察结果与先前实验中观察到的结果(图109b)相似,且可能归因于pt的组成部分。然而,脾细胞分析显示关于瑞米达西或雷帕霉素对irmc9修饰的t细胞去除的相似剂量应答(图110d)。图106.irc9中frb和fkbp的拓扑结构。(图106a)将来自供体920的pbmc活化并用pbp1310和pbp1311载体转导。(图106b)在转导后5天,将t细胞接种于具有0nm、0.8nm、4和20nm雷帕霉素的96孔板上。另外,添加2μm胱天蛋白酶3/7绿色试剂以监测incucyte的胱天蛋白酶切割。线图描绘了frb.fkbp.δc9相对于fkbp.frb.δc9在雷帕霉素处理后24小时内的胱天蛋白酶活化。(图106c)通过使用针对h胱天蛋白酶-9和β-肌动蛋白的抗体进行蛋白质印迹来分析irc9t细胞的蛋白质表达。图107.活化irc9需要高(>100nm)的瑞米达西浓度。将293细胞以300,000个细胞/孔接种于6孔板中并使其生长2天。在48h之后,用1μg实验质粒转染细胞。在转染之后48h收获细胞并将其稀释其原始体积的2.5x。(图107a)对于incucyte/casp3/7测定,每孔平铺50μl细胞,包括瑞米达西或雷帕霉素药物和胱天蛋白酶3/7绿色试剂(2.5μm最终浓度)。(图107b)对于seap测定,将100μl细胞平铺在具有(半对数)瑞米达西(或雷帕霉素)药物稀释物的96孔板中并且在药物暴露之后约18h,将板在底物(4-mup)添加之前热灭活。图108.irmc9t细胞可在体外被瑞米达西和雷帕霉素二者活化。(图108a)通过用pbp1501、pbp220、pbp1310、pbp1311、pbp1327、pbp1328载体和srα-seap报告质粒共转染293细胞进行srαseap测定。(图108b)对于incucyte/casp3/7测定,将t细胞接种在存在2μm胱天蛋白酶3/7绿色试剂的具有增加的瑞米达西和雷帕霉素浓度的96孔板上以通过incucyte监测胱天蛋白酶切割。(图108c)通过使用针对h胱天蛋白酶-9和β-肌动蛋白的抗体进行蛋白质印迹来分析irc9t细胞的蛋白质表达。图109.irmc9t细胞可在体内被瑞米达西和雷帕霉素二者活化。将来自供体676的pbmc活化并用编码pbp0220、1310、1327载体和gfp-fluc质粒的逆转录病毒共转导。(图109a)在转导后11天,在将细胞注射到小鼠中之前,分析其cd19和gfp转导效率。(图109b和图109c)对每只小鼠用与gfp-fluc共转导的107个t细胞静脉内注射nsg小鼠,且在第二天腹膜内注射自杀药物。在药物施用后-14小时、0小时、5小时、24小时和29小时评估细胞的生物发光。(图109d)在药物治疗后29h,使小鼠安乐死,并收集脾以供用针对hcd3、hcd34和mcd45的抗体进行流式细胞术分析图110.瑞米达西和雷帕霉素在带有irmc9t细胞的小鼠中的药物滴定。将来自供体584的pbmc活化并用编码pbp1327载体和gfp-fluc质粒的逆转录病毒共转导。(图110a)在转导后10天,在将细胞注射到小鼠中之前,分析其cd19和gfp转导效率。(图110b和图110c)对每只小鼠用与gfp-fluc共转导的1×107个t细胞静脉内注射nsg小鼠,且在第二天腹膜内注射自杀药物。在药物施用后-10小时、0小时、6小时和24小时评估细胞的生物发光。(图110d)在药物治疗后24h,使小鼠安乐死,并收集脾以供用针对hcd3、hcd34和mcd45的抗体进行流式细胞术分析。表9.比较ic9、irc9和irmc9在体内的细胞凋亡活化。组号t细胞(gfp-fluc)自杀药物小鼠的数目1220无治疗322205mg/kg瑞米达西5322010mg/kg雷帕霉素341310无治疗3513105mg/kg瑞米达西36131010mg/kg雷帕霉素571327无治疗3813275mg/kg瑞米达西59132710mg/kg雷帕霉素5小鼠总数35表10.瑞米达西和雷帕霉素在带有irmc9的小鼠中的药物滴定。概述比较三种不同的胱天蛋白酶-9使能型(enabled)安全开关之间在施用二聚化剂配体后细胞凋亡诱导的动力学和效率。一般来说,在用各自的药物触发时,ic9、irc9和irmc9关断开关之间在细胞凋亡诱导能力方面是相似的,但在动力学和剂量应答方面存在一些细微差别。因此,这三种安全开关设计扩展了分子工具箱,所述分子工具箱可用于当前和未来对关断机制有关键需要的临床应用。由于预测雷帕霉素和瑞米达西具有不同的药物效应动力学性质,因此该技术的一个可能应用可以是选择可提供组织选择性的配体。例如,如果由于血脑屏障的不可渗透性而将瑞米达西排除在脑外,则irmc9开关可通过雷帕霉素活化。或者,如果需要滴定t细胞数目,一种药物相对于另一种药物的剂量-应答曲线可能是决定布置哪种药物的重要决定因素。此外,如果需要口服递送,雷帕霉素或类似物可能是合理选择。实施例31:诱导型myd88-cd40共刺激通过cd123特异性嵌合抗原受体t细胞提供配体依赖性肿瘤根除提供了在表达cd123特异性嵌合抗原受体的t细胞共刺激背景下使用两种分子开关中的一种(imc)的示例。cd19特异性嵌合抗原受体(car)指向的t细胞用于治疗b细胞白血病和淋巴瘤的有前景的临床结果表明car可能在其他血液学恶性肿瘤(例如急性髓样白血病(aml))中有效。cd123/il-3rα由于其在aml原始细胞和白血病干细胞(aml-lsc)两者上的高表达而是有吸引力的car-t细胞靶标。然而,如果cd123特异性car-t细胞显示长期持久性,则抗原也以较低水平在正常干细胞祖细胞上表达,从而呈现主要的毒性担忧。imc-car共刺激平台imc使用增殖缺陷型第一代cd123特异性car连同配体(瑞米达西(rim))依赖性共刺激开关(诱导型myd88/cd40(imc))一起来提供医师控制的对cd123+肿瘤细胞的根除并调控长期car-t细胞植入。逆转录病毒和转导:将t细胞用抗cd3/28抗体活化,且随后用编码与myd88和cd40胞质信号传导分子符合读框地克隆的串联rim结合结构域(fkbp12v36)和第一代靶向cd123的car的双顺反子逆转录病毒(sfg-imc-cd123.ζ)(图111)转导。共培养物测定:在有rim和无rim的情况下,在利用cd123+、egfp萤光素酶(egfpluc)修饰的白血病细胞系(kg1、thp-1和molm-13)的共培养实验中,使用incucyte活细胞成像系统评估imc共刺激对靶向cd123的car的作用。通过elisa从共培养上清液检查il-2的产生。动物实验:使用免疫缺陷型nsg肿瘤异种移植物模型评估imc-cd123.ζ-修饰的t细胞的体内功效。将100万个表达egfpluc的cd123+thp-1肿瘤细胞静脉内注射到动物中,之后在第7天用不同的未经转导的t细胞或imc-cd123.ζ-修饰的t细胞单次静脉内注射。接受car-t细胞的组随后仅在t细胞注射后第0天和第15天接受rim(1mg/kg)或媒介物的腹膜内注射。使用ivis生物发光成像(bli)每周评价动物的thp-1-egfpluc肿瘤负荷和重量变化,并且在t细胞注射后第30天通过流式细胞术和qpcr评价t细胞持久性。图112:将来自2个供体的pbmc活化并用编码cd123imc+carζ-t载体的逆转录病毒转导。在转导后6天,将t细胞与thp1-gfp.fluc细胞或hpac-rfp细胞以1:10的e:t比接种到存在0nm、0.1nm或1nm瑞米达西的96孔板上,并置于incucyte中以监测thp1-gfp.fluc或hpac-rfp生长的动力学。(a和b)在接种后两天,通过elisa分析来自一式两份板的培养上清液的il-6和il-2产生。在第7天,使用用于incucyte的基本分析仪软件分析(c)thp1-gfp.fluc的总绿色荧光强度和(d)每孔hpac-rfp细胞的数目。图113.将来自4个供体的pbmc活化并用编码cd123imc+carζ-t和rfp载体的逆转录病毒共转导。在转导后10天,将t细胞与thp1-gfp.fluc细胞以1:1的e:t比接种到存在0nm或1nm瑞米达西的96孔板上,并置于incucyte中以监测thp1-gfp.fluc和t细胞-rfp生长的动力学。(a)在接种后两天,通过elisa分析来自一式两份板的培养上清液的il-2产生。在第7天,通过流式细胞术分析(b)thp1-gfp.fluc细胞的数目和(c)保留在共培养物中的t细胞-frp的数目。使用incucyte分析的(d)thp1-gfp.fluc绿色荧光和(e)t细胞-rfpp红色荧光的时程监测,总共7天。图114.(a)将pbmc活化并用包括cd123imc-carζ载体的逆转录病毒转导。在转导之后12天,在注射到小鼠中之前使用抗q-bend10抗体确定car表达。(b)对nsg小鼠静脉内植入1×106个thp1-gfp.fluc细胞,持续7天,之后静脉内输注2.5×106个未经转导(nt)细胞或cd123imc-carζ细胞。在以1mg/kg输注t细胞之后第0天和第15天腹膜内给予瑞米达西或安慰剂。(c)使用ivis生物发光测量荧光thp1-gfp.fluc生长。(d,e)在第30天,处死小鼠,并通过流式细胞术和载体拷贝数测定分析脾中car-t细胞的存在。图115:(a)对nsg小鼠静脉内植入1×106个thp1-gfp.fluc细胞,持续7天,之后用10e6个ntt细胞或各种剂量的cd123imc+carζ-t细胞静脉内治疗。在以1mg/kg输注t细胞之后第0天和第15天腹膜内给予瑞米达西或安慰剂。(b)在第29天,处死小鼠,并通过载体拷贝数测定分析脾中car-t细胞的存在。当通过系统性瑞米达西施用提供共刺激时,包含配体依赖性活化开关和增殖缺陷型第一代car的imc-carζ平台有效地根除cd123+白血病细胞。剥夺imc共刺激导致car-t水平降低,提供用于管理cd123特异性car-t细胞的持久性和安全性的用户控制系统。实施例32:诱导型myd88/cd40增强肿瘤特异性tcr修饰的t细胞的增殖和存活并且改善骨髓瘤中的抗肿瘤功效提供了在表达肿瘤特异性重组tcr的t细胞的背景下使用两种分子开关中的一种(imc)的示例。使用经工程化以表达肿瘤抗原特异性tcr的t细胞的癌症免疫疗法已在临床中显示出前景;然而,耐久的应答受到体内差的t细胞扩增和持久性限制。另外,肿瘤细胞上mhci类的下调降低了t细胞的识别,导致治疗功效降低。诱导型myd88/cd40(imc)是增强dc活化1以及t细胞增殖和存活的瑞米达西(ap1903)信赖性共刺激分子。prame(黑色素瘤中优先表达的抗原)是在许多癌症中但不在正常组织中过表达的睾丸癌(ct)抗原,所述癌症包括黑色素瘤、肉瘤、aml、cml、成神经细胞瘤、乳腺癌、肺癌、头颈癌。bob1(也被称为oca-b、obf1或pou2af1)是在cd19+b细胞、all、cll、mcl和多发性骨髓瘤(mm)中高度表达的b细胞特异性转录共活化剂。图116是使用诱导型共刺激多肽(imc)进行控制以更好地调控有效t细胞疗法的“按需共刺激”系统的示意图。t细胞活化和增殖是tcr-依赖性的和imc-依赖性的。最大的针对肿瘤的细胞毒性以及体内t细胞持久性需要来自肿瘤特异性tcr和瑞米达西活化的imc的协同信号。图117:(a-c)表达prametcr的逆转录病毒载体(amir等)或编码prametcr、imc多肽和表面标志物的载体,(d)sll-肽脉冲t2细胞的prametcr识别与瑞米达西依赖性imc信号协同作用以获得最大il-2分泌。图118:(a)trans-well测定装置。(b)由顶部孔中的经转导的t细胞分泌的细胞因子以不依赖于抗原但依赖于imc和瑞米达西的方式上调sk-n-sh成神经细胞瘤细胞表面上的hlai类。图119(a)imc-prametcr介导的针对hla-a2+prame+u2os骨肉瘤的细胞毒性是不依赖于瑞米达西的。(b)来自prametcr的信号与瑞米达西驱动的imc共刺激协同作用,产生最大的il-2分泌。go156tcr是阴性对照tcr。图120:(a)imc-bob-1tcr介导的针对hla-b7+bob-1+u266多发性骨髓瘤的细胞毒性是不依赖于瑞米达西的。(b)来自bob-1tcr的信号与瑞米达西驱动的imc共刺激协同作用,产生最大的il-2分泌。go156tcr是阴性对照tcr。图121:(a)对nsg小鼠植入1×106个表达荧光素酶的u266骨髓瘤细胞,并在第13天,用1×107个未经转导的t细胞、prametcr-转导的t细胞或imc-prametcr-转导的t细胞治疗。从第14天开始,接受imc-prame转导的t细胞的小鼠中的5只每周腹膜内接受5mg/kg瑞米达西直到第38天。(b)通过生物发光成像测量肿瘤生长。(c,d)在第94天处死小鼠,并分析脾中人t细胞的持久性。imc共刺激显著增加vβ1+cd8+t细胞的数目(c),但不增加vβ1+cd4+t细胞的数目(d)。瑞米达西驱动的imc活化在经转导的t细胞中提供有效的共刺激信号,所述共刺激信号与来自外源性prame-特异性tcr或bob1-特异性tcr的信号协同作用,导致体外和体内增强的t细胞增殖/存活以及改善的抗肿瘤功效。imc活化上调肿瘤靶标上的hlai类水平,这应当会通过工程化t细胞和内源性t细胞二者改善细胞毒性。参考文献:narayananp等,复合myd88/cd40开关协同活化小鼠和人树突细胞用于增强抗肿瘤功效.jclininvest.(2011)121:1524.amiral等,可用于治疗性t细胞受体基因转移的具有有效的抗肿瘤反应性的prame特异性同种异体-hla-限制性t细胞(usefulfortherapeutict-cellreceptorgenetransfer).clincancerres(2011)17:5615.实施例33:代表性实施方案下文提供了本技术的某些实施方案的实施例。a1.一种核酸,其包含可操作地连接到编码第一嵌合多肽的第一多核苷酸的启动子,其中:所述第一嵌合多肽包含结合第一配体的第一多聚化区;所述第一多聚化区包含第一配体结合单位和第二配体结合单位;所述第一配体是包含第一部分和第二部分的多聚体配体;所述第一配体结合单位结合所述第一配体的所述第一部分并且不显著结合所述第一配体的所述第二部分;并且所述第二配体结合单位结合所述第一配体的所述第二部分并且不显著结合所述第一配体的所述第一部分。a2.根据实施方案a1所述的核酸,其中所述第一嵌合多肽包含促细胞凋亡多肽区。a2.1.根据实施方案a2所述的核酸,其中所述第一多聚化区位于所述促细胞凋亡多肽区的氨基端。a2.2.根据实施方案a2所述的核酸,其中所述第一多聚化区位于所述促细胞凋亡多肽区的羧基端。a3.根据实施方案a1所述的核酸,其中所述第一嵌合多肽包含a)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和b)缺少cd40胞外结构域的cd40胞质多肽区。a4.根据实施方案a1-a3中任一项所述的核酸,其包含编码第二嵌合多肽的第二多核苷酸,其中:所述启动子可操作地连接到所述第二多核苷酸;所述第二嵌合多肽包含结合第二配体的第二多聚化区;所述第二多聚化区包含第三配体结合单位;所述第二配体是包含第三部分的多聚体配体;并且所述第三配体结合单位结合所述第二配体的所述第三部分并且不显著结合所述第一配体的所述第二部分。a5.根据实施方案a4所述的核酸,其中所述第一配体的所述第一部分和所述第二配体的所述第三部分相同。a6.根据实施方案a4所述的核酸,其中所述第一配体的所述第一部分和所述第二配体的所述第三部分不同。a7.根据实施方案a4所述的核酸,其中所述第一多聚化区的所述第一配体结合单位和所述第二多聚化区的所述第三配体结合单位相同。a8.根据实施方案a4所述的核酸,其中所述第一多聚化区的所述第一配体结合单位和所述第二多聚化区的所述第三配体结合单位不同。a9.根据实施方案a4-a8中任一项所述的核酸,其中所述第二嵌合多肽包含促细胞凋亡多肽区并且所述第一嵌合多肽不包含所述促细胞凋亡多肽区。a10.根据实施方案a9所述的核酸,其中所述第二嵌合多肽包含a)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和b)缺少cd40胞外结构域的cd40胞质多肽区其中所述第二嵌合多肽的所述第二多聚化区包含至少两个第三结合单位。a11.根据实施方案a1-a8中任一项所述的核酸,其中所述第二嵌合多肽包含mc多肽,其中所述mc多肽包含a)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和b)缺少cd40胞外结构域的cd40胞质多肽区并且所述第一嵌合多肽不包括所述mc多肽。a12.根据实施方案a11所述的核酸,其中所述第二嵌合多肽包含促细胞凋亡多肽区。a13.根据实施方案a1-a12中任一项所述的核酸,其中所述第一配体结合单位是fkbp12或fkbp12变体。a14.根据实施方案a13所述的核酸,其中所述第一配体结合单位是fkbp12。a15.根据实施方案a1-a14中任一项所述的核酸,其中所述第二配体结合单位是frb或frb变体。a16.根据实施方案a15所述的核酸,其中所述第二配体结合单位是frbl。a17.根据实施方案a1-a16中任一项所述的核酸,其中所述第三配体结合单位是fkbpv36。a18.根据实施方案a17所述的核酸,其中所述第一配体结合单位不是fkbpv36。a19.根据实施方案a1-a18中任一项所述的核酸,其中所述第一配体是雷帕霉素或雷帕霉素类似物。a20.根据实施方案a1-a19中任一项所述的核酸,其中所述第二配体是ap1903。a21.根据实施方案a1-a20中任一项所述的核酸,其中所述第三配体结合单位以比所述第一配体结合单位结合所述第二配体的所述第三部分的亲和力高100x的亲和力结合所述第二配体的所述第三部分。a22.根据实施方案a1-a20中任一项所述的核酸,其中所述第三配体结合单位以比所述第一配体结合单位结合所述第二配体的所述第三部分的亲和力高500x的亲和力结合所述第二配体的所述第三部分。a23.根据实施方案a1-a20中任一项所述的核酸,其中所述第三配体结合单位以比所述第一配体结合单位结合所述第二配体的所述第三部分的亲和力高1000x的亲和力结合所述第二配体的所述第三部分。a24.根据实施方案a1-a23中任一项所述的核酸,其进一步包含编码嵌合抗原受体的多核苷酸。a25.根据实施方案a24所述的核酸,其中所述嵌合抗原受体包含(i)跨膜区、(ii)t细胞活化分子和(iii)抗原识别部分。a26.根据实施方案a1-a23中任一项所述的核酸,其进一步包含编码嵌合t细胞受体的多核苷酸。a27.一种修饰细胞,其包含根据实施方案a1-a26中任一项所述的核酸。a28.一种修饰细胞,其包含编码第一嵌合多肽的第一多核苷酸,其中:所述第一嵌合多肽包含结合第一配体的第一多聚化区;所述第一多聚化区包含第一配体结合单位和第二配体结合单位;所述第一配体是包含第一部分和第二部分的多聚体配体;所述第一配体结合单位结合所述第一配体的所述第一部分并且不显著结合所述第一配体的所述第二部分;并且所述第二配体结合单位结合所述第一配体的所述第二部分并且不显著结合所述第一配体的所述第一部分。a29.根据实施方案a28所述的修饰细胞,其中所述第一嵌合多肽包含促细胞凋亡多肽区。a30.根据实施方案a28所述的修饰细胞,其中所述第一嵌合多肽包含a)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和(b)缺少cd40胞外结构域的cd40胞质多肽区。a31.根据实施方案a28-a30中任一项所述的修饰细胞,其包含编码第二嵌合多肽的第二多核苷酸,其中:所述第二嵌合多肽包含结合第二配体的第二多聚化区;所述第二多聚化区包含第三配体结合单位;所述第二配体是包含第三部分的多聚体配体;并且所述第三配体结合单位结合所述第二配体的所述第三部分并且不显著结合所述第一配体的所述第二部分。a32.根据实施方案a31所述的修饰细胞,其中所述第一配体的所述第一部分和所述第二配体的所述第三部分相同。a33.根据实施方案a31所述的修饰细胞,其中所述第一配体的所述第一部分和所述第二配体的所述第三部分不同。a34.根据实施方案a31所述的修饰细胞,其中所述第一多聚化区的所述第一配体结合单位和所述第二多聚化区的所述第三配体结合单位相同。a35.根据实施方案a31所述的修饰细胞,其中所述第一多聚化区的所述第一配体结合单位和所述第二多聚化区的所述第三配体结合单位不同。a36.根据实施方案a31-a35中任一项所述的修饰细胞,其中所述第二嵌合多肽包含促细胞凋亡多肽区并且所述第一嵌合多肽不包含所述促细胞凋亡多肽区。a37.根据实施方案a36所述的修饰细胞,其中所述第二嵌合多肽包含a)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和(b)缺少cd40胞外结构域的cd40胞质多肽区其中所述第二嵌合多肽的所述第二多聚化区包含至少两个第三结合单位。a38.根据实施方案a28-a35中任一项所述的修饰细胞,其中所述第二嵌合多肽包含mc多肽,其中所述mc多肽包含a)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和b)缺少cd40胞外结构域的cd40胞质多肽区并且所述第一嵌合多肽不包括所述mc多肽。a39.根据实施方案a38所述的修饰细胞,其中所述第二嵌合多肽包含促细胞凋亡多肽区。a40.根据实施方案a28-a39中任一项所述的修饰细胞,其中所述第一配体结合单位是fkbp12或fkbp12变体。a41.根据实施方案a40所述的修饰细胞,其中所述第一配体结合单位是fkbp12。a42.根据实施方案a28-a41中任一项所述的修饰细胞,其中所述第二配体结合单位是frb或frb变体。a43.根据实施方案a42所述的修饰细胞,其中所述第二配体结合单位是frbl。a44.根据实施方案a28-a43中任一项所述的修饰细胞,其中所述第三配体结合单位是fkbpv36。a45.根据实施方案a44所述的修饰细胞,其中所述第一配体结合单位不是fkbpv36。a46.根据实施方案a28-a45中任一项所述的修饰细胞,其中所述第一配体是雷帕霉素或雷帕霉素类似物。a47.根据实施方案a28-a46中任一项所述的修饰细胞,其中所述第二配体是ap1903。a48.根据实施方案a28-a47中任一项所述的修饰细胞,其中所述第三配体结合单位以比所述第一配体结合单位结合所述第二配体的所述第三部分的亲和力高100x的亲和力结合所述第二配体的所述第三部分。a49.根据实施方案a28-a47中任一项所述的修饰细胞,其中所述第三配体结合单位以比所述第一配体结合单位结合所述第二配体的所述第三部分的亲和力高500x的亲和力结合所述第二配体的所述第三部分。a50.根据实施方案a28-a47中任一项所述的修饰细胞,其中所述第三配体结合单位以比所述第一配体结合单位结合所述第二配体的所述第三部分的亲和力高1000x的亲和力结合所述第二配体的所述第三部分。a51.根据实施方案a28-a50中任一项所述的修饰细胞,其进一步包含编码嵌合抗原受体的多核苷酸。a52.根据实施方案a51所述的修饰细胞,其中所述嵌合抗原受体包含(i)跨膜区、(ii)t细胞活化分子和(iii)抗原识别部分。a53.根据实施方案a28-a50中任一项所述的修饰细胞,其进一步包含编码嵌合t细胞受体的多核苷酸。a54.一种修饰细胞,其包含a)第一嵌合多肽,其中:所述第一嵌合多肽包含结合第一配体的第一多聚化区;所述第一多聚化区包含第一配体结合单位和第二配体结合单位;所述第一配体是包含第一部分和第二部分的多聚体配体;所述第一配体结合单位结合所述第一配体的所述第一部分并且不显著结合所述第一配体的所述第二部分;并且所述第二配体结合单位结合所述第一配体的所述第二部分并且不显著结合所述第一配体的所述第一部分;和b)第二嵌合多肽,其中:所述第二嵌合多肽包含结合第二配体的第二多聚化区;所述第二多聚化区包含第三配体结合单位;所述第二配体是包含第三部分的多聚体配体;并且所述第三配体结合单位结合所述第二配体的所述第三部分并且不显著结合所述第一配体的所述第二部分。a55.根据实施方案a54所述的修饰细胞,其包含编码第一嵌合多肽的第一多核苷酸和编码第二嵌合多肽的第二多核苷酸。a56.根据实施方案a28-a55中任一项所述的修饰细胞,其包含所述第一配体或所述第二配体。a57.一种试剂盒或组合物,其包含核酸,所述核酸包含第一多核苷酸和第二多核苷酸,其中a)所述第一多核苷酸编码第一嵌合多肽,其中:所述第一嵌合多肽包含结合第一配体的第一多聚化区;所述第一多聚化区包含第一配体结合单位和第二配体结合单位;所述第一配体是包含第一部分和第二部分的多聚体配体;所述第一配体结合单位结合所述第一配体的所述第一部分并且不显著结合所述第一配体的所述第二部分;并且所述第二配体结合单位结合所述第一配体的所述第二部分并且不显著结合所述第一配体的所述第一部分;和b)所述第二多核苷酸编码第二嵌合多肽,其中所述第二嵌合多肽,其中:所述第二嵌合多肽包含结合到第二配体的第二多聚化区;所述第二多聚化区包含第三配体结合单位;所述第二配体是包含第三部分的多聚体配体;并且所述第三配体结合单位结合所述第二配体的所述第三部分并且不显著结合所述第一配体的所述第二部分。1.一种核酸,其包含可操作地连接到编码嵌合促细胞凋亡多肽的多核苷酸的启动子,其中所述嵌合促细胞凋亡多肽包含a)促细胞凋亡多肽区;b)frb或frb变体区;和c)fkbp12多肽区。2.根据实施方案1所述的核酸,其中区域(a)、(b)和(c)从所述嵌合促细胞凋亡多肽的氨基端到羧基端的顺序是(c)、(b)、(a)。3.根据实施方案1所述的核酸,其中区域(a)、(b)和(c)从所述嵌合促细胞凋亡多肽的氨基端到羧基端的顺序是(b)、(c)、(a)。3.1.根据实施方案2或3中任一项所述的核酸,其中(b)和(c)位于所述促细胞凋亡多肽的氨基端。3.2.根据实施方案2或3中任一项所述的核酸,其中(b)和(c)位于所述促细胞凋亡多肽的羧基端。4.根据实施方案1到3.2中任一项所述的核酸,其中所述嵌合促细胞凋亡多肽进一步包含在区域(a)、(b)和(c)之间的接头多肽。5.根据实施方案1-4中任一项所述的核酸,其进一步包含编码标志物多肽的多核苷酸。6.一种多肽,其由根据实施方案1-5中任一项所述的核酸编码。7.一种修饰细胞,其用根据实施方案1-5中任一项所述的核酸转染或转导。8.一种核酸,其包含可操作地连接到以下的启动子a)编码嵌合促细胞凋亡多肽的第一多核苷酸,其中所述嵌合促细胞凋亡多肽包含(i)促细胞凋亡多肽区;(ii)frb或frb变体区;和(iii)fkbp12多肽区;和b)编码嵌合共刺激多肽的第二多核苷酸,其中所述嵌合共刺激多肽包含(i)两个fkbp12变体区;(ii)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和(iii)缺少cd40胞外结构域的cd40胞质多肽区。8.5.一种核酸,其包含可操作地连接到以下的启动子a)编码嵌合促细胞凋亡多肽的第一多核苷酸,其中所述嵌合促细胞凋亡多肽包含(i)促细胞凋亡多肽区;(ii)frb或frb变体区;和(iii)fkbp12多肽区;和b)编码嵌合共刺激多肽的第二多核苷酸,其中所述嵌合共刺激多肽包含(i)两个fkbp12变体区;和(ii)myd88多肽区或缺少tir结构域的截短的myd88多肽区。9.根据实施方案8或8.5中任一项所述的核酸,其中所述fkbp12变体区以比配体结合所述fkbp12区的亲和力高至少100倍的亲和力结合所述配体。9.1.根据实施方案8所述的核酸,其中所述fkbp12变体区以比配体结合所述fkbp12区的亲和力高至少500倍的亲和力结合所述配体。9.2.根据实施方案8所述的核酸,其中所述fkbp12变体区以比配体结合所述fkbp12区的亲和力高至少1000倍的亲和力结合所述配体。10.根据实施方案8所述的核酸,其中所述fkbp12变体区是fkbp12v36区。11.一种核酸,其包含可操作地连接到以下的启动子a)编码嵌合促细胞凋亡多肽的第一多核苷酸,其中所述嵌合促细胞凋亡多肽包含(i)促细胞凋亡多肽区;(ii)frb或frb变体区;和(iii)fkbp12多肽区;和b)编码嵌合共刺激多肽的第二多核苷酸,其中所述嵌合共刺激多肽包含(i)两个fkbp12v36区;(ii)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和(iii)缺少cd40胞外结构域的cd40胞质多肽区。12.根据实施方案8-11中任一项所述的核酸,其中区域(i)、(ii)和(iii)从所述嵌合促细胞凋亡多肽的氨基端到羧基端的顺序是(iii)、(ii)、(i)。13.根据实施方案8-11中任一项所述的核酸,其中区域(i)、(ii)和(iii)从所述嵌合促细胞凋亡多肽的氨基端到羧基端的顺序是(ii)、(iii)、(i)。14.根据实施方案8-13中任一项所述的核酸,其进一步包含在所述嵌合促细胞凋亡多肽的区域(a)、(b)和(c)之间的接头多肽。15.根据实施方案8-14中任一项所述的核酸,其中所述核酸进一步包含在所述第一多核苷酸和所述第二多核苷酸之间的编码接头多肽的多核苷酸,其中所述接头多肽在翻译期间或翻译之后隔开所述第一多核苷酸和所述第二多核苷酸的翻译产物。16.根据实施方案15所述的核酸,其中隔开所述第一多核苷酸和所述第二多核苷酸的所述翻译产物的所述接头多肽是2a多肽。17.根据实施方案8-16中任一项所述的核酸,其中所述启动子可操作地连接到所述第一多核苷酸和所述第二多核苷酸。17.1.根据实施方案8-17中任一项所述的核酸,其进一步包含编码标志物多肽的多核苷酸。18.根据实施方案1-5或8-17.1中任一项所述的核酸,其中所述启动子受发育调控。19.根据实施方案1-5或8-17.1中任一项所述的核酸,其中所述启动子是组织特异性的。20.根据实施方案1-5或8-19中任一项所述的核酸,其中所述启动子在活化的t细胞中被活化。21.根据实施方案8-20中任一项所述的核酸,其进一步包含编码嵌合抗原受体的第三多核苷酸。22.根据实施方案21所述的核酸,其中所述嵌合抗原受体包含(i)跨膜区、(ii)t细胞活化分子和(iii)抗原识别部分。23.根据实施方案8-20中任一项所述的核酸,其进一步包含编码嵌合t细胞受体的第三多核苷酸。24.根据实施方案21-23中任一项所述的核酸,其进一步包含在所述第一多核苷酸、所述第二多核苷酸和所述第三多核苷酸之间的编码接头多肽的多核苷酸,其中所述接头多肽在翻译期间或翻译之后隔开所述第一多核苷酸、所述第二多核苷酸和所述第三多核苷酸的翻译产物。25.根据实施方案24所述的核酸,其中隔开所述第一多核苷酸、所述第二多核苷酸和所述第三多核苷酸的所述翻译产物的所述接头多肽是2a多肽。26.一种修饰细胞,其用根据实施方案8-25中任一项所述的核酸转导或转染。27.一种修饰细胞,其包含a)编码嵌合促细胞凋亡多肽的第一多核苷酸,其中所述嵌合促细胞凋亡多肽包含(i)促细胞凋亡多肽区;(ii)frb或frb变体区;和(iii)fkbp12多肽区;和b)编码嵌合共刺激多肽的第二多核苷酸,其中所述嵌合共刺激多肽包含(i)两个fkbp12变体区;(ii)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和(iii)缺少cd40胞外结构域的cd40胞质多肽区。27.5.一种修饰细胞,其包含a)编码嵌合促细胞凋亡多肽的第一多核苷酸,其中所述嵌合促细胞凋亡多肽包含(i)促细胞凋亡多肽区;(ii)frb或frb变体区;和(iii)fkbp12多肽区;和b)编码嵌合共刺激多肽的第二多核苷酸,其中所述嵌合共刺激多肽包含(i)两个fkbp12变体区;和(ii)myd88多肽区或缺少tir结构域的截短的myd88多肽区。28.根据实施方案27和27.5中任一项所述的修饰细胞,其中所述fkbp12变体区以比配体结合所述fkbp12区的亲和力小至少100倍的亲和力结合所述配体。29.根据实施方案27所述的修饰细胞,其中所述fkbp12变体区以比配体结合所述fkbp12区的亲和力小至少500倍的亲和力结合所述配体。30.根据实施方案27所述的修饰细胞,其中所述fkbp12变体区以比配体结合所述fkbp12区的亲和力小至少1000倍的亲和力结合所述配体。31.根据实施方案27-30中任一项所述的修饰细胞,其中所述fkbp12变体区是fkbp12v36区。31.1.根据实施方案31所述的修饰细胞,其中所述配体是ap1903。32.一种修饰细胞,其包含a)编码嵌合促细胞凋亡多肽的第一多核苷酸,其中所述嵌合促细胞凋亡多肽包含(i)促细胞凋亡多肽区;(ii)frb或frb变体区;和(iii)fkbp12多肽区;和b)编码嵌合共刺激多肽的第二多核苷酸,其中所述嵌合共刺激多肽包含(i)两个fkbp12v36区;(ii)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和(iii)缺少cd40胞外结构域的cd40胞质多肽区。33.根据实施方案27-32中任一项所述的修饰细胞,其中区域(i)、(ii)和(iii)从所述嵌合促细胞凋亡多肽的氨基端到羧基端的顺序是(iii)、(ii)、(i)。34根据实施方案27-32中任一项所述的修饰细胞,其中区域(i)、(ii)和(iii)从所述嵌合促细胞凋亡多肽的氨基端到羧基端的顺序是(ii)、(iii)、(i)。35.根据实施方案27-34中任一项所述的修饰细胞,其进一步包含在所述嵌合促细胞凋亡多肽的区域(a)、(b)和(c)之间的接头多肽。36.根据实施方案26-35中任一项所述的修饰细胞,其中所述细胞进一步包含嵌合抗原受体。37.根据实施方案36所述的修饰细胞,其中所述嵌合抗原受体包含(i)跨膜区、(ii)t细胞活化分子和(iii)抗原识别部分。38.根据实施方案26-35中任一项所述的修饰细胞,其中所述细胞进一步包含嵌合t细胞受体。39.根据实施方案7或实施方案a27-a56所述的修饰细胞,其中所述细胞是t细胞、肿瘤浸润性淋巴细胞、nk-t细胞或nk细胞。40.根据实施方案7或实施方案a27-a56所述的修饰细胞,其中所述细胞是t细胞。41.根据实施方案7或实施方案a27-a56所述的修饰细胞,其中所述细胞是原代t细胞。42.根据实施方案7或实施方案a27-a56所述的修饰细胞,其中所述细胞是细胞毒性t细胞。43.根据实施方案7或实施方案a27-a56所述的修饰细胞,其中所述细胞选自由以下组成的组:胚胎干细胞(esc)、诱导型多能干细胞(ipsc)、非淋巴细胞造血细胞、非造血细胞、巨噬细胞、角质形成细胞、成纤维细胞、黑色素瘤细胞、肿瘤浸润性淋巴细胞、天然杀伤细胞、天然杀伤t细胞或t细胞。44.根据实施方案7或实施方案a27-a56所述的修饰细胞,其中所述t细胞是辅助t细胞。45.根据实施方案7、39-44或实施方案a27-a56中任一项所述的修饰细胞,其中从骨髓获得或制备所述细胞。46.根据实施方案7、39-44或实施方案a27-a56中任一项所述的修饰细胞,其中从脐带血获得或制备所述细胞。47.根据实施方案7、39-44或实施方案a27-a56中任一项所述的修饰细胞,其中从外周血获得或制备所述细胞。48.根据实施方案7、39-44或实施方案a27-a56中任一项所述的修饰细胞,其中从外周血单核细胞获得或制备所述细胞。49.根据实施方案7或39-48或实施方案a27-a56中任一项所述的修饰细胞,其中所述细胞是人细胞。50.根据实施方案7或39-49或实施方案a27-a56中任一项所述的修饰细胞,其中所述修饰细胞在体内被转导或转染。51.根据实施方案7、39-50或实施方案a27-a56中任一项所述的修饰细胞,其中使用选自由以下组成的组的方法通过所述核酸载体转染或转导所述细胞:电穿孔、声致穿孔(sonoporation)、基因枪法(例如,具有au-粒子的基因枪)、脂质转染、聚合物转染、纳米粒子或聚合复合物(polyplex)。52.根据实施方案26-38或实施方案a27-a56中任一项所述的修饰细胞,其中所述细胞是t细胞、肿瘤浸润性淋巴细胞、nk-t细胞或nk细胞。53.根据实施方案26-38或实施方案a27-a56中任一项所述的修饰细胞,其中所述细胞是t细胞。54.根据实施方案26-38或实施方案a27-a56中任一项所述的修饰细胞,其中所述细胞是原代t细胞。55.根据实施方案26-38或实施方案a27-a56中任一项所述的修饰细胞,其中所述细胞是细胞毒性t细胞。56.根据实施方案26-38或实施方案a27-a56中任一项所述的修饰细胞,其中所述细胞选自由以下组成的组:胚胎干细胞(esc)、诱导型多能干细胞(ipsc)、非淋巴细胞造血细胞、非造血细胞、巨噬细胞、角质形成细胞、成纤维细胞、黑色素瘤细胞、肿瘤浸润性淋巴细胞、天然杀伤细胞、天然杀伤t细胞或t细胞。57.根据实施方案26-38或实施方案a27-a56中任一项所述的修饰细胞,其中所述t细胞是辅助性t细胞。58.根据实施方案26-38或52-57或实施方案a27-a56中任一项所述的修饰细胞,其中从骨髓获得或制备所述细胞。59.根据实施方案26-38或52-57或实施方案a27-a56中任一项所述的修饰细胞,其中从脐带血获得或制备所述细胞。60.根据实施方案26-38或52-57或实施方案a27-a56中任一项所述的修饰细胞,其中从外周血获得或制备所述细胞。61.根据实施方案26-38或52-57或实施方案a27-a56中任一项所述的修饰细胞,其中从外周血单核细胞获得或制备所述细胞。62.根据实施方案26-38或52-61或实施方案a27-a56中任一项所述的修饰细胞,其中所述细胞是人细胞。63.根据实施方案26-38或52-62或实施方案a27-a56中任一项所述的修饰细胞,其中所述修饰细胞在体内被转导或转染。64.根据实施方案26-38、52-63或实施方案a27-a56中任一项所述的修饰细胞,其中使用选自由以下组成的组的方法通过所述核酸载体转染或转导所述细胞:电穿孔、声致穿孔、基因枪法(例如,具有au-粒子的基因枪)、脂质转染、聚合物转染、纳米粒子或聚合复合物。64.1.一种修饰细胞,其包含a)第一嵌合促细胞凋亡多肽,包含(i)促细胞凋亡多肽区;(ii)frb或frb变体区;和(iii)fkbp12多肽区;和b)嵌合共刺激多肽,其中所述嵌合共刺激多肽包含(i)两个fkbp12变体区;(ii)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和(iii)缺少cd40胞外结构域的cd40胞质多肽区。64.2.一种修饰细胞,其包含a)第一嵌合促细胞凋亡多肽,包含(i)促细胞凋亡多肽区;(ii)frb或frb变体区;和(iii)fkbp12多肽区;和b)嵌合共刺激多肽,其中所述嵌合共刺激多肽包含(i)两个fkbp12变体区;和(ii)myd88多肽区或缺少tir结构域的截短的myd88多肽区。64.2.根据权利要求64.1或64.2所述的修饰细胞,其包含编码第一嵌合多肽的第一多核苷酸和编码第二多肽的第二多核苷酸。64.3.一种试剂盒或组合物,其包含核酸,所述核酸包含第一多核苷酸和第二多核苷酸,其中a)所述第一多核苷酸编码嵌合促细胞凋亡多肽,其中所述嵌合促细胞凋亡多肽包含(i)促细胞凋亡多肽区;(ii)frb或frb变体区;和(iii)fkbp12多肽区;和b)所述第二多核苷酸编码嵌合共刺激多肽,其中所述嵌合共刺激多肽包含(i)两个fkbp12变体区;(ii)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和(iii)缺少cd40胞外结构域的cd40胞质多肽区。65.根据实施方案5、7或17.1-64或实施方案a1-a56中任一项所述的核酸或细胞,其中所述标志物多肽是δcd19多肽。66.根据实施方案1-9、12-31.1或33-65中任一项所述的核酸或细胞,其中所述fkbp12变体区具有在位置36处选自由缬氨酸、亮氨酸、异亮氨酸和丙氨酸组成的组的氨基酸取代。67.根据实施方案66所述的核酸或细胞,其中fkbp变体区是fkbp12v36区。68.根据实施方案1-67中任一项所述的核酸或细胞,其中所述frb变体区选自由klw(t2098l)、ktf(w2101f)和klf(t2098l、w2101f)组成的组。69.根据实施方案1-67中任一项所述的核酸或细胞,其中所述frb变体区是frbl。70.根据实施方案1-69中任一项所述的核酸或细胞,其中所述frb变体区结合选自由以下组成的组的雷帕霉素类似物:s-o,p-二甲氧基苯基(dmop)-雷帕霉素、r-异丙氧基雷帕霉素和s-丁烷磺酰氨基雷帕霉素。71.根据实施方案1-70中任一项所述的核酸或细胞,其中所述促细胞凋亡多肽选自由以下组成的组:胱天蛋白酶1、胱天蛋白酶2、胱天蛋白酶3、胱天蛋白酶4、胱天蛋白酶5、胱天蛋白酶6、胱天蛋白酶7、胱天蛋白酶8、胱天蛋白酶9、胱天蛋白酶10、胱天蛋白酶11、胱天蛋白酶12、胱天蛋白酶13或胱天蛋白酶14、fadd(ded)、apaf1(card)、cradd/raiddcard)、asc(card)、bax、bak、bcl-xl、bcl-2、ripk3和ripk1-rhim。72.根据实施方案1-71中任一项所述的核酸或细胞,其中所述促细胞凋亡多肽是胱天蛋白酶多肽。73.根据实施方案84所述的核酸或细胞,其中所述促细胞凋亡多肽是胱天蛋白酶-9多肽。74.根据实施方案73所述的细胞或核酸,其中所述胱天蛋白酶-9多肽缺少所述card结构域。75.根据实施方案73或74中任一项所述的核酸或细胞,其中所述胱天蛋白酶多肽包含seqidno:300的氨基酸序列。76.根据实施方案73或74中任一项所述的核酸或细胞,其中所述胱天蛋白酶多肽是包含选自由表5或6中的催化活性胱天蛋白酶变体组成的组的氨基酸取代的修饰的胱天蛋白酶-9多肽。77.根据实施方案76所述的核酸或细胞,其中所述胱天蛋白酶多肽是包含选自由d330a、d330e和n405q组成的组的氨基酸序列的修饰的胱天蛋白酶-9多肽。78.根据实施方案8-38或52-77中任一项所述的核酸或细胞,其中所述截短的myd88多肽具有seqidno:214的氨基酸序列或其功能片段。79.根据实施方案8-38或52-77中任一项所述的核酸或细胞,其中所述myd88多肽具有seqidno:282的氨基酸序列或其功能片段。80.根据实施方案8-38或52-77中任一项所述的核酸或细胞,其中所述胞质cd40多肽具有seqidno:216的氨基酸序列或其功能片段。81.根据实施方案23、26、38或52-64中任一项所述的核酸或细胞,其中所述t细胞受体结合选自由prame、bob-1和ny-eso-1组成的组的抗原性多肽。82.根据实施方案22、26、37或52-80中任一项所述的核酸或细胞,其中所述抗原识别部分结合选自由以下组成的组的抗原:肿瘤细胞上的抗原、参与过度增殖性疾病的细胞上的抗原、病毒抗原、细菌抗原、cd19、psca、her2/neu、psma、muc1muc1、muc1、ror1、间皮素、gd2、cd123、muc16、cd33、cd38和cd44v6。83.根据实施方案22、26、37、52-80或82中任一项所述的核酸或细胞,其中所述t细胞活化分子选自由以下组成的组:含有itam的信号1赋予分子、cd3ζ多肽和fcε受体γ(fcεr1γ)亚基多肽。84.根据实施方案22、26、37、52-80或82-83中任一项所述的核酸或细胞,其中所述抗原识别部分是单链可变片段。85.根据实施方案22、26、37、52-80或82-84中任一项所述的核酸或细胞,其中所述跨膜区是cd8跨膜区。86.根据实施方案1-5、8-25或65-85中任一项所述的核酸,其中所述核酸包含在病毒载体内。87.根据实施方案86所述的核酸,其中所述病毒载体选自由以下组成的组:逆转录病毒载体、鼠白血病病毒载体、sfg载体、腺病毒载体、慢病毒载体、腺相关病毒(aav)、疱疹病毒和牛痘病毒。88.根据实施方案1-5、8-25或65-87中任一项所述的核酸,其中所述核酸被制备或在被设计用于电穿孔、声致穿孔或基因枪法的载体中,或者被附接到化学脂质、聚合物、无机纳米粒子或聚合复合物,或掺入化学脂质、聚合物、无机纳米粒子或聚合复合物中。89.根据实施方案1-5、8-25或65-85中任一项所述的核酸,其中所述核酸包含在质粒内。90.根据实施方案1-89中任一项所述的核酸或细胞,其包含编码实施例23或25的表中所提供的多肽的多核苷酸。91.根据实施方案1-89中任一项所述的核酸或细胞,其包含编码实施例23或25的表中所提供的多肽的多核苷酸,所述多肽选自由以下组成的组:fkbpv36、fpk’、fpk、fv、fv’、fkbppk’、fkbppk”和fkbppk”’。92.根据实施方案1-89中任一项所述的核酸或细胞,其包含编码实施例23或25的表中所述提供的多肽的多核苷酸,所述多肽选自由frp5-vl、frp5-vh、fmc63-vl和fmc63-vh组成的组。93.根据实施方案1-89中任一项所述的核酸或细胞,其包含编码frp5-vl和frp5-vh的多核苷酸。94.根据实施方案1-89中任一项所述的核酸或细胞,其包含编码fmc63-vl和fmc63-vh的多核苷酸。95.根据实施方案1-89中任一项所述的核酸或细胞,其包含编码实施例23或25的表中所提供的多肽的多核苷酸,所述多肽选自由myd88l和myd88组成的组。96.根据实施方案1-89中任一项所述的核酸或细胞,其包含编码实施例23或25的表中所提供的δ胱天蛋白酶-9多肽的多核苷酸。97.根据实施方案1-89中任一项所述的核酸或细胞,其包含编码实施例23或25的表中所提供的δcd18多肽的多核苷酸。98.根据实施方案1-89中任一项所述的核酸或细胞,其包含编码实施例23或25的表中所提供的hcd40多肽的多核苷酸。99.根据实施方案1-89中任一项所述的核酸或细胞,其包含编码实施例23或25的表中所提供的cd3ζ多肽的多核苷酸。100.保留。101.一种刺激受试者中的免疫应答的方法,其包括:a)将根据实施方案a27-a56、26-38或52-85中任一项所述的修饰细胞移植到所述受试者中,和b)在(a)之后,施用有效量的结合所述嵌合共刺激多肽的所述fkbp12变体区的配体以刺激细胞介导的免疫应答。102.一种向已经历使用修饰细胞进行细胞疗法的人受试者施用配体的方法,其包括向所述人受试者施用结合嵌合共刺激多肽的fkbp变体区的配体,其中所述修饰细胞包括根据实施方案a27-a56、26-38或52-85中任一项所述的修饰细胞。103.一种控制受试者中移植的修饰细胞的活性的方法,其包括a)移植根据实施方案a27-a56、26-38或52-85中任一项所述的修饰细胞;和b)在(a)之后,施用有效量的结合所述嵌合共刺激多肽的所述fkbp12变体区的配体以刺激所述移植的修饰细胞的活性。104.一种用于治疗患有与由靶细胞表达的靶抗原表达升高相关的疾病或病况的受试者的方法,其包括(a)将有效量的修饰细胞移植到所述受试者中;其中所述修饰细胞包括根据实施方案a27-a56、26-38或52-85中任一项所述的修饰细胞,其中所述修饰细胞包含嵌合抗原受体,所述嵌合抗原受体包含结合所述靶抗原的抗原识别部分,和(b)在a)之后,施用有效量的结合所述嵌合共刺激多肽的所述fkbp12变体区的配体,以降低所述受试者中靶抗原或靶细胞的数目或浓度。105.根据实施方案104所述的方法,其中所述靶抗原是肿瘤抗原。106.一种用于治疗患有与由靶细胞表达的靶抗原表达升高相关的疾病或病况的受试者的方法,其包括(a)向所述受试者施用有效量的修饰细胞,其中所述修饰细胞包含根据实施方案a27-a56、26-38或52-85中任一项所述的修饰细胞,其中所述修饰细胞包含识别并结合所述靶抗原的嵌合t细胞受体,和(b)在a)之后,施用有效量的结合所述嵌合共刺激多肽的所述fkbp12变体区的配体,以降低所述受试者中靶抗原或靶细胞的数目或浓度。107.一种用于减小受试者中肿瘤的大小的方法,其包括a)向所述受试者施用根据实施方案a27-a56、26-38或52-85中任一项所述的修饰细胞,其中所述细胞包含嵌合抗原受体,所述嵌合抗原受体包含结合所述肿瘤上的抗原的抗原识别部分;和b)在a)之后,施用有效量的结合所述嵌合共刺激多肽的所述fkbp12变体区的配体,以减小所述受试者中所述肿瘤的大小。108.根据实施方案104-107中任一项所述的方法,其包括在施用第二配体之前测量从所述受试者获得的第一样品中靶细胞的数目或浓度,在施用所述配体之后测量从所述受试者获得的第二样品中靶细胞的数目或浓度,和确定与所述第一样品中靶细胞的数目或浓度相比,所述第二样品中靶细胞的数目或浓度的增加或减小。109.根据实施方案108所述的方法,其中与所述第一样品中靶细胞的浓度相比,所述第二样品中靶细胞的浓度降低。110.根据实施方案108所述的方法,其中与所述第一样品中靶细胞的浓度相比,所述第二样品中靶细胞的浓度增加。111.根据实施方案101-110中任一项所述的方法,其中所述受试者在施用所述修饰细胞之前或同时已接受干细胞移植。112.根据实施方案101-111中任一项所述的方法,其中向所述受试者施用至少1×106个转导或转染的修饰细胞。113.根据实施方案101-111中任一项所述的方法,其中向所述受试者施用至少1×107个转导或转染的修饰细胞。114.根据实施方案101-111中任一项所述的方法,其中向所述受试者施用至少1×108个修饰细胞。114.1.根据实施方案101-114中任一项所述的方法,其中所述fkbp12变体区是fkbp12v36,并且结合所述fkbp12变体区的所述配体是ap1903。115.一种控制受试者中移植的修饰细胞的存活的方法,其包括a)将根据实施方案a27-a56、26-38、52-64或65-85中任一项所述的修饰细胞移植到所述受试者中,和b)在(a)之后,以有效杀伤小于30%表达所述嵌合促细胞凋亡多肽的所述修饰细胞的量,向所述受试者施用结合所述促细胞凋亡多肽的所述frb或frb变体区的雷帕霉素或雷帕霉素类似物。116.根据实施方案101-114.1中任一项所述的方法,其进一步包括在(b)之后,以有效杀伤小于30%表达所述嵌合促细胞凋亡多肽的所述修饰细胞的量,向所述受试者施用结合所述促细胞凋亡多肽的所述frb变体区的雷帕霉素或雷帕霉素类似物。116.1.根据实施方案116所述的方法,其中所述雷帕霉素或雷帕霉素类似物以有效杀伤至少30%表达所述嵌合促细胞凋亡多肽的所述修饰细胞的量施用。117.根据实施方案115或116中任一项所述的方法,其中所述雷帕霉素或雷帕霉素类似物以有效杀伤小于40%表达所述嵌合促细胞凋亡多肽的修饰细胞的量施用。118.根据实施方案115或116中任一项所述的方法,其中所述雷帕霉素或雷帕霉素类似物以有效杀伤小于50%表达所述嵌合促细胞凋亡多肽的修饰细胞的量施用。119.根据实施方案115或116中任一项所述的方法,其中所述雷帕霉素或雷帕霉素类似物以有效杀伤小于60%表达所述嵌合促细胞凋亡多肽的修饰细胞的量施用。120.根据实施方案115或116中任一项所述的方法,其中所述雷帕霉素或雷帕霉素类似物以有效杀伤小于70%表达所述嵌合促细胞凋亡多肽的修饰细胞的量施用。121.根据实施方案115或116中任一项所述的方法,其中所述雷帕霉素或雷帕霉素类似物以有效杀伤小于90%表达所述嵌合促细胞凋亡多肽的修饰细胞的量施用。122.根据实施方案115或116中任一项所述的方法,其中所述雷帕霉素或雷帕霉素类似物以有效杀伤至少90%表达所述嵌合促细胞凋亡多肽的修饰细胞的量施用。123.根据实施方案115或116中任一项所述的方法,其中所述雷帕霉素或雷帕霉素类似物以有效杀伤至少95%表达所述嵌合促细胞凋亡多肽的修饰细胞的量施用。124.根据实施方案115-116中任一项所述的方法,其中所述嵌合促细胞凋亡多肽包含frbl区。125.根据实施方案101-114.1中任一项所述的方法,其中向所述受试者施用超过一剂量的所述配体。126.根据实施方案115-125中任一项所述的方法,其中向所述受试者施用超过一剂量的所述雷帕霉素或雷帕霉素类似物。127.根据实施方案101-125中任一项所述的方法,其进一步包括鉴别在所述受试者中存在或不存在需要从该受试者中去除所述修饰细胞的病况;和基于在所述受试者中鉴别的所述病况的所述存在或不存在,施用雷帕霉素或雷帕霉素类似物,维持给所述受试者的雷帕霉素或所述雷帕霉素类似物的后续剂量,或调整给所述受试者的所述雷帕霉素或雷帕霉素类似物的后续剂量。128.根据实施方案101-125中任一项所述的方法,其进一步包括接收包含在所述受试者中存在或不存在需要从该受试者中去除所述修饰细胞的病况的信息;和基于在所述受试者中鉴别的所述病况的所述存在或不存在,施用所述雷帕霉素或雷帕霉素类似物,维持给所述受试者的雷帕霉素或所述雷帕霉素类似物的后续剂量,或调整给所述受试者的雷帕霉素或雷帕霉素类似物的后续剂量。129.根据实施方案101-125中任一项所述的方法,其进一步包括在所述受试者中鉴别需要从该受试者中去除所述修饰细胞的病况的存在或不存在;和将在所述受试者中鉴别的所述病况的所述存在、不存在或分期传送给决策者,所述决策者基于在所述受试者中鉴别的所述病况的所述存在、不存在或分期,施用雷帕霉素或所述雷帕霉素类似物,维持向所述受试者施用的所述雷帕霉素或所述雷帕霉素类似物的后续剂量,或调整向所述受试者施用的所述雷帕霉素或所述雷帕霉素类似物的后续剂量。130.根据实施方案101-125中任一项所述的方法,其进一步包括鉴别在所述受试者中存在或不存在需要从该受试者中去除所述修饰细胞的病况;和传送指示,以基于在所述受试者中鉴别的所述病况的所述存在、不存在或分期,施用所述雷帕霉素或所述雷帕霉素类似物,维持向所述受试者施用的所述雷帕霉素或所述雷帕霉素类似物的后续剂量,或调整向所述受试者施用的所述雷帕霉素或所述雷帕霉素类似物的后续剂量。131.根据实施方案101-130中任一项所述的方法,其中所述受试者患有癌症。132.根据实施方案101-131中任一项所述的方法,其中将所述修饰细胞递送到肿瘤床。133.根据实施方案131或132中任一项所述的方法,其中所述癌症存在于所述受试者的血液或骨髓中。134.根据实施方案101-130中任一项所述的方法,其中所述受试者患有血液或骨髓疾病。135.根据实施方案101-130中任一项所述的方法,其中所述受试者已被诊断患有镰状细胞贫血或异染性脑白质营养不良。136.根据实施方案101-130中任一项所述的方法,其中所述患者已被诊断患有选自由以下组成的组的病况:原发性免疫缺陷疾病、噬血细胞性淋巴组织细胞增生症(hlh)或其他噬血细胞性疾病、遗传性骨髓衰竭疾病、血红蛋白病、代谢疾病和破骨细胞疾病。137.根据实施方案101-130中任一项所述的方法,其中所述患者已被诊断患有选自由以下组成的疾病或病况:严重联合免疫缺陷(scid)、联合免疫缺陷(cid)、先天性t细胞缺陷/缺乏、普通变异型免疫缺陷(cvid)、慢性肉芽肿病、ipex(免疫缺陷、多内分泌腺病、肠病、x连锁)或ipex样病、威斯科特-奥尔德里奇综合征、cd40配体缺陷、白细胞粘附缺陷、doca8缺陷、il-10缺陷/il-10受体缺陷、gata2缺陷、x连锁淋巴组织增生性疾病(xlp)、软骨毛发发育不全、舒-戴二氏综合征、戴-布二氏贫血、先天性角化不良、范科尼贫血、先天性中性粒细胞减少、镰状细胞病、地中海贫血、粘多糖贮积症、鞘脂类代谢障碍和骨硬化病。138.一种用于表达嵌合促细胞凋亡多肽的方法,其中所述嵌合促细胞凋亡多肽包含a)促细胞凋亡多肽区;b)frb或frb变体区;和c)fkbp12多肽区,包括在一定条件下使根据实施方案1-6中任一项所述的核酸与细胞接触,在所述条件下将所述核酸掺入所述细胞中,由此所述细胞从所述掺入的核酸表达所述第一嵌合多肽和所述第二嵌合多肽。139.根据实施方案138所述的方法,其中使所述核酸与所述细胞离体接触。140根据实施方案138所述的方法,其中使所述核酸与所述细胞在体内接触。141-200.保留。201.一种核酸,其包含可操作地连接到编码嵌合共刺激多肽的多核苷酸的启动子,其中所述嵌合共刺激多肽包含a)共刺激多肽区,其包含(i)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和(ii)缺少cd40胞外结构域的cd40胞质多肽区;b)frb或frb变体区;和c)fkbp12多肽区。202.根据实施方案201所述的核酸,其中区域(a)、(b)和(c)从所述嵌合共刺激多肽的氨基端到羧基端的顺序是(c)、(b)、(a)。203.根据实施方案201所述的核酸,其中区域(a)、(b)和(c)从所述嵌合共刺激多肽的氨基端到羧基端的顺序是(b)、(c)、(a)。204.根据实施方案201-203中任一项所述的核酸,其进一步包含在所述嵌合共刺激多肽的区域(a)、(b)和(c)之间的接头多肽。205.根据实施方案201-204中任一项所述的核酸,其进一步包含编码标志物多肽的多核苷酸。206.一种多肽,其由根据实施方案201-205中任一项所述的核酸编码。207.一种修饰细胞,其用根据实施方案201-205中任一项所述的核酸转染或转导。208.一种核酸,其包含可操作地连接到以下的启动子编码嵌合共刺激多肽的第一多核苷酸,所述嵌合共刺激多肽包含a)共刺激多肽区,其包含(i)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和(ii)缺少cd40胞外结构域的cd40胞质多肽区;b)frb或frb变体区;和c)fkbp12多肽区;和编码嵌合促细胞凋亡多肽的第二多核苷酸,其中所述嵌合促细胞凋亡多肽包含a)两个fkbp12变体区;和b)促细胞凋亡多肽区。208.1.一种核酸,其包含可操作地连接到以下的启动子编码嵌合共刺激多肽的第一多核苷酸,所述嵌合共刺激多肽包含a)共刺激多肽区,其包含myd88多肽区或缺少tir结构域的截短的myd88多肽区;b)frb或frb变体区;和c)fkbp12多肽区;和编码嵌合促细胞凋亡多肽的第二多核苷酸,其中所述嵌合促细胞凋亡多肽包含a)两个fkbp12变体区;和b)促细胞凋亡多肽区。209.根据实施方案208所述的核酸,其中所述fkbp12变体区以比配体结合所述fkbp12区的亲和力小至少100倍的亲和力结合所述配体。209.1.根据实施方案208所述的核酸,其中所述fkbp12变体区以比配体结合所述fkbp12区的亲和力小至少500倍的亲和力结合所述配体。209.2.根据实施方案208所述的核酸,其中所述fkbp12变体区以比配体结合所述fkbp12区的亲和力小至少1000倍的亲和力结合所述配体。210.根据实施方案208所述的核酸,其中所述fkbp12变体区是fkbp12v36区。211.一种核酸,其包含可操作地连接到以下的启动子编码嵌合共刺激多肽的第一多核苷酸,所述嵌合共刺激多肽包含a)共刺激多肽区,其包含(i)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和(ii)缺少cd40胞外结构域的cd40胞质多肽区;b)frb或frb变体区;和c)fkbp12多肽区;和编码嵌合促细胞凋亡多肽的第二多核苷酸,其中所述嵌合促细胞凋亡多肽包含a)两个fkbp12v36区;和b)促细胞凋亡多肽区。212.根据实施方案208-211中任一项所述的核酸,其中区域(a)、(b)和(c)从所述嵌合共刺激多肽的氨基端到羧基端的顺序是(c)、(b)、(a)。213.根据实施方案208-211中任一项所述的核酸,其中区域(a)、(b)和(c)从所述嵌合共刺激多肽的氨基端到羧基端的顺序是(b)、(c)、(a)。214.根据实施方案208-213中任一项所述的核酸,其进一步包含在所述嵌合共刺激多肽的区域(a)、(b)和(c)之间的接头多肽。215.根据实施方案208-214中任一项所述的核酸,其中所述核酸进一步包含在所述第一多核苷酸和所述第二多核苷酸之间的编码接头多肽的多核苷酸,其中所述接头多肽在翻译期间或翻译之后隔开所述第一多核苷酸和所述第二多核苷酸的翻译产物。216.根据实施方案215所述的核酸,其中隔开所述第一多核苷酸和所述第二多核苷酸的所述翻译产物的所述接头多肽是2a多肽。217.根据实施方案208-216中任一项所述的核酸,其中所述启动子可操作地连接到所述第一多核苷酸和所述第二多核苷酸。217.1.根据实施方案208-217中任一项所述的核酸,其进一步包含编码标志物多肽的多核苷酸。218.根据实施方案201-205或208-217.1中任一项所述的核酸,其中所述启动子受发育调控。219.根据实施方案201-205或208-217.1中任一项所述的核酸,其中所述启动子是组织特异性的。220.根据实施方案201-205或208-219中任一项所述的核酸,其中所述启动子在活化的t细胞中被活化。221.根据实施方案208-220中任一项所述的核酸,其进一步包含编码嵌合抗原受体的第三多核苷酸。222.根据实施方案21所述的核酸,其中所述嵌合抗原受体包含(i)跨膜区、(ii)t细胞活化分子和(iii)抗原识别部分。223.根据实施方案208-220中任一项所述的核酸,其进一步包含编码嵌合t细胞受体的第三多核苷酸。224.根据实施方案221-223中任一项所述的核酸,其进一步包含在所述第一多核苷酸、所述第二多核苷酸和所述第三多核苷酸之间的编码接头多肽的多核苷酸,其中所述接头多肽在翻译期间或翻译之后隔开所述第一多核苷酸和所述第二多核苷酸的翻译产物。225.根据实施方案224所述的核酸,其中隔开所述第一多核苷酸、所述第二多核苷酸和所述第三多核苷酸的所述翻译产物的所述接头多肽是2a多肽。226.一种修饰细胞,其用根据实施方案208-225中任一项所述的核酸转导或转染。227.一种修饰细胞,其包含编码嵌合共刺激多肽的第一多核苷酸,所述嵌合共刺激多肽包含a)共刺激多肽区,其包含(i)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和(ii)缺少cd40胞外结构域的cd40胞质多肽区;b)frb或frb变体区;和c)fkbp12多肽区;和编码嵌合促细胞凋亡多肽的第二多核苷酸,其中所述嵌合促细胞凋亡多肽包含a)两个fkbp12变体区;b)促细胞凋亡多肽区。228.根据实施方案227所述的修饰细胞,其中所述fkbp12变体区以比配体结合所述fkbp12区的亲和力小至少100倍的亲和力结合所述配体。229.根据实施方案227所述的修饰细胞,其中所述fkbp12变体区以比配体结合所述fkbp12区的亲和力小至少500倍的亲和力结合所述配体。230.根据实施方案227所述的修饰细胞,其中所述fkbp12变体区以比配体结合所述fkbp12区的亲和力小至少1000倍的亲和力结合所述配体。231.根据实施方案227-230中任一项所述的修饰细胞,其中所述fkbp12变体区是fkbp12v36区。231.1.根据实施方案231所述的修饰细胞,其中所述配体是ap1903。232.一种修饰细胞,其包含编码嵌合共刺激多肽的第一多核苷酸,所述嵌合共刺激多肽包含a)共刺激多肽区,其包含(i)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和(ii)缺少cd40胞外结构域的cd40胞质多肽区;b)frb或frb变体区;和c)fkbp12多肽区;和编码嵌合促细胞凋亡多肽的第二多核苷酸,其中所述嵌合促细胞凋亡多肽包含a)两个fkbp12v36区;b)促细胞凋亡多肽区。233.根据实施方案227-232中任一项所述的修饰细胞,其中区域(a)、(b)和(c)从所述嵌合共刺激多肽的氨基端到羧基端的顺序是(c)、(b)、(a)。234根据实施方案227-232中任一项所述的修饰细胞,其中区域(a)、(b)和(c)从所述嵌合共刺激多肽的氨基端到羧基端的顺序是(b)、(c)、(a)。235.根据实施方案227-235中任一项所述的修饰细胞,其进一步包含在所述嵌合共刺激多肽的区域(a)、(b)和(c)之间的接头多肽。236.根据实施方案226-234中任一项所述的修饰细胞,其中所述细胞进一步包含嵌合抗原受体。237.根据实施方案236所述的修饰细胞,其中所述嵌合抗原受体包含(i)跨膜区、(ii)t细胞活化分子和(iii)抗原识别部分。238.根据实施方案226-235中任一项所述的修饰细胞,其中所述细胞进一步包含嵌合t细胞受体。239.根据实施方案207所述的修饰细胞,其中所述细胞是t细胞、肿瘤浸润性淋巴细胞、nk-t细胞或nk细胞。240.根据实施方案207所述的修饰细胞,其中所述细胞是t细胞。241.根据实施方案207所述的修饰细胞,其中所述细胞是原代t细胞。242.根据实施方案207所述的修饰细胞,其中所述细胞是细胞毒性t细胞。243.根据实施方案207所述的修饰细胞,其中所述细胞选自由以下组成的组:胚胎干细胞(esc)、诱导型多能干细胞(ipsc)、非淋巴细胞造血细胞、非造血细胞、巨噬细胞、角质形成细胞、成纤维细胞、黑色素瘤细胞、肿瘤浸润性淋巴细胞、天然杀伤细胞、天然杀伤t细胞或t细胞。244.根据实施方案207所述的修饰细胞,其中所述t细胞是辅助t细胞。245.根据实施方案207或239-244中任一项所述的修饰细胞,其中从骨髓获得或制备所述细胞。246.根据实施方案207或239-244中任一项所述的修饰细胞,其中从脐带血获得或制备所述细胞。247.根据实施方案207或239-244中任一项所述的修饰细胞,其中从外周血获得或制备所述细胞。248.根据实施方案207或239-244中任一项所述的修饰细胞,其中从外周血单核细胞获得或制备所述细胞。249.根据实施方案207或239-248中任一项所述的修饰细胞,其中所述细胞是人细胞。250.根据实施方案207或239-249中任一项所述的修饰细胞,其中所述修饰细胞在体内被转导或转染。251.根据实施方案207或239-250中任一项所述的修饰细胞,其中使用选自由以下组成的组的方法通过所述核酸载体转染或转导所述细胞:电穿孔、声致穿孔、基因枪法(例如,具有au-粒子的基因枪)、脂质转染、聚合物转染、纳米粒子或聚合复合物。252.根据实施方案226-238中任一项所述的修饰细胞,其中所述细胞是t细胞、肿瘤浸润性淋巴细胞、nk-t细胞或nk细胞。253.根据实施方案226-238中任一项所述的修饰细胞,其中所述细胞是t细胞。254.根据实施方案226-238中任一项所述的修饰细胞,其中所述细胞是原代t细胞。255.根据实施方案226-238中任一项所述的修饰细胞,其中所述细胞是细胞毒性t细胞。256.根据实施方案226-238中任一项所述的修饰细胞,其中所述细胞选自由以下组成的组:胚胎干细胞(esc)、诱导型多能干细胞(ipsc)、非淋巴细胞造血细胞、非造血细胞、巨噬细胞、角质形成细胞、成纤维细胞、黑色素瘤细胞、肿瘤浸润性淋巴细胞、天然杀伤细胞、天然杀伤t细胞或t细胞。257.根据实施方案226-238中任一项所述的修饰细胞,其中所述t细胞是辅助t细胞。258.根据实施方案226-238或252-257中任一项所述的修饰细胞,其中从骨髓获得或制备所述细胞。259.根据实施方案226-238或252-257中任一项所述的修饰细胞,其中从脐带血获得或制备所述细胞。260.根据实施方案226-238或252-257中任一项所述的修饰细胞,其中从外周血获得或制备所述细胞。261.根据实施方案226-238或252-257中任一项所述的修饰细胞,其中从外周血单核细胞获得或制备所述细胞。262.根据实施方案226-238或252-261中任一项所述的修饰细胞,其中所述细胞是人细胞。263.根据实施方案226-238或252-262中任一项所述的修饰细胞,其中所述修饰细胞在体内被转导或转染。264.根据实施方案226-238或252-263中任一项所述的修饰细胞,其中使用选自由以下组成的组的方法通过所述核酸载体转染或转导所述细胞:电穿孔、声致穿孔、基因枪法(例如,具有au-粒子的基因枪)、脂质转染、聚合物转染、纳米粒子或聚合复合物。264.1.一种修饰细胞,其包含a)编码嵌合共刺激多肽的第一多核苷酸,所述嵌合共刺激多肽包含共刺激多肽区,其包含(i)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和(ii)缺少cd40胞外结构域的cd40胞质多肽区;frb或frb变体区;和fkbp12多肽区;和b)编码嵌合促细胞凋亡多肽的第二多核苷酸,其中所述嵌合促细胞凋亡多肽包含两个fkbp12变体区;和促细胞凋亡多肽区。264.2.根据权利要求264.1所述的修饰细胞,其包含编码第一嵌合多肽的第一多核苷酸和编码第二多肽的第二多核苷酸。264.3.一种试剂盒或组合物,其包含核酸,所述核酸包含第一多核苷酸和第二多核苷酸,其中所述第一多核苷酸编码嵌合共刺激多肽,所述嵌合共刺激多肽包含a)共刺激多肽区,其包含(i)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和(ii)缺少cd40胞外结构域的cd40胞质多肽区;b)frb或frb变体区;和c)fkbp12多肽区;和所述第二多核苷酸编码嵌合促细胞凋亡多肽,其中所述嵌合促细胞凋亡多肽包含a)两个fkbp12变体区;和b)促细胞凋亡多肽区。265.根据实施方案205、207或217.1-264中任一项所述的核酸或细胞,其中所述标志物多肽是δcd19多肽。266.根据实施方案102-109、212-231.1或233-265中任一项所述的核酸或细胞,其中所述fkbp12变体区具有在位置36处选自由缬氨酸、亮氨酸、异亮氨酸和丙氨酸组成的组的氨基酸取代。267.根据实施方案266所述的核酸或细胞,其中fkbp变体区是fkbp12v36区。268.根据实施方案201-267中任一项所述的核酸或细胞,其中所述frb变体区选自由klw(t2098l)、ktf(w2101f)和klf(t2098l、w2101f)组成的组。269.根据实施方案201-267中任一项所述的核酸或细胞,其中所述frb变体区是frbl。270.根据实施方案201-269中任一项所述的核酸或细胞,其中所述frb变体区结合选自由以下组成的组的雷帕霉素类似物:s-o,p-二甲氧基苯基(dmop)-雷帕霉素、r-异丙氧基雷帕霉素和s-丁烷磺酰氨基雷帕霉素。271.根据实施方案201-270中任一项所述的核酸或细胞,其中所述促细胞凋亡多肽选自由以下组成的组:胱天蛋白酶1、胱天蛋白酶2、胱天蛋白酶3、胱天蛋白酶4、胱天蛋白酶5、胱天蛋白酶6、胱天蛋白酶7、胱天蛋白酶8、胱天蛋白酶9、胱天蛋白酶10、胱天蛋白酶11、胱天蛋白酶12、胱天蛋白酶13或胱天蛋白酶14、fadd(ded)、apaf1(card)、cradd/raiddcard)、asc(card)、bax、bak、bcl-xl、bcl-2、ripk3和ripk1-rhim。272.根据实施方案208-271中任一项所述的核酸或细胞,其中所述促细胞凋亡多肽是胱天蛋白酶多肽。273.根据实施方案284所述的核酸或细胞,其中所述促细胞凋亡多肽是胱天蛋白酶-9多肽。274.根据实施方案273所述的细胞或核酸,其中所述胱天蛋白酶-9多肽缺少所述card结构域。275.根据实施方案273或274中任一项所述的核酸或细胞,其中所述胱天蛋白酶多肽包含seqidno:300的氨基酸序列。276.根据实施方案273或274中任一项所述的核酸或细胞,其中所述胱天蛋白酶多肽是包含选自由表5或6中的催化活性胱天蛋白酶变体组成的组的氨基酸取代的修饰的胱天蛋白酶-9多肽。277.根据实施方案276所述的核酸或细胞,其中所述胱天蛋白酶多肽是包含选自由d330a、d330e和n405q组成的组的氨基酸序列的修饰的胱天蛋白酶-9多肽。278.根据实施方案201-277中任一项所述的核酸或细胞,其中所述截短的myd88多肽具有seqidno:214的氨基酸序列或其功能片段。279.根据实施方案201-277中任一项所述的核酸或细胞,其中所述myd88多肽具有seqidno:282的氨基酸序列或其功能片段。280.根据实施方案201-277中任一项所述的核酸或细胞,其中所述胞质cd40多肽具有seqidno:216的氨基酸序列或其功能片段。281.根据实施方案223、226、38或252-280中任一项所述的核酸或细胞,其中所述t细胞受体结合选自由prame、bob-1和np-eso-1组成的组的抗原性多肽。282.根据实施方案222、226、237或252-280中任一项所述的核酸或细胞,其中所述抗原识别部分结合选自由以下组成的组的抗原:肿瘤细胞上的抗原、参与过度增殖性疾病的细胞上的抗原、病毒抗原、细菌抗原、cd19、psca、her2/neu、psma、muc1、ror1、间皮素、gd2、cd123、muc16、cd33、cd38和cd44v6。283.根据实施方案222、226、237、252-280或282中任一项所述的核酸或细胞,其中所述t细胞活化分子选自由以下组成的组:含有itam的信号1赋予分子、cd3ζ多肽和fcε受体γ(fcεr1γ)亚基多肽。284.根据实施方案222、226、237、252-280或282-283中任一项所述的核酸或细胞,其中所述抗原识别部分是单链可变片段。285.根据实施方案222、226、237、252-280或282-284中任一项所述的核酸或细胞,其中所述跨膜区是cd8跨膜区。286.根据实施方案201-205、208-225或265-285中任一项所述的核酸,其中所述核酸包含在病毒载体内。287.根据实施方案286所述的核酸,其中所述病毒载体选自由以下组成的组:逆转录病毒载体、鼠白血病病毒载体、sfg载体、腺病毒载体、慢病毒载体、腺相关病毒(aav)、疱疹病毒和牛痘病毒。288.根据实施方案201-205、208-225或265-287中任一项所述的核酸,其中所述核酸被制备或在被设计用于电穿孔、声致穿孔或基因枪法的载体中,或者被附接到化学脂质、聚合物、无机纳米粒子或聚合复合物,或掺入化学脂质、聚合物、无机纳米粒子或聚合复合物中。289.根据实施方案201-205、208-225或265-285中任一项所述的核酸,其中所述核酸包含在质粒内。290.根据实施方案201-289中任一项所述的核酸或细胞,其包含编码实施例23或25的表中所提供的多肽的多核苷酸。291.根据实施方案201-289中任一项所述的核酸或细胞,其包含编码实施例23或25的表中所提供的多肽的多核苷酸,所述多肽选自由以下组成的组:fkbpv36、fpk’、fpk、fv、fv’、fkbppk’、fkbppk”和fkbppk”’。292.根据实施方案201-289中任一项所述的核酸或细胞,其包含编码实施例23或25的表中所述提供的多肽的多核苷酸,所述多肽选自由frp5-vl、frp5-vh、fmc63-vl和fmc63-vh组成的组。293.根据实施方案201-289中任一项所述的核酸或细胞,其包含编码frp5-vl和frp5-vh的多核苷酸。294.根据实施方案201-289中任一项所述的核酸或细胞,其包含编码fmc63-vl和fmc63-vh的多核苷酸。295.根据实施方案201-289中任一项所述的核酸或细胞,其包含编码实施例23或25的表中所提供的多肽的多核苷酸,所述多肽选自由myd88l和myd88组成的组。296.根据实施方案201-289中任一项所述的核酸或细胞,其包含编码实施例23或25的表中所提供的δ胱天蛋白酶-9多肽的多核苷酸。297.根据实施方案201-289中任一项所述的核酸或细胞,其包含编码实施例23或25的表中所提供的δcd18多肽的多核苷酸。298.根据实施方案201-289中任一项所述的核酸或细胞,其包含编码实施例23或25的表中所提供的hcd40多肽的多核苷酸。299.根据实施方案201-289中任一项所述的核酸或细胞,其包含编码实施例23或25的表中所提供的cd3ζ多肽的多核苷酸。300.保留。301.一种刺激受试者中的免疫应答的方法,其包括:a)将根据实施方案226-238、252-264或265-285中任一项所述的修饰细胞移植到所述受试者中,和b)在(a)之后,施用有效量的结合所述嵌合刺激多肽的所述frb或frb变体区的雷帕霉素或雷帕霉素类似物以刺激细胞介导的免疫应答。302.一种向已经历使用修饰细胞进行细胞疗法的人受试者施用配体的方法,其包括向所述人受试者施用雷帕霉素或雷帕霉素类似物,其中所述修饰细胞包括根据实施方案226-238、252-264或265-285中任一项所述的修饰细胞。303.一种控制受试者中移植的修饰细胞的活性的方法,其包括:a)移植根据实施方案226-238或252-285中任一项所述的修饰细胞;和b)在(a)之后,施用有效量的结合所述嵌合刺激多肽的所述frb或frb变体区的雷帕霉素或雷帕霉素类似物以刺激所述移植的修饰细胞的所述活性。304.一种用于治疗患有与由靶细胞表达的靶抗原表达升高相关的疾病或病况的受试者的方法,其包括(a)将有效量的修饰细胞移植到所述受试者中;其中所述修饰细胞包括根据实施方案226-238或252-285中任一项所述的修饰细胞,其中所述修饰细胞包含嵌合抗原受体,所述嵌合抗原受体包含结合所述靶抗原的抗原识别部分,和(b)在a)之后,施用有效量的结合所述嵌合刺激多肽的所述fkb或fkb变体区的雷帕霉素或雷帕霉素类似物,以降低所述受试者中靶抗原或靶细胞的数目或浓度。305.根据实施方案304所述的方法,其中所述靶抗原是肿瘤抗原。306.一种用于治疗患有与由靶细胞表达的靶抗原表达升高相关的疾病或病况的受试者的方法,其包括(a)向所述受试者施用有效量的修饰细胞,其中所述修饰细胞包含根据实施方案226-238或252-285中任一项所述的修饰细胞,其中所述修饰细胞包含识别并结合所述靶抗原的嵌合t细胞受体,和(b)在a)之后,施用有效量的结合所述嵌合刺激多肽的所述fkb或fkb变体区的雷帕霉素或雷帕霉素类似物,以降低所述受试者中靶抗原或靶细胞的数目或浓度。307.一种用于减小受试者中肿瘤的大小的方法,其包括a)向所述受试者施用根据实施方案226-238或252-285中任一项所述的修饰细胞,其中所述细胞包含嵌合抗原受体,所述嵌合抗原受体包含结合所述肿瘤上的抗原的抗原识别部分;和b)在a)之后,施用有效量的结合所述嵌合刺激多肽的所述fkb或fkb变体区的雷帕霉素或雷帕霉素类似物,以减小所述受试者中所述肿瘤的所述大小。308.根据实施方案304-307中任一项所述的方法,其包括在施用第二配体之前测量从所述受试者获得的第一样品中靶细胞的数目或浓度,在施用所述配体之后测量从所述受试者获得的第二样品中靶细胞的数目或浓度,和确定与所述第一样品中靶细胞的数目或浓度相比,所述第二样品中靶细胞的数目或浓度的增加或减小。309.根据实施方案308所述的方法,其中与所述第一样品中靶细胞的浓度相比,所述第二样品中靶细胞的浓度降低。310.根据实施方案308所述的方法,其中与所述第一样品中靶细胞的浓度相比,所述第二样品中靶细胞的浓度增加。311.根据实施方案301-310中任一项所述的方法,其中所述受试者在施用所述修饰细胞之前或同时已接受干细胞移植。312.根据实施方案301-311中任一项所述的方法,其中向所述受试者施用至少1×106个转导或转染的修饰细胞。313.根据实施方案301-311中任一项所述的方法,其中向所述受试者施用至少1×107个转导或转染的修饰细胞。314.根据实施方案301-311中任一项所述的方法,其中向所述受试者施用至少1×108个修饰细胞。314.1.根据实施方案301-314中任一项所述的方法,其中所述fkbp12变体区是fkbp12v36,并且结合所述fkbp12变体区的所述配体是ap1903。315.一种控制受试者中移植的修饰细胞的存活的方法,其包括a)将根据实施方案226-238或252-285中任一项所述的修饰细胞移植到所述受试者中,和b)在(a)之后,以有效杀伤小于30%表达所述嵌合促细胞凋亡多肽的所述修饰细胞的量,向所述受试者施用结合所述促细胞凋亡多肽的所述fkbp12变体区的配体。316.根据实施方案301-314.1中任一项所述的方法,其进一步包括在(b)之后,以有效杀伤小于30%表达所述嵌合促细胞凋亡多肽的所述修饰细胞的量,向所述受试者施用结合所述促细胞凋亡多肽的所述fkbp12变体区的配体。317.根据实施方案315或316中任一项所述的方法,其中结合所述fkbp12变体区的配体以有效杀伤小于40%表达所述嵌合促细胞凋亡多肽的修饰细胞的量施用。318.根据实施方案315或316中任一项所述的方法,其中结合所述fkbp12变体区的配体以有效杀伤小于50%表达所述嵌合促细胞凋亡多肽的修饰细胞的量施用。319.根据实施方案315或316中任一项所述的方法,其中结合所述fkbp12变体区的配体以有效杀伤小于60%表达所述嵌合促细胞凋亡多肽的修饰细胞的量施用。320.根据实施方案315或316中任一项所述的方法,其中结合所述fkbp12变体区的配体以有效杀伤小于70%表达所述嵌合促细胞凋亡多肽的修饰细胞的量施用。321.根据实施方案315或316中任一项所述的方法,其中结合所述fkbp12变体区的配体以有效杀伤小于90%表达所述嵌合促细胞凋亡多肽的修饰细胞的量施用。322.根据实施方案315或316中任一项所述的方法,其中结合所述fkbp12变体区的所述配体以有效杀伤至少90%表达所述嵌合促细胞凋亡多肽的修饰细胞的量施用。323.根据实施方案315或316中任一项所述的方法,其中结合所述fkbp12变体区的所述配体以有效杀伤至少95%表达所述嵌合促细胞凋亡多肽的修饰细胞的量施用。324.根据实施方案315-316中任一项所述的方法,其中所述嵌合共刺激多肽包含frbl区。325.根据实施方案301-314.1中任一项所述的方法,其中向所述受试者施用超过一剂量的所述配体。326.根据实施方案315-325中任一项所述的方法,其中向所述受试者施用超过一剂量的结合所述fkbp12变体区的所述配体。327.根据实施方案301-325中任一项所述的方法,其进一步包括鉴别在所述受试者中存在或不存在需要从该受试者中去除所述修饰细胞的病况;和基于在所述受试者中鉴别的所述病况的所述存在或不存在,施用结合所述fkbp12变体区的配体,维持给所述受试者的所述配体的后续剂量,或调整给所述受试者的所述配体的后续剂量。328.根据实施方案301-325中任一项所述的方法,其进一步包括接收包含在所述受试者中存在或不存在需要从该受试者中去除所述修饰细胞的病况的信息;和基于在所述受试者中鉴别的所述病况的所述存在或不存在,施用结合所述fkbp12变体区的配体,维持给所述受试者的所述配体的后续剂量,或调整给所述受试者的所述配体的后续剂量。329.根据实施方案301-325中任一项所述的方法,其进一步包括鉴别在所述受试者中存在或不存在需要从该受试者中去除所述修饰细胞的病况;和将在所述受试者中鉴别的所述病况的所述存在、不存在或分期传送给决策者,所述决策者基于在所述受试者中鉴别的所述病况的所述存在、不存在或分期,施用结合所述fkbp12变体区的配体,维持向所述受试者施用的所述配体的后续剂量,或调整向所述受试者施用的所述配体的后续剂量。330.根据实施方案301-325中任一项所述的方法,其进一步包括鉴别在所述受试者中存在或不存在需要从该受试者中去除所述转染或转导的修饰细胞的病况;和传送指示,以基于在所述受试者中鉴别的所述病况的所述存在、不存在或分期,施用结合所述fkbp12变体区的配体,维持向所述受试者施用的所述配体的后续剂量,或调整向所述受试者施用的所述配体的后续剂量。331.根据实施方案301-330中任一项所述的方法,其中所述受试者患有癌症。332.根据实施方案301-331中任一项所述的方法,其中将所述修饰细胞递送到肿瘤床。333.根据实施方案331或332中任一项所述的方法,其中所述癌症存在于所述受试者的血液或骨髓中。334.根据实施方案301-330中任一项所述的方法,其中所述受试者患有血液或骨髓疾病。335.根据实施方案301-330中任一项所述的方法,其中所述受试者已被诊断患有镰状细胞贫血或异染性脑白质营养不良。336.根据实施方案301-330中任一项所述的方法,其中所述患者已被诊断患有选自由以下组成的组的病况:原发性免疫缺陷疾病、噬血细胞性淋巴组织细胞增生症(hlh)或其他噬血细胞性疾病、遗传性骨髓衰竭疾病、血红蛋白病、代谢疾病和破骨细胞疾病。337.根据实施方案301-330中任一项所述的方法,其中所述患者已被诊断患有选自由以下组成的疾病或病况:严重联合免疫缺陷(scid)、联合免疫缺陷(cid)、先天性t细胞缺陷/缺乏、普通变异型免疫缺陷(cvid)、慢性肉芽肿病、ipex(免疫缺陷、多内分泌腺病、肠病、x连锁)或ipex样病、威斯科特-奥尔德里奇综合征、cd40配体缺陷、白细胞粘附缺陷、doca8缺陷、il-10缺陷/il-10受体缺陷、gata2缺陷、x连锁淋巴组织增生性疾病(xlp)、软骨毛发发育不全、舒-戴二氏综合征、戴-布二氏贫血、先天性角化不良、范科尼贫血、先天性中性粒细胞减少、镰状细胞病、地中海贫血、粘多糖贮积症、鞘脂类代谢障碍和骨硬化病。338.一种用于表达嵌合共刺激多肽的方法,其中所述嵌合共刺激多肽包含a)共刺激多肽区,其包含(i)myd88多肽区或缺少tir结构域的截短的myd88多肽区;和(ii)缺少cd40胞外结构域的cd40胞质多肽区;b)frb或frb变体区;和c)fkbp12多肽区。包括在一定条件下使根据实施方案301-306中任一项所述的核酸与细胞接触,在所述条件下将所述核酸掺入所述细胞中,由此所述细胞从所述掺入的核酸表达所述第一嵌合多肽和所述第二嵌合多肽。339.根据实施方案338所述的方法,其中使所述核酸与所述细胞离体接触。340根据实施方案338所述的方法,其中使所述核酸与所述细胞在体内接触。**本文引用的每个专利、专利申请、出版物和文献的全部内容在此以引用方式并入。以上专利、专利申请、出版物和文件的引用不承认任何前述内容是相关的现有技术,它也不构成对这些出版物或文献的内容或日期的任何承认。可在不脱离所述技术的基本方面的情况下对上文进行修改。尽管已参考一个或多个具体实施方案详细描述了所述技术,但本领域普通技术人员将认识到可对本申请中具体公开的实施方案作出改变,但这些修改和改进在所述技术的范围和精神内。本文说明性地描述的技术适当地可在不存在本文未具体公开的任何要素的情况下实施。因此,例如,在本文中的每种情况下,术语“包括”、“基本上由...组成”和“由...组成”中的任一个均可用其他两个术语中的任一个替代。已采用的术语和表达被用作描述而非限制的术语,并且使用此类术语和表达并不排除所显示和描述的特征或其部分的任何等同物,并且在所要求保护的技术的范围内进行各种修改是可能的。除非上下文中明显描述一个所述要素或超过一个所述要素,否则术语“一(a或an)”可指其修饰的一个或多个要素(例如,“试剂”可意指一种或多种试剂)。如本文所用的术语“约”是指基础参数的10%内(即,加或减10%)的值,并且在值串的开头使用术语“约”修饰每个值(即,“约1、2和3”是指约1、约2和约3)。例如,“约100克”的重量可包括90克到110克的重量。此外,当本文描述值的列表(例如,约50%、60%、70%、80%、85%或86%)时,该列表包括其所有中间值和分数值(例如,54%、85.4%)。因此,应当理解,尽管已通过代表性实施方案和任选特征具体地公开了本技术,但本领域技术人员可采用本文所公开的构思的修改和变更,并且认为此类修改和变更在本技术的范围内。本技术的某些实施方案陈述在所附权利要求书中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1