miR‑223或其抑制剂在川崎病诊断及治疗产品或药物中的应用的制作方法
本发明涉及 miR-223 或其抑制剂的用途,具体涉及 miR-223 或其抑制剂在川崎病患儿的诊断及对川崎病所致血管并发症治疗及预防产品或药物中的应用。另外, miR-223 或其抑制剂可用于上述相关疾病或相关蛋白功能机理研究的工具药物。本发明还涉及包含所述 miR-223 或其反义寡核苷酸抑制剂的组合物。
背景技术:
川崎病是儿童心血管常见的疾病,是以全身血管炎为主要病变的急性发热出疹性小儿疾病。高发年龄为5岁以下婴幼儿,男多于女。未经治疗的患儿20%~25%会出现冠状动脉扩张,部分患儿形成冠脉瘤、甚至出现破裂、猝死。目前川崎病的治疗主要是输注大剂量丙种球蛋白,但丙种球蛋白球输注易导致血液粘滞度高、感染病原及输血反应等不良后果。另外,即使经过丙种球蛋白球治疗,仍有5%的病人留有长期的冠脉损害。因此,研究血管损伤机制和新的治疗靶点是血管生物学家和临床心脏病专家当前重要的任务。已知,川崎病会伴随着一系列的炎症反应,包括血细胞激活及其释放入血液循环的各种内容物。这些内容物在川崎病血管损伤中的机制仍不清楚。
MicroRNAs是一类内源性的,约 20-22 个单核苷酸组成的非编码的小核糖核酸,广泛存在于真核生物中,可直接调控超过三分之一的人类基因,从而调控各种细胞功能、生理功能及各种疾病。MicroRNAs一度被认为只存在细胞内,然而我们最近的研究表明,microRNA可游离出细胞而进入血液和尿液中。此外,由于microRNA可与细胞外的微粒体结合,所以十分稳定,不易被RNA酶所降解。这些游离的microRNA可以进入其他组织和细胞成为细胞与细胞间交流的新的信使分子。
在人类疾病的研究中发现,血液细胞中这些大量的游离的microRNAs,不仅可以用来作为人类疾病的生物标记,也可能是许多疾病的关键参与者。microRNAs在心血管系统中的研究比较广泛,然而在川崎病的研究中尚处在初级研究阶段。
MiR - 223是一种造血系细胞特定的microRNA。先前的研究已经表明,miR - 223主要表达表达于骨髓造血细胞及骨髓和血液细胞,主要存在于血小板和白细胞,红细胞中水平较低。我们之前的研究表明,血细胞分泌的miR – 223可以进入血管平滑肌细胞(VSMCs)作为内分泌遗传信号调节平滑肌细胞的功能,另外通过调节靶基因而参与了动脉粥样硬化的形成。到目前为止,mir - 223在血管内皮细胞的生物功能仍不清楚。此外,血液中miR - 223 在川崎病中的作用及川崎病所致的血管内皮细胞(EC)损害中的研究完全未知。
技术实现要素:
本发明一方面涉及miR-223在用于川崎病诊断及治疗的产品或药物中的应用。
本发明另一方面涉及miR-223抑制剂在用于川崎病诊断及治疗的产品或药物中的应用。
本发明另一方面涉及miR-223在用于非治疗目的下调胰岛素样生长因子-1受体(IGF-1R)基因从而促进内皮细胞的凋亡、抑制内皮细胞增殖中的应用。
本发明另一方面涉及miR-223抑制剂在用于非治疗目的上调胰岛素样生长因子-1受体(IGF-1R)基因从而促进内皮细胞的凋亡、抑制内皮细胞增殖中的应用。
本发明另一方面涉及miR-223在川崎病诊断及治疗效果评价中的用途miR-223。
在本发明中,所述上调或下调基因是指上调或下调细胞中miRNA或mRNA水平;其中所述上调或下调是与未进行干预的细胞进行比较。
在本发明中,所述miR-223抑制剂具有本领域公知的含义,是能够特异抑制miRNA-223的核苷酸序列,可以在细胞中特异抑制miRNA-223表达。
在本发明中,微小RNA的抑制剂(反义寡核苷酸抑制剂,anti一iR)是指化学合成及修饰的、与特异miRNA序列(特别是核心序列,例如第2一8个核昔酸)互补、特异性抑制内生miRNAs功能的单链核酸分子,通过特异的靶向单个miRNA分子,从而削弱内源miRNA对其靶基因的调控作用,影响靶基因的表达。反义寡核昔酸抑制剂可以有不同的长度和化学修饰,如磷酸骨架的硫代修饰,核糖的2’一0一烷基化修饰,包括2’一0-甲基,2’一0-甲氧乙基,2’一F等,以及肤核酸(peptide nucleicacid,PNA)、锁核酸(locked nucleic acid,LNA)等修饰。
本发明的有益效果:本发明揭示了川崎病治疗前明显升高的miR – 223在川崎病治疗后明显下降,并证实了川崎病患者血清中的miR – 223来源于骨髓,并由血细胞释放,能够进入内皮细胞,通过与内皮细胞内的靶基因IGF-1R结合,抑制IGF-1R抗凋亡作用,从而加速内皮细胞凋亡,导致冠脉损害。miR – 223抑制剂能够逆转miR – 223对其靶基因的抑制作用,从而通过抗凋亡等机制保护内皮细胞免受损伤。可以将miR – 223或其抑制剂作为药物组成成份或生物标志物,应用于川崎病的诊断及治疗。
附图说明
图1 为血清中miR-223的含量比照图,其中(A)为78名川崎病病人与103个健康对照组血清miR-223含量比较;(B)为22名川崎病病人在大剂量丙球治疗前后血清miR-223含量比较;(C)为有冠脉病变的12名川崎病患者与无冠脉病变的12名川崎病患儿血清miR-223含量比较。
图2 为血管内皮细胞中的miR-223的含量比照图,(A)无血清培养的传代内皮细胞中miR-223含量非常低,与水的含量相仿;(B)血小板源性生长因子(PDGF)刺激传代内皮细胞并没有增加miR-223含量(C)新鲜分离的小鼠内皮细胞中含有较多的miR-223;(D)正常的血管壁中也含有较多的miR-223;(E)miR-223, miR-222及miR-34a在传代内皮细胞中的定量比较;(F)miR-223, miR-222及miR-34a在新分离的内皮细胞中的定量比较;(G)miR-223, miR-222及miR-34a在正常的血管壁中的定量比较;(H)将miR – 223敲除小鼠的骨髓移植到正常(野生型)小鼠中形成的嵌合小鼠后,发现,血清、血细胞(血小板和白细胞)中的miR – 223消失了,其CT值与阴性对照组水中含量相似;(I)上述嵌合小鼠中新分离的主动脉内皮细胞中miR-223含量低至检测不出,注:n=6,*与对照比较p<0.05。
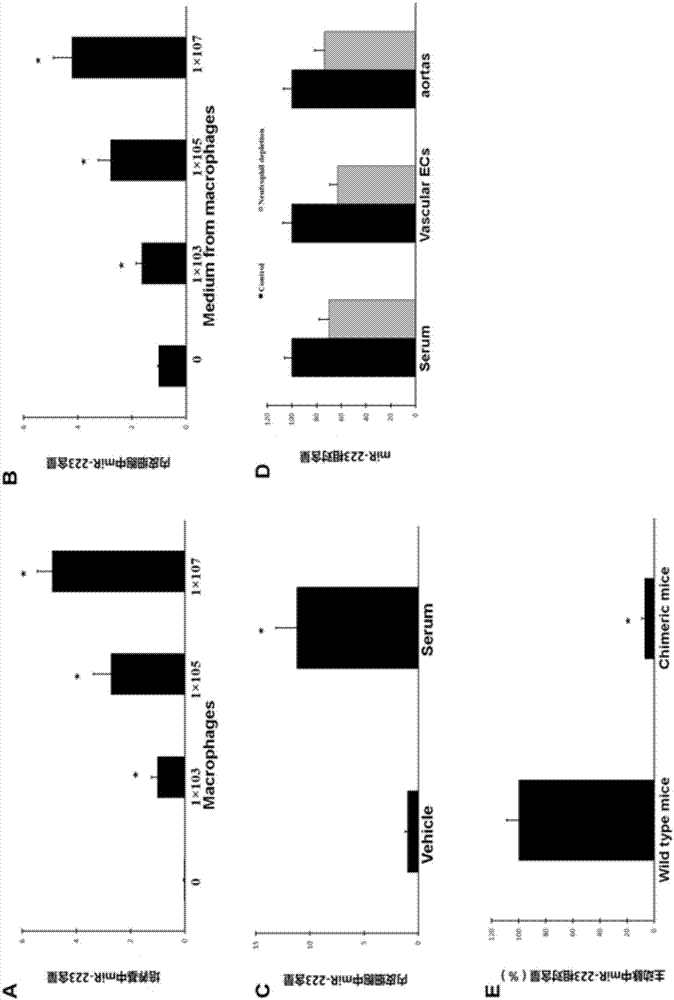
图3 为细胞外间隙、血管内皮细胞及血管壁中由血细胞分泌的miR-223的含量比照图,其中(A)培养基中的miR-223含量随着培养的THP-1巨噬细胞细胞数目的增加而增加;(B)将培养THP-1巨噬细胞的培养基培养内皮细胞,发现内皮细胞中的miR-223的含量明显增加;(C)用小鼠新鲜血清(10%浓度)培养内皮细胞,发现内皮细胞中miR-223含量明显增加;(D)通过腹腔内注射长春新碱(2.5mg/kg)清除小鼠体内的中性粒细胞;(E)通过腹腔内注射(50ul)抗血小板血清清除小鼠体内的血小板;(F)清除中性粒细胞后,血清及主动脉中miR-223含量明显降低;(G)清除血小板后,血清及中动脉中miR-223也明显降低,注:n=6,*与对照比较p<0.05。
图4 miR-223在内皮细胞中的功能比照图,其中(A)PDGF诱导内皮细胞增殖通过细胞计数法检测增殖情况,(B)MTT法检测增殖及(C)EdU法检测;(D)TUNEL法检测miR-223促进内皮细胞凋亡检测,注:n=6,*与对照比较p<0.05。
图5 川崎病血清miR-223诱导内皮细胞凋亡比照图,(A)用川崎病血清培养的人血管内皮细胞中miR-223含量明显升高;(B)miR-333抑制剂明显减轻由川崎病血清诱导的细胞凋亡;(C)各种代表性凋亡(TUNEL法)图片,注:n=6,*与对照比较p<0.05。
图6 miR-223与预测的靶基因IGF-1R结合位点图。
图7 内皮细胞中IGF-1R为miR-223的靶基因,其中(A)过表达miR-223后明显降低内皮细胞中IGF-1R蛋白水平;(B)各组代表性IGF-1R蛋白Western blots图片;(C)在内皮细胞中过表达miR-223后明显降低了IGF-1R mRNA含量;(D)miR-223基因敲除小鼠与野生型小鼠血管内皮细胞IGF-1R蛋白水平比较;(E)miR-223基因敲除小鼠与野生型小鼠血管内皮细胞IGF-1R蛋白代表性Western blot图片;(F)在miR-223基因敲除小鼠与野生型小鼠中新鲜分离的血管内皮细胞IGF-1R mRNA水平比较,注:n=6,*与对照比较p<0.05。
具体实施方式
本发明通过对川崎病患儿与正常儿童血中的microRNAs的芯片结果比较,发现在川崎病血中有10条microRNAs明显表达异常,而miR – 223是这10条中上调最明显的1条,通过qRT-PCR验证,发现,在川崎病治疗前明显升高的miR – 223在川崎病治疗后明显下降,因此有助于川崎病的临床诊断及治疗效果评价,参见图1。
本发明通过检测无血清培养的小鼠内皮细胞株发现,miR – 223在内皮细胞株中含量极低,且与细胞的生长状态无关。即使使用血小板源性生长因子(PDGF)刺激内皮细胞株生长,miR – 223含量仍然较低。然而,新分离的小鼠内皮细胞及血管壁中,却能检测到大量的miR – 223存在,说明外源的游离miR – 223能进入到血管内皮细胞中。
本发明为了进一步证实血中的miR – 223来源,我们构建了miR – 223基因敲除小鼠,通过将miR – 223敲除小鼠的骨髓移植到正常(野生型)小鼠中形成嵌合小鼠(chimeric mice)后,发现,血清、血细胞(血小板和白细胞)及新分离的内皮细胞中的miR – 223消失了,说明miR – 223主要是骨髓来源的,参见图2。
本发明为了证明骨髓来源的miR – 223主要是由血细胞分泌的,且能进入内皮细胞,我们通过体外无血清培养基培养THP-1巨噬细胞,培养12小时后收集培养基,检测miR – 223浓度,发现与单纯无血清培养基比较,miR – 223浓度明显增高。再将此收集的培养基培养内皮细胞,发现内皮细胞中miR – 223的含量明显升高,说明由THP-1巨噬细胞分泌的miR – 223能够进入内皮细胞中,参见图3。
本发明为了进一步证明小鼠内皮细胞中的miR – 223主要来源于血细胞,我们在小鼠体内注射长春新碱及兔抗鼠血小板血清,建立白细胞及血小板均删除的小鼠模型。模型建立7天后,分别检测小鼠主动脉内皮细胞及血清中miR – 223的浓度,发现两者中miR – 223的含量明显减少,由此证明,小鼠内皮细胞中的miR – 223主要来源于血细胞。参见图3。
本发明发现,外源性的miR – 223对内皮细胞有较强的生物效应。使用miR – 223 模拟物上调体外培养的内皮细胞的miR – 223含量,发现内皮细胞的增殖明显受到抑制,细胞凋亡明显增加,参见图4。
本发明使用川崎病患儿血清培养人冠状动脉内皮细胞的研究发现,内皮细胞中高表达miR – 223均为外源性的,因为细胞内无内源性miR – 223前体(pri-miR-223)存在。同时发现,内皮细胞凋亡明显增加,增殖减少,因此推测,川崎病血中miR – 223的增加,参与了川崎病冠脉内皮的损伤,是川崎病冠脉损害的机制之一,参见图5。
本发明使用川崎病血清培养的人冠脉内皮细胞,加入miR – 223抑制剂后,发现内皮细胞的凋亡明显减少,由此得出,miR – 223抑制剂可用于防治川崎病血管并发症发生的产品或药物中。参见图5。
本发明为了进一步研究miR – 223的作用机制,通过生物信息学分析发现miR – 223作用的靶基因胰岛素样生长因子-1受体(IGF-1R)的3′-UTR端存在着与miR – 223结合的位点,且这一位点在人、小鼠、大鼠之间是保守的。通过构建荧光素酶报告基因载体,证实miR – 223能够结合IGF-1R,参见图6。
本发明为了进一步研究内皮细胞中miR – 223与靶基因IGF-1R的作用关系,使用miR – 223 模拟物上调体外培养的内皮细胞的miR – 223含量后,发现内皮细胞中IGF-1R的mRNA含量及蛋白含量均明显下调,参见图7,因此可应用于下调胰岛素样生长因子-1受体(IGF-1R)基因的产品或药物中,从而促进内皮细胞的凋亡、抑制内皮细胞增殖。
本发明使用miR – 223基因敲除小鼠研究miR – 223与靶基因IGF-1R的作用关系发现,与野生型小鼠相比,miR – 223基因敲除小鼠内皮细胞的IGF-1R含量明显升高。
根据上述研究结果,表明川崎病患者血清中的miR – 223来源于骨髓,并由血细胞释放,能够进入内皮细胞,通过与内皮细胞内的靶基因IGF-1R结合,抑制IGF-1R抗凋亡作用,从而加速内皮细胞凋亡,导致冠脉损害。miR – 223抑制剂能够逆转miR – 223对其靶基因的抑制作用,从而通过抗凋亡等机制保护内皮细胞免受损伤。
下面将通过具体实施例对本发明做进一步详细描述,本领域技术人员将会理解,下列实施例仅用于说明本发明, 而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
1.方法
1)细胞分离和培养:分别从C57BL / 6小鼠、mir - 223基因敲除小鼠和骨髓移植形成的嵌合体小鼠分离的主动脉内皮细胞用10%胎牛血清的M199培养基培养。人冠状动脉内皮细胞购自American Type Culture Collection 公司(简写ATCC)。在血小板研究中, C57BL / 6老鼠血小板分离使用富含血小板血浆(PRP)和凝胶过滤方法。在白细胞研究中,使用文献的方法离如前所述分离单核细胞的方法,即将浓缩白细胞与 1640 培养基 1∶1 比例稀释,混匀。往 15 mL 离心管中加入 5 mL 人淋巴细胞分离液,将白细胞稀释液以 2∶1 比例轻轻加到分离液表面,使分界线清晰。2200 r/min 在4 ℃离心 20 min。吸出血清和分离液之间的白膜层,用 1640 培养基洗涤 3~4 次,充分吹打成单细胞悬液, 40 um 细胞筛过滤,收集滤液。1000 r/min 再离心 5 min,1640 培养基重悬,即获得外周血单个核细胞。此外,使用的人类单核细胞的细胞系THP-1细胞,购自于ATCC公司。
2)RNA分离,qRT PCR和依赖qRT PCR的绝对量化:使用TRIzol 法提取总RNA。qRT PCR的方法检测miRNAs和mRNA水平。miRNA的绝对量化是基于qRT PCR和使用一系列浓度合成成熟miRNA的标准曲线检测,分别表示为pmol / L、拷贝数/细胞、或拷贝数/ 15 pg组织RNA。
3)MiRNA表达谱芯片:人miRNA表达谱芯片使用人Taqman低密度阵列(V2.0)进行检测,操作按照操作说明进行。
4)人与小鼠miRNA-223序列均为:5’- ugucaguuugucaaauacccca-3’。
5)miRNA-223抑制剂、模拟物及阴性对照均由加拿大的Life Technologies公司合成设计合成。
6)miRNA-223抑制剂、模拟物及阴性对照的转染使用Lipofectamine RNAiMAX试剂瞬时转染至内皮细胞。
7)白细胞中miRNA-223进入内皮细胞的能力检测:培养THP-1巨噬细胞12小时后收集的培养基,先检测miRNA-223的水平,然后将这些培养基再加入小鼠内皮细胞系中继续培养12小时,检测小鼠内皮细胞中miRNA-223的含量,并与对照组比较。
8)Western blot分析:从血管及内皮细胞分离的IGF-1R蛋白使用Western blot方法进行检测。IGF-IR蛋白抗体购自Cell Signaling Technology公司(1:1000稀释),GAPDH作为内参(购自Cell Signaling Technology公司,1:2000稀释)。
9)细胞增殖及凋亡的检测:使用PDGF(20ng/ml)刺激内皮细胞增殖,然后分别使用MTT及EdU方法检测内皮细胞增殖情况。MTT法:培养的内皮细胞与MTT标记试剂中湿盒中孵育(37°C, 5% CO2)4小时,然后加入增容溶剂DMSO过夜培养(37°C, 5% CO2)。酶标仪检测580nm/680nm波长光密度值,根据光密度值推测活细胞数量。EdU法:培养的内皮细胞与EdU(50nM)孵育2小时,然后使用4%的多聚甲醛孵育30min,加入Apollo染液
100ul孵育30分钟,再加入100ul 1% Hoechst 33342进行核染。在荧光显微镜下观察细胞增殖情况。细胞凋亡检测使用TUNEL法 (试剂购自德国Roche公司),操作步骤按说明进行。
10)动物:C57BL/6及miR-223基因敲除小鼠购自于美国Jackson实验室,嵌合小鼠通过向致死剂量照射过的野生型小鼠体内移植miR-223基因敲除小鼠的骨髓而建立。通过向C57BL/6野生型小鼠腹腔内注射长春新碱建立白细胞删除的小鼠模型。所有动物实验都经过动物伦理委员会的批准使用。
11)人血清标本收集:通过温州医科大学附属第二医院、育英儿童医院伦理委员会的批准,收集103例健康体检儿童血清及78例川崎病患儿血清(其中12例存在冠脉损害,22例同时收集大剂量丙球治疗后的血清)。
SEQUENCE LISTING
<110> 温州医科大学附属第二医院、育英儿童医院
<120> miR-223或其抑制剂在川崎病诊断及治疗产品或药物中的应用
<130> 00
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 22
<212> RNA
<213> 人工序列
<400> 1
ugucaguuug ucaaauaccc ca 22
SEQUENCE LISTING
<110> 温州医科大学附属第二医院、育英儿童医院
<120> miR-223或其抑制剂在川崎病诊断及治疗产品或药物中的应用
<130> 00
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 22
<212> RNA
<213> 人工序列
<400> 1
ugucaguuug ucaaauaccc ca 22
- 还没有人留言评论。精彩留言会获得点赞!