家禽胫骨生长板软骨原代细胞分离用消化酶液及胫骨生长板软骨原代细胞的分离培养方法与流程
本发明属于细胞培养
技术领域:
,具体涉及家禽胫骨生长板软骨原代细胞分离用消化酶液及胫骨生长板软骨原代细胞的分离培养方法。
背景技术:
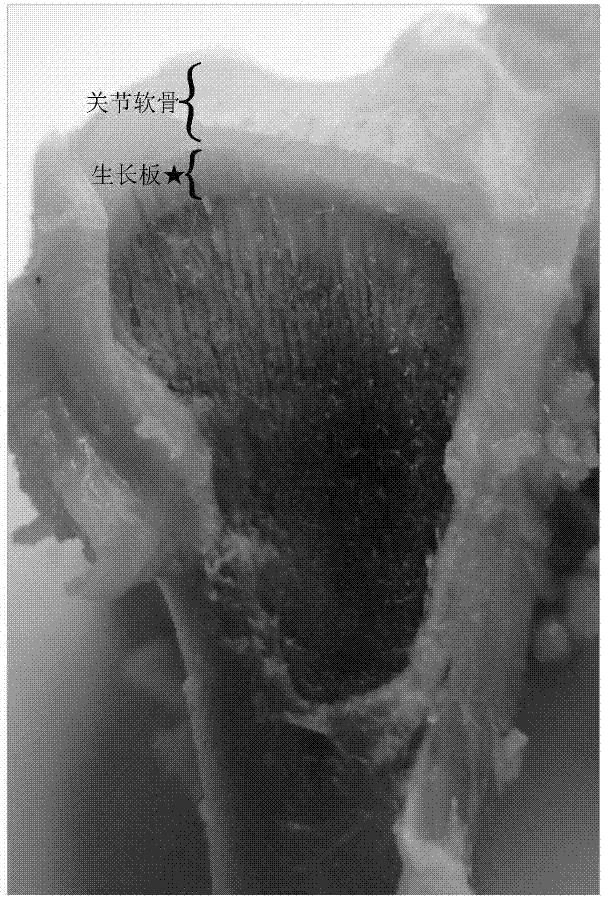
:胫骨软骨发育不良(td)是发生在禽类的一种软骨代谢性疾病,本病常发于肉鸡、蛋鸡和火鸡等禽类。临床表现为精神沉郁、食欲减退,经常匍匐于底面,运动障碍,站立困难,有时以双翅支撑行走。td可降低鸡的抗病性能和生产性能,诱发胸部囊肿和骨髓炎,降低鸡肉的品质和等级,危害动物福利,给家禽养殖领域造成重要损失。世界各国均有发生,每年给世界家禽养殖业造成巨大的经济损失。因此,对其发病机理的研究就成为家禽腿病研究的热点之一。胫骨生长板软骨是研究家禽腿病的一个研究点。软骨细胞体外培养可以排除体内诸多因素的干扰,从细胞水平上连续动态的观察生长板软骨细胞的增殖和分化,观察促生长药物的药效及作用机理是深入研究家禽胫骨软骨发育不良疾病的发病机理及其治疗的有效方法,因此胫骨生长板软骨细胞分离培养是研究家禽生长发育的重要手段。目前,对于胫骨生长板软骨细胞体外培养,存在主要技术难题是胫骨软骨生长板软骨原代细胞分离消化后细胞活力下降,并且在培养过程出现细胞大量死亡。然而造成活力下降和体外培养过程中死亡原因尚不明确,因此,现有技术中还未成功形成一套完整的分离培养方法。技术实现要素:有鉴于此,本发明的目的在于提供家禽胫骨生长板软骨原代细胞分离用消化酶液,使分离得到的胫骨生长板软骨原代细胞的活力较高;同时提供一种家禽胫骨生长板软骨原代细胞的分离培养方法,使所述方法得到的胫骨生长板软骨原代细胞不仅具有高的细胞活力,而且还具有较高的成活率。为了实现上述发明目的,本发明提供以下技术方案:本发明提供了家禽胫骨生长板软骨原代细胞分离用消化酶液,以完全培养基为基础液,含有以下组分:质量浓度为80~100mg/ml的胶原酶iv和质量浓度为80~100mg/ml的透明质酸酶;所述完全培养基是以高糖dmem-f12培养基为基本培养基,包含以下组分:体积浓度为8~12%的胎牛血清、质量浓度为4.5~5.5mg/ml维生素c和质量浓度为1~10mg/ml的青链霉素。优选的,所述胎牛血清在高糖dmem-f12培养基中的体积浓度为10%。优选的,所述维生素c在高糖dmem-f12培养基中的质量浓度为5.0mg/ml。优选的,所述青链霉素在高糖dmem-f12培养基中的质量浓度为3~8mg/ml。优选的,所述胶原酶iv在完全培养基中的质量浓度为85~95mg/ml。优选的,所述透明质酸酶在完全培养基中的质量浓度为85~95mg/ml。本发明还提供了一种家禽胫骨生长板软骨原代细胞的分离培养方法,包括以下步骤:1)将从处死30min之内的家禽中剥离的腿骨进行冲洗,75%酒精浸泡后再次冲洗,得到预处理的腿骨;2)在无菌环境下将所述步骤1)的腿骨剥离胫骨关节处肌肉,暴露出的胫骨干垢端纵切,切除表面关节软骨,暴露胫骨软骨生长板,收集胫骨生长板软骨,置于灭菌环境中;3)用冲洗液冲洗所述步骤2)得到的胫骨生长板软骨,将所述软骨破碎,冲洗后与所述的消化酶液混合进行消化,得到消化细胞;4)将所述步骤3)中的消化细胞进行增殖培养,得到胫骨生长板软骨原代细胞。优选的,所述步骤3)中消化的时间为12~14h;所述消化的温度为35℃~38℃。优选的,所述步骤3)胫骨生长板软骨的质量和消化酶液的体积比为1mg:6~10ml。所述清洗液为含有质量浓度为10~15mg/ml的青链霉素的pbs溶液;所述pbs溶液为含有7-9g/lnacl、0.40-0.44g/lkcl、1.54-1.56g/lna2hpo4.h2o、0.1-0.3g/lkh2po4的水溶液,pbs溶液的ph值为7.0~7.5。优选的,所述步骤4)增殖培养的co2浓度的4~6%;所述增殖培养的温度为35~38℃。本发明提供了家禽胫骨生长板软骨原代细胞分离用消化酶液,以完全培养基为基础液,含有以下组分:质量浓度为80~100mg/ml的胶原酶iv和质量浓度为80~100mg/ml的透明质酸酶;所述完全培养基是以高糖dmem-f12培养基为基本培养基,包含以下组分:体积浓度为8~12%的胎牛血清、质量浓度为4.5~5.5mg/ml维生素c和质量浓度为1~10mg/ml的青链霉素。本发明选择胶原酶iv、透明质酸酶和完全培养基进行搭配,胶原酶iv消化过程温和,对细胞造成的损伤较小,同时透明质酸酶通过水解组织粘多糖从而得到透明质酸,得到的透明质酸粘度较高起到保护细胞的作用;完全培养基能够为消化后的细胞提供充足的营养物质,使细胞在短时间内适应生长环境,从而保证消化后的细胞活力强、产率高的特点。本发明通过对消化酶的选择、浓度的优化,使细胞产率达到90%以上;对消化后的细胞进一步培养时,细胞涨势良好。同时消化后的原代细胞细胞活力达90%以上,且细胞活力较为稳定。附图说明图1为本发明中技术方案的流程图;图2为实施例1中关节软骨组织的图片;图3为实施例1中胫骨软骨生长板细胞;图4为实施例1中肉鸡胫骨软骨生长板细胞中扩增的ii型胶原dna电泳图。具体实施方式本发明提供了家禽胫骨生长板软骨原代细胞分离用消化酶液,以完全培养基为基础液,含有以下组分:质量浓度为80~100mg/ml的胶原酶iv和质量浓度为80~100mg/ml的透明质酸酶;所述完全培养基是以高糖dmem-f12培养基为基本培养基,包含以下组分:体积浓度为8~12%的胎牛血清、质量浓度为4.5~5.5mg/ml维生素c和质量浓度为1~10mg/ml的青链霉素。本发明中,所述胎牛血清在高糖dmem-f12培养基中的体积浓度优选为10%。所述胎牛血清的来源没有特殊限制,采用本领域技术人员所熟知的胎牛血清即可。本发明实施例中,胎牛血清购自sigma公司。所述高糖dmem-f12培养基没有特殊限制,采用本领域技术人员所熟知的高糖dmem-f12培养基即可。本发明实施例中,所述高糖dmem-f12培养基购自invitrogen公司。本发明中,所述维生素c在高糖dmem-f12培养基中的质量浓度优选为5.0mg/ml。所述维生素c的来源没有特殊限制,采用本领域技术人员所熟知的维生素c即可。本发明实施例中,维生素c购自武汉谷歌生物有限责任公司。本发明中,所述青链霉素在高糖dmem-f12培养基中的质量浓度优选为3~8mg/ml。所述青链霉素的来源没有特殊限制,采用本领域技术人员所熟知的青链霉素即可。本发明实施例中,青链霉素购自武汉谷歌生物有限责任公司。本发明中,所述胶原酶iv在完全培养基中的质量浓度优选为85~95mg/ml,更优选为90mg/ml。所述胶原酶iv的来源没有特殊限制,采用本领域技术人员所熟知的胶原酶iv即可。本发明实施例中,胶原酶iv购自武汉谷歌生物有限责任公司。本发明中,所述透明质酸酶在完全培养基中的质量浓度优选为85~95mg/ml,更优选为90mg/ml。所述透明质酸酶的来源没有特殊限制,采用本领域技术人员所熟知的透明质酸酶即可。本发明实施例中,透明质酸酶购自武汉谷歌生物有限责任公司。本发明中,所述消化酶液的制备方法,包括以下步骤:1)将高糖dmem-f12培养基、胎牛血清、维生素c和青链霉素混合,得到完全培养基;2)将所述步骤1)得到的完全培养基和胶原酶iv、透明质酸酶混合后膜过滤,得到消化酶液。本发明中,所述膜过滤用过滤膜孔径优选为0.22μm。本发明还提供了一种家禽胫骨生长板软骨原代细胞的分离培养方法,包括以下步骤:1)将从处死30min之内的家禽剥离的腿骨进行冲洗,75%酒精浸泡后再次冲洗,得到预处理的腿骨;2)在无菌环境下将所述步骤1)的腿骨剥离胫骨关节处肌肉,暴露出的胫骨干垢端纵切,切除表面关节软骨,暴露胫骨软骨生长板,收集胫骨生长板软骨,置于灭菌环境中;3)用冲洗液冲洗所述步骤2)得到的软骨,软骨将破碎,冲洗后与所述的消化酶液混合进行消化,得到消化细胞;4)将所述步骤3)中的消化细胞进行增殖培养,得到胫骨生长板软骨原代细胞。本发明将从处死30min之内的家禽中剥离的腿骨进行冲洗,75%酒精浸泡后再次冲洗,得到预处理的腿骨。本发明中,所述家禽优选健康的2周龄的家禽。所述家禽的种类优选为肉鸡、蛋鸡、火鸡等。所述处死的方法优选为颈静脉放血。所述处死30min之内的家禽优选从没有生命体征开始计。本发明中,剥离腿骨的方法没有特殊限制,采用本领域技术人员所熟知的剥离腿骨的方法即可。本发明中,所述冲洗和再次冲洗用溶液为灭菌的双蒸水。所述冲洗的次数优选为3~5次,更优选为4次。本发明中,所述酒精浸泡的时间优选为5~10min,更优选为8min。得到浸泡后的腿骨,本发明在无菌环境下将所述腿骨剥离胫骨关节处肌肉,暴露出的胫骨干垢端纵切,切除表面关节软骨,暴露胫骨软骨生长板,收集胫骨生长板软骨,置于灭菌环境中。本发明中,所述剥离胫骨关节处肌肉优选采用手术刀剔除腿骨肌肉。本发明中,所述切除的表面关节软骨的厚度优选为0.5~2mm,更优选为1.0mm。本发明中,胫骨生长板软骨的收集方法优选采用手术刀片轻轻刮取胫骨生长板软骨。分离得到胫骨生长板软骨后,本发明用冲洗液冲洗所述胫骨生长板软骨,经剪碎、冲洗液冲洗后与所述的消化酶液混合进行消化,得到胫骨生长板软骨原代细胞。本发明中,所述清洗液优选为含有质量浓度为10~15mg/ml的青链霉素的pbs溶液,更优选为含有质量浓度为12mg/ml的青链霉素的pbs溶液;所述pbs溶液优选为7~9g/lnacl、0.40-0.44g/lkcl、1.54-1.58g/lna2hpo4.h2o、0.1-0.3g/lkh2po4的水溶液更优选为8g/lnacl、0.42g/lkcl、1.56g/lna2hpo4.h2o、0.2g/lkh2po4的水溶液;所述pbs溶液的ph值优选为7.0~7.5,更优选为7.2。本发明中,所述冲洗液冲洗的次数优选为2~4次,更优选为3次。所述清洗的方法优选采用枪头吹打冲洗软骨组织。本发明中,所述破碎的方法优选剪碎。所述剪碎优选采用手术刀片进行。所述剪碎的粒度优选为180~240目,更优选为200目。剪碎后的软骨冲洗后进行消化。本发明中,所述消化时,胫骨生长板软骨的质量和消化酶液的体积比优选为1mg:6~10ml,更优选为1mg:8ml。本发明中,所述消化的时间优选为12~14h,更优选为13h;所述消化的温度优选为35~38℃,更优选为37℃。得到消化液后,本发明优选对消化液进行过滤,收集得到消化的胫骨生长板软骨原代细胞。所述过滤的孔径优选为180~220目,更优选为200目,以除去未消化完的残渣。本发明中,所述收集的方法优选采用离心方法。所述离心的转速优选为600~800r/min,更优选为700r/min。所述离心的时间优选为15~30min,更优选为20min。离心后,除去上清消化酶液,将沉淀加入pbs清洗并除去消化酶,重悬,再次离心。所述清洗优选2~3次。本发明中,所述胫骨生长板软骨原代细胞的细胞活力测定方法优选台盼蓝检测。所述台盼蓝检测的方法包括以下步骤:a、将细胞悬液与台盼蓝溶液混合,得到检测液;b、在3min内,分别计数活细胞和死细胞;c、镜下观察,死细胞被染成蓝色,而活细胞呈无色透明状;d、统计细胞活力本发明中,所述台盼蓝溶液的质量浓度为0.4%。所述细胞悬液与台盼蓝溶液体积比优选为9:1。本发明中,所述细胞活力计算公式按照式i进行:活细胞率(%)=活细胞总数/(活细胞总数+死细胞总数)×100%式i得到胫骨生长板软骨原代细胞后,本发明将所述胫骨生长板软骨原代细胞进行增殖培养,得到胫骨生长板软骨原代细胞。本发明中,所述增殖培养的co2浓度优选为4%~6%,更优选5%;所述增殖培养的温度优选为35℃~38℃,更优选为37℃。所述增殖培养用培养基为完全培养基。所述增殖培养的接种量为1%~2%。下面结合实施例对本发明提供的家禽胫骨生长板软骨原代细胞分离用消化酶液及胫骨生长板软骨原代细胞的分离培养方法进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。实施例1完全培养基配制:以高糖dmem-f12培养基为基本培养基,包含以下组分:体积浓度为8%的胎牛血清、质量浓度为5.5mg/ml维生素c和质量浓度为1mg/ml的青链霉素。消化酶液的配置:以完全培养基为基础液,包含质量浓度为100mg/ml的胶原酶iv和质量浓度为80mg/ml的透明质酸酶。采用上述完全培养基和消化酶液进行家禽胫骨生长板软骨原代细胞分离培养,具体如下步骤:(1)准备好所需的器材和试剂,并将它们置于无菌超净台中紫外线照射至少30min。(2)取健康的2周龄肉鸡3只,颈静脉放血处死,在外界剥离腿骨,用灭菌双蒸水冲洗3次,然后放置在75%酒精中浸泡5-10min。取样时注意尽量避免采样器械的污染。(3)超净台中点燃2个酒精灯。将肉鸡腿骨用无菌水冲洗2-3次,去除表面酒精;在酒精灯火焰附近将胫骨关节处肌肉剥离,暴露胫骨干垢端,干髓端胫骨纵切,切除表面关节软骨;暴露胫骨软骨生长板,用手术刀片轻轻刮取胫骨生长板软骨,置于灭菌后的玻璃培养平板中。(4)取2mlpbs冲洗液在玻璃培养平板中,用枪头吹打冲洗软骨组织,重复2-3次。然后用手术刀片将软骨组织剪碎,取pbs5ml冲洗,如此冲洗2-3次,将pbs吸净。(5)取约组织块8倍体积的消化酶液,置于青霉素小瓶中,盖好瓶盖,置于37℃培养箱中消化,每1h后取出在超净台中轻轻吹打5-10min,总共消化约12h。(6)将消化液经过200目筛过滤,除去未消化完的残渣,600r/min室温离心30min,轻轻除去上清消化酶液,加入5mlpbs清洗并除去消化酶,轻轻吹打,并600r/min室温离心30min。如此反复2次。(7)取少量培养液,混悬细胞,台盼蓝检测,具体步骤如下:1、4%台盼蓝母液:称取4g台盼蓝,加少量蒸馏水研磨,加双蒸水至100ml,用滤纸过滤。使用时用pbs稀释至0.4%。2、染色:细胞悬液与0.4%台盼蓝溶液以9:1混合混匀。(终浓度0.04%)。3、计数:在三分钟内,分别计数活细胞和死细胞。4、镜下观察,死细胞被染成蓝色,而活细胞呈无色透明状。5、统计细胞活力:活细胞率(%)=活细胞总数/(活细胞总数+死细胞总数)×100%。(8)将配好的细胞悬液在每瓶中加8ml完全培养基,置于细胞培养瓶中,放入5%co2、37℃细胞培养箱培养。(9)细胞观察与鉴定每隔24h显微镜下观察细胞形态(图3),根据细胞密度合理安排细胞换液时间。根据肉鸡胫骨软骨生长板细胞特异性蛋白ii型胶原进行rt-pcr鉴定,具体包括以下步骤:根据genebank中的ii型胶原特异性引物,采用rt-pcr扩增出相应大小的目的条带(见表1)。表1ii型胶原特异性引物信息rt-pcr实验步骤:培养的细胞总rna提取,rna反转录成cdna,pcr扩增。pcr反应程序:95℃5min,95℃45s,56℃40s,72℃40s,30循环。pcr反应结束后,将反应产物进行电泳检测,电泳结果如图4所示。从图4中可以看出,扩增的产物片段长度为接近250bp,与目的产物大小246bp相同,因此,可以确定原料细胞中能够表达ii型胶原的rna序列,说明原料细胞为肉鸡胫骨软骨生长板原代细胞。实施例2完全培养基配制:以高糖dmem-f12培养基为基本培养基,包含以下组分:体积浓度为12%的胎牛血清、质量浓度为4.5mg/ml维生素c和质量浓度为10mg/ml的青链霉素。消化酶液的配置:以完全培养基为基础液,包含质量浓度为80mg/ml的胶原酶iv和质量浓度为100mg/ml的透明质酸酶。采用上述完全培养基和消化酶液进行家禽胫骨生长板软骨原代细胞分离培养,具体如下步骤:(1)准备好所需的器材和试剂,并将它们置于无菌超净台中紫外线照射至少30min。(2)取健康的2周龄肉鸡3只,颈静脉放血处死,在外界剥离腿骨,用灭菌双蒸水冲洗3次,然后放置在75%酒精中浸泡5-10min。取样时注意尽量避免采样器械的污染。(3)超净台中点燃2个酒精灯。将肉鸡腿骨用无菌水冲洗2-3次,去除表面酒精;在酒精灯火焰附近将胫骨关节处肌肉剥离,暴露胫骨干垢端,干髓端胫骨纵切,切除表面关节软骨;暴露胫骨软骨生长板,用手术刀片轻轻刮取胫骨生长板软骨,置于灭菌后的玻璃培养平板中。(4)取2mlpbs冲洗液在玻璃培养平板中,用枪头吹打冲洗软骨组织,重复2-3次。然后用手术刀片将软骨组织剪碎,取pbs5ml冲洗,如此冲洗2-3次,将pbs吸净。(5)取约组织块8倍体积的消化酶液,置于青霉素小瓶中,盖好瓶盖,置于37℃培养箱中消化,每1h后取出在超净台中轻轻吹打5-10min,总共消化约13h。(6)将消化液经过200目筛过滤,除去未消化完的残渣,600r/min室温离心30min,轻轻除去上清消化酶液,加入5mlpbs清洗并除去消化酶,轻轻吹打,并600r/min室温离心30min。如此反复2次。(7)取少量培养液,混悬细胞,台盼蓝检测,具体步骤如下:1、4%台盼蓝母液:称取4g台盼蓝,加少量蒸馏水研磨,加双蒸水至100ml,用滤纸过滤。使用时用pbs稀释至0.4%。2、染色:细胞悬液与0.4%台盼蓝溶液以9:1混合混匀。(终浓度0.04%)。3、计数:在三分钟内,分别计数活细胞和死细胞。4、镜下观察,死细胞被染成蓝色,而活细胞呈无色透明状。5、统计细胞活力:活细胞率(%)=活细胞总数/(活细胞总数+死细胞总数)×100%。(8)将配好的细胞悬液在每瓶中加8ml完全培养基,置于细胞培养瓶中,放入5%co2、37℃细胞培养箱培养。(9)细胞观察与鉴定每隔24h显微镜下观察细胞形态,根据细胞密度合理安排细胞换液时间。根据肉鸡胫骨软骨生长板细胞表达特异性ii型胶原蛋白的基因进行rt-pcr鉴定。实施例3完全培养基配制:以高糖dmem-f12培养基为基本培养基,包含以下组分:体积浓度为10%的胎牛血清、质量浓度为5.0mg/ml维生素c和质量浓度为5mg/ml的青链霉素。消化酶液的配置:以完全培养基为基础液,包含质量浓度为90mg/ml的胶原酶iv和质量浓度为90mg/ml的透明质酸酶。采用上述完全培养基和消化酶液进行家禽胫骨生长板软骨原代细胞分离培养,具体如下步骤:(1)准备好所需的器材和试剂,并将它们置于无菌超净台中紫外线照射至少30min。(2)取健康的2周龄肉鸡3只,颈静脉放血处死,在外界剥离腿骨,用灭菌双蒸水冲洗3次,然后放置在75%酒精中浸泡5-10min。取样时注意尽量避免采样器械的污染。(3)超净台中点燃2个酒精灯。将肉鸡腿骨用无菌水冲洗2-3次,去除表面酒精;在酒精灯火焰附近将胫骨关节处肌肉剥离,暴露胫骨干垢端,干髓端胫骨纵切,切除表面关节软骨;暴露胫骨软骨生长板,用手术刀片轻轻刮取胫骨生长板软骨,置于灭菌后的玻璃培养平板中。(4)取2mlpbs冲洗液在玻璃培养平板中,用枪头吹打冲洗软骨组织,重复2-3次。然后用手术刀片将软骨组织剪碎,取pbs5ml冲洗,如此冲洗2-3次,将pbs吸净。(5)取约组织块8倍体积的消化酶液,置于青霉素小瓶中,盖好瓶盖,置于37℃培养箱中消化,每1h后取出在超净台中轻轻吹打5-10min,总共消化约14h。(6)将消化液经过200目筛过滤,除去未消化完的残渣,600r/min室温离心30min,轻轻除去上清消化酶液,加入5mlpbs清洗并除去消化酶,轻轻吹打,并600r/min室温离心30min。如此反复2次。(7)取少量培养液,混悬细胞,台盼蓝检测,具体步骤如下:1、4%台盼蓝母液:称取4g台盼蓝,加少量蒸馏水研磨,加双蒸水至100ml,用滤纸过滤。使用时用pbs稀释至0.4%。2、染色:细胞悬液与0.4%台盼蓝溶液以9:1混合混匀。(终浓度0.04%)。3、计数:在三分钟内,分别计数活细胞和死细胞。4、镜下观察,死细胞被染成蓝色,而活细胞呈无色透明状。5、统计细胞活力:活细胞率(%)=活细胞总数/(活细胞总数+死细胞总数)×100%。(8)将配好的细胞悬液在每瓶中加8ml完全培养基,置于细胞培养瓶中,放入5%co2、37℃细胞培养箱培养。(9)细胞观察与鉴定每隔24h显微镜下观察细胞形态,根据细胞密度合理安排细胞换液时间。肉鸡胫骨软骨生长板细胞表达特异性ii型胶原蛋白的基因进行rt-pcr鉴定。对比例1常规培养基配制:选择gibacol公司生产的dmem培养基为基础培养基;包含以下组分:体积浓度为4%的胎牛血清、质量浓度为10.0mg/ml维生素c和质量浓度为10mg/ml的青链霉素。消化酶液的配置:以上述配置得到的常规培养基为基础液,选择常用消化酶种类-胶原酶ii,具体为包含质量浓度90mg/ml的胶原酶ii。对比例2对照培养基配制:以高糖dmem-f12培养基为基本培养基,包含以下组分:体积浓度为4%的胎牛血清、质量浓度为10.0mg/ml维生素c和质量浓度为10mg/ml的青链霉素。消化酶液的配置:以完全培养基为基础液,包含质量浓度为90mg/ml的胶原酶iv。实施例4实施例1~3和对比例1~2制备的分离培养肉鸡胫骨软骨生长板细胞的细胞活力和细胞成活率见表1。表1不同处理方法得到胫骨软骨生长板细胞的细胞活力和细胞成活率结果实施例细胞活力(100%)细胞产率(100%)实施例192.3%93.5%实施例291.7%94.8%实施例394.1%95.0%对比例158.7%65.6%对比例267.5%68.4%由表1可以看出,采用常规培养基和消化酶的条件下消化细胞,细胞活力较低,而且消化后的细胞产率均低于70%,达不到细胞进一步培养的要求,当对消化后所得细胞进行进一步培养时,细胞会逐渐出现死亡的情况。本发明提供的消化酶液通过对消化酶的选择、浓度、消化时间的优化,使细胞产率达到90%以上;对消化后的细胞进一步培养时,细胞涨势良好。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。sequencelisting<110>西藏农牧学院<120>家禽胫骨生长板软骨原代细胞分离用消化酶液及胫骨生长板软骨原代细胞的分离培养方法<130>2017<160>2<170>patentinversion3.3<210>1<211>22<212>dna<213>人工序列<400>1gtggaagagcggagattactgg22<210>2<211>19<212>dna<213>人工序列<400>2tggatgctggcggtgttgg19当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1