一种犬肝细胞的分离与培养方法与流程
本发明属于细胞分离与培养领域,具体涉及一种犬肝细胞的分离与培养方法。
背景技术:
肝细胞分离方法、培养条件进行了大量的研究,但要获得高活率、功能好的肝细胞,至今仍较困难,尤其是犬原代肝细胞。
早期分离肝细胞的方法主要是非酶法分离肝细胞,包括机械法(如匀浆法)及螯合法。但是机械法对肝细胞损伤大,分离下来的肝细胞活率低;螯合法是用可结合ca2+、mg2+的螯合剂(如枸橼酸盐或edta)分离肝细胞,但螯合剂单独使用效果不好,常需与酶法结合使用。后期逐渐改为酶消化法分离肝细胞,包括胶原酶消化法、胰蛋白酶消化法等。根据结果显示,一步灌流结合组织块消化法获得的肝细胞形态完整性较差,大部分细胞不贴壁,活性差,功能不强,ldh漏出液、白蛋白分泌和尿素合成呈现不规律变化,无法模拟体内代谢情况。
技术实现要素:
为了解决上述问题,本发明的目的是提供一种犬肝细胞的分离与培养方法,获得的肝细胞几乎为纯的肝实质细胞,不仅数量多,肝细胞形态完整,贴壁良好,活性高,而且保留了肝细胞的各种功能。
本发明提供了如下的技术方案:
一种犬肝细胞的分离与培养方法,包括如下步骤:
s1,取肝,取新鲜的肝脏用灌流液a浸泡冲洗;
s2,灌流,向冲洗后的肝脏灌注37℃预热的灌流液a15-20min,流速为50ml/min,然后继续以50ml/min的流速灌注37℃预热的灌流液b3-5min,接着以20ml/min流速灌注37℃预热的灌流液c4-6min,最后将含有三抗的4℃预冷的基础培养基浇在肝脏表面上,所述三抗与基础培养基的体积比为1:99;
s3,肝细胞分离,在无菌环境下剔除血管、脂肪和结缔组织,撕掉肝脏表面包膜,将肝脏剪碎,将剪碎的肝脏放入4℃预冷的基础培养基溶液中,然后依次使用60目、80目的细胞筛过滤一遍,并使用4℃预冷的基础培养基冲洗,滤出多余组织,接着依次使用200目、300目的细胞筛分别过滤两遍,最后将收取的肝细胞悬液倒入离心管中,加入肝细胞悬浮液重量2%的红细胞裂解液,离心分离获得肝细胞,离心条件为1000-3500r/min,5-10min;
s4,肝细胞培养,将获得肝细胞放入经酒精消毒的细胞计数板上,使用rpmi1640贴壁培养基接板,接板完毕后,放入37℃,co2体积浓度为5%的培养箱中培养4h,在无菌条件下将细胞计数板内的rpmi1640贴壁培养基取出,向细胞计数板内加满rpmi1640生长培养基进行培养。
优选的,所述s2中灌流液a的配方为每1000ml蒸馏水中溶解8.1816gnacl、0.4995gkcl、2.3831ghepes、0.4500g葡萄糖、0.1861gedtana2,调节ph至7.2,灌流液b的配方为每1000ml蒸馏水中溶解8.1816gnacl、0.4995gkcl、6.8493ghepes、0.4500g葡萄糖、0.5550gcacl2,调节ph至7.2,灌流液c的配方为每500ml灌流液b中溶解0.1gⅳ型胶原酶。
优选的,所述s2中三抗的配方为每毫升三抗母液含青霉素、链霉素和两性霉素b分别为1万u、1万ug和250ug。
优选的,所述s4中rpmi1640贴壁培养基的配方为每250mlrpmi1640基础培养基中加入25ml胎牛血清、2.5ml三抗、4.59*10-4μmol胰岛素、4*10-5μmol地塞米松、0.16μg维生素c;所述rpmi1640生长培养基的配方为每250mlrpmi1640基础培养基中加入25ml胎牛血清和2.5ml三抗。
本发明的有益效果是:利用原代肝细胞进行体外实验,与其他体外及体内实验方法相比,有自身显著的优点。肝细胞是分化程度很高的细胞,一旦失去体内生存环境,则很快失去分化再生的能力,一些生化功能也很快丧失。犬原代肝细胞经过两步胶原酶灌流消化法后,模拟体内环境,探究分离的肝细胞活性最佳时期,并对肝细胞培养过程中的代谢情况进行检测;
使用两步胶原酶灌流法,这是目前国际上流行的肝细胞分离方法。先从门静脉用无钙、含edta的灌流液灌注,冲出血细胞;再用含钙和edta的灌流液冲出灌流液a,再换含四型胶原酶的灌流液灌注肝脏,除去残留edta的干扰,有利于激活胶原酶额活性,是肝组织软化分散,至肝细胞解离,肝脏表面明显的颗粒状为止,停止蛋白酶作用。经过细胞筛的多次过滤后,除去脉管组织和未充分消化的肝脏组织碎块。反复3次洗涤离心,除去非实质细胞和细胞碎片,即可产生大量的活性较高的肝细胞;
此法分离获得的肝细胞几乎为纯的肝实质细胞,不仅数量多,肝细胞形态完整,贴壁良好,活性高,而且保留了肝细胞的各种功能。
附图说明
图1是不同培养时间肝细胞形态变化图;
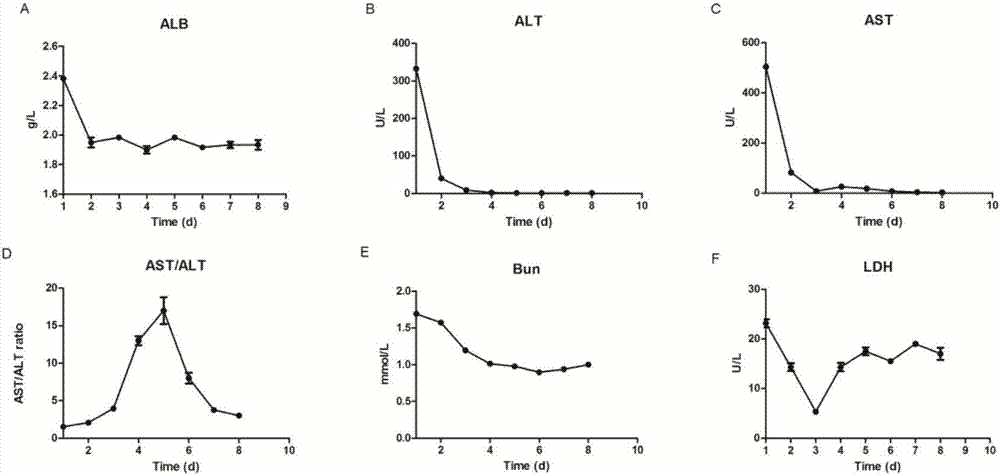
图2是肝细胞上清液各项指标变化图。
具体实施方式
下面结合具体实施例,对本发明进行详细的叙述。
将取出的肝脏用灌流液a浸泡冲洗后,灌注37℃预热的灌流液a15min,流速为50ml/min,然后继续以50ml/min的流速灌注37℃预热的灌流液b3-5min,接着以20ml/min流速灌注37℃预热的灌流液c4-6min,最后将含有三抗4℃预冷的基础培养基浇在肝脏表面上,三抗和基础培养基的体积比为1:99;其中灌流液a的配方为每1000ml蒸馏水中溶解8.1816gnacl、0.4995gkcl、2.3831ghepes、0.4500g葡萄糖、0.1861gedtana2,调节ph至7.2,灌流液b的配方为每1000ml蒸馏水中溶解8.1816gnacl、0.4995gkcl、6.8493ghepes、0.4500g葡萄糖、0.5550gcacl2,调节ph至7.2,灌流液c的配方为每500ml灌流液b中溶解0.1gⅳ型胶原酶,三抗的配方为每毫升三抗母液含青霉素、链霉素和两性霉素b分别为1万u、1万ug和250ug;在无菌环境下剔除血管、脂肪和结缔组织,撕掉肝脏表面包膜,将肝脏剪碎,将剪碎的肝脏放入4℃预冷的基础培养基溶液中,然后依次使用60目、80目的细胞筛过滤一遍,并使用4℃预冷的基础培养基冲洗,滤出多余组织,接着依次使用200目、300目的细胞筛分别过滤两遍,最后将收取的肝细胞悬液倒入离心管中,加入肝细胞悬浮液重量2%的红细胞裂解液,离心分离获得肝细胞,离心条件为1000-3500r/min,5-10min;将获得肝细胞放入经酒精消毒的细胞计数板上,使用rpmi1640贴壁培养基接板,接板完毕后,放入37℃,co2浓度为5%的培养箱中培养4h,在无菌条件下将细胞计数板内的rpmi1640贴壁培养基取出,向细胞计数板内加满rpmi1640生长培养基进行培养,其中rpmi1640贴壁培养基的配方为每250mlrpmi1640基础培养基中加入25ml胎牛血清、2.5ml三抗、4.59*10-4μmol胰岛素、4*10-5μmol地塞米松、0.16μg维生素c;所述rpmi1640生长培养基的配方为每250mlrpmi1640基础培养基中加入25ml胎牛血清和2.5ml三抗。
结果检测
通过倒置显微镜观察的到图1;
图1a是犬肝细胞刚分离完成后,在倒置显微镜下观察,两步胶原酶灌流分离的肝细胞呈现分散状态,呈圆球形,细胞核位于细胞中央;
图1b是4h后,细胞贴壁生长,细胞体开始变平,细胞核隐约可见,细胞开始伸张生长,形态多为椭圆形,活力差的细胞悬浮于细胞培养基中,换液可除去;
图1c是24h后,大部分肝细胞贴壁生长,细胞形态多为椭圆形和多边形,呈扁平状;
图1d是48h后,细胞体积增大,且细胞形态较稳定,细胞核清晰可见;
图1e是72h后,细胞贴壁牢固出现链接状,排列紧密,成片生长,细胞间界限清晰,形成胆小管结构;
图1f、g、h、i、j是96h后,细胞的活性逐渐降低,细胞出现部分破裂,肝细胞呈明显颗粒化,有空泡形成,细胞边缘不清晰,部分肝细胞核消失,细胞间隙拉大,肝细胞逐渐脱壁。
采用全自动生化分析仪检测不同时间的培养上清液得到图2、从图2中可知,上清液中白蛋白(alb)、乳酸脱氢酶(ldh)、尿素(bun)、谷丙转氨酶(alt)、谷草转氨酶(ast)等指标的变化,在一周内呈现较明显的规律性变化,ldh漏出液第一天指标最高,第3天和第4天时降低到最低,而后逐渐升高。
白蛋白分泌和尿素合成功能正常,第一天最高,第3-4天降到最低值,随着培养时间的延长有升高且稳定的状态,表明两步胶原酶灌流法分离的肝细胞活性在第3-4天功能最佳。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!