一种高尿酸血症肝细胞模型及其构建方法与流程
本发明属于细胞模型的构建技术领域,具体涉及一种高尿酸血症肝细胞(LO2)模型及其构建方法。
背景技术:
尿酸是内源性嘌呤和饮食中嘌呤的代谢产物。在人体嘌呤代谢过程中,ATP等经过一系列反应,生成次黄嘌呤和黄嘌呤,在黄嘌呤氧化酶的作用下生成尿酸。当嘌呤代谢紊乱时,人体内尿酸含量会升高,一般认为血尿酸盐水平≥417 μmol/L时,会诱发高尿酸血症。近年来,高尿酸血症发病率逐年上升,发病年龄呈低龄化,同时高尿酸血症与高血压、高血脂、糖尿病等密切相关,所以高尿酸血症发病机制及抗痛风药物的研究正成为医药界热点。
目前临床上常用的治疗痛风的药物根据其作用机制可分为抑制尿酸生成的药物和促进尿酸排泄的药物。抑制尿酸生成的药物(如别嘌呤醇)大多是通过抑制黄嘌呤氧化酶的活性来抑制次黄嘌呤和黄嘌呤转化为尿酸,从而减少尿酸的生成。促进尿酸排泄的药物常见的有丙磺舒和苯溴马隆。这些药物虽然能有效降低人体内尿酸含量,但是对人的毒副作用也较大,对肝肾有一定的损伤,在一定程度上限制了这些药物的临床应用。因此,临床上迫切需要新型的高效低毒且适用性更广的降尿酸药物,而构建高尿酸血症模型是研究高尿酸血症的前提。目前国内外均采用高尿酸血症动物模型来筛选降尿酸药物及研究其作用机制。
专利申请公开号为CN1698906的专利公开了“大鼠急性或持续性高尿酸血症模型的复制方法”,公开日期为2005-11-23,申请人为南京中医药大学。该方法是将SD、Wistar健康大鼠用灌胃、皮下注射和腹腔注射的方式,同时给予100-2000 mg/kg嘌呤类(次黄嘌呤、黄嘌呤)和5-1000 mg/kg尿酸酶抑制剂(氧嗪酸钾),每隔5-24 h,用同样方式和药物用量对大鼠用药,持续一周至两周,可获得稳定的急性或持续性大鼠高尿酸血症模型。
专利申请公开号为CN1698907的专利公开了“小鼠急性高尿酸血症模型的复制方法”,公开日期为2005-11-23,申请人为南京中医药大学。该专利是将昆明种、ICR健康小鼠用灌胃、皮下注射或腹腔注射的方式,对小鼠给予次黄嘌呤或黄嘌呤100-1500 mg/kg和尿酸酶抑制剂氧嗪酸钾10-1500 mg/kg,实验证明使用尿酸酶抑制剂配合嘌呤类,1小时即可获得稳定的小鼠高尿酸血症模型。
专利申请公开号为CN103977007A的专利公开了“急性高尿酸血症树鼩模型的构建方法”,公开日期为2014-08-13,申请人为中国医学科学院医学生物学研究所。该专利是将1-3岁的成年健康树鼩腹腔注射氧嗪酸钾混悬液,用量按树鼩体重为40 mg/kg-100 mg/kg,可得到急性高尿酸血症树鼩模型。
专利申请公开号为CN104388467A的专利公开了“一种构建自发性高尿酸血症模型的方法及其用途”,公开日期为2015-03-04,申请人为李长贵。该专利是利用类转录激活因子效应物核酸酶敲除基因敲除目的小鼠的尿酸氧化酶基因即得到自发性高尿酸血症小鼠模型,小鼠存活时间长,利于对该类小鼠进行长期实验。
专利申请公开号为103860562A的专利公开了“一种建立高尿酸血症动物模型的药物组合物及其应用”,公开日期为2014-06-18,申请人为曾文等。该专利采用乙胺丁醇和尿酸造模,造模动物为恒河猴,造模时间短,模型稳定,成功率高,可获得稳定、可靠的急性高尿酸血症模型。
综上所述,目前关于高尿酸血症的研究多以动物模型为基础,通过注射嘌呤类、尿酸酶抑制剂等方法构建高尿酸血症模型。但是现存的动物模型也有许多不完善的地方,如操作复杂,实验周期长,给痛风研究带来了极大的不便,并且常用的造模动物如小鼠、大鼠等虽与人类同属哺乳动物,但分类地位相差较远,属于低等啮齿类动物,解剖和生理与人相差较远,其动物模型得到的数据参考性也有一定的局限性。
肝脏是嘌呤代谢生成尿酸的主要场所,选择肝细胞(LO2)为造模细胞,构建高尿酸血症细胞模型,可用于降尿酸药物的快速筛选,相对于动物模型操作较简单,耗时较短,效率高。
在本申请提出之前,尚未见有利用肝细胞建立高尿酸血症模型的报道。
技术实现要素:
鉴于现在对快速筛选降尿酸药物的高尿酸血症模型开发的需求,本发明以肝细胞为造模细胞,提供了一种高尿酸血症肝细胞模型及其构建方法。
一种高尿酸血症肝细胞模型的构建方法,包括如下步骤:
(1)选取处于对数生长期的肝细胞(LO2),经消化后,制成细胞悬液,血球计数板计数后,将细胞悬液稀释,混匀,加入孔板中,置于细胞培养箱中培养;
(2)铺板12-24 h后,取出孔板,弃去细胞上清液,清洗,加入诱导物腺苷,置于细胞培养箱中继续培养12-24 h;
(3)从细胞培养箱中取出孔板,加入黄嘌呤氧化酶,置于细胞培养箱中继续孵育12-24 h,即得到高尿酸血症肝细胞模型;采用反向高效液相测定尿酸的含量。
进一步地,步骤(1)中所述消化采用胰蛋白酶进行消化;采用吸管吹打瓶壁细胞,制成细胞悬液。
进一步地,步骤(1)中,细胞悬液稀释后,细胞的浓度为104-106个/mL,优选为106个/mL。
进一步地,步骤(2)中所述清洗指采用聚丁二酸丁二醇酯(PBS)清洗2-3次。
进一步地,步骤(2)中所述腺苷的用量为0.5-2 mmol/L,优选为1.5 mmol/L;腺苷以腺苷溶液的形式加入,腺苷溶液是以不含胎牛血清的基础培养基为溶剂配制而成,现配现用,使用时混匀。
进一步地,步骤(3)中,加入黄嘌呤氧化酶为每孔加入0.2-0.4 IU黄嘌呤氧化酶,优选为每孔加入0.3 IU黄嘌呤氧化酶。
由上述任一项所述制备方法制得的高尿酸血症肝细胞模型。
与现有技术相比,本发明具有以下优点和有益效果:
(1)本发明首次利用肝细胞(LO2)建立了高尿酸血症细胞模型,操作简单,有效、简便、灵敏、重复性好、耗时较短。
(2)通过建立高尿酸血症细胞模型,可用于筛选和研制降尿酸药物,对评价相关抗高尿酸药物对该病的药效及作用机理具有十分重要的意义。
附图说明
图1为尿酸代谢途径示意图;
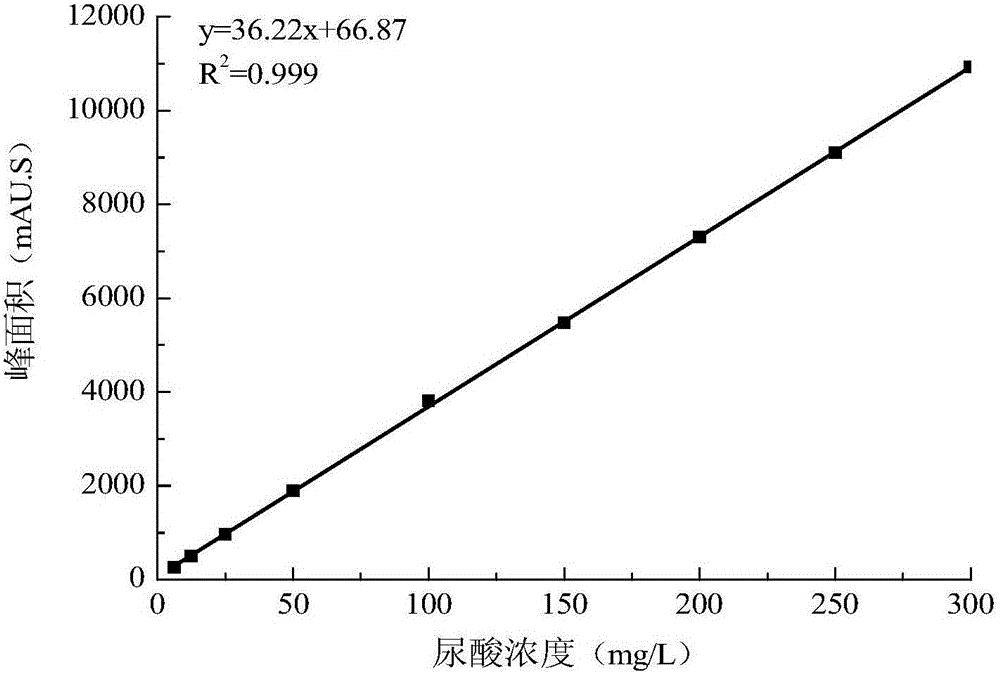
图2为尿酸标曲;
图3为实施例1中空白对照组和模型组细胞液高效液相图;
图4为不同实施例的模型组细胞上清液中尿酸浓度示意图;
图5为实施6中空白对照组、模型组及阳性对照组细胞上清液中尿酸的浓度示意图。
具体实施方式
下面结合实施方式及附图对本发明做进一步的详细说明。
下述实施方式中所使用的实验方法,如无特殊说明,均为常规方法。
下述方式中所使用的材料试剂等,如无特殊说明,均为商业途径得到。
1.实验细胞:肝细胞LO2,来自广中医药大学
2.造模药物:腺苷,购自广州硕恒生物科技有限公司
3.实验仪器:高效液相色谱,购自日本岛津公司
肝细胞LO2用DMEM培养基进行培养,并加入10 wt%的胎牛血清,1 wt%双抗,放入37 °C、5%(V/V) CO2培养箱中静置培养。
图1为尿酸代谢途径,从图1可知腺苷可在腺苷脱氨酶和嘌呤核苷磷酸化酶的作用下生成次黄嘌呤核苷和次黄嘌呤,接着在黄嘌呤氧化酶的作用下生成黄嘌呤和尿酸。
图2为尿酸标曲,尿酸生成量可根据图2尿酸标曲进行定量。
实施例1
一种高尿酸血症肝细胞模型的构建:本实验设为空白对照组和模型组。
模型组:(1)取对数生长期的肝细胞,经胰蛋白酶消化后,吸管吹打制成细胞悬液,血球计数板计数后,通过稀释将细胞浓度调整为104个/mL,混匀,接种于24孔板中,置于37 °C、5%(V/V)CO2细胞培养箱中培养;
(2)12 h后,取出24孔板,弃去细胞上清液,PBS清洗2次,加入现配的以不含胎牛血清的基础培养基为溶剂配制而成的腺苷溶液,腺苷的用量为0.5 mmol/L,置于细胞培养箱中继续孵育12 h;
(3)取出24孔板,每孔加入0.2 IU黄嘌呤氧化酶,置于细胞培养箱中继续孵育12 h后,即得到高尿酸血症肝细胞模型。
空白对照组:加入培养基,不加腺苷溶液,其余与模型组一样。
取出细胞上清液,高效液相分析其尿酸含量,高效液相图和尿酸含量图分别如图3和图4所示。
从图3可知空白对照组未生成尿酸,模型组有尿酸生成,进一步验证了图1中腺苷可经过一系列酶的作用最终生成尿酸。
实施例2
一种高尿酸血症细胞模型的构建:
(1)将对数生长期的肝细胞经胰酶消化,吸管吹打制成细胞悬液,血球计数板计数后,将细胞密度稀释为105个/mL,混匀,接种于24孔板中,置于37 °C、5%(V/V)CO2细胞培养箱中培养;
(2)12 h后,取出24孔板,弃去细胞上清液,PBS清洗3次后,加入现配的以不含胎牛血清的基础培养基为溶剂配制而成的腺苷溶液,腺苷的用量为1 mmol/L,置于细胞培养箱中继续孵育18 h;
(3)取出24孔板,每孔加入0.2 IU黄嘌呤氧化酶,置于细胞培养箱中继续孵育12 h后,即得到高尿酸血症肝细胞模型。
取出细胞上清液,高效液相分析其尿酸含量,结果如图4所示。
实施例3
一种高尿酸血症细胞模型的构建:
(1)将对数生长期的肝细胞经胰酶消化,吸管吹打制成细胞悬液,血球计数板计数后,将细胞密度稀释为105个/mL,混匀,接种于24孔板中,置于37 °C、5%(V/V)CO2细胞培养箱中培养;
(2)12 h后,弃去细胞上清液,PBS清洗2次后,加入现配的以不含胎牛血清的基础培养基为溶剂配制而成的腺苷溶液,腺苷的用量为1 mmol/L,置于细胞培养箱中继续孵育24 h;
(3)取出24板孔,每孔加入0.3 IU黄嘌呤氧化酶,置于细胞培养箱中继续孵育18 h后,即得到高尿酸血症肝细胞模型。
取出细胞上清液,高效液相分析其尿酸含量,结果如图4所示。
实施例4
一种高尿酸血症细胞模型的构建:
(1)将对数生长期的肝细胞经胰酶消化,吸管吹打制成细胞悬液,血球计数板计数后,将细胞密度稀释为106个/mL,混匀,接种于24孔板中,置于37 °C、5%(V/V)CO2细胞培养箱中培养;
(2)18 h后,弃去细胞上清液,PBS清洗3次后,加入现配的以不含胎牛血清的基础培养基为溶剂配制而成的腺苷溶液,腺苷的用量为1.5 mmol/L,置于细胞培养箱中继续孵育24 h;
(3)取出24板孔,每孔加入0.3 IU黄嘌呤氧化酶,置于细胞培养箱中继续孵育24 h后,即得到高尿酸血症肝细胞模型。
取出细胞上清液,高效液相分析其尿酸含量,结果如图4所示。
实施例5
一种高尿酸血症细胞模型的构建:
(1)将对数生长期的肝细胞经胰酶消化,吸管吹打制成细胞悬液,血球计数板计数后,将细胞密度稀释为106个/mL,混匀,接种于24孔板中,置于37 °C、5%(V/V)CO2细胞培养箱中培养;
(2)24 h后,取出24板孔,弃去细胞上清液,PBS清洗3次后,加入现配的以不含胎牛血清的基础培养基为溶剂配制而成的腺苷溶液,腺苷的用量为2 mmol/L,置于细胞培养箱中继续孵育24 h;
(3)取出24板孔,每孔加入0.4 IU黄嘌呤氧化酶,置于细胞培养箱中继续孵育24 h后,即得到高尿酸血症肝细胞模型。
取出细胞上清液,高效液相分析其尿酸含量,结果如图4所示。
由图4可知,模型组均产生尿酸。由实施例1和实施例2可知,随着细胞铺板密度和诱导物腺苷孵育时间的延长,尿酸生成量显著增加;由实施例2和实施例3可知,诱导物腺苷孵育时间和黄嘌呤氧化酶添加后孵育时间延长,生成尿酸含量增加;由实施例3、实施例4和实施例5可知,虽然随着诱导物腺苷浓度的增加,模型组产生的尿酸含量也增加,但当腺苷浓度增加到1.5 mmol/L时,再继续加大诱导物腺苷的浓度,尿酸含量无显著增加,是因为在一定时间和细胞密度下,腺苷的转化量一定,故最终生成的尿酸含量无显著增加。
结合图3、图4可知,高尿酸血症肝细胞模型造模成功。
实施例6
实验设为空白对照组、模型组及阳性对照组。
模型组:(1)将对数生长期的肝细胞经胰蛋白酶消化后,吸管吹打制成细胞悬液,血球计数板计数后,将细胞密度稀释为106个/mL,混匀,接种于24孔板中,每孔1 mL,置于37 °C、5%(V/V)CO2培养箱中培养;
(2)18 h后,取出24孔板,弃去孔板中的细胞上清液,加PBS清洗3次,所有孔均加入现配的以不含胎牛血清的基础培养基为溶剂配制而成的腺苷溶液,腺苷的用量为1.5 mmol/L,置于细胞培养箱中继续培养24 h;
(3)取出板孔,每孔加入0.3 IU黄嘌呤氧化酶,置于细胞培养箱中继续孵育24 h,即得到高尿酸血症肝细胞模型。
空白对照组:加入培养基,不加腺苷,其余条件和模型组一样。
阳性对照组:分别加入用量为10μmol/L的丙磺舒和非布索坦,其余条件和模型组一样。
取出细胞上清液,高效液相测定细胞上清液中尿酸含量,尿酸含量图如图5所示。
由图5可知,加入阳性药物丙磺舒和非布索坦后,生成的尿酸含量相对于模型组显著降低。说明该高尿酸血症肝细胞模型具有降尿酸评价的功效,可进一步用于筛选降尿酸药物。
- 还没有人留言评论。精彩留言会获得点赞!