一种产异丁醇和乙醇的大肠杆菌及其制备方法与流程
本发明涉及生物技术领域,尤其涉及一种产异丁醇和乙醇的大肠杆菌及其制备方法。
背景技术:
目前全球的液体运输燃料基本都是以石油为原料炼制的。这些燃料燃烧后会生成大量的温室气体,使全球的温度升高。而全球变暖会引起一系列问题,如海平面上升、亚热带地区沙漠膨胀、冰川融化、冻土解冻、北极雨林和北方森林的面积缩小、海啸和飓风密度增加、物种灭绝等。生物质是一种广泛存在且可再生的清洁资源。通过生物制造法,生物质可以被转化为可再生的替代能源。近几十年来,生物能源的研究开发主要集中在乙醇、丁醇、沼气、氢气和生物柴油等。醇类物质由于其具有的易燃性以及可以与汽油混合等优点,被认为是未来汽油燃料的理想替代品。其中,乙醇是目前研究最成熟、利用微生物进行生产并且实现产业化的可再生能源。
但是,乙醇燃料具有很多潜在的问题。而与乙醇相比,长链醇作为燃料具有更多的优势,如其能量密度高,和汽油基本相同;亲水性低,可与汽油高比例混合;能利用现有石油管道进行运输;能降低混合燃料的蒸汽压,操作更安全等。异丁醇作为长链醇的典型代表,其生物合成早已受到广泛重视。另外,除了作为燃料,异丁醇还可以直接用作溶剂,也可以转化为异丁烯。异丁烯是重要的化工原料,可以用于制备丁基橡胶、聚异丁烯和合成橡胶等。同时,异丁醇在化工市场上也有很多用途,主要用于生产润滑油添加剂、表面涂料、粘合剂等复合溶剂,同时还可以用于生产邻苯二甲酸酯类增塑剂。
自然界中仅有个别微生物(例如酿酒酵母)能产少量的异丁醇。近几年来,美国杜邦公司、美国gevo公司在构建基因工程菌发酵生产异丁醇方面进行了深入的研究。杜邦公司通过利用支链氨基酸的生物合成途径和ehrlich途径,首次在大肠杆菌中创建了异丁醇的生物合成途径,并申请了相关专利。美国加州大学洛杉矶分校的jamesc.liao课题组,通过缬氨酸合成的中间代谢物2-酮基异戊酸来生产异丁醇。该研究小组通过在大肠杆菌中敲除乙醇脱氢酶基因adhe、乳酸脱氢酶基因ldha、富马酸还原酶基因frd、转录调控因子fnr、磷酸乙酰转移酶基因pta、丙酮酸甲酸裂解酶基因pflb;过表达异丁醇合成途径中的关键基因来自枯草芽孢杆菌的乙酰乳酸合酶基因alss,大肠杆菌来源的醇酮酸还原异构酶基因ilvc,二羟基酸脱水酶基因ilvd,2-酮酸脱羧酶基因kivd和醇脱氢酶基因adha,获得菌株jcl260。该菌株微氧发酵122h可以生产22g/l的异丁醇,转化率达到86%。在用1l发酵罐进行好氧发酵并用汽提法收集时,发酵72h可以生产50g/l的异丁醇。2009年,该课题组用聚球藻(synechococcuselongatuspcc7942,s.elongatuspcc7942)发酵生产异丁醇。结果显示,发酵6天可以生产450mg/l异丁醇。jin-hoseo利用酵母菌(saccharomycescerevisiae,s.cerevisiae)作为表达宿主,采用微氧的发酵方式可以生产151mg/l的异丁醇。bernhardj.eikmanns用谷氨酸棒杆菌(corynebacteriumglutamicum,c.glutamicum)作为宿主菌,采用两步法发酵生产异丁醇。结果异丁醇产量达到175mm,糖醇转化率达到48%。闻建平等利用枯草芽孢杆菌(bacillussubtilis,b.subtilis)进行好氧发酵,可以生产0.607g/l异丁醇。
目前报道的异丁醇工程菌绝大多数采用好氧工艺。好氧工艺在生产过程中需要用空气,能耗很大;更关键的是,有相当一部分碳源进入三羧酸循环(tca)循环被用于细胞生长,导致转化率比理论最大值要低很多。厌氧工艺和好氧相比,具有低能耗、高转化率的优点,生产过程中不需要通空气,大大节约能耗;产品的转化率通畅接近理论最大值。因此在生产生物能源和大宗化学品等低价值产品时,非常有必要使用厌氧发酵工艺。厌氧条件下,葡萄糖转化为异丁醇的理论最大转化率是1mol/mol。然而,异丁醇合成途径存在的氧化还原问题导致目前的工程菌很难达到理论最大转化率。从丙酮酸到异丁醇的合成途径需要消耗2个还原力,一个是将乙酰乳酸还原为2,3-二羟基-3-甲基丁酸,由乙酰羟基酸还原异构酶ilvc催化,该酶是nadph依赖型;另一个是将异丁醛转化为异丁醇,由醇脱氢酶催化,该酶既有nadh依赖型,也有nadph依赖型。但是,在厌氧发酵时,葡萄糖的代谢主要是通过糖酵解途径(emp途径),1mol葡萄糖代谢生产2mol丙酮酸的同时,会生成2molatp和2molnadh。因此,这就导致了厌氧条件下生产异丁醇的代谢工程改造的大肠杆菌中出现氧化还原力供给不平衡的问题,即nadh过剩,而nadph供给不足。
目前已经有多种方法用于改造大肠杆菌使其能够在厌氧条件下生产异丁醇。如通过定向进化将酰羟基酸还原异构酶ilvc和醇脱氢酶adh的由nadph依赖型改造成nadh依赖型,从而在微氧发酵时能够获得理论转化率。另外,石爱琴等报道,同时激活转氢酶pntab和nad激酶yfjb可以将厌氧条件下异丁醇的转化率由0.66提高到0.92mol/mol。另外计算机模拟显示,将异丁醇设计大肠杆菌厌氧发酵时的唯一产物是不可行的,该途径必须与能够氧化nadh的途径相结合获得的菌株才能同时支持细胞生长和异丁醇生产。由此设计的菌株在厌氧条件下能够生产1.72g/l的异丁醇。但该方法只解决了nadh过剩的问题,而未解决nadph供给不足的问题。
大肠杆菌有三种途径来合成nadph:磷酸戊糖途径、tca循环和转氢酶。在好氧条件下,磷酸戊糖途径和tca循环分别贡献了35-45%和20-25%的nadph,而转氢酶贡献了35-45%的nadph。在厌氧条件下,磷酸戊糖途径和tca循环的活性很低,基本上所有的nadph都通过转氢酶来供给,但由于其活力有限,并不能满足异丁醇生产的需求。大肠杆菌工程菌株as108是前期构建的能够生产异丁醇的工程菌株。该菌株在厌氧条件下发酵时,能够生产35mm的异丁醇,转化率为0.66mol/mol,但是厌氧发酵中还存在的氧化还原力供给不平衡问题。
技术实现要素:
为了进一步优化as108菌株中异丁醇的生产效率并解决厌氧发酵存在的氧化还原力供给不平衡问题,进行如下:
本发明的一个目的是提供一种构建生产异丁醇和/或乙醇重组菌的方法。
本发明提供的方法,包括如下步骤:
1)在大肠杆菌as108中表达乙醇脱氢酶基因adhe和丙酮酸甲酸裂解酶的编码基因pflb,得到命名为a的重组菌;
2)降低所述命名为a的重组菌中的乙醇脱氢酶和/或提高所述命名为a的重组菌中的6-磷酸葡萄糖脱氢酶的酶活性,得到命名为b的重组菌。
上述方法中,步骤1)中,所述在大肠杆菌as108中表达乙醇脱氢酶基因adhe和丙酮酸甲酸裂解酶的编码基因pflb为将所述乙醇脱氢酶基因adhe和所述丙酮酸甲酸裂解酶的编码基因pflb导入所述大肠杆菌as108。
上述方法中,步骤2)中,所述降低命名为a的重组菌中的乙醇脱氢酶的酶活性为将所述命名为a的重组菌基因组中的乙醇脱氢酶编码基因调控元件替换为rbsl调控元件5、rbsl调控元件6、rbsl调控元件7或rbsl调控元件8;
所述提高命名为a的重组菌中的6-磷酸葡萄糖脱氢酶的酶活性为将所述命名为a的重组菌基因组中的6-磷酸葡萄糖脱氢酶编码基因调控元件替换为rbsl调控元件1、rbsl调控元件2、rbsl调控元件3或rbsl调控元件4;
所述rbsl调控元件1的核苷酸序列为序列6第54-142位核苷酸;
所述rbsl调控元件2的核苷酸序列为序列7第54-142位核苷酸;
所述rbsl调控元件3的核苷酸序列为序列8第54-142位核苷酸;
所述rbsl调控元件4的核苷酸序列为序列9第54-142位核苷酸;
所述rbsl调控元件5的核苷酸序列为序列12第51-139位核苷酸;
所述rbsl调控元件6的核苷酸序列为序列13第51-139位核苷酸;
所述rbsl调控元件7的核苷酸序列为序列14第51-139位核苷酸;
所述rbsl调控元件8的核苷酸序列为序列15第51-139位核苷酸。
上述方法中,包括如下步骤:
1)将所述乙醇脱氢酶基因adhe和所述丙酮酸甲酸裂解酶的编码基因pflb导入所述大肠杆菌as108,得到命名为a的重组菌;
2)步骤2)为将所述命名为a的重组菌基因组中的乙醇脱氢酶编码基因调控元件替换为rbsl调控元件6,且将所述命名为a的重组菌基因组中的6-磷酸葡萄糖脱氢酶编码基因调控元件替换为rbsl调控元件2,得到命名为b的重组菌zl021。
上述导入和替换均通过两步同源重组的方法进行,具体见实施例。
本发明另一个目的是提供一种构建生产异丁醇和/或乙醇重组菌的方法。
本发明提供的方法,包括如下步骤:在大肠杆菌as108中表达乙醇脱氢酶基因adhe和丙酮酸甲酸裂解酶的编码基因pflb,得到命名为a的重组菌zl004。
上述方法中,所述在大肠杆菌as108中表达乙醇脱氢酶基因adhe和丙酮酸甲酸裂解酶的编码基因pflb为将所述乙醇脱氢酶基因adhe和所述丙酮酸甲酸裂解酶的编码基因pflb导入所述大肠杆菌as108。
由上述方法制备的命名为b的重组菌或由上述方法制备的命名为a的重组菌也是本发明保护的范围。
上述方法或上述的重组菌在生产异丁醇和/或乙醇中的应用也是本发明保护的范围。
上述方法或上述的重组菌在提高异丁醇和/或乙醇产量中的应用也是本发明保护的范围。
本发明另一个目的是提供一种生产异丁醇和/或乙醇的方法。
本发明提供的方法,包括如下步骤:发酵上述的重组菌,得到异丁醇和/或丁醇。
本发明的实验证明,本研究将通过在as108菌株中引入乙醇生产途径来消耗掉过多的nadh,减少其积累对细胞造成的毒性,同时,激活磷酸戊糖途径(pentosephosphatepathway,ppp途径)来提高nadph的供给,从而改善异丁醇的生产能力;具体为将乙醇脱氢酶基因adhe和丙酮酸甲酸裂解酶的编码基因pflb导入as108菌株,得到中间菌,且降低中间菌中的乙醇脱氢酶和/或提高中间菌中6-磷酸葡萄糖脱氢酶的酶活性,得到目的重组菌,该目的菌可以为用于联产异丁醇和乙醇。
附图说明
图1为使用大肠杆菌工程菌株联产异丁醇和乙醇。
图2为异丁醇生产和zwf酶活性的关系;iso:异丁醇;zwf:6-磷酸葡萄糖脱氢酶。
图3为adhe活性与异丁醇生产的关系;iso,异丁醇;adhe,醇脱氢酶。
图4为组合调控adhe和zwf基因改善异丁醇生产;(a)异丁醇产量和转化率,(b)乙醇产量和转化率。iso,异丁醇;eth,乙醇;zwf,6-磷酸葡萄糖脱氢酶;adhe,醇脱氢酶。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中乙醇脱氢酶的氨基酸序列为序列19,其编码基因adhe为序列2第332-3007位核苷酸;
丙酮酸甲酸裂解酶的氨基酸序列为序列20,其编码基因pflb为序列4第871-3153位核苷酸;
6-磷酸葡萄糖脱氢酶的氨基酸序列为序列21,其编码基因zwf为序列22。
本发明通过下述实施例进一步阐明,但任何实施例或其组合不应当理解为对本发明的范围或实施方式的限制。本发明的范围由所附权利要求书限定,结合本说明书和本领域一般常识,本领域普通技术人员可以清楚地明白权利要求书所限定的范围。在不偏离本发明的精神和范围的前提下,本领域技术人员可以对本发明的技术方案进行任何修改或改变,这种修改和改变也包含在本发明的范围内。
图1为使用大肠杆菌工程菌株联产异丁醇和乙醇。
表1为本发明所用的大肠杆菌菌株
表2本发明所用的质粒
表3本发明所用到的引物
实施例1、重组大肠杆菌zl004的构建及应用
一、重组大肠杆菌zl002的构建
1、构建质粒pxz021c。
第一步,以pxz020质粒dna(shi,etal.,metabeng,2013,16:1-10)为模板,使用引物xz-adhe-1和xz-adhe-2进行pcr扩增,得到一条长4662bp的dna片段,称为片段i;
上述扩增体系为:newenglandbiolabsphusion5x缓冲液10μl、dntp(每种dntp各10mm)1μl、dna模板20ng、引物(10μm)各2μl、phusionhigh-fidelitydna聚合酶(2.5u/μl)0.5μl、蒸馏水33.5μl,总体积为50μl。
上述扩增条件为98℃预变性2分钟(1个循环);98℃变性10秒、56℃退火10秒、72℃延伸30秒(30个循环);72℃延伸5分钟(1个循环)。
第二步,以pxz-cs质粒dna(tan,etal.,applenvironmicrobiol,2013,79:4838-4844)为模板,使用引物cat-sacb-up和cat-sacb-down扩增出含有cat-sacb的dna片段,称为片段ii。扩增体系和扩增条件参见上文第一步。
第三步,片段i的磷酸化处理,反应步骤和体系为:8μl需处理的pcr片段i于70℃水浴处理5min;然后,依次加入1μl的t4dna连接酶缓冲液,加入0.5μl的t4多聚核苷酸激酶,于37℃反应60分钟。然后,于60℃温浴20分钟以将t4多聚核苷酸激酶灭活,得到磷酸化处理后的片段i。
pcr纯化试剂盒清洗(gel/pcrextrationkit,购自biomiga生物技术有限公司)磷酸化处理后的片段。
第四步,将第三步得到的磷酸化处理后的片段i和第二步得到的片段ii各取20ng,加入1μl10xt4连接缓冲液(neb公司)、1μlt4-dna连接酶(neb公司),补充蒸馏水至10μl,25℃反应5分钟;得到质粒pxz021c。
2、重组大肠杆菌zl002的构建
从大肠杆菌重组菌as108(shi,etal.,metabeng,2013,16:1-10)出发,采用两步同源重组的方法恢复as108中的adhe基因,获得重组大肠杆菌zl002,具体包括以下步骤:
1)第一次同源重组构建重组大肠杆菌zl001
(1)用于同源重组的dna片段i的制备
以上述1制备的质粒pxz021c为模板,使用引物xz-adhe-up/xz-adhe-down扩增出3689bpdna片段i。
扩增体系和扩增条件同上。
3689bpdna片段i的核苷酸序列为序列表中序列1,该片段包含约700个碱基乙醇脱氢酶编码基因adhe上游同源臂(序列1第1-705位核苷酸)、cat-sacbdna片段(序列1第706-3324位核苷酸)、约400个碱基乙醇脱氢酶编码基因adhe下游同源臂(序列1第3325-3689位核苷酸)。
(2)第一次同源重组
将3689bpdna片段i电转化法转化至带有pkd46的大肠杆菌as108,实现第一次同源重组,具体如下:
首先将pkd46质粒(datsenkoandwanner2000,procnatlacadsciusa97:6640-6645;质粒购买于美国耶鲁大学cgsc大肠杆菌保藏中心,cgsc#7739)通过电转化法转化至大肠杆菌as108,得到带有pkd46的大肠杆菌as108;将50μl带有pkd46的大肠杆菌as108感受态细胞置于冰上,加入50ngdna片段i,冰上放置2分钟,转移至0.2cm的bio-rad电击杯。使用micropulser(bio-rad公司)电穿孔仪,电击参数为电压2.5kv。电击后迅速将1mllb培养基转移至电击杯中,吹打5次后转移至试管中,75rpm,30℃孵育2小时。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,37℃过夜培养后,挑选5个单菌落进行pcr验证,使用引物xz-adhe-up/xz-adhe-down进行验证(得到3689bp为阳性),挑选一个阳性单菌落,命名为zl001。
2)第二次同源重组构建重组大肠杆菌zl002
(1)用于同源重组的dna片段ii的制备
以大肠杆菌atcc8739dna为模板,用引物xz-adhe-up/xz-adhe-down扩增出3313bpdna片段ii。
扩增体系和扩增条件同上。
3313bpdna片段ii的核苷酸序列为序列表中序列2,该片段包含约300个碱基乙醇脱氢酶编码基因adhe上游同源臂(序列2第1-331位核苷酸)、乙醇脱氢酶编码基因adhe(序列2第332-3007位核苷酸)、约300个碱基乙醇脱氢酶编码基因adhe下游同源臂(序列2第3008-3313位核苷酸)。
(2)第二次同源重组
将3313bpdna片段ii电转化法转化至带有pkd46的大肠杆菌as108,实现第二次同源重组,具体如下:
首先将pkd46质粒通过电转化法转化至大肠杆菌zl001,得到带有pkd46的大肠杆菌zl001;将50μl带有pkd46的大肠杆菌zl001感受态细胞置于冰上,加入50ngdna片段ii,冰上放置2分钟,转移至0.2cm的bio-rad电击杯。使用micropulser(bio-rad公司)电穿孔仪,电击参数为电压2.5kv。电击后迅速将1mllb培养基转移至电击杯中,吹打5次后转移至试管中,75转,30℃孵育4小时。将菌液转移至含有10%蔗糖的没有氯化钠的lb液体培养基(250ml烧瓶中装50ml培养基),培养24小时后在含有6%蔗糖的没有氯化钠的lb固体培养基上划线培养。经过pcr验证,所用引物为xz-adhe-up/xz-adhe-down(得到3313bp为阳性),挑选一个阳性单菌落,将其命名为zl002。
重组菌zl002为将乙醇脱氢酶基因adhe导入大肠杆菌as108中,得到的重组菌。
二、重组大肠杆菌zl004的构建
1、质粒的构建
为了将pflb基因整合在acka-pta位点,需构建3个质粒:
1)质粒pxz023
以e.coliatcc8739基因组为模板,用引物xz-acka-up/xz-pta-down将acka-pta基因及其操纵子和邻近的513bp扩增下来,得到片段i;然后克隆到peasy-blunt克隆载体上,克隆方法为将上面所述pcr所获得的片段i取1μl,加入1μlpeasy-bluntsimple载体(试剂盒,北京全式金生物技术有限公司),25℃反应15分钟;氯化钙转化法:加入50μltrans10感受态细胞(购自北京全式金生物技术有限公司)中进行,冰浴30分钟。42℃热激30秒,立即置于冰上2分钟。加入500μllb培养基,200rpm,37℃孵育1小时。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)的lb平板上,过夜培养后,挑选5个阳性单菌落,进行菌落pcr验证,引物为m13-f/m13-r。送样测序分析,结果正确的阳性克隆为dna片段i连接到peasy-bluntsimple载体中的质粒,挑取1个正确的质粒命名为pxz023。
2)、质粒pxz024c
以pxz023质粒dna为模板,用引物xz-acka-1/xz-pta-2扩增出一条长4662bp的dna片段ii;以pxz-cs质粒dna为模板,用引物cat-sacb-up/down扩增出含有cat-sacb的dna片段iii。磷酸化处理片段ii,然后用t4快连酶将磷酸化处理的dna片段ii和dna片段iii连接起来得到质粒pxz024c。
3)、质粒pxz-pl001
以e.coliatcc8739基因组为模板,用引物pflb-up-pp/pflb-down-p扩增出含有磷酸化末端的pflb的dna片段iv,将上述第二步中获得的dna片段ii和片段iv连接起来得到质粒pxz-pl001。
2、重组大肠杆菌zl004的构建
从大肠杆菌重组菌zl002出发,采用两步同源重组的方法将pflb基因整合在重组菌zl002基因组的acka-pta位点,获得重组大肠杆菌zl002,具体包括以下步骤:
1)第一次同源重组构建重组大肠杆菌zl003
(1)用于同源重组的dna片段i的制备
以质粒pxz024c质粒dna为模板,使用引物xz-acka-up/xz-pta-down扩增出3709bpdna片段i。
3709bpdna片段i的核苷酸序列为序列表中序列3,该片段包含约400个碱基acka基因上游同源臂、cat-sacbdna片段(序列3第661-3279位核苷酸)、约400个碱基pta基因下游同源臂。
(2)第一次同源重组
将上述(1)获得的3709bpdna片段i电转化法转化至带有pkd46的大肠杆菌zl002,实现第一次同源重组,得到重组菌zl003;方法同上述步骤一的2。
使用引物xz-acka-up/xz-pta-down进行验证(得到3709bp为阳性),挑选一个阳性单菌落,命名为zl003。
2)第二次同源重组构建重组大肠杆菌zl004
(1)用于同源重组的dna片段ii的制备
以pxz-pl001质粒dna为模板,用引物xz-acka-up/xz-pta-down扩增出3614bpdna片段ii。
3614bpdna片段ii的核苷酸序列为序列表中序列4,该片段包含约320个碱基acka上游同源臂(序列4第1-320位核苷酸)、pflb基因启动子区(序列4第321-870位核苷酸)、pflb基因(序列4第871-3153位核苷酸,请指明)、约400个碱基pta下游同源臂(序列4第3154-3614位核苷酸)。
(2)第二次同源重组
将3614bpdna片段ii电转化法转化至带有pkd46的大肠杆菌zl003,实现第二次同源重组,得到重组菌zl004。方法同上述步骤一的2。
使用引物xz-acka-up/xz-pta-down进行验证(得到3614bp为阳性),挑选一个阳性单菌落,命名为zl004。
重组菌zl004为将乙醇脱氢酶基因adhe和pflb基因导入大肠杆菌as108中,得到的重组菌。
三、重组大肠杆菌zl004生产异丁醇
种子培养基由以下成分组成(溶剂为水):
大量元素:葡萄糖20g/l,nh4h2po40.87g/l、(nh4)2hpo42.63g/l、mgso4·7h2o0.18g/l、甜菜碱-hcl0.15g/l。
微量元素:fecl3·6h2o1.5μg/l、cocl2·6h2o0.1μg/l、cucl2·2h2o0.1μg/l、zncl20.1μg/l、na2moo4·2h2o0.1μg/l、mncl2·4h2o0.2μg/l,h3bo30.05μg/l。
发酵培养基大部分和种子培养基相同,区别是葡萄糖浓度为50g/l。
1、发酵培养
将上述二制备的重组菌zl004进行厌氧发酵,包括以下步骤:
(1)种子培养:将lb平板上新鲜的重组菌zl004接种到含有4ml种子培养基的试管中,37℃,250rpm振荡培养过夜。然后,将1ml培养物转接到含有30ml种子培养基的250ml三角瓶中,37℃,250rpm振荡培养至od550=4,即为种子培养液。种子培养液用于发酵培养基接种。
(2)发酵培养:100ml厌氧小瓶中发酵培养基体积为50ml,将种子液按照终浓度od550=0.1的接种量接种于发酵培养基,37℃静置培养6天,得到发酵液。发酵液为发酵罐内所有物质。培养过程没有通任何气体。
2、异丁醇检测
使用安捷伦(agilent-1260)高效液相色谱仪对144小时的发酵液中的组分(如葡萄糖、有机酸)进行测定,采用伯乐(biorad)公司的aminexhpx–87h有机酸分析柱(300mm×7.8mm,9.0μm,bio-rad,usa),上样量20μl,流动相为5mmh2so4,洗脱时间50min,洗脱流速0.5ml/min。
异丁醇标准品购自sigma公司,产品目录号为58448,cas.no.78-83-1。异丁醇出峰时间为38.5min,检测样品中有相同保留时间的峰确认为异丁醇。
乙醇标准品购自sigma公司,产品目录号为46139,cas.no.64-17-5。乙醇出峰时间为25.3min,检测样品中有相同保留时间的峰确认为乙醇。
葡萄糖标准品购自sigma公司,产品目录号为g8270,cas.no.50-99-7。葡萄糖出峰时间为10.8min,检测样品中有相同保留时间的峰确认为葡萄糖。
异丁醇产量的标曲函数式yg/l=(x+5445.5)/238871,x为异丁醇浓度g/l,y为峰面积
乙醇产量的标曲函数式yg/l=(x+54.565)/100673),x为乙醇浓度g/l,y为峰面积。
葡萄糖含量的标曲函数式yg/l=(x-107566.495)/409845,x为葡萄糖浓度g/l,y为峰面积。
总的糖醇转化率=(异丁醇产量+乙醇产量)/(葡萄糖初始量-葡萄糖残余量)。
异丁醇转化率=异丁醇产量/(葡萄糖初始量-葡萄糖残余量);
乙醇转化率=乙醇产量/(葡萄糖初始量-葡萄糖残余量)。
结果重组菌zl004在厌氧条件下发酵144小时,能够生产23mm异丁醇和36mm乙醇。总的糖醇转化率达到0.74mol/mol。
异丁醇和乙醇的转化率分别为0.29mol/mol和0.45mol/mol。
as108不产乙醇;as108生产的异丁醇产量35mm,异丁醇转化率0.66。
实施例2、重组大肠杆菌zl004中zwf基因的调控
从zl004出发,通过rbs文库调控葡萄糖-6-磷酸脱氢酶编码基因zwf,包括以下步骤:
1、第一次同源重组构建重组大肠杆菌zl004-zwf
(1)用于同源重组的dna片段i的制备
以pxz-cs质粒dna为模板,使用引物zwf-cat-sacb-up/down扩增出2722bp的dna片段i。
2722bp的dna片段i的核苷酸序列为序列表中序列5,该片段包含约50bpzwf基因调控区域上游同源臂(序列5第1-53位核苷酸)、cat-sacb基因片段(序列5第54-2672位核苷酸)、zwf基因起始50bp作为下游同源臂(序列5第2673-2722位核苷酸)。
(2)第一次同源重组
将上述(1)获得的2722bp的dna片段i电转化法转化至带有pkd46的大肠杆菌zl004,实现第一次同源重组,得到重组菌zl004-zwf;方法同实施例1。
使用引物zwf-yz-up/down进行验证,(得到3198bp为阳性),挑选一个阳性单菌落,命名为zl004-zwf。
2、第二次同源重组构建重组大肠杆菌zl005、zl006、zl007、zl008
(1)用于同源重组的dna片段ii的制备
以m1-93(lu,etal.,applmicrobiolbiotechnol,2012,93:2455-2462)基因组dna为模板,使用引物zwf-p-up/zwf-rbsl1-down扩增出193bp的序列6所示的dna片段ii(含有rbsl1)。
以m1-93(lu,etal.,applmicrobiolbiotechnol,2012,93:2455-2462)基因组dna为模板,使用引物zwf-p-up/zwf-rbsl2-down扩增出193bp的序列7所示的dna片段ii(含有rbsl2)。
以m1-93(lu,etal.,applmicrobiolbiotechnol,2012,93:2455-2462)基因组dna为模板,使用引物zwf-p-up/zwf-rbsl3-down扩增出193bp的序列8所示的dna片段ii(含有rbsl3)。
以m1-93(lu,etal.,applmicrobiolbiotechnol,2012,93:2455-2462)基因组dna为模板,使用引物zwf-p-up/zwf-rbsl4-down扩增出193bp的序列9所示的dna片段ii(含有rbsl4)。
(2)第二次同源重组
将上述不同的192bp的dna片段ii电转化法转化至带有pkd46的大肠杆菌zl004,实现第二次同源重组,得到重组菌zl005,zl006,zl007和zl008。
重组菌zl005为将重组菌zl004基因组中的zwf调控因子(序列10)替换为rbsl1(序列6第54-142位核苷酸)。
重组菌zl006为将重组菌zl004基因组中的zwf调控因子(序列10)替换为rbsl2(序列7第54-142位核苷酸)。
重组菌zl007为将重组菌zl004基因组中的zwf调控因子(序列10)替换为rbsl3(序列8第54-142位核苷酸)。
重组菌zl008为将重组菌zl004基因组中的zwf调控因子(序列10)替换为rbsl4(序列9第54-142位核苷酸)。
方法同实施例1。
使用引物zwf-yz-up/down进行验证(得到668bp为阳性)。
3、重组菌株zl005、zl006、zl007、zl008生产异丁醇
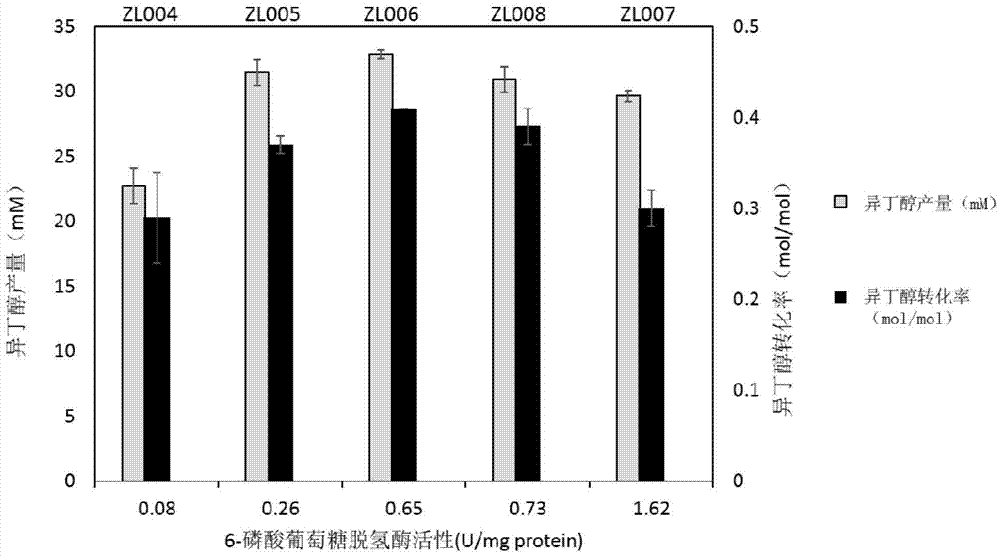
方法同实施例1的三,结果如图2所示,调控zwf基因的表达激活ppp途径后获得的菌株zl005,zl006,zl007和zl008中,异丁醇产量都发生了明显变化。其中产量最高的菌株zl006发酵144小时能够生产33mm异丁醇,转化率为0.41。相比zl004菌株,异丁醇产量提高了43%,转化率提高了41%。
4、重组菌株zl005、zl006、zl007、zl008中zwf酶活测定
对重组菌株zl005,zl006,zl007,zl008中zwf的酶活进行测定,具体包括以下步骤:
1)、发酵培养
重组菌株zl005,zl006,zl007,zl008的发酵培养同实施例1中zl004的发酵培养。
2)、细胞粗酶液制备
取30ml对数生长中后期的发酵液于50ml离心管中,4℃,10000rpm离心5min,弃去上清液,收集菌体,用15ml100mmtris-hclbuffer洗涤2次后,用3ml100mmtris-hcl将菌体悬浮,冰浴超声(功率:25w;开:1s;关:3s)破碎3-5分钟,4℃,10000rpm离心30min,收集上清液用于酶活测定。
粗酶液总蛋白浓度的测定:粗酶液总蛋白浓度用bio-radproteinassay(伯乐生物技术有限公司)试剂盒进行测定,操作按照试剂盒提供的说明书进行。
3)、zwf的酶活测定
1ml反应液中含有100mmtris-hcl(ph7.5),10mmmgcl2,1mmdtt,0.5mmnadp+,2mm6-磷酸葡萄糖,40ml粗酶液。酶活通过测定nadph在340nm的吸收值变化确定zwf的酶活性。nadph在340nm下的消光系数为6.22cm-1mm-1。酶活性单位定义为:反应1分钟,生成1μmolnadph所需要的酶量,为一个酶活性单位。
结果如图2所示,与重组菌株zl004相比,重组菌株zl005,zl006,zl007,zl008中zwf的酶活显著提高。且比较异丁醇产量,可以看出,在一定范围内(≤0.65u/mg),异丁醇产量和zwf的酶活呈正相关。但当zwf酶活继续提高时,异丁醇产量则会降低。
实施例3、重组大肠杆菌zl004中adhe基因的调控
从zl004出发,通过rbs文库调控乙醇脱氢酶编码基因adhe,包括以下步骤:
1、第一次同源重组构建重组大肠杆菌zl004-adhe
(1)用于同源重组的dna片段i的制备
以pxz-cs质粒dna为模板,使用引物adhe-cat-sacb-up/down扩增出2719bp的dna片段i。
2719bp的dna片段i的核苷酸序列为序列表中序列11,该片段包含约50bpadhe基因调控区域上游同源臂(序列11第1-50位核苷酸)、cat-sacb片段(序列11第51-2669位核苷酸)、adhe基因起始50bp序列为下游同源臂(序列11第2670-2719位核苷酸)。
(2)第一次同源重组
将上述(1)获得的2719bp的dna片段i电转化法转化至带有pkd46的大肠杆菌zl004,实现第一次同源重组,得到重组菌zl004-adhe;方法同实施例1。
使用adhe-yz-up/down进行验证,(得到3710bp为阳性),挑选一个阳性单菌落,命名为zl004-adhe。
2、第二次同源重组构建重组大肠杆菌zl009、zl010、zl015、zl018
(1)用于同源重组的dna片段ii的制备
以m1-93(lu,etal.,applmicrobiolbiotechnol,2012,93:2455-2462)基因组dna为模板,使用引物adhe-p-up/adhe-rbsl1-down扩增出189bp的序列12所示的dna片段ii(含有rbsl5)。
以m1-93(lu,etal.,applmicrobiolbiotechnol,2012,93:2455-2462)基因组dna为模板,使用引物adhe-p-up/adhe-rbsl2-down扩增出189bp的序列13所示的dna片段ii(含有rbsl6)。
以m1-93(lu,etal.,applmicrobiolbiotechnol,2012,93:2455-2462)基因组dna为模板,使用引物adhe-p-up/adhe-rbsl3-down扩增出189bp的序列14所示的dna片段ii(含有rbsl7)。
以m1-93(lu,etal.,applmicrobiolbiotechnol,2012,93:2455-2462)基因组dna为模板,使用引物adhe-p-up/adhe-rbsl4-down扩增出189bp的序列15所示的dna片段ii(含有rbsl8)。
(2)第二次同源重组
将上述各种189bp的dna片段ii电转化法转化至带有pkd46的大肠杆菌zl004-adhe,实现第二次同源重组,得到重组菌zl009,zl010,zl015和zl018。
重组菌zl009为将重组菌zl004基因组中的adhe调控因子(序列18)替换为rbsl5(序列12第51-139位)。
重组菌zl010为将重组菌zl004基因组中的adhe调控因子(序列18)替换为rbsl6(序列13第51-139位)。
重组菌zl015为将重组菌zl004基因组中的adhe调控因子(序列18)替换为rbsl7(序列14第51-139位)。
重组菌zl018为将重组菌zl004基因组中的adhe调控因子(序列18)替换为rbsl8(序列15第51-139位)。
方法同实施例1。
使用引物adhe-yz-up/down进行验证(得到1180bp为阳性)。
3、重组大肠杆菌zl009、zl010、zl015、zl018生产异丁醇
方法同实施例1的三,结果如图3所示,结调控adhe基因的表达后获得的菌株zl009,zl0010,zl015和zl018中,异丁醇产量都发生了明显变化。其中产量最高的菌株zl010发酵144小时能够生产37mm异丁醇,转化率为0.6。相比zl004菌株,异丁醇产量提高了60%,转化率提高了107%。
4、重组菌株zl009,zl0010,zl015和zl018中adhe的酶活测定
对重组菌株zl009,zl0010,zl015和zl018中adhe的酶活进行测定,具体包括以下步骤:
1)、发酵培养
重组菌株zl009,zl0010,zl015和zl018的发酵培养同实施例1中zl004的发酵培养。
2)、细胞粗酶液制备
取30ml对数生长中后期的发酵液于50ml离心管中,4℃,10000rpm离心5min,弃去上清液,收集菌体,用15ml100mmtris-hclbuffer洗涤2次后,用3ml100mmtris-hcl将菌体悬浮,冰浴超声(功率:25w;开:1s;关:3s)破碎3-5分钟,4℃,10000rpm离心30min,收集上清液用于酶活测定。
粗酶液总蛋白浓度的测定:粗酶液总蛋白浓度用bio-radproteinassay(伯乐生物技术有限公司)试剂盒进行测定,操作按照试剂盒提供的说明书进行。
3)、adhe的酶活测定
1ml反应液中含有50mmtris-hcl(ph7.5),0.25mmnadh,0.5mm乙酰辅酶a,50ml粗酶液。酶活通过测定nadh在340nm的吸收值变化确定adhe的酶活性。nadh在340nm下的消光系数为6.22cm-1mm-1。酶活性单位定义为:反应1分钟,消耗1molnadh所需要的酶量,为一个酶活性单位。
结果如图3所示,与重组菌株zl004相比,重组菌株zl005,zl006,zl007,zl008中adhe的酶活显著降低。异丁醇产量和adhe的酶活性呈负相关。adhe酶活越低的菌株异丁醇产量越高。含有最低adhe酶活性(0.1u/mgprotein)的菌株zl010生产的异丁醇产量最高,达到37mm,异丁醇转化率达到0.6。
实施例4、重组大肠杆菌zl004中adhe基因和zwf基因的组合调控
根据实施例2中zwf酶活性测定的结果,从zwf基因的rbs文库中分别筛选出低活性(low,l)、中等活性(medium,m)、以及高活性(high,h)的zwf基因的调控元件,与实施例3中根据adhe酶活性测定的结果筛选出的adhe基因rbs文库中低活性(low,l)、中等活性(medium,m)、以及高活性(high,h)的adhe基因的调控元件进行组合,共获得9株重组菌株。
表4为9种adhe基因和zwf基因组合调控获得的工程菌株
具体如下:
1、adhe基因和zwf基因的组合调控制备重组菌株zl021、zl022
1)第一次同源重组构建重组大肠杆菌zl010-zwf
(1)用于同源重组的dna片段i的制备
用于同源重组的dna片段i为序列5所示的2722bp的dna片段i。
(2)第一次同源重组
将序列5所示的2722bp的dna片段i电转化法转化至带有pkd46的大肠杆菌zl010,实现第一次同源重组,得到重组菌zl010-zwf;方法同实施例1。
使用zwf-yz-up/zwf-yz-down进行验证进行验证,(得到3198bp为阳性),挑选一个阳性单菌落,命名为zl010-zwf。
2)第二次同源重组构建重组大肠杆菌zl021、zl022
(1)用于同源重组的dna片段ii的制备
以重组菌株zl006的基因组dna为模板,使用引物zwf-yz-up/zwf-yz-down进行pcr扩增,获得667bpdna片段ii。
667bpdna片段ii的核苷酸序列为序列16。
以重组菌株zl007的基因组dna为模板,使用引物zwf-yz-up/zwf-yz-down进行pcr扩增,获得667bpdna片段ii。
667bpdna片段ii的核苷酸序列为序列17。
(2)第二次同源重组
将上述序列16所示的dna片段ii电转化法转化至带有pkd46的大肠杆菌zl010-zwf,实现第二次同源重组,得到重组菌zl021。
将上述序列17所示的dna片段ii电转化法转化至带有pkd46的大肠杆菌zl010-zwf,实现第二次同源重组,得到重组菌zl022。
筛选菌落时使用zwf-yz-up/zwf-yz-down进行验证(得到667bp为阳性)。
重组菌zl021为将重组菌zl004基因组中的乙醇脱氢酶基因adhe的调控因子替换为rbsl6,且将zwf基因的调控因子替换为rbsl2得到的重组菌。
重组菌zl022为将重组菌zl004基因组中的乙醇脱氢酶基因adhe的调控因子替换为rbsl6,且将zwf基因的调控因子替换为rbsl3得到的重组菌。
2、adhe基因和zwf基因的组合调控制备重组菌株zl019、zl020
1)第一次同源重组构建重组大肠杆菌zl015-zwf
(1)用于同源重组的dna片段i的制备
用于同源重组的dna片段i为序列5所示的2722bp的dna片段i。
(2)第一次同源重组
将序列5所示的2722bp的dna片段i电转化法转化至带有pkd46的大肠杆菌zl015,实现第一次同源重组,得到重组菌zl015-zwf;方法同实施例1。
使用zwf-yz-up/zwf-yz-down进行验证进行验证,(得到3198bp为阳性),挑选一个阳性单菌落,命名为zl015-zwf。
2)第二次同源重组构建重组大肠杆菌zl019、zl020
(1)用于同源重组的dna片段ii的制备
以重组菌株zl006的基因组dna为模板,使用引物zwf-yz-up/zwf-yz-down进行pcr扩增,获得667bpdna片段ii。
667bpdna片段ii的核苷酸序列为序列16。
以重组菌株zl007的基因组dna为模板,使用引物zwf-yz-up/zwf-yz-down进行pcr扩增,获得667bpdna片段ii。
667bpdna片段ii的核苷酸序列为序列17。
(2)第二次同源重组
将上述序列16所示的dna片段ii电转化法转化至带有pkd46的大肠杆菌zl015-zwf,实现第二次同源重组,得到重组菌zl019。
将上述序列17所示的dna片段ii电转化法转化至带有pkd46的大肠杆菌zl015-zwf,实现第二次同源重组,得到重组菌zl020。
筛选菌落时使用zwf-yz-up/zwf-yz-down进行验证(得到667bp为阳性)。
重组菌zl019为将重组菌zl004基因组中的乙醇脱氢酶基因adhe的调控因子替换为rbsl7,且将zwf基因的调控因子替换为rbsl2得到的重组菌。
重组菌zl020为将重组菌zl004基因组中的乙醇脱氢酶基因adhe的调控因子替换为rbsl7,且将zwf基因的调控因子替换为rbsl3得到的重组菌。
3、重组大肠杆菌zl021、zl022、zl019、zl020生产异丁醇
方法同实施例1的三,结果如图4所示,异丁醇产量和转化率最高的菌株来自含有低活性adhe和中等活性zwf的菌株zl021。该菌株发酵144小时,能够生产53mm的异丁醇,转化率为0.74mol/mol。与单纯生产异丁醇的工程菌株as108相比,zl021中异丁醇的产量和转化率分别提高了51%和12%。同时,zl021中总的糖醇转化率相对于as108提高了23%,达到0.81mol/mol。
- 还没有人留言评论。精彩留言会获得点赞!