知母皂苷元结构修饰的衍生物、其药物组合物及其应用的制作方法
技术领域
本发明涉及医药技术领域,特别涉及药物化学合成领域,具体是指知母皂苷元结构修饰的衍生物、其药物组合物及其应用。
背景技术:
阿尔茨海默病(AD)是一种最常见的老年痴呆症,是一种与年龄高度相关,以进行性认知障碍和记忆损伤为主的中枢神经系统的退行性疾病。早期的症状经常被错误的认为是与年龄有关的问题或是压力的临床表现。症状前期,最常见的是记忆与阅读能力的减退。随着病情的发展,将会出现困惑、易怒、情绪不稳定、语言障碍以及长期的记忆丧失等症状,甚至身体机能逐渐丧失最终导致死亡。
到目前为止,阿尔茨海默病的发病机制尚不清楚。研究表明该病与脑内的老年斑块与神经纤维缠结有关。目前的治疗仅仅缓解阿尔茨海默病的症状,而不能减缓它紊乱的进程。迄今,人们已经提出了很多关于阿尔茨海默病发病机理的假说,包括乙酰胆碱能假说、Tau蛋白假说、淀粉样多肽(Aβ)假说和能量代谢假说。
氧化应激是阿尔茨海默病的发病机制之一,它通过产生自由基和氧化物来损伤细胞。它打破了活性氧与抗氧化体系之间的平衡,从而使机体过度氧化,造成机体损伤。
在人体内,自由基的过量产生是有害的,它们很容易与酯类、核酸反应,损害细胞功能。氧化过程能够损伤细胞系统进而导致细胞膜性质的改变,如离子运输、酶活性、蛋白质交联等甚至可能导致细胞死亡。因此,氧化应激是导致阿尔茨海默病、帕金森症、心脏衰竭、癌症以及其他疾病的重要原因之一。
最近几年,从对实验模型和人类大脑研究数据得出的结论表明:氧化应激在阿尔茨海默病和帕金森症患者大脑内神经元变性方面起着重要作用。在患者体内增强的氧化应激也间接支持这一观点,其中氧化应激增强的表现有:大脑表皮传输元素Fe、Al、Zn等数量的增加,脂质过氧化程度增加,不饱和脂肪酸数量减少,自由基的激增,蛋白质、DNA氧化程度的加重,能量代谢的减少,超氧化物歧化酶(SOD-1)在神经纤维、老年斑中数量的增加。
阿尔茨海默病的发病机制有多种假说,比如乙酰胆碱能假说、淀粉样多肽假说、能量代谢假说、自由基损伤假说等。因此存在多种治疗阿尔茨海默病的方法,比如乙酰胆碱酯酶抑制剂(AchEI)、基于Tau蛋白的治疗、淀粉样蛋白抑制剂、β-分泌酶抑制剂、γ-分泌酶抑制剂、抗炎和神经保护疗法。
研究发现,天然产物成分中有很多具有清除自由基的功能(如茶多酚、黄铜、生物碱、甾体化合物等)。我国地大物博、植被众多,这就为我们从天然产物中寻找抗氧化剂提供了便利条件。
知母是我国常见的中药之一,它是百合科植物知母Anemarrhena asphodeloides Bunge.的干燥块茎,具有消渴热中、除邪气、消除肢体浮肿之功效,为常用的滋阴药之一。它的提取物已经被证明具有利尿、抗糖尿病、抗血小板凝集、抗真菌等生物活性,而且也表现出对环腺苷酸磷酸二酯酶的抑制作用。药效实验证明知母皂苷元及其衍生物是一种新型的能改善学习记忆能力的药物,它不同与以往的乙酰胆碱酯酶抑制剂或M受体的激动剂、拮抗剂。它能够使降低的脑M受体密度提高到接近正常水平,在体内作用缓慢而持久。
知母皂苷元及其衍生物的新药研究情况:
(1)知母皂苷元用于治疗卢伽霍氏病,已进行到临床1期,作用机制为神经营养剂作用于神经营养因子知母皂苷元用于治疗ALS。
(2)知母皂苷元衍生物用于治疗老年痴呆进行到生物学测试阶段的是:知母皂苷元3位乙酰酯化衍生物。
(3)知母皂苷A-III作为神经营养剂治疗疾病已进行到临床试验前期实验。
从以上关于知母皂苷元的研究显示,知母皂苷元是一种很好的用于治疗神经系统类疾病的先导化合物,但是现今对知母皂苷元结构修饰的衍生物的研究还不成熟,能用于制备治疗神经系统类疾病药物如老年痴呆药物的知母皂苷元结构修饰的衍生物还太过稀少。
所以,用于制备治疗抗老年痴呆疾病药物的知母皂苷元结构修饰的衍生物是十分具有实用价值的。
技术实现要素:
本发明的目的是为了克服上述现有技术中的缺失,提供可用于制备治疗抗老年痴呆疾病药物的知母皂苷元结构修饰的衍生物,其药物组合物及其应用。
为了实现上述目的,本发明第一方面提供了一种知母皂苷元结构修饰的衍生物,其主要特点是,所述的知母皂苷元结构修饰的衍生物的结构式如式(I)所示,
其中,所述的R1为以下基团中的任意一种,所述的以下基团包括:
R2为C1-C8直链或支链的烷基、取代或未取代的芳基中的一种,
R3为C1-C8直链或支链的烷基、取代或未取代的芳基中的一种,
R4为C1-C8取代或未取代直链或支链的烷基、取代或未取代的芳基中的一种,
R5、R6为H,
R7为H、C1-C8为直链或支链的烷基、取代或未取代的芳基中的一种。
较佳地,当R2为取代的芳基时,取代的芳基选自C1-C4不饱和烷基、烷氧基中的一种;
当R3为取代的芳基时,取代的芳基选自C1-C4直链或支链烷基、卤素中的一种;
当R4为取代烷基时,取代烷基为胺基或氰基中的一种,当R4为取代芳基时,取代芳基为卤素或胺基中的一种;
当R7为取代芳基时,取代芳基为C1-C4不饱和烷基、烷氧基、氰基、羟基、卤素或胺基、中的一种,其中R8、R9为C1-C8为直链或支链的烷基、取代或未取代的芳基中的一种。
较佳地,当R8、R9为取代芳基时,取代芳基为C1-C4不饱和烷基、烷氧基、羟基中的一种。
较佳地,所述的知母皂苷元结构修饰的衍生物为以下化合物中的一种,
本发明第二方面提供了另一种知母皂苷元结构修饰的衍生物,其特征在于,所述的知母皂苷元结构修饰的衍生物的结构式如式(II)所示,
其中,所述的R1为以下基团中的任意一种,所述的以下基团包括:
R2为卤素,
R3为H或者C1-C8直链或支链的烷基,取代或未取代的芳基,
X为O或NH,R4为C1-C8取代或为直链或支链的烷基、取代或未取代的芳基或芳杂环中的一种,
R5为H时,R6为C1-C8取代或为直链或支链的烷基。
较佳地,当R3为取代的芳基时,取代的芳基为C1-C4饱和烷基中的一种;
R4为取代芳基时,取代芳基为卤素或烷氧基或硝基中的一种;
R6为取代烷基时,取代烷基为羟基、取代或未取代的芳基或芳杂环。
较佳地,当R6为取代芳基时,取代芳基为芳杂环胺基,R5和R6连接在一起形成一个含有C、N、O的杂环G,所述杂环G是饱和的并且有取代基
较佳地,所述的知母皂苷元结构修饰的衍生物为以下化合物中的一种,
本发明第三方面提供了一种药物组合物,其特征在于,所述的药物组合物包含根据权利要求1至8任一项所述的知母皂苷元结构修饰的衍生物或其药学上可接受的盐,以及任选的药学上可接受的载体。
本发明第四方面提供了上述的知母皂苷元结构修饰的衍生物在制备治疗抗老年痴呆疾病药物中的应用。
采用本发明的知母皂苷元结构修饰的衍生物,其药物组合物及其应用,首次对该先导化合物进行了系统的针对3位和26位两个位点的结构修饰,合成了一系列的新化合物,这些新合成的化合物通过针对AD相关靶点的活性测试,很多显示出优于先导化合物的活性。对于治疗老年痴呆症十分具有实用价值。弥补了现有技术中知母皂苷元结构修饰的衍生物的不足,十分具有意义。
附图说明
图1为本发明实施例15的实验结果图。
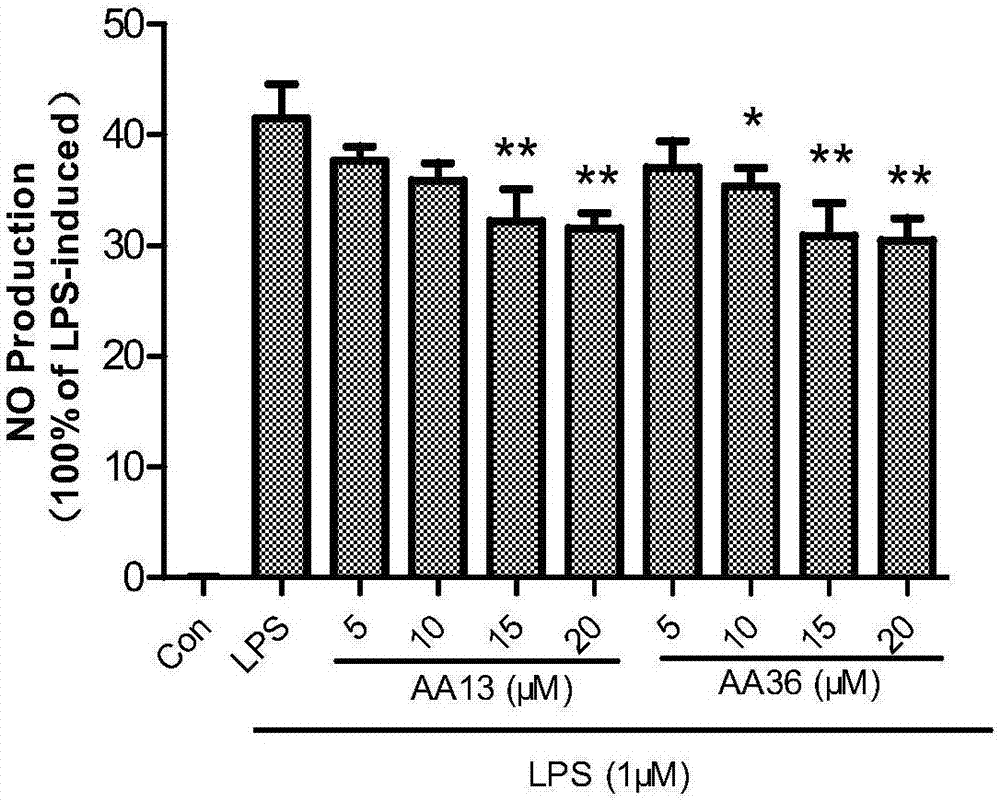
图2为本发明实施例16 NO测试的实验结果图。
图3为本发明实施例16 TNF-α测试的实验结果图。
图4为本发明实施例16 PGE2测试的实验结果图。
图5为本发明实施例17的实验结果图。
图6为本发明实施例18的实验结果图。
图7为本发明实施例19的实验结果图。
具体实施方式
为了能够更清楚地理解本发明的技术内容,下面对本发明的具体实施方法作进一步说明。
实施例1
知母皂苷元AA的制备的方法如下:
按知母根茎药于50%-90%的乙醇的重量份数1:2-1:4回流提取三次,过滤,挥干乙醇。乙醇粗提物分散于5%的H2SO4中,加热水解4-10小时,酸水解产物用DCM萃取多次,除去DCM得到知母皂苷元的粗产物。粗产物用石油醚-丙酮(20:1)洗脱,得到知母皂苷元AA。
知母皂苷元AA
1H NMR(400MHz,CDCl3)δ4.42(m,1H,H-20),4.12(s,1H,H-3),3.97(d,J=11.0Hz,1H,H-26),3.31(d,J=11.0Hz,1H,H-26),2.07–0.98(m,37H),0.77(s,3H).13C NMR(100MHz,CDCl3)δ109.75,81.02,67.08,65.14,62.08,56.47,42.11,40.67,40.31,39.85,36.52,35.27(2C),33.53,31.74,29.95,27.81,27.08,26.56,26.54,25.94,25.77,23.92,20.90,16.50,16.05,14.34.MS(ESI):m/z 416.45[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C27H44O3:416.3312;Found:416.3308.
实施例2
知母皂苷元衍生物ZM1制备方法:
常温下,将知母皂苷元AA与醋酸酐和氯化铵混合,然后将反应升温至50-150℃反应4-24小时后,加入2%-10%的甲醇的氢氧化钠溶液,常温反应4-24小时,经萃取、柱层析得知母皂苷元衍生物ZM1。
知母皂苷元衍生物ZM1
1H NMR(400MHz,CDCl3)δ4.73(ddd,J=16.2,7.1Hz,1H),4.11(s,1H),3.47(d,J=21.0Hz,2H),2.47(d,J=10.0Hz,1H),1.28-1.93(m,30H),0.98(s,3H),0.92(d,3H),0.67(s,3H).13C-NMR(101MHz,CDCl3)δ151.59,103.80,84.40,68.05,67.07,64.39,54.97,43.72,39.98,39.82,36.51,35.35,35.26,35.07,34.05,33.53,30.38,29.96,27.84,26.69,26.54,23.90,23.15,21.04,16.43,14.20,11.66,ESI-MS m/z 417.4[M+H]+。
实施例3
知母皂苷元衍生物ZM13制备方法:
氩气保护下,将知母皂苷元衍生物ZM1与对甲苯磺酰氯反应1-10h后,加入叠氮化钠,同时将温度升至40-100℃,反应1-10h后,再加入三苯基膦,常温反应1-10h后经萃取、柱层析得知母皂苷元衍生物ZM13。其中,ZM1与甲苯磺酰氯、叠氮化钠、三苯基膦的摩尔比为1:1:1:1到1:10:10:10。
知母皂苷元衍生物ZM13
1H NMR(400MHz,CDCl3)δ4.71(m,1H),4.32(d,J=5.6Hz,1H),4.11(s,1H),3.03(dd,J=13.6,6.8Hz,2H),2.46(d,J=10.0Hz,1H),1.32-1.83(m,30H),0.98(s,3H),0.91(d,J=6.6Hz,3H),0.65(s,3H),ESI-MS:m/z 416.3[M+H]+。
实施例4
知母皂苷元衍生物AA1-AA5的制备,其反应式如下:
在氩气保护下,将知母皂苷元AA(41.6mg,0.1mmol)和三乙胺(0.1mL)溶于3mL的二氯甲烷中,在0℃的冰浴中慢慢加入相应的酰氯(0.15mmol)然后升至室温继续反应1小时。反应完毕后,用水淬灭,用二氯甲烷萃取(3*20mL)、合并有机相、经无水硫酸钠干燥、减压浓缩后经柱层析(乙酸乙酯/石油醚=1:15)得到化合物AA1-AA5。
化合物AA1,白色粉末。1H NMR(400MHz,CDCl3)δ4.42(m,1H,H-20),5.09(s,1H,H-3),3.96(d,J=11.0Hz,1H,H-26),3.37(d,J=11.0Hz,1H,H-26),2.34(s,3H,CH3COO-)2.07–0.97(m,36H),0.78(s,3H).MS(ESI):m/z 458.40[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C28H46O4:458.3412;Found:458.3411。
化合物AA2,白色粉末。1H NMR(400MHz,CDCl3)δ4.41(m,1H,H-20),5.08(s,1H,H-3),3.94(d,J=11.0Hz,1H,H-26),3.35(d,J=11.0Hz,1H,H-26),2.24(m,2H,CH3CH2CH2COO-),2.05–0.95(m,39H),0.94(s,3H),0.82(s,3H).MS(ESI):m/z 486.44[M+H]+;HRMS(ESI):m/z [M+H]+Calcd for C30H50O4:486.3712;Found:458.3710。
化合物AA3,白色粉末。1H NMR(400MHz,CDCl3)δ7.74(d,J=15.4Hz,1H),7.23(d,J=8.2Hz,2H),7.10(s,1H),7.03(d,J=15.4Hz,1H),6.92(d,J=15.4Hz,1H),5.34(s,1H),4.42(dd,J=14.4,7.0Hz,1H),3.96(d,J=10.9Hz,1H),3.89(s,2H),3.31(d,J=10.9Hz,1H),2.10-0.97(m,36H),0.82–0.74(m,3H).MS(ESI):m/z 493.45[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C37H53O6:493.3712;Found:493.3713。
化合物AA4,白色粉末。1H NMR(400MHz,CDCl3)δ7.25-7.56(m,5H),5.31(s,1H),4.44(m,1H),3.94(d,J=10.9Hz,1H),3.30(d,J=10.9Hz,1H),2.07–0.93(m,36H),0.78(s,3H)。
化合物AA5,白色粉末。1H NMR(400MHz,CDCl3)δ8.00(d,J=8.3Hz,2H),6.92(d,J=8.3Hz,2H),5.30(s,1H),4.42(m,1H),3.96(d,J=10.7Hz,1H),3.86(s,3H),3.30(d,J=10.7Hz,1H),2.09–0.95(m,36H),0.77(s,3H).MS(ESI):m/z 551.40[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C35H51O5:551.3724;Found:551.3723。
实施例5
利用实施例4同样的方法,以知母皂苷元衍生物ZM1为底物分别获得知母皂苷元衍生物ZM2-ZM9,ZM28-ZM33。
化合物ZM2,白色固体。1H NMR(400MHz,CDCl3)δ4.75(dd,J=15.9,7.9Hz,1H),4.13(s,1H),3.94(m,2H),2.48(d,J=10.2Hz,1H),2.31(t,J=7.4Hz,2H),1.44–2.08(m,23H),1.28(s,3H),1.18–1.07(m,5H),1.00(s,4H),0.97(d,J=5.0Hz,3H),0.96(s,2H),0.68(s,3H),ESI–MS:m/z 417.3[M+H]+。
化合物ZM3,白色固体。1H NMR(400MHz,CDCl3)δ4.75(dd,J=15.7,7.7Hz,1H),4.13(s,1H),3.93(ddd,J=24.3,10.8,6.5Hz,2H),2.48(d,J=10.1Hz,1H),2.32(t,J=7.5Hz,2H),1.27-1.95(m,39H),1.00(s,3H),0.92(m,6H),0.68(s,3H),ESI–MS:m/z 543.3[M+H]+。
化合物ZM4,白色固体。1H NMR(400MHz,CDCl3)δ8.00(d,J=7.9Hz,2H),7.94(d,J=7.8Hz,2H),4.72(dd,J=15.9,7.6Hz,1H),4.15(dd,J=16.7,11.4Hz,3H),2.47(d,J=9.7Hz,1H),1.32-1.91(m,32H),1.03(d,J=6.6Hz,3H),0.96(s,3H),0.64(s,3H),ESI-MS:m/z 535.5[M+H]+。
化合物ZM5,白色固体。1H NMR(400MHz,CDCl3)δ8.03(d,J=8.7Hz,2H),6.94(d,J=8.7Hz,2H),4.75(dd,J=15.8,7.7Hz,1H),4.16(m,3H),3.88(s,3H),2.48(d,J=10.0Hz,1H),1.32-1.93(m,29H),1.05(d,J=6.7Hz,3H),0.99(s,3H),0.66(s,3H),ESI-MS:m/z 551.1[M+H]+。
化合物ZM6,白色固体。1H NMR(400MHz,CDCl3)δ8.00(d,J=8.4Hz,2H),7.44(d,J=8.4Hz,2H),4.74(dd,J=15.8,7.9Hz,1H),4.18(m,3H),2.48(d,J=10.1Hz,1H),1.31-1.90(m,29H),1.05(d,J=6.7Hz,3H),0.99(s,3H),0.65(s,3H),ESI-MS:m/z 555.3[M+H]+。
化合物ZM7,白色固体。1H NMR(400MHz,CDCl3)δ7.83(dd,J=8.5,3.3Hz,1H),7.50(d,J=2.0Hz,1H),7.32(dd,J=8.4,2.0Hz,1H),4.75(m,1H),4.20(d,J=6.1Hz,2H),4.13(s,1H),2.48(d,J=10.2Hz,1H),1.35-1.90(m,29H),1.05(d,J=6.8Hz,3H),0.99(s,3H),0.66(s,3H)。
化合物ZM8,白色固体。1H NMR(400MHz,CDCl3)δ7.83(dd,J=8.5,3.3Hz,1H),7.50(d,J=2.0Hz,1H),7.32(dd,J=8.4,2.0Hz,1H),4.75(m,1H),4.20(d,J=6.1Hz,2H),4.13(s,1H),2.48(d,J=10.2Hz,1H),1.35-1.90(m,29H),1.05(d,J=6.8Hz,3H),0.99(s,3H),0.66(s,3H),ESI-MS:m/z 557.4[M+H]+。
化合物ZM9,白色固体。1H NMR(400MHz,CDCl3)δ7.78(d,J=8.2Hz,1H),7.41(s,1H),7.32(d,J=8.2Hz,1H),4.66(m,1H),4.14(m,1H),4.06(d,J=11.5Hz,2H),2.39(d,J=11.6Hz,4H),1.23-1.85(m,26H),0.90(m,9H),0.57(s,3H),ESI-MS:m/z 580.7[M+H]+。
化合物ZM28,白色固体。1H NMR(400MHz,CDCl3)δ5.47(s,1H),4.65(dd,J=15.2,7.5Hz,1H),4.04(s,1H),3.07(t,J=5.8Hz,2H),2.40(d,J=10.2Hz,1H),0.87-1.65(m,42H)0.59(s,3H),ESI-MS:m/z 486.4[M+H]+。
化合物ZM29,白色固体。1H NMR(400MHz,CDCl3)δ7.72(d,J=7.7Hz,2H),7.40(d,J=7.8Hz,2H),6.38(s,1H),4.71(m,1H),4.11(s,1H),3.33(m,2H),2.47(d,J=10.2Hz,1H),1.22-1.95(m,35H),0.64(s,3H),ESI-MS:m/z 554.7[M+H]+。
化合物ZM30,白色固体。1H NMR(400MHz,CDCl3)δ8.29(d,J=7.9Hz,2H),7.95(d,J=8.1Hz,2H),6.63(s,1H),4.72(s,1H),4.11(s,1H),3.36(td,J=13.2,6.4Hz,2H),2.48(d,J=10.0Hz,1H),2.15(dd,J=29.8,6.6Hz,3H),1.27-1.77(m,26H),0.99(m,6H),0.65(s,3H),ESI-MS:m/z 565.7[M+H]+。
化合物ZM31,白色固体。1H NMR(400MHz,CDCl3)δ7.74(d,J=7.9Hz,2H),6.92(d,J=7.7Hz,2H),6.26(s,1H),4.72(m,1H),4.11(s,1H),3.85(s,3H),3.32(td,J=13.6,7.0Hz,2H),2.46(d,J=10.0Hz,1H),2.14(dd,J=22.9,6.1Hz,3H),1.31-1.85(m,26H),0.98(d,J=7.4Hz,6H),0.64(s,3H),ESI-MS:m/z 550.1[M+H]+。
化合物ZM32,白色固体。1H NMR(400MHz,CDCl3)δ7.42(s,1H),7.10(s,1H),6.49(s,2H),4.73(dd,J=15.1,7.4Hz,1H),4.11(s,1H),3.31(m,2H),2.46(d,J=10.1Hz,1H),2.13(dd,J=17.7,11.1Hz,3H),1.25-1.83(m,32H),0.65(s,3H),ESI-MS:m/z 510.3[M+H]+。
化合物ZM33,白色固体。1H NMR(400MHz,CDCl3)δ7.62(d,J=16.0Hz,1H),7.50(d,J=7.0Hz,2H),7.36(d,J=5.9Hz,3H),6.38(d,J=15.6Hz,1H),5.78(s,1H),4.73(s,1H),4.11(s,1H),3.27(ddd,J=19.5,13.4,6.9Hz,2H),2.47(d,J=10.3Hz,1H),2.17(dd,J=13.9,7.1Hz,3H),1.20-1.81(m,32H),0.66(s,3H),ESI-MS:m/z 546.3[M+H]+。
实施例6
知母皂苷元衍生物AA6-AA11的制备,其反应式如下:
在氩气保护下,将知母皂苷元AA(41.6mg,0.1mmol)和三乙胺(0.1mL)溶于3mL的二氯甲烷中,在0℃的冰浴中慢慢加入相应的黄酰氯(0.15mmol)然后升至室温继续反应2小时。反应完毕后,用20mL水淬灭,用二氯甲烷萃取(3*20mL)、合并有机相、经无水硫酸钠干燥、减压浓缩后经柱层析(乙酸乙酯/石油醚=1:10)得到化合物AA6-AA11。
化合物AA6,白色粉末。1H NMR(400MHz,CDCl3)δ4.72(s,1H,H-3),4.32–4.26(m,1H),3.81(d,J=11.0Hz,1H),3.42(m,2H),3.33(d,J=10.2Hz,1H),0.75-1.95(m,39H),0.70(s,3H).MS(ESI):m/z 509.38[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C29H49O5S:509.3111;Found:507.3117。
化合物AA7,白色粉末。1H NMR(400MHz,CDCl3)δ8.05(t,J=8.2,7.8Hz,1H),7.86(d,J=7.8Hz,2H),7.64(t,(t,J=8.2,7.8Hz,2H),4.85(s,1H,H-3),4.33–4.26(m,1H),3.84(d,J=11.0Hz,1H),3.32(d,J=10.2Hz,1H),0.72-1.92(m,36H),0.68(s,3H).MS(ESI):m/z 557.35[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C33H49O5S:557.3012;Found:557.3007。
化合物AA8,白色粉末。1H NMR(400MHz,CDCl3)δ7.72(d,J=8.2Hz,2H),7.25(d,J=8.2Hz,2H),4.75(s,1H,H-3),4.35–4.29(m,1H),3.87(d,J=11.0Hz,1H),3.22(d,J=11.0Hz,1H),2.37(s,3H),0.72-1.92(m,36H),0.68(s,3H).MS(ESI):m/z 571.45[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C34H51O5S:571.1711;Found:571.1703。
化合物AA9,白色粉末。1H NMR(400MHz,CDCl3)δ7.78(s,1H),7.75(d,J=8.0Hz,2H),7.61(m,1H),7.25(d,J=7.5Hz,2H),4.73(s,1H,H-3),4.35–4.29(m,1H),3.87(d,J=11.0Hz,1H),3.22(d,J=11.0Hz,1H),2.37(s,3H),0.72-1.92(m,36H),0.69(s,3H).MS(ESI):m/z 571.47[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C34H51O5S:571.1710;Found:571.1705。
化合物AA10,白色粉末。1H NMR(400MHz,CDCl3)δ7.80(d,J=8.1Hz,2H),7.23(d,J=8.1Hz,2H),4.80(s,1H,H-3),4.32–4.28(m,1H),3.85(d,J=11.0Hz,1H),3.21(d,J=11.0Hz,1H),0.72-1.92(m,36H),0.71(s,3H).MS(ESI):m/z 575.35[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C33H48FO5S:575.2701;Found:575.2703。
化合物AA11,白色粉末。1H NMR(400MHz,CDCl3)δ7.85(s,1H),7.70(m,1H),7.60(d,J=8.1Hz,1H),7.23(d,J=7.6Hz,1H),4.81(s,1H,H-3),4.32–4.28(m,1H),3.85(d,J=11.0Hz,1H),3.21(d,J=11.0Hz,1H),0.72-1.92(m,36H),0.71(s,3H).MS(ESI):m/z 575.55[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C33H48FO5S:575.2700;Found:575.2705。
实施例7
知母皂苷元衍生物AA12-AA26的制备,其反应式如下:
Reagent and conditions:(1)4-Nitrophenyl chloroformate,DCM,Py,0℃-rt,4h,95%(2)Piperazine,TEA,DCM,0℃-rt,3h(3)RCHO,Sodium triacetoxyborohydride,DCE,TEA,rt.
(1)中间体S1的制备
在氩气保护下,将知母皂苷元AA(1.664g,40mmol)和吡啶(0.5mL)溶于20mL的二氯甲烷中,在0℃的冰浴中缓慢加入对硝基苯基氯甲酸酯(60mmol)然后升至室温继续反应4小时。反应完毕后,用100mL水淬灭,用二氯甲烷萃取(3*100mL)、合并有机相、经无水硫酸钠干燥、减压浓缩后经柱层析(丙酮/石油醚=1:30)得到化合物S1 2.19g(95%)。
(2)化合物AA12-AA26的制备
在氩气保护下,将S1(58.1mg,1mmol)和三乙胺(0.05mL)溶于4mL的二氯甲烷中,在0℃的冰浴中缓慢加入相应的胺(1.5mmol)然后升至室温继续反应3小时。反应完毕后,用30mL水淬灭,用二氯甲烷萃取(3*30mL)、合并有机相、经无水硫酸钠干燥、减压浓缩后经柱层析(乙酸乙酯/石油醚=1:30)得到化合物AA12-AA26(45%-85%)。
化合物AA12,白色固体。1H NMR(400MHz,CDCl3)δ4.99(s,1H),4.66(s,1H,NH),4.43(dd,J=14.1,7.4Hz,1H),3.97(dd,J=11.1,2.4Hz,1H),3.32(d,J=11.1Hz,1H),3.15(m,2H),0.97–2.02(m,38H),0.95(t,J=7.4Hz,3H),0.78(s,3H).MS(ESI):m/z 502.35[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C31H52NO4:502.1101;Found:502.1104。
化合物AA13,白色固体1H NMR(400MHz,CDCl3)δ4.99(s,1H),4.70(s,1H),4.43(dd,J=14.3,7.3Hz,1H),3.97(d,J=10.6Hz,1H),3.32(d,J=10.9Hz,1H),3.02(t,J=6.3Hz,2H),1.12-2.12(m,27H),1.10(d,J=7.0Hz,3H),1.01(m,6H),0.94(s,3H),0.93(s,3H),0.78(s,3H).MS(ESI):m/z 516.45[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C32H53NO4:516.1301;Found:516.1308。
化合物AA14,白色固体。1H NMR(400MHz,CDCl3)δ7.34(m,5H),5.05(s,1H,H-3),4.97(s,1H,NH),4.46–4.33(m,3H),3.97(dd,J=11.0,2.4Hz,1H),3.32(d,J=11.0Hz,1H),0.84-2.12(m,35H),0.78(s,3H).MS(ESI):m/z 550.41[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C35H51NO4:550.3810;Found:550.3806。
化合物AA15,白色固体。1H NMR(400MHz,CDCl3)δ7.30(d,J=7.4Hz,2H),7.25(d,J=7.4Hz,2H),5.04(s,1H,H-3),4.93(s,1H,NH),4.44(dd,J=14.2,7.0Hz,1H),4.33(d,J=4.7Hz,2H,CH3Ar-CH2-),3.97(d,J=11.1Hz,1H),3.32(d,J=11.1Hz,1H),2.37(s,3H),1.15-2.05(m,27H)1.10(d,J=7.0Hz,3H),1.01(d,J=6.5Hz,3H),0.97(s,3H),0.79(s,3H).MS(ESI):m/z 584.40[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C35H51ClNO4:584.3411;Found:584.3408。
化合物AA16,白色固体。1H NMR(400MHz,CDCl3)δ7.42(s,1H),7.30(m,1H),7.25(d,J=7.4Hz,1H),7.12(d,J=7.5Hz,1H)5.03(s,1H,H-3),4.93(s,1H,NH),4.44(dd,J=14.2,7.0Hz,1H),4.33(d,J=4.7Hz,2H,CH3Ar-CH2-),3.97(d,J=11.1Hz,1H),3.32(d,J=11.1Hz,1H),2.37(s,3H),1.15-2.05(m,27H)1.10(d,J=7.0Hz,3H),1.02(d,J=6.5Hz,3H),0.97(s,3H),0.78(s,3H).MS(ESI):m/z 584.50[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C35H51ClNO4:584.3413;Found:584.3409。
化合物AA17,白色固体。1H NMR(400MHz,CDCl3)δ7.21(d,J=7.2Hz,2H),7.16(d,J=7.2Hz,2H),5.04(s,1H,H-3),4.93(s,1H,NH),4.43(dd,J=14.2,7.0Hz,1H),4.34(d,J=4.7Hz,2H,CH3Ar-CH2-),3.97(d,J=11.0Hz,1H),3.32(d,J=11.0Hz,1H),2.37(s,3H),1.15-2.05(m,27H)1.10(d,J=7.0Hz,3H),1.01(d,J=6.5Hz,3H),0.97(s,3H),0.78(s,3H).MS(ESI):m/z 564.45[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C36H54NO4:564.4010;Found:564.4008。
化合物AA18,白色固体。1H NMR(400MHz,CDCl3)δ7.19(d,J=7.8Hz,2H),6.81(d,J=7.8Hz,2H),5.04(s,1H.H-3),4.92(s,1H,NH),4.43(d,J=7.2Hz,1H),4.30(s,2H),3.98(d,J=10.5Hz,1H),3.33(d,J=10.5Hz,1H),1.12-2.12(m,27H),1.10(d,J=7.2Hz,3H),1.01(d,J=6.4Hz,3H),0.97(s,3H),0.78(s,3H).MS(ESI):m/z 566.44[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C35H52NO4:566.3810;Found:566.3808。
化合物AA19,白色固体。1H NMR(400MHz,CDCl3)δ7.21(d,J=7.6Hz,2H),6.82(d,J=7.6Hz,2H),5.01(s,1H.H-3),4.94(s,1H,NH),4.44(d,J=7.2Hz,1H),4.31(s,2H),3.97(d,J=10.4Hz,1H),3.81(s,3H),3.32(d,J=10.4Hz,1H),1.13-2.15(m,27H),1.11(d,J=7.2Hz,3H),1.02(d,J=6.4Hz,3H),0.96(s,3H),0.77(s,3H).MS(ESI):m/z 580.41[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C36H54NO4:580.3913;Found:566.3808。
化合物AA20,白色固体。1H NMR(400MHz,CDCl3)δ4.99(s,1H),4.54(s,1H),4.43(d,J=6.6Hz,1H),3.98(d,J=10.9Hz,1H),3.49(s,1H),3.32(d,J=10.9Hz,1H),1.23-2.20(m,37H),1.10(d,J=6.6Hz,3H),1.01(m,6H),0.78(s,3H).MS(ESI):m/z 542.45[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C34H56NO4:542.4111;Found:542.4104。
化合物AA21,白色固体。1H NMR(400MHz,CDCl3)δ4.99(s,1H),4.41(m,1H),3.95(dd,J=11.0,2.3Hz,1H),3.42(m,4H),3.30(d,J=11.0Hz,1H),1.23-2.20(m,33H),1.08(d,J=7.0Hz,3H),0.99(m,6H),0.76(s,3H).MS(ESI):m/z 528.44[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C33H54NO4:528.4014;Found:528.4015。
化合物AA22,白色固体。1H NMR(400MHz,CDCl3)δ5.02(s,1H),4.43(dd,J=14.1,7.6Hz,1H),3.97(dd,J=10.9,2.4Hz,1H),3.39(dd,J=13.8,7.2Hz,4H),3.32(d,J=10.9Hz,1H),1.23-2.21(m,31H),1.10(d,J=7.0Hz,3H),1.04–0.97(m,6H),0.78(s,3H).MS(ESI):m/z 514.45[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C32H52NO4:514.3811;Found:514.3815。
化合物AA23,白色固体。1H NMR(400MHz,CDCl3)δ5.01(s,1H),4.41(dd,J=14.2,7.4Hz,1H),3.95(dd,J=11.0,2.3Hz,1H),3.51–3.41(m,4H),3.30(d,J=11.0Hz,1H),2.90–2.73(m,4H),1.23-2.15(m,27H),1.08(d,J=7.0Hz,3H),1.01–0.93(m,6H),0.76(s,3H).MS(ESI):m/z 529.44[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C32H53N2O4:529.3905;Found:529.3903。
化合物AA24,白色固体。1H NMR(400MHz,CDCl3)δ7.45(s,1H,NH),5.12(s,1H),4.41(dd,J=14.2,7.2Hz,1H),3.95(dd,J=11.0,2.3Hz,1H),3.30(d,J=11.0Hz,1H),2.05(s,2H),1.15-2.02(m,27H),1.08(d,J=7.2Hz,3H),0.99(d,J=5.7Hz,6H),0.76(s,3H).MS(ESI):m/z 475.45[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C28H47N2O4:475.3504;Found:475.3508。
化合物AA25,白色固体。1H NMR(400MHz,CDCl3)δ5.46(s,1H),4.96(s,1H),4.40(dd,J=14.6,7.3Hz,1H),3.95(d,J=11.0Hz,1H),3.34(m,2H),3.30(d,J=11.3Hz,1H),3.09–2.92(m,2H),1.15-2.03(m,27H),1.08(d,J=7.1Hz,3H),1.02–0.91(m,6H),0.76(s,3H).MS(ESI):m/z 503.50[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C30H50N2O4:503.3801;Found:503.3806。
化合物AA26,白色固体。1H NMR(400MHz,CDCl3)δ5.00(s,1H),4.41(dd,J=14.3,7.3Hz,1H),3.95(d,J=11.0Hz,1H),3.30(m,3H),1.11-2.01(m,27H),1.08(d,J=7.0Hz,3),0.99(d,J=8.3Hz,6H),0.76(s,3H).MS(ESI):m/z 527.40[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C30H47N4O4:527.3505;Found:527.3501。
实施例8
知母皂苷元衍生物AA27-AA38的制备,其反应式如下:
Reagent and conditions:(1)4-Nitrophenyl chloroformate,DCM,Py,0℃-rt,4h,95%(2)Piperazine,TEA,DCM,0℃-rt,3h(3)RCHO,Sodium triacetoxyborohydride,DCE,TEA,rt.
(1)以醛和知母皂苷元为底物
化合物AA27-AA38的合成是从知母皂苷元经过三步获得,前两步同氨基甲酸酯的制备,第三步是由化合物AA23和不同醛经还原氨化制得。
第三步:在氩气保护下,将AA23(53.2mg,1mmol)和相应的醛溶于4mL的二氯乙烷中,加入三乙酰氧基硼氢化钠(1.5mmol),一分钟后加入三乙胺(0.05mL)。反应完毕后,用30mL水淬灭,用二氯甲烷萃取(3*30mL)、合并有机相、经无水硫酸钠干燥、减压浓缩后经柱层析(丙酮/石油醚=1:30)得到化合物AA27-AA38(50%-90%)。
化合物AA27,白色固体。1H NMR(400MHz,CDCl3)δ5.03(s,1H),4.52–4.36(m,1H),3.97(d,J=10.5Hz,1H),3.51(m,4H),3.32(d,J=10.5Hz,1H),2.42(m,4H),2.39–2.32(m,2H),1.12-2.08(m,29H)1.10(d,J=6.9Hz,3H),1.01(d,J=7.2Hz,3H),0.94-1.01(m,6H),0.78(s,4H).MS(ESI):m/z 571.45[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C35H59N2O4:571.4405;Found:571.4401。
化合物AA28,白色固体。1H NMR(400MHz,CDCl3)δ7.34-7.40(m,5H),6.55(d,J=16.1Hz,1H),6.35–6.23(m,1H),4.43(d,J=7.8Hz,1H),3.97(d,J=11.0Hz,1H),3.54(s,4H),3.32(d,J=11.0Hz,1H),3.20(d,J=6.6Hz,2H),2.50(s,4H),1.23-2.05(m,27H),1.10(d,J=7.0Hz,3H),1.01(m,6H),0.78(s,3H).MS(ESI):m/z 645.45[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C41H61N2O4:645.4401;Found:645..4407。
化合物AA29,白色固体。1H NMR(400MHz,CDCl3)δ7.25-7.38(m,5H),5.02(s,1H),4.42(d,J=7.3Hz,1H),3.95(d,J=10.1Hz,1H),3.43-3.47(m,6H),3.33(d,J=10.1Hz,1H),2.42(s,4H),1.23-2.05(m,27H),1.10(d,J=6.9Hz,3H),1.05–0.96(m,6H),0.79(s,3H).MS(ESI):m/z 620.50[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C39H59N2O4:620.4411;Found:620.4412。
化合物AA30,白色固体。1H NMR(400MHz,CDCl3)δ7.23(d,J=7.4Hz,2H),7.18(d,J=7.4Hz,2H),5.03(s,1H),4.43(d,J=7.3Hz,1H),3.96(d,J=10.1Hz,1H),3.44-3.48(m,6H),3.32(d,J=10.1Hz,1H),2.41(s,4H),2.36(s,3H),1.23-2.05(m,27H),1.10(d,J=6.9Hz,3H),1.05–0.96(m,6H),0.78(s,3H).MS(ESI):m/z 633.54[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C40H61N2O4:633.4604;Found:633.4612。
化合物AA31,白色固体。1H NMR(400MHz,CDCl3)δ7,32(m,2H),7.13(d,J=8.3Hz,2H),5.01(s,1H),4.44(d,J=7.3Hz,1H),3.96(d,J=10.1Hz,1H),3.46-3.49(s,6H),3.32(d,J=10.1Hz,1H),2.41(m,4H),1.23-2.05(m,27H),1.10(d,J=6.9Hz,3H),1.05–0.96(m,6H),0.78(s,3H).MS(ESI):m/z 653.50[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C39H58ClN2O4:653.4516;Found:653.4512。
化合物AA32,白色固体。1H NMR(400MHz,CDCl3)δ7,32(m,2H),7.03(m,2H),5.02(s,1H),4.43(d,J=7.2Hz,1H),3.98(d,J=10.0Hz,1H),3.50(m,6H),3.32(d,J=10.0Hz,1H),2.41(m,4H),1.23-2.03(m,27H),1.10(d,J=6.9Hz,3H),1.05–0.96(m,6H),0.78(s,3H).MS(ESI):m/z 636.45[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C39H58FN2O4:636.4306;Found:636.4301。
化合物AA33,白色固体。1H NMR(400MHz,CDCl3)δ7.16(d,J=8.2Hz,2H),6.77(d,J=8.2Hz,2H),4.41(dd,J=14.4,7.2Hz,1H),3.95(d,J=8.7Hz,1H),3.53–3.38(m,6H),3.30(d,J=10.3Hz,1H),2.39(m,4H),1.17-2.07(m,27H),1.06(t,J=10.3Hz,3H),1.01–0.92(m,6H),0.77(d,J=10.0Hz,3H).MS(ESI):m/z 634.55[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C39H59N2O5:636.4306;Found:636.4301。
化合物AA34,白色固体。1H NMR(400MHz,CDCl3)δ7.21(t,J=7.8Hz,1H),7.00(d,J=7.3Hz,1H),6.83(m,2H),5.04(s,1H),4.43(d,J=7.5Hz,1H),3.97(d,J=10.7Hz,1H),3.75(m,2H),3.52-3.55(m,4H),3.32(d,J=10.7Hz,1H),2.55-2.58(m,4H),1,18-2.07(m,27H),1.10(d,J=6.9Hz,4H),1.05–0.96(m,6H),0.78(s,3H).MS(ESI):m/z 634.53[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C39H59N2O5:636.4303;Found:636.4304。
化合物AA35,白色固体。1H NMR(400MHz,CDCl3)δ7.25(d,J=8.0Hz,2H),6.88(d,J=8.0Hz,2H),5.02(s,1H),4.43(dd,J=13.8,6.8Hz,1H),3.97(d,J=10.6Hz,1H),3.83(s,3H),3.48(m,6H),3.32(d,J=10.6Hz,1H),2.41(m,4H),1.16-2.05(m,27H),1.10(d,J=7.0Hz,3H),1.05–0.93(m,6H),0.79(s,3H).MS(ESI):m/z 649.50[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C40H61N2O5:649.4513;Found:649.4512。
化合物AA36,白色固体。1H NMR(400MHz,CDCl3)δ6.85-6.89(m,2H),6.80(d,J=8.0Hz,1H),5.58(s,1H,Ar-OH),5.02(s,1H),4.43(d,J=7.0Hz,1H),3.98(d,J=11.3Hz,1H),3.92(s,3H),3.46-3.50(m,6H),3.32(d,J=11.3Hz,1H),2.41(m,4H),1.15-2.06(m,27H),1.10(d,J=6.7Hz,3H),1.04–0.96(m,5H),0.78(s,3H).MS(ESI):m/z 665.50[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C40H61N2O6:664.4518;Found:664.4515。
化合物AA37,白色固体。1H NMR(400MHz,CDCl3)δ7.19(d,J=8.0Hz,2H),6.73(d,J=8.0Hz,2H),5.02(s,1H),4.43(d,J=7.0Hz,1H),3.97(d,J=10.6Hz,1H),3.47(m,6H),3.38–3.27(m,1H),2.96(s,6H),2.41(m,4H),1.13-2.03(m,27H),1.10(d,J=6.9Hz,3H),1.04–0.97(m,6H),0.78(s,3H).MS(ESI):m/z 661.60[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C41H64N3O4:661.4613;Found:661.4615。
化合物AA38,白色固体。1H NMR(400MHz,CDCl3)δ7.24.7.28(m,2H),7.03(d,J=8.1Hz,2H),5.02(s,1H),4.43(d,J=7.2Hz,1H),3.98(d,J=10.0Hz,1H),3.50(s,6H),3.32(d,J=10.0Hz,1H),2.41(s,4H),1.12-2.05(m,27H),1.09(t,J=9.6Hz,3H),1.06–0.96(m,6H),0.78(s,3H).MS(ESI):m/z 643.50[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C40H58N3O4:643.4316;Found:643.43。
实施例9
知母皂苷元衍生物AA39-AA45的制备,其反应式如下:
其以酸和知母皂苷元为底物,化合物AA39-AA45的合成是从知母皂苷元经过三步获得,前两步同氨基甲酸酯的制备,第三步是由化合物AA23和不同的酸酰化制得。
第三步:在氩气保护下,将AA23(53.2mg,1mmol)、EDCI(1.3mL)以及相应的酸(2mmol)溶于5mL的二氯甲烷中,然后加入催化当量的DMAP(0.5mmol)室温继续反应3小时。反应完毕后,用30mL水淬灭,用二氯甲烷萃取(3*30mL)、合并有机相、经无水硫酸钠干燥、减压浓缩后经柱层析(丙酮/石油醚=1:30)得到化合物AA39-AA45(50%-96%)。
化合物AA39,白色固体。1H NMR(400MHz,CDCl3)δ7.45-7.62(m,5H),5.06(s,1H),4.43(dd,J=14.5,7.4Hz,1H),3.97(d,J=11.0Hz,1H),3.34-3.75(m,8H),3.32(d,J=11.0Hz,1H),1.23-2.07(m,27H),1.10(d,J=7.1Hz,3H),1.09–0.95(m,6H),0.78(s,3H).MS(ESI):m/z 633.55[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C39H57N2O5:633.4213;Found:633.4210。
化合物AA40,白色固体。1H NMR(400MHz,CDCl3)δ7.43(d,J=8.3Hz,2H),7.38(d,J=8.3Hz,2H),5.06(s,1H),4.43(d,J=6.8Hz,1H),3.98(d,J=11.1Hz,1H),3.45-3.75(m,8H),3.32(d,J=11.1Hz,1H),1.23-2.05(m,27H),1.10(d,J=7.0Hz,3H),1.02(m,6H),0.78(s,3H).MS(ESI):m/z 667.45[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C39H56ClN2O5:667.3816;Found:667.3814。
化合物AA41,白色固体。1H NMR(400MHz,CDCl3)δ7.25(m,2H),6.68(d,J=7.4Hz,2H),5.05(s,1H),4.43(d,J=7.4Hz,1H),3.98(d,J=10.7Hz,1H),3.90(s,2H),3.64(m,4H),3.53(m,4H),3.32(d,J=10.7Hz,1H),1.15-2.05(m,27H),1.10(d,J=6.9Hz,3H),1.01(m,6H),0.78(s,3H).MS(ESI):m/z 648.45[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C39H58N3O5:648.4416;Found:648.4412。
化合物AA42,白色固体。1H NMR(400MHz,CDCl3)δ7.41(d,J=8.6Hz,2H),6.95(d,J=8.6Hz,2H),5.06(s,1H),4.46–4.39(m,1H),3.97(d,J=11.1Hz,1H),3.86(s,3H),3.45-3.3.59(m,8H),3.32(d,J=11.1Hz,1H),1.16-2.06(m,27H),1.09(t,J=9.4Hz,3H),1.01-1.03(m,6H),0.78(s,3H).MS(ESI):m/z 662.45[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C40H59N2O6:662.4312;Found:662.4310。
化合物AA43,白色固体。1H NMR(400MHz,CDCl3)δ5.06(s,1H),4.41(m,1H),3.95(d,J=10.9Hz,1H),3.73-3.80(m,5H),3.61–3.49(m,4H),3.42(m,2H),3.30(d,J=10.9Hz,1H),1.15-2.06(m,31H),1.07(d,J=7.1Hz,3H),1.03–0.93(m,6H),0.78(s,3H).MS(ESI):m/z 513.55[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C32H53N2O3:513.4014;Found:513.4019。
化合物AA44,白色固体。1H NMR(400MHz,CDCl3)δ7.64(d,J=15.3Hz,1H),7.10(d,J=8.2Hz,1H),7.00(s,1H),6.92(d,J=8.2Hz,1H),6.70(d,J=15.3Hz,1H),5.85(s,1H,-OH),5.04(s,1H),4.41(dd,J=14.2,7.3Hz,1H),3.95(d,J=11.0Hz,3H),3.70(s,4H),3.54(s,4H),3.30(d,J=11.0Hz,1H),1.15-2.10(m,27H),1.08(d,J=7.0Hz,3H),0.96-0.98(m,6H),0.76(s,3H).MS(ESI):m/z 704.50[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C42H61N2O7:705.4403;Found:704.4401。
化合物AA45,白色固体。1H NMR(400MHz,CDCl3)δ5.05(s,1H),4.43(d,J=6.8Hz,1H),3.97(d,J=10.2Hz,1H),3.64(s,2H),3.48-3.52(m,8H),3.33(d,J=10.2Hz,1H),1.15-2.10(m,27H),1.10(d,J=7.0Hz,3H),1.05–0.96(m,6H),0.79(s,3H).MS(ESI):m/z 615.45[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C35H55N2O7:615.4003;Found:615.4011。
实施例10
知母皂苷元衍生物AA46-AA52的制备,其反应式如下:
Reagent and conditions:(1)4-Nitrophenyl chloroformate,DCM,Py,0℃-rt,4h,95%(2)Piperazine,TEA,DCM,0℃-rt,3h(3)RSO2Cl,DCM,TEA,0℃-rt,3h,.
其以磺酰氯与知母皂苷元为底物,化合物AA46-AA52的合成是从知母皂苷元经过三步获得,前两步同氨基甲酸酯的制备,第三步是由化合物AA23和不同的酸酰化制得。
第三步:在氩气保护下,将知母皂苷元AA23(53.2mg,0.1mmol)和三乙胺(0.1mL)溶于3mL的二氯甲烷中,在0℃的冰浴中慢慢加入相应的黄酰氯(0.15mmol)然后升至室温继续反应3小时。反应完毕后,用20mL水淬灭,用二氯甲烷萃取(3*20mL)、合并有机相、经无水硫酸钠干燥、减压浓缩后经柱层析(丙酮/石油醚=1:20)得到化合物AA46-AA52。
化合物AA46,白色固体。1H NMR(400MHz,CDCl3)δ7.20-7.55(m,5H),4.98(s,1H),4.42(d,J=7.5Hz,1H),3.97(d,J=10.4Hz,1H),3.58(s,4H),3.32(d,J=10.4Hz,1H),3.00(s,4H),2.46(s,3H),1.10(d,J=6.8Hz,3H),1.15-2.05(m,26H),1.03–0.96(m,6H),0.96–0.95(m,1H),0.78(s,3H).MS(ESI):m/z 669.53[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C38H57N2O6S:669.3912;Found:669.3910。
化合物AA47,白色固体。1H NMR(400MHz,CDCl3)δ7.66(d,J=7.8Hz,2H),7.36(d,J=7.8Hz,2H),4.97(s,1H),4.42(d,J=7.5Hz,1H),3.97(d,J=10.4Hz,1H),3.58(s,4H),3.32(d,J=10.4Hz,1H),3.00(s,4H),2.46(s,3H),1.10(d,J=6.9Hz,3H),1.15-2.05(m,26H),1.03–0.96(m,6H),0.96–0.95(m,1H),0.77(s,3H).MS(ESI):m/z 683.50[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C39H59N2O6S:683.4017;Found:683.4015。
化合物AA48,白色固体。1H NMR(400MHz,CDCl3)δ7.81(s,1H),7.64(d,J=7.7Hz,1H),7.56(m,1H),7.23(d,J=7.5Hz),4.99(s,1H),4.42(d,J=7.5Hz,1H),3.97(d,J=10.4Hz,1H),3.58(s,4H),3.32(d,J=10.4Hz,1H),3.00(s,4H),2.46(s,3H),1.11(d,J=6.9Hz,3H),1.15-2.05(m,26H),1.03–0.96(m,6H),0.96–0.95(m,1H),0.79(s,3H).MS(ESI):m/z 683.50[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C39H59N2O6S:683.4017;Found:683.4015。
化合物AA49,白色固体。1H NMR(400MHz,CDCl3)δ7.80(dd,J=7.1,5.1Hz,2H),7.25(m,2H),4.98(s,1H),4.42(d,J=7.4Hz,1H),3.97(d,J=10.5Hz,1H),3.59(s,4H),3.32(d,J=10.5Hz,1H),3.02(s,4H),1.15-2.05(m,27H),1.09(t,J=7.7Hz,3H),1.04–0.93(m,7H),0.79(d,J=10.7Hz,3H).MS(ESI):m/z 687.40[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C38H56FN2O6S:687.3817;Found:687.3813。
化合物AA50,白色固体。1H NMR(400MHz,CDCl3)δ7.57(s,2H),7.49(d,J=8.1Hz,1H),7.36(s,1H),4.98(s,1H),4.42(d,J=7.2Hz,1H),3.97(d,J=10.4Hz,1H),3.60(s,4H),3.32(d,J=10.4Hz,1H),3.05(s,4H),1.15-2.05(m,27H),1.10(d,J=7.0Hz,3H),1.00(d,J=10.3Hz,6H),0.78(s,3H).MS(ESI):m/z 687.40[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C38H56FN2O6S:687.3816;Found:687.3812。
化合物AA51,白色固体。1H NMR(400MHz,CDCl3)δ8.08(s,1H),7.88(d,J=8.5Hz,1H),7.73(d,J=8.5Hz,1H),4.99(s,1H),4.42(d,J=7.6Hz,1H),3.97(d,J=10.5Hz,1H),3.61(m,4H),3.32(d,J=11.4Hz,1H),3.07(m,4H),1.14-2.04(m,27H),1.10(d,J=6.9Hz,3H),1.00(d,J=10.4Hz,6H),0.78(s,3H).MS(ESI):m/z 771.45[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C39H55ClF3N2O6S:771.3310;Found:771.3314。
化合物AA52,白色固体。1H NMR(400MHz,CDCl3)δ5.05(s,1H),4.43(dd,J=14.4,7.1Hz,1H),3.97(d,J=11.1Hz,1H),3.57-3.59(m,4H),3.30-3.35(m,5H),2.99(q,J=7.3Hz,2H),1.12-2.05(m,27H),1.10(d,J=7.0Hz,3H),1.05–0.97(m,6H),0.78(s,3H).MS(ESI):m/z 621.45[M+H]+;HRMS(ESI):m/z[M+H]+Calcd for C34H57FN2O6S:621.3913;Found:621.3911。
实施例11
当R1为卤素时,知母皂苷元衍生物ZM10-ZM12的合成,其反应式如下:
第一步,在氩气保护下,将知母皂苷元衍生物ZM1(416mg,1mmol)溶于4mL二氯甲烷中,冰浴条件下,加入1mL三乙胺,缓慢加入对甲苯磺酰氯(292mg,1.5mmol),反应3h后,反应结束,用30mL水淬灭反应,用二氯甲烷(50mL*2)萃取混合液,合并有机相后,再用饱和食盐水洗一遍,得到的有机相用无水硫酸钠干燥后,经减压浓缩后以石油醚(PE)和乙酸乙酯(EA)混合液作为洗脱剂进行硅胶柱层析,得到中间体化合物S2。
第二步,常温下,将知母衍生物S2(57mg,0.1mmol)溶于4mLTHF中,加入相应的卤化钠(0.2mmol),将反应升温至60℃反应3h后,反应结束。用10mL水稀释反应液,用二氯甲烷(20mL*2)萃取混合液,合并有机相后,再用饱和食盐水洗一遍,得到的有机相用无水硫酸钠干燥后,经减压浓缩后以石油醚(PE)和乙酸乙酯(EA)混合液作为洗脱剂进行硅胶柱层析,得到知母衍生物ZM10-ZM12。
化合物ZM10,白色固体。1H NMR(400MHz,CDCl3)δ4.75(m,1H),4.09(d,J=34.0Hz,1H),3.51(dd,J=10.6,4.9Hz,1H),3.44(m,1H),2.49(d,J=10.2Hz,1H),1.32–1.98(m,29H),1.04(d,J=6.6Hz,3H),1.00(s,3H),0.69(s,3H),ESI-MS:m/z 527.7[M+H]+。
化合物ZM11,白色固体。1H NMR(400MHz,CDCl3)δ4.75(m,1H),4.09(d,J=34.0Hz,1H),3.51(dd,J=10.6,4.9Hz,1H),3.44(m,1H),2.49(d,J=10.2Hz,1H),1.32-1.98(m,29H),1.04(d,J=6.6Hz,3H),1.00(s,3H),0.69(s,3H),ESI-MS:m/z 480.2[M+H]+。
化合物ZM12,白色固体。1H NMR(400MHz,CDCl3)δ4.75(dt,J=9.7,6.8Hz,1H),4.13(s,1H),3.43(dd,J=9.8,4.6Hz,1H),3.35(dd,J=9.8,6.2Hz,1H),2.49(d,J=10.2Hz,1H),1.32–1.98(m,29H),1.04(d,J=6.6Hz,3H),1.00(s,3H),0.69(s,3H),ESI-MS:m/z 436.8[M+H]+。
实施例12
当R1为胺基时,知母皂苷元衍生物ZM14-ZM24的合成,其反应式如下:
常温下,将ZM10(52.6mg,0.1mmol)溶于4mL的N,N-二甲基甲酰胺中,加入相应的胺(0.2mmol),将温度升至60℃下反应3h,反应结束。用10mL水稀释反应液,用二氯甲烷(20mL*2)萃取混合液,合并有机相后,再用饱和食盐水洗一遍,得到的有机相用无水硫酸钠干燥后,经减压浓缩后以石油醚(PE)和乙酸乙酯(EA)混合液作为洗脱剂进行硅胶柱层析,得到知母衍生物ZM14-ZM24。
化合物ZM14,白色固体。1H NMR(400MHz,CDCl3)δ4.74(ddd,J=10.2,7.9,5.7Hz,1H),4.13(s,1H),3.74(q,J=7.0Hz,1H),2.58(ddd,J=17.2,9.4,3.7Hz,3H),2.48(d,J=10.2Hz,1H),2.40(dd,J=11.7,7.5Hz,1H),1.28-1.96(m,33H),1.00(s,3H),0.93(m,6H),0.69(s,3H),ESI-MS:m/z 472.5[M+H]+。
化合物ZM15,白色固体。1H NMR(400MHz,CDCl3)δ4.72(d,J=9.3Hz,1H),4.11(s,1H),2.58(dd,J=11.4,5.1Hz,1H),2.42(m,3H),1.26-1.97(m,40H),0.98(s,3H),0.91(d,J=6.2Hz,3H),0.66(s,3H),ESI-MS:m/z 498.3[M+H]+。
化合物ZM16,白色固体。1H NMR(400MHz,CDCl3)δ4.74(ddd,J=10.2,7.9,5.7Hz,1H),4.13(s,1H),2.46(dd,J=15.2,8.7Hz,5H),1.24-1.94(m,35H),1.00(s,3H),0.96(d,J=6.5Hz,3H),0.69(s,3H),ESI-MS:m/z 470.8[M+H]+。
化合物ZM17,白色固体。1H NMR(400MHz,CDCl3)δ4.75(ddd,J=10.2,7.9,5.7Hz,1H),4.13(s,1H),2.48(d,J=10.2Hz,1H),2.33(m,3H),1.24-1.94(m,38H),1.02(s,3H),0.91(d,J=6.6Hz,3H),0.69(s,3H),ESI-MS:m/z 484.4[M+H]+。
化合物ZM18,白色固体。1H NMR(400MHz,CDCl3)δ4.72(m,1H),4.11(s,1H),3.69(m,4H),2.46(d,J=10.2Hz,1H),2.37(m,4H),1.24–1.94(m,31H),0.98(s,3H),0.90(d,J=6.5Hz,3H),0.66(s,3H),ESI-MS:m/z 486.5[M+H]+。
化合物ZM19,白色固体。1H NMR(400MHz,CDCl3)δ4.75(ddd,J=10.2,7.9,5.8Hz,1H),4.13(s,1H),2.89(m,4H),2.48(d,J=10.4Hz,1H),2.36(s,4H),1.24-1.94(m,32H),1.00(s,3H),0.92(d,J=6.5Hz,3H),0.68(s,3H),ESI-MS:m/z 485.3[M+H]+。
化合物ZM20,白色固体。1H NMR(400MHz,CDCl3)δ4.75(ddd,J=10.2,7.9,5.7Hz,1H),4.13(s,1H),2.89(m,3H),2.73(d,J=7.2Hz,2H),2.48(d,J=10.2Hz,1H),1.32-2.00(m,34H),1.04(d,J=6.4Hz,3H),1.00(s,3H),0.91(d,J=6.6Hz,3H),0.69(s,3H),ESI-MS:m/z 499.7[M+H]+。
化合物ZM21,白色固体。1H NMR(400MHz,CDCl3)δ8.02(s,1H),7.65(d,J=7.9Hz,1H),7.38(d,J=8.1Hz,1H),7.21(t,J=7.1Hz,1H),7.14(t,J=7.5Hz,1H),7.06(d,J=2.0Hz,1H),4.73(ddd,J=10.1,7.9,5.8Hz,1H),4.13(s,1H),2.97(m,4H),2.61(dd,J=11.6,5.7Hz,1H),2.45(m,2H),1.27-1.96(m,30H),1.00(s,3H),0.90(d,J=6.6Hz,3H),0.67(s,3H),ESI-MS:m/z 559.5[M+H]+。
化合物ZM22,白色固体。1H NMR(400MHz,CDCl3)δ4.75(ddd,J=10.2,7.9,5.7Hz,1H),4.13(s,1H),3.66(t,J=5.2Hz,2H),2.82(m,2H),2.60(dd,J=11.8,5.8Hz,1H),2.47(dd,J=11.7,7.4Hz,2H),1.27-1.96(m,31H),1.00(s,3H),0.97(d,J=6.6Hz,3H),0.68(s,3H),ESI-MS:m/z 460.7[M+H]+。
化合物ZM23,白色固体。1H NMR(400MHz,CDCl3)δ4.75(ddd,J=10.2,7.9,5.7Hz,1H),4.13(s,1H),3.60(dd,J=10.4,4.4Hz,1H),3.30(dd,J=10.4,7.5Hz,1H),2.49(m,2H),2.37(td,J=7.2,4.4Hz,1H),1.36-1.97(m,34H),0.97(dd,J=13.0,5.9Hz,8H),0.90(d,J=6.8Hz,3H),0.68(s,3H),ESI-MS:m/z 502.3[M+H]+。
化合物ZM24,白色固体。1H NMR(400MHz,CDCl3)δ4.76(ddd,J=10.1,7.8,5.7Hz,1H),4.13(s,1H),3.64(m,4H),2.68(ddd,J=13.2,6.7,4.4Hz,2H),2.59(m,2H),2.48(d,J=10.1Hz,1H),2.40(dd,J=12.7,7.5Hz,1H),2.26(m,1H),1.31-1.97(m,31H),0.99(s,3H),0.93(d,J=6.6Hz,3H),0.68(s,3H),ESI-MS:m/z 504.5[M+H]+。
实施例13
当R1为醚基时,知母皂苷元衍生物ZM25-ZM27的合成
冰浴条件下,将知母皂苷元衍生物ZM1(416mg,0.1mmol)溶于无水N,N-二甲基甲酰胺中,加入氢化钠(3.6mg,0.15mmol),最后加入对应的溴代烃,将反应升至室温,反应3h后,反应结束。用10mL水稀释反应液,用二氯甲烷(20mL*2)萃取混合液,合并有机相后,再用饱和食盐水洗一遍,得到的有机相用无水硫酸钠干燥后,经减压浓缩后以石油醚(PE)和乙酸乙酯(EA)混合液作为洗脱剂进行硅胶柱层析,得到知母衍生物ZM25-ZM27。
化合物ZM25,白色固体。1H NMR(400MHz,CDCl3)δ4.74(ddd,J=10.2,7.9,5.7Hz,1H),4.13(s,1H),3.40(m,2H),3.29(dd,J=9.3,5.8Hz,1H),3.18(dd,J=9.3,7.0Hz,1H),2.48(d,J=10.1Hz,1H),1.35-1.93(m,33H),1.00(s,3H),0.93(m,6H),0.68(s,3H),ESI-MS:m/z 573.5[M+H]+。
化合物ZM26,白色固体。1H NMR(400MHz,CDCl3)δ4.72(d,J=8.3Hz,1H),4.11(s,1H),3.37(t,J=6.4Hz,2H),3.26(m,1H),3.16(t,J=8.4Hz,1H),2.46(d,J=9.5Hz,1H),1.35-1.92(m,37H),0.98(s,3H),0.91(d,J=6.8Hz,6H),0.66(s,3H),ESI-MS:m/z 501.3[M+H]+。
化合物ZM27,白色固体。1H NMR(400MHz,CDCl3)δ7.35(t,J=5.8Hz,5H),4.74(ddd,J=10.2,7.9,5.7Hz,1H),4.52(d,J=1.6Hz,2H),4.13(s,1H),3.36(dd,J=9.1,5.7Hz,1H),3.26(dd,J=9.1,6.8Hz,1H),2.47(d,J=9.9Hz,1H),1.31-1.93(m,30H),1.00(s,3H),0.97(d,J=6.7Hz,3H),0.68(s,3H),ESI-MS:m/z 507.1[M+H]+。
实施例14
知母皂苷元衍生物对H2O2诱导损伤的PC12细胞活性的影响
(1)试剂材料
PC12鼠肾上腺髓质嗜铬细胞购于American Type Culture Collection;DMEM培养基、胎牛血清FBS、青霉素/链霉素、胰酶购于Gibco;30%过氧化氢购于国药试剂。
(2)实验仪器
移液器购于Thermo Scientific;荧光显微镜购于Nikon Ti-S,Nikon;二氧化碳培养箱购于Thermo Scientific;96孔板购于Jet Biofil;电热恒温鼓风干燥箱购于上海一恒科学仪器仪表有限公司。
(3)MTT法检测细胞存活率
鼠肾上腺髓质嗜铬细胞PC12培养基为含有10%胎牛血清、100U/mL青霉素和100μg/mL链霉素的DMEM培养基。PCI2细胞培养于6cm培养皿中,置于细胞培养箱内,37℃、5%CO2、饱和湿度条件下培养。细胞长至对数生长期时以1×105个/mL接种于96孔板中,每孔100μL。设置调零孔,空白对照、损伤组和药物实验组。
H2O2损伤模型:将96孔板放置过夜后,实验组依次加入DMEM培养基稀释的不同的化合物,化合物终浓度为10μM,调零孔,空白对照、损伤组加入等体积培养基。两小时后加入400μM的过氧化氢溶液处理30min,调零孔,空白对照组加入等体积D-Hank’s溶液。24小时后加入5mg/mL的MTT溶液20μL,4小时后吸去培养基,各孔加入二甲基亚砜(DMSO)200μL,吹打均匀后,全自动酶标仪测定490nm处吸光值。
保护率=(A实验组-A阴性对照组)/(A空白组-A阴性对照组)×100%
(4)实验结果
实施例15
知母皂苷元及其衍生物对Aβ诱导损伤的细胞保护活性
(1)材料
Aβ;D-Hank’s,其它试剂同上。
(2)Aβ损伤模型:细胞长至对数生长期时以1×105个/mL接种于96孔板中,每孔100μL。设置调零孔,空白对照、损伤组和药物实验组。将96孔板放置过夜后,实验组依次加入DMEM培养基稀释的不同浓度的化合物,调零孔,空白对照、损伤组加入等体积培养基。两小时后加入1μM的Aβ寡聚物连续孵育48小时,调零孔,空白对照加入等体积D-Hank’s溶液。48小时后加入5mg/mL的MTT溶液20μL,4小时后吸去培养基,各孔加入二甲基亚砜(DMSO)200μL,吹打均匀后,全自动酶标仪测定490nm处吸光值。
细胞活力=(A实验组-A调零组)/(A空白组-A调零组)×100%
(3)其实验结果如图1所示。
实施例16
知母皂苷元及其衍生物对LPS诱导的RAW264.7细胞NO、TNF-α和PGE2水平抑制活性研究
(1)材料
RAW264.7细胞株(中国科学院上海细胞生物学研究所);DMEM培养基(含有10%胎牛血清、100IU/mL青霉素、100mg/L链霉素);Griess试剂(含1%的对氨基苯磺酰胺、0.1%的N-1-萘乙二胺盐酸盐、2.5%磷酸);TNF-α检测试剂盒(上海西唐生物科技有限公司);PGE2检测试剂盒(Cayman Chemicals,USA),其它试剂同上。
诱导物为脂多糖(LPS)。
阳性对照为氨基胍。
(2)实验方法
NO测试:小鼠巨噬细胞RAW264.7于DMEM培养基中在37℃,5%CO2环境下的培养箱培养。试验时将100μL浓度为1×106/mL的细胞悬液接种到96孔板上,继续培养5-6小时。然后将相应浓度的阳性对照药品、制备好的化合物分别加到悬液中。实验分为三组:空白对照组、LPS组、实验组。半小时后,将10μL的LPS加入到LPS组和实验组,使LPS的终浓度为1μg/mL。培养20小时后,用Griess法通过测定细胞上清液中亚硝酸盐的含量间接反映NO的生成量;取50μL细胞培养液,加入等量的Griess试剂,于540nm波长处测吸光度,以亚硝酸盐标准溶液绘制标准曲线,计算亚硝酸盐的浓度。其实验结果图如图2所示。
TNF-α/PGE2测试:细胞处理方法同上,TNF-α/PGE2水平测试按照PGE2ELISA Kit说明书进行。其实验结果图如图3、4所示。
NO抑制率=(阴性对照组NO产生量-实验组NO产生量)/阴性对照组NO生量×100%
(3)实验结果
实施例17
知母皂苷元及其衍生物对LPS诱导的RAW264.7细胞COX-2和iNOS蛋白水平研究
(1)实验材料
COX-2、iNOS抗体,GAPDH,HRP标记的二抗购自Santa Cruz,ECL化学发光液,显影液购自生工生物,其它试剂同上。
(2)Western Blot实验方法
RAW264.7细胞5×105个/孔接接种于六孔板中,过夜后,对六孔板进行不同的处理,设空白实验组,LPS刺激组,AA36药物处理组(20μM、15μM、10μM、5μM),AA36预处理30min后,LPS组及药物处理组分别加入培养基稀释的LPS,终浓度1μg/mL,培养24h后,去上清,D-Hank’s洗两遍,每孔加裂解液100μL,冰上孵育30min,细胞裂解液于413000rpm离心15min,取上清,BCA法对蛋白进行定量,加上样缓冲液,100℃下变性5min,10%聚丙烯酰胺SDS凝胶电泳后,电转至PVDF膜上,5%脱脂牛奶封闭1h后加入COX-2/iNOS一抗,4℃孵育过夜,于TBST缓冲液中,摇床上洗涤3×10min,上二抗,室温孵育2h,于TBST缓冲液中,摇床上洗涤3×10min,加入化学发光剂,显色。
(3)其实验结果如图5所示。
实施例18
知母皂苷元及其衍生物AA36对LPS诱导的RAW264.7细胞MAPK信号通路的影响
(1)实验材料
ERK/JNK/p38/p-ERK/p-JNK/p-p38抗体(购自Cell Signaling Technology),其它试剂同上。
(2)Western Blot实验方法:同上。
(3)其实验结果如图6所示。
实施例19
知母皂苷元衍生物AA36对LPS诱导的巨噬细胞NF-KB p65蛋白转位的影响
(1)实验材料
NF-κB p65抗体(购自Cell Signaling Technology);荧光二抗(购自Santa Cruz Biotechnology);DAPI(购自Roche Diagnostics);其它试剂同上。
(2)荧光免疫细胞化学实验方法
细胞接种于玻璃爬片上,药物处理结束后,D-Hank’s清洗三次,4%PFA固定15min,取爬片,组化封闭液100μL室温孵育1h;p65一抗4℃孵育过夜;PBS缓冲液洗三次,每次10min;上荧光二抗,室温孵育2h;PBS洗三次,每次10min;DAPI室温然核15min,封片。
(3)其实验结果如图7所示。
采用本发明的知母皂苷元结构修饰的衍生物,其药物组合物及其应用,首次对该先导化合物进行了系统的针对3位和26位两个位点的结构修饰,合成了一系列的新化合物,这些新合成的化合物通过针对AD相关靶点的活性测试,很多显示出优于先导化合物的活性。对于治疗老年痴呆症十分具有实用价值。弥补了现有技术中知母皂苷元结构修饰的衍生物的不足,十分具有意义。
在此说明书中,本发明已参照其特定的实施例作了描述。但是,很显然仍可以做出各种修改和变换而不背离本发明的精神和范围。因此,说明书应被认为是说明性的而非限制性的。
- 还没有人留言评论。精彩留言会获得点赞!