结合SPARC的scFv的制作方法
要求优先权
本申请要求2008年12月5日提交的美国临时申请号61/120,228的优先权,其全部内容通过引用方式并入本文。
背景技术:
酸性的富含半胱氨酸的分泌蛋白(Secreted Protein,Acidic,Rich in Cysteines,SPARC)也被称作骨粘连蛋白(osteonectin),是人体内表达的303个氨基酸的糖蛋白。SPARC的表达在发育上受到调控,SPARC主要在正常发育或响应于损伤而发生重塑的组织中表达。参见,例如Lane et al.,FASEB J.,8,163-173(1994)。例如,在鼠、牛和人胚胎的发育中的骨和牙齿(主要是成骨细胞、成牙质细胞、软骨膜的成纤维细胞)以及分化中的软骨细胞中高水平表达SPARC蛋白。SPARC也在组织重塑、创伤修复、形态发生、细胞分化、细胞迁移和血管形成过程中的细胞-基质相互作用中发挥重要作用,其中包括这些过程与疾病状态相关的情况。例如,在肾间质纤维化中表达SPARC,并且其在宿主对肺损伤例如博来霉素诱导的肺纤维化的应答中具有重要作用。
在多种癌症中,SPARC在肿瘤及其周围基质中的表达相对于正常组织中是不同的,其表达模式取决于癌症的类型。因此,没有统一的模型来解释其功能及其对癌症产生和发展的作用的各个方面。在一种模式中,有报道指出在乳腺癌(Bellahcene and Castronovo,1995;Jones et al.,2004;Lien et al.,2007;Porter et al.,1995)、黑素瘤(Ledda et al.,1997a)和成胶质细胞瘤(Rempel et al.,1998)中SPARC的表达增加。在这些癌症中,增加的SPARC的表达在肿瘤促进或进展中具有重要作用。
因此,在炎症和一些癌症中SPARC的过表达使SPARC成为诊断和治疗的潜在靶标。
技术实现要素:
本发明提供了用于将治疗或诊断剂递送至哺乳动物中的疾病位点的组合物,其包含治疗或诊断上有效量的药物组合物,所述药物组合物包含偶联于SPARC结合肽("SBP")的治疗或诊断剂以及药学上可接受的载体("本发明的组合物"),其中所述SBP包含SEQ ID NO:1-117中的一项或多项。
特别优选的实施方式包括,例如,用于将治疗剂递送至哺乳动物中的疾病位点的本发明组合物,其包含一种或多种SBP,其中所述治疗剂是包含功能性抗体Fc结构域的抗体片段,例如,其中所述功能性抗体Fc结构域包括SEQ ID NO:118。
特别优选的实施方式包括,例如,用于将治疗或诊断剂递送至哺乳动物中的疾病位点的本发明的组合物,例如,其中SBP包含:SEQ ID NO:1-112和117中的任意一项或多项的至少10个连续氨基酸。优选地,SBP可以由SEQ ID NO:1-112和117中的任意一项或多项的至少10个连续氨基酸组成。其它实施方式包括这样的组合物,例如,其中存在两种或更多种单独的SBP,其中每种单独的SBP包含SEQ ID NO:1-112和117中的任意一项、优选SEQ ID NO:1-5中的任意一项或多项的至少10个连续氨基酸。实施方式包括这样的组合物,例如,其中存在两种或更多种单独的SBP,其中每种单独的SBP由SEQ ID NO:1-112和117中的一项或多项组成。
本发明还提供了用于将治疗或诊断剂递送至哺乳动物中的疾病位点的组合物,其包含治疗或诊断上有效量的药物组合物,所述药物组合物包含偶联于SBP的治疗或诊断剂,药学上可接受的载体和药学上可接受的载体,还包含白蛋白结合肽("ABP"),其中所述ABP包括SEQ ID NO:119或SEQ ID NO:120或者SEQ ID NO:119与SEQ ID NO:120二者。此类组合物包括:其中所述SBP和ABP在同一多肽中,以及,所述SBP和ABP在不同的多肽中的情况。
本发明还提供了用于将治疗或诊断剂递送至哺乳动物中的疾病位点的方法,包含治疗或诊断上有效量的药物组合物,所述药物组合物包含偶联于SPARC结合肽的治疗或诊断剂以及药学上可接受的载体("本发明的方法"),其中所述SBP包括SEQ ID NO:1-117。优选的实施方式包括本发明的方法,其中所述组合物,例如,其中SBP包含:SEQ ID NO:1-112和117中的任意一项或多项、更优选SEQ ID NO:1-5和117中的任意一项或多项的至少10个连续氨基酸。
其它优选的实施方式包括本发明的方法,例如,其中存在两种或更多种单独的SBP,其中每种单独的SBP由SEQ ID NO:1-117中的一项或多项组成。本发明还提供了本发明的方法,其中存在两种或更多种单独的多肽,每种多肽由至少一个SBP组成,并且其中SBP包含SEQ ID NO:1-112中任一项的至少10个连续氨基酸。
特别优选的本发明的方法包括这样的组合物,例如,其中治疗剂是包含功能性抗体Fc结构域的抗体片段,例如,其中所述抗体片段包括SEQ ID NO:118。根据本发明的此类方法包括,例如,其中治疗剂是介导下列一项或多项的抗体片段:补体激活、细胞介导的细胞毒性、诱导细胞凋亡、诱导细胞死亡和调理作用。
本发明提供的本发明的方法还包括血清白蛋白结合肽("ABP"),其包括SEQ ID NO:119或SEQ ID NO:120或者SEQ ID NO:119与SEQ ID NO:120二者。根据本发明的方法还包括,例如,其中所述SBP和ABP在同一多肽中,以及,所述SBP和ABP在不同的多肽中的情况。然而,所述SBP也可以由SEQ ID NO:1-112的任意一项或多项的至少10个连续氨基酸组成。
所提供的本发明的组合物和方法可用于其中疾病位点是肿瘤并且哺乳动物是人类患者的情况。
附图说明
图1显示了将结合肽与治疗或诊断剂融合的一般概念。在该图所示的实例中,治疗剂是抗体Fc结构域。
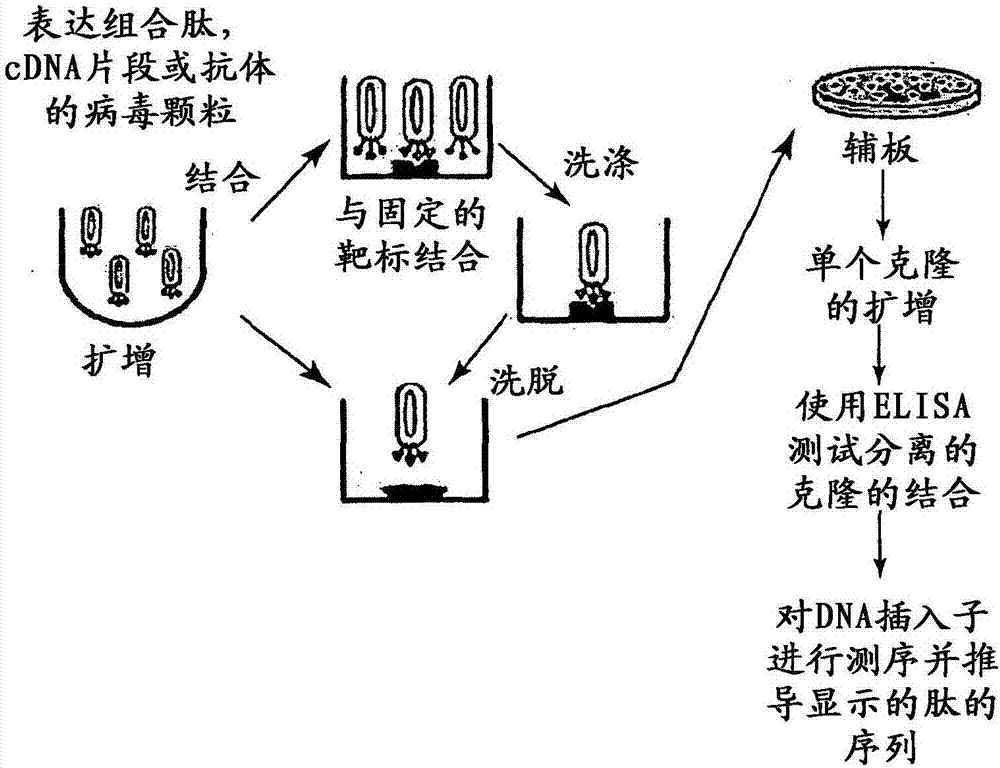
图2显示了用于反复筛选噬菌体显示文库的一般策略。
图3显示了通过序列被分离的次数就与SPARC的结合筛选肽噬菌体显示文库后鉴别的序列。
图4显示了通过与SPARC结合的亲和性(由OD指示)就与SPARC的结合筛选肽噬菌体显示文库后鉴别的序列。
图5显示了将肽PD 15或PD21克隆进入pFUSE-hIgG1-Fc2载体以产生PD 15或PD21Fc融合蛋白。
图6显示了通过将编码肽15和肽21的序列克隆进入pFUSE-hIgG1-Fc2载体以编码肽-Fc融合蛋白,而由此产生的DNA序列。
图7显示了所表达的和在聚丙烯酰胺凝胶电泳中纯化的PD 15-Fc和PD 21-Fc融合蛋白。
图8显示了用于定义PD15和PD21的脱靶结合的Protoarray。
图9是ELISA结合测定的图,其中将SPARC与PD15和PD21的结合亲和力与SPARC和抗-SPARC抗体的结合亲和力进行了比较。
图10显示了在人肿瘤的切片上进行的免疫组织学研究的显微照片,其中使用抗-SPARC抗体(R&D抗-SPARC)证明了肿瘤SPARC表达。阴性对照抗-赫赛汀抗体(仅Fc片段)和Stablin结合肽-Fc融合蛋白(stab-Fc)不使肿瘤染色。
图11显示了表达SPARC的肿瘤的组织学染色,其证明:PD 15和PD 21与肿瘤中表达SPARC的细胞结合。
图12显示了弹性蛋白上的潜在的SPARC结合位点。
图13显示了PD15和PD21在人前列腺癌/裸鼠模型系统中的抗肿瘤活性。
图14显示了PD15和PD21在人乳腺癌/裸鼠模型系统中的抗肿瘤活性。
图15显示了两种svFc多肽scFv 3-l和scFv 3-2与SPARC的结合活性。
图16显示了两种svFc多肽scFv 2-l和scFv 2-2与SPARC的结合活性。
图17显示了scFv 2-1,2-2,3-1和3-2的核苷酸序列。以下划线标示出了CDR。
图18显示了从细菌中纯化scFv2-l。
图19显示了从细菌中纯化scFv3-l。
图20显示了使用Biacore,scFv2-l与固定在芯片上的SPARC的结合。列出了使用Biacore,scFv 2-1,3-1和3-2与SPARC的Kd(HTI SPARC-获自HTI的纯化的血小板SPARC;Abx SPARC-由Abraxis生产的来自工程化的HEK293细胞的SPARC)。
具体实施方式
SBP和ABP是“肽配体结构域”。术语“肽配体结构域”意思是指:可以以其本身存在和/或存在于更大的多肽序列内并且特异性地与另一种生物分子结合的氨基酸序列。例如,脂肪酸、胆红素、色氨酸,钙、类固醇激素和其它生理上重要的化合物的主要血液运输系统涉及这些生物分子与血清白蛋白的结合。这些生物分子的结合发生于白蛋白氨基酸序列中的不连续位点,即,发生于血清白蛋白中的肽配体结构域。
本发明提供了用于将治疗或诊断剂递送至哺乳动物中的疾病位点的组合物,其包含治疗或诊断上有效量的药物组合物,所述药物组合物包含偶联于SPARC结合肽("SBP")的治疗或诊断剂以及药学上可接受的载体("本发明的组合物"和"本发明的方法")。本发明包括这样的组合物和方法,其中SBP包括具有SEQ ID NO:1-117中的任意一项或多项、最优选SEQ ID NO:1-5中的任意一项或多项的序列、或SEQ ID NO:1-117中任一项的一种或多种同源物的肽。
术语“同源物”意思是具有与原始序列实质上相同的氨基酸序列并且显示出与原始序列所显示出的性质实质上相似的相关性质的多肽。一种此类性质的实例是调节活性试剂的组织分布的能力,其中SEQ ID NO:1-117的同源物将能够提供与SEQ ID NO:1-117提供的调节水平实质上相似的调节水平。在本文中,例如以及优选地,相对于SEQ ID NO:1-117提供的活性试剂的血液水平,显示出这种实质上相似的调节的SEQ ID NO:1-117同源物将提供至少大约80%,优选至少大约85%,更优选至少大约90%,最优选至少大约95%的活性试剂的血液水平。或者,术语“同源物”还意指,例如,SEQ ID NO:1-112任一项、最优选SEQ ID NO:1-5任一项或多项的至少6个连续氨基酸,优选至少7个连续氨基酸,更优选至少8个连续氨基酸,甚至更优选至少9个连续氨基酸,最优选至少10个连续氨基酸的肽序列。
本发明提供的组合物和方法还包括包含SEQ ID NO:119或120或者SEQ ID NO:119与120二者及其同源物的ABP。根据本发明的方法还包括,例如,其中所述SBP和ABP在同一多肽中,以及,所述SBP和ABP在不同的多肽中的情况。
就相对于原始序列的变化而言,原始序列的同源物优选将与原始序列至少大约80%同一,优选与原始序列至少大约90%同一,甚至更优选与原始序列至少大约95%同一,最优选与原始序列至少大约99%同一。
如本文使用的“序列同一性百分率”意思是通过在比较窗口中比较两个优化比对的序列而测定的值。另外,为了两个序列优化比对的目的,比较窗口中的多肽序列部分相对于参考序列(其不包含添加或缺失)可以包含添加或缺失(即空隙)。百分率是这样计算的:测定两个序列中的相同氨基酸残基的位置数目以产生匹配位置的数目,将匹配位置的数目除以比较窗口中的位置的总数目,将结果乘以100以产生序列同一性百分率。优选地,使用Needleman和Wunsch(1970)J.Mol.Biol.48:443 453中的同源性比对算法来进行优化比对。
另外优选的是,当同源物不含相同的氨基酸时,突变仅产生保守性氨基酸变化。因此,那些不相同的残基位置的变化使得氨基酸残基被替换为其它的具有相似化学性质(例如电荷或疏水性)的氨基酸残基,因此,分子的功能性质不发生改变。当序列的区别在于保守性替换时,可以上调序列同一性百分率以校正替换的保守性性质。区别在于此类保守性替换的序列被称作具有“序列相似性”或“相似性”。进行这种调整的方法是本领域技术人员熟知的。
为了进一步例示本发明上下文中的“保守性”氨基酸取代或改变的含义,以下列出了组A-F。下列组中的一个成员被替换为同一个组中的另一个成员被认为是“保守性”取代。
组A包括:亮氨酸、异亮氨酸、缬氨酸、甲硫氨酸、苯丙氨酸、丝氨酸、半胱氨酸、苏氨酸和具有下列侧链的修饰的氨基酸:乙基、异丁基、-CH2CH2OH、-CH2CH2CH2OH、-CH2CHOHCH3和CH2SCH3。
组B包括甘氨酸、丙氨酸、缬氨酸、丝氨酸、半胱氨酸、苏氨酸和具有乙基侧链的修饰的氨基酸。
组C包括苯丙氨酸、苯基甘氨酸、酪氨酸、色氨酸、环己基甲基和具有取代的苄基或苯基侧链的修饰的氨基残基。
组D包括谷氨酸、天冬氨酸、谷氨酸或天冬氨酸的取代的或非取代的脂肪族、芳香族或苄族酯(例如,甲酯、乙酯、正丙酯、异丙酯、环己酯、苄酯或取代的苄酯)、谷氨酰胺、天冬酰胺、CO-NH-烷基化的谷氨酰胺或天冬酰胺(例如,甲基、乙基、正丙基和异丙基),以及具有侧链-(CH2)3COOH的修饰的氨基酸,其酯(取代的或非取代的脂肪族、芳香族或苄族酯),其酰胺,及其取代的或未取代的N-烷基化酰胺。
组E包括组氨酸、赖氨酸、精氨酸、N-硝基精氨酸、p-环精氨酸、g-羟基精氨酸、N-脒基瓜氨酸(N-amidinocitruline),2-氨基胍基丁酸(2-arnino guanidinobutanoic acid)、赖氨酸的同源物、精氨酸的同源物和鸟氨酸。
组F包括丝氨酸、苏氨酸、半胱氨酸和具有被-OH或-SH取代的C1-C5直链或支链烷基侧链的修饰的氨基酸。
本发明还提供了包含缀合物分子的组合物,所述缀合物分子包含缀合于活性试剂的肽配体结构域,其中所述肽配体结构域在氨基或羧基末端或者两个末端添加至多另外大约50个氨基酸,优选至多另外大约25个氨基酸,更优选至多另外大约15个氨基酸,最优选至多另外大约10个氨基酸。得到的多肽(本发明的多肽)包括总长度小于50个,小于40,小于30,小于25或小于20个氨基酸的多肽。
本发明还提供了包含缀合物分子的组合物,其中所述缀合物分子包含缀合于活性试剂的SBP,其中存在包含SEQ ID NO:1-117中任一项、最优选SEQ ID NO:1、2和117中任意一项或多项的一个或多个SBP。
本发明还提供了分离的多核苷酸,其编码具有肽配体结合结构域的氨基酸序列的多肽,包括在氨基和/或羧基末端具有所述的另外的氨基酸的那些多肽。
II.根据本发明的制备肽的方法
可以使用已知的技术来合成、检测、定量和纯化本发明提供的含有肽配体结构域的多肽。例如,可以这样产生表达含有外源肽配体结构域的多肽的细胞:通过本领域普通技术人员熟知的方法将cDNA置于强启动子/翻译起始点的控制下并将载体转染或转化进入合适的原核或真核细胞以驱动含有肽配体结构域的多肽的表达。或者,可以通过本领域普通技术人员熟知的方法化学地制备含有肽配体结构域的多肽。
可以通过标准的固相合成技术来制备含有肽配体结构域的多肽。如一般已知的那样,可以使用商售的设备和试剂,根据生产商的说明书,通过封闭干扰性基团、保护待反应的氨基酸、偶联、脱保护和将未反应的残基加帽来制备所需长度的肽。合适的设备可以从下列生产商获得,例如,Applied BioSystems,Foster City,CA或Biosearch Corporation,San Raphael,CA。
例如,使用叔丁氧羰基-α-氨基酸以及合适的侧链保护,使用标准的自动化固相合成程序来合成肽。使用标准的氟化氢方法从固相载体上取下完成的肽,同时使侧链脱保护。使用0.1%三氟乙酸中的乙腈梯度,通过半制备型反相HPLC(Vydac C18)进一步纯化粗制肽。将肽真空干燥以除掉乙腈并从0.1%的TFA水溶液中冷冻干燥。通过分析型RP-HPLC验证纯度。可以将肽冻干,然后以1-2mg/mL的重量浓度溶解于水或0.01M乙酸中。
如果肽中存在非编码氨基酸或D形式的氨基酸,则需要使用前述合成方法。然而,对于由基因编码的肽,也可以使用容易合成的DNA序列在商售的表达系统中通过重组技术获得其来源。
本发明相应地提供了包含控制编码含有肽配体结构域的多肽的多核苷酸序列表达的元件的重组载体。此外,本发明提供了包含编码含有肽配体结构域的多肽的核酸的细胞,其中所述细胞是原核细胞或真核细胞。微生物和组织培养方法是本领域技术人员熟知的(见,例如,Sambrook&Russell,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Laboratory Press,New York(2001),pp.16.1-16.54)。因此,本发明提供了制备含有肽配体结构域的多肽的方法,包括:(a)以编码权利要求1的多肽的核酸转化细胞;(b)诱导转化的细胞表达所述多肽;和(c)纯化所述多肽。
蛋白表达取决于RNA转录的水平,RNA转录继而又由DNA信号调节。类似地,mRNA的翻译至少需要AUG起始密码子,其通常位于信使的5’末端的10-100个核苷酸内。已经表明侧接AUG起始密码子的序列影响其识别。例如,对于真核细胞核糖体的识别而言,与完美“Kozak共有”序列一致的序列中镶嵌的AUG起始密码子引起优化的翻译(见,例如,Kozak,J.Molec.Biol.196:947-950(1987))。同样,细胞中外源核酸的成功表达可能需要所得到的蛋白的翻译后修饰。
本文描述的核酸分子优选包含与合适的启动子可操作地连接的编码区,所述启动子是例如真核细胞中有功能性的启动子。病毒启动子,例如但不限于,RSV启动子和腺病毒主要晚期启动子,可用于本发明中。合适的非病毒启动子包括但不限于,磷酸甘油激酶(PGK)启动子和延伸因子1α启动子。非病毒启动子是优选的人类启动子。另外的合适的遗传元件(很多是本领域已知的)也可以连接于或插入至本发明的核酸和构建体中以提供另外的功能、表达水平或表达模式。
此外,本文描述的核酸分子可以与增强子可操作地连接以促进转录。增强子是DNA的顺式作用元件,其刺激相邻基因的转录。赋予所连接的基因在来自很多物种的多种不同细胞类型中的高水平转录的增强子的实例包括但不限于,来自SV40和RSV-LTR的增强子。此类增强子可以与具有细胞类型特异性效应的其它增强子组合,或者可以单独使用任意增强子。
为了优化真核细胞中的蛋白产生,本发明的核酸分子还可以在核酸分子的编码区之后包含多腺苷酸化位点。同样地,优选所有的正确转录信号(以及翻译信号,如果适用)将正确地排列,以使外源核酸在其所被导入的细胞中正确表达。如果需要,外源核酸中还可以引入剪接位点(即,剪接受体和剪接供体位点)以促进mRNA产生并同时保持框内的全长转录本。此外,本发明的核酸还可以包含合适的序列以进行加工、分泌、细胞内定位等。
可以将核酸分子插入至任何合适的载体中。合适的载体包括但不限于病毒载体。合适的病毒载体包括但不限于,逆转录病毒载体,α病毒、痘苗病毒、腺病毒、腺相关病毒、疱疹病毒和禽痘病毒载体。载体优选具有天然或工程化的能力以转化真核细胞,例如CHO-K1细胞。另外,用于本发明上下文中的载体可以是“裸的”核酸载体(即具有极少或没有封装它们的蛋白、糖类和/或脂类的载体),例如质粒或游离体,或者载体可以与其它分子复合。可以与本发明的核酸适宜地组合的其它分子包括但不限于病毒包被、阳离子脂质、脂质体、聚胺、金颗粒和靶向部分,例如靶向细胞分子的配体、受体或抗体。
如本文描述的核酸分子可以被转化进入任意合适的细胞,通常是真核细胞,例如CHO,HEK293或BHK,优选引起含有肽配体结构域的多肽例如本文描述的包含SEQ ID NO:1-120的多肽或其同源物的表达。可以培养所述细胞以提供核酸分子的表达,并由此产生含有肽配体结构域的多肽,例如本文描述的包含SEQ ID NO:1-120所示氨基酸序列的多肽或其同源物。
因此,本发明提供了以本文描述的本发明的核酸分子转化或转染的细胞。以外源DNA分子转化或转染细胞的方法是本领域熟知的。例如但不限于,使用本领域熟知的标准转化或转染技术将DNA分子导入细胞中,所述技术是例如磷酸钙或DEAE-葡聚糖-介导的转染、原生质体融合、电穿孔、脂质体和直接显微注射(参见,例如,Sambrook&Russell,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Laboratory Press,New York(2001),pp.1.1-1.162,15.1-15.53,16.1-16.54)。
转化方法的另一个实例是原生质体融合法,将源自携带高拷贝数的目标质粒的细菌的原生质体直接与培养的哺乳动物细胞混合。细胞膜融合后(通常使用聚乙二醇),细菌的内容物被递送进入哺乳动物细胞的胞质中,并且质粒DNA被转移进入细胞核。
电穿孔,即向多种哺乳动物和植物细胞施加短暂的高压电脉冲,导致在质膜上形成纳米尺寸的孔。通过这些孔或者由于膜成分的重新分布(伴随孔的关闭)而使DNA直接被递送进入细胞的细胞质内。电穿孔可以是非常有效率的,并且可以用于克隆的基因的瞬时表达以及用于建立携带整合拷贝的目标基因的细胞系。
此类技术可用于真核细胞的稳定转化和瞬时转化。稳定转化的细胞的分离需要在导入目标基因的同时导入可选择标志物。此类可选择标志物包括赋予对新霉素抗性的基因,以及HPRT阴性细胞中的HPRT基因。选择可能需要在选择性培养基中进行延长的培养,至少大约2-7天,优选至少大约1-5周(见,例如,Sambrook&Russell,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Laboratory Press,New York(2001),pp.16.1-16.54)。
可以从重组宿主细胞表达并纯化含有肽配体结构域的多肽。重组宿主细胞可以是原核或真核细胞,包括但不限于细菌,例如大肠杆菌;真菌细胞例如酵母;昆虫细胞,包括但不限于果蝇和蚕衍生的细胞系,以及哺乳动物细胞和细胞系。当体外或在体内在细胞例如人类细胞中表达含有肽配体结构域的多肽时,可以就给定的细胞类型(即物种)对选择用于编码肽的多核苷酸进行优化。很多用于密码子优化的技术是本领域已知的(见,例如,Jayaraj et al,Nucleic Acids Res.33(9):3011-6(2005);Fuglsang et al.,Protein Expr.Purif.31(2):247-9(2003);Wu et al.,"The Synthetic Gene Designer:a Flexible Web Platform to Explore Sequence Space of Synthetic Genes for Heterologous Expression,"csbw,2005IEEE Computational Systems Bioinformatics Conference-Workshops(CSBW'05),pp.258-259(2005))。
在原核细胞中进行最佳的多肽表达时必须考虑的问题包括:所用的表达系统、宿主菌株的选择、mRNA的稳定性、密码子偏好性、包涵体的形成和防止、融合蛋白和位点特异性蛋白水解、腔室导向的分泌(见Sorensen et al.,Journal of Biotechnology 115(2005)113-128,通过引用方式并入本文)。
通常从遗传背景相容性系统携带的质粒诱导表达。表达质粒的遗传元件包括复制起点(ori)、抗生素抗性标志物、转录启动子、翻译起始区(TIR)以及转录和翻译终止子。
可以使用任何合适的表达系统,例如大肠杆菌由于其相对的简单性、高密度培养、熟知的遗传学和大量的相容性工具(包括可用于多肽表达的多种可获得的质粒,重组融合伴侣和突变菌株)而有助于蛋白表达。用于重组表达的大肠杆菌菌株或遗传背景是非常重要的。表达菌株应该缺乏最有害的天然蛋白酶,维持表达质粒稳定,并且提供与表达系统相关的遗传元件(例如DE3)。
质粒拷贝数由复制起点控制,优选以松弛的方式复制(Baneyx,1999)。存在于现代的表达质粒中的ColEl复制子源自pBR322(拷贝数15-20)或pUC(拷贝数500-700)质粒家族,而p15A复制子源自pACYC184(拷贝数10-12)。重组表达质粒中最常见的药物抗性标志物赋予对氨比西林、卡那霉素、氯霉素或四环素的抗性。
大肠杆菌表达系统包括基于T7的pET表达系统(由Novagen商业化)、λPL启动子/cI阻抑子(例如,Invitrogen pLEX)、Trc启动子(例如,Amersham Biosciences pTrc)、Tac启动子(例如,Amersham Biosciences pGEX)和杂合lac/T5(例如,Qiagen pQE)和BAD启动子(例如,Invitrogen pBAD)。
从转录的信使RNA的翻译起始区(TIR)进行的翻译起始需要核糖体结合位点(RBS),包括Shine-Dalgarno(SD)序列和翻译起始密码子。Shine-Dalgarno序列位于起始密码子上游7±2个核苷酸处,在有效的重组表达系统中,起始密码子是规范的AUG。从具有SD序列UAAGGAGG的mRNA获得最佳的翻译起始。
大肠杆菌中的密码子使用由细胞质中可获得的同源的氨基-酰基化tRNA的水平反映。主要密码子存在于高水平表达的基因中,而少数或罕见密码子倾向于在低水平表达的基因中。在大肠杆菌中罕见的密码子在来源于具有不同密码子频率偏向的来源例如真核细胞、古细菌和其它远相关的生物的异源基因中通常是丰富的(Kane,1995)。含有罕见密码子的基因的表达可能导致翻译错误,这是由于在需要引入偶联于少数密码子tRNA的氨基酸的位置处核糖体停滞所致(McNulty et al.,2003)。当含有成簇(例如双重和三重)的罕见密码子的转录本大量积累时,密码子偏向问题在重组表达系统中变得至关重要。
蛋白活性需要折叠成精确的三维结构。压力状况例如热休克会破坏体内的折叠,折叠中间体倾向于结合成无定形的蛋白颗粒,其被称作包涵体。
包涵体是一组结构上复杂的聚合体,通常被理解为当以高水平表达重组蛋白时作为压力应答而发生。大肠杆菌的细胞质中浓度为200-300mg/ml的蛋白的大分子量密集暗示高度不利的蛋白折叠环境,尤其是在高水平重组表达过程中(van den Berg et al.,1999)。尚不知道包涵体是通过非折叠链上暴露的碎片之间的疏水相互作用而发生的被动事件而形成还是通过特定的聚集机制而形成(Villaverde and Carrio,2003)。可以使用去污剂例如脲和盐酸胍溶解纯化的聚集体。可以通过稀释、透析或柱上重折叠方法,从溶解的包涵体中在体外进行重折叠以制备天然蛋白(Middelberg,2002;et al.,2003a)。
可以通过加入分子伴侣来改善重折叠策略(Mogk et al.,2002)。然而,对于给定的蛋白,重折叠程序的优化需要耗时的努力,并不总是产生高的产品产率。防止形成包涵体的可能的策略是共同过表达分子伴侣。
已经开发了多种蛋白融合配对物以简化重组蛋白的纯化和表达(Stevens,2000)。融合蛋白或嵌合蛋白通常包括经由特异性蛋白酶的识别位点而连接于乘客蛋白(passenger protein)或靶蛋白的配对物或“标签”。多数融合配对物用于特异性亲和纯化策略。融合配对物在体内也是有利的,其中它们可以保护乘客蛋白免受细胞内蛋白水解(Jacquet et al.,1999;Martinez et al.,1995)、增强溶解性(Davis et al.,1999;Kapust and Waugh,1999;et a l.,2003b)或用作特异性表达报告蛋白(Waldo et al.,1999)。高表达水平通常可以从N-末端融合配对物转移至低表达的乘客蛋白,最有可能是由于mRNA稳定化的结果(Arechaga et al.,2003)。常见的亲和标签是聚组氨酸标签(His-tag),其与固定化的金属亲和色谱(IMAC)相容,以及谷胱甘肽S-转移酶(GST)标签,其用于基于谷胱甘肽树脂上进行的纯化。还有数种其它的亲和标签并且已经进行了深入评论(Terpe,2003)。
原则上可以将重组表达的蛋白导向三个不同的位置,即细胞质、周质或培养基。将重组蛋白导向特定细胞区室具有不同的优点和缺点。在细胞质中表达通常是优选的,因为产率高。在大肠杆菌中,二硫键的形成被隔离,在周质中被Dsb系统活性地催化(Rietsch and Beckwi th,1998)。在细胞质中,硫氧还蛋白和谷氧还蛋白实现半胱氨酸的还原。硫氧还蛋白还原酶使硫氧还蛋白保持还原,谷胱甘肽使谷氧还蛋白保持还原。谷胱甘肽还原酶使低分子量的谷胱甘肽分子还原。编码这两种还原酶的trxB和gor基因的破坏允许在大肠杆菌细胞质中形成二硫键。
就产生的蛋白的质量和数量而言,基于细胞的表达系统具有缺点,并且并不总是适合于高通量生产。可以通过使用无细胞翻译系统来克服很多这些缺点。
已经针对很多不同的原核和真核系统描述了用于体外基因表达和蛋白合成的无细胞系统(见Endo&Sawasaki Current Opinion in Biotechnology 2006,17:373-380)。真核的无细胞系统,例如兔网织红细胞裂解物和小麦胚提取物,是从包含体外转录RNA模板的翻译所需的所有成分的粗提取物制备而来的。真核的无细胞系统使用体内或体外合成的分离的RNA作为模板以进行翻译反应(例如兔网织红细胞裂解物系统或小麦胚提取物系统)。偶联的真核无细胞系统组合了原核噬菌体RNA聚合酶与真核提取物,并且利用具有噬菌体启动子的外源DNA或由PCR产生的模板以进行体外蛋白合成(例如,偶联的网织红细胞裂解物)。
使用偶联系统翻译的蛋白可用于多种类型的功能性研究。偶联的转录/翻译反应传统地被用于确认开放阅读框,研究蛋白突变和在体外制备蛋白以用于蛋白-DNA结合研究,蛋白活性测定,或蛋白-蛋白相互作用研究。最近,使用偶联系统表达的蛋白已经被用于确认酵母双杂交反应的测定法中,进行体外表达克隆(IVEC)和制备用于酶活性或蛋白修饰测定的蛋白底物。关于在多种应用中使用偶联系统的最近的文献的列举,请访问www.promega.com/citations/。
在原核系统中,转录和翻译通常是偶联的;即,它们包含内源性的或噬菌体RNA聚合酶,其从外源DNA模板转录mRNA。然后,该RNA用作翻译的模板。DNA模板可以是克隆进入质粒载体的基因(cDNA)或由PCR产生的模板。在原核系统中翻译的模板需要核糖体结合位点(RBS)。在转录过程中,mRNA的5’末端可用于核糖体结合和翻译起始,允许同时发生转录和翻译。可以获得使用含有原核启动子(例如lac或tac;用于环状和线性DNA的大肠杆菌S30提取物系统)的DNA模板或含有噬菌体RNA聚合酶启动子的DNA模板(用于环状DNA的大肠杆菌T7S30提取物系统)的原核系统。可以通过本领域已知的方法改善纯化的含有肽配体结构域的多肽的溶解性。例如,为了增强表达的蛋白(例如,在大肠杆菌中表达的)的溶解性,可以通过降低生长温度、使用较弱的启动子、使用低拷贝数的质粒、降低诱导剂浓度、改变生长培养基来降低蛋白合成速率,见Georgiou&Valax(Current Opinion Biotechnol.7:190-197(1996))的描述。这会降低蛋白合成速率,通常会获得更可溶的蛋白。也可以添加正确折叠或蛋白稳定性必不可少的辅基或辅因子,或添加缓冲剂以控制生长过程中培养基中的pH波动,或添加1%的葡萄糖以阻止乳糖(在多数富集培养基例如LB、2xYT中存在乳糖)对lac启动子的诱导。也可以向培养基中添加多元醇(例如山梨醇)和蔗糖,因为这些添加物引起的渗透压的升高会导致细胞中渗透保护剂的积累,渗透保护剂会稳定天然蛋白的结构。可以添加乙醇、低分子量的硫醇和二硫化物和NaCl。此外,可以与需要的多肽共表达伴侣和/或折叠酶。分子伴侣通过与折叠中间体的瞬时相互作用而促进正确的异构化和细胞靶向。大肠杆菌伴侣系统包括但不限于:GroES-GroEL、DnaK-DnaJ-GrpE、CIpB。
折叠酶加速折叠途径中的限速步骤。有三种类型的折叠酶具有重要作用:肽基脯氨酰顺式/反式异构酶(PPI's)、二硫化物氧化还原酶(DsbA)和二硫化物异构酶(DsbC),蛋白二硫化物异构酶(PDI),后者是真核蛋白,其催化蛋白半胱氨酸氧化和二硫键异构化。这些蛋白中的一种或多种与靶蛋白的共表达可以引起产生更高水平的可溶性靶蛋白。
可以以融合蛋白的形式产生包含肽配体结构域的多肽,以改善其溶解性和产量。所述融合蛋白包含含有肽配体结构域的多肽和在框内融合在一起的第二多肽。所述第二多肽可以是本领域已知的融合配对物以改善与其融合的多肽的溶解性,例如,NusA、细菌铁蛋白(BFR)、GrpE、硫氧还蛋白(TRX)和谷胱甘肽-S-转移酶(GST)。Novagen Inc.(Madison,WI)提供了pET 43.1载体系统,其允许形成NusA-靶标融合物。已经表明:当用作融合配对物时,DsbA和DsbC对表达水平具有积极影响,因此它们可用于与肽配体结构域融合以实现较高的溶解性。
在此类融合蛋白的一个方面,表达的含有肽配体结构域的多肽包括连接子多肽,所述连接子多肽包含蛋白酶切割位点,所述蛋白酶切割位点包括可被蛋白酶水解的肽键。结果,可以在表达之后通过蛋白水解使多肽中的肽配体结构域与多肽的其余部分分离。所述连接子可以在蛋白酶的催化位点相结合的所述键的任一侧包含一个或多个另外的氨基酸,(见,例如,Schecter&Berger,Biochem.Biophys.Res.Commun.27,157-62(1967))。或者,连接子的切割位点可以与蛋白酶的识别位点间隔开,并且两个切割位点与识别位点可以被一个或多个(例如2-4个)氨基酸间隔开。在一个方面,连接子包含至少大约2、3、4、5、6、7、8、9、大约10、大约20、大约30、大约40、大约50或更多个氨基酸。更优选地,连接子长度为大约5至大约25个氨基酸,最优选地,连接子长度是大约8至大约15个氨基酸。
在以下文献中讨论了可用于本发明的一些蛋白酶:Hooper et al.,Biochem.J.321:265-279(1997);Werb,Cell 91:439-442(1997);Wolfsberg et al.,J.Cell Biol.131:275-278(1995);Murakami&Etlinger,Biochem.Biophys.Res.Comm.146:1249-1259(1987);Berg et al.,Biochem.J.307:313-326(1995);Smyth and Trapani,Immunology Today 16:202-206(1995);Talanian et al.,J.Biol.Chem.272:9677-9682(1997);and Thornberry et al.,J.Biol.Chem.272:17907-17911(1997)。根据本发明,也可以使用细胞表面蛋白酶和可切割的连接子,包括但不限于:氨肽酶N;嘌呤霉素敏感性氨肽酶;血管紧张素转化酶;焦谷氨酰肽酶II;二肽基肽酶IV;N-精氨酸二元转化酶;内肽酶24.15;内肽酶24.16;淀粉样蛋白前体蛋白分泌酶α、β和γ;血管紧张素转化酶分泌酶;TGFα分泌酶;TNFα分泌酶;FAS配体分泌酶;TNF受体-I和TNF受体-II分泌酶;CD30分泌酶;KL1和KL2分泌酶;IL6受体分泌酶;CD43、CD44分泌酶;CD16-I和CD16-II分泌酶;L-选择素分泌酶;叶酸受体分泌酶;MMP 1、2、3、7、8、9、10、11、12、13、14和15;尿激酶纤溶酶原激活剂;组织纤溶酶原激活物;纤溶酶;凝血酶;BMP-1(前胶原C-肽酶);ADAM 1、2、3、4、5、6、7、8、9、10和11;以及Granzymes A、B、C、D、E、F、G和H。
依赖于细胞相关蛋白酶的替代性方式是使用自我切割的连接子。例如,口足病病毒(FMDV)2A蛋白酶可用作连接子。其是17个氨基酸的短的多肽,其在2A/2B接合点切割FMDV的多聚蛋白。FMDV 2A前肽的序列是NFDLLKLAGDVESNPGP。切割发生于肽C-末端的最后的甘氨酸-脯氨酸氨基酸对处,并且不依赖于其它FMDV序列的存在,即使在存在异源序列的情况下也切割。
可以单独使用亲和色谱或与离子交换、分子筛或HPLC色谱技术联合用于纯化含有肽配体结构域的多肽。可以使用柱或以批式形式进行此类色谱技术。此类色谱纯化方法是本领域熟知的。
另外,本发明提供了编码含有肽配体结构域的多肽的分离的核酸,所述多肽在SEQ ID NO:1-117的序列中具有一个或多个氨基酸替换和插入或缺失:大约1至大约5个氨基酸,优选大约1至大约3个氨基酸,更优选1个氨基酸,其中相关性质基本上类似于原始肽显示出的性质。
可以通过本领域已知的数种方法中的任意方法进行诱变。一般而言,可以通过将核酸序列克隆进入质粒或一些其它的易于操作序列的载体来进行诱变。然后,鉴定或在核酸序列中插入可以向所述核酸序列中添加另外的核酸的独特限制性位点。通常从重叠的合成单链正义和反义寡核苷酸中产生双链的合成寡核苷酸,从而所述双链寡核苷酸中引入侧接靶序列的限制性位点,并且例如可用于引入替代性DNA。以限制性酶切割质粒或其它载体,将具有相容性粘末端的寡核苷酸序列连接进入质粒或其它载体中以替换原始DNA。
其它体外定点诱变方法是本领域技术人员已知的并且是可实现的(尤其是,使用重叠延伸聚合酶链式反应(PCR),见,例如,Parikh&Guengerich,Biotechniques 24:428-431(1998))。与变化位点重叠的互补性引物可用于在混合物中PCR扩增完整质粒,所述混合物包含500mM dNTP,2单位的Pfu聚合酶,250ng每种正义和反义引物,以及200ng包含编码含有肽配体结构域的多肽的序列的质粒DNA。PCR优选包括18个循环,对于每Kb的DNA,延伸时间为2.5分钟。可以以DpnI(其仅消化腺嘌呤甲基化的质粒DNA)处理PCR产物,并转化进入大肠杆菌DH5α细胞。可以通过限制性酶消化就引入的变化来筛选转化子,然后可以通过DNA序列分析来确认。
合适的蛋白检测和含有肽配体结构域的多肽的定量测定方法包括Western印迹、酶联免疫吸附测定(ELISA)、银染、BCA测定(见,例如,Smith et al.,Anal.Biochem.,150,76-85(1985))、Lowry蛋白测定(描述于,例如,Lowry et al.,J.Biol.Chem.,193,265-275(1951))(其是基于蛋白-铜复合物的比色测定),以及Bradford蛋白测定(描述于,例如,Bradford et al.,Anal.Biochem.,72,248(1976))(其依赖于蛋白结合之后考马斯蓝G-250的吸光率的变化)。一旦被表达,可以通过传统的纯化方法来纯化含有肽配体结构域的多肽,例如离子交换、大小排阻或C18色谱。
III.偶联肽配体结构域的方法
用于将合适的活性试剂例如治疗剂、化疗剂、放射性核素、多肽等“偶联”(或“缀合”或“交联”)至含有肽配体结构域的多肽上的方法在本领域有完善的描述。在制备本文提供的缀合物时,通过本领域目前已知用于连接两个部分的任意方法将活性试剂直接或间接连接至肽配体结构域,只要缀合或偶联部分与肽配体结构域的连接不实质上妨碍肽配体结构域的功能或实质上妨碍活性试剂的功能即可。偶联可以通过任意合适的方法进行,包括但不限于,离子和共价键,以及任意其它足够稳定的结合,由此将调节被靶向的试剂的分布。
用于在氨基和巯基之间形成共价键以及用于向蛋白中导入巯基的多种异双官能交联剂是本领域技术人员已知的(见,例如,Cumber et al.(1992)Bioconjugate Chem.3':397 401;Thorpe et al.(1987)Cancer Res.47:5924 5931;Gordon et al.(1987)Proc.Natl.Acad.Sci.84:308 312;Walden et al.(1986)J.MoI.Cell Immunol.2:191197;Carlsson et al.(1978)Biochem.J.173:723 737;Mahan et al.(1987)Anal.Biochem.162:163 170;Wawryznaczak et al.(1992)Br.J.Cancer 66:361 366;Fattom et al.(1992)Infection&Immun.60:584 589)。这些试剂可用于在肽配体结构域或含有肽配体结构域的多肽与本文公开的任意活性试剂之间形成共价键。这些试剂包括但不限于:N-琥珀酰亚胺-3-(2-吡啶二硫)丙酸酯(SPDP;二硫化物连接子);硫代琥珀酰亚胺6-[3-(2-吡啶二硫)丙酰氨基]己酸酯(硫代-LC-SPDP);琥珀酰亚胺氧基羰基-α-甲基苄基硫代硫酸酯(SMBT,受阻的二硫酸酯连接子);琥珀酰亚胺6-[3-(2-吡啶二硫)丙酰氨基]己酸酯(LC-SPDP);硫代琥珀酰亚胺4-(N-马来酰亚胺甲基)环己烷-1-羧酸酯(硫代-SMCC);琥珀酰亚胺3-(2-吡啶二硫)丁酸酯(SPDB;受阻的二硫键连接子);硫代琥珀酰亚胺2-(7-叠氮-4-甲基香豆素-3-乙酰胺)乙基-1,3-二硫丙酸酯(SAED);硫代-琥珀酰亚胺7-叠氮-4-甲基香豆素-3-乙酸酯(SAMCA);硫代琥珀酰亚胺6-[α-甲基-α-(2-吡啶二硫)甲苯酰胺(toluamido)]己酸酯(硫代-LC-SMPT);l,4-二-[3'-(2'-吡啶二硫)丙酰氨基]丁烷(DPDPB);4-琥珀酰亚胺氧基羰基-α-甲基-α-(2-吡啶硫)-甲苯(SMPT,受阻的二硫酸酯连接子);硫代琥珀酰亚胺6[α-甲基-α-(2-吡啶二硫)甲苯酰胺]己酸酯(硫代-LC-SMPT);m-马来酰亚胺苯甲酰-N-羟基琥珀酰亚胺酯(MBS);m-马来酰亚胺苯甲酰-N-羟基硫代琥珀酰亚胺酯(硫代-MBS);N-琥珀酰亚胺(4-碘乙酰)氨基苯甲酸酯(SIAB;硫醚连接子);硫代琥珀酰亚胺(4-碘乙酰)氨基苯甲酸酯(硫代-SIAB);琥珀酰亚胺4(对马来酰亚胺苯基)丁酸酯(SMPB);硫代琥珀酰亚胺-4-(对马来酰亚胺苯基)丁酸酯(硫代-SMPB);叠氮苯甲酰基酰肼(ABH)。
其它的异双官能可切割的偶联剂包括:N-琥珀酰亚胺(4-碘乙酰)-氨基苯甲酸酯;硫代琥珀酰亚胺(4-碘乙酰)-氨基苯甲酸酯;4-琥珀酰亚胺-氧基羰基-a-(2-吡啶二硫)-甲苯;硫代琥珀酰亚胺-6-[a-甲基-a-(吡啶二硫)-甲苯酰胺]己酸酯;N-琥珀酰亚胺-3-(-2-吡啶二硫)-丙酸酯;琥珀酰亚胺6[3(-(-2-吡啶二硫)-丙酰氨基]己酸酯;硫代琥珀酰亚胺6[3(-(-2-吡啶二硫)-丙酰氨基]己酸酯;3-(2-吡啶二硫)-丙酰肼,Ellman氏试剂,二氯三嗪酸(dichlorotriazinic acid),S-(2-硫吡啶)-L-半胱氨酸。另外的示例性的双官能连接化合物公开于美国专利号5,349,066、5,618,528、4,569,789、4,952,394和5,137,877。
或者,可以使用例如多肽硫氢基进行缀合。另外,与糖蛋白例如抗体结合的糖部分可以被氧化以形成可用于本领域已知的多种偶联程序的醛基。根据本发明形成的缀合物在体内可以是稳定的或不稳定的,例如可酶促降解的四肽键或酸不稳定性的顺式-乌头酰(aconityl)或腙键。
任选地,含有肽配体结构域的多肽通过一个或多个连接子与活性试剂连接。连接子部分根据所需的性质来选择。例如,可以选择连接子部分的长度以优化配体结合的动力学和特异性,包括由于配体与靶受体结合而诱导的任何构象变化。连接子部分的长度和灵活性应该足以允许多肽配体部分与靶细胞受体自由地相互作用。如果连接子太短或太刚硬,则在多肽配体部分与细胞毒素之间可能会有空间位阻。如果连接子部分太长,则活性试剂可能在生产过程中被降解,或者可能不会将所需的效应有效递送至靶细胞。
本文中可以使用本领域技术人员已知的任意合适的连接子。一般而言,那些是融合蛋白的缀合物中将使用与通过化学方式产生的缀合物中的连接子不同的一组连接子。适合用于化学连接的缀合物的连接子和键包括但不限于:二硫键、硫醚键、受阻的二硫键和自由反应基之间的共价键,例如胺和巯基。使用异双功能试剂产生这些键以在多肽中的一个或二者中产生活性巯基,然后使一个多肽上的巯基与另一个多肽上的活性巯基或胺基(其上可以连接活性马来酰亚胺基或巯基)反应。其它的连接子包括:酸可切割的连接子,例如双马来酰亚胺乙氧基丙烷(bismaleimideothoxy propane),酸不稳定性转铁蛋白缀合物和己二酸二酰肼,其将在更加酸性的细胞内区室内被切割;在暴露于UV或可见光后被切割的交联连接子,以及连接子。在一些实施方式中,可以包括数种连接子以利用每种连接子的优点。可以通过将连接子共价偶联至含有肽配体结构域的多肽和被靶向的试剂来插入化学连接子和肽连接子。如下文描述的异双官能试剂可用于进行此类共价偶联。还可以通过以融合蛋白形式表达编码连接子和肽配体结构域的DNA,编码连接子和活性试剂的DNA,或者编码肽配体结构域、连接子和活性试剂的DNA来连接肽连接子。在本文中也考虑单独使用或与其它连接子一起使用弹性连接子和增加缀合物溶解性的连接子。
因此,连接子可以包括但不限于:肽键、氨基酸和肽键,其通常包含1至大约30个氨基酸,更优选大约10至30个氨基酸。或者,化学连接子,例如异双官能可切割的关联连接子,包括但不限于:N-琥珀酰亚胺(4-碘乙酰)-氨基苯甲酸酯;硫代琥珀酰亚胺(4-碘乙酰)-氨基苯甲酸酯;4-琥珀酰亚胺-氧基羰基-a-(2-吡啶二硫)-甲苯;硫代琥珀酰亚胺-6-[a-甲基-a-(吡啶二硫)-甲苯酰胺]己酸酯;N-琥珀酰亚胺-3-(-2-吡啶二硫)-丙酸酯;琥珀酰亚胺6(3(-(-2-吡啶二硫)-丙酰氨基)己酸酯;硫代琥珀酰亚胺6(3(-(-2-吡啶二硫)-丙酰氨基)己酸酯;3-(2-吡啶二硫)-丙酰肼,Ellman氏试剂,二氯三嗪酸,和S-(2-硫吡啶)-L-半胱氨酸。
其它的连接子包括三苯甲基连接子,尤其是衍生的三苯甲基以产生一类缀合物,其提供在不同的酸度或碱度时释放治疗剂。通过预先选择治疗剂被释放时的pH范围而提供的灵活性允许基于需要递送治疗剂的组织之间的已知的生理差异来选择连接子(见,例如,美国专利号5,612,474)。例如,肿瘤组织的酸度似乎比正常组织低。
也可以使用酸可切割的连接子,光可切割的连接子和热敏感性连接子,尤其是在需要切割被靶向的试剂以允许其更容易地进入反应的情况下。酸可切割的连接子包括但不限于:二马来酰亚胺乙氧基丙烷和己二酸二酰肼连接子(见,例如,Fattom et al.(1992)Infection&Immun.60:584 589),以及酸不稳定性转铁蛋白缀合物,其包含足够的转铁蛋白部分以允许进入细胞内转铁蛋白循环途径(见,例如,Welhoner et al.(1991)J.Biol.Chem.266:4309 4314)。光可切割的连接子是在暴露于光后被切割的连接子(见,例如,Goldmacher et al.(1992)Bioconj.Chem.3:104 107,该连接子通过引用方式并入本文),从而在暴露于光后释放被靶向的试剂。在暴露于光后被切割的光可切割的连接子是已知的(见,例如,Hazum et al.(1981)in Pept,Proc.Eur.Pept.Symp.,16th,Brunfeldt,K(Ed),pp.105 110,其描述了使用硝基苯甲基作为用于半胱氨酸的光可切割的保护性基团;Yen et al.(1989)Makromol.Chem 190:69 82,其描述了水溶性的光可切割的共聚物,包括羟基丙基甲基丙烯酰胺共聚物、甘氨酸共聚物、荧光素共聚物和甲基罗丹明共聚物;Goldmacher et al.(1992)Bioconj.Chem.3:104 107,其描述了在暴露于近紫外光(350nm)后发生蛋白水解降解的交联剂和反应剂;和Senter et al.(1985)Photochem.Photobiol 42:231 237,其描述了硝基苄氧基羰基氯化物交联反应剂,其产生光可切割的键),从而在暴露于光之后释放被靶向的试剂。此类连接子在治疗可以使用纤维光学暴露于光的皮肤或眼科病况中是特别有用的。施用缀合物之后,可以使眼睛或皮肤或身体的其它部分暴露于光,从而使被靶向的部分从缀合物中释放。此类光可切割的连接子可以与诊断程序联合使用,其中需要除掉靶向试剂以允许迅速从动物体内清除。
IV.本发明提供了多种活性试剂
本发明的多个方面涉及偶联于活性试剂即治疗或诊断剂的含有肽配体结构域的多肽。
如本文使用的术语“治疗剂”是指化学化合物,生物大分子,或从怀疑具有治疗性质的生物材料例如细菌、植物、真菌或动物(尤其是哺乳动物)细胞或组织制备的提取物,例如化疗剂或放疗剂。如本文使用的术语“治疗”是指缓解折磨哺乳动物受试者的疾病或相关病况的影响,治愈或预防(举例而言,预防或减少靶向的疾病例如癌症或其它增殖性疾病的机会)折磨哺乳动物受试者的疾病或相关病况。治愈性治疗是指全部或部分地减轻哺乳动物中存在的疾病或病况。
试剂可以是纯化的、实质上纯化的或部分纯化的。此外,此类治疗剂可以在脂质体或免疫脂质体中或与之结合,缀合可以直接与所述试剂进行或与所述脂质体/免疫脂质体进行。“脂质体”是由多种类型的脂、磷脂和/或表面活性剂组成的小囊泡,其可用于递送药物(例如,药物、抗体、毒素)。脂质体的成分通常以类似于生物膜的脂排列的双层形式排列。
可以按照本发明考虑到的方式偶联于含有肽配体结构域的多肽的示例性治疗剂包括但不限于:化疗剂(例如,多西紫杉醇,紫杉醇,紫杉烷类化合物和铂化合物),抗叶酸类,抗代谢药物,抗有丝分裂剂,DNA损伤剂,促凋亡剂,分化诱导剂,抗血管生成剂,抗生素,激素,肽,抗体,酪氨酸激酶抑制剂,生物活性剂,生物分子,放射性核素,阿霉素,安沙霉素抗生素,天冬酰胺酶,博莱霉素,白消安,顺铂,卡铂,卡莫司汀,卡培他滨,苯丁酸氮芥,阿糖胞苷,环磷酰胺,喜树碱,达卡巴嗪,更生霉素,柔红霉素,右雷佐生,多西紫杉醇,多柔比星,依托泊苷,埃坡霉素类,氟尿苷,氟达拉滨,氟尿嘧啶,吉西他滨,羟基脲,去甲氧柔红霉素,异环磷酰胺,伊立替康,洛莫司汀,氮芥,巯基嘌呤,美法仑,甲氨蝶呤,雷帕霉素(西罗莫司),丝裂霉素,米托坦,米托蒽醌,硝基脲,紫杉醇,帕米膦酸钠,喷司他丁,光神霉素,甲基苄肼,利妥昔单抗,链脲菌素,替尼泊苷,硫鸟嘌呤,塞替派,紫杉烷类,长春碱,长春新碱,长春瑞滨,泰素,康普立停,迪科莫奈得(discodermolides),反铂,高金雀花碱(genistein)和其它化疗剂。
如本文使用的术语“化疗剂”是指具有抗癌症、肿瘤发生和/或增殖性疾病的活性的试剂。优选的化疗剂包括:包含白蛋白的颗粒形式的多西紫杉醇和紫杉醇,其中50%以上的化疗剂是纳米颗粒的形式。最优选地,化疗剂包含与白蛋白结合的紫杉醇的颗粒,例如
合适的治疗剂还包括,例如,生物活性试剂(tTF的TNF),放射性核素(131I,90Y,111In,211At,32P和其它已知的治疗性放射性核素),抗血管生成剂(血管生成抑制剂,例如,INF-α,烟曲霉素,血管抑素,内皮抑素,萨利多胺等),其它生物活性多肽,治疗致敏剂,抗体,植物凝血素和毒素。
适合应用本发明的疾病包括恶性和良性病况,以及增殖性疾病,包括但不限于,其中增殖性疾病是例如良性前列腺增生、子宫内膜异位症、子宫内膜增生、动脉硬化症、牛皮癣、免疫增殖或增殖性肾小球病。
术语“治疗上有效量”意思是部分或完全回复至与疾病或病况相关或诱发疾病或病况的正常生理或生化参数的量。本领域技术人员应该能够确定相对于特定疾病或病况在治疗上有效的药物组合物的量。举例而言,根据其中治疗剂是紫杉醇的优选实施方式,施用的紫杉醇剂量可以是大约30mg/m2至大约1000mg/m2,服药循环为大约三周(即,大约每三周施用一剂紫杉醇),优选大约50mg/m2至大约800mg/m2,优选大约80mg/m2至大约700mg/m2,最优选大约250mg/m2至大约300mg/m2,服药循环为大约三周,优选以大约2周循环,更优选每周循环。
本发明还具有诊断性的方面。例如,诊断剂可以是示踪剂或标记物,包括但不限于:放射活性试剂、MRI造影剂、X射线造影剂、超声造影剂以及PET造影剂。本发明的这个方面也考虑到这些试剂(如就治疗剂所描述)的偶联。此外,术语“诊断上有效量”是在相关的临床环境中允许合理地精确测定组织和器官中的异常增殖、增生、重构、炎性活性的存在和/或程度的药物组合物的量。例如,根据本发明“诊断”的病况可以是良性或恶性肿瘤。
本文教导的诊断剂包括多肽,例如抗体,其可以通过共价或非共价连接提供可检测信号的物质而进行标记。多种标记物和缀合技术是已知的,并且在科技和专利文献中进入了深入报道。合适的标记物包括放射性核素、酶、底物、辅因子、抑制剂、荧光部分、化学发光部分、磁性颗粒等。教导了此类标记物的用途的专利包括美国专利号3,817,837;3,850,752;3,939,350;3,996,345;4,277,437;4,275,149;和4,366,241。同样,可以产生重组免疫球蛋白,见Cabilly的美国专利号4,816,567;Moore等人的美国专利号4,642,334;和Queen等人(1989)Proc.Nat'l Acad.Sci.USA 86:10029-10033。
可以通过任意合适的方法来监视和测定经由本发明的组合物和方法递送至肿瘤或其它疾病位点的治疗或诊断剂,所述方法包括例如,向组合物中添加放射活性标记物或放射不透性标记物并成像,这视情况而定,并且是本领域普通技术人员所熟知的。可以通过任意合适的方法包括例如静脉穿刺来监测组合物在血浆区室内的隔离。
此外,在相关的方面,本发明提供了预测或测定肿瘤对化疗剂的响应的方法,以及预测或测定增殖性疾病对化疗剂的应答或治疗增殖性疾病的方法,包括但不限于,其中所述增殖性疾病是例如良性前列腺增生、子宫内膜异位、子宫内膜增生、动脉硬化症、牛皮癣、免疫增殖或增殖性肾小球病。
V.本发明提供了将肽配体结构域与多肽活性试剂偶联的融合蛋白
本发明还考虑到将肽配体结构域与多肽活性试剂偶联于融合蛋白中。例如但不限于,可以将肽配体结构域序列融合于诊断上有用的蛋白结构域(例如半抗原、GFP)、治疗致敏剂、活性蛋白结构域(例如但不限于,tTF、TNF、Smar1衍生的p44肽、干扰素、TRAIL、Smac、VHL、前半胱天冬酶、半胱天冬酶和IL-2)或毒素(例如但不限于,篦麻毒素、PAP、白喉毒素、假单胞菌外毒素)的上游或下游。
“融合蛋白”和“融合多肽”是指具有至少两个彼此共价连接的部分的多肽,其中每个部分是具有不同性质的多肽。所述性质可以是生物学性质,例如体外或体内的活性。所述性质也可以是简单的化学或物理性质,例如与靶分子结合、催化反应等。所述部分可以通过单一的肽键直接连接或通过含有一个或多个氨基酸残基的肽连接子连接。一般而言,所述部分和所述连接子将彼此处于读码框内。
VI.抗体或抗体片段活性剂
在本发明的一个具体方面,治疗剂可以是抗体或抗体片段,其介导下列一项或多项:补体激活,细胞介导的细胞毒性,细胞凋亡,坏死性细胞死亡和调理作用。
本文中的术语“抗体”包括但不限于,单克隆抗体、多克隆抗体、二聚体、多聚体、多特异性抗体(例如双特异性抗体)。抗体可以是鼠的、人的、人源化的、嵌合的或源自其它物种。抗体是通过免疫系统产生的蛋白,其能够识别并结合特异性抗原。靶抗原一般具有被多个抗体上的CDR识别的多个结合位点,也称作表位。与不同表位特异性结合的每种抗体具有不同的结构。因此,一种抗原可以具有不止一种对应的抗体。抗体包括全长免疫球蛋白分子或全长免疫球蛋白分子的免疫活性部分,即,含有免疫特异性地结合目标靶抗原或其部分的抗原结合位点的分子,此类靶标包括但不限于,产生与自身免疫病相关的自身免疫抗体的癌细胞。本文公开的免疫球蛋白可以是任意种类(例如,IgG,IgE,IgM,IgD和IgA)或亚类(例如,IgGl,IgG2,IgG3,IgG4,IgA1和IgA2)的免疫球蛋白分子。免疫球蛋白可以源自任意物种。
“抗体片段”包括全长抗体的保持所需生物活性的部分。“抗体片段”通常是抗原结合区或其可变区。抗体片段的实例包括:Fab,Fab',F(ab')2和Fv片段;diabodies;线性抗体;通过Fab表达文库产生的片段;抗-特异型(抗-Id)抗体;CDR(互补决定区)和与癌细胞抗原、病毒抗原或微生物抗原免疫特异性结合的上述任意项的表位结合片段;单链抗体分子;和从抗体片段形成的多特异性抗体。然而,本文所述的“抗体片段”也可以是抗体的其它非抗原结合部分,例如但不限于,抗体片段可以是完整的或部分的Fc结构域。
单克隆抗体在本文中具体包括“嵌合”抗体,其中重链和/或轻链的一部分与源自特定物种的抗体或属于特定抗体类或亚类的抗体中的相应序列相同或同源,而链的其余部分与源自另一物种的抗体或属于另一抗体类或亚类的抗体中的相应序列相同或同源;以及此类抗体的片段,只要它们显示出需要的生物学活性(美国专利号4,816,567)。本文中的目标嵌合抗体包括“灵长类源化的”抗体,其包含源自非人灵长类(例如旧世界猴或Ape)的可变域抗原结合序列和人类恒定区序列。
“抗体依赖性细胞介导的细胞毒性”和“ADCC”是指细胞介导的反应,其中表达Fc受体(FcR)的非特异性细胞毒性细胞(例如天然杀伤(NK)细胞、嗜中性粒细胞和巨噬细胞)识别靶细胞上结合的抗体,随后引起靶细胞的裂解。介导ADCC的主要细胞NK细胞仅表达FcγRIII,而单核细胞表达FcγRI,FcγRII和FcγRIII。为了测定目标分子的ADCC活性,可以进行体外ADCC测定(美国专利号55,003,621;U.S.Pat.No.5,821,337)。用于此类测定的有用的效应子细胞包括外周血单个核细胞(PBMC)和天然杀伤(NK)细胞。可替代的或另外,可以在体内测定目标分子的ADCC活性,例如,在动物模型例如在Clynes et al.PNAS(USA),95:652-656(1998)中公开的动物模型中测定。
“诱导细胞死亡”的抗体是引起活细胞变得不存活的抗体。可以在不存在补体和免疫效应子分子的情况下测定体外细胞死亡,以区分抗体依赖性的细胞介导的细胞毒性(ADCC)或补体依赖性细胞毒性(CDC)诱导的细胞死亡。因此,可以使用热灭活的血清(即在不存在补体的情况下)和不存在免疫效应分子的情况下进行细胞死亡测定。为了测定抗体是否能够诱导细胞死亡,可以测定相对于未经处理的细胞而言膜完整性的丧失,这可以通过碘化丙啶(PI)、台盼蓝或7AAD的摄取来评价。诱导细胞死亡的抗体是在PI摄取测定中诱导BT474细胞摄取PI的那些抗体。
“诱导凋亡”的抗体是诱导程序性细胞死亡的抗体,如通过膜联蛋白V的结合、DNA的片段化、细胞皱缩、内质网膨胀、细胞片段化和/或膜囊泡(称作凋亡小体)的形成来测定。
VII.调节活性试剂分布的方法
本发明的另一个方面利用了如本文公开的含有肽配体结构域的缀合物的性质以提供用于调节活性试剂在动物组织内的分布的方法,包括:向动物施用包含缀合物分子的组合物,所述缀合物分子包含缀合于活性试剂的肽配体结构域,其中所述肽配体结构域包括SEQ ID NO:1-117的肽或其同源物,并且相对于单独施用活性试剂时所获得的组织分布而言,向动物施用所述组合物引起不同的活性试剂组织分布。
本发明的组合物和方法优选地提供了活性试剂向疾病位点的经调节的组织分布。优选地,其表现为:在疾病位点提供一定浓度的活性试剂,和/或增加的或延长的(半衰期)活性试剂血液水平,其大于向动物施用活性试剂(以未缀合的形式)时提供的浓度和水平。这种调节也可以表现为:增大组织摄取缀合肽分子的速率,增加分子在其靶位点即肿瘤处的保持,增大缀合的肽分子在组织中的扩散速率,和/或增加缀合的肽分子在组织中的分布,以及,使组织摄取缀合的肽分子的速率与一种或多种组织受体的内在化速率相匹配。可以通过本领域已知的任意合适的方法来测定此类增强,包括但不限于,检测、定位和相对定量测定经适当标记的活性试剂,例如使用放射照相、显微镜、化学、免疫学或MRI技术。
“增大的速率”意思是至少大约高33%,优选至少大约高25%,更优选至少大约高15%,最优选至少大约高10%的速率。“疾病位点处较大的浓度”意思是,在疾病位点处,缀合物中的活性试剂的浓度比相当的疾病位点处未缀合的活性试剂的浓度高至少大约33%,优选高至少大约25%,更优选高至少大约15%,最优选高至少大约10%。
合适的疾病位点包括但不限于,任意身体组织包括软组织、结缔组织、骨、实体器官、血管等中的异常增殖的病况、组织重构、增生、扩大的伤口愈合的位点。此类疾病的更具体的实例包括癌症、糖尿病性或其它视网膜病变(retinopathy)、炎症、纤维化、关节炎、血管或人工血管移植物或血管内装置的再狭窄等、白内障和黄斑退化、骨质疏松症和骨的其它疾病、动脉硬化症和其它经常观察到钙化的疾病。
在优选的方面,本发明提供了诊断和/或治疗肿瘤的方法,其中所述肿瘤选自:口腔肿瘤、咽肿瘤、消化系统肿瘤、呼吸系统肿瘤、骨肿瘤、软骨肿瘤、骨转移、肉瘤、皮肤肿瘤、黑色素瘤、乳腺肿瘤、生殖系统肿瘤、尿道肿瘤、眼窝肿瘤、脑和中枢神经系统肿瘤、神经胶质瘤、内分泌系统肿瘤、甲状腺肿瘤、食道肿瘤、胃肿瘤、小肠肿瘤、结肠肿瘤、直肠肿瘤、肛门肿瘤、肝脏肿瘤、胆囊瘤、胰腺肿瘤、喉肿瘤、肺的肿瘤、支气管肿瘤、非小细胞肺癌、小细胞肺癌、子宫颈肿瘤、子宫体肿瘤、卵巢肿瘤、外阴肿瘤、阴道肿瘤、前列腺肿瘤、前列腺癌、睾丸肿瘤、阴茎肿瘤、膀胱肿瘤、肾脏肿瘤、肾孟肿瘤、输尿管肿瘤、头颈肿瘤、副甲状腺癌、霍奇金病、非霍奇金淋巴瘤、多发性骨髓瘤、白血病、急性淋巴细胞性白血病、慢性淋巴细胞性白血病、急性髓性白血病、慢性髓性白血病。此外,本发明提供了预测或确定肿瘤对化疗剂的响应的方法,治疗肿瘤的方法,用于预测哺乳动物肿瘤对化疗剂的应答的试剂盒,其中所述肿瘤是肉瘤、腺癌、鳞状细胞癌、大细胞癌、小细胞癌、基底细胞癌、透明细胞癌、癌细胞瘤(oncytoma)或其组合。
在另一方面,本发明提供了组合物和使用所述组合物的方法,其中,相对于单独使用活性试剂之后获得的血液水平,向动物施用所述组合物引起更高的活性试剂的血液水平。可以使用任意合适的活性试剂的血液水平的度量,包括但不限于,Cmax,Cmin和AUC。"大于单独施用活性试剂后获得的血液水平"意思是:高至少大约33%,优选高至少大约25%,更优选高至少大约15%,最优选高至少大约10%的血液水平。
在另一个方面,本发明提供了组合物和使用所述组合物的方法,其中,相对于单独使用活性试剂之后获得的血液水平半衰期而言,向动物施用所述组合物引起更长的活性试剂的血液水平半衰期。"大于单独施用活性试剂后获得的血液半衰期"意思是:高至少大约33%,优选高至少大约25%,更优选高至少大约15%,最优选高至少大约10%的半衰期。
VIII.制剂和施用
对于体内使用,优选将偶联于肽配体结构域例如SEQ ID NO:1-117及其同源物的活性试剂配制成包含药学上可接受的载体的药物组合物。在本发明的上下文中可以使用任意合适的药学上可接受的载体,这取决于施用途径。本领域技术人员将认识到可以用于提供适合于所需施用方法的药物组合物的那些载体。
本发明的药物组合物的施用可以通过任意合适的途径完成,包括但不限于:静脉内、皮下、肌内、腹膜内、肿瘤内、经口、经直肠、经阴道、膀胱内和吸入施用,其中静脉内和肿瘤内施用是最优选的。组合物还可以包含任意其它合适的成分,尤其是用于增强组合物的稳定性和/或其终用途。因此,本发明的组合物有多种合适的制剂。以下制剂和方法仅仅是示例性的,绝不是限制。
如果需要,药物组合物还可以包括另外的治疗剂或生物活性试剂。例如,可以存在可用于治疗特定适应症的治疗因子。控制炎症的因子例如布洛芬或类固醇可以是组合物的一部分,以减少与体内施用药物组合物相关的肿胀和炎症以及生理疼痛。
载体通常是液体,但也可以是固体,或液体与固体成分的组合。载体优选为生理上可接受的(例如药学上可接受的或药理学上可接受的)载体(例如赋形剂或稀释剂)。生理上可接受的载体是本领域熟知的并且是可以容易获得的。载体的选择将至少部分由靶组织和/或细胞的位置以及用于施用组合物的特定方法决定。
通常而言,此类组合物可以配制为可注射的液体溶液或悬浮液;也可以配制为适合用于在注射前通过添加液体来制备溶液或悬浮液的固体形式;制备物也可以是乳化的。适合于可注射用途的药物制剂包括无菌水性溶液或分散液;含有已知的蛋白稳定剂和冻干保护剂的制剂;含有芝麻油、花生油或水性丙二醇的制剂;以及用于即用即配的无菌可注射溶液或分散液的无菌粉末。在所有的情况下,制剂必须是无菌的并且其流动性必须达到容易注射的程度。其在生产和储存的条件下必须是稳定的,并且必须能抗微生物例如细菌和真菌的污染作用而保存。可以在水中通过适宜地与表面活性剂例如羟基纤维素混合来制备游离碱或药学上可接受盐形式的活性化合物的溶液。也可以在甘油、液体聚乙二醇及其混合物以及在油中制备分散液。在通常的储存和使用条件下,这些制备物含有防腐剂以阻止微生物的生长。
含有肽配体结构域的缀合物,可以配制为例如中性或盐形式的组合物。药学上可接受的盐包括酸加成盐(与蛋白质的游离氨基形成)以及与无机酸例如盐酸或磷酸形成的盐,以及与有机酸例如乙酸、草酸、酒石酸、扁桃酸等形成的盐。与游离羧基形成的盐也可以衍生自无机碱,例如氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙或氢氧化铁,以及有机碱例如异丙胺、三甲基胺、组氨酸、普鲁卡因等。
适合于非肠道施用的制剂包括水性和非水性等渗无菌注射溶液,其可以包含抗氧化剂、缓冲剂、抑菌剂和使制剂与目标接受体的血液等渗的溶质;水性和非水性的无菌悬浮液,其可以包含悬浮剂、增溶剂、增稠剂、稳定剂和防腐剂。制剂的形式可以是单元剂量或多剂的密封的容器,例如安瓿和小瓶,并且可以储存在冷冻干燥(冻干)的条件下,在临使用前,仅需要添加无菌的液体赋形剂例如用于注射的水。可以从无菌粉末、颗粒和之前描述的类型的片剂来制备即用型的注射溶液和悬浮液。在本发明的一个优选实施方式中,将含有肽配体结构域的缀合物配制为用于注射(例如,非肠道施用)。在这个意义上,所述制剂优选适合于肿瘤内施用,但也可以配制为用于静脉内注射、腹膜内注射、皮下注射等。
如果需要,本发明还提供了这样的实施方式:其中含有肽配体结构域的缀合物(即,缀合于活性试剂的含有肽配体结构域的多肽)进一步缀合于聚乙二醇(PEG)。PEG缀合能够增加这些多肽的循环半衰期,降低多肽的免疫原性和抗原性,并改善其生物活性。如果使用,则可以使用任意合适的PEG缀合方法,包括但不限于:使甲氧基-PEG与肽的可供利用的氨基或其它活性反应位点例如组氨酸或半胱氨酸反应。此外,可以使用重组DNA技术将具有PEG反应活性基团的氨基酸添加到含有肽配体结构域的缀合物中。此外,根据本发明的这个方面,可以使用可释放的和杂合的聚乙二醇化策略,例如多肽的聚乙二醇化,其中,添加到含有肽配体结构域的缀合物分子上的某些位点的PEG分子在体内被释放。PEG缀合方法的实例是本领域已知的。见,例如,Greenwald et al.,Adv.Drug Delivery Rev.55:217-250(2003)。
适合于通过吸入施用的制剂包括气溶胶制剂。可以将气溶胶制剂置于加压的可接受的推进剂中,例如二氯二氟甲烷、丙烷、氮气等。它们还可以被配制为非加压的制剂,用于从喷雾器或雾化器递送。
可以通过将活性成分与多种基底例如乳化基底或水溶性基底混合而将适合用于肛门施用的制剂制备为栓剂。适合于阴道施用的制剂可以是阴道栓剂、棉塞、霜、凝胶、糊、泡沫或喷雾制剂的形式,其中除了活性成分之外,还含有例如本领域已知的这类载体。
此外,本发明的组合物可以包括另外的治疗剂或生物活性试剂。例如,可以存在可用于治疗特定适应症的治疗因子。控制炎症的因子例如布洛芬或类固醇可以是组合物的一部分,以减少与体内施用药物组合物相关的肿胀和炎症以及生理疼痛。
在吸入式治疗的情况下,本发明的药物组合物优选是气溶胶的形成。用于施用药剂(如果是固体形式)的气溶胶和喷雾发生器是可以获得的。这些发生器提供可呼吸的或可吸入的颗粒,并以适合于人类施用的速率产生一定体积的气溶胶,其中含有预先确定计量的剂量的药物。此类气溶胶和喷雾发生器的实例包括本领域已知的计量的剂量吸入器和吹药器。如果是液体形式,则本发明的药物组合物可以通过任意合适的装置进行气雾化。
当用于静脉内、腹膜内或肿瘤内施用时,本发明的药物组合物可以包含活性化合物的无菌的水性和非水性注射溶液、悬浮液或乳液,其中所述制剂优选与目标接受体的血液等渗。这些制剂可以包含下列一项或多项:抗氧化剂、缓冲剂、表面活性剂、助溶剂、抑菌剂、使组合物与目标接受体的血液等渗的溶质和本领域已知的其它制剂成分。水性和非水性的无菌悬浮液可以包含悬浮剂和增稠剂。组合物的形式可以是单元剂量或多剂的容器,例如密封安瓿和小瓶。
本发明的方法还可以是组合治疗的一部分。术语“组合治疗”是指:按照顺次或同时的方式与另一种治疗组合物联合施用根据本发明的治疗剂,从而在接受治疗的哺乳动物中实现该组合的有益效果。
IX.本发明适用于多种病况
本发明的组合物和方法适合用于诊断或治疗多种疾病,包括但不限于,其中疾病位点是,任意身体组织包括软组织、结缔组织、骨、实体器官、血管等中的异常增殖的病况、组织重构、增生、扩大的伤口愈合的位点。此类疾病的更具体的实例包括癌症、糖尿病性或其它视网膜病变、炎症、纤维化、关节炎、血管或人工血管移植物或血管内装置的再狭窄等、白内障和黄斑退化、骨质疏松症和骨的其它疾病、动脉硬化症和其它经常观察到钙化的疾病。
在一个优选的方面,本发明提供了诊断和/或治疗肿瘤的方法,其中所述肿瘤选自:口腔肿瘤、咽肿瘤、消化系统肿瘤、呼吸系统肿瘤、骨肿瘤、软骨肿瘤、骨转移、肉瘤、皮肤肿瘤、黑色素瘤、乳腺肿瘤、生殖系统肿瘤、尿道肿瘤、眼窝肿瘤、脑和中枢神经系统肿瘤、神经胶质瘤、内分泌系统肿瘤、甲状腺肿瘤、食道肿瘤、胃肿瘤、小肠肿瘤、结肠肿瘤、直肠肿瘤、肛门肿瘤、肝脏肿瘤、胆囊瘤、胰腺肿瘤、喉肿瘤、肺的肿瘤、支气管肿瘤、非小细胞肺癌、小细胞肺癌、子宫颈肿瘤、子宫体肿瘤、卵巢肿瘤、外阴肿瘤、阴道肿瘤、前列腺肿瘤、前列腺癌、睾丸肿瘤、阴茎肿瘤、膀胱肿瘤、肾脏肿瘤、肾孟肿瘤、输尿管肿瘤、头颈肿瘤、副甲状腺癌、霍奇金病、非霍奇金淋巴瘤、多发性骨髓瘤、白血病、急性淋巴细胞性白血病、慢性淋巴细胞性白血病、急性髓性白血病、慢性髓性白血病。此外,本发明提供了预测或确定肿瘤对化疗剂的响应的方法,治疗肿瘤的方法,用于预测哺乳动物肿瘤对化疗剂的应答的试剂盒,其中所述肿瘤是肉瘤、腺癌、鳞状细胞癌、大细胞癌、小细胞癌、基底细胞癌、透明细胞癌、oncytoma或其组合。
本发明提供了这样的实施方式,其中所述疾病是哺乳动物包括但不限于人中的疾病。
X.试剂盒
本发明提供了用于治疗肿瘤的试剂盒,其包含药物制剂和在治疗肿瘤中使用该制剂的说明书,其中所述药物制剂包含缀合物分子,所述缀合物分子包含缀合于活性试剂的肽配体结构域,并且其中所述肽配体结构域包括SEQ ID NO:1-137、139或140或141-143的肽或其同源物,其中所述肽配体结构域针对人血清白蛋白具有亲和力,该亲和力表征为大约700μM或更低的平衡解离常数(Kd),任选地,其中所述缀合物分子还包含第二肽配体结构域,以及使用所述试剂盒的说明书(例如,FDA批准的包装插页)。
XI.亲和纯化
亲和色谱(也称作亲和纯化)利用分子之间的特异性结合相互作用。将特定的配体化学地固定于或“偶联”于固体支持物,从而当复杂的混合物通过柱时,那些针对所述配体具有特异性结合亲和性的分子变为结合状态。将其它样品成分洗掉之后,将结合分子从支持物上剥离,从而使其从原始样品中纯化。
每种特异性亲和系统需要其自身的一组条件,并且对于给定的研究目的,呈现出其自身的特殊的挑战。其它的蛋白方法文献描述了与特定的纯化系统相关的因素和条件(见本页末尾附近的侧栏中的链接)。然而,其中涉及的一般原理对于所有的配体-靶标结合系统都是相同的,这些概念是本综述的焦点。
亲和纯化一般包括以下步骤:
(1)将粗样品与亲和支持物温育,以允许样品中的靶分子与固定的配体结合;
(2)从支持物上洗掉未结合的样品成分;
(3)通过改变缓冲液条件而从固定的配体上洗脱(解离和回收)靶分子,使得不再发生结合相互作用。
血清或细胞裂解物样品单次通过亲和柱可以实现特定蛋白的1,000倍以上的纯化,从而在凝胶电泳(例如SDS-PAGE)分析之后检测到仅一条单一的带。
与一般类别的蛋白(例如抗体)或通常使用的融合蛋白标签(例如6xHis)结合的配体可以在商业上以预先固定的用于亲和纯化的即用型形式获得。或者,可以使用数种商业上可获得的激活的亲和支持物中的一种将更特化的配体例如特异性抗体或目标抗原固定;例如,可以将肽抗原固定于支持物并用于纯化识别该肽的抗体。
最常见的是,通过在配体上的特定官能团(例如伯胺、硫氢基、羧酸、醛)与支持物上的活性反应基团之间形成共价化学键而将配体直接固定于或“偶联于”固体支持物材料(见关于共价固定的相关的文献)。然而,也可以进行间接偶联法。例如,可以首先使GST-标签化的融合蛋白通过谷胱甘肽-GST亲和相互作用捕获于谷胱甘肽支持物上,然后进行化学交联将其固定。然后,固定的GST-标签化的融合蛋白可用于亲和纯化融合蛋白的结合配对物。
多数涉及蛋白-配体相互作用的亲和纯化程序使用生理pH和离子强度的结合缓冲液,例如磷酸盐缓冲的盐水(PBS)。当抗体-抗原或天然蛋白-蛋白相互作用是亲和纯化的基础时,情况尤其是这样。发生结合相互作用之后,以另外的缓冲液洗涤支持物以除掉未结合的样品成分。可以通过加入低水平的去污剂或通过对结合和/或洗涤缓冲液中的盐浓度适度调整而使非特异性结合相互作用(例如简单的离子性结合)最小化。最后,加入洗脱缓冲液以打断结合相互作用并释放靶分子,然后以其纯化的形式收集。洗脱缓冲液可以通过极端pH值(低或高)、高盐(离子强度)、使用去污剂或离液试剂(其使分子中的一个或二者变性)、除掉结合因子或以反配体竞争性结合来解离结合配对物。在多数情况下,需要随后进行透析或脱盐以将纯化的蛋白从洗脱缓冲液中置换进入更适当的缓冲液以储存或进行下游分析。
最广泛使用的用于蛋白亲和纯化的洗脱缓冲液是0.1M甘氨酸·HCl,pH2.5-3.0。这种缓冲液有效解离多数蛋白-蛋白和抗体-抗原结合相互作用而不永久性影响蛋白结构。然而,一些抗体和蛋白会被低pH破坏,所以应该通过加入1/10体积的碱性缓冲液例如1M Tris·HCl,pH8.5立即将由此洗脱的蛋白级份中和。用于蛋白亲和纯化的其它洗脱缓冲液包括:
亲和纯化涉及基于与固定于固定材料(固相)的配体的结合相互作用的差异而分离溶液中的分子(流动相)。亲和纯化中的支持物或基质是生物特异性配体共价结合其上的任意材料。通常而言,用作亲和基质的材料在存在靶分子的系统中是不可溶的。不可溶基质通常(但不总是)固体。已经描述了上百种用作亲和基质的物质。
有用的亲和支持物是那些具有高面积体积比、容易被修饰以共价连接配体的化学基团、最小化的非特异性结合性质、良好的流动特性和机械及化学稳定性的支持物。当针对任何分离选择亲和支持物或基质时,所要考虑的最重要的问题恐怕是是否存在可靠的商业供应商以所需的量来提供所需的基质材料。
可以获得固定的配体或激活的亲和支持物化学法以用于数种不同的形式。最常见的是,交联的珠子化的琼脂糖或聚丙烯酰胺树脂用于柱或小规模的纯化程序。其上固定了亲和配体的磁珠在细胞分离和一些自动化纯化程序中是特别有用的。甚至更经常是用于测定目的的聚苯乙烯微量板也可用作固定配体以纯化结合配对物的支持物。
多孔的凝胶支持物一般提供用于蛋白亲和纯化的最有用的性质。这些类型的支持物通常是以直径为50-150μm的珠子的形式在溶液中产生的(即水合的)基于糖或丙烯酰胺的聚合物树脂。珠子化的形式允许这些树脂以湿浆的形式提供,其可容易地分配以填充并“塞满”具有任意尺寸的树脂床的柱。珠子是极其多孔的并且足够大,从而生物分子(蛋白质等)能够像在珠子之间和珠子表面周围自由流动一样地流动进入并通过珠子。配体通过多种方式共价结合于珠子聚合物(外部和内部表面)。结果是松散的基质,其中样品分子能够自由流动通过固定的配体的高表面积。
迄今为止,用于蛋白亲和纯化技术的最广泛使用的基质是交联的珠子化的琼脂糖,其通常可以以4%和6%的密度获得(这意味着1ml树脂-床有90%以上的体积的水)。
抗体纯化的数种方法涉及亲和纯化技术。典型的实验室规模的抗体生产涉及相对小体积的血清、腹水或培养物上清液。取决于抗体将如何被用于各种测定和检测方法,其必须是部分或完全纯化的。三种纯化特异性水平包括下列方法:
以硫酸铵沉淀。这种简易方法提供从其它血清蛋白中粗纯化的总免疫球蛋白。
以固定的蛋白A、G、A/G或L进行亲和纯化。这些蛋白与多数IgG种类和亚类结合,IgG是哺乳动物动物响应于免疫原而产生的最丰富的免疫球蛋白类型。可以以很多包装大小和形式获得含有这些蛋白的即用型树脂和纯化试剂盒。
以固定的抗原进行亲和纯化。纯化的抗原(即用作免疫原以诱导宿主动物产生抗体的肽或半抗原)共价地固定于亲和支持物上,这允许从粗样品中纯化特异性抗体。通过多种化学法制备固定抗原的激活的树脂和完整的试剂盒是可以获得的。另外见:Seo et al.,Characterization of a Bifidobacterium longum BORI dipeptidase belonging to the U34family,Appl Environ Microbiol.2007 Sep;73(17):5598-606;Clonis YD,Affinity chromatography matures as bioinformatic and combinatorial tools develop,J Chromatogr A.2006Jan 6;1101(l-2):l-24;Jmeian Y&El Rassi Z,Liquid-phase-based separation systems for depletion,prefractionation and enrichment of proteins in biological fluids for in-depth proteomics analysis,Electrophoresis.2009 Jan;30(l):249-61。
本发明提供了scFv,其与SEQ ID NO:113-116的任一项至少80%,优选至少85%,更优选至少90%,甚至更优选至少95%,最优选至少99%同一,并且其针对SPARC蛋白的KD值为至少4x10-7M,优选4x10-6M,更优选7x10-5M,或者针对SPARC蛋白的KD值是大约3.3xl0-7至大约7.8xl0-5。此外,本发明提供了scFv,其与SEQ ID NO:113-116的任一项至少80%,优选至少85%,更优选至少90%,甚至更优选至少95%,最优选至少99%同一,与SEQ ID NO:113-116中的CDR的任一项至少80%,优选至少85%,更优选至少90%,甚至更优选至少95%,最优选至少99%同一,并且针对SPARC蛋白的KD值为至少4x10-7M,优选4x10-6M,更优选7x10-5M,或者针对SPARC蛋白的KD值是大约3.3xl0-7M至大约7.8xl0-5M。
以下实施例进一步诠释了本发明,但是,当然不应该被解释为以任何方式限制其范围。
实施例1
本实施例证明了使用噬菌体显示技术鉴定SPARC结合肽,以及将此类SPARC结合肽引入到分子中以进行肿瘤治疗。
具体地,主要目标是产生具有缀合于治疗剂或诊断剂的SPARC结合肽的分子。特别地,目标是产生SPARC结合肽-Fc融合蛋白(图1),其中抗体Fc结构域作为治疗剂发挥作用:其刺激免疫功能,例如,抗体依赖性细胞毒性(ADC)或细胞依赖性细胞毒性(CDC)。
显示方法的一般原理是将配体(例如肽、蛋白)连接于编码该配体的基因(见图2)。在噬菌体显示技术中,这是通过将配体基因与编码丝状噬菌体的包被蛋白的基因融合而获得的。然后将重组的噬菌体基因组导入大肠杆菌,其中杂合蛋白将与所有其它的噬菌体蛋白一起被表达。然后融合蛋白将被掺入到含有噬菌体基因组(含有配体基因)的噬菌体包被中。可以在固定化的靶标上选择显示出所述配体的分泌的噬菌体颗粒,同时洗掉所有的非结合性噬菌体。洗脱步骤之后,回收的噬菌体用于感染大肠杆菌以允许扩增该噬菌体以进行新一轮的选择,最终用于结合分析。
因此,就与SPARC结合的肽筛选了商售的肽噬菌体显示文库(M13中的12-mer的肽)。靶标SPARC是酸性的糖蛋白,PI为4.6。通过使用pH 9.6的包被缓冲液固定于96孔板,使用噬菌体显示技术对Ph.D.-12肽文库进行了四轮筛选以选择肽结合剂。具体地,在第一轮筛选中,使用酸性洗脱溶液洗脱结合的噬菌体。然后,通过降低靶标蛋白浓度并增加洗涤缓冲液中的Tween-20的百分率而逐渐增加筛选的严格性。同时,以过量的靶标进行竞争性洗脱以改进筛选的特异性。最后,经过四轮筛选,将所选的克隆的ssDNA进行DNA测序。同时,使用噬菌体ELISA验证阳性噬菌体与靶蛋白的结合。
就SPARC结合肽筛选肽噬菌体显示文库的该筛选的结果显示于图3和4。可以通过分离的编码具有相同序列的肽的噬菌体克隆的数目(图3),或者通过SPARC结合的亲和性(如通过表达肽的噬菌体与SPARC包被的微量滴定板孔的结合所测定)(图4)来定量测定SPARC的结合。对通过噬菌体显示鉴定的两个肽PD15(SEQ ID NO:1)和PD21(SEQ ID NO:2)进行进一步表征。
然后将PD15和PD21克隆进入表达载体pFUSE-hIg1-Fc2(图5),得到编码PD 15-Fc和PD 21-Fc融合蛋白的质粒(图6)。表达并成功纯化了这些融合蛋白,如通过聚丙烯酰胺凝胶电泳所证明(图7)。
PD15和PD21的蛋白微阵列分析(见图8)显示:在阵列(Invitrogen,ProtoArray v.3)上所测定的5,000种蛋白中,仅有极少量的与非SPARC蛋白的交叉反应活性。
浓度依赖性结合ELISA测定证明了:PD 15和PD 21与SPARC的结合仅稍弱于抗-SPARC抗体(图9)。PD15与SPARC结合的Kd值是4.1±0.6 X 10-8M,PD 21则是1.0±0.7 X 10-7M(所测的抗-SPARC抗体与SPARC结合的Kd值是6.2±3.4 10-9M,即该抗体与SPARC的结合亲和性仅仅稍高些)。
图10和11显示了人脑肿瘤切片(已经就IHC染色进行了表位标签化)中SPARC的共定位(如通过以抗-SPARC抗体进行的免疫组化(IHC)染色所示)和PD 15及PD 21的结合。如图10所示,文献报道的stabilin1与SPARC的结合未得到证实,因为stab-Fc不与肿瘤组织结合,而PD15和PD21与肿瘤组织结合(图11)。
通过噬菌体显示分离的SPARC结合肽的序列同源性分析证明:所分离的多个SPARC结合肽序列与如图12所示的弹性蛋白的区域具有序列同一性。
因此,本实施例证明:可以通过噬菌体显示鉴定SPARC结合肽,以及如何进一步表征所鉴定的肽。在建立的两个克隆PD 15和PD21中,在ELISA和IHC实验中PD15显示出比PD21更高的针对SPARC的亲和性。
实施例2
在鼠-人PC3前列腺癌异种移植物模型中测定了PD15和PD21-Fc融合蛋白的抗肿瘤活性。PD15和PD21-Fc融合蛋白都显示出统计学上显著的肿瘤生长抑制(图13)。PD15显示出比PD21更好的针对PC3异种移植物的抗肿瘤活性。在小鼠-人HT29结肠异种移植物模型中,PD21显示出比PD15更好的抗肿瘤活性,PD21的活性接近等同于Abraxane(图14).
实施例3
本实施例证明了SPARC结合肽的潜在的免疫原性。
ProPred是用于预测抗原性蛋白序列中的MHC II类结合区的图形网上工具(见Singh et al.:ProPred:prediction of HLA-DR binding sites.Bioinformatics 2001,17(12):1236-7)。服务器执行基于基质的预测算法,使用从文献中推导而来的氨基酸/位置系数表。所预测的结合剂可以显示为图形界面中的峰或显示为HTML界面中的有颜色的残基。该服务器可能是定位能够结合至数个HLA-DR等位基因的混杂结合区的有用工具。
以噬菌体显示鉴定的SPARC结合肽(包括PD21和PD15)的ProPred分析结果表明:仅有少数几个HLA-DR分子将呈递这些肽,并且暗示这些肽将不会具有非常高的免疫原性。
本文公开的显示出高亲和性的任意肽,包括例如SEQ ID NO:1-112或117,可以类似地分析为低免疫原性或无免疫原性。
实施例4
可以使用不同的形式在噬菌体上显示抗体片段。单链可变片段(scFv)是免疫球蛋白的重链和轻链的可变区的融合物,通过短的(通常是丝氨酸、甘氨酸)连接子连接在一起。这种嵌合分子保留原始免疫球蛋白的特异性,虽然其除掉了恒定区并导入了连接子肽。抗体噬菌体显示的最常见的形式包括使用scFv文库。因此,可以就是否存在抗原结合克隆来筛选抗体变体的大的集合。
总体策略是首先以SPARC作为抗原通过ELISA来筛选人类抗体噬菌体显示文库。
开始的时候,对进行四轮筛选(三轮使用酸性洗脱,一轮使用竞争性洗脱),通过噬菌体ELISA选择了17个阳性克隆。对这些克隆进行的DNA测序揭示出两个独特的抗体序列,其中第一个序列在15个阳性克隆中是共有的,而第二个序列在其余2个阳性克隆中是共有的。然后,通过可溶性scFv ELISA验证这两个独特抗体的结合特异性。
接下来,对进行三轮筛选(两轮使用胰蛋白酶消化洗脱,一轮使用竞争性洗脱)。最后,通过噬菌体ELISA选择了30个阳性克隆。根据测序结果,一个抗体序列在29个克隆中是共有的,其余1个克隆编码另一个独特抗体。然后,也通过可溶性scFv ELISA验证这两种抗体的结合特异性。
鉴定了4个独特的针对SPARC的scFv:scFv 3-1,scFv 3-2,scFv 2-1和scFv 2-2(SEQ ID NOs:113-116)。图17显示了scFv 3-1,scFv 3-2,scFv 2-1和scFv 2-2(SEQ ID NOs:113-116)的序列,以下划线标示出了抗原结合性CDR。
实施例5
该实施例公开了示例性的SPARC结合性scFv的纯化。
图18显示了scFv2.1的镍柱纯化和通过细菌分离的scFv2.1的末端氨基酸测序和SDS-PAGE进行的scFv2.1的表征(A:表达的序列;B:亲和色谱;C:SDS-PAGE;D:N-末端氨基酸序列数据)。
图19显示了通过细菌分离的scFv3.1的末端氨基酸测序和SDS-PAGE进行的scFv3.1的纯化和表征(A:表达的序列;B:亲和色谱;C:SDS-PAGE;D:N-末端氨基酸序列数据)。
图20显示了纯化scFv2.1,scFv3.1和scFv3.2与SPARC的结合的Kd的测定。A:使用SPARC固定化芯片和scFv2.1作为流动通过物而进行的典型的Biacore实验的传感图;B:scFv2-l,scFv3-l和scFv3-2针对SPARC的Kd值(HTI SPARC是获自HTI的血小板SPARC;Abx SPARC是在Abraxis从工程化的HEK293细胞纯化而来的SPARC)。
本发明涉及以下实施方式:
实施方式1.一种组合物,其中包含以至少7.8x10-5M的KD与SPARC蛋白结合的scFv。
实施方式2.实施方式1的组合物,其中所述scFv包括SEQ ID NO:113-116中任一项的序列。
实施方式3.实施方式1的组合物,其中所述与SPARC蛋白结合的scFv包括与SEQ ID NO:113-116的CDR的任一项至少80%同一的序列。
实施方式4.实施方式1-3任一项的组合物,其中所述scFv偶联于治疗剂或诊断剂。
实施方式5.实施方式4的组合物,其中所述治疗剂或诊断剂是选自下列的治疗剂:铂化合物,抗叶酸类,抗代谢类药物,抗有丝分裂剂,DNA损伤剂,促凋亡剂,分化诱导剂,抗血管生成剂,抗生素,酪氨酸激酶抑制剂,激酶抑制剂,生物活性剂,生物分子,激素、肽、抗体、抗体片段,及其组合。
实施方式6.实施方式4的组合物,其中所述治疗剂是包含功能性抗体Fc结构域的抗体片段。
实施方式7.实施方式6的组合物,其中所述功能性抗体Fc结构域包含SEQ ID NO:118。
实施方式8.实施方式4的组合物,其中所述治疗剂选自:放射性核素,阿霉素,安沙霉素抗生素,天冬酰胺酶,博莱霉素,白消安,顺铂,卡铂,卡莫司汀,卡培他滨,苯丁酸氮芥,阿糖胞苷,环磷酰胺,喜树碱,达卡巴嗪,更生霉素,柔红霉素,右雷佐生,多西紫杉醇,多柔比星,依托泊苷,埃坡霉素类,氟尿苷,氟达拉滨,氟尿嘧啶,吉西他滨,羟基脲,去甲氧柔红霉素,异环磷酰胺,伊立替康,洛莫司汀,氮芥,巯基嘌呤,美法仑,甲氨蝶呤,雷帕霉素(西罗莫司),丝裂霉素,米托坦,米托蒽醌,硝基脲,紫杉醇,帕米膦酸钠,喷司他丁,光神霉素,甲基苄肼,利妥昔单抗,链脲菌素,替尼泊苷,硫鸟嘌呤,塞替派,紫杉烷类,长春碱,长春新碱,长春瑞滨,泰素,康普立停,迪科莫奈得,反铂,多西紫杉醇,紫杉醇,紫杉烷,5-氟尿嘧啶,抗-血管内皮生长因子化合物(“抗-VEGF”),抗表皮生长因子受体化合物(“抗-EGFR”),高金雀花碱,tTF、TNF、Smar1衍生的p44肽、干扰素、TRAIL、Smac、VHL、前半胱天冬酶、半胱天冬酶和IL-2,非-Fc结构域抗体片段,及其组合。
实施方式9.实施方式4任一项的组合物,其中所述治疗或诊断剂是选自下列的诊断剂:放射活性试剂、MRI造影剂、X射线造影剂、超声造影剂以及PET造影剂。
实施方式10.实施方式1-9任一项的组合物,其中进一步包含药学载体。
实施方式11.用于治疗具有疾病的哺乳动物的方法,包括施用治疗上有效量的实施方式1-10任一项的组合物。
实施方式12.实施方式11的方法,其中所述疾病是任意身体组织中的异常细胞增殖状况、组织重构、增生、扩大的伤口愈合,及其组合。
实施方式13.实施方式11的方法,其中所述疾病是糖尿病性或其它视网膜病变、炎症、纤维化、关节炎、血管或人工血管移植物或血管内装置的再狭窄等、白内障和黄斑退化、骨质疏松症和骨的其它疾病、动脉硬化症和其它经常观察到钙化的疾病。
实施方式14.实施方式11的方法,其中所述疾病是癌症。
实施方式15.实施方式11-14任一项方法,其中所述哺乳动物是人类患者。
本文引用的所有参考文献,包括公开物、专利申请和专利通过引用方式并入本文,达到如同每篇参考文献都单独且特别被指明通过引用方式并入并以其全文显示于本文的程度。
在描述本发明的上下文中(尤其是以下权利要求的上下文中)术语"一种/个(a)"和"一种/个(an)"和"该/所述(the)"的使用应该被解释为涵盖了单数和复数,除非本文中另有指明或上下文明显矛盾。除非另有指明,否则术语"含有(comprising)"、"具有(having)"、"包括(including)"和"含有(containing)"应该被解释为开放式术语(即,意思是“包括但不限于”)。除非本文另有指明,否则本文中提及的数值范围仅仅是作为单独提及落在该范围内的每个单独数值的简便方式,并且每个单独数值并入本说明书中,如同在本文中单独提及一样。除非本文另有指明或者上下文明显矛盾,否则本文描述的所有方法可以通过任意合适的顺序进行。除非另有要求,否则本文提供的任意和所有实施例或示例性语言(例如“例如”)仅仅意在更好地诠释本发明,而不对本发明的范围进行限制作用。本说明书中的任何语言不应被解释为指明未要求保护的要素对于本发明的实施是必不可少的。
在本文中描述了本发明的优选实施方式,包括本发明人已知的用于实施本发明的最佳模式。本领域普通技术人员在阅读了上述说明书之后,那些优选实施方式的变体会变得明显。本发明人预期技术人员视情况而应用此类变体,本发明人想到本发明可以按照除了本文特异性描述以外的方式来实施。因此,本发明包括适用法律所允许的随附的权利要求中提及的主题的所有修饰和等同物。此外,除非本文另有指明或上下文明显矛盾,否则本发明中包括上述要素的以其所有可能变体进行的任意组合。
序列表
<110> ABRAXIS BIOSCIENCE, LLC
Trieu, Vuong
Desai, Neil P.
<120> 结合SPARC的ScFv
<130> 705870
<150> 61/120,228
<151> 2008-12-05
<150> PCT/US2009/067032
<151> 2009-12-07
<160> 146
<170> PatentIn version 3.4
<210> 1
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 1
Tyr Thr Arg Leu His His Trp Ile Pro Pro Gln Arg
1 5 10
<210> 2
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 2
Val Thr Pro Leu Leu Lys Phe Arg Ala Leu Ser Ser
1 5 10
<210> 3
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 3
Ala His Pro Trp Arg Tyr Thr Glu Pro Trp Ser Trp
1 5 10
<210> 4
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 4
Ala Leu Ser Arg His His His Pro Ile Phe Pro Arg
1 5 10
<210> 5
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 5
Asn Glu Val Val Pro Phe Ser Tyr Ala Arg Gln Ser
1 5 10
<210> 6
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 6
His Val Pro His Leu Ala Ser Ile Met Ala Ser Asn
1 5 10
<210> 7
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 7
His Trp Gly Leu His Leu Ser Ala Trp Ser Gln Met
1 5 10
<210> 8
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 8
His Trp Lys Pro Trp Thr Ser Pro Ser Arg His Ser
1 5 10
<210> 9
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 9
Ile Asp Lys Pro Leu His Val Val Leu Ala Leu Gly
1 5 10
<210> 10
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 10
Ser Pro Cys Ala Tyr Thr Ser Thr Cys Asp Ala Leu
1 5 10
<210> 11
<211> 11
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 11
Ser Tyr Ser Pro Asn Leu Lys Ser Ala Tyr Asn
1 5 10
<210> 12
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 12
Thr His His Pro Thr Glu Tyr Leu Thr Arg Ala Pro
1 5 10
<210> 13
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 13
Thr Pro His Gln Asn Pro Trp Phe Phe Glu Ile Thr
1 5 10
<210> 14
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 14
Thr Gln Trp His Asp Asp Ser Thr Phe Tyr Trp Leu
1 5 10
<210> 15
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 15
Thr Val Asn Thr Tyr Tyr Asn Tyr Gly Met Ser Pro
1 5 10
<210> 16
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 16
Thr Trp His Ala Ser Ala Pro Arg Pro Pro Leu Leu
1 5 10
<210> 17
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 17
Val Thr Pro Leu Leu Lys Phe Arg Ala Leu Ser Ser
1 5 10
<210> 18
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 18
Ala Ala Ala Pro Leu Asn Leu Ser Met Thr Phe Pro
1 5 10
<210> 19
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 19
Ala Ala Leu Thr Phe Pro Ala Pro Gln Ser Ala Ser
1 5 10
<210> 20
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 20
Ala Leu Val Pro Lys Asn Leu Thr Pro Pro Gln His
1 5 10
<210> 21
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 21
Ala Asn Trp Ser Pro Trp His His Tyr His His Lys
1 5 10
<210> 22
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 22
Ala Pro Ala His Pro His Thr Ala Tyr Pro Ser Gly
1 5 10
<210> 23
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 23
Ala Thr Trp His Ser Phe Phe Tyr His Asn His Ser
1 5 10
<210> 24
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 24
Ala Tyr Ser His Ser Thr Pro Ser Ser Leu Thr Glu
1 5 10
<210> 25
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 25
Asp Asp Asn Asn Leu Phe Trp Trp Asn Asn Ala Gln
1 5 10
<210> 26
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 26
Asp Gly Met Phe Asn Tyr Arg Ala Ser Leu Asp Pro
1 5 10
<210> 27
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 27
Asp Leu His Gly Arg Thr Ser Ser Thr Pro Pro Asp
1 5 10
<210> 28
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 28
Asp Pro Leu Gln Pro Pro Asp Asn Val Thr Tyr Phe
1 5 10
<210> 29
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 29
Asp Gln Ala Ala Ser Arg Ser His Ser Phe Pro Leu
1 5 10
<210> 30
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 30
Glu His Gly Ser Ala Leu Phe Arg Trp Ser Gln Thr
1 5 10
<210> 31
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 31
Glu Val Phe His Trp Thr Ala Gly Thr Pro Arg Glu
1 5 10
<210> 32
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 32
Phe His Ser Ser Glu Ser Arg Pro Met Ser Pro Thr
1 5 10
<210> 33
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 33
Phe Gln Ser Val Pro Ser Lys Asn Ile Ala Thr His
1 5 10
<210> 34
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 34
Gly His His His Pro Ser Ala Thr Phe Asn Ala Arg
1 5 10
<210> 35
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 35
Gly His Ser Ala Ser Phe Ala Leu His Ser Ser Asp
1 5 10
<210> 36
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 36
Gly Leu Thr Ser Val Lys His His His Asn Ala His
1 5 10
<210> 37
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 37
Gly Met Asp Phe Arg Thr Leu Ile Trp Pro His Lys
1 5 10
<210> 38
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 38
Gly Met His Val Pro Gln Ile Pro Gly His Phe Leu
1 5 10
<210> 39
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 39
Gly Thr Ile Gly Pro Phe Pro Glu Thr Leu Arg Leu
1 5 10
<210> 40
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 40
His Gly Pro His Asp Met Thr Ile Val Gly Met Gly
1 5 10
<210> 41
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 41
His His Leu Phe Gln Ile His Pro Asp Ser Trp Pro
1 5 10
<210> 42
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 42
His His Tyr Lys Thr Asp Leu His Arg Thr Pro Arg
1 5 10
<210> 43
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 43
His Leu Lys His Leu Asn Trp Thr Ala Ser Lys Leu
1 5 10
<210> 44
<211> 7
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 44
His Leu Pro Lys Ser Leu Ser
1 5
<210> 45
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 45
His Met Lys Ser Gln Thr Asp Thr Pro Phe Tyr Gly
1 5 10
<210> 46
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 46
His Gln Met Phe Leu Ile Gly Thr Gly His Trp Gly
1 5 10
<210> 47
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 47
His Thr Leu His His Met Thr Thr Ser Pro Phe Ala
1 5 10
<210> 48
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 48
His Thr Asn Leu Met Gln Thr Thr Arg Pro Leu Val
1 5 10
<210> 49
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 49
His Val His Gln His Arg His Leu Val Glu Val Ile
1 5 10
<210> 50
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 50
His Trp Leu Pro Leu Leu Gly Gly Glu Leu Ser Ala
1 5 10
<210> 51
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 51
His Tyr Phe Ser Arg Thr Gln Thr Leu Ser Thr Leu
1 5 10
<210> 52
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 52
His Tyr Gln Phe His Trp Arg Ser Leu Ser Gly Pro
1 5 10
<210> 53
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 53
Ile His Arg Ala Pro Thr Pro Phe Asn Leu Gly Thr
1 5 10
<210> 54
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 54
Ile Ile Pro Leu Arg Met Asn Thr Ala Tyr Pro Tyr
1 5 10
<210> 55
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 55
Ile Pro Phe Ala Thr Ala Ala Tyr Asn Ala Pro Gly
1 5 10
<210> 56
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 56
Lys Ala Tyr Leu Asp Ser Ile Pro Ile Thr Pro Arg
1 5 10
<210> 57
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 57
Lys Val Thr Thr Asn Tyr Ala Leu His Leu Ala Ser
1 5 10
<210> 58
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 58
Leu Pro Phe Pro Leu Ser Tyr Asn Ile Gly Pro Ala
1 5 10
<210> 59
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 59
Leu Pro Pro Pro Pro His Leu Pro Thr Phe Leu Pro
1 5 10
<210> 60
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 60
Leu Pro Thr Phe Asn Phe Ser Leu Pro Gly Ile Ile
1 5 10
<210> 61
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 61
Leu Ser Thr His Lys Leu Phe His Ser His Ser Gln
1 5 10
<210> 62
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 62
Met Asp Thr Pro Gly His Leu His Leu Ser Arg Ser
1 5 10
<210> 63
<211> 11
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 63
Met Lys Glu Ala Pro His Asp Gly Ser Cys Leu
1 5 10
<210> 64
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 64
Asn Phe Ala Gln Asn Leu Ser Ser Asn Thr Tyr Trp
1 5 10
<210> 65
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 65
Asn Gly Tyr Leu Gly Leu Arg Pro Gln Leu His Phe
1 5 10
<210> 66
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 66
Asn His Leu Asn Ser Met Ser Ser Val Glu Ala Leu
1 5 10
<210> 67
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 67
Asn His Gln Leu His Gln Asn His Phe Pro Arg Met
1 5 10
<210> 68
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 68
Asn Leu Thr His Pro Leu Trp Gly Pro Asp Leu Phe
1 5 10
<210> 69
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 69
Asn Thr Leu Ser Gln Pro Arg Val Gly Gly Leu Asn
1 5 10
<210> 70
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 70
Asn Thr Pro Pro Met Ser His Gln Asn Pro Val Arg
1 5 10
<210> 71
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 71
Gln Asp Ala Leu Thr Pro Arg Arg Leu Trp Pro Thr
1 5 10
<210> 72
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 72
Gln Ile Leu Gly Tyr Pro Thr Asn Leu Gly Pro Phe
1 5 10
<210> 73
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 73
Gln Tyr Asp Thr His Arg Gly Ser Asp Asn Lys Gln
1 5 10
<210> 74
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 74
Arg His Leu Glu Ile Asn His Val Thr Leu Leu Val
1 5 10
<210> 75
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 75
Ser Ala His Thr Leu Ala Ala Trp Phe Ala Lys Pro
1 5 10
<210> 76
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 76
Ser Glu Thr Leu Gln Val Tyr Lys Pro Ile Leu Val
1 5 10
<210> 77
<211> 11
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 77
Ser His Val Leu Ser Ser Pro Ser Arg Gly Val
1 5 10
<210> 78
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 78
Ser His Ser Thr Gln Asp Arg Phe Val His Pro Ala
1 5 10
<210> 79
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 79
Ser His Tyr Pro Thr Ala Arg Gln Leu Thr Asn Ser
1 5 10
<210> 80
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 80
Ser Ile Ala Pro His Ser Gln Arg Leu Ser Leu Ser
1 5 10
<210> 81
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 81
Ser Leu Pro Asp Ile Ser Thr Arg Gly Leu Ala Ala
1 5 10
<210> 82
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 82
Ser Pro Pro His Pro Ala Arg Tyr Tyr Ser Pro Leu
1 5 10
<210> 83
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 83
Ser Pro Pro Thr Thr Met Thr Pro Asn Asn Met Pro
1 5 10
<210> 84
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 84
Ser Ser His Pro Ile Pro Tyr Asn Ala Ser Gln Met
1 5 10
<210> 85
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 85
Ser Thr Tyr Lys Asp Ser Trp Asn Glu Tyr Gly Pro
1 5 10
<210> 86
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 86
Ser Tyr Gln Gln Pro Met Gly Leu Tyr Arg Gln Phe
1 5 10
<210> 87
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 87
Thr Gly Leu Leu Gln Glu Pro Thr Phe Arg Gly Met
1 5 10
<210> 88
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 88
Thr His Gly His Tyr Tyr Pro Ser Ile Ala Leu Ser
1 5 10
<210> 89
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 89
Thr Leu Pro Ala Ala Ala Leu Pro Trp Leu Tyr Leu
1 5 10
<210> 90
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 90
Thr Met Ile Pro Leu Ile Tyr Pro Pro Gln Ala Asn
1 5 10
<210> 91
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 91
Thr Pro Asp Leu Ser Gln Ser Ser Pro His Ser Phe
1 5 10
<210> 92
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 92
Thr Pro His Leu Pro Pro Thr Arg Ala Gly Ser Pro
1 5 10
<210> 93
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 93
Thr Pro Asn Pro Leu Gly Thr Gln Cys Met Thr Cys
1 5 10
<210> 94
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 94
Thr Gln Tyr Ile His Thr Asp Leu Ser Ser Thr Ser
1 5 10
<210> 95
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 95
Thr Ser His Gln Ile Tyr Pro Val Ser Trp Met Arg
1 5 10
<210> 96
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 96
Thr Ser Ser Ala Ser His Thr Asn Leu Thr Thr Arg
1 5 10
<210> 97
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 97
Thr Ser Thr Arg Asp Ile Trp Ser Thr His Asp Leu
1 5 10
<210> 98
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 98
Thr Ser Tyr Leu Asn Ser Gly Met Ile Pro Ala Arg
1 5 10
<210> 99
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 99
Thr Thr His Ser Glu Leu Ser Gly Tyr Val Glu Leu
1 5 10
<210> 100
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 100
Val Glu Ala Glu Asn Asp Ser Gly Met Asn Ser Gln
1 5 10
<210> 101
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 101
Val Phe Asp Leu Asn Gly Tyr Asn Arg Asn Pro Ile
1 5 10
<210> 102
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 102
Val Gly Asn Met Pro Phe Val His Pro His Gln Trp
1 5 10
<210> 103
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 103
Val Pro Ala Thr Arg Val Ser Pro Thr Pro Tyr Ala
1 5 10
<210> 104
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 104
Val Ser His Pro Pro Arg Phe Pro Gly Trp Pro Gln
1 5 10
<210> 105
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 105
Trp His Glu Pro Ser Thr Trp Leu Val Asn Pro Arg
1 5 10
<210> 106
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 106
Trp Pro Ala His Pro His Thr Ala Tyr Pro Ser Gly
1 5 10
<210> 107
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 107
Trp Pro Ile Asn Gln Gln Arg Gln Leu Tyr Thr Ser
1 5 10
<210> 108
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 108
Trp Ser Asp Pro Arg Ala Val Thr Trp Arg Ala His
1 5 10
<210> 109
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 109
Trp Ser Leu Thr Pro Thr Ala Leu Leu Thr Ser Phe
1 5 10
<210> 110
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 110
Trp Ser Val Pro Leu Pro Pro Gly Asp Pro Lys Pro
1 5 10
<210> 111
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 111
Tyr Met Ala Pro His Val Pro Leu Thr Asn Ala Ser
1 5 10
<210> 112
<211> 12
<212> PRT
<213> 人工的
<220>
<223> 合成的
<400> 112
Tyr Pro Asn Pro Trp His Glu Ser Ser Phe Met Ser
1 5 10
<210> 113
<211> 251
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 113
Ala Ile Arg Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Asp Ile Lys Arg Ser Gly Gly Ser
100 105 110
Thr Ile Thr Ser Tyr Asn Val Tyr Tyr Thr Lys Leu Ser Ser Ser Gly
115 120 125
Thr Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly
130 135 140
Ser Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser
145 150 155 160
Tyr Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp
165 170 175
Met Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys
180 185 190
Phe Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala
195 200 205
Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr
210 215 220
Cys Ala Arg Asp Pro Glu Asp Asn Trp Gly Ala Phe Asp Ile Trp Gly
225 230 235 240
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser
245 250
<210> 114
<211> 250
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 114
Glu Ile Val Met Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Asp Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Gly Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Ser Thr Leu Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Ser Gly Gly Ser
100 105 110
Thr Ile Thr Ser Tyr Asn Val Tyr Tyr Thr Lys Leu Ser Ser Ser Gly
115 120 125
Thr Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly
130 135 140
Arg Pro Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser
145 150 155 160
Tyr Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
165 170 175
Val Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser
180 185 190
Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu
195 200 205
Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr
210 215 220
Cys Ala Arg Asp Leu Ser Trp Asn Asp Ala Phe Asp Ile Trp Gly Gln
225 230 235 240
Gly Thr Met Val Thr Val Ser Ser Ala Ser
245 250
<210> 115
<211> 240
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 115
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Met Ile Thr Pro Leu Gly Ser Thr Thr Ala Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Arg Ala Gly Val Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Thr Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser
130 135 140
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser
145 150 155 160
Ile Ser Ser Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Arg Ala Ser Thr Leu Gln Ser Gly Val Pro Ser
180 185 190
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
195 200 205
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Asn Asp
210 215 220
Ser Phe Pro Thr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
225 230 235 240
<210> 116
<211> 239
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 116
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser His Ile Gln Gly Gln Gly Arg Ala Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Thr His Gly Lys Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Thr Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser
130 135 140
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser
145 150 155 160
Ile Ser Ser Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Arg Ala Ser Arg Leu Gln Ser Gly Val Pro Ser
180 185 190
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
195 200 205
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Pro Ser
210 215 220
Gly Val Pro Thr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
225 230 235
<210> 117
<211> 52
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 117
Gln Gly Gly Cys Gln Ser Pro Ala Pro Ser Cys Ser Trp Ala Trp Cys
1 5 10 15
Trp His Pro Trp Thr Trp Ser Trp Cys Arg Arg Pro Trp Thr Trp Ser
20 25 30
Trp Cys Trp Cys Ser Trp Thr Trp Ser Trp Cys Trp Cys Ser Trp Leu
35 40 45
Arg Gly Ser Thr
50
<210> 118
<211> 227
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 118
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Gly Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 119
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 119
Met Tyr Ile Phe Pro Val His Trp Gln Phe Gly Gln Leu Asp Gln
1 5 10 15
<210> 120
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 120
Lys Asn His Gly Ala Thr Arg Thr Thr Arg Ala Ser
1 5 10
<210> 121
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 121
Tyr Thr Arg Leu His His Trp Ile Pro Pro Gln Arg
1 5 10
<210> 122
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 122
Val Thr Pro Leu Leu Lys Phe Arg Ala Leu Ser Ser
1 5 10
<210> 123
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 123
Val Ser His Pro Pro Arg Phe Pro Gly Trp Pro Gln
1 5 10
<210> 124
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 124
Lys Ala Tyr Leu Asp Ser Ile Pro Ile Thr Pro Arg
1 5 10
<210> 125
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 125
Thr Ser Tyr Leu Asn Ser Gly Met Ile Pro Ala Arg
1 5 10
<210> 126
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 126
Ala His Pro Trp Arg Tyr Thr Glu Pro Trp Ser Trp
1 5 10
<210> 127
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 127
Val Pro Ala Thr Arg Val Ser Pro Thr Pro Tyr Ala
1 5 10
<210> 128
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 128
Gln Ile Leu Gly Tyr Pro Thr Asn Leu Gly Pro Phe
1 5 10
<210> 129
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 129
Ala His Pro Trp Arg Tyr Thr Glu Pro Trp Ser Trp
1 5 10
<210> 130
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 130
Leu Ser Thr His Lys Leu Phe His Ser His Ser Gln
1 5 10
<210> 131
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 131
Ala Ala Ala Pro Leu Asn Leu Ser Met Thr Phe Pro
1 5 10
<210> 132
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 132
Ile Asp Lys Pro Leu His Val Val Leu Ala Leu Gly
1 5 10
<210> 133
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 133
Thr Gln Trp His Asp Asp Ser Thr Phe Tyr Trp Leu
1 5 10
<210> 134
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 134
Thr Thr His Ser Glu Leu Ser Gly Tyr Val Glu Leu
1 5 10
<210> 135
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 135
Ile Pro Phe Ala Thr Ala Ala Tyr Asn Ala Pro Gly
1 5 10
<210> 136
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 136
Val Gly Asn Met Pro Phe Val His Pro His Gln Trp
1 5 10
<210> 137
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 137
His Tyr Phe Ser Arg Thr Gln Thr Leu Ser Thr Leu
1 5 10
<210> 138
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 138
Ser Ala His Thr Leu Ala Ala Trp Phe Ala Lys Pro
1 5 10
<210> 139
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 139
Tyr Ser Ala His Ile Gly Ser Arg His Thr His Tyr
1 5 10
<210> 140
<211> 52
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 140
Gln Gly Gly Cys Gln Ser Pro Ala Pro Ser Cys Ser Trp Ala Trp Cys
1 5 10 15
Trp His Pro Trp Thr Trp Ser Trp Cys Arg Arg Pro Trp Thr Trp Ser
20 25 30
Trp Cys Trp Cys Ser Trp Thr Trp Ser Trp Cys Trp Cys Ser Trp Leu
35 40 45
Arg Gly Ser Thr
50
<210> 141
<211> 83
<212> DNA
<213> 人工序列
<220>
<223> 合成的
<400> 141
tatacccgcc tgcatcattg gattccgccg cagcgcgaca aaactcacac atgcccaccg 60
tgcccagcac ctgaactcct ggg 83
<210> 142
<211> 27
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 142
Tyr Thr Arg Leu His His Trp Ile Pro Pro Gln Arg Asp Lys Thr His
1 5 10 15
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
20 25
<210> 143
<211> 83
<212> DNA
<213> 人工序列
<220>
<223> 合成的
<400> 143
gtgaccccgc tgctgaaatt tcgcgcgctg agcagcgaca aaactcacac atgcccaccg 60
tgcccagcac ctgaactcct ggg 83
<210> 144
<211> 27
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 144
Val Thr Pro Leu Leu Lys Phe Arg Ala Leu Ser Ser Asp Lys Thr His
1 5 10 15
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
20 25
<210> 145
<211> 284
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 145
Met Lys Lys Leu Leu Phe Ala Ile Pro Leu Val Val Pro Phe Tyr Ser
1 5 10 15
His Ser Thr Met Glu Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Val Ser Met Ile Thr Pro Leu Gly Ser Thr Thr Ala
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
85 90 95
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Lys Arg Ala Gly Val Phe Asp Tyr Trp Gly
115 120 125
Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Thr Asp Ile Gln Met Thr Gln Ser
145 150 155 160
Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys
165 170 175
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn Trp Tyr Gln Gln Lys
180 185 190
Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Arg Ala Ser Thr Leu Gln
195 200 205
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
210 215 220
Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr
225 230 235 240
Cys Gln Gln Asn Asp Ser Phe Pro Thr Thr Phe Gly Gln Gly Thr Lys
245 250 255
Val Glu Ile Lys Arg Phe Leu Glu Gln Lys Leu Ile Ser Glu Glu Asp
260 265 270
Leu Asn Ser Ala Val Asp His His His His His His
275 280
<210> 146
<211> 297
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 146
Met Lys Lys Leu Leu Phe Ala Ile Pro Leu Val Val Pro Phe Tyr Ser
1 5 10 15
His Ser Thr Met Glu Ala Ile Arg Met Thr Gln Ser Pro Ser Ser Leu
20 25 30
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln
35 40 45
Asp Ile Ser Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser
100 105 110
Tyr Ser Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Asp Ile Lys
115 120 125
Arg Ser Gly Gly Ser Thr Ile Thr Ser Tyr Asn Val Tyr Tyr Thr Lys
130 135 140
Leu Ser Ser Ser Gly Thr Glu Val Gln Leu Val Gln Ser Gly Ala Glu
145 150 155 160
Val Lys Lys Pro Gly Ser Ser Val Lys Val Ser Cys Lys Ala Ser Gly
165 170 175
Gly Thr Phe Ser Ser Tyr Ala Ile Ser Trp Val Arg Gln Ala Pro Gly
180 185 190
Gln Gly Leu Glu Trp Met Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala
195 200 205
Asn Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Ile Thr Ala Asp Glu
210 215 220
Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp
225 230 235 240
Thr Ala Val Tyr Tyr Cys Ala Arg Asp Pro Glu Asp Asn Trp Gly Ala
245 250 255
Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser
260 265 270
Arg Ser Phe Leu Glu Gln Lys Leu Ile Ser Glu Glu Asp Leu Asn Ser
275 280 285
Ala Val Asp His His His His His His
290 295
- 还没有人留言评论。精彩留言会获得点赞!