大丽轮枝菌的致病基因、蛋白及其应用的制作方法
本发明涉及生物
技术领域:
,具体涉及大丽轮枝菌的致病基因、蛋白及其应用。
背景技术:
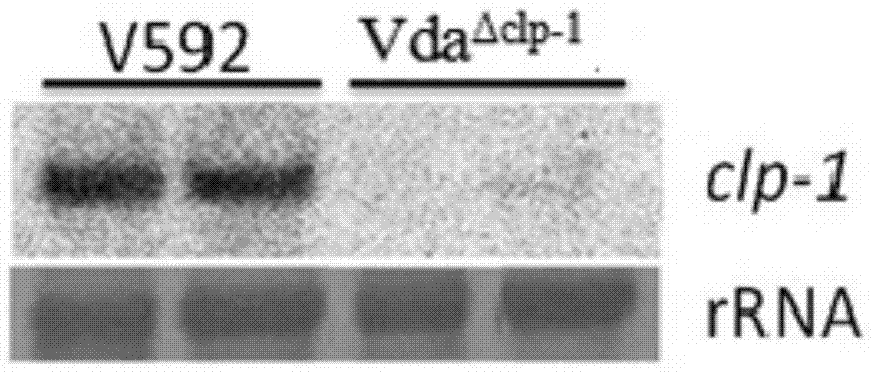
:由土壤丝状真菌大丽轮枝菌(VerticilliumdahliaeKleb.)所引起的棉花黄萎病是一种土壤传播的维管束病害,病原菌变异较快,具有分布广、危害重、存活时间长、化学农药难于防治等特点,是棉花生长过程中最具毁灭性的病害之一,严重威胁着棉花的生产和发展。棉花黄萎病1914年始见于美国的费吉尼亚州,随后在其它州和世界各植棉国先后发现(沈其益,1992),1935年随引进美棉品种传入中国,但危害不重。到二十世纪50年代以后,黄萎病在我国南北局部棉区陆续发生,扩散蔓延速度加快。80年代末,黄萎病已遍及全国478个植棉县(市)。进入90年代以来,中国棉花黄萎病扩展蔓延迅猛,尤其是1993,1995,1996,2002年在全国范围内连续大发生,损失严重。据2012年第11届国际轮枝菌大会的报导,棉花2005-2010年世界平均年产量2352万吨,因轮枝菌病害造成的损失高达年产的30%,每1%产量的损失相当于损失3.54亿美元。中国是棉花生产大国,全国棉花种植面积近亿亩,棉产量占全球棉花总产量的四分之一。棉花生产的好坏不但直接影响着棉农的收入和生活,对轻纺、外贸及国防建设也有重大的影响。然而棉花黄萎病在世界范围内的盛行,严重威胁着棉花的生产和发展。在中国的棉花主要生产区新疆,每年因为黄萎病引起的棉花减产问题非常严重,给棉农及国家造成了很大的经济损失。棉花黄萎病已成为棉花生产可持续发展的主要障碍之一,被称为“棉花的癌症”(简桂良等.2003),并已成为当前制约我国棉花生产的突出问题。大丽轮枝菌(VerticilliumdahliaeKleb.)属半知菌亚门,丛梗抱目,淡色孢科,轮枝菌属。大丽轮枝菌的寄主范围很广,涉及十字花科、蔷薇科、 豆科、茄科、唇形花科、菊科等,目前已达660多种植物,并且还在逐年扩大。关于棉花黄萎病的致病机制有多种解释,其中以导管堵塞和中毒两种观点为主。60年代人们对该病菌致病机制的认识是由于菌体在导管内定殖,并大量繁殖,同时刺激邻近的薄壁细胞产生胶状物质及侵填体而堵塞导管,阻碍水分的运转,从而导致棉株萎焉(Garber,1966)。马远莉等(1990)对棉花各部位黄萎病菌在导管中的分布情况研究后认为,正常的次生木质部导管的潜在输水能力远远超过植物的总需水量,而且被堵塞的导管数占整个维管束的比例不大(最大的有17.7%),因此导管堵塞不是导致棉花萎焉的主要原因。Keen等(1972)认为,黄萎病菌在代谢过程中产生的毒素为有毒的蛋白质,是一种酸性蛋白质一脂多糖的复合体。该复合物对感病棉花品种的叶片与根组织的细胞膜具有破坏作用,使细胞内K+和Na+大量渗漏。而抗病品种的细胞膜不具备毒素作用的受体位点而不受毒素破坏。Wang等(2004)从黄萎病原菌的菌丝中分离到一个新的具有对棉花叶片有致萎作用的蛋白VdNEP。该蛋白可以诱导烟草叶片形成坏死斑,也可以使拟南芥产生抗病反应,因此该蛋白可能参与了黄萎病菌对棉花侵染时的互作反应。但目前尚不清楚该蛋白是否与以前己分离的毒素蛋白是同一物质。现在越来越多的研究表明,黄萎病菌分泌的毒素是导致黄萎病的关键生化因子,同时组织导管的阻塞影响水分运输可能加剧了病症的产生。大丽轮枝菌是一种土传真菌,在干燥恶劣的环境下能够产生其休眠结构微菌核,从而在土壤中存活多年。所以微菌核的形成与其致病性息息相关。2004年,DobinsonKF等(Dobinson,K.F.,etal.,2004)利用改造了的EZ::TN转座系统,对来源于番茄的大丽轮枝菌的胰蛋白酶VTP1成功的进行了定向敲除。该基因能够促进微菌核的形成,但是敲除以后没有影响其致病性及生长特性。2005年,DobinsonKF等对来源于莴苣和番茄的大丽轮枝菌的细胞分裂素活化蛋白激酶基因VMK1进行了敲除。敲除VMK1后菌株对各种宿主的致病性严重衰退,说明MAP激酶介导的信号通路在真菌致病性上起着重要作用。并且基因的敲除减少了孢子的产生和微菌核的形成,说明该基因可能参与多个细胞进程。由于棉花黄萎病危害的严重性和寄主的广泛性,世界上不少国家的科技工作者对其进行了深入研究。植物在与病原物的长期协同进化过程中获 得了一系列复杂的防御机制保护自己,抗性表现为组成型抗性和诱导型抗性,诱导型抗性又包括组织结构抗性和生理生化抗性。对黄萎病抗性不同的棉花品种在组织结构方面存在一定差异,己被国内外不少研究证实。抗病品种木质部的细胞间隙较小,细胞壁较厚,且木质部中含有较多的髓射线。另外,抗病品种的导管腔和木质部的纤维腔直径小于感病品种,说明棉花品种对黄萎病的抗性与其具有坚实的木质部有关。棉花的生理生化抗病性方面己有过较多的研究,研究较多的抗病相关因子包括:植保素、单宁、可溶性糖、氨基酸及多种酶类。棉株在遭受病菌侵袭后,内部产生多种抑菌物质,主要包括棉酚、植保素、单宁等,另外还与一些酶类、蛋白以及小分子物质如H202。它们的作用是非专化性,与植物的基础抗性相关。棉花抗黄萎病的机制是一个非常复杂的问题,涉及的因素众多,因此不断深入研究这些抗病反应产物在基因表达水平上的规律,对于进一步深入了解抗病机制和利用基因工程手段改造棉花品种抗性具有重要意义。抗病基因的获得是选育抗病品种的重要基础,目前通过分子生物学手段己经克隆的植物抗病基因有39个以上,其中抗病原真菌的大概有20多个,如拟南芥抗白粉病基因RPW8,番茄抗枯萎病基因泌Ve,高梁抗普通锈病(PucciniaSorghi)基因Rpl-D,且在海岛棉上已经克隆了NBS-LRR类抗病基因。在常规育种上,国内外棉花育种者一直重视抗源的筛选和创造。1983-1986年李成葆等161对911份陆地棉资源进行了抗黄萎病鉴定,筛选了抗性较好的一批抗(耐)病品种。K.V.Srinvasin鉴定了126个海岛棉品种的抗性,结果显示表现耐病和抗病的占85%。无论是通过常规方法寻找抗源,还是通过分子生物学手段克隆抗病基因都已经取得了一定的进展,但还没有找到真正防治棉花黄萎病的有效办法。根本原因在于棉花等作物遗传背景复杂,很难在分子水平进行更深入的研究,另外大丽轮枝菌小种分化变异性强等原因也为抗病遗传育种带来重重困难。因此,研究棉花黄萎病病原大丽轮枝菌与寄主植物互作的分子机理至关重要。技术实现要素:本发明提供了一种大丽轮枝菌的致病基因、蛋白及其应用,该致病基因、蛋白与大丽轮枝菌导致棉花黄萎病的机理具有紧密联系,通过敲除该 致病基因可以降低大丽轮枝菌的致病性。本发明的一个方面,提供一种大丽轮枝菌的致病蛋白,命名为CLP-1(calpainclp-1),来自大丽轮枝菌(VerticilliumdahliaeKleb.),所述蛋白具有导致棉花黄萎病的作用,是如下1)或2)的蛋白质:1)氨基酸序列如SEQIDNO:2所示的蛋白质;2)将SEQIDNO:2的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且与大丽轮枝菌致病相关的由1)衍生的蛋白质。本发明的另一方面,提供一种大丽轮枝菌的致病基因(命名为CLP-1),该基因编码的蛋白具有导致棉花黄萎病的作用,是如下1)至4)中任一所述的基因:1)核苷酸序列如SEQIDNO:1中自5′末端第1-347位、第438-746位、第808-1311位和第1368-2901位所示的基因;2)核苷酸序列如SEQIDNO:1所示的基因;3)在严格条件下与1)或2)限定的基因杂交且编码权利要求1所述蛋白的基因;4)与1)或2)限定的基因具有90%以上的同源性且编码权利要求1所述蛋白的基因。SEQIDNO:1由2901个脱氧核苷酸组成,序列表中SEQIDNO:1的自5’端第1-347位;第438-746位;第808-1311位;第1368-2901位为ORF区,编码SEQIDNO:2中所述氨基酸残基序列的蛋白质,将SEQIDNO:2所示的蛋白命名为CLP-1,将CLP-1蛋白的编码基因命名为CLP-1。所述“严格条件”为足以使核苷酸序列与SEQIDNO:1所示的基因序列杂交的条件,这些条件对本领域技术人员是公知的,例如:在含0.1%SDS的0.1×SSPE或含0.1%SDS的0.1×SSC溶液中,在65℃下杂交,并用该溶液洗膜。本发明还提供了以上所述基因的重组载体、表达盒、转基因细胞系或重组菌。“表达盒”意指能指导适合宿主细胞中特定核苷酸序列表达的核酸序列,包含与目的核苷酸序列可操作地连接的调控元件。所述调控元件可以是启动子、增强子、静默子、终止子和/或其它控制所述核苷酸序列表达的元件, 如聚腺苷酸化序列等。本发明的再一个方面,提供以上所述基因的用途,在大丽轮枝菌中敲除以上所述的基因使大丽轮枝菌的致病性降低。本发明的又一个方面,提供一种降低大丽轮枝菌致病性的方法,敲除权利要求2所述的基因,具体包括如下步骤:(1)使用两对引物分别扩增SEQIDNO:3和SEQIDNO:4所示序列,将扩增后获得的片段导入表达载体;(2)通过步骤(1)中获得的含有SEQIDNO:3和SEQIDNO:4所示序列的片段的表达载体转化农杆菌;(3)选取转化成功的农杆菌;(4)通过步骤(3)中所述的转化成功的农杆菌转染大丽轮枝菌,选取具有抗性的菌株,即为致病性降低的菌株。以上所述的方法,其中,步骤(1)中所述两对引物序列如下:上游引物1:5’→3’方向:GGGTTTAAUGATGAATACTTCGCACCACG(SEQIDNO:5);上游引物2:5’→3’方向:GGACTTAAUGTCAGTGGTGCTGCCATCAA(SEQIDNO:6);下游引物1:5’→3’方向:GGCATTAAUACGCAAACCCAGGGCAAAAC(SEQIDNO:7);下游引物2:5’→3’方向:GGTCTTAAUAACTCACGCGGCGGGATACT(SEQIDNO:8)。以上所述的方法,其中,步骤(1)中还具体包括如下步骤:通过所述上游引物1及所述上游引物2以大丽轮枝菌基因组DNA为模板PCR扩增SEQIDNO:3所示序列的基因,所述下游引物1及所述下游引物2以大丽轮枝菌基因组DNA为模板PCR扩增SEQIDNO:4所示序列的基因,将扩增后的两种PCR产物都连接到表达载体。以上所述的方法,其中,步骤(2)中通过电击转化的方法将所述含有SEQIDNO:3和SEQIDNO:4所示序列的片段的表达载体导入农杆菌感受态细胞。以上所述的方法,其中,步骤(3)中通过将所述农杆菌涂布于含有抗 生素的平板上培养,筛选转化成功的菌株。以上所述的方法,其中,步骤(4)中通过将农杆菌转化后的真菌菌株涂布于含有抗生素的平板上培养筛选转化成功的菌株。本发明提供的致病基因、蛋白经实验证明与大丽轮枝菌导致棉花黄萎病的机理具有紧密联系,通过在大丽轮枝菌中敲除本发明的致病基因可以使大丽轮枝菌的致病性降低,将敲除了本发明致病基因的大丽轮枝菌突变体与野生型大丽轮枝菌同时侵染植株,被大丽轮枝菌突变株侵染的棉花相比野生型大丽轮枝菌侵染的棉花黄萎病发病率降低了50%以上,病情指数和病级数也有较大降低。因此本发明为研究大丽轮枝菌致病机理提供了新的启示,为治疗和预防棉花黄萎病提供了新的途径。附图说明图1是实施例2中通过PCR检测DNA水平CLP-1敲除突变体的对比电泳图;泳道1为marker,泳道2,3,4为野生型大丽轮枝菌V592;泳道5,6,7为CLP-1敲除突变体VdaΔclp-1-1;泳道8,9,10为CLP-1敲除突变体VdaΔclp-1-2。野生型大丽轮枝菌V592用F1-HptR及HptF-R1这两对引物扩增不出条带,而Fg-Rg是可以扩增出条带;相反,CLP-1敲除突变体VdaΔclp-1-1和VdaΔclp-1-2用F1-HptR及HptF-R1这两对引物能够扩增出条带,而Fg-Rg是不能扩增出条带的,说明CLP-1被敲除掉了;图2是实施例2中通过Northern杂交检测RNA水平CLP-1敲除突变体中CLP-1表达情况的印迹图;图中所示为Northern检测敲除突变体中CLP-1被敲除掉,不表达。泳道1,2为野生型大丽轮枝菌V592能够表达CLP-1;泳道3,4为敲除突变体VdaΔclp-1-1和VdaΔclp-1-2,不能表达CLP-1。图3是实施例3中未被侵染的对照棉花植株;图4是实施例3中被大丽轮枝菌V592侵染后的棉花植株;图5是实施例3中被大丽轮枝菌V592的敲除突变体VdaΔclp-1侵染后的棉花植株;图6是实施例3中棉花植株被野生型大丽轮枝菌V592和敲除突变体VdaΔclp-1侵染20天后的发病率对比图;图7是实施例3中棉花植株被野生型大丽轮枝菌V592和敲除突变体 VdaΔclp-1侵染20天后的病情指数对比图;图8是实施例3中棉花植株被野生型大丽轮枝菌V592和敲除突变体VdaΔclp-1侵染20天后的病级数对比图。具体实施方式以下结合附图和实施例,对本发明的具体实施方式进行更加详细的说明,以便能够更好地理解本发明的方案以及其各个方面的优点。然而,以下描述的具体实施方式和实施例仅是说明的目的,而不是对本发明的限制。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。下述实施例中的根癌农杆菌EHA105(ElizabethE.Hood.NewAgrobacteriumhelperplasmidsforgenetransfertoplants.TransgenicResearch,July1993,Volume2,Issue4,pp208-218)自申请日起二十年公众可从中国科学院微生物研究所获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。下述实施例中的大丽轮枝菌V592(Feng-Gao,Bang-JunZhou,AGlutamicAcid-RichProteinIdentifiedinVerticilliumdahliaefromanInsertionalMutagenesisAffectsMicrosclerotialFormationandPathogenicity.PLoSONE5(12):e15319.)自申请日起二十年公众可从中国科学院微生物研究所获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。下述实施例中“野生型”意指不含有异源核酸分子的生物体,为非转化的或非转基因的生物体。实施例1、CLP-1敲除载体的构建利用CTAB法提取大丽轮枝菌V592基因组DNA,利用以下引物以该基因组DNA为模板,利用CxHotstartDNA聚合酶(Agilent)进行PCR扩增:上游引物1:5’→3’方向:GGGTTTAAUGATGAATACTTCGCACCACG(SEQIDNO:5);上游引物2:5’→3’方向:GGACTTAAUGTCAGTGGTGCTGCCATCAA(SEQIDNO:6);下游引物1:5’→3’方向:GGCATTAAUACGCAAACCCAGGGCAAAAC(SEQIDNO:7);下游引物2:5’ →3’方向:GGTCTTAAUAACTCACGCGGCGGGATACT(SEQIDNO:8)。用USERenzymemix(NewEnglandBiolabs)将两种PCR产物同时连接到pGKO-HPT载体(Tian,L.,Chen,J.,Wang,J.,Wang,J.,andDai,X.2011,自申请日起二十年公众可从中国科学院微生物研究所获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用)上,测序结果表明含有SEQIDNo:3和SEQIDNo:4所示的DNA分子的重组载体确定为最终敲除载体。利用农杆菌介导的转化转进野生型大丽轮枝菌V592中得到CLP-1敲除突变体。实施例2、CLP-1敲除突变体的获得1)采用农杆菌介导法对真菌进行遗传转化相关培养基:(a)查式培养基(30g/L蔗糖,3g/LNaNO3,0.5g/LMgSO4-7H2O,0.5g/LKCl,100mg/LFeSO4-7H2O,1g/LK2HPO4,pH7.2)。LB液体培养基:蛋白胨10g,酵母浸膏5g,水1000ml,用NaOH调pH至7,121℃,高压蒸汽灭菌20min。(b)LB液体培养基:蛋白胨10g,酵母浸膏5g,NaCl5g,加水至1L,121℃,蒸汽灭菌20min。固体培养基加1.5%琼脂。(c)MM基本培养基:10mLK-bufer(200g/LK2HPO4,145g/LKH2PO4,H3PO3调节pH至7.0),20mLM-Nbuffer(30g/LMgSO4·7H2O,15g/LNaCl),1mL1%的CaCl2·2H2O(w/v),10mL20%的蔗糖(w/v),1mL0.1%的FeSO4(w/v),0.5gNH4NO3,加蒸馏水至1L。113℃,蒸汽灭菌20min。(d)IM诱导培养基:10mLK-bufer(pH7.0),20mLM-Nbuffer,1mL1%CaC12·2H2O(w/v),2.5mL20%的NH4NO3(w/v),1mL0.1%的FeSO4(w/v),5mL甘油,5mL2mol/L的蔗糖,2mL100mmol/L乙酰丁香酮,40mLlmol/L的MES(pH5.3),加蒸馏水至1L。113℃,蒸汽灭菌20min。(e)CM共培养培养基:IM培养基中加入1.5%琼脂粉,113℃,蒸汽灭菌20min。具体操作步骤(1)挑取农杆菌单菌落放入到5ml含有抗生素(50ug/ml卡那霉素, 50ug/ml利福平)的LB液体培养基,置于28℃摇床上,200rpm培养24小时,与此同时用牙签挑取3个PDA固体培养基上的V592菌饼放入含有80ml查式培养基的三角瓶中,置于26℃摇床上,200rpm培养。(2)取1ml培养了24小时的农杆菌菌液加入到20ml含有抗生素(50ug/ml卡那霉素,50ug/ml利福平)的MM液体培养基中,置于28℃摇床上,200rpm继续培养24小时后,离心机上4000rpm离心10min,收集菌体,菌体用IM培养基洗两次,再用IM培养基重悬,调OD600≈0.25,将培养了48小时之后的野生型大丽轮枝菌V592用四层灭过菌的纱布过滤,将过滤好的菌液置于离心机上4000rpm,离心10min,用IM+AS重悬孢子,血球计数板计数,调孢子浓度为1.0×106-7个孢子/ml。(3)将农杆菌菌液和真菌孢子悬浮液按1:1体积比例混匀(各取1ml),按照每培养皿200μl涂布于CM培养基平板上的玻璃纸,26℃培养36个小时。(4)用3ml无菌水对共培养物进行冲洗,按照500ul/板涂布于含有抗生素(潮霉素50ug/ml,羧苄青霉素200ug/ml,头孢霉素200ug/ml,20ug/ml五氟尿嘧啶)的PDA固体培养基上培养5-7天。2)PCR鉴定CLP-1敲除突变体(图1)A、CTAB法提取CLP-1敲除突变体基因组DNA。B、利用三对引物进行PCR扩增。第一对:在目的基因CLP-1的上游片段SEQIDNO:3的上游设计一个引物F1:5’-GGCTGACCTTGTCGGTGTCT-3’(SEQIDNO:9),HPTBOX上的一个引物HptR:5’-AAATTTTGTGCTCACCGCCTGGAC-3’(SEQIDNO:10)进行上游片段PCR扩增。第二对:在目的基因下游片段SEQIDNO:4的下游再设计的一个引物,命名为R1:5’-CCGTTGGTGGGTAGGTATCA-3’(SEQIDNO:11),在HPTBOX上的另一个引物HptF:5’-TCTCCTTGCATGCACCATTCCTTG-3’(SEQIDNO:12)进行下游片段的扩增。如果引物对1和引物对2都能够扩增出与预期大小相等的片段,说明重组是发生在目的基因的位置。第三对引物:Fg:5’-CGAAATCGATGGATCCCAGGATCAAAAGCCCTCTAC-3’(SEQIDNO:13),Rg:5’-AGGCTACGTAGGATCCTTACCACTGCGGTGCTTACA-3’ (SEQIDNO:14)用来扩增敲除的目的基因,不能扩增出片段表面目的基因确实被敲除成功。实施例3、Northern杂交检测CLP-1敲除突变体中CLP-1表达情况A、Trizol试剂法提取真菌组织RNA(1)将真菌材料在研钵中用液氮研磨成粉末,每50~100mg组织加入1mlRNAVzol,于离心管中匀浆至完全裂解;室温放置5min。(2)在装有裂解物的离心管中加入0.2倍体积的氯仿(1mlRNAVzol加入0.2ml氯仿),用振荡器充分振荡混匀30秒,室温放置2~3min。(3)4℃,14000rpm,离心10min,吸取上层水相至一新的离心管中,每毫升RNAVzol可吸取约0.5~0.55ml。(4)按每毫升最初的RNAVzol加入0.5ml异丙醇,颠倒数次,混匀,室温沉淀10min。(5)4℃,1,4000rpm,离心10min,在管底可见RNA沉淀。弃上清,每毫升最初的RNAVzol加入1ml75%乙醇,轻轻颠倒混匀,以清洗RNA沉淀。弃去液体,小心勿丢弃RNA沉淀。室温倒置晾干(5~10min)。(6)加入适量的50%去离子甲酰胺溶解RNA沉淀,存放于-80℃备用。B、RNA电泳(1)相关试剂20×SSC(175.3gNaCl,88.2g柠檬酸三钠,用HCl调节pH至7.0,定容至1L,高压灭菌),10×MOPS(41.8gMOPS,6.56gNaAc,20ml0.5MEDTA,用NaOH调节pH至7.0,定容至1L,装在棕色瓶中,高压灭菌或过滤除菌。高压灭菌后呈现淡黄色可用,黄色不可用),37%甲醛(Formaldehyde),去离子甲酰胺(Formamidedeionized),亚甲基蓝染色液(0.03%亚甲基蓝,0.3MNaAc,pH5.2)。(2)RNA电泳(a)1.2%琼脂糖甲醛变性胶的配制:(b)上样前RNA样品的处理:Samplebuffermix体积:25.5μl10×MOPS5μl37%甲醇8μl去离子甲酰胺12.5μl将Samplebuffermix与RNA样品等体积混匀,65℃,变性5min,置于冰上5min,加入上样缓冲液,混匀后即可上样。(c)RNA电泳。所用缓冲液为1×MOPS,120V约3h。(3)转膜(上行毛细管转移法)(a)用长和宽均大于凝胶的胶板作为平台,放在塑料盘中,倒入20×SSC,剪一条与平台等宽,长度大于平台的滤纸,先将滤纸一端浸湿在塑料盘中,慢慢放在平台上,直到另一端也浸湿在20×SSC中,赶出滤纸和平台间的气泡;(b)剪一张长和宽均略大于凝胶的尼龙膜,剪去左上角,完全浸湿在无菌水中,取出膜,再浸入20×SSC中,至少5分钟;(c)电泳结束后,切掉凝胶的无用部分,并在左上角切去一角,以作为方位标记。将凝胶放在20×SSC中漂洗片刻;(d)将凝胶倒放在平台上滤纸的中央,赶出胶和滤纸间的气泡,用Parafilm围绕凝胶周围,不要碰到凝胶上的样品;(e)用20×SSC浸湿凝胶,将湿润的尼龙膜放在凝胶上面,使二者切角重合,赶出尼龙膜和凝胶间的气泡;(f)用20×SSC浸湿5张与尼龙膜同样大小的滤纸,放在尼龙膜上面,赶出滤纸和尼龙膜间的气泡;(g)剪一叠10cm厚,略小于滤纸的纸巾,放在滤纸上面,纸巾上放一块玻璃板,再压上500g的重物,转移过夜;(h)揭去凝胶上方的纸巾、滤纸和Parafilm,翻转凝胶和尼龙膜,以凝胶一面在上放在一个塑料盘中,用铅笔在尼龙膜上标记凝胶加样孔的位置;(i)从尼龙膜上剥离凝胶弃之,将尼龙膜浸泡在20×SSC中5min,取出尼龙膜,放在湿润的滤纸上,紫外交联固定RNA;(j)用亚甲基蓝染色,直到看见清晰的RNA条带,蒸馏水冲洗脱色,用保鲜膜包好,放在4℃保存待用。(4)探针标记(Amersham公司随机引物标记试剂盒,RediprimeTMIIRandomPrimerLabellingSystem)。(a)取待标记的DNA25ng,加无菌水,使体积扩增至45μl。(b)98℃,保温5分钟,变性DNA。(c)离心,使DNA聚集在离心管管底,放在冰上。(d)将变性的DNA加到标记混合物中,轻轻混匀,直到pellet完全融解(不能用枪吹打)。(e)加1μlKlenow(防止标记混合物中的Klenow失活),离心。(f)加5μlα-32P-dCTP,用枪轻轻吹打均匀,离心。(g)37℃,反应30分钟;98℃,5分钟,变性已标记好的DNA探针,离心,放在冰上。(h)取适量探针用于杂交,剩余的探针保存在4℃冰箱中。C、杂交杂交缓冲液的配制杂交缓冲液:20.4ml所需体积终浓度1MNaHPO4(pH7.2)8.6ml43mM20%SDS7ml7%5%BSA4ml1%0.5MEDTA0.8ml20mM(a)预杂交:将杂交缓冲液倒入杂交管中65℃预热15min后放入交联固定的膜65℃预杂1~2h;(b)杂交:将标记好的探针放入杂交管中,65℃杂交过夜;(c)洗膜:用洗膜缓冲液2×SSC/0.2%SDS,在65℃/15min条件下洗膜2~3次;(d)压片:将洗好的膜从杂交管中拿出,转移至两层塑膜中,检测杂交信号强弱,将膜放入磷屏中,根据信号强弱压数小时或过夜;(e)检测杂交信号:扫描磷屏。结果如图2所示。实施例3敲除突变体的致病性检测通过菌株侵染水培棉花来鉴定其致病性。挑选饱满的棉种用15%的次氯酸钠浸泡30min后,无菌水冲洗2-3遍,再用无菌水浸泡催芽过夜后平铺在培养盒中保湿,待芽长至3cm,种于发芽盒中。将长出子叶的苗转移到盛满清水的塑料盒(高8-10cm)中,于25℃,光照16h,黑暗8h培养。待真叶长出时将清水换成1/3的MS培养液,每周更换一次培养液,1片真叶展平时接种。将-80℃保存的大丽轮枝菌V592菌株和CLP-1敲除突变体VdaΔclp-1经PDA平板活化3-4d,从菌落边缘挑取菌块放入查氏培养液,25℃,220rpm摇培5d,过滤,滤液5000rpm离心5min,清水稀释孢子,血球计数板计数,将浓度调至1×107个孢子/ml。将调好浓度的孢子悬浮液加入空塑料盒中,棉苗浸根40min。之后用1/3的MS培养液25℃光照16h,黑暗下继续培养棉苗8h。每盒中种12株苗,每个品种3个重复,对照棉苗用清水浸泡40min。20后观察发病情况。通过上述方法,我们验证了CLP-1敲除突变体对棉花的致病性明显减弱计算发病率和病情指数:发病率=发病数/调查总数×100%(见图6)病情指数=∑[病级数×该级病叶(穗、株)数]/(调查总数×最高病级数)×100(见图7)发病分级标准:0级植物健康没有症状;1级0.1%-25%的叶片萎蔫;2级25%-50%的叶片萎蔫;3级50%-75%的叶片萎蔫;4级75%-100%的叶片萎蔫或者死亡;野生型大丽轮枝菌V592侵染的棉花与敲除突变体VdaΔclp-1侵染的棉花 的发病分级标准统计图(见图8)。通过上述方法的结果图,我们可以看出敲除突变体VdaΔclp-1侵染棉花相比于野生型大丽轮枝菌V592侵染棉花发病率、病情指数及发病分级都明显降低,说明CLP-1基因与大丽轮枝菌的致病性相关。最后应说明的是:显然,上述实施例仅仅是为清楚地说明本发明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明的保护范围之中。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1