一种用于脑脊液中细胞分选富集的微流控芯片、系统和方法与流程
本发明属于生化分离分析技术领域,具体涉及一种用于脑脊液中细胞分选富集的微流控芯片、系统和方法。
背景技术:
脑脊髓液习惯上又被称为脑脊液(cerebrospinalfluid,csf),存在于蛛网膜下腔以及围绕并穿过中枢神经系统(cns)的腔室中,是中枢神经系统的细胞外液,大部分成分为盐、葡萄糖、蛋白质和水。正常脑脊液中细胞种类和数量稀少,但患者的脑脊液中,白细胞及其它细胞种类和数量均与正常脑脊液中的情况存在着明显差别。因此,对脑脊液中的细胞进行分选和计数、鉴定和监测成为基础检验学中的常规检测项目,及时、准确地判断脑脊液成分,对于诊断和鉴别神经系统的感染性和出血性疾病等具有十分重要的临床监测意义。
专利文献zl200910089582.4公开了一种基于免疫磁性分离技术的细胞分选微流控芯片及其应用,基于免疫磁珠抗体与肿瘤细胞表面抗原特异性结合的原理,设计制作了磁分选芯片,对血液中的肿瘤细胞进行分选,但在应用中由于难以去除多余的磁珠,多余的磁珠易团聚,干扰实验操作和观测,影响分离和监测效果;专利文献zl201210475444.1公开了一种血液细胞快速分选装置及其制造方法,基于肿瘤细胞与普通细胞间的尺寸差异,设计制作了微柱阵列芯片,对血液中的肿瘤细胞进行分选,但基于尺寸分离分选的方法存在管道中细胞沉降和阻塞等问题,使其应用受限。
目前,对于脑脊液中白细胞和其他病变细胞的监测以显微镜下人工计数为主,还没有用于脑脊液中细胞分离富集的检测设备。由于脑脊液中的成分特征与外周血液有很大差异,细胞种类也与外周血液中的细胞种类区别很大,细胞数量稀少,因此,用于外周血中肿瘤细胞分离的微流控芯片装置并不能适于脑脊液中细胞的分选,寻求脑脊液中细胞快速高效分选和富集的新方法,满足对患者脑脊液中细胞分离鉴定的需求,成为临床检验关注的热点和重点。
技术实现要素:
针对脑脊液中细胞量少、获取困难、分选效率低下、目前临床缺乏快速有效分析富集方法的缺陷,本发明的一个目的是提供一种用于脑脊液中细胞分选富集的微流控芯片,所述芯片能够免除样本前处理、细胞标记等预处理操作,实现脑脊液中量少细胞的快速、高效分选富集功能,并可进一步结合原位显微技术,实现脑脊液中量少细胞的原位计数和快速鉴别。
本发明的另一个目的是提供一种用于脑脊液中细胞分选富集的系统,所述系统集脑脊液中量少细胞的快速、高效分离富集与原位显微观测于一体,能够实现脑脊液中量少细胞的分选、富集、计数、观测和检测,功能性强,效率高,可用于临床脑脊液细胞的快速高效检测。
本发明的再一个目的是提供一种用于脑脊液中细胞分选富集的方法。
为实现上述发明目的,本发明提供以下技术方案:
第一方面,一种用于脑脊液中细胞分选富集的微流控芯片,包括键合在一起的盖片和基片,其特征在于:
所述盖片上设有第一进样微通道、第二进样微通道、第三进样微通道、第四进样微通道、中间微通道和富集微通道,四个进样微通道同时进样,可有效加大样本进样量;所述第一进样微通道的下端、第二进样微通道的上端均向内弯折,与中间微通道的左端连通,第一进样微通道下端弯折通道的中心线与第二进样微通道上端弯折通道的中心线呈90°夹角;所述第三进样微通道的下端、第四进样微通道的上端均向内弯折,与中间微通道的右端连通,第三进样微通道下端弯折通道的中心线与第四进样微通道上端弯折通道的中心线呈90°夹角,本发明的进样微通道通过弯折与中间微通道连通,且保持两相邻弯折通道的中心线呈90°夹角的设计,有效解决了样本死体积的技术难题,避免了样本在中间通道的丢失,为细胞高效富集奠定基础,所述富集微通道与中间微通道的中部垂直连通,能够保证四个进样微通道的样本到达富集微通道所受的作用力和途径一致;
所述基片上设有四组叉指微阵列电极和一组抛物线电极,所述叉指微阵列电极的位置分别与盖片上的四个进样微通道的进样端对应,四组叉指微阵列电极能够实现对样本中靶细胞的第一级分选,将毫升级样本中的微量靶细胞通过介电泳效应,浓缩到四个叉指电极区域,所述抛物线电极的位置与盖片上富集微通道的中部对应,能够进一步提升对靶细胞的分离富集倍数,有效提高靶细胞的捕获效率,提高检测效率,尤其是将抛物线电极的位置与富集微通道中部对应避免了因对应位置靠近出样端、微流泵的作用力过强影响电场力对细胞富集的缺陷。
根据本发明,所述盖片上的第一进样微通道、第二进样微通道、第三进样微通道、第四进样微通道对称分布,具有相同长度、宽度和深度,与中间微通道一起构成近似h形状,既能够保证四个进样微通道中的样本到达富集区所受的微泵作用力和流体途径一致,又能够保证四个进样微通道中的样本所受微流泵的作用力相同,具有良好的流通性能。
根据本发明,所述盖片上的第一进样微通道、第二进样微通道、第三进样微通道、第四进样微通道的长度为1~100mm,宽度为10~1200μm,深度为20~50μm,所述中间微通道的长度为1~100mm,宽度为1~1200μm,深度为20~50μm;优选地,所述盖片上的第一进样微通道、第二进样微通道、第三进样微通道、第四进样微通道的长度为8-12mm,宽度为600-1000μm,深度为20-50μm,所述中间微通道的长度为9-10mm,宽度为600-1000μm,深度为20-50μm;进一步优选地,所述盖片上的第一进样微通道、第二进样微通道、第三进样微通道、第四进样微通道的长度为10mm,宽度为800μm,深度为30μm,所述中间微通道的长度为9.5mm,宽度为800μm,深度为30μm,既与介电电泳作用力匹配良好,发挥dep的良好性能,且具有较高样本通量。
根据本发明,所述盖片上富集微通道的长度为1~100mm,宽度为500~2000μm,深度为20~50μm;优选地,所述盖片上富集微通道的长度为8-12mm,宽度为1300-1700μm,深度为20-50μm;进一步优选地,所述盖片上富集微通道的长度为10mm,宽度为1500μm,深度为30μm,尤其是将宽度设计为1500μm,能够有效增加样本的流动面积,减缓样本汇集到富集通道处的流速,防止流速过快影响dep富集。
根据本发明,所述盖片的制备方法为:通过mems技术制备得到含进样微通道、中间微通道和富集微通道的su8阳膜,通过热塑法将材料为聚二甲基硅氧烷(pdms)的盖片浇注到su8阳膜上,待气泡除完,60~100℃下固化20~60min,将凝固的pdms从阳膜上剥离,即得到带有微通道的pdms盖片。
根据本发明,所述基片上的四组叉指微阵列电极分别由30~50对并联的叉指电极组成,每根叉指电极的长度为200~1000μm,宽度为10~30μm、厚度为5~200nm,每对叉指电极之间的间距为10~80μm;优选地,所述基片上的四组叉指微阵列电极分别由50对并联的叉指电极组成,每根叉指电极的长度为800~1000μm,宽度为10-30μm,每对叉指电极之间的间距为10~20μm;进一步优选地,所述基片上的四组叉指微阵列电极分别由50对并联的叉指电极组成,每根叉指电极的长度为900μm,宽度为20μm,每对叉指电极之间的间距为15μm。
根据本发明,所述基片上的抛物线电极半径为500~1500μm,四分之一半圆电极间距为10~100μm;优选地,所述基片上的抛物线电极半径为600-900μm,四分之一半圆电极间距为50-60μm;进一步优选地,所述基片上的抛物线电极半径为750μm,四分之一半圆电极间距为55μm,抛物线电极区域的容量仅为0.07μl,浓缩效果可达到104倍。
根据本发明,所述基片上的叉指微阵列电极的材料选自金、铂、铜、铝或钯,采用mems加工的磁控溅射技术制备得到。
根据本发明,所述基片的材料选自玻璃、石英、硅或聚合物。
第二方面,本发明提供一种用于脑脊液中细胞分选富集的系统,包括所述用于脑脊液中细胞分选富集的微流控芯片、信号发生器、微泵和带有电荷耦合元件(ccd)的显微镜,其特征在于:
所述信号发生器通过双向开关实现与微流控芯片的叉指微阵列电极或抛物线电极相连,提供0.05~10v的激励电压和频率为0.01hz~16mhz的激发频率,当双向开关与微流控芯片的叉指微阵列电极连接时,信号发生器与抛物线电极断开,与微流控芯片的叉指微阵列电极形成回路,当双向开关与微流控芯片的抛物线电极连接时,信号发生器与叉指微阵列电极断开,与抛物线电极形成回路;
所述的微泵与微流控芯片的富集微通道尾部的出样端连接,用于控制微流控芯片微通道中的流体速度;
所述带有ccd的显微镜实现对微流控芯片的可视化观测,并将显微镜观测到的图像信息传输到计算机。
所述能够实现脑脊液中细胞分选富集的系统,将脑脊液中细胞高效分离富集与原位显微观测集成于一体,实现脑脊液中细胞的分选、富集、计数、观测和检测,具有功能性强,效率高的特性,可用于临床脑脊液细胞的快速高效检测;此外,通过调节信号发生器提供的激发频率和电压,能够对不同的靶细胞或细菌进行分离和富集,具有多种细胞或者细菌分选的强大拓展功能。
第三方面,本发明提供一种脑脊液中细胞的分选富集方法,包括以下步骤:
步骤1:在所述微流控芯片的四个进样微通道的进样端处同时进样,通过微泵控制进样速率为5~200μl/min;
步骤2:将信号发生器与叉指电极连接,设置激发频率为10khz~10mhz、电压为1~10v,完成脑脊液中细胞在叉指电极区域的第一步分选;
步骤3:通过微泵调节微通道内流体速度为0,将信号发生器与抛物线电极相连,设置激发频率为10khz~10mhz,电压为1~10v,调节进样微通道内样品流速为5~50μl/min,完成脑脊液细胞在抛物线电极区域的富集。
根据本发明,进一步包括通过带有ccd的显微镜实现可视化观测,并将显微镜观测到的图像信息传输到计算机。
本发明人发现,对于成分特征与外周血液有很大差异,细胞种类也与外周血液中的细胞种类区别很大,细胞数量稀少的脑脊液,微流控芯片的微通道尺寸、电极的激发电压和频率以及它们之间的配合关系,对脑脊液中的细胞分选富集的效果影响较大。当四个进样微通道的长度为8-12mm,宽度为600-1000μm,深度为20-50μm,中间微通道的长度为9-10mm,宽度为600-1000μm,深度为20-50μm,且富集微通道的长度为8-12mm,宽度为1300-1700μm,深度为20-50μm;同时,四组叉指微阵列电极中,每根叉指电极的长度为800-1000μm,宽度为10-30μm,每对叉指电极之间的间距为10-20μm,激发电压3~7v,激发频率0.5mhz~2mhz,且抛物线电极半径为600-900μm,四分之一半圆电极间距为50-60μm,激发电压3~7v,激发频率50khz~100khz时,细胞分选富集效果较好,白细胞捕获效率高。尤其是当四个进样微通道的长度为10mm,宽度为800μm,深度为30μm,中间微通道的长度为9.5mm,宽度为800μm,深度为30μm,且富集微通道的长度为10mm,宽度为1500μm,深度为30μm;同时,四组叉指微阵列电极中,每根叉指电极的长度为900μm,宽度为20μm,每对叉指电极之间的间距为15μm,激发电压5v,激发频率1mhz,且抛物线电极半径为750μm,四分之一半圆电极间距为55μm,激发电压5v,激发频率75khz时,细胞分选富集效果最佳,白细胞捕获效率最高。
附图说明
图1是本发明用于脑脊液中细胞分选富集的微流控芯片结构示意图;
图2是本发明用于脑脊液中细胞分选富集的微流控芯片的基片结构示意图;
图3是本发明用于脑脊液中细胞分选富集的微流控芯片的盖片结构示意图;
图中,
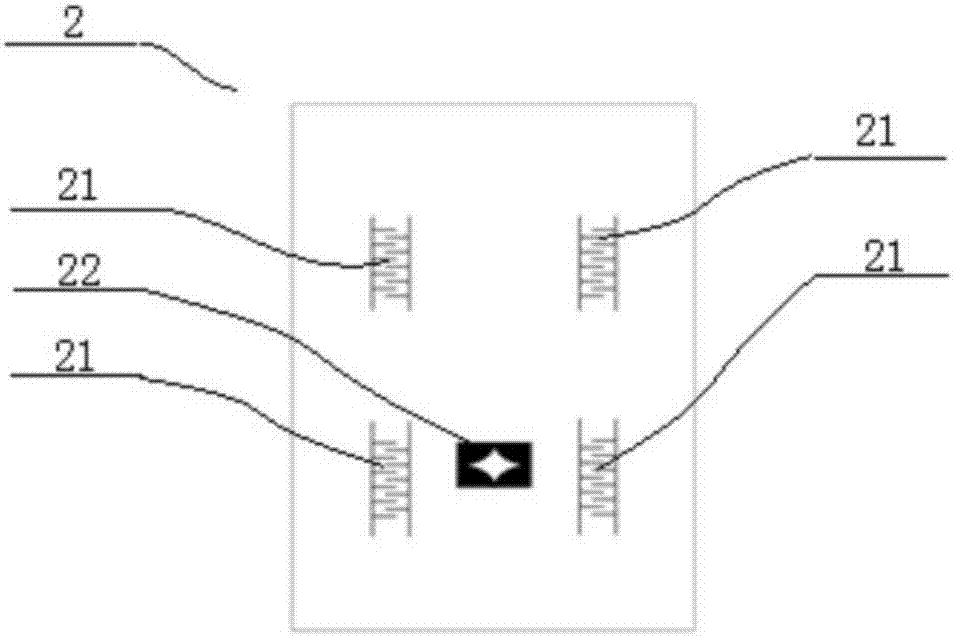
1-盖片,11-第一进样微通道,12-第二进样微通道,13-第三进样微通道,14-第四进样微通道,15-中间微通道,16-富集微通道;
2-基片,21-叉指微阵列电极,22-抛物线电极。
具体实施方式
下面根据说明书附图,通过具体实施例对本发明的技术方案进一步详细阐述。
参见图1-图3所示的一种用于脑脊液中细胞分选富集的微流控芯片,包括键合在一起的盖片(1)和基片(2),所述盖片(1)上设有第一进样微通道(11)、第二进样微通道(12)、第三进样微通道(13)、第四进样微通道(14)、中间微通道(15)和富集微通道(16),四个进样微通道同时进样,可有效加大样本进样量,所述第一进样微通道(11)的下端、第二进样微通道(12)的上端均向内弯折,与中间微通道(15)的左端连通,第一进样微通道(11)下端弯折通道的中心线与第二进样微通道(12)上端弯折通道的中心线呈90°夹角,所述第三进样微通道(13)的下端、第四进样微通道(14)的上端均向内弯折,与中间微通道(15)的右端连通,第三进样微通道(13)下端弯折通道的中心线与第四进样微通道(14)上端弯折通道的中心线呈90°夹角,本发明的进样微通道通过弯折与中间微通道连通,且保持两相邻弯折通道的中心线呈90°夹角的设计,有效解决了样本死体积的技术难题,避免了样本在中间通道的丢失,为细胞高效富集奠定基础,所述富集微通道(16)与中间微通道(15)的中部垂直连通,能够保证四个进样微通道的样本到达富集微通道所受的作用力和途径一致;
所述基片(2)上设有四组叉指微阵列电极(21)和一组抛物线电极(22),所述叉指微阵列电极(21)的位置分别与盖片(1)上的四个进样微通道(11、12、13和14)的进样端对应,四组叉指微阵列电极(21)能够实现对样本中靶细胞的第一级分选,将毫升级样本中的微量靶细胞通过介电泳效应,浓缩到四个叉指电极区域,所述抛物线电极(22)的位置与盖片(1)上富集微通道(16)的中部对应,能够进一步提升对靶细胞的分离富集倍数,有效提高靶细胞的捕获效率,提高检测效率,尤其是将抛物线电极(22)的位置与富集微通道(16)中部对应,避免了因对应位置靠近出样端、微流泵的作用力过强影响电场力对细胞富集的缺陷。
所述盖片(1)上的第一进样微通道(11)、第二进样微通道(12)、第三进样微通道(13)、第四进样微通道(14)对称分布,具有相同长度、宽度和深度,既能够保证四个进样微通道中的样本到达富集区所受的微泵作用力和流体途径一致,又能够保证四个进样微通道中的样本所受微流泵的作用力相同,具有良好的流通性能。
所述盖片(1)上的第一进样微通道(11)、第二进样微通道(12)、第三进样微通道(13)、第四进样微通道(14)的长度为10mm,宽度为800μm,深度为30μm,所述中间微通道(15)的长度为9.5mm,宽度为800μm,深度为30μm,既能保障微通道中介电电泳作用力的有效作用范围,同时又能保障较高样本通量。
所述盖片(1)上富集微通道(16)的长度为10mm,宽度为1500μm,深度为30μm,宽度为500~2000μm,尤其是1500μm的设计,能够增加样本的流动面积,减缓样本汇集到富集通道处的流速,防止流速过快影响dep富集。
所述盖片(1)的制备方法为:通过mems技术制备得到含进样微通道、中间微通道和富集微通道的su8阳膜,通过热塑法将材料为聚二甲基硅氧烷(pdms)的盖片浇注到su8阳膜上,待气泡除完,80℃下固化40min,将凝固的pdms从阳膜上剥离,即得到带有微通道的pdms盖片。
所述基片(2)上的四组叉指微阵列电极(21)分别由50对并联的叉指电极组成,每根叉指电极的长度为900μm,宽度为20μm,每对电极之间的间距15μm。
所述基片(2)上的抛物线电极半径为750μm,四分之一半圆电极间距为55μm,抛物线电极区域的容量仅为0.07μl,浓缩效果可达到104倍。
所述基片(2)上的叉指微阵列电极的材料为金。
所述基片(2)的材料为玻璃。
通过双向开关将信号发生器与四组叉指微阵列电极(50对叉指电极并联)或抛物线电极连接,用于提供所需的激发频率与电压。首先,控制双向开关使信号发生器与叉指微阵列电极相连,与抛物线电极断开,提供5v的激励电压和1mhz的激发频率,通过微泵控制芯片微通道中的脑脊液样本的流速为10μl/min,完成叉指微阵列电极区域的第一步细胞分选;通过微泵控制芯片微通道中的脑脊液样本的流速为0,控制双向开关使信号发生器与叉指微阵列电极断开,与抛物线电极相连,提供5v的激励电压和75khz的激发频率,完成抛物线电极区域的第二级细胞捕获和富集。
采用上述方法对制备的1毫升含有10个白细胞的脑脊液合成样本进行分离富集,重复实验20次,对富集到的白细胞进行显微下人工计数,按照捕获效率=白细胞捕获数/10×100%模式计算,白细胞捕获效率超过90%。
采用上述方法处理患者腰部穿刺获得的脑脊液样本,无样本前处理,直接将获得的脑脊液样本在芯片四个进样端加入总量为1ml的样本,进行脑脊液中白细胞的分离富集,从开始进样到完成细胞富集耗时28min,10次平行测试,白细胞捕获量在6~8个之间。
- 还没有人留言评论。精彩留言会获得点赞!