一种左旋艾普拉唑钠化合物及其药物组合物和制备方法与流程
本发明属于治疗胃病的药物领域,特别涉及一种左旋艾普拉唑钠化合物及其药物组合物和制备方法。
背景技术:
艾普拉唑(ilaprazole),化学名:5-(1-氢-吡咯-1-基)-2[[(4-甲氧基-3-甲基)-2-吡啶基]-甲基-亚磺酰基-1-氢-苯并咪唑。其是一种新型质子泵抑制剂,由韩国一洋药品株式会社开发,主要用于十二指肠溃疡、胃溃疡、反流性或腐蚀性食管炎等的治疗。
与其他质子泵抑制剂例如奥美拉唑等相比,具有起效快、抑酸效果好、作用时间长等优势,当时该化合物及其钠盐稳定性差,为了提高该化合物的稳定性,现有技术研究出了多种该化合物及其钠盐的晶型,例如cn101687878a公开了艾普拉唑的a、b、e、f、i晶型及其制备方法,cn103172618a公开了艾普拉唑的m晶型,又如cn102746275a公开了一种结晶形式的艾普拉唑钠,又如cn105461692a公开了一种艾普拉唑钠的c晶型,等。虽然现有技术公开了多种艾普拉唑及其钠盐的晶型,但是以上公开的晶型稳定性仍较差。
此外,由于艾普拉唑钠对酸不稳定,所以常将其制成冻干粉或肠溶片,例如cn105769777a公开的一种艾普拉唑钠的冻干粉针剂,及cn103705476a公开的一种艾普拉唑冻干粉针剂,cn102552190公开的一种肠溶片,以上公开的制剂解决了艾普拉唑钠对酸不稳定的技术问题,当上述限定的冻干粉的稳定性较低,并且冻干保护后化合物的有关物质低。
技术实现要素:
为了解决上述技术问题,本发明提供了一种左旋艾普拉唑钠化合物及其药物组合物和制备方法,该左旋艾普拉唑钠化合物的稳定性显著提高。
本发明具体方案如下:
本发明提供一种左旋艾普拉唑钠化合物,该化合物以2θ角度表示的x-射线衍射在7.6°、14.3°、19.8°、24.1°处有特征峰。
进一步的改进,该化合物以2θ角度表示的x-射线衍射还在9.6°、11.5°、14.1°、18.0°、25.3°、31.9°、35.1°处有特征峰。
本发明另一方面提供一种制剂,该制剂包括左旋艾普拉唑钠化合物和辅料,该制剂为冻干粉或肠溶片,该左旋艾普拉唑钠化合物和辅料的重量份数比为1:1.5-3。
进一步的改进,该制剂为冻干粉,其中,辅料包括如下重量份的各成分:
卡波姆1-1.8
谷氨酸钠2.5-6。
本发明在冻干粉中加入卡波姆和谷氨酸钠的混合物,两者在水溶液中能够形成一层凝胶起到保护化合物的作用,进而提高了冻干粉中左旋艾普拉唑钠化合物的稳定性,提高了冻干粉的稳定性。
进一步的改进,辅料还包括重量份为1.2-3.5份的冻干保护剂。进一步的改进,所该冻干保护剂各成分及重量份如下:
海藻糖1-3
维生素c0.2-0.5。
本发明进一步选择海藻糖和维生素c的混合物作为冻干保护剂,提高了冻干粉的有关物质,进而提高了冻干粉的整体疗效。
进一步的改进,辅料还包括如下重量份的各成分:
聚丙烯酸钠1-3
十二烷基磺酸钠0.5-1。
本发明在冻干粉中加入聚丙烯酸钠和十二烷基磺酸钠的混合物可以与化合物形成微球,不但提高了化合物的溶解性及稳定性,使得化合物具有缓释特性,延长冻干粉的作用时间。
进一步的改进,该冻干粉各成分的重量份数如下:
本发明另一方面提供了左旋艾普拉唑钠化合物的制备方法,该方法包括如下步骤:
1)将1g左旋艾普拉唑钠溶于50ml溶液a中,制得混合液;其中溶液a为体积比为11.5:1-1.5的四氢呋喃和乙醇的混合物,搅拌,转速为100r/min;
2)将混合液浓缩至原体积的2/3后,向浓缩后的混合液中加入5-10ml乙醚,然后再缓慢滴加2-3ml浓度为0.02mol/l的碳酸氢钠水溶液,静置,析晶。
本发明另一方面还提供了冻干粉的制备方法,该方法包括如下步骤:
s1:将卡波姆加入水中,于研钵中研匀后,将谷氨酸钠加入研钵中搅拌均匀,制得凝胶液;
s2:将左旋艾普拉唑钠化合物、凝胶液、聚丙烯酸钠溶于水中,制得水溶液;
s3:将十二烷基磺酸钠溶于乙醇中,制得乙醇溶液;
s4:将步骤s3制得的乙醇溶液加入到步骤s2制得的水溶液中,1600r·min-1搅拌,形成乳液;
s5:控制乳液温度低于20℃下,继续搅拌,使乙醇挥发至微球固化,得微球沉淀物,离心后加入冻干保护剂,搅拌30min,冷冻干燥,即得。
本发明的有益效果在于,本发明提供一种左旋艾普拉唑钠化合物,该化合物具有新的结晶形式,其稳定性较现有艾普拉唑钠的晶型形式显著提高;此外,本发明还提供了包括左旋艾普拉唑钠化合物的冻干粉和肠溶片,该冻干粉具有稳定性高、缓释等效果,疗效优于现有的冻干粉或肠溶片。
附图说明
图1为左旋艾普拉唑钠化合物的x-射线衍射图;
图2冻干粉的体外释放度图。
具体实施例方式
实施例1一种左旋艾普拉唑钠化合物
该化合物以2θ表示的x-射线衍射在7.6°、14.3°、19.8°、24.1°处有特征峰,如图1所示,以上各特征峰的相对强度如下所示:
实施例2一种左旋艾普拉唑钠化合物
该化合物以2θ表示的x-射线衍射在7.6°、9.6°、11.5°、14.1°、14.3°、18.0°、19.8°、24.1°、25.3°、31.9°、35.1°处有特征峰,如图1所示,以上各特征峰的相对强度如下所示:
实施例3冻干粉
冻干粉各成分的用量为:
实施例1的化合物1.75g
卡波姆1g
谷氨酸钠2.5g。
实施例4冻干粉
冻干粉各成分的用量为:
实施例2的化合物2.4g
卡波姆1.8g
谷氨酸钠5.4g
制备方法:
s1:将1.8g卡波姆加入30ml水中,于研钵中研匀后,将5.4g谷氨酸钠加入研钵中搅拌均匀,制得凝胶液;
s2:将2.4g左旋艾普拉唑钠化合物溶解于步骤s1获得的凝胶液中,搅拌至完全溶解,再继续搅拌30min,冷冻干燥,即得。
实施例5冻干粉
冻干粉各成分的用量为:
实施例6冻干粉
冻干粉各成分的用量为:
制备方法:
s1:将1.2g卡波姆加入50ml水中,于研钵中研匀后,将3.6g谷氨酸钠加入研钵中搅拌均匀,制得凝胶液;
s2:将2.84g左旋艾普拉唑钠化合物溶解于步骤s1获得的凝胶液中,搅拌至完全溶解,加入2g海藻糖和0.3g维生素c,再继续搅拌30min,冷冻干燥,即得。
实施例7冻干粉
冻干粉各成分的用量为:
实施例8冻干粉
冻干粉各成分的用量为:
实施例9
冻干粉各成分的用量为:
制备方法:
s1:将1.5g卡波姆加入50ml水中,于研钵中研匀后,将4.5g谷氨酸钠加入研钵中搅拌均匀,制得凝胶液;
s2:将5g左旋艾普拉唑钠化合物、凝胶液、2g聚丙烯酸钠溶于100ml水中,制得水溶液;
s3:将十0.75二烷基磺酸钠溶于10ml乙醇中,制得乙醇溶液;
s4:将步骤s3制得的乙醇溶液加入到步骤s2制得的水溶液中,1600r·min-1搅拌,形成乳液;
s5:控制乳液温度低于20℃下,继续搅拌,使乙醇挥发至微球固化,得微球沉淀物,离心后加入2.5g海藻糖和0.25g维生素c,搅拌30min,冷冻干燥,即得。
对照例1冻干粉
冻干粉各成分的用量为:
实施例1的化合物1.75g
卡波姆1g
依地酸二钠2.5g
按照实施例4的方法制备。
对照例2冻干粉
冻干粉各成分的用量为:
实施例1的化合物1.75g
羧甲基纤维素钠1g
谷氨酸钠2.5g
按照实施例4的方法制备。
对照例3冻干粉
冻干粉各成分的用量为:
按照实施例9的方法制备。
对照例4冻干粉
冻干粉各成分的用量为:
按照实施例9的方法制备。
实验例1化合物稳定性实验
以下通过对比实验来说明本发明与现有技术中的艾普拉唑钠晶型的稳定性差异。
1.高温影响因素实验
分别取实施例2、对照例1(cn10546169a2公开的c晶型)、对照例2(cn102746277a公开的结晶形式的艾普拉唑钠)、对照例3(cn104922080a公开的艾普拉唑钠晶体)、对照例4(cn106749191公开的艾普拉唑的ⅱ型结晶)、对照例5(cn105147680a公开的一种抗胃酸分泌的药物艾普拉唑钠组合物中艾普拉唑钠晶体)的艾普拉唑钠或艾普拉唑晶体,在温度60℃,相对湿度75%的条件下放置10天,分别在第0、5、10天取样观察其外观、色泽并测定杂质含量,结果见表1。
表1高温影响因素实验结果
结果表明,本发明提供的左旋艾普拉唑钠的晶型在高温条件下放置10天,从性状、外观上看没有变化,有关物质和含量的变化较对照例4和对照例5小,且明显好于对照例1-3。
2.高湿影响因素实验
分别取实施例2、对照例1(cn10546169a2公开的c晶型)、对照例2(cn102746277a公开的结晶形式的艾普拉唑钠)、对照例3(cn104922080a公开的艾普拉唑钠晶体)、对照例4(cn106749191公开的艾普拉唑的ⅱ型结晶)、对照例5(cn105147680a公开的一种抗胃酸分泌的药物艾普拉唑钠组合物中艾普拉唑钠晶体)的艾普拉唑钠或艾普拉唑晶体,在温度25℃,相对湿度92.5%的条件下放置10天,分别在第0、5、10天取样观察其外观、色泽并测定杂质含量,结果见表2。
表2高湿影响因素实验结果
结果表明,本发明提供的左旋艾普拉唑钠的晶型在高湿条件下放置10天,从性状、外观上看没有变化,有关物质和含量的变化较对照例4和对照例5小,且明显好于对照例1-3。
3.强光影响因素实验
分别取实施例2、对照例1(cn10546169a2公开的c晶型)、对照例2(cn102746277a公开的结晶形式的艾普拉唑钠)、对照例3(cn104922080a公开的艾普拉唑钠晶体)、对照例4(cn106749191公开的艾普拉唑的ⅱ型结晶)、对照例5(cn105147680a公开的一种抗胃酸分泌的药物艾普拉唑钠组合物中艾普拉唑钠晶体)的艾普拉唑钠或艾普拉唑晶体,在照度为4000-5000lx的日光灯的光照箱内放置10天,分别在第0、5、10天取样观察其外观、色泽并测定杂质含量,结果见表3。
表3强光影响因素实验结果
结果表明,本发明提供的左旋艾普拉唑钠的晶型在强光条件下放置10天,从性状、外观上看没有变化,有关物质和含量的变化较对照例4和对照例5小,且明显好于对照例1-3。
实验例2冻干粉稳定性实验
1加速试验
取本发明实施例3、及对照例1和2的冻干粉,均在40℃±2℃下,相对湿度为75%±5%的条件下放置6个月,在试验期间1个月、2个月、3个月、6个月末分别取样一次,按中国药典中的规定,检测冻干粉的性状、左旋艾普拉唑钠的含量(标示量%)、有关物质(%,总杂),结果见表4。
表4冻干粉的加速试验结果
从表中可看出本发明实施例3所提供的冻干粉,经加速试验结果可知,放置6个月后,所述冻干粉的性状、含左旋艾普拉唑钠的量、有关物质均未发生明显的变化;而对照例1-3的冻干粉放置6个月后,冻干粉发黄,且左旋艾普拉唑钠的含量显著下降,有关物质显著升高;表明本发明的冻干粉与对照例1-2相比,稳定性显著提高。
1.2长期试验
取本发明实施例3及对照例1-2的冻干粉,均于温度25℃±2℃下,相对湿度为60%±10%的条件下放置12个月,每3个月取样一次,分别于0个月、3个月、6个月、9个月、12个月、24个月取样,检测冻干粉的性状、左旋艾普拉唑钠的含量(标示量%)及有关物质(%,总杂),结果见表5。
表5冻干粉的长期试验结果
从表中可看出本发明实施例3所提供的冻干粉,经长期试验结果可知,放置24个月后,所述冻干粉的性状、含左旋艾普拉唑钠的量、有关物质均未发生明显的变化;而对照例1-2的冻干粉放置24个月后,冻干粉发黄,并且左旋艾普拉唑钠的含量显著下降,有关物质升高;表明本发明的冻干粉与对照例1-2的冻干粉相比,稳定性显著提高。
实验例3不同冻干保护剂对冻干粉的影响
本试验选择不同的冻干保护剂,其余的成分与实施例5的相同,制成不同的冻干粉,对冻干粉的包封率、外观、再分散时间等因素进行考察,考察结果见表6。
表6不同冻干保护剂对冻干粉的影响结果
从表中可以看出,当选择海藻糖和维生素c的混合物作为冻干保护剂时,制得的冻干粉的外观为白色、饱满,包封率和再分散时间好,其余的冻干保护剂外观不好,且有萎缩现象,分散时间长,包封率低。
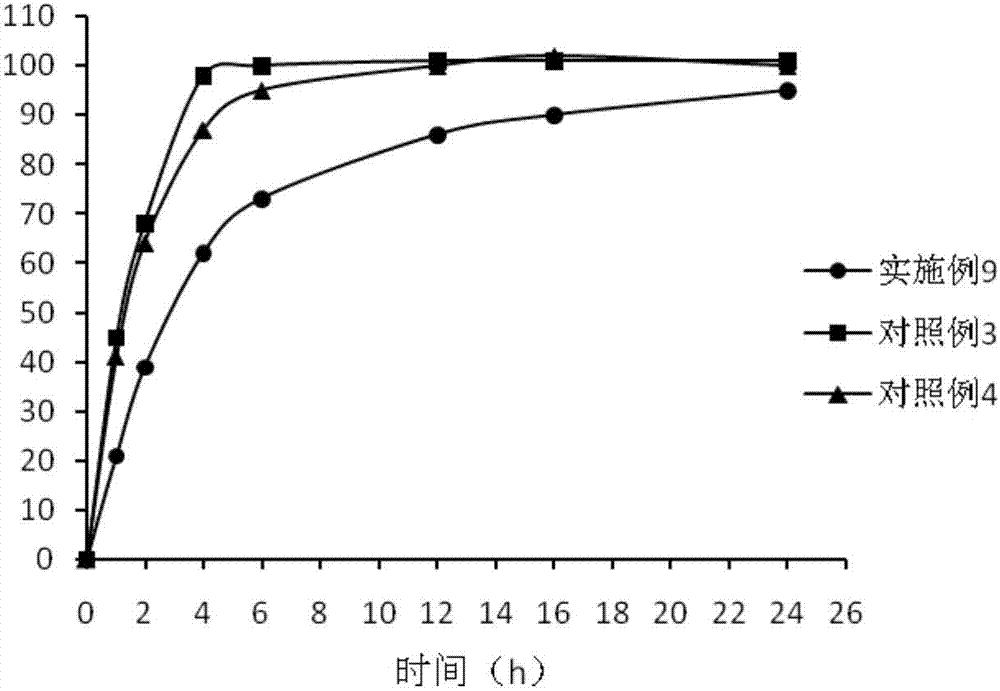
实验例4体外释放度测定试验
药物释放度检测:参照2015版《中国药典》附录xixd体外药物释放度检查。
分别取以上实施例9和对照例3-4的冻干粉,置药物溶出仪中,于1h、2h、4h、6h、12h、16h、24h分别取样,用高效液相色谱法检测溶出百分率,并计算药物的累积释放百分率,结果见图2。
从图中可以看出实施例9的冻干粉,在24h内缓慢释放。
- 还没有人留言评论。精彩留言会获得点赞!