一种裂解性噬藻体MACPNOA1及其应用的制作方法
本发明涉及环境微生物领域,尤其涉及一种裂解性噬藻体macpnoa1及其在蓝藻水华控制中的应用。
背景技术
随着湖泊流域人类活动的加剧、大量的营养盐通过各种途径进入水体。国际经济发展合作组织(oecd)将这种“水体中由于营养盐的增加而导致藻类和水生植物生产力的增加、水质下降等一系列的变化,从而使水的用途受到影响”的现象定义为富营养化。
与富营养化相伴随的一个普遍现象就是许多浮游植物,尤其是那些具有浮力或运动能力的藻类,通常会过度生长,形成藻华,释放毒素,从而导致水质的下降及一系列严重的水环境问题。如微囊藻(microcystis)水华在世界各地包括我国均有大量的报道,在中国,其在包括湖泊、水库、池塘等水生环境中爆发,常常引起家畜和野生动物的死亡。多种水华蓝藻能释放毒素,如铜绿微囊藻(microcystisarruginosa)能够产生很强的藻毒素,这种毒素能专一性的抑制真核生物的蛋白磷酸酶2a(pp2a)的活性而引起肝癌。
蓝藻水华治理是一个难题。常用的治理方法分为生物方法、物理方法和化学方法。物理方法虽控藻见效快,但是需要耗费巨大的人力、物力。化学方法主要是通过化学药剂来控制藻类,其缺点是化学药剂在水体中会造成污染。生物控藻经济环保,具有巨大的应用前景。
噬藻体是一类感染原核藻类的病毒类群,形态上类似噬菌体。作为水体环境中的活跃的动态因子,噬藻体在控制水体初级生产力和有害藻类水华方面发挥着重要的作用。噬藻体入侵可影响其宿主光合作用中心发生改变,导致光合作用发生率降低,影响水体中初级生产率的产生,显著降低藻类密度。裂解性噬藻体可在短时间内使藻体裂解,大大减少富营养藻华水体中的蓝藻量。而且,噬藻体是从自然水域中分离所得,对环境和人类不会产生危害。通过筛选,获得裂解活性高、能够广泛感染并裂解有毒水华藻的噬藻体,在蓝藻藻华形成初期和爆发期添加噬藻体,让噬藻体裂解藻华藻,是生物控藻的主要发展途径,具有十分重要的意义。尤其是宿主广泛的裂解性噬藻体,具有巨大的应用前景。
技术实现要素:
本发明所要解决的技术问题是提供一种可安全、高效、快速地裂解淡水中多种蓝藻的裂解型噬藻体macpnoa1及其分离方法和应用。
本发明解决上述技术问题所采用的技术方案是提供了一株新的裂解性噬藻体macpnoa1,可感染来源于7个属(microcystis,aphanizomenon,chroococcus,planktothrix,nostoc,oscillatoria和anabaena)的不同蓝藻,为双链dna噬菌体。于2016年10月24日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏单位地址:北京市朝阳区北辰西路1号院3号,保藏编号为cgmccno.12996。
该噬藻体具有如下生物学特征:macpnoa1噬藻体具有圆球形的头部结构和细长的不可伸缩的尾部,头部直径约40nm,尾部长约380nm;噬藻体macpnoa1在藻平板上可以形成大小形状均一的透明噬藻斑,周围无晕环,边缘清晰规则;该噬藻体核酸能被dnasei酶消化,而不能被rnasea和s1单链核酸酶消化处理,其基因组为双链dna,大小为42473bp,基因组与其他噬菌体及噬藻体基因组序列没有明显同源性。形态学和分子生物学特性显示macpnoa1为全新的长尾噬藻体(cyanosiphovirus)。此前,从未有感染微囊藻的长尾噬藻体被报道,macpnoa1是首株能感染微囊藻类蓝藻的长尾科噬藻体。macpnoa1亦是溶藻谱最广的长尾噬藻体,其能裂解包括但不限于下列蓝藻:铜绿微囊藻(microcystisaeruginosafachb-469、m.aeruginosafachb-925),惠氏微囊藻(m.wesenbergiifachb-908、m.wesenbergiifachb-929、m.wesenbergiifachb-1112),绿色微囊藻(m.viridisfachb-979),水华束丝藻(aphanizomenonflos-aquaefachb-1039),色球藻(chroococcussp.fachb-193),阿氏浮丝藻(planktothrixagardhiifachb-920),念珠藻(nostocsp.fachb-596),浮游颤藻(oscillatoriaplanctonicafachb-708)和水华鱼腥藻(anabaenaflos-aquaefachb-245)。
该噬藻体具有如下生物学特征:对于高温处理,macpnoa1在40℃中放置1小时后,感染活性不受影响;在50℃条件下,感染活性明显下降;在超过60℃条件下则失活;对于酸处理,macpnoa1经ph5.37处理,保持溶藻活性;经ph3.2处理下则失活;对于碱处理,macpnoa1经ph8.83和11.06处理,感染活性明显下降;macpnoa1对紫外线照射和氯仿敏感;噬藻体在全光照和光、黑交替条件下,保持溶藻活性;在长期黑暗条件下裂藻效果不明显。
上述裂解性噬藻体的分离纯化方法,具体包括如下步骤:
(1)噬藻体的初步分离
由浙江省宁波市宁波大学南门水沟采集表层水样,10000×g离心30min,将上清经0.8μm和0.45μm滤膜过滤,将滤过液与处于对数生长期的铜绿微囊藻(m.aeruginosafachb-469)按体积比1∶2的比例混合;同时,将bg11藻培养基按同样比例加入到对数生长期的铜绿微囊藻作为对照;将混合液于光照强度为2000lx,温度为25℃,光暗周期为12h∶12h条件下培养。将发生黄化的培养液10000×g离心30min,将上清经0.8μm和0.45μm滤膜过滤,将滤过液与铜绿微囊藻藻液再次按照体积比1∶2的比例混合、培养。如此,进行连续传代感染,直至保持稳定噬藻性,得到噬藻体感染液。
(2)噬藻体的分离纯化
将噬藻体感染液做10倍梯度系列稀释(10-1,10-2,10-3,10-4,10-5,10-6,10-7),取各稀释液分别与浓度为108~109cell/ml的铜绿微囊藻藻液按体积比1∶9的比例混合后,于摇床上室温培养30min,使噬藻体和藻体充分吸附,然后倒入冷却至42℃的含质量体积比为0.7%琼脂的bg-11培养基中,充分混匀后倒入底层含质量体积比为1.5%琼脂的bg-11培养基平板的培养皿中,待其凝固,倒置,于2000lx,25℃,光照周期为12h∶12h的培养箱中培养,每日观察培养情况,7~10天后,刮取所形成的单个噬藻斑。
(3)噬藻体的进一步纯化
将上述步骤(2)得到的噬藻斑悬浮于bg-11培养基中,于4℃涡旋过夜,10,000×g离心20分钟后,取上清作为噬藻体感染液,重复上述步骤(2),得到第二代噬藻斑;如此重复传代3次,得到形状、大小均一的噬藻斑。
(4)噬藻体的扩大培养
取步骤(3)中获得的单一噬藻斑,悬浮于bg-11培养基中,10,000×g离心20分钟后取上清,将其与对数生长期的铜绿微囊藻(m.aeruginosafachb-469)藻液按体积比1∶2的比例混合培养,获得扩大培养物,10,000×g离心20分钟后取上清,将其与对数生长期的铜绿微囊藻(m.aeruginosafachb-469)藻液混合培养,如此不断扩大培养。
(5)噬藻体的提取
将扩大的培养产物经10,000×g离心30分钟,取上清经0.22μm滤膜过滤后,在4℃下20,000×g离心20min,取上清在4℃下80,000×g离心2h,用bg-11培养基冲洗沉淀,并用bg-11悬浮余下的白色沉淀;悬浮液经10000g离心20min,取上清,再次在4℃下80,000×g离心2h,用bg-11培养基冲洗沉淀,得到的白色沉淀用bg-11悬浮即纯化的噬藻体悬浮液。
macpnoa1的应用:将噬藻体悬浮液按1∶2的比例分别添加到19株蓝藻水华样品中,结果表明macpnoa1裂解谱宽,对下列蓝藻均有强烈裂解作用。这些藻包括:微囊藻属(microcystis)的铜绿微囊藻fachb-469(m.aeruginosafachb-469)、铜绿微囊藻fachb-925(m.aeruginosafachb-925)、惠氏微囊藻fachb-908(m.wesenbergiifachb-908)、惠氏微囊藻fachb-929(m.wesenbergiifachb-929)、惠氏微囊藻fachb-1112(m.wesenbergiifachb-1112)、绿色微囊藻fachb-979(m.viridisfachb-979),束丝藻属(aphanizomenon)的水华束丝藻fachb-1039(a.flos-aquaefachb-1039);色球藻属(chroococcus)的色球藻fachb-193(chroococcus.spfachb-193);浮丝藻属(planktothrix)的阿氏浮丝藻fachb-920(p.agardhiifachb-920);念珠藻属(nostoc)的念珠藻fachb-596(nostocsp.fachb-596);颤藻属(oscillatoria)的浮游颤藻fachb-708(o.planctonicafachb-708);鱼腥藻属(anabaena)的水华鱼腥藻fachb-245(a.flos-aquaefachb-245)。其中铜绿微囊藻(m.aeruginosa)fachb-925株、惠氏微囊藻(m.wesenbergii)fachb-929株、绿色微囊藻(m.viridis)fachb-979株,水华束丝藻(a.flos-aquae)fachb-1039株,色球藻(c.sp.)fachb-193株和念珠藻(nostocsp.)fachb-596株已被发现为有毒藻。
macpnoa1对动物的保护性应用:(1)取体长为4-5cm的锦鲫,暂养1-2周后用于试验。将噬藻体悬浮液按1∶2的比例接入到指数生长期的水华束丝藻(a.flos-aquae)fachb-1039藻华液中设为实验组,对照组藻华液加入相同体积的培养基。实验组与对照组各放10条锦鲫,置于室温、自然光的条件下,观察并记录锦鲫的状况。结果,8天后实验组藻液由于藻细胞裂解而完全黄化,对照组藻液呈现典型的藻华色;对照组水体中的锦鲫瘦削,体表各处包括鳃、嘴、尾巴、体侧、鳍条等均呈现墨绿色和绿色中毒斑;实验组(藻华水体+macpnoa1)的锦鲫体色、体型正常,表明macpnoa1的存在,对锦鲫有明显的保护作用。(2)取体长为2cm左右的斑马鱼,暂养1-2周后用于试验。将噬藻体悬浮液按1∶2的比例接入到指数生长期的水华束丝藻(a.flos-aquae)fachb-1039藻华液中设为实验组,对照组藻华液加入相同体积的培养基。实验组与对照组各放63条斑马鱼,置于室温、自然光的条件下,观察并记录斑马鱼的状况。结果,5天后实验组(添加macpnoa1的藻华水体)的斑马鱼死亡率为27%,明显低于对照组(未添加噬藻体的藻华水体)的斑马鱼死亡率(57%)。结果表明,macpnoa1大量裂解蓝藻,有效地降低水体中藻毒素的含量,从而对对藻毒素很敏感的斑马鱼有明显保护作用。
与现有技术相比,本发明的优点在于:本发明一种裂解性噬藻体macpnoa1及应用,该裂解性噬藻体是一种新的长尾噬藻体,它感染水华蓝藻后,可以在宿主内快速增殖,并使之裂解。该裂解性噬藻体裂解谱宽,可以广泛地感染并裂解至少7个属的水华蓝藻。因而在水华治理中,该裂解性噬藻体能够作为“控藻因子”来控制多种蓝藻引起的水华。且macpnoa1是从自然水域中分离所得,该裂解性噬藻体macpnoa1可安全、高效、快速的裂解淡水中的蓝藻,对环境和人类不会产生危害。同时macpnoa1培养条件简单,易扩大培养,水温升至40℃也不影响其溶藻活性,在蓝藻水华治理领域具有巨大的应用前景。
附图说明
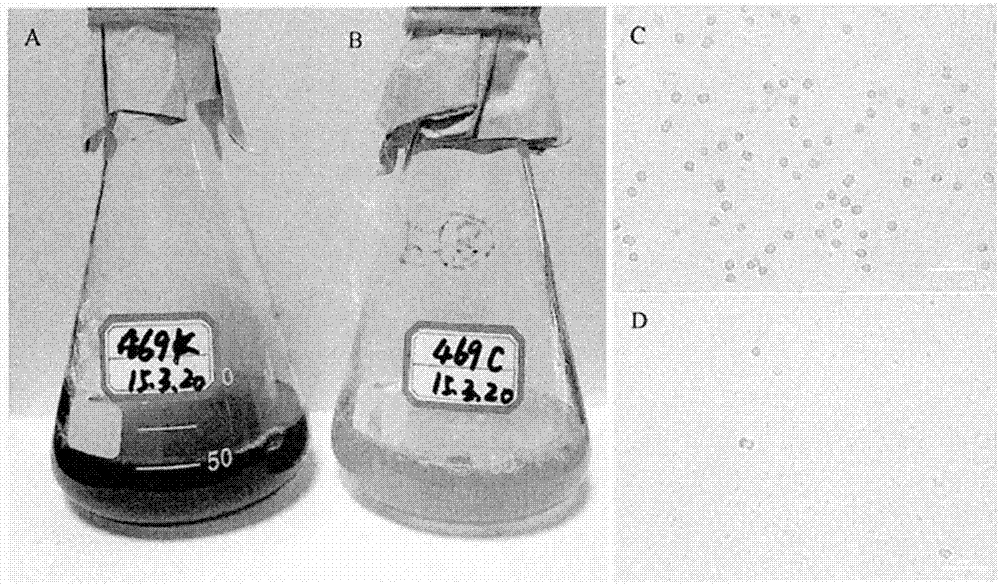
图1噬藻体macpnoa1对铜绿微囊藻fachb-469的裂解效果图:a、c未添加噬藻体的藻液;b、d添加了噬藻体的藻液;c、d为显微图。
图2macpnoa1在铜绿微囊藻fachb-469藻苔上形成的噬藻斑。
图3macpnoa1核酸经dnasei酶、rnasea酶和s1单链核酸酶处理后的琼脂糖凝胶电泳图(泳道1:dnasei酶处理,泳道2:rnasea酶处理,泳道3:s1单链酶处理,泳道4:未处理的核酸);
图4温度、紫外线、氯仿、光照及ph对macpnoa1噬藻体溶藻活性的影响:实验组为添加经过各理化因子处理的噬藻体液的铜绿微囊藻藻液;空白对照为添加bg11的铜绿微囊藻藻液。
图5噬藻体macpnoa1对各种藻华水的处理结果。其中实验组藻华液中添加噬藻体悬液,对照组用bg11代替噬藻体悬液添加于藻华液中。a:铜绿微囊藻fachb-925,b:惠氏微囊藻fachb-908,c:惠氏微囊藻fachb-1112,d:绿色微囊藻fachb-979,e:水华束丝藻fachb-1039,f:阿氏浮丝藻fachb-920,g:念珠藻fachb-596,h:浮游颤藻fachb-708,i:水华鱼腥藻fachb-245。
图6macpnoa1处理藻华水对其中的动物的保护结果。实验组为添加噬藻体的藻华液中的锦鲫;对照组为藻华水体中的锦鲫。
具体实施方式
实施例1
噬藻体macpnoa1的制备方法如下:
(1)噬藻体的初步分离
由浙江省宁波市宁波大学南门水沟采集表层水样,10000×g离心30min,将上清经0.8μm和0.45μm滤膜过滤,将滤过液与处于对数生长期的铜绿微囊藻(m.aeruginosafachb-469)按体积比1∶2的比例混合;同时,将bg11藻培养基按同样比例加入到对数生长期的铜绿微囊藻作为对照;将混合液于光照强度为2000lx,温度为25℃,光暗周期为12h∶12h条件下培养,获得黄化的培养液,并用显微镜观察藻液,确认藻的裂解(图1)。将发生黄化的培养液10000×g离心30min,将上清经0.8μm和0.45μm滤膜过滤,将滤过液与铜绿微囊藻藻液再次按照体积比1∶2的比例混合、培养。如此,进行连续传代感染,直至保持稳定噬藻性,得到噬藻体感染液。
(2)噬藻体的分离纯化
将噬藻体感染液做10倍梯度系列稀释(10-1,10-2,10-3,10-4,10-5,10-6,10-7),取各稀释液分别与浓度为108~109cell/ml的铜绿微囊藻藻液按体积比1∶9的比例混合后,于摇床上室温培养30min,使噬藻体和藻体充分吸附,然后倒入冷却至42℃的含质量体积比为0.7%琼脂的bg-11培养基中,充分混匀后倒入底层含质量体积比为1.5%琼脂的bg-11培养基平板的培养皿中,待其凝固,倒置,于2000lx,25℃,光照周期为12h∶12h的培养箱中培养,每日观察培养情况,7~10天后,刮取所形成的单个噬藻斑。
(3)噬藻体的进一步纯化
将上述步骤(2)得到的噬藻斑悬浮于bg-11培养基中,于4℃涡旋过夜,10,000×g离心20分钟后取上清作为噬藻体感染液,取此感染液进行上述步骤(2)的操作,得到第二代噬藻斑;取第二代噬藻斑,将其悬浮于bg-11培养基中,涡旋4℃过夜后,离心取上清后,将其进行系列梯度稀释,作为噬藻体感染液进行上述步骤(2)的操作,获得第三代噬藻斑。此时,噬藻斑大小形状均一,周围无晕环,边缘清晰规则(图2)。挑取第三代噬藻斑重复将其悬浮于bg-11培养基中,涡旋4℃过夜后,离心取上清后,将其进行系列梯度稀释,稀释液与指数生长的铜绿微囊藻感染混合,进行噬藻斑实验,均可以得到大小形状一致的噬藻斑。
(4)噬藻体的扩大培养
取步骤(3)中获得的单一噬藻斑,悬浮于bg-11培养基中,10,000×g离心20分钟后取上清,将其与对数生长期的铜绿微囊藻(m.aeruginosafachb-469)藻液按体积比1∶2的比例混合培养,获得扩大培养物,10,000×g离心20分钟后取上清,将其与对数生长期的铜绿微囊藻(m.aeruginosafachb-469)藻液混合培养,如此不断扩大培养。
(5)噬藻体的提取
将扩大的培养产物经10,000×g离心30分钟,取上清经0.22μm滤膜过滤后,在4℃下20,000×g离心20min,取上清在4℃下80,000×g离心2h,用bg-11培养基冲洗沉淀,并用bg-11悬浮余下的白色沉淀;悬浮液经10000g离心20min,取上清,再次在4℃下80,000×g离心2h,用bg-11培养基冲洗沉淀,得到的白色沉淀用bg-11悬浮即纯化的噬藻体悬浮液。该纯化的噬菌体保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为:cgmccno.12996,保藏日期为2016年10月24日,保藏单位地址:北京市朝阳区北辰西路1号院3号,邮编100101。
bg-11培养基的配方如下:
实施例2
裂解性噬藻体的形态观察
取实施例1得到的噬藻体悬液滴于铜网,以2%乙酸双氧铀溶液(w/v)进行负染,再置于电子显微镜(日立h-7650)下观察噬藻体的形态。
该噬藻体具有呈圆形的头部结构和细长的不可伸缩的尾部,头部衣壳直径约40nm,尾部长约380nm。
实施例3
噬藻体基因组分析
取实施例1中分离纯化的噬藻体,提取核酸后,分别采用dnasei、rnasea及s1单链核酸酶(s1nuclease)处理,处理方法参照takara说明书进行。将处理后的样品进行琼脂糖核酸电泳,得到的图谱如图3所示,其中泳道1:dnasei酶处理,泳道2:rnasea酶处理,泳道3:s1nuclease酶处理,泳道4:未处理的核酸。结果显示该噬藻体核酸能被dnasei消化,而不能被rnasea酶和s1nuclease酶消化。结果表明噬藻体macpnoa1的基因组为双链dna(dsdna);将macpnoa1的基因组dna采用二代测序法进行全基因组测序。根据国际病毒分类委员会(ictv)2005年发表的《病毒分类-国际病毒分类委员会第八次报告》为标准,macpnoa1属于长尾病毒科,是全新的长尾噬藻体。我们根据其已鉴定的宿主范围(microcystis,aphanizomenon,chroococcus,planktothrix,nostoc,oscillatoria和anabaena),取各宿主属名首字母,将其命名为macpnoa1。
实施例4
不同温度、紫外线(uv253.7nm)、氯仿、光照条件以及ph对macpnoa1噬藻体稳定性的影响
1、热稳定性实验
取实施例1分离纯化得到的噬藻体悬浮液,分装于各试管中,分别置于40℃,50℃,60℃和80℃水浴锅中,处理1h,而后在室温下冷却,将处理过的噬藻体悬浮液加入到对数生长期的铜绿微囊藻fachb-469藻液中混合、培养;同时,将bg11按同样比例加入到对数生长期的铜绿微囊藻fachb-469藻液中作为空白对照;将未处理的噬藻体悬浮液加入对数生长期的铜绿微囊藻fachb-469藻液中作为阳性对照。每组并设置3个平行,在光照强度为2000lx,温度为25℃,光暗周期为12h∶12h条件下培养7~10天,观察并记录od680。
结果如图4所示,噬藻体在40℃处理1h后,感染活力几乎不变;50℃水浴处理后,实验组od680相对于空白对照组由0.2508下降到0.1638,噬藻体还存在感染活性,但相对于阳性对照组而言,感染活力却明显下降;60水浴处理后,感染活力丧失;由于自然水体温度一般达不到40℃,结果说明在自然环境中,温度的升高对噬藻体macpnoa1的溶藻活性不会有明显影响。
2、紫外对噬藻体的影响
取实施例1分离纯化得到的噬藻体悬浮液,置于培养皿中,在紫外下(波长为253.7nm)照射40min后加入到处于对数生长期的铜绿微囊藻fachb-469中,每天测定其od680,在光照强度为2000lx,温度为25℃,光暗周期为12h∶12h条件下培养7~10天,观察并记录od680。
结果如图4所示,在紫外线处理40min后,实验组od680相对于空白组由0.2508下降到0.2005,噬藻体还存在感染活性,但相对于阳性对照组,感染活力却明显下降,说明噬藻体对紫外敏感。
3、氯仿对噬藻体的影响
取5ml实施例1分离纯化得到的噬藻体悬浮液,加入1ml氯仿(1∶5),混匀后用手轻轻摇晃30min,在4℃条件下6000g离心20min取液相加入到处于对数生长期的铜绿微囊藻fachb-469中,每天测定其od680,在光照强度为2000lx,温度为25℃,光暗周期为12h∶12h条件下培养7~10天,通过观察记录od680,判定噬藻体对氯仿的敏感性。
结果如图4所示,经氯仿处理后,实验组od680相对于空白对照组由0.2508下降到0.1297,说明尚有溶藻活性,但相对于阳性对照组,感染活力明显下降。则说明分离所得的噬藻体对氯仿敏感。
4、光照对噬藻体的影响
取实施例1分离纯化得到的噬藻体悬浮液与2份对数生长期的铜绿微囊藻按体积比1∶2感染,分别放在全光照和全黑暗的条件下,温度为25℃,培养7~10天,观察并记录od680。
结果如图4所示,噬藻体在全光照培养条件下,实验组od680相对于空白对照组由0.152下降到0.0781,感染活性几乎不变,相对于阳性对照组和常规的光暗周期为12h∶12h的培养条件,感染活力也没有明显变化;噬藻体在全黑暗培养条件下,实验组od680相对于空白对照组由0.0727降到0.0519,溶藻活性不明显。说明昼夜更替或全光照条件对噬藻体macpnoa1的裂解过程十分重要。
5、ph对噬藻体的影响
取实施例1分离纯化得到的噬藻体悬浮液将ph分别调节为3.2、5.37、8.83和11.06,处理30min后将ph值调回初始值(ph7左右),将处理后的噬藻体悬浮液与对数生长期的铜绿微囊藻按体积比1∶2感染,每天测定其od680,在光照强度为2000lx,温度为25℃,光暗周期为12h∶12h条件下培养7~10天,观察并记录。
结果如图4所示,噬藻体在ph分别为8.83和11.06条件下处理半小时后,实验组od680相对于空白对照组由0.2508分别下降到0.1548和0.1403,说明尚有溶藻活性,但相对于阳性对照组,感染活力却明显下降,而在ph为5.37时,感染活性几乎不变。噬藻体在ph为3.2时,感染活性几乎丧失。说明噬藻体macpnoa1对强酸敏感。
实施例5
macpnoa1对微囊藻属(microcystis)、束丝藻属(aphanizomenon)、浮丝藻属(planktothrix)、念珠藻属(nostoc)、颤藻属(oscillatoria)和鱼腥藻属(anabaena)藻华的应用
取噬藻体悬浮液按1∶2的比例分别添加到下列藻华液中:微囊藻属(microcystis)的铜绿微囊藻m.aeruginosafachb-925,惠氏微囊藻m.wesenbergiifachb-908、m.wesenbergiifachb-1112,绿色微囊藻m.viridisfachb-979,束丝藻属(aphanizomenon)的水华束丝藻a.flos-aquaefachb-1039,浮丝藻属(planktothrix)的阿氏浮丝藻.p.agardhiifachb-920,念珠藻属(nostoc)里面的念珠藻fachb-596,颤藻属(oscillatoria)的浮游颤藻o.planctonicafachb-708,鱼腥藻属(anabaena)的水华鱼腥藻a.flos-aquaefachb-245;对照组藻华液添加同样比例的bg11培养基。每天检测实验组和对照组的od680值的变化,直至实验组藻完全黄化或白化。
对于产毒株铜绿微囊藻fachb-925,结果如图5a所示,对照组藻的od680从0.214一直稳定上升至0.368,相对于起始值上升了72%。而实验组,前2天由0.221上升至0.314,随后开始直线下降,到第8天下降至0.106,相对于起始值下降了52%,对产毒株fachb-925具有很好的裂解作用。
对于惠氏微囊藻fachb-908,结果如图5b所示,对照组藻的od680前6天数值基本不变,从第7天0.259直线上升至第10天0.42,相对于起始值上升了51%。而实验组,前6天od680变化不明显,随后开始直线下降,从第7天0.236下降至第10天0.127,相对于起始值下降了30%,对fachb-908具有较好的裂解作用。
对于惠氏微囊藻fachb-1112,结果如图5c所示,对照组藻的od680从0.168一直稳定上升至0.323,相对于起始值上升了92%。而实验组藻的od680从0.172一直下降至0.127,相对于起始值下降了26%,对fachb-1112具有较好的裂解作用。
对于产毒株绿色微囊藻fachb-979,结果如图5d所示,对照组藻的od680从第一天至第2天稳定上升至0.308,第3天至第6天基本保持不变,从第6天开始直线上升至第8天0.372,相对于起始值上升了48%。而实验组藻的od680从第1天0.275上升至第2天0.323,随后直线下降至第8天0.102,相对于起始值下降了63%,对产毒株fachb-979具有很好的裂解作用。
对于产毒株水华束丝藻fachb-1039,结果如图5e所示,对照组藻的od680从0.131稳定上升至0.184,相对于起始值上升了40%。而实验组藻的od680从0.143稳定下降至0.0551,相对于起始值下降了61%,对产毒株fachb-1039具有很好的裂解作用。
对于阿氏浮丝藻fachb-920,结果如图5f所示,对照组藻的od680从0.072稳定上升至0.096,相对于起始值上升了33%。而实验组藻的od680从0.075稳定下降至0.054,相对于起始值下降了28%,对fachb-920具有较好的裂解作用。
对于产毒株念珠藻fachb-596,结果如图5g所示,对照组藻的od680从0.142稳定上升至0.195,相对于起始值上升了37%。而实验组藻的od680从0.17稳定下降至0.091,相对于起始值下降了46%,对产毒株fachb-596具有较好的裂解作用。
对于浮游颤藻fachb-708,结果如图5h所示,对照组藻的od680从整体而言呈上升趋势,从0.106上升至0.316,相对于起始值上升了198%。而实验组藻的od680整体呈先上升后下降的趋势,从0.1上升至0.262再下降至0.07,总体相对于起始值下降了30%,对fachb-708具有较好的裂解作用。
对于水华鱼腥藻fachb-245,结果如图5i所示,对照组藻的od680从整体而言呈上升趋势,从0.086上升至0.203,相对于起始值上升了136%。而实验组藻的od680整体呈下降的趋势,从0.145下降至0.061,总体相对于起始值下降了58%,对fachb-245具有很好的裂解作用。
实施例5
macpnoa1对动物的保护性应用:
(1)取体长为2cm左右的斑马鱼,暂养1-2周后用于试验。将噬藻体悬浮液按1∶2的比例接入到指数生长期的水华束丝藻(a.flos-aquae)fachb-1039藻华液中设为实验组,对照组藻华液加入相同体积的培养基。实验组与对照组各放63条斑马鱼,置于室温、自然光的条件下,观察并记录斑马鱼的状况。结果,5天后实验组(添加macpnoa1的藻华水体)的斑马鱼死亡率为27%,明显低于对照组(未添加噬藻体的藻华水体)的斑马鱼死亡率(57%)。结果表明,macpnoa1大量裂解蓝藻,有效地降低水体中藻毒素的含量,从而对对藻毒素很敏感的斑马鱼有明显保护作用。
(2)取体长为4-5cm的锦鲫,暂养1-2周后用于试验。将噬藻体悬浮液按1∶2的比例接入到指数生长期的水华束丝藻(a.flos-aquae)fachb-1039藻华液中设为实验组,对照组藻华液加入相同体积的培养基。实验组与对照组各放10条锦鲫,置于室温、自然光的条件下,观察并记录锦鲫的状况。结果,8天后实验组藻液由于藻细胞裂解而完全黄化,对照组藻液呈现典型的藻华色;对照组水体中的锦鲫瘦削,体表各处包括鳃、嘴、尾巴、体侧、鳍条等均呈现墨绿色和绿色中毒斑;实验组(藻华水体+macpnoa1)的锦鲫的体色、体型正常(图6),表明macpnoa1的存在,对锦鲫有明显的保护作用。
上述说明并非对本发明的限制,本发明也并不限于上述举例。本技术领域的普通技术人员在本发明的实质范围内,作出的变化、改型、添加或替换,也应属于本发明的保护范围,本发明的保护范围以权利要求书为准。
- 还没有人留言评论。精彩留言会获得点赞!