一种基于鸡胚成瘤模型的接种细胞固定方法与流程
本发明属于生物工程技术领域,涉及一种基于鸡胚成瘤模型建立过程中的接种细胞固定方法,特别涉及利用硅胶圈作为细胞悬液载体的固定方法。
背景技术
鸡胚尿囊膜(cam)模型是研究血管生成的器官水平的活体模型,将人肿瘤细胞接种到鸡胚上,从蛋壳开窗可观察到肿瘤的全部生长过程,效果直观而明显,与小鼠肿瘤模型相比具有简便价廉、便于动态观察、敏感性强、易于大样本重复等优点,鸡胚成瘤模型适用于肿瘤血管生成因子及药物的筛选及研究,为肿瘤抗血管生成治疗研究提供一个良好的模型。
实验过程中,常以甲基纤维素、玻璃纤维滤纸和明胶海绵作为接种细胞的载体,但都存在一定的缺陷。肿瘤细胞接种需要一定的体积,甲基纤维素和玻璃纤维滤纸容易导致导致肿瘤细胞悬液外流或分部不均匀,不易固定,造成肿瘤细胞局部密集生长,使接种体积受到限制,且肿瘤细胞局部密集易使鸡胚致死,造模成功率下降;明胶海绵因其较厚会造成接种细胞加入体积少量时不能直接接触到尿囊膜表面,且不易观察载体下面血管变化情况,最终导致观察和统计困难。
技术实现要素:
本发明针对上述现有技术中存在的问题提供一种便利于细胞固定和便于拍照观察统计的细胞悬液的固定载体及方法。
为了实现上述目的,本发明采用以下技术方案
一种基于鸡胚成瘤模型的接种细胞固定方法,将硅胶圈作为细胞载体应用于鸡胚成瘤模型建立过程中,包括以下步骤:
s1、将硅胶圈进行前期处理;
s2、把处理后的硅胶圈自然晾干;
s3、将胚蛋在温度为35~40℃、湿度为60~80%的培养箱中孵育2~4天,在胚蛋顶端剪开(0.5~1.5)cm×(0.5~1.5)cm窗口,将硅胶圈放到绒毛尿囊膜上;
s4、将硅胶圈作为载体进行细胞接种,将培养细胞掺入细胞外基质,制成细胞悬液,滴加到硅胶圈内;
s5、后期的观察和统计,35~40℃、湿度为50~65%条件下孵育3天,并镜检拍照。
优选地,所述硅胶圈为o型圈。
优选地,所述硅胶圈外径为0.8~1.2cm,内径为0.6~1.0cm。
优选地,所述硅胶圈外径为1cm,内径为0.8cm。
优选地,所述硅胶圈的材质为高透明硅胶。
优选地,步骤s1中,所述硅胶圈使用前处理方式为:0.005~0.02%无菌多聚赖氨酸溶液常温浸泡0.5~2小时。
优选地,所述硅胶圈使用前处理方式为:0.01%无菌多聚赖氨酸溶液常温浸泡1小时。
优选地,步骤s2中,在超净工作台上自然晾干。
优选地,步骤s1之前,硅胶圈使用70%乙醇溶液清洗、烘干、无菌保存。
本发明的有益效果:与明胶海绵和纤维滤纸载体等相比,硅胶圈作为鸡胚成瘤模型建立中的接种载体具有良好的固定细胞悬液的作用,加样量准确;使细胞悬液和细胞外环境隔离开,均匀分布于o型圈内,效果直观,在显微镜下易于拍照观察、统计;使造模稳定,提高鸡胚成活率;硅胶圈具有透明,药物不易外延,便于观察的优点,以硅胶圈作为接种载体具有细胞悬液固定良好,效果直观,加样量准确,在显微镜下易于观察、照相的优点。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
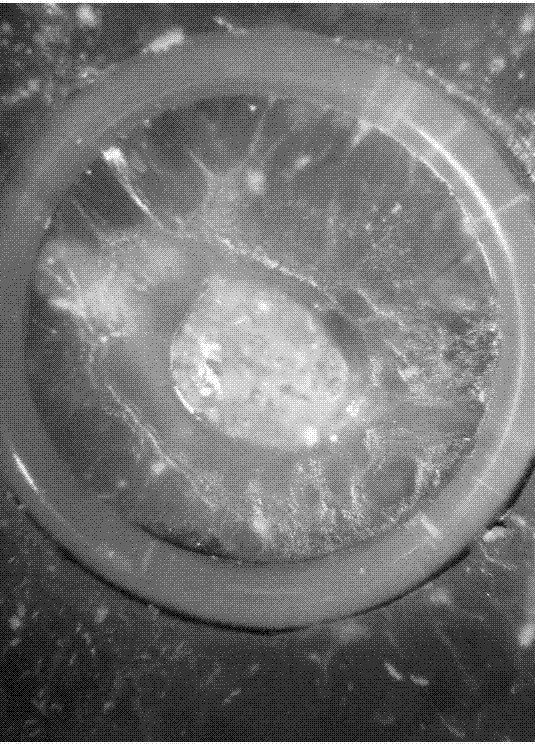
图1为硅胶圈作为固定载体示意图。
图2为肺癌细胞的培养后在显微镜下的形态图。
图3为肝癌细胞的培养后在显微镜下的形态图。
具体实施方式
下面将结合本发明的实施例或附图,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
所述一种基于鸡胚成瘤模型的接种细胞固定方法,将硅胶圈作为细胞载体应用于鸡胚成瘤模型建立过程中,包括以下步骤:
s1、将硅胶圈进行前期处理;
s2、把处理后的硅胶圈自然晾干;
s3、将胚蛋在温度为35~40℃、湿度为60~80%的培养箱中孵育2~4天,在胚蛋顶端剪开(0.5~1.5)cm×(0.5~1.5)cm窗口,将硅胶圈放到绒毛尿囊膜上;
s4、将硅胶圈作为载体进行细胞接种,将培养细胞掺入细胞外基质,制成细胞悬液,滴加到硅胶圈内;
s5、后期的观察和统计,35~40℃、湿度为50~65%条件下孵育3天,并镜检拍照。
其中,所述硅胶圈为o型圈,o型结构可保证细胞悬液扩散均匀,利于观察。
所述硅胶圈外径为0.8~1.2cm,内径为0.6~1.0cm,硅胶圈外径优选为1cm,内径优选为0.8cm。
所述硅胶圈的材质为高透明硅胶,透明度高,有利于后期显微镜下进行观察。
步骤s1中,所述硅胶圈使用前处理方式为:0.005~0.02%无菌多聚赖氨酸溶液常温浸泡0.5~2小时,优选:0.01%无菌多聚赖氨酸溶液常温浸泡1小时;多聚赖氨酸溶液作为载体玻片处理剂,防止使用过程中组织脱片。
步骤s1之前,硅胶圈使用70%乙醇溶液清洗、烘干、无菌保存,保证硅胶圈自身的洁净和无菌,使其减少对后期操作的影响。
步骤s2中,在超净工作台上自然晾干,超净工作台避免沾染其他杂菌,影响后续的培养结果。
实施例1
选用硅胶圈作为细胞载体。
s1、将外径为1cm,内径为0.6cm的硅胶圈浸入0.01%无菌多聚赖氨酸溶液常温浸泡1小时进行处理;
s2、处理好的硅胶圈超净工作台上自然晾干;
s3、将胚蛋在温度为35℃、湿度为65%的培养箱中孵育3天,在胚蛋顶端剪开1cm×1cm窗口,将硅胶圈放到绒毛尿囊膜上;
s4、将硅胶圈作为载体进行细胞接种,将培养细胞掺入细胞外基质,制成细胞悬液,滴加到硅胶圈内;
s5、后期的观察和统计,35℃、湿度为55%条件下孵育3天,并镜检拍照。
图1为硅胶圈作为固定载体的示意图,如图1所示,硅胶圈具有透明,药物不易外延,便于观察的优点,以硅胶圈作为接种载体具有细胞悬液固定良好,效果直观,加样量准确,在显微镜下易于观察、照相的优点。
实施例2
选用硅胶圈作为细胞载体,选用肺癌细胞作为培养细胞。
s1、将外径为1cm,内径为0.6cm的硅胶圈浸入0.01%无菌多聚赖氨酸溶液常温浸泡1小时进行处理;
s2、处理好的硅胶圈超净工作台上自然晾干;
s3、将胚蛋在温度为35℃、湿度为65%的培养箱中孵育3天,在胚蛋顶端剪开1cm×1cm窗口,将硅胶圈放到绒毛尿囊膜上;
s4、将硅胶圈作为载体进行细胞接种,将3*106个肺癌细胞掺入细胞外基质,制成细胞悬液,滴加到硅胶圈内;
s5、后期的观察和统计,35℃、湿度为55%条件下孵育3天,并镜检拍照。
图2为肺癌细胞的培养后在显微镜下的形态图,肺癌细胞与绒毛尿囊膜对比明显;显微镜下可见膜各层组织细胞结构完整,组织细微结构清晰、特征明显,能较准确显示各层组织细胞的细微结构及其在外套膜各部位的分布情况。
实施例3
选用硅胶圈作为细胞载体,选用肝癌细胞作为培养细胞。
s1、将外径为1cm,内径为0.8cm的硅胶圈浸入0.015%无菌多聚赖氨酸溶液常温浸泡1.5小时进行处理;
s2、处理好的硅胶圈超净工作台上自然晾干;
s3、将胚蛋在温度为40℃、湿度为75%的培养箱中孵育4天,在胚蛋顶端剪开1.2cm×1.2cm窗口,将硅胶圈放到绒毛尿囊膜上;
s4、将硅胶圈作为载体进行细胞接种,将5*106个肺癌细胞掺入细胞外基质,制成细胞悬液,滴加到硅胶圈内;
s5、后期的观察和统计,40℃、湿度为60%条件下孵育3天,并镜检拍照。
图3为肝癌细胞的培养后在显微镜下的形态图,肺癌细胞与绒毛尿囊膜对比明显;显微镜下可见膜各层组织细胞结构完整,组织细微结构清晰、特征明显,能较准确显示各层组织细胞的细微结构及其在外套膜各部位的分布情况。
对照组1
选用明胶海绵作为细胞载体,其他同实施例2。
观察结果,肺癌细胞在尿囊膜表面分别不均匀;明胶海绵对观察视线有影响,导致肺癌细胞与绒毛尿囊膜对比不明显,不易观察载体下面血管变化情况,最终导致观察和统计困难。
对照组2
选用纤维滤纸作为细胞载体,其他同实施例3。
观察结果,肝癌细胞悬液外流或分部不均匀,不易固定,肺癌细胞局部密集生长,局部稀少,使接种体积受到限制。
在本说明书的描述中,参考术语“一个实施例”、“示例”、“具体示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
最后需要说明的是,以上公开的本发明优选实施例只是用于帮助阐述本发明。优选实施例并没有详尽叙述所有的细节,也不限制该发明仅为所述的具体实施方式。显然,根据本说明书的内容,可作很多的修改和变化。本说明书选取并具体描述这些实施例,是为了更好地解释本发明的原理和实际应用,从而使所属技术领域技术人员能很好地理解和利用本发明。本发明仅受权利要求书及其全部范围和等效物的限制。
- 还没有人留言评论。精彩留言会获得点赞!