一种特异性的间充质干细胞外泌体提取方法与流程
本发明属于细胞
技术领域:
,具体涉及一种特异性的间充质干细胞外泌体提取方法。
背景技术:
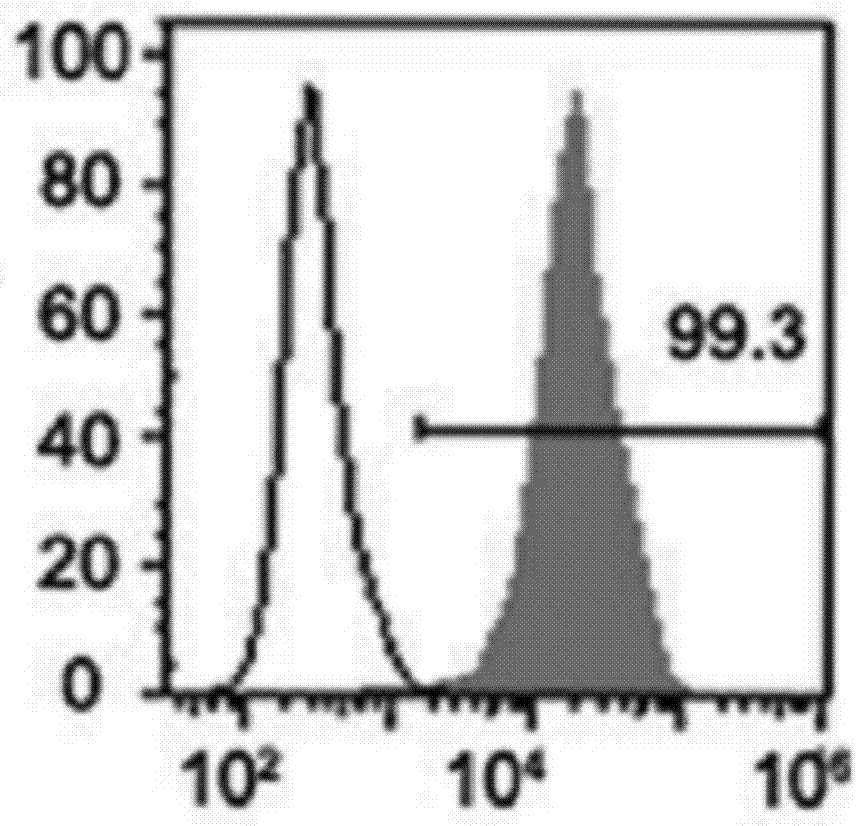
间充质干细胞(mesenchyamlstemcells,mscs)是一类多能干细胞,它源于发育早期的中胚层和外胚层,可以在骨髓、脂肪、滑膜、骨骼、肌肉和脐带等多种组织中分离,经诱导后可分化为脂肪、骨、软骨、肌肉、肌腱、韧带、神经肝、心肌和内皮等多种组织细胞。过去,常常认为间充质干细胞可巢居到受损部位后直接定向分化为靶细胞来发挥作用。然而,有研究表明,间充质干细胞巢居到损伤部位的比例和分化为靶细胞的数量都是非常有限的,而且分化为所需靶细胞的这一过程非常短暂,与观察到的治疗效果在时间上互相矛盾。因此,越来越多的研究倾向于认为间充质干细胞主要通过旁分泌机制来分泌多种细胞因子作用于其他细胞来发挥作用。外泌体(exosome,exo)作为旁分泌的一个重要组成部分,它是由各种活体细胞分泌的大小约为30~100nm之间,密度在1.13~1.19g/ml之间的脂质双层膜囊泡状结构小体,与质膜融合后,以胞吐形式释放到细胞外环境中。当外泌体与靶细胞接触后,外泌体及其携带的生物分子(如功能性的脂类、蛋白质,信使rnas(mrnas)、micrornas等分子)以胞吞的形式被接收并发挥作用。因此,大量的研究也发现间充质干细胞确实可以通过自身的外泌体发挥与细胞相类似的组织修复、免疫抑制调节免疫功能等作用。如早在2007年,timmer等团结就发现,msc的细胞外基质可以有效地减轻缺血再灌注损伤,通过猪的心脏缺血/再灌注模型给予msc的细胞外基时质处理,可以减少心脏梗死面积达将近60%。通过对细胞外基质内在活性物质的研究分析,电镜观察到是一群大小在50~200nm间的脂质双分子囊泡,并且特异性表达cd81、cd9、alix等蛋白,基本符合外泌体的基本特性。除此之外,在肾损伤修复方面,有人通过5/6肾全切构建小鼠慢性肾损伤模型时,分别给与30ug间充质干细胞外泌体和1×106间充质干细胞,通过尾静脉注射处理,7天后解剖显示,与给予pbs的空白对照组相比,间充质干细胞处理组和间充质干细胞外泌体处理组的小鼠血尿素氮、血肌酐、尿酸比例都出现减少,改善了组织纤维化和间质淋巴细胞浸润现象。这些均证实,间充质干细胞确实可通过分泌外泌体发挥旁分泌功能。并且与细胞治疗相比较,外泌体性质更稳定,保存运输方便,没有移植细胞带来的免疫排斥反应和肿瘤形成风险,因此这种“无细胞的外泌体”有望成为一种新的治疗策略。如何获得分离外泌体并获得高纯度的外泌体是当前科研工作者及其关注的问题,它对后续的应用研究至关重要。因此,本专利针对此问题发明一种可收集高浓度的、特异性的间充质干细胞来源的外泌体。目前,外泌体的分离提取方法主要有:超速离心、免疫磁珠、超滤法、沉淀或试剂盒等方法。这些方法具体如下:1、超速离心法(差速离心法):超离法是最常用的外泌体纯化手段,采用低速离心、高速离心交替进行:即细胞培养上清液在300g,10min离心,沉淀,取细胞上清液;2000g离心10min去除死细胞沉淀,取上清液;再接着1000g,30min分离,沉淀,去除细胞碎片沉淀物,获得的上清在>10000g,70min分离条件下,获得的沉淀为外泌体沉淀和其他干扰蛋白质,最后将这些沉淀再次用pbs洗涤,在>100000g离心70min,沉淀即可得到外泌体。超速离法因操作简单,获得的囊泡数量较多而广受欢迎,但过程比较费时,且回收率不稳定(可能与转子类型有关),纯度也受到质疑;此外,重复离心操作还有可能对囊泡造成损害,从而降低其质量。2、密度梯度离心:该方法是将样本和不同蔗糖密度材料混合在一起离心。在超速离心力作用下,使蔗糖溶液形成从低到高连续分布的密度阶层,以致使样品中的不同组分沉降到各自的等密度区,形成一种区带进而分离的方法。如实验中常用蔗糖密度梯度离心法是预先将两种浓度蔗糖溶液(如2.5m和0.25m)配成连续梯度体系置于超速离心管中,样本铺在蔗糖溶液上,100000g离心16h,外泌体会沉降到等密度区(1.10~1.18g/ml)。用此种方法分离到的外泌体纯度高,但是前期准备工作繁杂,耗时,产量少。在干细胞来源的外泌体提取相关专利未见报道。3、超滤离心:由于外泌体是一个大小约几十纳米的囊状小体,大于一般蛋白质,利用不同截留相对分子质量(mwco)的超滤膜对样品进行选择性分离,便可获得外泌体。超滤离心法简单高效,且不影响外泌体的生物活性,是提取细胞外泌体的一种新方法。申请号为201710447410.4的中国专利公开了干细胞外泌体的分离方法,他们通过联合运用不同大小的浓缩管可以快速收集干细胞外泌体。即:通过对无菌的外泌体分别采用10kd超滤管进行4℃,3500~4500g离心35~45min后,将获得的浓缩液,再次将用新的10kd超滤管在常温条件下再次离心,条件为150000g,8~12min,收集浓缩液;最后则常温条件下(15~30℃)进一步采用900~1100g离心1.5~2.5min,收集管中获得的液体则为含高浓度干细胞外泌体的溶液。他们表明,他们提供的分离法法离心时间比超速离心时间短,可有效减少外泌体的机械损伤,更好的保留外泌体的活性。4、磁珠免疫法:外泌体表面有其特异性标记物(如cd63、cd9蛋白),用包被抗标记物抗体的磁珠与外泌体囊泡孵育后结合,即可将外泌体吸附并分离出来。磁珠法具有特异性高、操作简便、不影响外泌体形态完整等优点,但是效率低,外泌体生物活性易受ph和盐浓度影响,不利于下游实验,难以广泛普及。5、peg-base沉淀法:聚乙二醇(peg)可与疏水性蛋白和脂质分子结合共沉淀,早先应用于从血清等样本中收集病毒,现在也被用来沉淀外泌体,其原理可能与竞争性结合游离水分子有关。利用peg沉淀外泌体存在不少问题:比如纯度和回收率低,杂蛋白较多(假阳性),颗粒大小不均一,产生难以去除的聚合物,机械力或者吐温-20等化学添加物将会破坏外泌体等,因此发表文章时易受质疑。6、试剂盒提取:近几年来,市场上已出现各种商业化的外泌体提取试剂盒,有的是通过特殊设计的过滤器过滤掉杂质成分,有的则采用空间排阻色谱法(sec)进行分离纯化,也有的则利用化合物沉淀将法外泌体沉淀出来。虽然这些方法各有其特点,但是磁珠免疫法、peg-base沉淀法和试剂盒提取方法仅适用小样本的外泌体提取,并不适用于大规模外泌体的收集。而蔗糖梯度离心的方法又相对费时,超滤离心需要不断更换滤膜。另外,这些方案均未针对各类样品进行特异性外泌体的分离优化。因此本方案主要针对最常见的、适于分离、提取间充质干细胞来源的外泌体的超速离心法进行优化,发明出一种适用于间充质干细胞并能分离出特异性外泌体的分离提取方法。如上所述,超速离心法简单来说将细胞培养液或体液等样本依次在300g、2000g、10000g离心去除细胞碎片和大分子蛋白质,最后100000g离心得到外泌体。申请号为201610279473.9的中国专利公开了一种外泌体、外泌体的制备方法及其在制备治疗脓毒症药物或者制剂中的应用,公开了白介素-1β(il-1β)优化的脐带间充质干细胞来源外泌体在治疗脓毒症中的应用时,外泌体收集和分离提取的方法是:①采取第3-7代的间充质干细胞(mscs)接种于10cm培养皿中,待细胞融合达到60-70%时,加入重组人il-1β,使得终浓度为10ng/m1,处理12-24小时;用pbs清洗细胞两次,更换含10%无外泌体fbs的dmem/f12培养基继续培养48-72小时。其中无外泌体的fbs是通过100,00g超速离心18小时后去除沉淀的fbs;②收集步骤①中的培养基上清液,用差速离心的方法收集外泌体:无菌收集步骤①中最后一步所得的培养基上清液于500m1无菌离心瓶或50ml聚丙烯离心管中,于4℃、2000g离心10分钟,以去除死细胞和大的碎片;小心将上清液转移到新的无菌离心管中,于4℃,10,000g离心30分钟,以去除细胞器及小颗粒;小心将上清液转移到无菌超速离心管中,于4℃、110,000g超速离心70分钟,小心弃去上清,再加注射用生理盐水清洗一次,于4℃、110000g超速离心70分钟,得到的沉淀即为il-1β优化的人脐带间充质干细胞来源的外泌体。用生理盐水重悬外泌体,测定蛋白浓度后-80℃分装保存。申请号为201711104768.3的中国专利公开了一种人脐带间充质干细胞外泌体外用乳霜及其制备方法,该发明配方中的外泌体收集提取的方法也是超速离心法,即:取p2~p5代的人脐带间充质干细胞,用dmem/f12培养液进行培养,直到细胞达70%融合时,改用无血清的饥饿培养液,培养12h,将无血清的饥饿培养液换为含有10ng/ml表皮细胞生长因子的dmem/f12培养液,培养至细胞处于对数生长期,收集细胞培养上清液300g~10000g梯度离心60-120min,将离心所得上清液用0.22um滤器过滤,得到人脐带间充质干细胞外泌体提取液。申请号为201510779110.7的中国专利公开了mir-145-5p修饰脐带间充质干细胞分泌的外泌体及其制备与应用,该发明在抽提高表达的micror-145-5p修饰的umsc外泌体时,采用的方法也是超速离心法,即:对即将抽提的mir-145-5p修饰的ucmsc更换成exosome-freefbs培养基,培养48-72h后收集上清,然后将其于4℃,300×g,10min离心除去细胞碎片;4℃,2000×g,10min离心去除死细胞等杂质;0.22um无菌滤膜过滤进一步去除杂质;4℃,100000×g,120min超速离心得到含有microrna145-5p过表达的exosome沉淀,加入约200ulpbs洗涤一遍;再次4℃,100000×g,120min超速离心,可得到较纯浓度由microrna145-5p修饰的脐带间充质干细胞来源的外泌体。将其保存于80℃,可长期保存。现有技术中的分离提取充质干细胞来源的外泌体方法虽然比较常见,但是存在以下问题:(1)虽然超速离心法收集到的外泌体比较多,由于现今微泡和外泌体没有非常统一的鉴定标准,收集到的外泌体纯度不佳,所以电镜鉴定时发现外泌体聚集成块,质量不好;(2)现有的外泌体提取方法均无细胞特异性,如超速离心法,不同大小和种类的细胞均为同一超速离心条件,即300g、2000g、10000g、100000g离心,那样超速离心的方法当然难以满足不同细胞类型的离心条件,因此需要对不同细胞类型的外泌体离心条件进行优化;(3)虽然超滤离心法简单,采用超滤管离心操作只需1h,相对超速离心管耗时接近2.5h,可节省1.5h,但是整个离心过程需要更换至少2次滤膜,价格昂贵。而且单纯的超滤方法收集的外泌体浓度不能达到很高,对于需要较高浓度外泌体的检测和治疗等应用也是一种限制。鉴于以上原因,特提出本发明。技术实现要素:为了解决现有技术存在的以上问题,本发明提供了一种特异性的间充质干细胞外泌体提取方法,该方法主要在传统的超速离心的基础上,对离心率进行优化,研究出了一种适于大规模分离提取间充质干细胞外泌体分离提纯方法,该方法提取的充质干细胞外泌体不仅纯度高,获取的外泌体蛋白含量也高,内含活性物质丰富,还具有特异性标志物评估间充质干细胞的外泌体的质量和潜在疗效。为了实现上述目的,本发明采用如下技术方案:一种特异性的间充质干细胞外泌体提取方法,所述的方法包括如下步骤:(1)无血清的间充质干细胞的上清液的收集:首先进行间充质干细胞的培养,将细胞融合度达到60-70%的间充质干细胞,用pbs清洗,更换成无血清相关成分的培养基进行培养,待细胞长满平底,收集培养基,离心,去除细胞碎片,得到初始上清液;(2)取所述初始上清液在进一步梯度离心2000g离心10min,除去死细胞和大的碎片,得到离心后的上清液;(3)将所述离心后的上清液转移到离心管中,在10000g离心30min,收集到含有微囊泡的上清液;(4)将含有微囊泡的上清液在70000g离心60min,得到含有外泌体的沉淀,清洗,然后再70000g离心70min,得到外泌体沉淀;(5)将得到的外泌体沉淀加入pbs,用过滤膜过滤,得到所述的特异性的间充质干细胞外泌体。进一步的,步骤(1)中培养间充质干细胞的培养基为浓度为5%的pla的ɑ-mem培养基或为浓度为15%的fbs的ɑ-mem培养基。进一步的,所述的培养基放置在37℃,co2浓度为5%的培养箱中培养。进一步的,步骤(1)更换成无血清相关成分的培养基为ɑ-mem或dmem/f12培养基,所述培养基中pla或fbs的浓度均为0。本发明中更换成无血清相关成分的培养基是为了避免pla或fbs(血小板裂解物)残留对后续外泌体提取的影响。进一步的,更换培养基后进行的培养时间为48-72小时。进一步的,步骤(1)中离心的条件为300-500g离心5-10min。进一步的,步骤(2)-(4)中离心的温度为4℃。进一步的,步骤(5)中加入的180-220ul无菌pbs。进一步的,步骤(5)中过滤膜的孔径为0.1um。本发明中采用孔径为0.1um的过滤膜过滤,确保得到真正的纳米级外泌体。进一步的,外泌体提取的每一步骤均在无菌的条件下进行操作。与现有技术相比,本发明的有益效果如下:(1)本发明收集的外泌体采用过滤膜过滤,可以确保提取的外泌体为纳米级;本发的超速离心采用70000g,提取出来的间充质干细胞外泌体内含丰富的活性物质,减少了高速的机械损伤,分离效率高,成本低;(2)本发明的提取方法是在传统的超速离心的基础上,对离心率进行了优化,得出了一种适合大规模分离提取间充质干细胞外泌体提取方法,该方法提取的间充质干细胞外泌体不仅纯度高,获取的外泌体蛋白总量也高,内含活性物质丰富,还具有特异性标志物评估间充质干细胞的外泌体的质量和潜在的疗效;(3)本发明的方法提取的外泌体含有小分子物质对促进血管修复和抗纤维化具有较好的作用。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1:脐带来源的第三代间充质干细胞的cd29流式表型检测;图2:脐带来源的第三代间充质干细胞的cd90流式表型检测;图3:脐带来源的第三代间充质干细胞的cd44流式表型检测;图4:脐带来源的第三代间充质干细胞的cd73流式表型检测;图5:脐带来源的第三代间充质干细胞的cd105流式表型检测;图6:脐带来源的第三代间充质干细胞的cd14流式表型检测;图7:脐带来源的第三代间充质干细胞的cd34流式表型检测;图8:脐带来源的第三代间充质干细胞的cd45流式表型检测;图9:脐带来源的第三代间充质干细胞的cd19流式表型检测;图10:脐带来源的第三代间充质干细胞的hla-dr流式表型检测;图11:对照组提取方法提取的外泌体在电镜观察下的形态图;图12:试验组提取方法提取的外泌体在电镜观察下的形态图;图13:蛋白印迹法鉴定试验组和对照组不同分离提取方法的外泌的cd63和cd81蛋白表达情况。图14:qrt-pcr检测mir-486-5p在脐带间充质干细胞来源的外泌体的相对表达量图。具体实施方式为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。本发明的间充质干细胞为人脐带间充质干细胞。实施例1本实施例的一种特异性的间充质干细胞外泌体提取方法,所述的方法包括如下步骤:(1)无血清的间充质干细胞的上清液的收集:首先进行间充质干细胞的培养,所述培养基为浓度为5%的pla的ɑ-mem培养基,放入37℃,co2浓度为5%的培养箱中培养;当细胞融合度达到60%,用pbs清洗两次,更换成无血清相关成分的培养基进行培养,待细胞长满平底,收集培养基,更换成无血清相关成分的培养基为ɑ-mem,且更换后的培养基中pla或fbs的浓度均为0,进行培养48小时;300g离心10min离心,去除细胞碎片,得到初始上清液;(2)取所述初始上清液在进一步梯度离心,在4℃,2000g离心10min,除去死细胞和大的碎片,得到离心后的上清液;(3)将所述离心后的上清液转移到离心管中,在4℃,10000g离心30min,收集到含有微囊泡的上清液;(4)将含有微囊泡的上清液在4℃,70000g离心60min,得到含有外泌体的沉淀,pbs清洗一遍,然后再70000g离心70min,得到外泌体沉淀;(5)将得到的外泌体沉淀加入180ulpbs,用0.1um过滤膜过滤,得到所述的特异性的间充质干细胞外泌体;其中,外泌体提取的每一步骤均在无菌的条件下进行操作。实施例2(1)无血清的间充质干细胞的上清液的收集:首先进行间充质干细胞的培养,所述培养基为浓度为15%的fbs的ɑ-mem培养基,放入37℃,co2浓度为5%的培养箱中培养;当细胞融合度达到65%,用pbs清洗两次,更换成无血清相关成分的培养基进行培养,待细胞长满平底,收集培养基,更换成无血清相关成分的培养基为dmem/f12,且更换后的培养基中pla或fbs的浓度均为0,进行培养60小时;400g离心8min离心,去除细胞碎片,得到初始上清液;(2)取所述初始上清液在进一步梯度离心,在4℃,2000g离心10min,除去死细胞和大的碎片,得到离心后的上清液;(3)将所述离心后的上清液转移到离心管中,在4℃,10000g离心30min,收集到含有微囊泡的上清液;(4)将含有微囊泡的上清液在4℃,70000g离心60min,得到含有外泌体的沉淀,pbs清洗一遍,然后再70000g离心70min,得到外泌体沉淀;(5)将得到的外泌体沉淀加入200ulpbs,用0.1um过滤膜过滤,得到所述的特异性的间充质干细胞外泌体;其中,外泌体提取的每一步骤均在无菌的条件下进行操作。实施例3(1)无血清的间充质干细胞的上清液的收集:首先进行间充质干细胞的培养,所述培养基为浓度为15%的fbs的ɑ-mem培养基,放入37℃,co2浓度为5%的培养箱中培养;当细胞融合度达到70%,用pbs清洗两次,更换成无血清相关成分的培养基进行培养,待细胞长满平底,收集培养基,更换成无血清相关成分的培养基为ɑ-mem,且更换后的培养基中pla或fbs的浓度均为0,进行培养60小时;500g离心5min离心,去除细胞碎片,得到初始上清液;(2)取所述初始上清液在进一步梯度离心,在4℃,2000g离心10min,除去死细胞和大的碎片,得到离心后的上清液;(3)将所述离心后的上清液转移到离心管中,在4℃,10000g离心30min,收集到含有微囊泡的上清液;(4)将含有微囊泡的上清液在4℃,70000g离心60min,得到含有外泌体的沉淀,pbs清洗一遍,然后再70000g离心70min,得到外泌体沉淀;(5)将得到的外泌体沉淀加入220ulpbs,用0.1um过滤膜过滤,得到所述的特异性的间充质干细胞外泌体;其中,外泌体提取的每一步骤均在无菌的条件下进行操作。试验例1不同离心条件对间充质干细胞外泌体分离提取的影响试验方法试验组:采用本发明方法进行提取外泌体;对照组:采用传统超速离心方法,即300g、2000g、10000g、100000g;1试验方法评价试验组和对照组的对脐带间充质干细胞的外泌体抽提总量和表型的影响,评价不同超速离心方法对间充质干细胞提取的效果,以及两种提取方法对神经元细胞生长的影响,具体方法如下:1.1细胞培养方法分别将收集到的脐带间充质干细胞(uc-mscs)按照2000-5000个/cm2的密度进行接种,然后加入适量的干细胞完全培养基,培养基为amem的15%fbs或5%pla,置于37℃,co2浓度为5%的培养箱中培养,当胞贴壁连生面积达70%~90%后(贴壁细胞生长至70%-90%融合时),可根据实验需要然后进行后续实验。1.2脐带间充质干细胞的流式检测msc细胞复苏后培养到80-90%融合度时进行流式检测。准备消化好的代脐带间充质干细胞,pbs洗涤后对细胞进行抗体标记,标记抗体分别是cd29、cd73、cd105、cd90、cd44、cd14、cd34、fcd45、hla-dr、cd19。经孵育洗涤后,上机检测。1.3外泌体提取(1)传统超速离心法:将待提取的且细胞融合度达到70%的msc用pbs洗涤2遍,换成无fbs或pla的a-mem,培养48小时。然后收上清,分次离心:①300g,10分钟,去除细胞及其碎片;②2000g,10分钟,去除死去的细胞及其碎片;③10000g,30分钟,去除细胞碎片;④将上清液以50注射器接0.22μm滤膜过滤;⑤100000g,1小时,可见沉淀(外泌体和蛋白成分);⑥弃去上清,保留沉淀,加入pbs;⑦100000g,1小时,可见沉淀即为较纯浓度外泌体;以上离心步骤均于4℃下完成,全程均为无菌操作。(2)本发明的超速离心法:将待提取的且细胞融合度达到70%的msc用pbs洗涤2遍,换成无fbs或pla的a-mem,培养48小时。然后收上清,分次离心:①500g,10分钟,去除细胞及其碎片;②2000g,10分钟,去除死去的细胞及其碎片;③10000g,30分钟,去除细胞碎片;④将上清液以50注射器接0.22μm滤膜过滤;⑤70000g,1小时,可见沉淀(外泌体和蛋白成分);⑥弃去上清,保留沉淀,加入pbs;⑦70000g,1小时,可见沉淀即为较纯浓度外泌体;⑧得到的外泌体沉淀,加入200ul无菌pbs,采用0.1um的滤膜过滤,确保得到真正的纳米级外泌体。以上离心步骤均于4℃下完成。全程均为无菌操作。1.4bca法测定外泌体蛋白浓度本试验采用美国thermo公司的bca蛋白浓度测定试剂盒测定外泌体的蛋白浓度。取bsa溶于1%sds配成浓度为0.5mg/ml的蛋白标准。每孔需bca工作液200ul,按如下公式计算所需工作液的总体积:(标准品的个数+待测蛋白质样品的个数)×(实验重复次数,本实验为2)×200ul。将a:b体积比为50:1充分混匀配置所需的bca工作液。将0.5mg/ml蛋白标准以0,1,2,4,8,12,16,20ul及4ul蛋白样本加到96孔板中,加1%sds补足至20ul。每孔加入200ulbca工作液,37℃孵育30min。用酶标仪测定各孔在562nm波长的吸收值。并根据各标准孔的浓度及光吸收值绘制标准浓度曲线,再根据各个样本孔的光吸收值求得其实际浓度。如需进一步进行westernblot蛋白印迹法检测,则需根据上述所测浓度稀释样本浓度,使其浓度接近一致,并加入适量蛋白上样缓冲液。将样本置于沸水中煮15min使蛋白变性,冷却待用或-20℃存放。1.5nanosight鉴定外泌体体积以及外泌体密度本实验采用英国malvern公司ns300型号的nanosight检测仪。将冻存于-80℃的外泌体于4℃冰箱解冻,pbs冲洗仪器连接管,抽取100μl外泌体溶液缓慢注射入连接管,仪器检测1分钟,可通过纳米微粒的布朗运动成像并检测其密度。2试验结果2.1对本试验的方法培养的uc-msc第3代msc细胞进行实验,发现发现阳性指标cd29、cd90、cd44、cd73和cd105阳性率分别为99.3%、98.8%、98.5%、99.6%,99.3%,所有阳性指标均>95%;而cd14、cd34、cd45、cd19和hla-dr阳性率均小于2%,呈阴性,见图1-10,说明组织贴壁培养法培养可得到较纯净的脐带间充质干细胞。2.2msc培养上清中外泌体的收集与纯化本次实验通过采用两种不同的超速离心法,均能成功获取了msc培养上清中的超速离心沉淀物,通过对超速离心沉淀物进行蛋白定量,申请人发现本次200ml培养上清中,传统超速离心方法能够分离得到大约0.31g总蛋白,因此浓度约为0.159μg/ml培养上清;而本发明的超速离心法抽提到的总蛋白为0.428ug,浓度为0.214ug/ml,高于传统的分离方法,见表1。表1不同外泌体离心法提取到的总蛋白浓度编号分组蛋白浓度(ug/ml)1空白培养基02传统超速离心法0.1853传统超速离心法0.1344传统超速离心法0.1575本发明的超速离心法0.2236本发明的超速离心法0.2077本发明的超速离心法0.2132.3msc来源外泌体的性质鉴定为了研究收集得到的上清沉淀物是否为msc来源外泌体,针对外泌体的大小及其表明特有的标志物进行检测。首先利用电镜观察这两种方法收集到的外泌体,发现均为100nm级左右的囊泡,见图11-13,而且wb方法检测外泌体特征性的cd63和cd81抗原,传统方法和本发明的超速分离方法均表达,说明这两种方法均可有效的抽提间充质干细胞exosome。此外,还对这两种抽提方法的外泌体进行分组大小的鉴定,nanosight检测发现外泌体的成分均一,外泌体粒径大小均小于120nm。说明本次新抽提的外泌体也是纳米级外泌体。所以综合上述,本次发明的超速分离方法收集纯化到的纳米级外泌体总量较高,是一种适于间充质干细胞外泌体抽提的方法。试验例2本发明的方法提取的间充质干细胞外泌体rna表达谱分析和功能验证1试验目的:鉴定间充质干细胞外泌体内rna表达谱情况,寻找特异性标志物。2、试验方法:利用本发明方法分离2种间充质干细胞血清外泌体,然后提取rna,应用二代测序技术进行1例样本的转录组测序,并在另一份外泌体中采用实时荧光定量pcr验证测序结果。具体如下:2.1外泌体的分离提取:间充质干细胞的培养与试验例1中细胞培养方法相同。将待提取的且细胞融合度达到70%的msc用pbs洗涤2遍,换成无fbs或pla的a-mem,培养48小时。然后收上清,分次离心:①500g,10分钟,去除细胞及其碎片;②2000g,10分钟,去除死去的细胞及其碎片;③10000g,30分钟,去除细胞碎片;④将上清液以50注射器接0.22μm滤膜过滤;⑤70000g,1小时,可见沉淀(外泌体和蛋白成分);⑥弃去上清,保留沉淀,加入pbs;⑦70000g,1小时,可见沉淀即为较纯浓度外泌体;⑧得到的外泌体沉淀,加入200ul无菌pbs,采用0.1um的滤膜过滤,确保得到真正的纳米级外泌体。以上离心步骤均于4℃下完成。全程均为无菌操作。2.2高通量测序msc及其exo中全部表达的mirna:参照qiazol试剂盒操作步骤提取外泌体总rna,经纯度和浓度检测符合标准后,由广州锐博公司应用转录组测序技术(rnaseq)检测1例外泌体的转录组表达数据,通过与已知基因序列进行比对,分析得出信使rna(messagerna,mrna)与非编码rna(1non-codingrna,ncrna)的表达数据。以每1百万个碱基在染色体中的位置上的读值定位到外显子的每1000个碱基上的片段个数(fragmentperkilobaseofexonmodelpermillionmappedreads,fpkm)>1认为有基因表达。2.3qrt-pcr验证exo中mirna的表达情况,其中mir-486-5prt序列为:5'-gtcgtatccagtgcagggtccgaggtattcgcactggatacgacctcggg-3',mir-486-5p成熟序列为:f5'-cagtcctgtactgagctgc-3',内参u6f序列为:5'-ctcgcttcggcagcaca-3';u6r序列为:5'-aacgcttcacgaatttgcgt-3'引物序列,由吉玛公司设计、合成。rna的反转录和定量pcr按照toyobo品牌说明书进行,即rna逆转录合成cdna,于42℃作用30分钟,经95℃作用5分钟灭活后作为q-pcr反应的模板,采用sybrgreenrealtimepcrmastermix(toyobo)进行定量pcr扩增(lightcycler2.0instrument,rocheappliedscience)。mirna的反转录和定量pcr使用mircurylnuniversalrtmicrornapcrkit(203300and203450,exigoninc.,ma,usa),按照试剂盒说明书操作。3试验结果3.1通过对mirna表达谱进行检测,本发明人发现msc来源的外泌体中,mir-486-5p、mir-10a-5p、mir-10b-5p、mir-191-5p、mir-222-3p等富集高表达,而外泌体这些高表达的mir-486-5p在细胞中低表达。结合最新的文献发现,外泌体表达的mir-486-5p不仅具有抗肺纤维化作用,还可以可促进肾缺血损伤的修复。于此同时,低氧条件下的bm-msc,mir-486高表达,可以增强bm-mscs分泌hgf,vegf等因子促进造血。因此推测,mir-486-5p可作为msc-exosome的特异性marker,还可作为评价msc来源的外泌体在血管损伤修复疗效的潜在指标,结果见表2。表2mscs来源的外泌体和细胞高表达的mirnas3.2mir-486-5p在msc来源的外泌体中的验证。通过对未进行测序另一份msc来源的exosome进行mir-486-5pqrt-pcr表达的验证。发明人发现和内参相比,外泌体的exosome确实高表达。证明mir-486-5p可作为间充质来源的外泌体的特异性maker,见图14。以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本
技术领域:
的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1