一种制备间充质干细胞外泌体的方法及其应用与流程
本发明属于干细胞与再生医学领域,具体涉及一种制备间充质干细胞外泌体的方法及其应用。
背景技术:
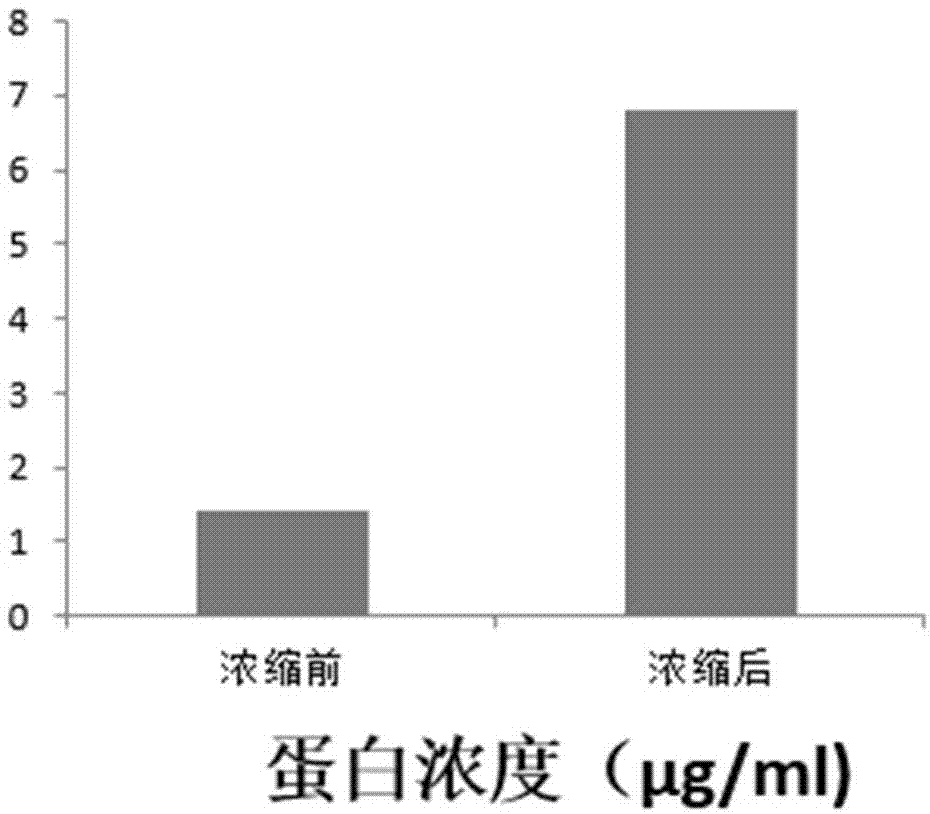
外泌体(exosome)是由细胞内囊泡结构释放到细胞外的一种膜性囊泡,直径约30-150nm,细胞在正常的生理状况下都会分泌外泌体,通过囊泡中的蛋白质和rna在细胞间信号传导和细胞间相互调控中起到重要作用,而这种信号传导和相互调控机制复杂,尤其是在肿瘤细胞之间,肿瘤细胞分泌的外泌体是否对肿瘤组织内的免疫抑制、肿瘤细胞迁移、增殖及浸润有促进作用等,现在尚未完全搞清楚。外泌体研究存在一个亟待解决的瓶颈问题就是外泌体的分离提取,现有方法包括超速离心、免疫磁珠分选等。超速离心是分离外泌体的最常用方法,但是超速离心需要配置超速离心机,这种设备属于特种设备,价格昂贵,使用复杂,而且分离时间长,分离量少,每次只能分离少量液体,需要数小时的离心时间,分离效率低下,限制了一些中小型实验室对外泌体的研究和外泌体批量生产,不具备批量生产的可能。免疫磁珠分选法是选用cd69抗体连接的磁珠通过抗体抗原结合的方式连接在外泌体上,再通过强磁场将外泌体吸附在分选仪上,从而将外泌体从液体中分离出来。免疫磁珠分选法也存在试剂耗材昂贵,分选量少的缺点,因此寻求新的分选方法可以低成本、大批量分离外泌体成为目前研究的重点。此外,正常培养的间充质干细胞外泌体分泌量少,在细胞培养上清液中含量极低,如果不提前浓缩,得到所需外泌体需要的细胞培养上清液体积巨大,分离困难。虽然通过低氧、饥饿培养等特殊方法处理细胞可以得到大量外泌体及细胞因子蛋白质,但是细胞状态受损,收集外泌体后的间充质干细胞不能再用于其他治疗。技术实现要素:本发明的目的是针对间充质干细胞外泌体浓度低、超速离心操作复杂、提取效率低下等技术问题,提供一种间充质干细胞外泌体的制备方法,其制备的间充质干细胞外泌体浓度高,超速离心操作简单,提取效率高。为此,本发明提供了一种间充质干细胞外泌体的制备方法,包括以下步骤:步骤1:清洗人脐带组织表面血液,去除表皮和血管组织,取出华通胶清洗后剪碎,采用组织贴壁法接种培养;步骤2:待原代细胞长至70%融合度时进行传代培养;选用生长状况良好的第二代脐带间充质干细胞接种培养;步骤3:在细胞培养过程中加入促进外泌体分泌的的细胞刺激因子,促进细胞生产和外泌体分泌;步骤4:待细胞生长至90%融合度时吸出第一细胞上清液用于分离外泌体;步骤5:将所述第一细胞上清液离心去除细胞碎片,收集第二细胞上清液;步骤6:将所述第二细胞上清液进行第一次超滤浓缩,去除多余水分,得到第一浓缩液;步骤7:将所述第一浓缩液进行第二次超滤浓缩,去除多余水分,得到第二浓缩液;步骤8:将第二浓缩液进行第一次超速离心,去除细小细胞碎片;步骤9:取上清液进行第二次超速离心,去除上清液,沉淀为干细胞分泌的外泌体;步骤10:加入生理盐水清洗,超速离心,去除上清液,得到外泌体沉淀。作为一种优选的实施方式,所述细胞刺激因子包括维生素c、inf-γ(γ干扰素)、hgf(肝细胞生长因子)、bfgf(碱性成纤维细胞生长因子)。更优选地,所述细胞刺激因子由以下浓度的组分组成:维生素c50ng/ml、inf-γ25ng/ml、hgf10ng/ml、bfgf5ng/ml。作为一种优选的实施方式,所述步骤5中,离心速度为3000转/分钟,离心时间为至少20分钟。作为一种优选的实施方式,所述步骤6中,超滤膜孔径为3kd,离心速度为4500转/分钟,离心时间为至少30分钟。作为一种优选的实施方式,所述步骤7中,第二次超滤浓缩的条件与第一次超滤浓缩的条件相同。作为一种优选的实施方式,所述步骤7中,第二浓缩液的体积为第二细胞上清液体积的20%。作为一种优选的实施方式,所述步骤8中,超速离心的速度为10000转/分钟,离心时间为至少1小时。作为一种优选的实施方式,所述步骤9和步骤10中,超速离心的速度为100000转/分钟,离心时间为至少1小时。作为一种优选的实施方式,本发明的方法还包括用生理盐水重悬外泌体沉淀,稀释为外泌体溶液。作为一种优选的实施方式,本发明的方法还包括用生理盐水重悬外泌体沉淀,稀释为外泌体溶液后,向外泌体溶液加入人血清白蛋白、海藻糖、甘露醇后做成冻干粉。优选地,该冻干粉包括基于浓度为10μg/ml的外泌体溶液体积百分比为2%的人血清白蛋白、终浓度为0.2m的海藻糖、质量体积浓度为6%的甘露醇。本发明还提供了一种化妆品,其包括利用上述方法制得的外泌体。本发明的制备方法中,通过添加外泌体刺激因子,可以有效促进脐带间充质干细胞在正常培养过程中大量释放外泌体,而且不影响脐带间充质干细胞正常生长过程;通过结合超滤法和超速离心法,先使用超滤管浓缩,去除细胞培养上清液中多余水分,对外泌体进行浓缩,能够有效减少外泌体超速离心的体积,提高溶液中外泌体浓度,提高分离效率,节约分离时间和成本。此外,在本发明公开的外泌体冻干粉配方中,通过添加人血清白蛋白和海藻糖可以有效保持外泌体中蛋白质和小分子rna的结构和活性稳定。附图说明图1是浓缩前后上清液中总蛋白浓度的对比结果。图2是本发明的外泌体在扫描电子显微镜下的形态。图3是分离的外泌体的颗粒直径分布范围。具体实施方式下面结合具体实施例对本发明的技术方案作进一步的详述,但本发明并不限于以下实施例。如未特别指出,本发明所使用的试剂均为现有试剂,可通过商业渠道获得。按照以下步骤制备注射针剂:1、医院采集足月剖腹产胎儿脐带组织,采集前签署客户知情同意书,组织于4℃冷藏无菌环境下运抵实验室,运输过程中使用组织保护液保护脐带组织生物学活性,组织保护液由生理盐水添加25μg/ml的硫酸庆大霉素和5μg/ml的两性霉素b配制,确保运输过程中无细菌和真菌污染;2、实验室中用组织保护液清洗脐带组织表面血液,去除表皮和血管组织,取出华通胶清洗后剪碎成1-2mm3体积碎块,采用组织贴壁法接种于t75培养瓶中培养,使用无血清且成分明确的增殖培养基培养;3、原代细胞经14天培养长至70%融合度进行传代培养;4、选用生长状况良好的第二代脐带间充质干细胞,按10000/cm2密度接种于康宁t175培养瓶中,加入30ml无血清增殖培养基正常培养;5、在细胞培养过程中加入促进外泌体分泌的的细胞刺激因子,包括维生素c(50ng/ml,按在细胞培养液中的终浓度计)、inf-γ(25ng/ml)、hgf(10ng/ml)、bfgf(5ng/ml),促进细胞生产和外泌体分泌;6、培养3-4天后细胞生长至90%融合度时吸出上清液用于分离外泌体,间充质干细胞正常传代培养,根据细胞生长状态决定培养代次;7、收集的细胞上清液3000转/分钟离心20分钟去除细胞碎片,收集上清液;8、细胞上清液加入15ml超滤管中浓缩,超滤膜孔径3kd,4500转/分钟离心30分钟,去除多余水分;9、收集超滤管中液体再次浓缩去除多余水分,浓缩终体积为初始体积的20%,使用bca(bicinchoninicacid)法测定上清液中总蛋白浓度(结果见图1),结果显示浓缩前人脐带间充质干细胞无血清培养上清液中总蛋白浓度为(1.43±0.21)μg/ml,液体浓缩后,上清液中总蛋白质浓度为(6.8±0.34)μg/ml;10、浓缩液体超速离心,10000转/分钟离心1小时去除细小细胞碎片,取上清液再次100000转/分钟离心1小时,去除上清液,沉淀为干细胞分泌的外泌体;11、加入10ml生理盐水清洗一次,100000转/分钟离心1小时,去除上清液;12、1ml生理盐水重悬外泌体沉淀,bca(bicinchoninicacid)法测定外泌体沉淀中总蛋白浓度、扫描电子显微镜拍摄外泌体形态(结果见图2)、用nanosight纳米粒度分析仪对分离的外泌体进行颗粒分布范围(结果见图3)分析,结果显示提取的外泌体蛋白浓度为(1.21±0.15)mg/ml;13、根据bca法测定的总蛋白浓度使用生理盐水对外泌体进行稀释为10μg/ml溶液;14、外泌体溶液加入人血清白蛋白(基于外泌体溶液的总体积计体积分数为2%)、海藻糖(基于外泌体溶液的总体积计终浓度为0.2m)、甘露醇(基于外泌体溶液的总体积计质量体积百分比为6%)后做成冻干粉长期保存(3ml西林瓶中装1ml液体冻干);15、外泌体冻干粉用于面部皮肤保养,使用时,外泌体冻干粉加入1.5ml溶媒(去离子水+0.5wt%透明质酸)完全溶解后使用。效果验证:选取20名受试者面部清洁后用75%(v/v)医用酒精面部消毒,将溶解后的外泌体溶液均匀涂抹于面部,用滚针上下轻轻滚动5分钟,无需清洗,每天早晚各使用一次,每周使用2次,连续使用4周。在第0天、7天、14天、21天、28天后用cbs-807皮肤分析系统检测皮肤毛孔大小、皮肤弹性、肤色、皱纹等。结果如以下表1所示,受试者在1周后可以看到皮肤改善,连续使用4周后皮肤改善明显。表10天7天14天21天28天毛孔++++++++++++++弹性++++++++++++++++++皱纹+++++++++++肤色++++++++++++++皮肤光泽度++++++++++++++当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1