一种高纯度条斑紫菜多糖类α‑淀粉酶抑制剂的制备方法与流程
本发明涉及一种高纯度条斑紫菜多糖类α-淀粉酶抑制剂的制备方法,属于植物有效成分的制备领域。
背景技术:
条斑紫菜(porphyrayezoensis)藻体卵形,长卵形,为紫红色或略带绿色。紫菜中含有丰富的维生素、矿物质、蛋白质、脂肪酸、紫菜多糖等各种营养成分和生理活性物质。紫菜是多糖含量最丰富的海藻之一,紫菜中的多糖含量随着藻的种类及生长时间、地点等而有所不同,通常多糖含量在20%-40%。
糖尿病是21世纪严重威胁人类生命健康的重大疾病之一。其发病率与遗传因素、生活方式、饮食结构及年龄等因素有关,是一种常见的代谢性疾病。近年流行病学研究表明,餐后高血糖较空腹高血糖对2型糖尿病慢性并发症的发生发展更为重要,与糖尿病大血管、微血管并发症的发生与发展均有密切关系;并且严格控制餐后血糖异常升高能够延缓糖耐量异常患者向2型糖尿病的转化。因而,干预治疗餐后高血糖在防治2型糖尿病方面具有非常重要的意义。
α-淀粉酶抑制剂可以是蛋白质、多肽类或者多糖。20世纪70年代以来,因其在医学上的价值α-淀粉酶抑制剂而被广泛研究,目前已经从豆类、小麦、野生苋属等植物种子中分离得到α-ai,其中活性较高的是从白芸豆中提取的α-ai,它对哺乳动物胰α-淀粉酶有较强的抑制作用,国外已经将其作为减肥保健食品进行应用。蛋白质和多肽类的α-ai活性高但存在植物凝集素去除不完全,或者提取过程中需要酸碱条件会对生态环境造成严重影响,同时不耐高温处理,严重时会出现过敏休克等。多糖类的α-ai对温度、酸碱和胃肠消化有一定强度的稳定性,安全无毒,可以有效地预防和管理2型糖尿病,作为天然的降糖药物具有良好的开发前景。国内外研究者从海带和藻类中提取的多糖α-ai对α-淀粉酶有较强的抑制作用。传统的海藻多糖提取方法主要有水提取法、酸提取法和碱提取法,并对粗多糖组分进行分级分离,多采用乙醇或丙酮进行反复沉淀,除去一部分醇溶性杂质,之后采用离子交换,凝胶层析等处理,从中逐级分离纯多糖。传统的方法使用乙醇等有机溶剂会造成环境污染等,分离纯化也无法工业化应用,本发明采用酶解结合超滤的方法从条斑紫菜中获得高纯度的多糖α-ai,对α-淀粉酶有较强的抑制作用,可应用于工业化生产。
技术实现要素:
针对现有技术存在的上述问题,本发明的目的是提供一种酶解结合超滤的方法,以制备效率高,产物温度稳定性高、耐酸碱和耐胃肠道消化的高纯度条斑紫菜多糖α-淀粉酶抑制剂的工业化制备方法,有助于条斑紫菜α-淀粉酶抑制剂的实际生产和应用。
本发明的第一个目的是提供一种高纯度条斑紫菜多糖类α-淀粉酶抑制剂的制备方法,所述方法包括以下步骤:
(1)磨粉:将条斑紫菜磨粉,过筛;
(2)水提取:将紫菜粉与水混合后,搅拌提取,获得提取液;
(3)离心:将步骤(2)的提取液进行离心,取上清液;
(4)调节ph:将步骤(3)的上清液的ph调节至3.0~8.0;
(5)酶解:搅拌状态下向步骤(4)溶液中加入蛋白酶进行酶解,得到酶解液;
(6)灭酶:对步骤(5)的酶解液进行灭酶;
(7)离心:将步骤(6)的溶液离心取上清液;
(8)超滤:将步骤(7)的上清液进行超滤,收集截留液;
(9)干燥:将步骤(8)的截留液进行喷雾干燥,即得粉末状的α-淀粉酶抑制剂产品。
在本发明的一种实施方式中,所述步骤(1)中过筛是过60~80目筛。
在本发明的一种实施方式中,所述步骤(2)中提取温度是50~90℃,提取时间为2~4h。
在本发明的一种实施方式中,所述步骤(5)中蛋白酶加酶量是步骤4溶液重量的1~5%。
在本发明的一种实施方式中,所述步骤(5)中的酶解温度是40~60℃,酶解时间为2~4h。
在本发明的一种实施方式中,所述步骤(6)中的灭酶条件为:ph调至6.5~7.5,60~80℃水浴灭酶10~20min。
在本发明的一种实施方式中,所述步骤(8)中超滤的超滤膜分子截留量为1~10kda。
在本发明的一种实施方式中,所述方法具体是:
(1)磨粉:将条斑紫菜磨粉,过60~80目筛子;
(2)水提取:将步骤(1)的紫菜粉与水按质量比1:20~1:30混合,50~90℃搅拌2~4h;
(3)离心:将步骤(2)的提取液4000~8000r/min离心10~20min取上清液;
(4)调节ph:将步骤(3)的上清液的ph调节至3.0~8.0;
(5)酶解:搅拌状态下向步骤(4)溶液中加入溶液重量1~5%蛋白酶酶解杂蛋白,40~60℃搅拌2~4h得到酶解液;
(6)灭酶:将步骤(5)的酶解液ph调至6.5~7.5,60~80℃水浴灭酶10~20min;
(7)离心:将步骤(6)溶液4000~8000r/min离心10~20min取上清液;
(8)超滤:将步骤(7)的上清液通过截留分子量为1~10kd的超滤膜,收集截留液;
(9)干燥:将步骤(8)的截留液喷雾干燥,超微粉碎后即得粉末状的α-淀粉酶抑制剂产品。
本发明的第二个目的是提供一种上述方法得到的α-淀粉酶抑制剂。
本发明的第三个目的是提供上述α-淀粉酶抑制剂在制备降糖药物、保健食品中的应用。本发明的有益效果:
本发明高纯度条斑紫菜α-淀粉酶抑制剂提取方法为酶解结合超滤,具有简单、操作控制容易、纯度高、生物活性高、稳定性好的特点,α-淀粉酶抑制剂活力可达到8000u/g;制得条斑紫菜α-淀粉酶抑制剂对温度、酸碱和胃肠消化有一定强度的稳定性,安全无毒,可以有效地预防和管理2型糖尿病,作为天然的降糖药物具有良好的开发前景。
附图说明
图1:条斑紫菜酶解结合超滤提取多糖分子量分布图;
图2:条斑紫菜α-淀粉酶抑制剂对温度的稳定性曲线图;
图3:条斑紫菜α-淀粉酶抑制剂对酸碱的稳定性曲线图;
图4:条斑紫菜α-淀粉酶抑制剂耐胃肠道消化的稳定性曲线图;
图5:条斑紫菜传统方法提取多糖分子量分布图。
具体实施方式
通过以下具体实施例对本发明作进一步的具体说明,但应该理解本发明并不受这些内容所限制。
α-淀粉酶抑制剂活力的测定方法
将0.25mlα-淀粉酶液和0.25ml样品加入到0.5ml0.2mol/lpbs(ph6.9)中,37℃水浴反应10min后,加入1%可溶性淀粉溶液0.5ml,精确反应5min后加入1mldns试剂,沸水浴10min后迅速冷却,然后加入5ml去离子水,在540nm波长下测定吸光值。在测定过程中,设置空白管、空白对照管和抑制对照管。空白管中不添加样品,空白对照管中不加α-淀粉酶液和样品,抑制对照管中不加α-淀粉酶液。体积不足处均以pbs补足。
样品对α-淀粉酶的抑制率可按式(1)计算:
式中a1、a2、a3和a4分别为空白管、空白对照管、抑制管和抑制对照管在540nm下的吸光值。
实施例1:条斑紫菜多糖类α-淀粉酶抑制剂制备
将条斑紫菜进行粉碎,过80目筛,收集条斑紫菜粉;
取50g紫菜粉加1000ml去离子混合,70℃搅拌提取2h;
将提取物于4℃,8000r/min下离心20min,收集上清液;
用1mol/lhcl溶液调节上清液ph至3.0,加入1%蛋白酶酶解杂蛋白,60℃搅拌2h后,用1mol/lnaoh溶液调节酶解液ph至6.5,于80℃水浴灭酶20min,离心8000r/min下离心20min,取上清液;
将上清液超滤,使用超滤膜孔径为10kda,收集截留液;
将截留液进行喷雾干燥,即得粉末状的α-淀粉酶抑制剂产品,采用hplc测定多糖分子量分布。测定结果显示,α-淀粉酶抑制剂产品中α-淀粉酶抑制剂活力为8000u/g。如图1所示,本发明提取多糖分子量均一,且对α-淀粉酶有较强的抑制作用。
实施例2:条斑紫菜多糖类α-淀粉酶抑制剂制备
将条斑紫菜进行粉碎,过60目筛,收集条斑紫菜粉;
取50g紫菜粉加1000ml去离子混合,50℃搅拌提取2h;
将提取物于4℃,8000r/min下离心20min,收集上清液;
用1mol/lnaoh溶液调节上清液ph至8.0,加入2%蛋白酶酶解杂蛋白,50℃搅拌2h后,用1mol/lhcl溶液调节酶解液ph至7.5,于80℃水浴灭酶20min,离心8000r/min下离心20min,取上清液;
将上清液超滤,使用超滤膜孔径为10kda,收集截留液;
将截留液进行喷雾干燥,即得粉末状的α-淀粉酶抑制剂产品。
将α-淀粉酶抑制剂产品取适量溶于去离子水中,测定α-淀粉酶抑制剂产品中α-淀粉酶抑制剂活力。测定结果显示,α-淀粉酶抑制剂产品中α-淀粉酶抑制剂活力为5000u/g。
实施例3:条斑紫菜多糖类α-淀粉酶抑制剂制备
将条斑紫菜进行粉碎,过80目筛,收集条斑紫菜粉;
取50g紫菜粉加1500ml去离子混合,60℃搅拌提取2h;
将提取物于4℃,8000r/min下离心20min,收集上清液;
用1mol/lhcl溶液调节上清液ph至5.0,加入4%蛋白酶酶解杂蛋白,40℃搅拌2h后,用1mol/lnaoh溶液调节酶解液ph至7.0,于60℃水浴灭酶20min,离心8000r/min下离心20min,取上清液;
将上清液超滤,使用超滤膜孔径为1kda,收集截留液;
将截留液进行喷雾干燥,即得粉末状的α-淀粉酶抑制剂产品。测定结果显示,α-淀粉酶抑制剂产品中α-淀粉酶抑制剂活力为3600u/g。
实施例4:条斑紫菜多糖类α-淀粉酶抑制剂制备
将条斑紫菜进行粉碎,过80目筛,收集条斑紫菜粉;
取50g紫菜粉加1500ml去离子混合,70℃搅拌提取2h;
将提取物于4℃,8000r/min下离心20min,收集上清液;
用1mol/lnaoh溶液调节上清液ph至8.0,加入5%蛋白酶酶解杂蛋白,60℃搅拌2h后,用1mol/hcl溶液调节酶解液ph至6.5,于80℃水浴灭酶20min,离心8000r/min下离心20min,取上清液;
将上清液超滤,使用超滤膜孔径为1kda,收集截留液;
将截留液进行喷雾干燥,即得粉末状的α-淀粉酶抑制剂产品。测定结果显示,α-淀粉酶抑制剂产品中α-淀粉酶抑制剂活力为3100u/g。
实施例5:条斑紫菜多糖类α-淀粉酶抑制剂耐受性能
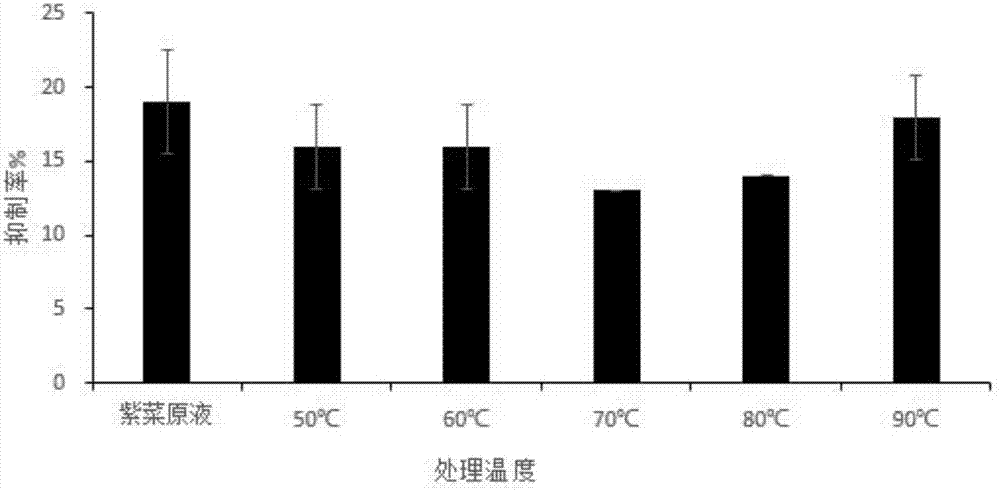
将实施例1制备得到的α-淀粉酶抑制剂产品取适量溶于去离子水中,取产品水溶液5ml分装到试管中,在50、60、70、80、90℃的恒温水浴锅中处理20min后,迅速流水冷却至室温,测定α-淀粉酶抑制剂产品中α-淀粉酶抑制剂活力。如图2所示,它在90℃下加热30min后,抑制活力基本上没有改变,具有良好的耐热稳定性。
将实施例1制备得到的α-淀粉酶抑制剂产品取适量溶于去离子水中,取产品水溶液100ml,用1mol/lhcl或1mol/mlnaoh将其ph于室温下分别调节至2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0并持续搅拌30min,然后立即将ph调回至原液ph值,8000r/min下离心20min,取上清液,测定其对α-淀粉酶的抑制活力。如图3所示,它在ph值2-10之间化学结构稳定,抑制活性不受影响,具有广泛的酸碱耐受性。
将实施例1制备得到的α-淀粉酶抑制剂产品取适量溶于去离子水中,取产品水溶液于37℃的酶反应器中,分别用1mol/lhcl将其调至ph2.0,并加入1%的胃蛋白酶来模拟胃环境,在处理过程中每30min取20ml灭酶后进行测定;用1mol/lnaoh将其调至ph8.2,并加入1%的胰蛋白酶来模拟肠道环境,在处理过程中每30min取20ml灭酶后进行测定。如图4所示,在模拟胃肠处理时,抑制活性一直处于稳定状态。由此可见,α-淀粉酶抑制剂活性在胃肠道内可以发挥很好的降糖作用,其生理效果可靠。
对照例1:传统方法制备条斑紫菜多糖类α-淀粉酶抑制剂
将条斑紫菜进行粉碎,过80目筛,收集条斑紫菜粉;
取50g紫菜粉加1000ml去离子混合,70℃搅拌提取2h;
将提取物于4℃,8000r/min下离心20min,收集上清液;
用乙醇或丙酮进行反复沉淀,8000r/min下离心20min,收集上清液;沉淀用去了离子水复溶,采用hplc测定多糖分子量分布。测定结果显示,α-淀粉酶抑制剂产品中α-淀粉酶抑制剂活力为1000u/g。如图5所示,传统的方法提取多糖分子量不均一,需进一步分离纯化才可获得高纯度的多糖,且对α-淀粉酶抑制活力不高。
对照例2:条斑紫菜多糖类α-淀粉酶抑制剂制备
在蛋白酶酶解时,用1mol/lnaoh溶液调节上清液ph至10.0,其他步骤与实施例1一致,结果发现,α-淀粉酶抑制剂产品中α-淀粉酶抑制剂活力仅为1100u/g;而在蛋白酶酶解时,用1mol/lhcl溶液调节上清液ph至2.0,其他步骤与实施例1一致,结果发现,α-淀粉酶抑制剂产品中α-淀粉酶抑制剂活力仅为2000u/g。
对照例3:条斑紫菜多糖类α-淀粉酶抑制剂制备
将提取液进行离心后的上清液通过截留分子量为10kd的超滤膜过滤,然后再按照实施例1的酶解、灭酶步骤进行处理,条件与实施例1一致,结果发现,α-淀粉酶抑制剂产品中α-淀粉酶抑制剂活力仅为600u/g。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!