一种皮肤创伤修复肽WHPP‑OA1及其提纯方法与应用与流程
本发明属于生物医药领域,具体涉及一种皮肤创伤修复肽whpp-oa1及其提纯方法与应用。
背景技术:
皮肤创伤修复一直是临床医学领域中比较棘手的问题。皮肤是人体最大的器官,是人体和外界环境之间的物理屏障,并且承担着诸多重要的生理功能,包括排汗、热感和痛觉等。一旦皮肤被破坏,就会引起机体内外环境失调,从而继发营养不良、多器官衰竭甚至导致死亡。传统的促创伤修复药物都有一定的局限性,比如成本高、活性相对较低并且容易造成增生性瘢痕愈合。因此,寻找新型促创伤修复药物是非常重要和非常有必要的。与传统促创伤修复药物相比,多肽类具有高活性、高特异性以及高稳定性等特性。目前,已经发现许多活性多肽,如抗菌肽、镇痛肽、抗癌多肽等,但是具有促创伤修复作用的多肽还很少报道。
两栖动物的生活环境复杂,它们的皮肤裸露、光滑、潮湿,容易受到各种病原微生物侵袭和紫外线辐射损伤。在长期的自然选择过程中,两栖动物逐渐进化出了独特的、高效的皮肤多肽防御系统。广泛的研究表明:两栖动物皮肤受到创伤后能快速修复,因此两栖动物皮肤被视为具有巨大开发潜力的促创伤修复药物资源宝库。两栖动物皮肤包含丰富的小分子多肽,这些小分子肽具有各种生物活性,如抗菌性、抗氧化性以及免疫活性。然而,到目前为止,对于两栖动物皮肤具有皮肤促创伤修复活性多肽的认知还非常匮乏。
为此,本发明提供了一种来源于云南臭蛙(odorranaandersonii)的具促创伤修复活性的多肽及其提纯方法和应用。
技术实现要素:
本发明的第一目的在于提供一种皮肤创伤修复肽whpp-oa1,所述修复肽whpp-oa1包含的氨基酸序列为igkppdtwkhlasklkci。
本发明的第二目的在于提供一种所述皮肤创伤修复肽whpp-oa1的提纯方法,其特征在于,包括以下步骤:
(1)用电刺激法取云南臭蛙活体皮肤分泌物,溶解于pbs,真空冷冻干燥,获得皮肤分泌物冻干粉-80℃保存备用;
(2)将所述冻干粉用sephadexg75排阻层析进行分离;
(3)将步骤(2)的分离产物进行第一次高效液相色谱反相层析,并收集具促创伤修复功能的活性组分;
(4)将所述活性组分进行第二次高效液相色谱反相层析,得到纯化的修复肽whpp-oa1。
本发明的第三目的在于提供所述皮肤创伤修复肽whpp-oa1的应用,其特征在于,将所述创伤修复肽whpp-oa1用于加速体表皮肤的创口愈合,减少疤痕产生。
本发明的第四目的在于提供一种含有所述皮肤创伤修复肽whpp-oa1的外用药品。
本发明的第五目的在于提供一种含有所述皮肤创伤修复肽whpp-oa1的外用护肤品。
附图说明
图1为本发明云南臭蛙皮肤促创伤修复肽whpp-oa1的sephadexg75分子筛层析图。
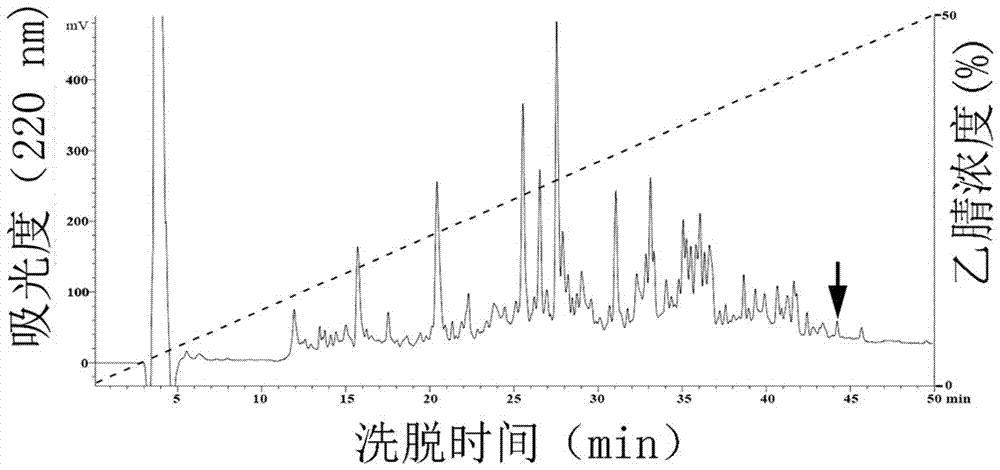
图2为本发明云南臭蛙皮肤促创伤修复肽whpp-oa1的第一次hplc反相c18柱层析图。
图3为本发明云南臭蛙皮肤促创伤修复肽whpp-oa1的第二次hplc反相c18柱层析图。
图4为本发明分离纯化云南臭蛙皮肤促创伤修复肽whpp-oa1的hacat的促创伤修复活性图;
图中:
a-hacat细胞在10μmol/l修复肽whpp-oa1作用下表现出较强的促创伤修复活性;
b-加入丝裂霉素c抑制细胞增殖后,10μmol/l修复肽whpp-oa1没有促进细胞创伤修复;
c-在修复肽whpp-oa1的作用下,hacat细胞的创伤修复活性表现出时间和剂量依赖性;
d加入丝裂霉素c抑制细胞增殖后,在修复肽whpp-oa1的作用下,hacat细胞没有表现出创伤修复活性及时间和剂量依赖性;
e-修复肽whpp-oa1促进hacat细胞的增殖。
图5为本发明提纯后修复肽whpp-oa1的hsf促创伤修复活性图;
图中:
a-hsf细胞在10nmol/l修复肽whpp-oa1作用下表现出较强的促创伤修复活性;
b-加入丝裂霉素c抑制细胞增殖后,10nmol/l修复肽whpp-oa1促进细胞创伤修复活性;
c-在修复肽whpp-oa1的作用下,hsf细胞的创伤修复活性表现出时间和剂量依赖性;
d-加入丝裂霉素c抑制细胞增殖后,在修复肽whpp-oa1的作用下,hsf细胞的创伤修复活性表现出时间和剂量依赖性;
e-修复肽whpp-oa1没有促进hsf细胞的增殖作用。
图6为本发明分离纯化云南臭蛙皮肤促创伤修复肽whpp-oa1的动物模型促创伤修复活性图。
具体实施方式
下面结合附图对本发明作进一步的说明,但不以任何方式对本发明加以限制,基于本发明教导所做的任何变换或替换,均属于本发明的保护范围。
本发明所述种皮肤创伤修复肽whpp-oa1,来源于云南臭蛙(odorranaandersonii),所述修复肽whpp-oa1包含的氨基酸序列为igkppdtwkhlasklkci。
由于所述皮肤创伤修复肽whpp-oa1来源于云南臭蛙,本发明提供一种从云南臭蛙活体提纯所述皮肤创伤修复肽whpp-oa1的提纯方法,包括以下步骤:
(1)用电刺激法取云南臭蛙活体皮肤分泌物,溶解于pbs,真空冷冻干燥,获得皮肤分泌物冻干粉-80℃保存备用;
(2)将所述冻干粉过sephadexg75分子筛:将皮肤分泌物冻干粉,溶解于去离子水中,配置成100mg/ml的溶液,取1ml上预先用20mmol/ltris-hcl缓冲液(ph=7.8,含0.1mol/lnacl)平衡24小时的sephadexg75(gehealthcare,超细)柱子(长度40cm,内径宽度1.5cm),用同样的缓冲液进行洗脱,流速为1.5ml/10min,每10min收集1次,测定其在280nm下的吸光度;
(3)将过分子筛的产物进行第一次高效液相色谱反相层析,并收集具促创伤修复活性区段产物:将过筛产物上样于预先用超纯水(含0.1%的三氟乙酸)平衡好的hypersilods25mm柱子(伊利特产品,尺寸为4.6mm×300mm),实验仪器为waters1525高压液相系统,在流速为1ml/min的条件下,用乙腈(含0.1%的三氟乙酸)在线性梯度(0-100%in100min)条件下进行洗脱,监测波长为220nm。
(4)将所述具促创伤修复活性区段产物进行第二次高效液相色谱反相层析,得到纯化的修复肽whpp-oa1:将收集的第一次具有促创伤修复活性峰,真空冷冻干燥后溶于去离子水,然后重复第一次hplc过程,得到提纯产物。
除了从云南臭蛙活体上直接提取外,本发明所述的修复肽whpp-oa1还可通过人工合成的方法得到。目前生物活性肽的制备方法有很多种,包括保护化学合成法、水解法、重组dna技术等,这些方法均适用于制备本发明所述的修复肽whpp-oa1。
由于本发明所述修复肽whpp-oa1具有来源天然、活性高、促修复能力强等特点,可用于加速体表皮肤的创口愈合,减少疤痕产生。生产含有所述皮肤创伤修复肽whpp-oa1的外用药品、外用护肤品等产品,具有广阔的应用前景。
下面将结合具体实施例,对本发明进行进一步的说明。
实施例1:修复肽whpp-oa1的提纯和分子鉴定
1、提纯
云南臭蛙活体采自云南保山,用电刺激法取其皮肤分泌物(溶解于pbs),真空冷冻干燥,-80°保存备用。
将获得将皮肤分泌物冻干粉,溶解于去离子水中,配置成100mg/ml的溶液,取1ml(蛋白含量为100mg)上预先用20mmol/ltris-hcl缓冲液(ph=7.8,含0.1mnacl)平衡24小时的sephadexg75(gehealthcare,超细)柱子(长度40cm,内径宽度1.5cm),用同样的缓冲液进行洗脱,流速为1.5ml/10min,每10min收集1次,测定其在280nm下的吸光度,所得的分离纯化图谱如图1所示,其中oa1存在于图所示峰。
将第一步所得样品上样于预先用超纯水(含0.1%的三氟乙酸)平衡好的hypersilods25mm柱子(伊利特产品,尺寸为4.6mm×300mm),实验仪器为waters1525高压液相系统,在流速为1ml/min的条件下,用乙腈(含0.1%的三氟乙酸)在线性梯度(0-100%in100min)条件下进行洗脱,监测波长为220nm,所得的分离纯化图谱如图2所示,箭头所指为具有促创伤修复活性峰,whpp-oa1存在所示峰。
收集第一次具有促创伤修复活性峰,真空冷冻干燥后溶于去离子水,然后重复第一次hplc过程,所得的分离纯化图谱如图3所示,箭头所指为纯化的whpp-oa1所在峰。
2、分子鉴定
纯化得到的修复肽whpp-oa1在全自动蛋白质序列测定仪(岛津ppsq-31a)上经edman降解法测定氨基酸全序列,结果显示:所述修复肽whpp-oa1的氨基酸序列为igkppdtwkhlasklkc。
实施例2:在细胞水平和动物模型中测定修复肽whpp-oa1的修复活性
1、细胞水平上测定活性
在含5%co2的37℃的恒温箱中,用含10%胎牛血清及1%青霉素-链霉素的dmem/f12(bi,israel)培养基培养人的上皮细胞(hacat)和成纤维细胞(hsf),待细胞在培养瓶中长满后,用胰酶将细胞在培养瓶中消化下来,将细胞种在24孔板,每孔大约种2.5×(10-5)个细胞,然后培养12-14小时,每孔细胞长满形成单层细胞,用黄色200μl枪头(axygen,usa)在每孔划痕,用pbs把每孔清洗两遍,主要是为了把死细胞清洗干净。最后,在每孔加入含有不同浓度whpp-oa1(10nmol/l,100nmol/l,1μmol/l,10μmol/lforhacatand100pmol/l,1nmol/l,10nmol/lforhsf)的不含胎牛血清的dmem/f12培养基500μl,继续培养细胞,然后每隔6h拍照,计算创伤修复率。
细胞迁移和增殖是引起创伤修复的两个主要原因,因此我们还用丝裂霉素c(10μg/ml,sigma-aldrich,stlouis,mo,usa)把细胞增殖抑制,进一步探究是否是由细胞迁移引起创伤修复;通过96孔细胞增殖检测试剂盒检测whpp-oa1对细胞增殖的作用活性:将不含胎牛血清的细胞悬液(5000hacat个/孔,10000hsf个/孔,90μl)移入96孔板培养2-4h,待细胞贴壁后,在每孔加入不同浓度的whpp-oa1(10nmol/l,100nmol/l,1μmol/l,和10μmol/lhacat细胞,10pmol/l,100pmol/l,1nmol/l,和10nmol/lhsf细胞)10μl,在37℃的恒温箱培养24小时后,最后用细胞增殖检测试剂盒检测细胞增殖活性。
2、动物模型中测定活性
选体重22-25g的spf级昆明种小白鼠进行实验,将小鼠随机分成两组,每组10只。首先给小鼠腹腔注射1%的戊巴比妥钠(0.1ml/20g)麻醉小鼠,然后将小鼠背部毛剃除干净,并用75%的酒精消毒,最后在小鼠背部两侧用凿孔器凿出两个大小对称的孔,约8mm×8mm大小。术后将小鼠放在加热器旁待其醒后放回饲养室正常饲养。每天两次上样,每孔每次上样约20μl,第一组小鼠背部左侧涂生理盐水(nacl),右侧whpp-oa1;第二组小鼠背部左侧涂表皮生长因子(egf),右侧oa1。每隔3天给小鼠背部创伤拍照,最后通过imagej软件计算创伤修复率。云南臭蛙皮肤促创伤修复肽whpp-oa1的促创伤修复活性如图4所示。
细胞水平(见图4、5)和动物模型试验(见图6)结果均表明:本发明所述的皮肤创伤修复肽whpp-oa1具有较强的促创伤修复活性。
sequencelisting
<110>昆明医科大学
<120>一种皮肤创伤修复肽whpp-oa1及其提纯方法与应用
<130>2017
<160>1
<170>patentinversion3.5
<210>1
<211>18
<212>prt
<213>odorranaandersonii
<400>1
ileglylysproproaspthrtrplyshisleualaserlysleulys
151015
cysile
- 还没有人留言评论。精彩留言会获得点赞!