一种基于数字微流控技术的全自动单颗粒/单细胞捕获芯片及其应用的制作方法
本发明属于数字微流控技术领域,具体为一种基于数字微流控技术的全自动单颗粒/单细胞捕获芯片及其应用。
背景技术:
细胞作为生命体结构和功能的基本单元,是生命活动规律研究中的重要基础。现阶段的生命科学研究主要以大量的细胞为研究对象,采取对细胞群体的分析手段来获得细胞中的化学信息。然而,不同的细胞个体间存在着显著的微观不均一性(异质性),基于大量细胞的实验结果统计分析结果会掩盖单细胞间的差异,难以反映单细胞水平上的生命活动规律,造成了医学、生物学及其它学科在深一步研究中受到限制。因此,基于单个细胞的研究,能够掌握更准确更全面的细胞信息,可以深入探讨以往群体分析中平均结果对个别信息掩盖的局限性,将能在更深的层次上揭示生命活动的本质和规律,单细胞分析的引入对与疾病的早期预防和诊断有重要的意义。
尽管单细胞分析技术在很多应用领域中是至关重要的,然而单细胞体积小、所测组分含量低、偏差放大的特点使得单细胞的分离和分析面临着巨大的挑战。而且在细胞数目较多时,需要大量的重复操作,极其耗时,导致实验通量无法提升。
微流控芯片利用结构各异的微通道和形式多样的外加力场,对微量流体或样品在微观尺度上进行操纵、处理与控制,从而实现了传统实验室的部分乃至全部功能在一块微芯片上的集成。相比于传统方法,其具有成本低、分析速度快、试剂消耗少等优势,代表着未来生物、化学分析走向微型化的发展方向。因此,微流控芯片作为单细胞分离和分析的最主要研究手段之一,被广泛应用于神经科学、干细胞生物学、发育生物学、癌症诊断和个性化药物筛选等领域中。然而,常规微流控芯片的局限性也是非常明显的,其需要机械泵、阀配合使用,集成化难度大,难以实现样品的连续多步处理;对多试剂位置和反应时间的精确控制捉襟见肘;并且无法实现对少量稀有细胞的单细胞俘获,在大量单细胞进行高效率高通量分析领域更是无能为力。
数字微流控技术(digitalmicrofluidics,dmf)作为一种新兴的离散化微液滴操纵手段,由于具有一系列传统微流控技术无法比拟的优点有望改变这一现状。数字微流控是一种基于微电极阵列来实现离散液滴精确控制(包括移动、合并、分配和分裂等操作)的新型液滴操纵技术,其利用液滴在疏水化表面上的介电润湿现象实现了大通量离散化液滴的可控精准操纵。相比于传统的实验处理技术,既拥有传统微流控技术样品消耗量少、高并行性的能力,同时,又不依赖微泵、微阀或微混合器等元件,不需要加工复杂的三维流体通道,具有可动态配置的优点。更为重要的是,数字微流控芯片可以实现由宏观大体积试剂到精确可控体积微纳液滴的生成,对精确控制反应条件、保证结果的精确有效性非常有利;而且,其微电极阵列驱动的方式具有高并行性和全自动化的特点,能够实现多通路实时可控反应,对于实现样品制备、反应、分离、检测等生化实验基本操作的完全集成化具有重要的意义,因此特别适用于单细胞分析研究。
为了解决以上问题,我们提出了一种基于数字微流控技术的全自动单颗粒/单细胞捕获芯片。该芯片可以全自动地捕获单颗粒,而且单颗粒的捕获效率高。
技术实现要素:
本发明的目的在于提供一种基于数字微流控技术的全自动单颗粒/单细胞捕获芯片,可以全自动高效率地捕获单颗粒/单细胞。
为了达到上述目的,本发明采用如下技术方案:
该数字微流控芯片包括具有多层图案的数字微流控芯片和集成电路两部分。所述的具有多层图案的数字微流控芯片由上、下极板两部分组成,下极板包括基底、电极层、介质层、捕获层和局部亲水化的疏水层,上极板包括疏水化的地电极;集成电路为数字微流控电路控制系统。
所述数字微流控芯片的下极板包括基底、电极层、介质层、捕获层和局部亲水化的疏水层,电极层可由湿法刻蚀技术、电路板印刷技术和打印技术等方法制作于基底表面,介质层均匀涂覆于电极层上表面,捕获层通过光刻等技术结合于介质层上方并与电极层特定位置对准,局部亲水化的疏水层在捕获层上表面,通过局部剥离等技术在捕获层周围形成特定的亲水图案,在其余区域形成疏水图案;所述上极板从下至上依次包括疏水层、接地导电层和上极板基底;
电极层为具有特定图案的电极阵列,包括贮液池电极单元、液滴生成通道电极阵列、单颗粒/单细胞捕获电极阵列和反应电极区,液滴生成通道电极阵列分别与贮液池电极单元一一相连,并以单颗粒/单细胞捕获电极阵列和反应电极区为中心对称分列于其两侧;
捕获层为具有单细胞捕获能力的微结构阵列,由具有小于单颗粒/单细胞尺寸间隙的微结构和流体分布微柱组成,该阵列与电极层特定位置对准;
局部亲水化的疏水层是由局部剥离技术形成的具有局部亲水化位点的疏水层,其经对准可在捕获层的微结构处形成亲水化位点。
本发明的一个优选的实施方式中,捕获层结构的尺寸有具体使用和分析的颗粒和细胞的大小决定。一般的,捕获层微结构间隙的宽度可以是5-500微米,例如:8微米、20微米、50微米、80微米、100微米、200微米、300微米或者400微米;高度可以是5-500微米,例如10微米、20微米、50微米、80微米、100微米、200微米、300微米或者400微米;流体分布微柱随微结构的大小形状变化而变化。
本发明的一个优选的实施方式中,所述的颗粒的直径可以是5-200微米,例如5微米、10微米、15微米、20微米、30微米、70微米、80微米或者90微米。
本发明的一个优选的实施方式中,所述的细胞的直径可以是5-100微米,例如5微米、10微米、15微米、20微米、30微米、70微米、80微米或者90微米。
本发明的数字微流控芯片所述的亲水化位点的形状包括圆形、方形、半月形等,随捕获层形状的变化而变化。
本发明的数字微流控芯片所用的介质层为光刻胶。
本发明的数字微流控芯片所用捕获层的材料为光刻胶,捕获层和介质层通过分子间直接相互作用或等离子体可逆键合在一起。
本发明的数字微流控芯片所用亲疏水层的材料为特氟龙或聚四氟乙烯ptfe水分散液,通过局部剥离技术构建于捕获层上,形成局部亲水化的捕获结构。
为了防止液滴的挥发,对液滴包裹油壳或将液滴浸润在油相中。
对于不同的单颗粒/单细胞捕获体系,所述贮液池电极单元可以实现液滴体积从1纳升至10微升的变化。
为了保证单颗粒/单细胞分析体系中液滴的移动,在液滴中加入表面活性剂用以防止生物黏附。
本发明的一个优选的实施方式中,所述的数字微流控芯片基本工作流程为:
步骤a:将各试剂分别负载于数字微流控芯片的贮液池电极单元内,加入适量的填充油将各液滴包裹住,使用集成电路对电极进行预通电,转入步骤b;
步骤b:使用集成电路的控制电路控制电极驱动电路,按一定次序进行电极的通断电控制,从而从贮液池电极单元产生一个合适体积的含颗粒/细胞液滴,通过与其连接的通道电极阵列将液滴移动至单颗粒/单细胞捕获电极处,重复这一过程使各捕获电极均负载含颗粒/细胞液滴,转入步骤c;
步骤c:对单颗粒/单细胞捕获电极阵列区电极断电,液滴静置1~3分钟后,使颗粒/细胞在重力作用下沉降于芯片表面,转入步骤d;
步骤d:集成电路的控制电路控制电极驱动电路,使液滴从单颗粒/单细胞捕获电极阵列区通过,当单个颗粒/细胞进入微捕获结构中时,因为流体从旁路经过的路径大于从微结构的间隙,颗粒/细胞会先进入微捕获结构的间隙中,由于间隙的宽度小于颗粒/细胞的直径,颗粒/细胞被卡在微捕获结构内,同时堵住捕获结构,使得同一平面上流经微结构间隙的流体流速趋近于零,此时后续的颗粒/细胞无法再次进入该捕获结构,只能从结构的旁侧或上方流走。同时由于该结构具有较强的亲水性,使得被捕获的颗粒/细胞粘附于芯片表面,不会在液滴移动的过程中被冲走。流体分布微柱起到分布流体和富集颗粒/细胞的作用。在后续的颗粒/细胞捕获结构中重复该过程,即可实现该芯片上多路单颗粒/细胞的捕获,然后转入步骤e。
步骤e:对于稀有样品,将移走的液滴驱动回贮液池电极中可以实现几乎无损捕获;对于普通样品,直接将移走的液滴驱动至废液池中,转入步骤f。
步骤f:控制电极驱动电路从另一贮液池电极单元中引出清洗液,洗去捕获结构电极区残余的颗粒/细胞,然后将液滴驱动至废液池中,转入步骤g。
步骤g:控制电极驱动电路从另一贮液池电极单元中引出其余反应试剂,用于进行后续的分析研究。
本发明与现有技术相比,其优势在于:
(1)本发明采用数字微流控技术,具有全自动、易集成、可寻址地优点,体积小,消耗试剂少,节约成本;
(2)单颗粒/细胞捕获效率高,由于颗粒/细胞的捕获原理是基于表面亲疏水性辅助的流体动力学方式,在完成单个颗粒/细胞的捕获后,后续的颗粒/细胞不会再次被同一个捕获单元捕获,因此该芯片单颗粒/细胞捕获效率高,尤其适合单细胞分析;
(3)基本没有颗粒/细胞损失,在有限颗粒/细胞数目的条件下可以使得全部捕获单元捕获有单颗粒/细胞,能够根据芯片捕获单元的数目控制单颗粒/细胞捕获数目,特别适用于稀有样品的分析,比如循环肿瘤细胞(ctc)、干细胞等稀有细胞的分析;
(4)数字微流控可以实现对产生的离散微液滴更加直接和更大程度的时空控制,在全自动处理和完全集成化上具有先天上的优势。
附图说明
图1为本发明数字微流控芯片整体结构示意图;其中(a)为其剖面结构示意图,(b)为数字微流控芯片下极板平面结构示意图。
图2为本发明芯片放大结构俯视图。
图3为本发明颗粒/细胞捕获单元俯视图。
图4为本发明芯片捕获单颗粒/单细胞图,其中左图显示显微镜明场下细胞的捕获情况,右图显示显微镜荧光场下细胞的捕获情况(其中细胞为gfp表达细胞)。
图5为不同捕获轮次的单细胞捕获效率图。
附图标记
图1(a)中1为上极板基底,2为上极板地电极,3为疏水层,4为介质层,5为电极层,6为下极板基底,7为间隙层,8为捕获层,9为局部亲水区域。
图1(b)中10为下极板电路连接触点,11为电极层电极阵列。
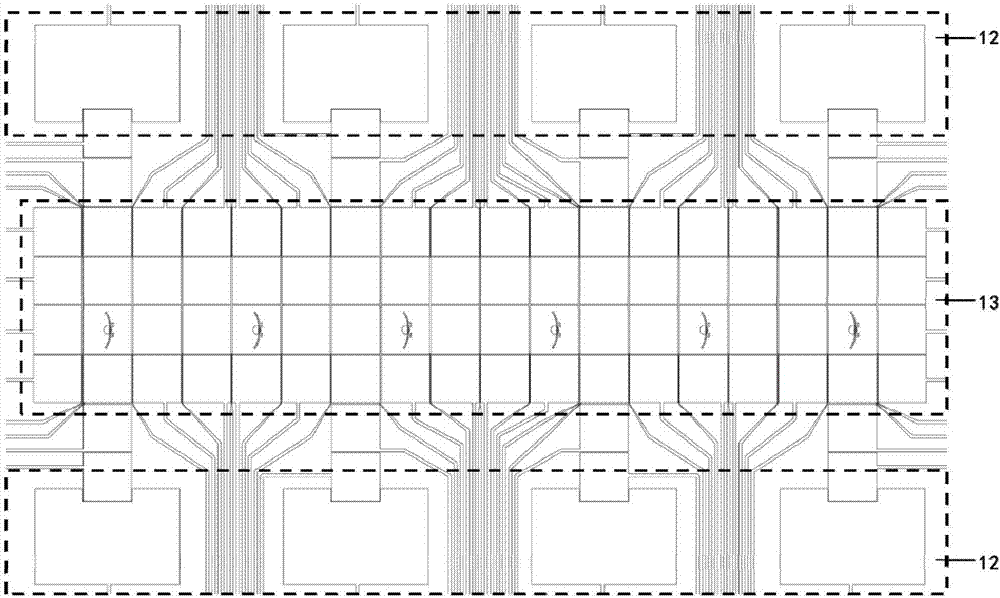
图2中12为贮液池电极单元,液滴生成通道电极阵列,13为单颗粒/单细胞捕获电极阵列和反应电极区。
图3中14为捕获层流体分布微柱,15为具有小于单颗粒/单细胞尺寸间隙的微结构,16为局部亲水化位点。
具体实施方式
下面结合附图以数字微流控芯片上单细胞全基因组扩增为例,对本发明进行进一步细致描述。
该数字微流控芯片包括具有多层图案的数字微流控芯片和集成电路两部分。所述的具有多层图案的数字微流控芯片由上、下极板两部分组成,如图1所示,下极板包括基底6、电极层5、介质层4、捕获层8和局部亲水化的疏水层(3,9),上极板包括疏水化的地电极2;集成电路为数字微流控电路控制系统。
所述数字微流控芯片的下极板包括玻璃基底6(在其它实施例中,也可以是其它材料基底)、电极层5、介质层4、捕获层8和局部亲水化的疏水层(3,9),电极层5由湿法刻蚀技术制作于基底表面(在其它实施例中,也可以是电路板印刷技术和打印技术等方法),介质层4均匀涂覆于电极层5上表面,捕获层8通过光刻等技术结合于介质层4上方并与电极层5特定位置对准,局部亲水化的疏水层(3,9)在捕获层8上表面,通过局部剥离等技术在捕获层8周围形成特定的亲水图案9,在其余区域形成疏水图案;所述上极板从下至上依次包括疏水层3、接地导电层2和上极板基底1;
电极层5为具有特定图案的铬电极阵列(10,11)(在其它实施例中,也可以是其它导电金属),包括96个电极接入口、八个贮液池电极单元12、八个液滴生成通道电极阵列、6个单颗粒/单细胞捕获电极阵列和反应电极区13,液滴生成通道电极阵列分别与贮液池电极单元一一相连,并以单颗粒/单细胞捕获电极阵列和反应电极区13为中心对称分列于其两侧(在其它实施例中,也可以是其它数目、其它形状的电极阵列);
捕获层8为具有单细胞捕获能力的微结构阵列,由具有小于单颗粒/单细胞尺寸间隙的微坝结构15和分布于其两侧的流体分布微柱14组成(在其它实施例中,也可以是其它形状、其它数目的捕获层结构),该阵列与电极层5特定位置对准;
局部亲水化的疏水层(3,9)是由局部剥离技术形成的具有局部亲水化位点的疏水层3,其经对准可在捕获层8的微坝结构处形成圆形的亲水化位点9(在其它实施例中,也可以是其它形状的亲水化位点)。
本发明的数字微流控制作工艺如下:
下极板的制作:
(a)下极板玻璃基底6使用磁控溅射方法蒸镀300纳米厚铬层,通过湿法刻蚀形成具有特定结构的铬电极阵列(10,11);
(b)介质层4材料为具有高介电常数、厚度均匀、抗击穿能力强的绝缘材料,本实施案例中使用光刻胶通过旋涂的方式形成;
(c)捕获层8材料为光刻胶,本实施案例中所使用的优选结构形状为弯月形,通过套刻技术在特定的电极处形成含有微坝15和流体分布微柱14的捕获结构;
(d)作为本发明的优选实施方式,所述的捕获结构高度为20微米,其中微坝结构15的间隙宽度为8微米;
(e)疏水层3材料一般为特氟龙,本实施案例中使用聚四氟乙烯ptfe水分散液通过局部剥离和套刻技术在微坝结构15处形成局部圆形的亲水化位点16形成。
上极板的制作:
(a)上极板基底1为任意绝缘透明材料,如玻璃;
(b)接地导电层2材料选择透光率高、可见性好的材料,如ito等,通过沉积形成;
(c)上极板疏水材料一般与下极板疏水材料一致,一般为teflon,本实施案例中使用聚四氟乙烯ptfe水分散液通过旋涂退火工艺形成。
上下极板之间使用具有一定厚度的间隙层7分隔开来,与其中的液滴形成三明治结构,液滴通过对应下极板贮液池电极12上方的上极板位置开孔,通过自动进样引入。进样完成后,将数字微流控芯片进行油封,起到隔绝污染和促进液滴移动的作用。
作为本发明的优选实施方式,所选用的细胞为gfp表达的293t细胞,细胞直径分布为10-20微米。
作为本发明的优选实施方式,本发明的具体工作过程为:
步骤a:将各试剂分别负载于数字微流控芯片的贮液池电极单元12内,加入适量的填充油将各液滴包裹住,使用集成电路对电极进行预通电,转入步骤b;
步骤b:使用集成电路的控制电路控制电极驱动电路,按一定次序进行电极的通断电控制,从而从贮液池电极单元产生一个合适体积的含颗粒/细胞液滴,通过与其连接的通道电极阵列将液滴移动至单颗粒/单细胞捕获电极处,重复这一过程使各捕获电极均负载含颗粒/细胞液滴,转入步骤c;
步骤c:对单颗粒/单细胞捕获电极阵列区电极13断电,液滴静置30s~1min分钟后,使颗粒/细胞在重力作用下沉降于芯片表面,转入步骤d;
步骤d:集成电路的控制电路控制电极驱动电路,使液滴从单颗粒/单细胞捕获电极阵列区13通过,当单个颗粒/细胞进入微捕获结构15中时,因为流体从旁路经过的路径大于从微结构15的间隙,颗粒/细胞会先进入微捕获结构15的间隙中,由于间隙的宽度小于颗粒/细胞的直径,颗粒/细胞被卡在微捕获结构15内,同时堵住微捕获结构15,使得同一平面上流经微结构间隙的流体流速趋近于零,此时后续的颗粒/细胞无法再次进入该捕获结构,只能从结构的旁侧或上方流走。同时由于该结构具有较强的亲水性,使得被捕获的颗粒/细胞粘附于芯片表面,不会在液滴移动的过程中被冲走。流体分布微柱14起到分布流体和富集颗粒/细胞的作用。在后续的颗粒/细胞捕获结构中重复该过程,即可实现该芯片上多路单颗粒/细胞的捕获,然后转入步骤e。
步骤e:控制电极驱动电路从另一贮液池电极单元12中引出pbs溶液,洗去捕获结构电极区13残余的颗粒/细胞,然后将液滴驱动至废液池中,转入步骤f。
步骤f:控制电极驱动电路从另一贮液池电极单元12中引出细胞裂解液(0.2%tritonx-100),将细胞裂解液驱动至单细胞捕获结构15处,使细胞裂解,细胞裂解后其含有的细胞内含物释放于该液滴中,转入步骤g。
步骤g:控制电极驱动电路从下一贮液池电极单元12中引出单细胞全基因组扩增试剂,通过液滴驱动的方式对反应过程进行混合,反应结束后将液滴取出进行后续的分析研究。
当细胞浓度为5×106个/ml,步骤d的重复次数为1次、2次和3次时,捕获效率分别为88.1%、95.3%和99.9%;捕获时间分别为40s、80s和120s。即该方法可以在较短时间内实现高效的单细胞捕获,且在保证一定捕获轮数的情况(≥3)下,可以实现无人值守式单细胞捕获。
申请人声明,本发明通过上述实施例来说明本发明的详细特征以及详细方法,但本发明并不局限于上述详细特征以及详细方法,即不意味着本发明必须依赖上述详细特征以及详细方法才能实施。所属技术领域的技术人员应该明白,对本发明的任何改进,对本发明选用组分的等效替换、具体方式的选择等,均属于本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!