基因组编辑的免疫效应细胞的制作方法
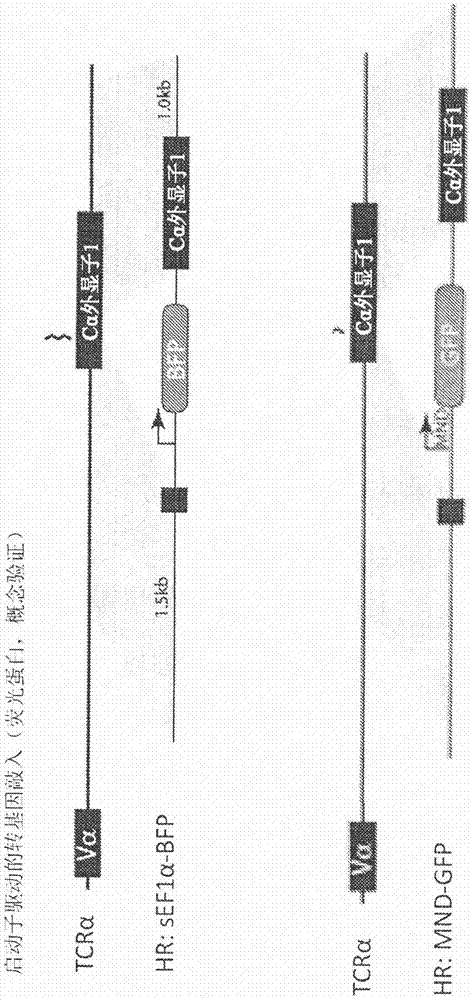
根据美国法典第35条119(e)款,本申请要求2016年4月14日提交的美国临时申请第62/322,604号和2016年3月11日提交的美国临时申请第62/307,245号的权益,其全部内容通过引用并入本文。关于序列表的声明与本申请相关的序列表以文本格式提供以代替纸质副本,并且通过引用并入本说明书中。包含序列表的文本文件的名称是blbd_065_02wo_st25.txt。该文本文件为168kb,于2017年3月9日创建,并通过efs-web以电子方式提交,与说明书的提交同时进行。本发明涉及用于过继性细胞疗法的改进的免疫效应细胞组合物。更具体地,本发明涉及基因组编辑的免疫效应细胞组合物及其制备方法。
背景技术:
:全球癌症负担在1975年至2000年间翻了一番。癌症是全球发病率和死亡率的第二大原因,2012年新发病例约为1410万,癌症相关死亡人数达820万。最常见的癌症是乳腺癌、肺和支气管癌、前列腺癌、结肠和直肠癌、膀胱癌、皮肤黑素瘤、非霍奇金淋巴瘤、甲状腺癌、肾和肾盂癌、子宫内膜癌、白血病和胰腺癌。预计未来二十年内新发癌症病例的数量将增加到2200万。免疫系统在检测和对抗人类癌症方面具有关键作用。大多数转化细胞很快被免疫哨兵检测到,并经由克隆表达的t细胞受体(tcr)通过抗原特异性t细胞的活化而被破坏。因此,癌症可以被认为是免疫病症,免疫系统无法发挥必要的抗肿瘤反应以持久地抑制和消除该疾病。为了更有效地对抗癌症,在过去几十年中开发的某些免疫疗法干预特别关注于增强t细胞免疫。这些治疗仅产生了零星的疾病缓解病例,并没有取得实质性的全面成功。最近使用抑制t细胞活化的单克隆抗体靶向分子(例如,ctla-4或pd-1)的疗法已表现出更显著的抗肿瘤作用;然而,由于全身免疫活化,这些治疗还与显著毒性有关。最近,已经在早期临床试验中研究和测试了基于t细胞的分离、修饰、扩增和重新输注的过继性细胞免疫治疗策略。由于其选择性识别和强大的效应机制,t细胞通常是癌症免疫疗法的选择效应细胞。这些治疗表现出不同的成功率,但有少数患者经历了持久的缓解,从而突出了基于t细胞的癌症免疫疗法尚未实现的潜力。细胞溶解性t细胞成功识别肿瘤细胞相关抗原启动了靶向肿瘤溶解并支持了任何有效的癌症免疫治疗方法。肿瘤浸润性t细胞(til)表达tcr特异性定向的肿瘤相关抗原;然而,大量的til仅限于少数人类癌症。工程化t细胞受体(tcr)和嵌合抗原受体(car)可能增加基于t细胞的免疫疗法对许多癌症和其它免疫病症的适用性。尽管使用car表达转基因t细胞的初始结果非常有希望,但基于cart细胞的免疫疗法的疗效、安全性和可扩展性受到克隆衍生的tcr的连续表达的限制。此外,残留的tcr表达可能干扰工程化t细胞中的car信号转导,或者它可能引发对自身或同种异体抗原的脱靶和病理反应。然而,缺少用于精确破坏内源性tcr信号转导组分和tcr表达的方法。因此,基于car的t细胞仅用于自体移植。即便如此,也存在着潜在的对自体过继性细胞免疫治疗的安全性和疗效的担忧:工程化受体的随机整合和不可预测的表达可能影响经修饰的自体t细胞的疗效,并且识别自身抗原的自体t细胞可能增强不良自身免疫反应。此外,现有技术的工程化t细胞仍然受到由癌细胞、炎性细胞、基质细胞和细胞因子组成的复杂免疫抑制肿瘤微环境的调节。在这些组分中,癌细胞、炎性细胞和抑制性细胞因子调节t细胞表型和功能。总的来说,肿瘤微环境驱使t细胞终末分化为耗竭的t细胞。t细胞耗竭是慢性环境中t细胞功能障碍的状态,其特征在于对抑制性受体的表达的增加或抑制性受体的信号转导的增加;效应细胞因子的产生的减少;和持续和消除癌症的能力的下降。耗竭的t细胞还以分级方式表现出功能丧失:在耗竭的早期,il-2产生减少和离体杀伤能力丧失;在中期,tnf-α产生丧失;在耗竭的晚期,ifn-γ和gzmb产生丧失。肿瘤微环境中的大多数t细胞分化为耗竭的t细胞并丧失消除癌症的能力,并且最终被清除。癌症并不是工程化t细胞可以提供有效治疗选择的唯一疾病。t细胞对身体对刺激免疫系统活性的反应至关重要。例如,t细胞受体多样性在移植物抗宿主病(gvhd),特别是慢性gvhd中起作用。事实上,已表明,给予t细胞受体抗体可减少急性gvhd的症状。因此,需要更有效、靶向、更安全和持久的疗法来治疗各种形式的癌症和其它免疫病症。此外,需要能够以高效率精确且可再现地破坏内源性tcr基因的方法和组合物。当今对大多数癌症的护理标准在一些或所有这些标准中都不尽如人意。技术实现要素:本发明一般部分地涉及改进的免疫效应细胞组合物和使用基因组编辑对其进行制造的方法。特定实施例中涵盖的免疫效应细胞包括在一个或多个t细胞受体基因座中的精确破坏或修饰,其导致tcr表达和信号转导的破坏以及更有效和更安全的过继性细胞疗法。工程化免疫效应细胞可以进一步包括一个或多个工程化抗原受体,以增加过继性细胞免疫疗法的疗效和特异性。特定实施例中涵盖的免疫效应细胞组合物可以进一步包括插入一个或多个免疫效力增强子和/或免疫抑制信号减弱子(damper),以增加过继性细胞疗法的疗效和持久性。在各个实施例中,提供了一种细胞,其包括:一个或多个经修饰的t细胞受体α(tcrα)等位基因;和包括编码免疫效力增强子的多核苷酸的核酸,其插入一个或多个经修饰的tcrα等位基因中。在各个实施例中,提供了一种细胞,其包括:一个或多个经修饰的t细胞受体α(tcrα)等位基因;和包括编码免疫抑制信号减弱子的多核苷酸的核酸,其插入一个或多个经修饰的tcrα等位基因中。在各个实施例中,提供了一种细胞,其包括:一个或多个经修饰的t细胞受体α(tcrα)等位基因;和包括编码工程化抗原受体的多核苷酸的核酸,其插入一个或多个经修饰的tcrα等位基因中。在各个实施例中,提供了一种细胞,其包括:一个或多个经修饰的t细胞受体α(tcrα)等位基因;和包括编码免疫效力增强子、免疫抑制信号减弱子和工程化抗原受体的多核苷酸的核酸,其插入一个或多个经修饰的tcrα等位基因中。在额外的实施例中,经修饰的tcrα是非功能性的或具有显著降低的功能。在某些实施例中,核酸进一步包括与编码免疫效力增强子、免疫抑制信号减弱子或工程化抗原受体的多核苷酸可操作地连接的rna聚合酶ii启动子。在一些实施例中,rna聚合酶ii启动子选自由以下组成的群组:短ef1α启动子、长ef1α启动子、人rosa26基因座、泛素c(ubc)启动子、磷酸甘油酸激酶-1(pgk)启动子、巨细胞病毒增强子/鸡β-肌动蛋白(cag)启动子、β-肌动蛋白启动子和骨髓增生性肉瘤病毒增强子、阴性对照区缺失的dl587rev引物结合位点取代(mnd)启动子。在特定实施例中,核酸进一步包括一种或多种编码自裂解病毒肽的多核苷酸,所述自裂解病毒肽与编码免疫效力增强子、免疫抑制信号减弱子或工程化抗原受体的多核苷酸可操作地连接。在某些实施例中,自裂解病毒肽是2a肽。在另外的实施例中,自裂解肽选自由以下组成的群组:口蹄疫病毒(fmdv)2a肽、马鼻炎a病毒(erav)2a肽、明脉扁刺蛾β四体病毒(thoseaasignavirus)(tav)2a肽、猪捷申病毒-1(ptv-1)2a肽、泰勒病毒2a肽和脑心肌炎病毒2a肽。在特定实施例中,核酸进一步包括异源多腺苷酸化信号。在额外的实施例中,免疫抑制信号减弱子包括抵消免疫抑制因子的酶功能。在一些实施例中,免疫抑制信号减弱子包括犬尿氨酸酶活性。在某些实施例中,免疫抑制信号减弱子包括结合免疫抑制因子的外结构域,任选地其中外结构域是抗体或其抗原结合片段。在特定实施例中,免疫抑制信号减弱子包括结合免疫抑制因子的外结构域和跨膜结构域。在某些实施例中,免疫抑制信号减弱子包括结合免疫抑制因子的外结构域、跨膜结构域和不能向细胞转导免疫抑制信号的经修饰的内结构域。在一些实施例中,外结构域包括受体的细胞外配体结合结构域,所述受体包括免疫受体酪氨酸抑制性基序(itim)和/或免疫受体酪氨酸开关基序(itsm)。在另外的实施例中,外结构域结合免疫抑制因子,所述免疫抑制因子选自由以下组成的群组:程序性死亡配体1(pd-l1)、程序性死亡配体2(pd-l2)、转化生长因子β(tgfβ)、巨噬细胞集落刺激因子1(m-csf1)、肿瘤坏死因子相关凋亡诱导配体(trail)、表达于siso细胞配体上的受体结合癌抗原(rcas1)、fas配体(fasl)、cd47、白细胞介素-4(il-4)、白细胞介素-6(il-6)、白细胞介素-8(il-8)、白细胞介素-10(il-10)和白细胞介素-13(il-13)。在特定实施例中,外结构域包括受体的细胞外配体结合结构域,所述受体选自由以下组成的群组:程序性细胞死亡蛋白1(pd-1)、淋巴细胞活化基因3蛋白(lag-3)、t细胞免疫球蛋白结构域和粘蛋白结构域蛋白3(tim-3)、细胞毒性t淋巴细胞抗原-4(ctla-4)、b和t淋巴细胞衰减子(btla)、基于t细胞免疫球蛋白和免疫受体酪氨酸的抑制性基序结构域(tigit)、转化生长因子β受体ii(tgfβrii)、哺乳动物集落刺激因子1受体(m-csf1)、白细胞介素4受体(il4r)、白细胞介素6受体(il6r)、趋化因子(c-x-c基序)受体1(cxcr1)、趋化因子(c-x-c基序)受体2(cxcr2)、白细胞介素10受体亚单位α(il10r)、白细胞介素13受体亚单位α2(il13rα2)、肿瘤坏死因子相关的凋亡诱导受体(trailr1)、表达于siso细胞上的受体结合癌抗原(rcas1r)和fas细胞表面死亡受体(fas)。在额外的实施例中,外结构域包括受体的细胞外配体结合结构域,所述受体选自由以下组成的群组:pd-1、lag-3、tim-3、ctla-4、btla、tigit和tgfβrii。在一些实施例中,外结构域包括tgfβrii的细胞外配体结合结构域。在特定实施例中,免疫抑制信号减弱子是显性负性tgfβrii受体。在另外的实施例中,跨膜结构域从多肽分离,所述多肽选自由以下组成的群组:t细胞受体的α或β链、cdδ、cd3ε、cdγ、cd3ζ、cd4、cd5、cd8α、cd9、cd16、cd22、cd27、cd28、cd33、cd37、cd45、cd64、cd80、cd86、cd134、cd137、cd152、cd154和pd-1。在某些实施例中,免疫抑制因子选自由以下组成的群组:pd-l1、pd-l2、tgfβ、m-csf、trail、rcas1、fasl、il-4、il-6、il-8、il-10和il-13。在特定实施例中,免疫效力增强子选自由以下组成的群组:双特异性t细胞衔接子分子(bite)、免疫增效因子和翻转(flip)受体。在额外的实施例中,bite包括:结合抗原的第一结合结构域,所述抗原选自由以下组成的群组:α叶酸受体、5t4、αvβ6整联蛋白、bcma、b7-h3、b7-h6、caix、cd16、cd19、cd20、cd22、cd30、cd33、cd44、cd44v6、cd44v7/8、cd70、cd79a、cd79b、cd123、cd138、cd171、cea、cspg4、egfr,包含erbb2的egfr家族(her2)、egfrviii、egp2、egp40、epcam、epha2、epcam、fap、胎achr、frα、gd2、gd3、磷脂酰肌醇蛋白聚糖-3(gpc3)、hla-a1+mage1、hla-a2+mage1、hla-a3+mage1、hla-a1+ny-eso-1、hla-a2+ny-eso-1、hla-a3+ny-eso-1、il-11rα、il-13rα2、λ、路易斯y、κ、间皮蛋白、muc1、muc16、ncam、nkg2d配体、ny-eso-1、prame、psca、psma、ror1、ssx、存活蛋白、tag72、tem、vegfr2和wt-1;连接子;第二结合结构域,其结合免疫效应细胞上的抗原,所述抗原选自由以下组成的群组:cd3γ、cd3δ、cd3ε、cd3ζ、cd28、cd134、cd137和cd278。在另外的实施例中,bite包括:结合抗原的第一结合结构域,所述抗原选自由以下组成的群组:i类mhc-肽复合物和ii类mhc-肽复合物;连接子;第二结合结构域,其结合免疫效应细胞上的抗原,所述抗原选自由以下组成的群组:cd3γ、cd3δ、cd3ε、cd3ζ、cd28、cd134、cd137和cd278。在特定实施例中,免疫增效因子选自由以下组成的群组:细胞因子、趋化因子、细胞毒素、细胞因子受体及其变体。在某些实施例中,细胞因子选自由以下组成的群组:il-2、胰岛素、ifn-γ、il-7、il-21、il-10、il-12、il-15和tnf-α。在一些实施例中,趋化因子选自由以下组成的群组:mip-1α、mip-1β、mcp-1、mcp-3和rantes。在另外的实施例中,细胞毒素选自由以下组成的群组:穿孔蛋白、粒酶a和粒酶b。在某些实施例中,细胞因子受体选自由以下组成的群组:il-2受体、il-7受体、il-12受体、il-15受体和il-21受体。在某些实施例中,免疫增效因子包括蛋白质去稳定化结构域。在一些实施例中,翻转受体包括结合免疫抑制细胞因子的外结构域;跨膜;和内结构域。在特定实施例中,翻转受体包括:外结构域,其包括细胞因子受体的细胞外细胞因子结合结构域,其中所述细胞因子受体选自由以下组成的群组:il-4受体、il-6受体、il-8受体、il-10受体、il-13受体或tgfβrii;跨膜结构域,其从cd4、cd8α、cd27、cd28、cd134、cd137、cd3多肽、il-2受体、il-7受体、il-12受体、il-15受体或il-21受体分离;和内结构域,其从il-2受体、il-7受体、il-12受体、il-15受体或il-21受体分离。在额外的实施例中,翻转受体包括:外结构域,其包括结合il-4、il-6、il-8、il-10、il-13或tgfβ的抗体或其抗原结合片段;跨膜结构域,其从cd4、cd8α、cd27、cd28、cd134、cd137、cd3多肽、il-2受体、il-7受体、il-12受体、il-15受体或il-21受体分离;和内结构域,其从il-2受体、il-7受体、il-12受体、il-15受体或il-21受体分离。在特定实施例中,翻转受体包括结合免疫抑制因子的外结构域、跨膜结构域和一个或多个细胞内共刺激信号转导结构域和/或主要信号转导结构域。在某些实施例中,外结构域包括受体的细胞外配体结合结构域,所述受体包括itim和/或itsm。在一些实施例中,外结构域包括受体的细胞外配体结合结构域,所述受体选自由以下组成的群组:pd-1、lag-3、tim-3、ctla-4、btla、tigit、tgfβrii、il4r、il6r、cxcr1、cxcr2、il10r、il13rα2、trailr1、rcas1r和fas。在另外的实施例中,外结构域包括受体的细胞外配体结合结构域,所述受体选自由以下组成的群组:pd-1、lag-3、tim-3、ctla-4、btla、tigit和tgfβrii。在某些实施例中,外结构域包括tgfβrii或pd-1的细胞外配体结合结构域。在一些实施例中,跨膜结构域从多肽分离,所述多肽选自由以下组成的群组:t细胞受体的α或β链、cd3δ、cd3ε、cd3γ、cd3ζ、cd4、cd5、cdsα、cd9、cd16、cd22、cd27、cd28、cd33、cd37、cd45、cd64、cd80、cd86、cd134、cd137、cd152、cd154和pd-1。在特定实施例中,一个或多个共刺激信号转导结构域和/或主要信号转导结构域包括免疫受体酪氨酸活化基序(itam)。在一些实施例中,一个或多个共刺激信号转导结构域从多肽分离,所述多肽选自由以下组成的群组:tlr1、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9、tlr10、card11、cd2、cd7、cd27、cd28、cd30、cd40、cd54(icam)、cd83、cd134(ox40)、cd137(4-1bb)、cd278(icos)、dap10、lat、nkd2c、slp76、trim和zap70。在某些实施例中,一个或多个共刺激信号转导结构域从多肽分离,所述多肽选自由以下组成的群组:cd28、cd134、cd137和cd278。在另外的实施例中,一个或多个共刺激信号转导结构域从cd28分离。在额外的实施例中,一个或多个共刺激信号转导结构域从cd134分离。在特定实施例中,一个或多个共刺激信号转导结构域从cd137分离。在特定实施例中,一个或多个共刺激信号转导结构域从cd278分离。在一些实施例中,一个或多个主要信号转导结构域从多肽分离,所述多肽选自由以下组成的群组:fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd3ζ、cd22、cd79a、cd79b的和cd66d。在一些实施例中,一个或多个主要信号转导结构域从cd3ζ分离。在某些实施例中,翻转受体包括tgfβrii受体的细胞外配体结合结构域;il-2受体、il-7受体、il-12受体或il-15受体跨膜结构域;和从il-2受体、il-7受体、il-12受体或il-15受体分离的内结构域。在特定实施例中,翻转受体包括pd-1受体的细胞外配体结合结构域、pd-1或cd28跨膜结构域跨膜结构域和一个或多个细胞内共刺激和/或主要信号转导结构域,所述细胞内共刺激和/或主要信号转导结构域选自由以下组成的群组:cd28、cd134、cd137和cd278。在额外的实施例中,工程化抗原受体选自由以下组成的群组:工程化tcr、car、daric或嵌合细胞因子受体。在特定实施例中,核酸包括编码第一自裂解病毒肽的多核苷酸和编码整合到一个经修饰的tcrα等位基因中的工程化tcr的α链的多核苷酸。在另外的实施例中,核酸包括编码第一自裂解病毒肽的多核苷酸和编码整合到一个经修饰的tcrα等位基因中的工程化tcr的β链的多核苷酸。在某些实施例中,核酸包括5′至3′的编码第一自裂解病毒肽的多核苷酸、编码工程化tcr的α链的多核苷酸、编码第二自裂解病毒肽的多核苷酸和编码整合到一个经修饰的tcrα等位基因中的工程化tcr的β链的多核苷酸。在特定实施例中,两个经修饰的tcrα等位基因都是非功能性的。在一些实施例中,第一经修饰的tcrα等位基因包括核酸,所述核酸包括编码第一自裂解病毒肽的多核苷酸和编码工程化tcr的α链的多核苷酸,并且第二经修饰的tcrα等位基因包括编码第二自裂解病毒肽的多核苷酸和编码工程化tcr的β链的多核苷酸。在一些实施例中,工程化tcr结合抗原,所述抗原选自由以下组成的群组:α叶酸受体、5t4、αvβ6整联蛋白、bcma、b7-h3、b7-h6、caix、cd16、cd19、cd20、cd22、cd30、cd33、cd44、cd44v6、cd44v7/8、cd70、cd79a、cd79b、cd123、cd138、cd171、cea、cspg4、egfr,包含erbb2的egfr家族(her2)、egfrviii、egp2、egp40、epcam、epha2、epcam、fap、胎achr、frα、gd2、gd3、磷脂酰肌醇蛋白聚糖-3(gpc3)、hla-a1+mage1、hla-a2+mage1、hla-a3+mage1、hla-a1+ny-eso-1、hla-a2+ny-eso-1、hla-a3+ny-eso-1、il-11rα、il-13rα2、λ、路易斯y、κ、间皮蛋白、muc1、muc16、ncam、nkg2d配体、ny-eso-1、prame、psca、psma、ror1、ssx、存活蛋白、tag72、tem、vegfr2和wt-1。在某些实施例中,car包括:结合抗原的细胞外结构域,所述抗原选自由以下组成的群组:α叶酸受体、5t4、αvβ6整联蛋白、bcma、b7-h3、b7-h6、caix、cd16、cd19、cd20、cd22、cd30、cd33、cd44、cd44v6、cd44v7/8、cd70、cd79a、cd79b、cd123、cd138、cd171、cea、cspg4、egfr,包含erbb2的egfr家族(her2)、egfrviii、egp2、egp40、epcam、epha2、epcam、fap、胎achr、frα、gd2、gd3、磷脂酰肌醇蛋白聚糖-3(gpc3)、hla-a1+mage1、hla-a2+mage1、hla-a3+mage1、hla-a1+ny-eso-1、hla-a2+ny-eso-1、hla-a3+ny-eso-1、il-11rα、il-13rα2、λ、路易斯y、κ、间皮蛋白、muc1、muc16、ncam、nkg2d配体、ny-eso-1、prame、psca、psma、ror1、ssx、存活蛋白、tag72、tem、vegfr2和wt-1;从多肽分离的跨膜结构域,所述多肽选自由以下组成的群组:t细胞受体的α或β链、cd3δ、cd3ε、cd3γ、cd3ζ、cd4、cd5、cd8α、cd9、cd16、cd22、cd27、cd28、cd33、cd37、cd45、cd64、cd80、cd86、cd134、cd137、cd152、cd154和pd-1;从多肽分离的一个或多个细胞内共刺激信号转导结构域,所述多肽选自由以下组成的群组:tlr1、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9、tlr10、card11、cd2、cd7、cd27、cd28、cd30、cd40、cd54(icam)、cd83、cd134(ox40)、cd137(4-1bb)、cd278(icos)、dap10、lat、nkd2c、slp76、trim和zap70;和从多肽分离的信号转导结构域,所述多肽选自由以下组成的群组:fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd3ζ、cd22、cd79a、cd79b和cd66d。在特定实施例中,car包括:细胞外结构域,其结合mhc-肽复合物、i类mhc-肽复合物或ii类mhc-肽复合物;从多肽分离的跨膜结构域,所述多肽选自由以下组成的群组:t细胞受体的α或β链、cd3δ、cd3ε、cd3γ、cd3ζ、cd4、cd5、cd8α、cd9、cd16、cd22、cd27、cd28、cd33、cd37、cd45、cd64、cd80、cd86、cd134、cd137、cd152、cd154和pd-1;从多肽分离的一个或多个细胞内共刺激信号转导结构域,所述多肽选自由以下组成的群组:tlr1、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9、tlr10、card11、cd2、cd7、cd27、cd28、cd30、cd40、cd54(icam)、cd83、cd134(ox40)、cd137(4-1bb)、cd278(icos)、dap10、lat、nkd2c、slp76、trim和zap70;从多肽分离的信号转导结构域,所述多肽选自由以下组成的群组:fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd3ζ、cd22、cd79a、cd79b和cd66d。在另外的实施例中,car包括:结合抗原的细胞外结构域,所述抗原选自由以下组成的群组:bcma、cd19、cspg4、psca、ror1和tag72;从多肽分离的跨膜结构域,所述多肽选自由以下组成的群组:cd4、cd8α、cd154和pd-1;从多肽分离的一个或多个细胞内共刺激信号转导结构域,所述多肽选自由以下组成的群组:cd28、cd134和cd137;和从多肽分离的信号转导结构域,所述多肽选自由以下组成的群组:fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd3ζ、cd22、cd79a、cd79b和cd66d。在特定实施例中,daric受体包括:信号转导多肽,其包括第一多聚化结构域、第一跨膜结构域和一个或多个细胞内共刺激信号转导结构域和/或主要信号转导结构域;和结合多肽,其包括结合结构域、第二多聚化结构域和任选的第二跨膜结构域;其中桥连因子促进细胞表面上daric受体复合物的形成,其中桥连因子与信号转导多肽和结合多肽的多聚化结构域缔合并置于其之间。在某些实施例中,第一和第二多聚化结构域与桥连因子缔合,所述桥连因子选自由以下组成的群组:雷帕霉素或其雷帕霉素类似物、库马霉素或其衍生物、赤霉素或其衍生物、脱落酸(aba)或其衍生物、甲氨蝶呤或其衍生物、环孢菌素a或其衍生物、fkcsa或其衍生物、用于fkbp的甲氧苄啶(tmp)-合成配体(slf)或其衍生物、及其任意组合。在一些实施例中,第一和第二多聚化结构域是选自以下的对:fkbp和frb、fkbp和钙调神经蛋白、fkbp和亲环蛋白、fkbp和细菌性dhfr、钙调神经蛋白和亲环蛋白、pyl1和abi1、或gib1和gai、或其变体。在某些实施例中,第一多聚化结构域包括frbt2098l,第二多聚化结构域包括fkbp12,并且桥连因子是雷帕霉素类似物ap21967。在一些实施例中,第一多聚化结构域包括frb,第二多聚化结构域包括fkbp12,并且桥连因子是雷帕霉素、替西罗莫司或依维莫司。在特定实施例中,结合结构域包括scfv。在另外的实施例中,结合结构域包括结合至抗原的scfv,所述抗原选自由以下组成的群组:α叶酸受体、5t4、αvβ6整联蛋白、bcma、b7-h3、b7-h6、caix、cd19、cd20、cd22、cd30、cd33、cd44、cd44v6、cd44v7/8、cd70、cd79a、cd79b、cd123、cd138、cd171、cea、cspg4、egfr,包含erbb2的egfr家族(her2)、egfrviii、egp2、egp40、epcam、epha2、epcam、fap、胎achr、frα、gd2、gd3、磷脂酰肌醇蛋白聚糖-3(gpc3)、hla-a1+mage1、hla-a2+mage1、hla-a3+mage1、hla-a1+ny-eso-1、hla-a2+ny-eso-1、hla-a3+ny-eso-1、il-11rα、il-13rα2、λ、路易斯y、κ、间皮蛋白、muc1、muc16、ncam、nkg2d配体、ny-eso-1、prame、psca、psma、ror1、ssx、存活蛋白、tag72、tem、vegfr2和wt-1。在某些实施例中,结合结构域包括结合至mhc-肽复合物、i类mhc-肽复合物或ii类mhc-肽复合物的scfv;在特定实施例中,第一和第二跨膜结构域从多肽分离,所述多肽独立地选自由以下组成的群组:cd3δ、cd3ε、cd3γ、cd3ζ、cd4、cd5、cd8α、cd9、cd16、cd22、cd27、cd28、cd33、cd37、cd45、cd64、cd80、cd86、cd134、cd137、cd152、cd154和pd-1。在特定实施例中,第一和第二跨膜结构域从多肽分离,所述多肽独立地选自由以下组成的群组:cd3δ、cd3ε、cd3γ、cd3ζ、cd4和cd8α。在额外的实施例中,一个或多个共刺激结构域从多肽分离,所述多肽选自由以下组成的群组:cd28、cd134和cd137。在某些实施例中,一个或多个主要信号结构域从多肽分离,所述多肽选自由以下组成的群组:fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd3ζ、cd22、cd79a、cd79b和cd66d。在一些实施例中,信号转导多肽包括frbt2098l的第一多聚化结构域、cd8跨膜结构域、4-1bb共刺激结构域和cd3ζ主要信号转导结构域;结合多肽包括结合cd19的scfv、fkbp12的第二多聚化结构域和cd4跨膜结构域;并且桥连因子是雷帕霉素类似物ap21967。在特定实施例中,信号转导多肽包括frb的第一多聚化结构域、cd8跨膜结构域、4-1bb共刺激结构域和cd3ζ主要信号转导结构域;结合多肽包括结合cd19的scfv、fkbp12的第二多聚化结构域和cd4跨膜结构域;并且桥连因子是雷帕霉素、替西罗莫司或依维莫司。在某些实施例中,一个经修饰的tcrα等位基因包括编码信号转导多肽、病毒自裂解2a肽和结合多肽的核酸。在特定实施例中,嵌合细胞因子受体包括:免疫抑制细胞因子或其细胞因子受体结合变体、连接子、跨膜结构域和细胞内信号转导结构域。在一些实施例中,细胞因子或细胞因子受体结合变体选自由以下组成的群组:白细胞介素-4(il-4)、白细胞介素-6(il-6)、白细胞介素-8(il-8)、白细胞介素-10(il-10)和白细胞介素-13(il-13)。在一些实施例中,连接子包括ch2ch3结构域或铰链结构域。在另外的实施例中,连接子包括igg1、igg4或igd的ch2和ch3结构域。在额外的实施例中,连接子包括cd8α或cd4铰链结构域。在特定实施例中,跨膜结构域从多肽分离,所述多肽选自由以下组成的群组:t细胞受体的α或β链、cd3δ、cd3ε、cd3γ、cd3ζ、cd4、cd5、cd8α、cd9、cd16、cd22、cd27、cd28、cd33、cd37、cd45、cd64、cd80、cd86、cd134、cd137、cd152、cd154和pd-1。在某些实施例中,细胞内信号转导结构域选自由以下组成的群组:含有主要信号转导结构域和/或共刺激结构域的itam。在额外的实施例中,细胞内信号转导结构域从多肽分离,所述多肽选自由以下组成的群组:fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd3ζ、cd22、cd79a、cd79b和cd66d。在另外的实施例中,细胞内信号转导结构域从多肽分离,所述多肽选自由以下组成的群组:tlr1、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9、tlr10、card11、cd2、cd7、cd27、cd28、cd30、cd40、cd54(icam)、cd83、cd134(ox40)、cd137(4-1bb)、cd278(icos)、dap10、lat、nkd2c、slp76、trim和zap70。在一些实施例中,细胞内信号转导结构域从多肽分离,所述多肽选自由以下组成的群组:cd28、cd137、cd134和cd3ζ。在特定实施例中,两个tcrα等位基因都被修饰;将包括本文考虑的编码免疫效力增强子、免疫抑制信号减弱子或工程化抗原受体的多核苷酸的第一核酸插入一个经修饰的tcrα等位基因中。在特定实施例中,两个tcrα等位基因都是非功能性的;将包括本文考虑的编码免疫效力增强子、免疫抑制信号减弱子或工程化抗原受体的第一多核苷酸的第一核酸插入第一非功能性tcrα等位基因中;并且细胞进一步包括本文考虑的编码免疫效力增强子、免疫抑制信号减弱子或工程化抗原受体的第二多核苷酸,其插入第二非功能性tcrα等位基因中。在另外的实施例中,第一多核苷酸和第二多核苷酸不同。在一些实施例中,第一多核苷酸和第二多核苷酸各自独立地编码免疫效力增强子或免疫抑制信号减弱子。在某些实施例中,第一多核苷酸和第二多核苷酸各自独立地编码翻转受体。在某些实施例中,两个tcrα等位基因都被修饰;将包括本文考虑的编码免疫效力增强子或免疫抑制信号减弱子的多核苷酸的第一核酸插入一个非功能性tcrα等位基因中;并且细胞进一步包括工程化抗原受体。在特定实施例中,核酸进一步包括编码抑制性rna的多核苷酸。在特定实施例中,抑制性rna是shrna、mirna、pirna或核酶。在额外的实施例中,核酸进一步包括与编码抑制性rna的多核苷酸可操作地连接的rna聚合酶iii启动子。在一些实施例中,rna聚合酶iii启动子选自由以下组成的群组:人或小鼠u6snrna启动子、人和小鼠h1rna启动子、或人trna-val启动子。在某些实施例中,细胞是造血细胞。在另外的实施例中,细胞是免疫效应细胞。在一些实施例中,细胞是cd3+、cd4+、cd8+或其组合。在另外的实施例中,细胞是t细胞。在某些实施例中,细胞是细胞毒性t淋巴细胞(ctl)、肿瘤浸润淋巴细胞(til)或辅助t细胞。在特定实施例中,细胞的来源是外周血单核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、来自感染部位的组织、腹水、胸腔积液、脾脏组织或肿瘤。在一些实施例中,细胞在存在pi3k途径抑制剂的情况下被活化和刺激。在特定实施例中,与在不存在pi3k途径抑制剂的情况下活化和刺激的细胞相比较,在存在pi3k途径抑制剂的情况下活化和刺激的细胞具有增加的对以下的表达:i)一个或多个标志物,其选自由以下组成的群组:cd62l、cd127、cd197和cd38或ii)标志物cd62l、cd127、cd197和cd38中的所有标志物。在某些实施例中,与在不存在pi3k途径抑制剂的情况下活化和刺激的细胞相比较,在存在pi3k抑制剂的情况下活化和刺激的细胞具有增加的对以下的表达:i)一个或多个标志物,其选自由以下组成的群组:cd62l、cd127、cd27和cd8或ii)标志物cd62l、cd127、cd27和cd8中的所有标志物。在另外的实施例中,pi3k抑制剂是zstk474。在各个实施例中,提供了一种组合物,其包括本文考虑的细胞。在各个实施例中,提供了一种组合物,其包括本文考虑的细胞和生理学上可接受的赋形剂。在各个实施例中,提供了一种编辑t细胞群中tcrα等位基因的方法,其包括:活化t细胞群并刺激所述t细胞群增殖;将编码工程化核酸酶的mrna导入t细胞群中;用一种或多种包括供体修复模板的病毒载体转导t细胞群;其中工程化核酸酶的表达在tcrα等位基因中的靶位点产生双链断裂,并且在双链断裂(dsb)位点通过同源定向修复(hdr)将供体修复模板掺入tcrα等位基因中。在特定实施例中,供体修复模板包括与dsb的tcrα序列5′同源的5′同源臂;本文考虑的编码免疫效力增强子、免疫抑制信号减弱子或工程化抗原受体的多核苷酸;和与dsb的tcrα序列3′同源的3′同源臂。在额外的实施例中,5′和3′同源臂的长度独立地选自约100bp至约2500bp。在一些实施例中,5′和3′同源臂的长度独立地选自约600bp至约1500bp。在某些实施例中,5′同源臂为约1500bp,并且所述3′同源臂为约1000bp。在特定实施例中,5′同源臂为约600bp,并且所述3′同源臂为约600bp。在特定实施例中,病毒载体是重组腺相关病毒载体(raav)或逆转录病毒。在特定实施例中,raav具有来自aav2的一种或多种itr。在另外的实施例中,raav具有血清型,其选自由以下组成的群组:aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9和aav10。在一些实施例中,raav具有aav6血清型。在额外的实施例中,逆转录病毒是慢病毒。在某些实施例中,慢病毒是整合酶缺陷型慢病毒。在另外的实施例中,工程化核酸酶选自由以下组成的群组:大范围核酸酶、megatal、talen、zfn或crispr/cas核酸酶。在一些实施例中,大范围核酸酶由laglidadg归巢核酸内切酶(lhe)改造而成,所述laglidadg归巢核酸内切酶选自由以下组成的群组:i-aabmi、i-aaemi、i-anii、i-apami、i-capiii、i-capiv、i-ckami、i-cpami、i-cpamii、i-cpamiii、i-cpamiv、i-cpamv、i-cpav、i-crami、i-ejemi、i-gpemi、i-gpii、i-gzemi、i-gzemii、i-gzemiii、i-hjemi、i-ltrii、i-ltri、i-ltrwi、i-mpemi、i-mvemi、i-ncrii、i-ncrl、i-ncrmi、i-ohemi、i-onui、i-osomi、i-osomii、i-osomiii、i-osomiv、i-panmi、i-panmii、i-panmiii、i-pnomi、i-scumi、i-smami、i-sscmi和i-vdi141i。在特定实施例中,大范围核酸酶由lhe改造而成,所述lhe选自由以下组成的群组:i-cpami、i-hjemi、i-onui、i-panmi和smami。在另外的实施例中,大范围核酸酶由i-onuilhe改造而成。在某些实施例中,megatal包括taledna结合结构域和工程化大范围核酸酶。在额外的实施例中,tale结合结构域包括约9.5个tale重复单元至约11.5个tale重复单元。在一些实施例中,大范围核酸酶由lhe改造而成,所述lhe选自由以下组成的群组:i-aabmi、i-aaemi、i-anii、i-apami、i-capiii、i-capiv、i-ckami、i-cpami、i-cpamii、i-cpamiii、i-cpamiv、i-cpamv、i-cpav、i-crami、i-ejemi、i-gpemi、i-gpii、i-gzemi、i-gzemii、i-gzemiii、i-hjemi、i-ltrii、i-ltri、i-ltrwi、i-mpemi、i-mvemi、i-ncrii、i-ncrl、i-ncrmi、i-ohemi、i-onui、i-osomi、i-osomii、i-osomiii、i-osomiv、i-panmi、i-panmii、i-panmiii、i-pnomi、i-scumi、i-smami、i-sscmi和i-vdi141i。在另外的实施例中,大范围核酸酶由lhe改造而成,所述lhe选自由以下组成的群组:i-cpami、i-hjemi、i-onui、i-panmi和smami。在特定实施例中,大范围核酸酶由i-onuilhe改造而成。在一些实施例中,talen包括taledna结合结构域和核酸内切酶结构域或半结构域。在某些实施例中,tale结合结构域包括约9.5个tale重复单元至约11.5个tale重复单元。在某些实施例中,核酸内切酶结构域从ii型限制性核酸内切酶分离。在额外的实施例中,核酸内切酶结构域从ii型限制性核酸内切酶分离,所述ii型限制性核酸内切酶选自由以下组成的群组:aari、aceiii、acii、aloi、alw26i、baei、bbr7i、bbvi、bbvii、bbvci、bcci、bce83i、bceai、bcefi、bcgi、bcivi、bfii、bini、bmgi、bpu10i、bsaxi、bsbi、bscai、bscgi、bseri、bseyi、bsii、bsmi、bsmai、bsmfi、bsp24i、bspgi、bspmi、bspnci、bsri、bsrbi、bsrdi、bstf5i、btri、btsi、cdii、cjepi、drdii、eari、ecii、eco31i、eco57i、eco57mi、esp3i、faui、fini、foki、gdiii、gsui、hgai、hin4ii、hphi、ksp632i、mboii、mlyi、mmei、mnli、pfl1108、iplei、ppiipsri、rleai、sapi、sfani、simi、sspd5i、sth132i、stsi、tspdti、tspgwi、tth111ii、ubapi、bsai和bsmbi。在特定实施例中,核酸内切酶结构域从foki分离。在特定实施例中,zfn包括锌指dna结合结构域和核酸内切酶结构域或半结构域。在另外的实施例中,锌指dna结合结构域包括2个、3个、4个、5个、6个、7个或8个锌指基序。在某些实施例中,zfn包括tale结合结构域。在另外的实施例中,taledna结合结构域包括约9.5个tale重复单元至约11.5个tale重复单元。在特定实施例中,核酸内切酶结构域从ii型限制性核酸内切酶分离。在某些实施例中,核酸内切酶结构域从ii型限制性核酸内切酶分离,所述ii型限制性核酸内切酶选自由以下组成的群组:aari、aceiii、acii、aloi、alw26i、baei、bbr7i、bbvi、bbvii、bbvci、bcci、bce83i、bceai、bcefi、bcgi、bcivi、bfii、bini、bmgi、bpu10i、bsaxi、bsbi、bscai、bscgi、bseri、bseyi、bsii、bsmi、bsmai、bsmfi、bsp24i、bspgi、bspmi、bspnci、bsri、bsrbi、bsrdi、bstf5i、btri、btsi、cdii、cjepi、drdii、eari、ecii、eco31i、eco57i、eco57mi、esp3i、faui、fini、foki、gdiii、gsui、hgai、hin4ii、hphi、ksp632i、mboii、mlyi、mmei、mnli、pfl1108、iplei、ppiipsri、rleai、sapi、sfani、simi、sspd5i、sth132i、stsi、tspdti、tspgwi、tth111ii、ubapi、bsai和bsmbi。在另外的实施例中,核酸内切酶结构域从foki分离。在一些实施例中,将编码cas核酸内切酶的mrna、tracrrna和靶向tcrα基因中的原型间隔区的一个或多个crrna导入t细胞群中。在特定实施例中,将编码cas核酸内切酶的mrna和靶向tcrα基因中的原型间隔区序列的一个或多个sgrna导入t细胞群中。在另外的实施例中,cas核酸酶是cas9或cpf1。在一些实施例中,cas核酸酶进一步包括一个或多个taledna结合结构域。在特定实施例中,在两个tcrα等位基因中生成dsb;将包括本文考虑的编码免疫效力增强子、免疫抑制信号减弱子或工程化抗原受体的第一多核苷酸的第一供体模板插入一个经修饰的tcrα等位基因中。在另外的实施例中,在两个tcrα等位基因中生成dsb;将包括本文考虑的编码免疫效力增强子、免疫抑制信号减弱子或工程化抗原受体的第一多核苷酸的第一供体模板插入第一经修饰的tcrα等位基因中;将包括本文考虑的编码免疫效力增强子、免疫抑制信号减弱子或工程化抗原受体的第二多核苷酸的第二供体模板插入第二经修饰的tcrα等位基因中。在特定实施例中,第一供体模板和第二模板包括不同的多核苷酸。在某些实施例中,第一多核苷酸和第二多核苷酸各自独立地编码免疫效力增强子或免疫抑制信号减弱子。在额外的实施例中,第一多核苷酸和第二多核苷酸各自独立地编码翻转受体。在特定实施例中,在两个tcrα等位基因中生成dsb;将包括本文考虑的编码免疫效力增强子或免疫抑制信号减弱子的第一多核苷酸的第一供体模板插入一个经修饰的tcrα等位基因中;用包括工程化抗原受体的慢病毒载体进一步转导细胞。在另外的实施例中,t细胞是细胞毒性t淋巴细胞(ctl)、肿瘤浸润淋巴细胞(til)或辅助t细胞。在一些实施例中,编码工程化核酸酶的mrna进一步编码病毒自裂解2a肽和末端加工酶。在另外的实施例中,该方法进一步包括将编码末端加工酶的mrna导入t细胞中。在特定实施例中,末端加工酶显示5-3′核酸外切酶、5-3′碱性核酸外切酶、3-5′核酸外切酶、5′瓣状核酸内切酶、解旋酶或模板非依赖性dna聚合酶活性。在某些实施例中,末端加工酶包括trex2或其生物活性片段。在额外的实施例中,t细胞在存在pi3k途径抑制剂的情况下被活化和刺激。在某些实施例中,与在不存在pi3k途径抑制剂的情况下活化和刺激的t细胞相比较,在存在pi3k途径抑制剂的情况下活化和刺激的t细胞具有增加的对以下的表达:i)一个或多个标志物,其选自由以下组成的群组:cd62l、cd127、cd197和cd38或ii)标志物cd62l、cd127、cd197和cd38中的所有标志物。在另外的实施例中,与在不存在pi3k途径抑制剂的情况下活化和刺激的t细胞相比较,在存在pi3k抑制剂的情况下活化和刺激的t细胞具有增加的对以下的表达:i)一个或多个标志物,其选自由以下组成的群组:cd62l、cd127、cd27和cd8或ii)标志物cd62l、cd127、cd27和cd8中的所有标志物。在特定实施例中,pi3k抑制剂是zstk474。附图说明图1a示出了转基因,其包括启动子、编码荧光蛋白的核酸序列和敲入tcrα基因座恒定区的外显子1的多腺苷酸化信号。图1b示出了用megatal、aav模板、megatal和aav模板治疗的细胞或对照治疗的细胞中荧光蛋白表达和任选的cd3表达(tcr破坏)。在治疗后第10天通过流式细胞术测量表达。用megatal和aav模板有效靶向tcrα基因座的特征在于缺少cd3表达以及荧光蛋白表达。图1c示出了用megatal、aav模板、megatal和aav模板治疗的细胞或对照治疗的细胞中荧光蛋白表达和任选的cd3表达(tcr破坏)。在治疗后第5天和第10天通过流式细胞术测量表达。用megatal和aav模板有效靶向tcrα基因座的特征在于缺少cd3表达以及荧光蛋白表达。图2a示出了转基因,其包括启动子、编码cd19靶向嵌合抗原受体(car)的核酸序列和敲入tcrα基因恒定区的外显子1的多腺苷酸化信号。图2b示出了在第8天通过用pe-缀合的cd19-fc染色通过流式细胞术分析的cd19car表达。在用megatal和aav模板治疗的细胞中证实了稳定的转基因表达。图2c示出了靶向tcrα基因座的cd19car是功能性的。将未转导的或megatal/aav治疗的细胞与cd19+k562细胞以1∶1的比例共培养24小时。仅在接受编码cd19car的megatal和aav模板的那些样品中观察到有效的ifnγ产生。图3a示出了转基因,其包括启动子、编码cd19靶向嵌合抗原受体(car)的核酸序列和敲入tcrα基因恒定区的外显子1的多腺苷酸化信号。比较示意图示出了含有驱动cd19car表达的异源mnd启动子的慢病毒构建体。图3b示出了用aav+megatal或用cd19car慢病毒治疗的t细胞中的cd19car表达,如在第8天通过用pe缀合的cd19-fc染色通过流式细胞术分析。在用megatal和aav模板治疗的细胞中证实了稳定的转基因表达。示出了cd19car+t细胞上cd45ra和cd62l的表达。染色数据的汇总显示在右侧。图3c示出了靶向tcrα基因座的cd19car能够杀死靶细胞。将慢病毒转导的或megatal/aav治疗的细胞与cd19+k562细胞以1∶1的比例共培养24小时。在接受慢病毒载体的样品或用megatal+aav治疗的样品之间观察到等同的细胞毒性。图3d示出了靶向tcrα基因座的cd19car能够在识别cd19+肿瘤细胞时分泌细胞因子。将慢病毒转导的或megatal/aav治疗的细胞与cd19+k562细胞以1∶1的比例共培养24小时。在接受慢病毒载体的样品或用megatal+aav治疗的样品之间观察到等同的ifnγ、il2和tnfα细胞因子产生。图3e示出了将cd19car靶向tcrα基因座不会诱导t细胞耗竭。将慢病毒转导的或megatal/aav治疗的细胞与cd19+k562细胞以1∶1的比例共培养72小时。通过流式细胞术分析耗竭标志物表达(pd1、ctla4和tim3)。图4a示出了设计用于双等位基因表达的两个转基因。每个转基因包括驱动不同荧光蛋白表达的启动子,所述荧光蛋白整合到tcrα基因座的一个等位基因中。图4b示出了用megatal转染并随后用单一aav(gfp或bfp)转导或用两种aav双重转导的细胞中的转基因表达。在转染/转导后10天通过流式细胞术分析荧光蛋白的表达。在双重转导的样品中,通过cd3染色测量的tcr破坏在四个象限中的每一个中进行评价,从而证实了单转基因和双转基因阳性群体中的进行性破坏。图5a示出了敲入tcrα基因恒定区的外显子1的基因捕获转基因。图5b示出了用megatal转染并随后用编码基因捕获转基因的aav转导的细胞中的转基因表达和tcrα基因座破坏(cd3染色)。在转染/转导后10天通过流式细胞术分析表达。对照仅包含用megatal或aav治疗的样品。图5c示出了敲入tcrα基因恒定区的外显子1的基因捕获cd19car转基因。图5d示出了用megatal转染并随后用编码cd19car基因捕获载体的aav转导的细胞中的cd19car表达。在转染/转导后10天通过流式细胞术分析表达。对照包含用标准cd19car慢病毒载体治疗的样品。图5e示出了cd19car相对于cd19表达nalm6细胞系的细胞毒性。对于用cd19car慢病毒转导生成的cart细胞和使用cd19car基因捕获敲入载体生成的cart细胞表现出等同的细胞毒性。图6示出了改变基因组编辑条件的温度的代表性实验的结果。用tcrα靶向megatal+/-编码gfp的aav模板转染活化的pbmc。转染后,将细胞在30℃或37℃下培养24小时。通过分析cd3表达(nhej+hr)或gfp表达(仅hr)的缺失来确定断裂修复选择。在30℃下培养细胞使tcrα基因座处的nhej事件最大化,而在37℃下培养细胞减少了cd3破坏,而没有显著改变hr率。图7a示出了daric转基因,其包括启动子、编码cd19daric组分的核酸序列和敲入tcrα基因座恒定区的外显子1的多腺苷酸化信号。图7b示出了用megatal转染并随后用编码daric转基因的aav转导的细胞中的cd19daric转基因表达。通过用pe缀合的重组cd19-fc染色并在转染/转导后10天通过流式细胞术分析来分析表达。对照仅包含用megatal或aav治疗的样品。图8a示出了转基因,其包括不同长度的同源臂、启动子、编码gfp的核酸序列和敲入tcrα基因座恒定区的外显子1的多腺苷酸化信号。图8b示出了用megatal转染并随后用编码gfp转基因的aav转导但具有不同同源臂长度的细胞中的gfp转基因表达。通过流式细胞术分析表达。对照包含未转染的样品和仅用megatal治疗的样品。在所有样品中观察到等同水平的tcrα破坏,如汇总条形图数据所示。图9a示出了通过在存在cd19表达nalm-6细胞的情况下培养24小时的慢病毒转导(lv-cart细胞)或同源重组hr-cart细胞)产生的抗cd19cart细胞的t细胞耗竭标志物的表达。图9b示出了通过在存在cd19表达nalm-6细胞的情况下培养72小时的慢病毒转导(lv-cart细胞)或同源重组hr-cart细胞)产生的抗cd19cart细胞的t细胞耗竭标志物的表达。图10a示出了转基因,其包括启动子、编码car和wpre的核酸序列和敲入tcrα基因座恒定区的外显子1的多腺苷酸化信号。图10b使用中值荧光强度(mfi)示出当tcrα敲入转基因与wpre元件组合时改善的转基因表达。图11a示出了敲入tcrα基因座恒定区的外显子1的两个转基因设计。mnd-内含子-car-wpre转基因包括启动子、内含子、编码car的核酸序列、wpre和多腺苷酸化信号。mnd-car-内含子-wpre转基因包括启动子、内含子、编码car的核酸序列、wpre和多腺苷酸化信号。图11b示出了当敲入tcrα基因座的car转基因先导有内含子或具有内部内含子时相似或减少的转基因表达。图12a示出了敲入tcrα基因座恒定区的外显子1的双向转基因。转基因包括驱动编码显性负性tgfβrii的核酸的表达的启动子,并且在相反的方向上包括驱动编码car的核酸序列的表达的启动子。一种可替代设计使用t2a核糖体跳跃元件将cd19car转基因与显性负性tgfβrii转基因组合。图12b示出了tgfβrii显性负性受体的表达与cd19car转基因构建体的表达的组合。图13a示出了转基因,其包括启动子和敲入tcrα基因座恒定区的外显子1的工程化tcr。图13b示出了敲入tcrα基因座恒定区的外显子1的tct构建体的转基因表达。图14示出了两个转基因,其设计用于双等位基因表达以重构工程化tcr的表达。每个转基因包括驱动tcr组分的表达的启动子,其整合到tcrα基因座的一个等位基因中。图15示出了两个基因捕获转基因,其设计用于双等位基因表达以重构工程化tcr的表达。每个转基因包括自裂解2a肽、tcr组分和聚腺苷酸化或2a肽序列,其整合到tcrα基因座的一个等位基因中。图16示出了基因捕获转基因,其包括2a自裂解肽、翻转受体或显性负性细胞因子受体,其被敲入tcrα基因座恒定区的外显子1。图17示出了转基因,其包括启动子、翻转受体或显性负性细胞因子受体,其被敲入tcrα基因座恒定区的外显子1。图18示出了两个转基因,其设计用于双等位基因表达以重构工程化tcr和一个或多个翻转受体的表达。每个转基因整合到tcrα基因座的一个等位基因中,并且包括驱动tcr组分、自裂解2a肽和任选的翻转受体或显性负性细胞因子受体的表达的启动子。图19示出了两个基因捕获转基因,其设计用于双等位基因表达以重建工程化tcr和一个或多个翻转受体的表达。每个转基因整合到tcrα基因座的一个等位基因中,并且包括自裂解2a肽、tcr组分(例如,tcrβ或tcrα)、自裂解2a肽和任选的翻转受体或显性负性细胞因子受体、和自裂解2a肽或多腺苷酸化序列。序列标识符简述seqidno:1给出了i-onui的多核苷酸序列。seqidno:2给出了由seqidno:1编码的多肽序列。seqidno:3和4给出了用于基因组编辑的tcrα靶位点的说明性实例。seqidno:5-7给出了工程化i-onui变体的多肽序列。seqidno:8给出了质粒pbw790的多核苷酸序列。seqidno:9给出了质粒pbw851的多核苷酸序列seqidno:10给出了tcrαi-onuimegatal靶位点。seqidno:11给出了tcrαi-onuimegatal的说明性实例的多肽序列。seqidno:12给出了质粒pbw1019的多核苷酸序列。seqidno:13给出了质粒pbw1018的多核苷酸序列。seqidno:14给出了质粒pbw1020的多核苷酸序列。seqidno:15给出了质粒pbw841的多核苷酸序列。seqidno:16给出了质粒pbw400的多核苷酸序列。seqidno:17给出了质粒pbw1057的多核苷酸序列。seqidno:18给出了质粒pbw1058的多核苷酸序列。seqidno:19给出了质粒pbw1059的多核苷酸序列。seqidno:20给出了质粒pbw1086的多核苷酸序列。seqidno:21给出了质粒pbw1087的多核苷酸序列。seqidno:22给出了质粒pbw1088的多核苷酸序列。seqidno:23-32给出了各个示例性细胞渗透性肽的氨基酸序列。seqidno:33-43给出了各个示例性连接子的氨基酸序列。seqidno:34-68给出了蛋白酶切割位点和自裂解多肽切割位点的氨基酸序列。具体实施方式a.概述本文考虑的各个实施例一般部分地涉及改进的过继性细胞疗法。改进的过继性细胞疗法包括通过与t细胞受体(tcr)表达相关的基因座的基因组编辑制造的免疫效应细胞,例如t细胞受体α(tcrα)基因或t细胞受体β(tcrβ)基因。在特定实施例中考虑的制造的免疫效应细胞组合物可用于治疗或预防多种病症,包含但不限于癌症、感染性疾病、自身免疫疾病、炎性疾病和免疫缺陷。与现有的基于细胞的免疫疗法相比,基因组编辑的免疫效应细胞提供了许多优点,包含但不限于由于降低不良自身免疫反应风险而提高的安全性,具有更可预测的治疗基因表达的精确靶向治疗,增加的在肿瘤微环境中的耐久性和增加的疗效。在特定实施例中考虑的基因组编辑方法部分地通过修饰t细胞受体α(tcrα)基因的一个或多个等位基因来实现。在特定实施例中,一个或多个tcrα等位基因的修饰清除了或基本上清除了tcrα等位基因的表达,降低了tcrα等位基因的表达,和/或损害了、基本上损害了或清除了tcrα等位基因的一个或多个功能或使tcrα等位基因无功能。在特定实施例中,tcrα功能包含但不限于将cd3募集至细胞表面、抗原的mhc依赖性识别和结合、tcrαβ信号转导的活化。在各个实施例中考虑的基因组编辑方法包括工程化核酸酶,其设计用于结合和切割t细胞受体α(tcrα)基因中的靶dna序列。在特定实施例中考虑的工程化核酸酶可以用于在靶多核苷酸序列中引入双链断裂,其可在不存在多核苷酸模板(例如,供体修复模板)的情况下通过非同源末端连接(nhej)修复,或在存在供体修复模板的情况下通过同源定向修复(hdr)(即,同源重组)修复。在某些实施例中考虑的工程化核酸酶也可以被改造为切口酶,这生成单链dna断裂,其可以使用细胞的碱基切除修复(ber)机制或在存在供体修复模板的情况下的同源重组来修复。nhej是一个容易出错的过程,经常形成小的插入和缺失,这会破坏基因功能。同源重组需要同源dna作为修复的模板,并且可以利用同源重组产生无限多个修饰,这些修饰通过将在靶位点含有所需序列的供体dna导入以靶位点为侧翼的区域来指定,所述靶位点位于具有同源性的序列的任一侧的侧翼。在一个优选的实施例中,本文考虑的基因组编辑方法部分地通过工程化核酸内切酶和末端加工酶实现。在各个实施例中,其中在细胞的tcrα基因中生成dna断裂,切割的基因组序列末端的nhej可能产生具有正常tcr表达、功能丧失或功能获得tcr的表达的细胞,或优选地产生缺少功能性tcr表达(例如,缺少将cd3募集到细胞表面、活化tcrαβ信号转导,识别和结合mhc-抗原复合物的能力)的细胞。在各个其它实施例中,其中提供了一种用于修复切割的tcrα基因组序列的供体模板,通过dna断裂位点的同源重组,用模板的序列修复tcrα等位基因。在优选的实施例中,修复模板包括不同于靶向基因组序列的多核苷酸序列。在更优选的实施例中,供体修复模板包括一种或多种编码免疫效力增强子、免疫抑制信号减弱子或工程化抗原受体的多核苷酸。在各个实施例中,考虑了基因组编辑的细胞,例如免疫效应细胞。基因组编辑的细胞包括在一个或两个tcrα等位基因中生成的dna断裂处的一种或多种编码免疫效力增强子、免疫抑制信号减弱子或工程化受体的多核苷酸的减少的内源性tcr表达和/或信号转导、插入或整合,并且任选地表达通过逆转录病毒转导导入细胞的另一个免疫效力增强子或工程化抗原受体。因此,与现有的过继性细胞疗法相比,本文考虑的方法和组合物代表了量子改善。除非特别相反地指出,否则特定实施例的实践将采用本领域技术范围内的化学、生物化学、有机化学、分子生物学、微生物学、重组dna技术、遗传学、免疫学和细胞生物学的常规方法。为了说明的目的,下面描述了这些常规方法中的许多常规方法。这些技术在文献中有充分说明。参见例如sambrook等人,《分子克隆:实验手册(molecularcloning:alaboratorymanual)》(第3版,2001年);sambrook等人,《分子克隆:实验手册(molecularcloning:alaboratorymanual)》(第2版,1989年);maniatis等人,《分子克隆:实验手册(molecularcloning:alaboratorymanual)》(1982年);ausubel等人,《现代分子生物学实验指南(currentprotocolsinmolecularbiology)》(johnwileyandsons,2008年7月更新);《精编分子生物学实验指南:现代分子生物学实验指南的方法纲要(shortprotocolsinmolecularbiology:acompendiumofmethodsfromcurrentprotocolsinmolecularbiology)》,greenepub.associatesandwiley-interscience;glover,《dna克隆:实用方法(dnacloning:apracticalapproach)》,第i卷和第ii卷(irl出版社,牛津,1985年);anand,《复杂基因组分析技术(techniquesfortheanalysisofcomplexgenomes)》(学术出版社,纽约,1992年);《转录和翻译(transcriptionandtranslation)》(b.hames和s.higgins编辑,1984年);perbal,《分子克隆实用指南(apracticalguidetomolecularcloning)》(1984年);harlow和lane,《抗体(antibodies)》,(冷泉港实验室出版社,冷泉港,纽约,1998年),《现代免疫学实验指南(currentprotocolsinimmunology)》,q.e.coligan,a.m.kruisbeek,d.h.margulies,e.m.shevach和w.strober编辑,1991年);《免疫学年鉴(annualreviewofimmunology)》;以及《免疫学进展(advancesinimmunology)》等期刊上的专著。b.定义除非另外定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。尽管与本文描述的那些类似或等同的任何方法和材料可用于特定实施例的实践或测试,但本文描述了组合物、方法和材料的优选实施例。出于本公开的目的,以下术语定义如下。冠词“一个(a/an)”和“所述(the)”在本文中用于指代冠词的一个或多于一个(即,至少一个,或一个或多个)语法对象。举例来说,“一个元件”表示一个元件或一个或多个元件。选择连词(例如,“或”)的使用应理解为表示选择对象中的一者、两者或其任何组合。术语“和/或”应理解为表示选择对象中的一者或两者。如本文使用,术语“约”或“大约”是指相对于参考数量、水平、值、数目、频率、百分比、尺寸、大小、量、重量或长度变化了多达15%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%的数量、水平、值、数目、频率、百分比、尺寸、大小、量、重量或长度。在一个实施例中,术语“约”或“大约”是指参考数量、水平、值、数目、频率、百分比、尺寸、大小、量、重量或长度±15%、±10%、±9%、±8%、±7%、±6%、±5%、±4%、±3%、±2%或±1%的数量、水平、值、数目、频率、百分比、尺寸、大小、量、重量或长度的范围。在一个实施例中,范围,例如1至5、约1至5或约1至约5,是指该范围所涵盖的每个数值。例如,在一个非限制性且仅仅是说明性的实施例中,范围“1至5”等同于表达1、2、3、4、5;或1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5或5.0;或1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9或5.0。如本文使用,术语“基本上”是指为参考数量、水平、值、数目、频率、百分比、尺寸、大小、量、重量或长度的80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高的数量、水平、值、数目、频率、百分比、尺寸、大小、量、重量或长度。在一个实施例中,“基本上相同”是指产生与参考数量、水平、值、数目、频率、百分比、尺寸、大小、量、重量或长度大致相同的效应(例如,生理效应)的数量、水平、值、数目、频率、百分比、尺寸、大小、量、重量或长度。在整个本说明书中,除非上下文另有要求,否则词语“包括(comprise/comprises/comprising)”将被理解为暗示包含所述一个步骤或元件或一组步骤或元件但不排除任何其它步骤或元件或任何其它一组步骤或元件。“由......组成”表示包含并限于短语“由......组成”之后的任何内容。因此,短语“由......组成”表示所列出的元件是必需的或强制性的,并且不存在其它元件。“基本上由......组成”表示包含在该短语之后列出的任何元件,并且限于不干扰或有助于本公开中针对所列元件指定的活性或作用的其它元件。因此,短语“基本上由......组成”表示所列元件是必需的或强制性的,但不存在实质上影响所列元件的活性或作用的其它元件。在整个本说明书中对“一个实施例(oneembodiment)”、“一个实施例(anembodiment)”、“一个特定实施例”、“一个相关实施例”、“某个实施例”,“一个额外的实施例”或“一个另外的实施例”或其组合的引用表示结合该实施例描述的特定特征、结构或特性包含在至少一个实施例中。因此,在整个本说明书中各处出现的前述短语不一定都指同一实施例。此外,特定特征、结构或特性可以在一个或多个实施例中以任何合适的方式组合。还应理解,在一个实施例中对特征的肯定叙述用作在一个特定实施例中排除该特征的基础。“免疫效应细胞”是免疫系统的任何细胞,其具有一个或多个效应子功能(例如,细胞毒性细胞杀伤活性、细胞因子的分泌、adcc和/或cdc的诱导)。在特定实施例中考虑的说明性免疫效应细胞是t淋巴细胞,特别是细胞毒性t细胞(ctl;cd8+t细胞)、til和辅助t细胞(htl;cd4+t细胞)。在一个实施例中,免疫效应细胞包含天然杀伤(nk)细胞。在一个实施例中,免疫效应细胞包含天然杀伤t(nkt)细胞。术语“t细胞”或“t淋巴细胞”是本领域公认的并且旨在包含胸腺细胞、幼稚t淋巴细胞、未成熟t淋巴细胞、成熟t淋巴细胞、静息t淋巴细胞或活化t淋巴细胞。t细胞可以是t辅助(th)细胞,例如t辅助1(th1)或t辅助2(th2)细胞。t细胞可以是辅助t细胞(htl;cd4+t细胞)cd4+t细胞、细胞毒性t细胞(ctl;cd8+t细胞)、肿瘤浸润细胞毒性t细胞(til;cd8+t细胞)、cd4+cd8+t细胞、cd4-cd8-t细胞或任何其它t细胞亚群。在一个实施例中,t细胞是nkt细胞。适用于特定实施例的其它说明性t细胞群包含幼稚t细胞和记忆t细胞。“有效t细胞”和“幼小t细胞”在特定实施例中可互换使用,并且是指t细胞表型,其中t细胞能够增殖并伴随分化减少。在特定实施例中,幼小t细胞具有“幼稚t细胞”的表型。在特定实施例中,幼小t细胞包括以下生物学标志物中的一种或多种或全部:cd62l、ccr7、cd28、cd27、cd122、cd127、cd197和cd38。在一个实施例中,幼小t细胞包括以下生物学标志物中的一种或多种或全部:cd62l、cd127、cd197和cd38。在一个实施例中,幼小t细胞缺少cd57、cd244、cd160、pd-1、ctla4、tim3和lag3的表达。如本文使用,术语“增殖”是指细胞分裂的增加,或是细胞的对称分裂,或是细胞的不对称分裂。在特定实施例中,“增殖”是指t细胞的对称或不对称分裂。当与未治疗的样品中的细胞相比,治疗的样品中的细胞数量增加时,发生“增殖增加”。如本文使用,术语“分化”是指降低细胞的效力或增殖或将细胞移动到更具发育限制状态的方法。在特定实施例中,分化的t细胞获得免疫效应细胞功能。如本文使用,术语“t细胞制造”或“制造t细胞的方法”或类似术语是指生产t细胞治疗组合物的过程,该制造方法可以包括以下步骤中的一个或多个或全部:收获、刺激、活化、基因组编辑和扩增。术语“离体”通常是指在生物体外发生的活动,例如在生物体外的人工环境中在活组织中或活体组织上进行的实验或测量,优选具有最小的自然条件改变。在特定实施例中,“离体”程序涉及活细胞或活体组织,其取自生物体并在实验室设备中培养或调节,通常在无菌条件下,通常持续数小时或多至约24小时,但包含多至48小时或72小时,视情况而定。在某些实施例中,可以收集并冷冻这些组织或细胞,然后解冻用于离体治疗。使用活细胞或活体组织持续长于几天的组织培养实验或程序通常被认为是“体外”,但在某些实施例中,该术语可与离体互换使用。术语“体内”通常是指在生物体内发生的活动,例如细胞自我更新和细胞增殖或扩增。在一个实施例中,术语“体内扩增”是指细胞群体内数量增加的能力。在一个实施例中,在体内改造或修饰细胞。术语“刺激”是指通过刺激分子(例如,tcr/cd3复合物)与其同源配体结合,从而介导信号转导事件(包含但不限于通过tcr/cd3复合物的信号转导)而诱导的主要反应。“刺激分子”是指t细胞上与同源刺激配体特异性结合的分子。如本文使用,“刺激配体”表示当存在于抗原呈递细胞(例如,aapc、树突细胞、b细胞等)上时可以与t细胞上的同源结合配偶体(在本文中称为“刺激分子”)特异性结合,从而介导t细胞的主要反应(包含但不限于活化、免疫反应的起始、增殖等)的配体。刺激配体包含但不限于cd3配体,例如抗cd3抗体和cd2配体,例如抗cd2抗体,和肽,例如cmv、hpv、ebv肽。术语“活化”是指已被充分刺激以诱导可检测的细胞增殖的t细胞的状态。在特定实施例中,活化还可以与诱导的细胞因子产生和可检测的效应子功能相关。术语“活化的t细胞”尤其是指增殖的t细胞。仅通过tcr生成的信号不足以完全活化t细胞,并且还需要一种或多种辅助信号或共刺激信号。因此,t细胞活化包括通过tcr/cd3复合物的主要刺激信号和一种或多种辅助共刺激信号。共刺激可以通过已经接收到主要活化信号的t细胞的增殖和/或细胞因子产生来证明,例如通过cd3/tcr复合物或通过cd2的刺激。“共刺激信号”是指一种信号,其与主要信号(例如,tcr/cd3连接)组合导致t细胞增殖、细胞因子产生和/或特定分子(例如,cd28)的上调或下调。“共刺激配体”是指结合共刺激分子的分子。共刺激配体可以是可溶的或提供在表面上。“共刺激分子”是指t细胞上的同源结合配偶体,其与共刺激配体(例如,抗cd28抗体)特异性结合。如本文使用,“自体的”是指供体和受体是相同受试者的细胞。如本文使用,“同种异体的”是指其中供体和受体物种相同但细胞在遗传学上不同的细胞。如本文使用,“同源的”是指其中供体和受体物种相同,供体和受体是不同个体,并且供体细胞和受体细胞在遗传学上相同的细胞。如本文使用,“异种的”是指其中供体和受体物种不同的细胞。如本文使用,术语“个体”和“受试者”通常可互换使用,并且是指表现出可以用本文其它地方考虑的基因治疗载体、基于细胞的治疗剂和方法治疗的癌症或其它免疫病症的症状的任何动物。合适的受试者(例如,患者)包含实验动物(例如,小鼠、大鼠、兔或豚鼠)、农场动物和家养动物或宠物(例如,猫或狗)。包含非人灵长类动物,优选人类患者。典型的受试者包含患有、已经被诊断患有或有风险患有癌症或其它免疫病症的人类患者。如本文使用,术语“患者”是指已经被诊断患有癌症或其它免疫病症的受试者,所述免疫病症可以用本文其它地方公开的基因治疗载体、基于细胞的治疗剂和方法治疗。如本文使用,“治疗(treatment/treating)”包含对疾病或病理病状的症状或病理学的任何有益或期望的作用,并且可以包含所治疗的疾病或病状的一种或多种可测量标志物的甚至最小量的减少,所治疗的疾病或病状例如癌症、自身免疫疾病、免疫病症等。治疗可以任选地涉及延迟疾病或病状的进展。“治疗”不一定表示完全根除或治愈疾病或病状或其相关症状。如本文使用,“预防(prevent)”和相似词语(例如,prevention/prevented/preventing等)表示预防、抑制或降低疾病或病状发生或复发的可能性的方法,所述疾病或病状例如癌症、自身免疫疾病、免疫病症等。它还指延迟疾病或病状的发作或复发或延迟疾病或病状的症状的发生或复发。如本文使用,“预防”和相似词语还包含在疾病或病状发作或复发之前降低疾病或病状的强度、作用、症状和/或负荷。如本文使用,短语“改善至少一种症状”是指降低受试者所治疗的疾病或病状的一种或多种症状,例如癌症、传染病、自身免疫疾病、炎性疾病和免疫缺陷。在特定实施例中,所治疗的疾病或病状是癌症,其中改善的一种或多种症状包含但不限于虚弱、疲劳、呼吸短促、易瘀伤和出血、频繁感染、淋巴结肿大、腹部膨胀或疼痛(由于腹部器官肿大)、骨骼或关节疼痛、骨折、意外体重减轻、食欲不振、盗汗、持续性轻度发烧和排尿减少(由于肾功能受损)。如本文使用,术语“量”是指基因组编辑的免疫效应细胞(例如,t细胞)实现有益或所需的预防或治疗结果(包含临床结果)的“有效量(anamounteffective/aneffectiveamount)”。“预防有效量”是指有效实现所需预防结果的遗传修饰治疗细胞的量。通常但非必要地,由于预防剂量是在疾病之前或疾病的早期阶段在受试者中使用,所以预防有效量小于治疗有效量。遗传修饰的治疗细胞的“治疗有效量”可以根据诸如个体的疾病状态、年龄、性别和体重以及基因组编辑的免疫效应细胞在引发个体中的期望反应中的能力等因素而不同。治疗有效量还是其中治疗有益效果超过病毒或转导的治疗细胞的任何毒性或有害作用的量。术语“治疗有效量”包含有效“治疗”受试者(例如,患者)的量。当指示治疗量时,医生可以根据说明书并考虑年龄、体重、肿瘤大小、感染或转移程度以及患者(受试者)病状的个体差异来确定待给予的在特定实施例中考虑的组合物的精确量。“免疫病症”是指引起免疫系统反应的疾病。在特定实施例中,术语“免疫病症”是指癌症、自身免疫疾病或免疫缺陷。在一个实施例中,免疫病症包括传染病。如本文使用,术语“癌症”通常涉及一类疾病或病状,其中异常细胞无控制地分裂并且可以侵入附近的组织。如本文使用,术语“恶性的”是指其中一组肿瘤细胞表现出以下中一者或多者的癌症:不受控制的生长(即,超出正常限度的分裂)、侵入(即,侵入和破坏相邻组织)和转移(即,通过淋巴或血液扩散到体内的其它部位)。如本文使用,术语“转移”是指癌症从身体的一部分扩散到另一部分。由已经扩散的细胞形成的肿瘤称为“转移性肿瘤”或“转移”。转移性肿瘤含有与原始(原发性)肿瘤中的细胞相似的细胞。如本文使用,术语“良性的”或“非恶性的”是指可以变大但不扩散到身体其它部位的肿瘤。良性肿瘤是自限性的,通常不会侵入或转移。“癌细胞”或“肿瘤细胞”是指癌性生长或组织的单个细胞。肿瘤通常是指由细胞异常生长形成的肿胀或病变,其可以是良性的、癌变前的或恶性的。大多数癌症形成肿瘤,但一些癌症(例如,白血病)不一定形成肿瘤。对于那些形成肿瘤的癌症,术语癌症(细胞)和肿瘤(细胞)可互换使用。个体中肿瘤的量是“肿瘤负荷”,其可以作为肿瘤的数目、体积或重量来测量。“自身免疫疾病”是指身体对其自身组织的某些成分产生免疫原性(即,免疫系统)反应的疾病。换句话说,免疫系统失去了将身体内的某些组织或系统识别为“自身”的能力,并将其作为目标并攻击它,就好像它是外来的一样。自身免疫疾病可分为其中主要影响一个器官的自身免疫疾病(例如,溶血性贫血和抗免疫性甲状腺炎),以及其中自身免疫疾病过程通过许多组织(例如,系统性红斑狼疮)扩散的自身免疫疾病。例如,多发性硬化被认为是由t细胞攻击围绕脑和脊髓神经纤维的鞘引起的。这导致失调、虚弱和视力模糊。自身免疫疾病是本领域已知的,包含例如桥本氏甲状腺炎、格雷夫斯病、狼疮、多发性硬化、风湿性关节炎、溶血性贫血、抗免疫性甲状腺炎、系统性红斑狼疮、乳糜泻、克罗恩病、结肠炎、糖尿病、硬皮病、牛皮癣等。“免疫缺陷”表示免疫系统已受到疾病或化学品给药的危害的患者的状态。这种病状使得该系统缺乏防御外来物质所需的血细胞的数量和类型。免疫缺陷病状或疾病是本领域已知的,包含例如aids(获得性免疫缺陷综合征)、scid(严重联合免疫缺陷病)、选择性iga缺乏症、常见变异型免疫缺陷、x-连锁无丙种球蛋白血症、慢性肉芽肿病、高igm综合症和糖尿病。“传染病”是指可以在人之间或生物体之间传播的疾病,并且由微生物或病毒剂(例如,普通感冒)引起。传染病是本领域已知的,包含例如肝炎、性传播疾病(例如,衣原体、淋病)、结核病、hiv/aids、白喉、乙型肝炎、丙型肝炎、霍乱和流感。“增强”或“促进”或“增加”或“扩增”或“增效”通常是指本文考虑的组合物产生、引发或引起相较于由载剂或对照分子/组合物引起的反应更大的反应(即,生理反应)的能力。可测量的反应可以包含工程化tcr或car表达的增加,hr或hdr效率的增加,免疫效应细胞扩增、活化、持久性的增加和/或癌细胞死亡杀伤能力的增加等,尤其是根据本领域的认识和本文的描述所显而易见的。“增加的”或“增强的”量通常是“统计上显著的”量,并且可以包含由载剂或对照组合物产生的反应的1.1倍、1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍或更多倍(例如,500倍、1000倍)(包含其间的大于1的所有整数和小数点,例如1.5倍、1.6倍、1.7倍、1.8倍等)的增加。“降低”或“削减”或“减小”或“减少”或“减轻”或“消除”或“抑制”或“减弱”通常是指本文考虑的组合物产生、引发或引起相较于由媒剂或对照分子/组合物引起的反应更小的反应(即,生理反应)的能力。可测量的反应可以包括内源性tcr表达或功能的降低,与免疫效应细胞耗竭相关的生物标志物的表达降低等。“降低”或“减少的”量通常是“统计上显著的”量,并且可以包含由载剂、对照组合物产生的反应(参考反应)或特定细胞谱系中的反应的1.1倍、1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍或更多倍(例如,500倍、1000倍)(包含其间的大于1的所有整数和小数点,例如1.5倍、1.6倍、1.7倍、1.8倍等)的降低。“维持(maintain/maintenance)”或“保留”或“没有改变”或“没有实质性改变”或“没有实质性降低”通常是指本文考虑的组合物在细胞中产生、引发或引起相较于由载剂、对照分子/组合物引起的反应或特定细胞谱系中的反应基本上相似或相当的生理反应(即,下游效应)的能力。相当的反应是与参考反应没有显著差异或可测量的反应。本文使用的术语“特异性结合亲和力”或“特异性结合(specificallybinds/specificallybound/specificbinding)”或“特异性靶向”描述了一种分子与另一种分子以比本底结合更高的结合亲和力结合。如果结合结构域以某一亲和力或ka(即,特定结合相互作用的平衡缔合常数,以1/m为单位)(例如,所述亲和力或ka大于或等于约105m-1)结合至靶分子或与靶分子缔合,则该结合结构域“特异性结合”至该靶分子。在某些实施例中,结合结构域以大于或等于约106m-1、107m-1、108m-1、109m-1、1010m-1、1011m-1、1012m-1或1013m-1的ka结合至靶标。“高亲和力”结合结构域是指具有至少107m-1、至少108m-1、至少109m-1、至少1010m-1、至少1011m-1、至少1012m-1、至少1013m-1或更高的ka的结合结构域。可替代地,亲和力可以定义为以m为单位的特定结合相互作用的平衡解离常数(kd)(例如,10-5m至10-13m,或更低)。在特定实施例中考虑的结合结构域多肽的亲和力可以使用常规技术容易地确定,例如通过竞争性elisa(酶联免疫吸附测定),或通过结合关联,或使用标记配体的置换测定,或使用表面-等离子体共振装置,例如,biacoret100,可购自biacore,inc.,皮斯卡塔韦,新泽西,或光学生物传感器技术,例如epic系统或enspire,分别可购自corning和perkinelmer(参见例如scatchard等人(1949年)《纽约科学院年鉴(ann.n.y.acad.sci.)》,第51期:第660页;和美国专利第5,283,173号;第5,468,614号,或等同内容)。在一个实施例中,特异性结合的亲和力比本底结合大约2倍,比本底结合大约5倍,比本底结合大约10倍,比本底结合大约20倍,比本底结合大约50倍,比本底结合大约100倍,或比本底结合大约1000倍或更多。“抗原(ag)”是指可以刺激动物中抗体的产生或t细胞反应的化合物、组合物或物质,例如脂质、碳水化合物、多糖、糖蛋白,肽或核酸,包含注射或吸收到动物体内的组合物(例如,包含肿瘤特异性蛋白的组合物)。抗原与特异性体液或细胞免疫的产物反应,包含由异源抗原诱导的那些,例如公开的抗原。“靶抗原”或“目标靶抗原”是本文考虑的工程化抗原受体的结合结构域设计用于结合的抗原。在一个实施例中,抗原是mhc-肽复合物,例如i类mhc-肽复合物或ii类mhc-肽复合物。“表位”或“抗原决定簇”是指结合剂结合至的抗原的区域。如本文使用,“分离的多核苷酸”是指从天然存在状态侧翼的序列中纯化的多核苷酸,例如已从通常与片段相邻的序列中移除的dna片段。“分离的多核苷酸”还指互补dna(cdna)、重组dna或天然不存在并且由人工制造的其它多核苷酸。如本文使用,“分离的蛋白质”、“分离的肽”或“分离的多肽”等是指来自细胞环境以及来自与细胞的其它组分的缔合的肽或多肽分子的体外合成、分离和/或纯化,即其与体内物质没有显著关联。“分离的细胞”是指非天然存在的细胞,例如自然界中不存在的细胞、经修饰的细胞、工程化细胞等,其已经从体内组织或器官获得并且基本上不含细胞外基质。“重组”是指在两个多核苷酸之间交换遗传信息的过程,包含但不限于通过非同源末端连接(nhej)和同源重组的供体捕获。出于本公开的目的,“同源重组(hr)”是指这种交换的专化形式,这种交换例如发生在通过同源定向修复(hdr)机制修复细胞中的双链断裂期间。该过程需要核苷酸序列同源性,使用“供体”分子作为模板来修复“靶”分子(即,经历双链断裂的分子),并且被不同地称为“非交换基因转换”或“短序列(tract)基因转换”,因为它导致遗传信息从供体转移到靶标。不希望受任何特定理论的束缚,这种转移可能涉及在断裂的靶标和供体之间形成的异源双链dna的错配校正和/或“合成依赖性链退火”,其中供体用于重新合成遗传信息,这将成为靶标和/或相关过程的一部分。这种专化hr通常导致靶分子序列的改变,使得供体多核苷酸序列的部分或全部掺入靶多核苷酸中。“切割”是指dna分子的共价骨架的断裂。切割可以通过多种方法引发,包含但不限于磷酸二酯键的酶促或化学水解。单链切割和双链切割都是可能的。由于两个不同的单链切割事件,可能发生双链切割。dna切割可导致平末端或交错末端的产生。在某些实施例中,本文考虑的多肽用于靶向双链dna切割。“靶位点”或“靶序列”是染色体或染色体外核酸序列,如果存在足够的结合和/或切割条件,其定义了结合分子将结合和/或切割至的核酸的一部分。“外源”分子是通常不存在于细胞中但通过一种或多种遗传、生物化学或其它方法导入细胞的分子。示例性外源分子包含但不限于小有机分子、蛋白质、核酸、碳水化合物、脂质、糖蛋白、脂蛋白、多糖、上述分子的任何修饰衍生物、或包括上述分子中一种或多种的任何复合物。将外源分子导入细胞的方法是本领域技术人员已知的,包含但不限于脂质介导的转移(即,脂质体,包含中性和阳离子脂质)、电穿孔、直接注射、细胞融合、粒子轰击、生物聚合物纳米粒子、磷酸钙共沉淀、deae-葡聚糖介导的转移和病毒载体介导的转移。“内源”分子是在特定环境条件下在特定发育阶段通常存在于特定细胞中的分子。例如,内源核酸可以包括染色体、线粒体的基因组或其它细胞器,或天然存在的附加型核酸。额外的内源分子可以包含蛋白质,例如内源性tcr。“基因”是指编码基因产物的dna区,以及调节基因产物产生的所有dna区,无论这些调节序列是否与编码和/或转录序列相邻。基因包含但不限于启动子序列、终止子、翻译调节序列(例如,核糖体结合位点和内部核糖体进入位点)、增强子、沉默子、绝缘子、边界元件、复制起点、基质附着位点和基因座控制区。“基因表达”是指基因中还有的信息转化为基因产物。基因产物可以是基因的直接转录产物(例如,mrna、trna、rrna、反义rna、核酶、结构rna或任何其它类型的rna)或通过mrna翻译产生的蛋白质。基因产物还包含通过过程(例如,加帽、聚腺苷酸化、甲基化和编辑)修饰的rna,以及通过例如甲基化、乙酰化、磷酸化、泛素化、adp-核糖基化、十四酰化和糖基化经修饰的蛋白质。如本文使用,术语“基因组编辑”是指遗传物质在细胞基因组中的靶位点的取代、缺失和/或导入,其恢复、校正和/或修饰基因的表达,和/或以用于表达一个或多个免疫效力增强子、免疫抑制信号减弱子和工程化抗原受体。在特定实施例中考虑的基因组编辑包括将一种或多种工程化核酸酶导入细胞中以在细胞基因组中的靶位点生成dna损伤,任选地在存在供体修复模板的情况下。如本文使用,术语“遗传改造的”或“遗传修饰的”是指额外的遗传物质以dna或rna的形式染色体或染色体外添加至细胞中的总遗传物质。遗传修饰可以靶向或非靶向细胞基因组中的特定位点。在一个实施例中,遗传修饰是位点特异性的。在一个实施例中,遗传修饰不是位点特异性的。c.核酸酶在特定实施例中考虑的免疫效应细胞组合物通过基因组编辑生成,所述基因组编辑用靶向一个或多个有助于t细胞受体(tcr)信号转导的基因座(包含但不限于tcrα(tcrα)基因座和tcrβ(tcrβ)基因座)的工程化核酸酶完成。不希望受任何特定理论的束缚,预期工程化核酸酶被设计为通过基因组编辑精确地破坏tcr信号转导组分,并且一旦核酸酶活性和特异性得到验证,就导致可预测的tcr表达和/或功能的破坏,从而提供更安全且更有效的治疗性免疫效应细胞组合物。在特定实施例中考虑的工程化核酸酶在靶序列中生成单链dna切口或双链dna断裂(dsb)。此外,可以通过使用两个生成单链切口的核酸酶(切口酶)在靶dna中实现dsb。每个切口酶切割dna的一条链,并且使用两个或更多个切口酶可以在靶dna序列中产生双链断裂(例如,交错的双链断裂)。在优选的实施例中,核酸酶与供体修复模板组合使用,其在dsb通过同源重组导入dna断裂位点处的靶序列中。在本文特定实施例中考虑的适用于基因组编辑的工程化核酸酶包括一个或多个dna结合结构域和一个或多个dna切割结构域(例如,一个或多个核酸内切酶和/或核酸外切酶结构域),以及任选的本文考虑的一个或多个连接子。“工程化核酸酶”是指包括一个或多个dna结合结构域和一个或多个dna切割结构域的核酸酶,其中核酸酶已被设计和/或修饰以结合与dna切割靶序列相邻的dna结合靶序列。可以从天然存在的核酸酶或从先前改造的核酸酶设计和/或修饰工程化核酸酶。在特定实施例中考虑的工程化核酸酶可以进一步包括一个或多个额外的功能结构域,例如,显示5-3′核酸外切酶、5-3′碱性核酸外切酶、3-5′核酸外切酶(例如,trex2)、5′瓣状核酸内切酶、解旋酶或模板非依赖性dna聚合酶活性的末端加工酶的末端加工酶结构域。可以被改造以结合和切割靶序列的核酸酶的说明性实例包含但不限于归巢核酸内切酶(大范围核酸酶)、megatal、类转录活化因子效应子核酸酶(talen)、锌指核酸酶(zfn)和成簇规律间隔短回文重复(crispr)/cas核酸酶系统。在特定实施例中,本文考虑的核酸酶包括一个或多个异源dna结合和切割结构域(例如,zfn、talen、megatal),(boissel等人,2014年;christian等人,2010年)。在其它实施例中,可以改变天然存在的核酸酶的dna结合结构域以结合选定的靶位点(例如,已被改造以结合不同于同源结合位点的位点的大范围核酸酶)。例如,已设计大范围核酸酶以结合不同于其同源结合位点的靶位点(boissel等人,2014年)。在特定实施例中,核酸酶需要核酸序列以将核酸酶靶向靶位点(例如,crispr/cas)。1.归巢核酸内切酶/大范围核酸酶在各个实施例中,归巢核酸内切酶或大范围核酸酶被改造以结合至一个或多个基因座并将单链切口或双链断裂(dsb)导入其中,所述一个或多个基因座有助于t细胞受体(tcr)信号转导,包含但不限于tcrα(tcrα)和tcrβ(tcrβ)基因座。“归巢核酸内切酶”和“大范围核酸酶”可互换使用,指天然存在的核酸酶或工程化大范围核酸酶,其识别12至45个碱基对切割位点,并且通常基于序列和结构基序分为五个家族:laglidadg、giy-yig、hnh、his-cys盒和pd-(d/e)xk。工程化he在自然界中不存在,并且可以通过重组dna技术或通过随机诱变获得。工程化he可以通过在天然存在的he或先前改造的he中进行一个或多个氨基酸改变,例如突变、取代、添加或缺失一个或多个氨基酸来获得。在特定实施例中,工程化he包括dna识别界面的一个或多个氨基酸改变。在特定实施例中考虑的工程化he可以进一步包括一个或多个连接子和/或额外的功能结构域,例如,显示5-3′核酸外切酶、5-3′碱性核酸外切酶、3-5′核酸外切酶(例如,trex2)、5′瓣状核酸内切酶、解旋酶或模板非依赖性dna聚合酶活性的末端加工酶的末端加工酶结构域。在特定实施例中,将工程化he导入具有显示5-3′核酸外切酶、5-3′碱性核酸外切酶、3-5′核酸外切酶(例如,trex2)、5′瓣状核酸内切酶、解旋酶或模板非依赖性dna聚合酶活性的末端加工酶的t细胞中。he和3′加工酶可以分开导入,例如,在不同的载体或分开的mrna中,或者一起导入,例如作为融合蛋白,或在由病毒自裂解肽或ires元件分开的多顺反子构建体中导入。“dna识别界面”是指与核酸靶碱基相互作用的he氨基酸残基以及相邻的那些残基。对于每个he,dna识别界面包括侧链到侧链和侧链到dna接触的广泛网络,其中大多数必须是识别特定核酸靶序列所独有的。因此,对应于特定核酸序列的dna识别界面的氨基酸序列显著不同,并且是任何天然或工程化he的特征。作为非限制性实例,可以通过构建he变体文库来衍生在特定实施例中考虑的工程化he,其中位于天然he(或先前改造的he)的dna识别界面中的一个或多个氨基酸残基是各不相同的。可以使用切割测定针对相对于每个预测的tcrα基因座靶位点的靶切割活性来筛选文库(参见例如jarjour等人,2009年,《核酸研究(nuc.acidsres.)》,第37(20)期:第6871-6880页)。laglidadg归巢核酸内切酶(lhe)是研究最深入的大范围核酸酶家族,主要编码于古细菌和绿藻和真菌中的细胞器dna中,并显示出最高的整体dna识别特异性。lhe包括每个蛋白质链的一个或两个laglidadg催化基序,并分别起同二聚体或单链单体的作用。laglidadg蛋白的结构研究标识了高度保守的核心结构(stoddard2005年),其特征在于αββαββα折叠,其中laglidadg基序属于该折叠的第一螺旋。lhe的高效和特异性切割代表了蛋白质支架,以衍生新的高度特异性的核酸内切酶。然而,改造lhe以结合和切割非天然或非规范靶位点需要在靶位点中多达三分之二的碱基对位置处选择合适的lhe支架,检查靶基因座,选择推定的靶位点,并广泛改变lhe以改变其dna接触点和切割特异性。可以设计工程化lhe的lhe的说明性实例包含但不限于i-aabmi、i-aaemi、i-anii、i-apami、i-capiii、i-capiv、i-ckami、i-cpami、i-cpamii、i-cpamiii、i-cpamiv、i-cpamv、i-cpav、i-crami、i-ejemi、i-gpemi、i-gpii、i-gzemi、i-gzemii、i-gzemiii、i-hjemi、i-ltrii、i-ltri、i-ltrwi、i-mpemi、i-mvemi、i-ncrii、i-ncrl、i-ncrmi、i-ohemi、i-onui、i-osomi、i-osomii、i-osomiii、i-osomiv、i-panmi、i-panmii、i-panmiii、i-pnomi、i-scumi、i-smami、i-sscmi和i-vdi141i。在一个实施例中,工程化lhe选自由以下组成的群组:i-cpami、i-hjemi、i-onui、i-panmi和smami。在一个实施例中,工程化lhe是i-onui。参见例如seqidno:1和2。在一个实施例中,靶向人tcrα基因的工程化i-onuilhe由天然i-onui生成。在一个优选的实施例中,靶向人tcrα基因的工程化i-onuilhe由先前改造的i-onui生成。在一个实施例中,针对seqidno:3中给出的人tcrα基因靶位点生成工程化i-onuilhe。在一个实施例中,针对seqidno:4中给出的人tcrα基因靶位点生成工程化i-onuilhe。在一个特定实施例中,工程化i-onuilhe在dna识别界面中包括一个或多个氨基酸取代。在特定实施例中,i-onuilhe包括与i-onui或如seqidno:5、6或7中给出的i-onui的工程化变体或其另外的工程化变体的dna识别界面至少70%、至少71%、至少72%、至少73%、至少74%、至少75%、至少76%、至少77%、至少78%、至少79%、至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性(taekuchi等人,2011年,《美国国家科学院学报(procnatlacadsciu.s.a.)》,2011年8月9日;第108(32)期:第13077-13082页)。在一个实施例中,i-onuilhe包括与i-onui或如seqidno:5、6或7中给出的i-onui的工程化变体或其另外的工程化变体的dna识别界面至少70%、更优选至少80%、更优选至少85%、更优选至少90%、更优选至少95%、更优选至少97%、更优选至少99%的序列同一性(taekuchi等人,2011年,《美国国家科学院学报(procnatlacadsciu.s.a.)》,2011年8月9日;第108(32)期:第13077-13082页)。在一个特定实施例中,工程化i-onuilhe在dna识别界面中包括一个或多个氨基酸取代或修饰,特别是在位于i-onui(seqidno:2)或如seqidno:5、6或7中给出的i-onui的工程化变体或其另外的工程化变体的24至50、68至82、180至203和223至240位的亚结构域中。在一个实施例中,工程化i-onuilhe在位于整个i-onui序列内任何位置的其它位置包括一个或多个氨基酸取代或修饰。可被取代和/或修饰的残基包含但不限于与核酸靶标接触或与核酸骨架或与核苷酸碱基直接或通过水分子相互作用的氨基酸。在一个非限制性实例中,本文考虑的工程化i-onuilhe在至少一个位置包括一个或多个取代和/或修饰,优选至少5个,优选至少10个,优选至少15个,更优选至少20个,甚至更优选至少25个,所述至少一个位置选自由以下位置组成的位置群组:i-onui(seqidno:2)或如seqidno:5、6或7中给出的i-onui的工程化变体或其另外的工程化变体的19、24、26、28、30、32、34、35、36、37、38、40、42、44、46、48、68、70、72、75、76、77、78、80、82、168、180、182、184、186、188、189、190、191、192、193、195、197、199、201、203、223、225、227、229、231、232、234、236、238、240位。在一个特定实施例中,本文考虑的工程化i-onuilhe包括一个或多个氨基酸取代和/或修饰,其选自由以下组成的群组:l26i、r28d、n32r、k34n、s35e、v37n、g38r、s40r、e42s、g44r、v68k、a70t、n75r、s78m、k80r、l138m、s159p、e178d、c180y、f182g、i186k、s188v、s190g、k191n、l192a、g193k、q195y、q197g、v199r、t203s、k207r、y223s、k225w和d236e。在一个实施例中,i-onuilhe具有如seqidno:5、6或7中给出的氨基酸序列或其另外的工程化变体。2.megatal各个说明性实施例考虑了megatal核酸酶,其结合至并切割有助于t细胞受体(tcr)信号转导的基因座(包含但不限于tcrα(tcrα)和tcrβ(tcrβ)基因座)的靶区。“megatal”是指包括工程化taledna结合结构域和工程化大范围核酸酶的工程化核酸酶,并且任选地包括一个或多个连接子和/或额外的功能结构域,例如,显示5-3′核酸外切酶、5-3′碱性核酸外切酶、3-5′核酸外切酶(例如,trex2)、5′瓣状核酸内切酶、解旋酶或模板非依赖性dna聚合酶活性的末端加工酶的末端加工酶结构域。在特定实施例中,可以将megatal导入具有显示5-3′核酸外切酶、5-3′碱性核酸外切酶、3-5′核酸外切酶(例如,trex2)、5′瓣状核酸内切酶、解旋酶或模板非依赖性dna聚合酶活性的末端加工酶的t细胞中。megatal和3′加工酶可以分开导入,例如,在不同的载体或分开的mrna中,或者一起导入,例如作为融合蛋白,或在由病毒自裂解肽或ires元件分开的多顺反子构建体中导入。“taledna结合结构域”是类转录活化因子效应子(tale或tal效应子)的dna结合部分,其模拟植物转录活化因子以操纵植物转录组(参见例如kay等人,2007年,《科学(science)》,第318期:第648-651页)。在特定实施例中考虑的taledna结合结构域是从头改造的或从天然存在的tale改造的,所述天然存在的tale例如来自野油菜黄单胞菌疮痂致病变种(xanthomonascampestrispv.vesicatoria)、加德纳黄单胞菌(xanthomonasgardneri)、半透明黄单胞菌(xanthomonastranslucens)、地毯草黄单胞菌(xanthomonasaxonopodis)、穿孔黄单胞菌(xanthomonasperforans)、苜蓿黄单胞菌(xanthomonasalfalfa)、柑橘黄单胞菌(xanthomonascitri)、易疮痂黄单胞菌(xanthomonaseuvesicatoria)和水稻黄单胞菌(xanthomonasoryzae)的avrbs3以及来自青枯雷尔氏菌(ralstoniasolanacearum)的brg11和hpx17。用于衍生和设计dna结合结构域的tale蛋白的说明性实例公开在美国专利第9,017,967号和其中引用的参考文献中,所有这些文献都通过引用整体并入本文。在特定实施例中,megatal包括taledna结合结构域,其包括一个或多个重复单元,所述重复单元参与taledna结合结构域与其相应的靶dna序列的结合。单个“重复单元”(也称为“重复”)的长度通常为33至35个氨基酸。每个taledna结合结构域重复单元包含构成重复可变二残基(rvd)的1个或2个dna结合残基,通常在重复的12和/或13位。已经确定了用于这些taledna结合结构域的dna识别的天然(规范)密码,使得12和13位的hd序列会结合至胞嘧啶(c),ng结合至t,ni结合至a,nn结合至g或a,并且ng结合至t。在某些实施例中,考虑非规范(非典型)rvd。适用于在特定实施例中考虑的特定megatal的非规范rvd的说明性实例包含但不限于用于识别鸟嘌呤(g)的hh、kh、nh、nk、nq、rh、rn、ss、nn、sn、kn;用于识别腺嘌呤(a)的ni、ki、ri、hi、si;用于识别胸腺嘧啶(t)的ng、hg、kg、rg;用于识别胞嘧啶(c)的rd、sd、hd、nd、kd、yg;用于识别a或g的nv、hn;以及用于识别a或t或g或c的h*、ha、ka、n*、na、nc、ns、ra、s*,其中(*)表示不存在13位的氨基酸。适用于在特定实施例中考虑的特定megatal的rvd的额外的说明性实例进一步包含美国专利第8,614,092号中公开的那些,其通过引用整体并入本文。在特定实施例中,本文考虑的megatal包括taledna结合结构域,其包括3至30个重复单元。在某些实施例中,megatal包括3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个或30个taledna结合结构域重复单元。在一个优选的实施例中,本文考虑的megatal包括taledna结合结构域,其包括5至13个重复单元,更优选7至12个重复单元,更优选9至11个重复单元,更优选9个、10个或11个重复单元。在特定实施例中,本文考虑的megatal包括taledna结合结构域和额外的单截短tale重复单元,所述taledna结合结构域包括3至30个重复单元,所述额外的单截短tale重复单元包括位于一组tale重复单元的c-末端的20个氨基酸,即其为额外的c-末端半taledna结合结构域重复单元(本文其它地方公开的c-帽的氨基酸-20至-1,见下文)。因此,在特定实施例中,本文考虑的megatal包括taledna结合结构域,其包括3.5至30.5个重复单元。在某些实施例中,megatal包括3.5个、4.5个、5.5个、6.5个、7.5个、8.5个、9.5个、10.5个、11.5个、12.5个、13.5个、14.5个、15.5个、16.5个、17.5个、18.5个、19.5个、20.5个、21.5个、22.5个、23.5个、24.5个、25.5个、26.5个、27.5个、28.5个、29.5个或30.5个taledna结合结构域重复单元。在一个优选的实施例中,本文考虑的megatal包括taledna结合结构域,其包括5.5至13.5个重复单元,更优选7.5至12.5个重复单元,更优选9.5至11.5个重复单元,更优选9.5个、10.5个或11.5个重复单元。在特定实施例中,megatal包括“n-末端结构域(ntd)”多肽、一个或多个tale重复结构域/单元、“c-末端结构域(ctd)”多肽和工程化大范围核酸酶。如本文使用,术语“n-末端结构域(ntd)”多肽是指天然存在的taledna结合结构域的n-末端部分或片段侧翼的序列。如果存在,ntd序列可以是任何长度,只要taledna结合结构域重复单元保留结合dna的能力即可。在特定实施例中,ntd多肽包括在taledna结合结构域的n-末端的至少120个至至少140个或更多个氨基酸(0是最n-末端重复单元的氨基酸1)。在特定实施例中,ntd多肽包括在taledna结合结构域的n-末端的至少约120个、121个、122个、123个、124个、125个、126个、127个、128个、129个、130个、131个、132个、133个、134个、135个、136个、137个、138个、139个或至少140个氨基酸。在一个实施例中,本文考虑的megatal包括ntd多肽,其为黄单胞菌tale蛋白的至少约氨基酸+1至+122至至少约+1至+137(0是最n-末端重复单元的氨基酸1)。在特定实施例中,ntd多肽包括在黄单胞菌tale蛋白的taledna结合结构域的n-末端的至少约122个、123个、124个、125个、126个、127个、128个、129个、130个、131个、132个、133个、134个、135个、136个或137个氨基酸。在一个实施例中,本文考虑的megatal包括ntd多肽,其为雷尔氏菌tale蛋白的至少氨基酸+1至+121(0是最n-末端重复单元的氨基酸1)。在特定实施例中,ntd多肽包括在雷尔氏菌tale蛋白的taledna结合结构域的n-末端的至少约121个、122个、123个、124个、125个、126个、127个、128个、129个、130个、131个、132个、133个、134个、135个、136个或137个氨基酸。如本文使用,术语“c-末端结构域(ctd)”多肽是指天然存在的taledna结合结构域的c-末端部分或片段侧翼的序列。如果存在,ctd序列可以是任何长度,只要taledna结合结构域重复单元保留结合dna的能力即可。在特定实施例中,ctd多肽包括在taledna结合结构域的最后一个完整重复的c-末端的至少20个至至少85个或更多个氨基酸(前20个氨基酸是在最后一个c-末端完整重复单元的c-末端的半重复单元)。在特定实施例中,ctd多肽包括在taledna结合结构域的最后一个完整重复的c-末端的至少约20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、31个、32个、33个、34个、35个、36个、37个、38个、39个、40个、41个、42个、443个、44个、45个、46个、47个、48个、49个、50个、51个、52个、53个、54个、55个、56个、57个、58个、59个、60个、61个、62个、63个、64个、65个、66个、67个、68个、69个、70个、71个、72个、73个、74个、75个、76个、77个、78个、79个、80个、81个、82个、83个、84个或至少85个氨基酸。在一个实施例中,本文考虑的megatal包括ctd多肽,其为黄单胞菌tale蛋白的至少约氨基酸-20至-1(-20是最后一个c-末端完全重复单元的c-末端的半重复单元的氨基酸1)。在特定实施例中,ctd多肽包括在黄单胞菌tale蛋白的taledna结合结构域的最后一个完全重复的c-末端的至少约20个、19个、18个、17个、16个、15个、14个、13个、12个、11个、10个、9个、8个、7个、6个、5个、4个、3个、2个或1个氨基酸。在一个实施例中,本文考虑的megatal包括ctd多肽,其为雷尔氏菌tale蛋白的至少约氨基酸-20至-1(-20是最后一个c-末端完全重复单元的c-末端的半重复单元的氨基酸1)。在特定实施例中,ctd多肽包括在雷尔氏菌tale蛋白的taledna结合结构域的最后一个完全重复的c-末端的至少约20个、19个、18个、17个、16个、15个、14个、13个、12个、11个、10个、9个、8个、7个、6个、5个、4个、3个、2个或1个氨基酸。在特定实施例中,本文考虑的megatal包括融合多肽,其包括被改造以结合靶序列的taledna结合结构域、被改造以结合并切割靶序列的大范围核酸酶和任选的ntd和/或ctd多肽,所述taledna结合结构域大范围核酸酶和任选的ntd和/或ctd多肽任选地通过一个或多个本文其它地方考虑的连接子多肽彼此连接。不希望受任何特定理论的束缚,预期包括taledna结合结构域和任选的ntd和/或ctd多肽的megatal与连接子多肽融合,所述连接子多肽进一步与工程化大范围核酸酶融合。因此,taledna结合结构域结合距离由大范围核酸酶的dna结合结构域结合的靶序列约1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个或15个核苷酸之内的dna靶序列。以这种方式,本文考虑的megatal增加了基因组编辑的特异性和效率。在特定实施例中,本文考虑的megatal包括一个或多个taledna结合重复单元和工程化lhe,所述工程化lhe选自由以下组成的群组:i-aabmi、i-aaemi、i-anii、i-apami、i-capiii、i-capiv、i-ckami、i-cpami、i-cpamii、i-cpamiii、i-cpamiv、i-cpamv、i-cpav、i-crami、i-ejemi、i-gpemi、i-gpii、i-gzemi、i-gzemii、i-gzemih、i-hjemi、i-ltrii、i-ltri、i-ltrwi、i-mpemi、i-mvemi、i-ncrii、i-ncrl、i-ncrmi、i-ohemi、i-onui、i-osomi、i-osomii、i-osomiii、i-osomiv、i-panmi、i-panmii、i-panmiii、i-pnomi、i-scumi、i-smami、i-sscmi和i-vdi141i,或优选i-cpami、i-hjemi、i-onui、i-panmi和smami,或更优选i-onui。在特定实施例中,本文考虑的megatal包括ntd、一个或多个taledna结合重复单元、ctd和工程化lhe,所述工程化lhe选自由以下组成的群组:i-aabmi、i-aaemi、i-anii、i-apami、i-capiii、i-capiv、i-ckami、i-cpami、i-cpamii、i-cpamiii、i-cpamiv、i-cpamv、i-cpav、i-crami、i-ejemi、i-gpemi、i-gpii、i-gzemi、i-gzemii、i-gzemiii、i-hjemi、i-ltrii、i-ltri、i-ltrwi、i-mpemi、i-mvemi、i-ncrii、i-ncrl、i-ncrmi、i-ohemi、i-onui、i-osomi、i-osomii、i-osomiii、i-osomiv、i-panmi、i-panmii、i-panmiii、i-pnomi、i-scumi、i-smami、i-sscmi和i-vdi141i,或优选i-cpami、i-hjemi、i-onui、i-panmi和smami,或更优选i-onui。在特定实施例中,本文考虑的megatal包括ntd、约9.5个至约11.5个taledna结合重复单元和工程化i-onuilhe,所述工程化i-onuilhe选自由以下组成的群组:i-aabmi、i-aaemi、i-anii、i-apami、i-capiii、i-capiv、i-ckami、i-cpami、i-cpamii、i-cpamiii、i-cpamiv、i-cpamv、i-cpav、i-crami、i-ejemi、i-gpemi、i-gpii、i-gzemi、i-gzemii、i-gzemiii、i-hjemi、i-ltrii、i-ltri、i-ltrwi、i-mpemi、i-mvemi、i-ncrii、i-ncrl、i-ncrmi、i-ohemi、i-onui、i-osomi、i-osomii、i-osomiii、i-osomiv、i-panmi、i-panmii、i-panmiii、i-pnomi、i-scumi、i-smami、i-sscmi和i-vdi141i,或优选i-cpami、i-hjemi、i-onui、i-panmi和smami,或更优选i-onui。在特定实施例中,本文考虑的megatal包括约122个氨基酸至137个氨基酸的ntd、约9.5个、约10.5个或约11.5个结合重复单元、约20个氨基酸至约85个氨基酸的ctd和工程化i-onuilhe,所述工程化i-onuilhe选自由以下组成的群组:i-aabmi、i-aaemi、i-anii、i-apami、i-capiii、i-capiv、i-ckami、i-cpami、i-cpamii、i-cpamiii、i-cpamiv、i-cpamv、i-cpav、i-crami、i-ejemi、i-gpemi、i-gpii、i-gzemi、i-gzemii、i-gzemiii、i-hjemi、i-ltrii、i-ltri、i-ltrwi、i-mpemi、i-mvemi、i-ncrii、i-ncrl、i-ncrmi、i-ohemi、i-onui、i-osomi、i-osomii、i-osomiii、i-osomiv、i-panmi、i-panmii、i-panmiii、i-pnomi、i-scumi、i-smami、i-sscmi和i-vdi141i,或优选i-cpami、i-hjemi、i-onui、i-panmi和smami,或更优选i-onui。3.talen在特定实施例中,考虑了talen,其结合至并切割有助于t细胞受体(tcr)信号转导的基因座(包含但不限于tcrα(tcrα)和tcrβ(tcrβ)基因座)的靶区。“talen”是指包括本文其它地方考虑的工程化taledna结合结构域和核酸内切酶结构域(或其核酸内切酶半结构域)的工程化核酸酶,并且任选地包括一个或多个连接子和/或额外的功能结构域,例如,显示5-3′核酸外切酶、5-3′碱性核酸外切酶、3-5′核酸外切酶(例如,trex2)、5′瓣状核酸内切酶、解旋酶或模板非依赖性dna聚合酶活性的末端加工酶的末端加工酶结构域。在特定实施例中,可以将talen导入具有显示5-3′核酸外切酶、5-3′碱性核酸外切酶、3-5′核酸外切酶(例如,trex2)、5′瓣状核酸内切酶、解旋酶或模板非依赖性dna聚合酶活性的末端加工酶的t细胞中。talen和3′加工酶可以分开导入,例如,在不同的载体或分开的mrna中,或者一起导入,例如作为融合蛋白,或在由病毒自裂解肽或ires元件分开的多顺反子构建体中导入。在一个实施例中,用两个talen实现靶向双链切割,每个包括核酸内切酶半结构域的talen可以用于重构催化活性切割结构域。在另一个实施例中,使用包括taledna结合结构域和两个核酸内切酶半结构域的单个多肽实现靶向双链切割。在特定实施例中考虑的talen包括ntd、taledna结合结构域和核酸内切酶结构域或半结构域,所述taledna结合结构域包括约3个至30个重复单元,例如,约3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个或30个重复单元。在特定实施例中考虑的talen包括ntd、taledna结合结构域、ctd和核酸内切酶结构域或半结构域,所述taledna结合结构域包括约3.5个至30.5个重复单元,例如,约3.5个、4.5个、5.5个、6.5个、7.5个、8.5个、9.5个、10.5个、11.5个、12.5个、13.5个、14.5个、15.5个、16.5个、17.5个、18.5个、19.5个、20.5个、21.5个、22.5个、23.5个、24.5个、25.5个、26.5个、27.5个、28.5个、29.5个或30.5个重复单元。在特定实施例中考虑的talen包括如本文其它地方公开的约121个氨基酸至约137个氨基酸的ntd、包括约9.5个至约11.5个重复单元(即,约9.5个、约10.5个或约11.5个重复单元)的taledna结合结构域、约20个氨基酸至约85个氨基酸的ctd和核酸内切酶结构域或半结构域。在特定实施例中,talen包括型限制性核酸内切酶的核酸内切酶结构域。限制性核酸内切酶(限制酶)存在于许多物质中,并且能够与dna(在识别位点)进行序列特异性结合并在结合位点处或附近切割dna。某些限制酶(例如,iis型)在从识别位点移除的位点切割dna,并具有可分开的结合和核酸内切酶结构域。在一个实施例中,talen包括来自至少一种iis型限制酶的核酸内切酶结构域(或核酸内切酶半结构域)和一个或多个本文其它地方考虑的taledna结合结构域。适用于在特定实施例中考虑的talen的iis型限制性核酸内切酶结构域的说明性实例包含在“rebase.neb.com/cgi-bin/sublist?s”中公开的至少1633种iis型限制性核酸内切酶的核酸内切酶结构域。适用于在特定实施例中考虑的talen的iis型限制性核酸内切酶结构域的额外的说明性实例包含选自由以下组成的群组的核酸内切酶的那些:aari、aceiii、acii、aloi、alw26i、baei、bbr7i、bbvi、bbvii、bbvci、bcci、bce83i、bceai、bcefi、bcgi、bcivi、bfii、bini、bmgi、bpu10i、bsaxi、bsbi、bscai、bscgi、bseri、bseyi、bsii、bsmi、bsmai、bsmfi、bsp24i、bspgi、bspmi、bspnci、bsri、bsrbi、bsrdi、bstf5i、btri、btsi、cdii、cjepi、drdii、eari、ecii、eco31i、eco57i、eco57mi、esp3i、faui、fini、foki、gdiii、gsui、hgai、hin4ii、hphi、ksp632i、mboii、mlyi、mmei、mnli、pfl1108、iplei、ppiipsri、rleai、sapi、sfani、simi、sspd5i、sth132i、stsi、tspdti、tspgwi、tth111ii、ubapi、bsai和bsmbi。在一个实施例中,本文考虑的talen包括fokiiis限制性核酸内切酶的核酸内切酶结构域。在一个实施例中,本文考虑的talen包括taledna结合结构域和来自至少一个iis型限制性核酸内切酶的核酸内切酶半结构域以增强切割特异性,任选地其中核酸内切酶半结构域包括一个或多个氨基酸取代或修饰,其最小化或防止同源二聚化。适用于在特定实施例中考虑的特定实施例的切割半结构域的说明性实例包含美国专利公开第20050064474号;第20060188987号,第20080131962号,第20090311787号;第20090305346号;第20110014616号,和第20110201055号中公开的那些,其各自通过引用整体并入本文。4.锌指核酸酶在特定实施例中,考虑了锌指核酸酶(zfn),其结合至并切割有助于t细胞受体(tcr)信号转导的基因座(包含但不限于tcrα(tcrα)和tcrβ(tcrβ)基因座)的靶区。“zfn”是指包括一个或多个锌指dna结合结构域和核酸内切酶结构域(或其核酸内切酶半结构域)的工程化核酸酶,并且任选地包括一个或多个连接子和/或额外的功能结构域,例如,显示5-3′核酸外切酶、5-3′碱性核酸外切酶、3-5′核酸外切酶(例如,trex2)、5′瓣状核酸内切酶、解旋酶或模板非依赖性dna聚合酶活性的末端加工酶的末端加工酶结构域。在特定实施例中,可以将zfn导入具有显示5-3′核酸外切酶、5-3′碱性核酸外切酶、3-5′核酸外切酶(例如,trex2)、5′瓣状核酸内切酶、解旋酶或模板非依赖性dna聚合酶活性的末端加工酶的t细胞中。zfn和3′加工酶可以分开导入,例如,在不同的载体或分开的mrna中,或者一起导入,例如作为融合蛋白,或在由病毒自裂解肽或ires元件分开的多顺反子构建体中导入。在一个实施例中,使用两个zfn实现靶向双链切割,每个包括核酸内切酶半结构域的zfn可以用于重构催化活性切割结构域。在另一个实施例中,使用包括一个或多个锌指dna结合结构域和两个核酸内切酶半结构域的单个多肽实现靶向双链切割。在一个实施例中,znf包括本文其它地方考虑的taledna结合结构域、锌指dna结合结构域和本文其它地方考虑的核酸内切酶结构域(或核酸内切酶半结构域)。在一个实施例中,znf包括锌指dna结合结构域和本文其它地方考虑的大范围核酸酶。在特定实施例中,zfn包括具有一个、两个、三个、四个、五个、六个、七个或八个或更多个锌指基序的锌指dna结合结构域和核酸内切酶结构域(或核酸内切酶半结构域)。通常,单个锌指基序的长度为约30个氨基酸。锌指基序包含规范的c2h2锌指和非规范的锌指(例如,c3h锌指和c4锌指)。可以改造锌指结合结构域以结合任何dna序列。已经标识了给定3bpdna靶序列的候选锌指dna结合结构域,并且已经设计了模块化组装策略,用于将多个结构域连接成靶向相应复合dna靶序列的多指肽。还可以使用本领域已知的其它合适方法来设计和构建编码锌指dna结合结构域的核酸,例如噬菌体展示、随机诱变、组合文库、计算机/理性设计、亲和选择、pcr、从cdna或基因组文库克隆图、合成构建等。(参见例如美国专利第5,786,538号;wu等人,《美国科学院院报(pnas)》,第92期:第344-348页(1995年);jamieson等人,《生物化学(biochemistry)》,第33期:第5689-5695页(1994年);rebar和pabo,《科学(science)》,第263期:第671-673页(1994年);choo和klug,《美国科学院院报(pnas)》,第91期:第11163-11167页(1994年);choo和klug,《美国科学院院报(pnas)》,第91期:第11168-11172页(1994年);desjarlais和berg,《美国科学院院报(pnas)》,第90期:第2256-2260页(1993年);desjarlais和berg,《美国科学院院报(pnas)》,第89期:第7345-7349页(1992年);pomerantz等人,《科学(science)》,第267期:第93-96页(1995年);pomerantz等人,《美国科学院院报(pnas)》,第92期:第9752-9756页(1995年);liu等人,《美国科学院院报(pnas)》,第94期:第5525-5530页(1997年);griesman和pabo,《科学(science)》,第275期:第657-661页(1997年);desjarlais和berg,《美国科学院院报(pnas)》,第91期:第11-99-11103页(1994年))。各个锌指基序结合至三或四核苷酸序列。锌指结合结构域被改造以结合的序列(例如,靶序列)的长度将决定工程化锌指结合结构域中锌指基序的数量。例如,对于其中锌指基序不与重叠亚位点结合的zfn,六核苷酸靶序列由双指结合结构域结合;九核苷酸靶序列由三指结合结构域结合,以此类推。在特定实施例中,靶位点中各个锌指基序的dna结合位点不需要是连续的,而是可以被一个或几个核苷酸分开,这取决于关于多指结合结构域中锌指基序之间的连接子序列的长度和性质。在特定实施例中,本文考虑的znf包括锌指dna结合结构域(其包括两个、三个、四个、五个、六个、七个或八个或更多个锌指基序)和来自至少一个iis型限制酶的核酸内切酶结构域或半结构域以及一个或多个本文其它地方考虑的taledna结合结构域。在特定实施例中,本文考虑的znf包括锌指dna结合结构域(其包括三个、四个、五个、六个、七个或八个或更多个锌指基序)和来自至少一个iis型限制酶的核酸内切酶结构域或半结构域,所述iis型限制酶选自由以下组成的群组:aari、aceiii、acii、aloi、alw26i、baei、bbr7i、bbvi、bbvii、bbvci、bcci、bce83i、bceai、bcefi、bcgi、bcivi、bfii、bini、bmgi、bpu10i、bsaxi、bsbi、bscai、bscgi、bseri、bseyi、bsii、bsmi、bsmai、bsmfi、bsp24i、bspgi、bspmi、bspnci、bsri、bsrbi、bsrdi、bstf5i、btri、btsi、cdii、cjepi、drdii、eari、ecii、eco31i、eco57i、eco57mi、esp3i、faui、fini、foki、gdiii、gsui、hgai、hin4ii、hphi、ksp632i、mboii、mlyi、mmei、mnli、pfl1108、iplei、ppiipsri、rleai、sapi、sfani、simi、sspd5i、sth132i、stsi、tspdti、tspgwi、tth111ii、ubapi、bsai和bsmbi。在特定实施例中,本文考虑的znf包括锌指dna结合结构域(其包括三个、四个、五个、六个、七个或八个或更多个锌指基序)和来自fokiiis型限制性核酸内切酶的核酸内切酶结构域或半结构域。在一个实施例中,本文考虑的zfn包括锌指dna结合结构域和来自至少一个iis型限制性核酸内切酶的核酸内切酶半结构域以增强切割特异性,任选地其中核酸内切酶半结构域包括一个或多个氨基酸取代或修饰,其最小化或防止同源二聚化。5.crispr/cas核酸酶系统在各个实施例中,crispr(成簇规律间隔短回文重复)/cas(crispr相关)核酸酶系统被改造以结合至一个或多个基因座并将单链切口或双链断裂(dsb)导入其中,所述一个或多个基因座有助于t细胞受体(tcr)信号转导,包含但不限于tcrα(tcrα)和tcrβ(tcrβ)基因座。crispr/cas核酸酶系统是基于细菌系统的最近改造的核酸酶系统,其可以用于哺乳动物基因组工程。参见例如jinek等人(2012年),《科学(science)》,第337期:第816-821页;cong等人(2013年),《科学(science)》,第339期:第819-823页;mali等人(2013年),《科学(science)》,第339期:第823-826页;qi等人(2013年),《细胞(cell)》,第152期:第1173-1183页;jinek等人(2013年),《电子生活(elife)》,第2期:e00471;davidsegal(2013年),《电子生活(elife)》,第2期:e00563;ran等人(2013年),《自然·实验手册(natureprotocols)》,第8(11)期:第2281-2308页;zetsche等人(2015年),《细胞(cell)》,第163(3)期:第759-771页,其各自通过引用整体并入本文。在一个实施例中,crispr/cas核酸酶系统包括cas核酸酶和一个或个种将cas核酸酶募集至靶位点的rna,例如反式活化crna(tracrrna)和crisprrna(crrna)或单向导rna(sgrna)。crrna和tracrrna可以被改造成一个多核苷酸序列,其在本文中称为“单向导rna”或“sgrna”。在一个实施例中,cas核酸酶被改造为双链dna核酸内切酶或切口酶或催化死亡的cas,并与crrna和tracrrna或sgrna形成靶复合物,用于位于tcrα或tcrβ基因座内的原型间隔区靶序列的位点特异性dna识别和位点特异性切割。原型间隔区基序邻接短原型间隔区相邻基序(pam),其在募集cas/rna复合物中起作用。cas多肽识别对cas多肽具有特异性的pam基序。因此,crispr/cas系统可以用于靶向和切割双链多核苷酸序列的一条或两条链,所述双链多核苷酸序列位于对特定cas多肽具有特异性的特定3′pam序列的侧翼。可以使用生物信息学或使用实验方法标识pam。esvelt等人,2013年,《自然方法(naturemethods)》,第10(11)期:第1116-1121页,其全部内容通过引用并入本文。在一个实施例中,cas核酸酶包括一个或多个异源dna结合结构域,例如taledna结合结构域或锌指dna结合结构域。cas核酸酶与tale或锌指dna结合结构域的融合增加了dna切割效率和特异性。在一个特定实施例中,cas核酸酶任选地包括一个或多个连接子和/或额外的功能结构域,例如,显示5-3′核酸外切酶、5-3′碱性核酸外切酶、3-5′核酸外切酶(例如,trex2)、5′瓣状核酸内切酶、解旋酶或模板非依赖性dna聚合酶活性的末端加工酶的末端加工酶结构域。在特定实施例中,可以将cas核酸酶导入具有显示5-3′核酸外切酶、5-3′碱性核酸外切酶、3-5′核酸外切酶(例如,trex2)、5′瓣状核酸内切酶、解旋酶或模板非依赖性dna聚合酶活性的末端加工酶的t细胞中。cas核酸酶和3′加工酶可以分开导入,例如,在不同的载体或分开的mrna中,或者一起导入,例如作为融合蛋白,或在由病毒自裂解肽或ires元件分开的多顺反子构建体中导入。在各个实施例中,cas核酸酶是cas9或cpf1。适用于在特定实施例中考虑的特定实施例的cas9多肽的说明性实例可以从菌种获得,所述菌种包含但不限于:屎肠球菌、意大利肠球菌、无害李斯特菌、单核细胞增多性李斯特菌、斯氏李斯特菌、伊氏李斯特菌、无乳链球菌、咽峡炎链球菌、牛链球菌、停乳链球菌、马链球菌、解没食子酸链球菌、猕猴链球菌、变异链球菌、假豕链球菌、酿脓链球菌、嗜热链球菌、格氏链球菌、婴儿链球菌、马其顿链球菌、缓症链球菌、巴氏链球菌、猪链球菌、前庭链球菌、血链球菌、汗毛链球菌、杆状奈瑟菌、灰色奈瑟菌、金黄奈瑟菌、乳糖奈瑟菌、脑膜炎奈瑟菌、微黄奈瑟菌、短乳杆菌、布氏乳杆菌、干酪乳杆菌、副干酪乳杆菌、发酵乳杆菌、加氏乳杆菌、詹氏乳杆菌、约氏乳杆菌、鼠李糖乳杆菌、瘤胃乳酸杆菌、唾液乳杆菌、旧金山乳杆菌、拥挤棒杆菌、白喉棒杆菌、马氏棒杆菌、空肠弯曲杆菌、产气荚膜梭菌、奋森密螺旋体、蚀疮溃疡密螺旋体和齿垢密螺旋体。适用于在特定实施例中考虑的特定实施例的cpf1多肽的说明性实例可以从菌种获得,所述菌种包含但不限于:弗朗西斯菌属、氨基酸球菌属、普氏菌属、毛螺菌属等。cas9直向同源物的保守区包含中心hnh核酸内切酶结构域和分裂的ruvc/rna酶h结构域。cpf1直向同源物具有ruvc/rna酶h结构域但没有可辨别的hnh结构域。hnh和ruvc样结构域各自负责切割双链dna靶序列的一条链。cas9核酸酶多肽的hnh结构域切割与tracrrna:crrna或sgrna互补的dna链。cas9核酸酶的ruvc样结构域切割与tracrrna:crrna或sgrna不互补的dna链。预测cpf1充当二聚体,其中cpf1的每个ruvc样结构域切割靶位点的互补或非互补链。在特定实施例中,考虑了cas9核酸酶变体(例如,cas9切口酶),其包括在hnh或ruvc样核酸内切酶结构域中的一个或多个氨基酸添加、缺失、突变或取代,这降低或消除变体结构域的核酸酶活性。降低或消除结构域中核酸酶活性的cas9hnh突变的说明性实例包含但不限于:酿脓链球菌(d10a);嗜热链球菌(d9a);齿垢密螺旋体(d13a);和脑膜炎奈瑟菌(d16a)。降低或消除结构域中核酸酶活性的cas9ruvc样结构域突变的说明性实例包含但不限于:酸脓链球菌(d839a、h840a或n863a);嗜热链球菌(d598a、h599a或n622a);齿垢密螺旋体(d878a、h879a或n902a);和脑膜炎奈瑟菌(d587a、h588a或n611a)。d.供体修复模板在本文特定实施例中考虑的免疫效应细胞组合物通过用工程化核酸酶进行基因组编辑和导入一个或多个供体修复模板来生成。不希望受任何特定理论的束缚,预期细胞中一种或多种工程化核酸酶的表达在靶位点(例如,tcrα基因)生成单链或双链dna断裂;并且在存在供体修复模板的情况下的核酸酶表达和断裂生成导致通过同源重组将模板插入或整合到靶位点,从而修复断裂。在各个实施例中,供体修复模板包括一个或多个编码免疫效力增强子、免疫抑制信号减弱子或工程化抗原受体的多核苷酸。在各个实施例中,预期在存在多个独立地编码靶向不同免疫抑制途径的免疫效力增强子和/或免疫抑制信号减弱子的供体修复模板的情况下为细胞提供工程化核酸酶,会产生具有增加的疗效和持久性的基因组编辑的t细胞。例如,在特定实施例中,优选靶向pd-1、lag-3、ctla-4、tim-3、il-10r、tigit和tgfβrii途径的组合的免疫效力增强子或免疫抑制信号。在特定实施例中,供体修复模板包括一个或多个同源臂。如本文使用,术语“同源臂”是指供体模板中与以核酸酶在靶位点导入的dna断裂为侧翼的dna序列相同或几乎相同的核酸序列。在一个实施例中,供体模板包括5′同源臂,其包括与dna断裂位点的dna序列5′相同或几乎相同的核酸。在一个实施例中,供体模板包括3′同源臂,其包括与dna断裂位点的dna序列3′相同或几乎相同的核酸。在一个优选的实施例中,供体模板包括5′同源臂和3′同源臂。可以独立地选择在特定实施例中考虑的同源臂的合适长度的说明性实例,包含但不限于:约100bp、约200bp、约300bp、约400bp、约500bp、约600bp、约700bp、约800bp、约900bp、约1000bp、约1100bp、约1200bp、约1300bp、约1400bp、约1500bp、约1600bp、约1700bp、约1800bp、约1900bp、约2000bp、约2100bp、约2200bp、约2300bp、约2400bp、约2500bp、约2600bp、约2700bp、约2800bp、约2900bp或约3000bp或更长的同源臂,包含所有中间长度的同源臂。合适的同源臂长度的额外的说明性实例包含但不限于:约100bp至约3000bp、约200bp至约3000bp、约300bp至约3000bp、约400bp至约3000bp、约500bp至约3000bp、约500bp至约2500bp、约500bp至约2000bp、约750bp至约2000bp、约750bp至约1500bp、或约1000bp至约1500bp,包含所有中间长度的同源臂。在一个特定实施例中,5′和3′同源臂的长度独立地选自约500bp至约1500bp。在一个实施例中,5′同源臂为约1500bp,3′同源臂为约1000bp。在一个实施例中,5′同源臂为约600bp,3′同源臂为约600bp。供体修复模板可以进一步包括一个或多个多核苷酸,例如启动子和/或增强子、非翻译区(utr)、kozak序列、多腺苷酸化信号、额外的限制酶位点、多克隆位点、内部核糖体进入位点(ires)、重组酶识别位点(例如,loxp、frt和att位点)、终止密码子、转录终止信号和本文其它地方考虑的编码自裂解多肽、表位标签的多核苷酸。在各个实施例中,供体修复模板包括5′同源臂、rna聚合酶ii启动子、一个或多个编码免疫效力增强子、免疫抑制信号减弱子或工程化抗原受体的多核苷酸、和3′同源臂。在各个实施例中,用供体修复模板修饰tcrα等位基因,所述供体修复模板包括5′同源臂、一个或多个自裂解多肽、一个或多个编码免疫效力增强子、免疫抑制信号减弱子或工程化抗原受体的多核苷酸、和3′同源臂。1.免疫效力增强子在特定实施例中,通过在存在编码免疫效力增强子的供体修复模板的情况下在tcrα基因座中导入dsb,使本文考虑的基因组编辑的免疫效应细胞对免疫抑制因子更有效力和/或抗性。如本文使用,术语“免疫效力增强子”是指刺激和/或增强t细胞活化和/或功能的非天然存在的分子、免疫增效因子和将来自肿瘤微环境的免疫抑制信号转化为t细胞中的免疫刺激信号的非天然存在的多肽。在特定实施例中,免疫效力增强子选自由以下组成的群组:双特异性t细胞衔接子(bite)分子;免疫增效因子,包含但不限于细胞因子、趋化因子、细胞毒素和/或细胞因子受体;和翻转受体。在一些实施例中,免疫效力增强子、免疫增效因子或翻转受体是包括蛋白质去稳定化结构域的融合多肽。a.双特异性t细胞衔接子(bite)分子在特定实施例中,通过在存在编码双特异性t细胞衔接子(bite)分子的供体修复模板的情况下在tcrα基因座中导入dsb,使本文考虑的基因组编辑的免疫效应细胞更有效力。bite分子是二联分子,其包括结合靶抗原的第一结合结构域、如本文其它地方考虑的连接子或间隔区和结合免疫效应细胞上的刺激或共刺激分子的第二结合结构域。第一和第二结合结构域可以独立地选自配体、受体、抗体或其抗原结合片段、凝集素和碳水化合物。在特定实施例中,第一和第二结合结构域是抗原结合结构域。在特定实施例中,第一和第二结合结构域是抗体或其抗原结合片段。在一个实施例中,第一和第二结合结构域是单链可变片段(scfv)。在特定实施例中可以被第一结合结构域识别和结合的靶抗原的说明性实例包含但不限于:α叶酸受体、5t4、αvβ6整联蛋白、bcma、b7-h3、b7-h6、caix、cd16、cd19、cd20、cd22、cd30、cd33、cd44、cd44v6、cd44v7/8、cd70、cd79a、cd79b、cd123、cd138、cd171、cea、cspg4、egfr,包含erbb2的egfr家族(her2)、egfrviii、egp2、egp40、epcam、epha2、epcam、fap、胎achr、frα、gd2、gd3、磷脂酰肌醇蛋白聚糖-3(gpc3)、hla-a1+mage1、hla-a2+mage1、hla-a3+mage1、hla-a1+ny-eso-1、hla-a2+ny-eso-1、hla-a3+ny-eso-1、il-11rα、il-13rα2、λ、路易斯y、κ、间皮蛋白、muc1、muc16、ncam、nkg2d配体、ny-eso-1、prame、psca、psma、ror1、ssx、存活蛋白、tag72、tem、vegfr2和wt-1。靶抗原的其它说明性实施例包含mhc-肽复合物,任选地其中肽由以下加工:α叶酸受体、5t4、αvβ6整联蛋白、bcma、b7-h3、b7-h6、caix、cd16、cd19、cd20、cd22、cd30、cd33、cd44、cd44v6、cd44v7/8、cd70、cd79a、cd79b、cd123、cd138、cd171、cea、cspg4、egfr,包含erbb2的egfr家族(her2)、egfrviii、egp2、egp40、epcam、epha2、epcam、fap、胎achr、frα、gd2、gd3、磷脂酰肌醇蛋白聚糖-3(gpc3)、mage1、ny-eso-1、il-11rα、il-13rα2、λ、路易斯y、κ、间皮蛋白、muc1、muc16、ncam、nkg2d配体、prame、psca、psma、ror1、ssx、存活蛋白、tag72、tem、vegfr2和wt-1。在特定实施例中由第二结合结构域识别和结合的免疫效应细胞上的刺激或共刺激分子的说明性实例包含但不限于:cd3γ、cd3δ、cd3ε、cd3ζ、cd28、cd134、cd137和cd278。在特定实施例中,通过工程化核酸酶在tcrα等位基因中诱导dsb,并且将包括bite的供体修复模板导入细胞中并通过同源重组插入tcrα等位基因中。b.免疫增效因子在特定实施例中,通过在基因组编辑的细胞或肿瘤微环境中的细胞中增加免疫增效因子,使本文考虑的基因组编辑的免疫效应细胞更有效力。免疫增效因子是指增强免疫效应细胞中的免疫反应的特定细胞因子、趋化因子、细胞毒素和细胞因子受体。在一个实施例中,通过在存在编码细胞因子、趋化因子、细胞毒素或细胞因子受体的供体修复模板的情况下在tcrα基因座中导入dsb来改造t细胞。在特定实施例中,供体修复模板编码细胞因子,其选自由以下组成的群组:il-2、胰岛素、ifn-γ、il-7、il-21、il-10、il-12、il-15和tnf-α。在特定实施例中,供体修复模板编码趋化因子,其选自由以下组成的群组:mip-1α、mip-1β、mcp-1、mcp-3和rantes。在特定实施例中,供体修复模板编码细胞毒素,其选自由以下组成的群组:穿孔蛋白、粒酶a和粒酶b。在特定实施例中,供体修复模板编码细胞因子受体,其选自由以下组成的群组:il-2受体、il-7受体、il-12受体、il-15受体和il-21受体。c.翻转受体在特定实施例中,通过肿瘤微环境引发的免疫抑制因子将免疫抑制信号“翻转”或“逆转”至阳性免疫刺激信号,使本文考虑的基因组编辑的免疫效应细胞更耐受耗竭。在一个实施例中,通过在存在编码翻转受体的供体修复模板的情况下在tcrα基因座中导入dsb来改造t细胞。如本文使用,术语“翻转受体”是指非天然存在的多肽,其将来自肿瘤微环境的免疫抑制信号转化为t细胞中的免疫刺激信号。在优选的实施例中,翻转受体是指包括结合免疫抑制因子的外结构域、跨膜结构域和将免疫刺激信号转导至t细胞的内结构域的多肽。在一个实施例中,供体修复模板包括翻转受体,其包括结合免疫抑制细胞因子的外结构域或细胞外结合结构域、跨膜结构域和免疫强效细胞因子受体的内结构域。在特定实施例中,翻转受体包括结合免疫抑制细胞因子的外结构域,其是il-4受体、il-6受体、il-8受体、l-10受体、il-13受体或tgfβ受体的细胞外细胞因子结合结构域;从cd4、cd8α、cd27、cd28、cd134、cd137、cd3多肽、il-2受体、il-7受体、il-12受体、il-15受体或il-21受体分离的跨膜;和从il-2受体、il-7受体、il-12受体、il-15受体或il-21受体分离的内结构域。在特定实施例中,翻转受体包括结合免疫抑制细胞因子的外结构域,其是结合il-4、il-6、il-8、il-10、il-13或tgfβ的抗体或其抗原结合片段;从cd4、cd8α、cd27、cd28、cd134、cd137、cd3多肽、il-2受体、il-7受体、il-12受体、il-15受体或il-21受体分离的跨膜;和从il-2受体、il-7受体、il-12受体、il-15受体或il-21受体分离的内结构域。在一个实施例中,供体修复模板包括翻转受体,其包括结合免疫抑制因子的外结构域、跨膜结构域和一个或多个细胞内共刺激信号转导结构域和/或主要信号转导结构域。适用于在特定实施例中考虑的翻转受体的特定实施例的外结构域的说明性实例包含但不限于:包括itim和/或itsm的受体的细胞外配体结合结构域。适用于在特定实施例中考虑的翻转受体的特定实施例的外结构域的另外的说明性实例包含但不限于:pd-1、lag-3、tim-3、ctla-4、btla、ceacam1、tigit、tgfβrii、il4r、il6r、cxcr1、cxcr2、il10r、il13rα2、trailr1、rcas1r和fas。在一个实施例中,外结构域包括受体的细胞外配体结合结构域,所述受体选自由以下组成的群组:pd-1、lag-3、tim-3、ctla-4、il10r、tigit和tgfβrii。在一个实施例中,供体修复模板包括翻转受体,其包括结合免疫抑制细胞因子的外结构域、跨膜结构域和一个或多个细胞内共刺激信号转导结构域和/或主要信号转导结构域。适用于在特定实施例中考虑的翻转受体的特定实施例的跨膜结构域的说明性实例包含但不限于以下蛋白质的跨膜结构域:pd-1、lag-3、tim-3、ctla-4、il10r、tigit和t细胞受体的tgfβriiα或β链、cdδ、cd3ε、cdγ、cd3ζ、cd4、cd5、cd8α、cd9、cd16、cd22、cd27、cd28、cd33、cd37、cd45、cd64、cd80、cd86、cd134、cd137或cd154。在特定实施例中,可优选选择与tcr信号转导复合物(例如,cd3)缔合的跨膜结构域,以增加免疫刺激信号。在各个实施例中,翻转受体包括引发免疫刺激信号的内结构域。如本文使用,术语“内结构域”是指免疫刺激基序或结构域,包含但不限于免疫受体酪氨酸活化基序(itam)、共刺激信号转导结构域、主要信号转导结构域或与引发t细胞中的免疫刺激信号相关的另一细胞内结构域。适用于在特定实施例中考虑的翻转受体的特定实施例的内结构域的说明性实例包含但不限于包括itam基序的结构域。适用于在特定实施例中考虑的翻转受体的特定实施例的内结构域的额外的说明性实例包含但不限于共刺激信号转导结构域,其从以下分离:tlr1、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9、tlr10、card11、cd2、cd7、cd27、cd28、cd30、cd40、cd54(icam)、cd83、cd134(ox40)、cd137(4-1bb)、cd278(icos)、dap10、lat、nkd2c、slp76、trim或zap70。适用于在特定实施例中考虑的翻转受体的特定实施例的内结构域的额外的说明性实例包含但不限于:从il-2受体、il-7受体、il-12受体、il-15受体或il-21受体分离的内结构域。适用于在特定实施例中考虑的翻转受体的特定实施例的内结构域的另外的说明性实例包含但不限于主要信号转导结构域,其从以下分离:fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd3ζ、cd22、cd79a、cd79b和cd66d。在特定实施例中,翻转受体包括外结构域,其包括来自pd-1、lag-3、tim-3、ctla-4、il10r、tigit或tgfβrii的细胞外结构域;来自cd3多肽、cd4、cd8α、cd28、cd134、cd137、pd-1、lag-3、tim-3、ctla-4、il10r和tgfβrii的跨膜结构域;和来自cd28、cd134、cd137、cd278和/或cd3ζ的内结构域。在特定实施例中,翻转受体包括外结构域,其包括来自pd-1、lag-3、tim-3、ctla-4、il10r、tigit或tgfβrii的细胞外结构域;来自cd3多肽、cd4、cd8α、cd28、cd134或cd137的跨膜结构域;和来自cd28、cd134、cd137、cd278和/或cd3ζ的内结构域。i.pd-1翻转受体pd-1在t细胞上表达,并且通过肿瘤微环境中存在的免疫抑制因子进行免疫抑制。pd-l1和pd-l2的表达与一些人恶性肿瘤的预后相关。pd-l1/pd-1信号转导途径是t细胞耗竭的一种重要调节途径。pd-l1在癌细胞和基质细胞中大量表达,并且使用单克隆抗体阻断pd-l1/pd-1增强了t细胞抗肿瘤功能。pd-l2还结合至pd-1并负调节t细胞功能。在一个实施例中,通过工程化核酸酶在tcrα等位基因中诱导dsb,并且将包括pd-1翻转受体的供体修复模板导入细胞中并通过同源重组插入tcrα等位基因中。在特定实施例中考虑的pd-1翻转受体包括人pd-1受体的细胞外配体结合结构域,来自pd-1、cd3多肽、cd4、cd8α、cd28、cd134或cd137的跨膜结构域,和来自cd28、cd134、cd137、cd278和/或cd3ζ的内结构域。ii.lag-3翻转受体淋巴细胞活化基因-3(lag-3)是一种细胞表面分子,对t细胞功能具有不同的生物学作用。lag-3信号转导与自身免疫反应的cd4+调节性t细胞抑制有关。此外,lag-3表达在cd8+t细胞的抗原刺激后增加,并且与肿瘤微环境中的t细胞耗竭有关。lag-3的体内抗体阻断与抗原特异性cd8+t细胞的累积和效应子功能增加有关。一组表现出抗lag-3抗体与特异性抗肿瘤疫苗接种组合给予导致肿瘤中活化的cd8+t细胞显著增加和肿瘤实质的破坏。grosso等人(2007年),《临床研究杂志(jclininvest.)》,第117(11)期:第3383-3392页。在一个实施例中,通过工程化核酸酶在tcrα等位基因中诱导dsb,并且将包括lag-3翻转受体的供体修复模板导入细胞中并通过同源重组插入tcrα等位基因中。在特定实施例中考虑的lag-3翻转受体包括人lag-3受体的细胞外配体结合结构域,来自lag-3、cd3多肽、cd4、cd8α、cd28、cd134或cd137的跨膜结构域,和来自cd28、cd134、cd137、cd278和/或cd3ζ的内结构域。iii.tim-3翻转受体t细胞免疫球蛋白-3(tim-3)已被确定为负调节分子并在免疫耐受中起作用。tim-3表达标识癌症中和慢性感染期间耗竭的t细胞。tim-3表达cd4+和cd8+t细胞产生减少量的细胞因子或响应于抗原而增殖较少。增加的tim-3表达与t细胞增殖减少和il-2、tnf和ifn-γ的产生减少有关。阻断tim-3信号转导途径恢复增殖并增强抗原特异性t细胞中细胞因子的产生。tim-3与癌胚抗原细胞粘附分子1(ceacam1)共表达并与其形成异二聚体,所述ceacam1是在活化t细胞上表达并参与t细胞抑制的另一种众所周知的分子。ceacam1的存在赋予tim-3抑制性功能。ceacam1通过每个分子的高度相关的膜-远端n-末端结构域顺式形成异二聚体相互作用,促进tim-3的成熟和细胞表面表达。ceacam1和tim-3也通过其n-末端结构域反式结合。在一个实施例中,通过工程化核酸酶在tcrα等位基因中诱导dsb,并且将包括tim-3翻转受体的供体修复模板导入细胞中并通过同源重组插入tcrα等位基因中。在特定实施例中考虑的tim-3翻转受体包括人tim-3受体的细胞外配体结合结构域,来自tim-3、cd3多肽、cd4、cd8α、cd28、cd134或cd137的跨膜结构域,和来自cd28、cd134、cd137、cd278和/或cd3ζ的内结构域。iv.ctla-4翻转受体ctla4主要在t细胞上表达,其中它调节t细胞活化早期的幅度。ctla4抵消t细胞共刺激受体cd28的活性。cd28不影响t细胞活化,除非tcr首先被同源抗原衔接。一旦发生抗原识别,cd28信号转导强烈地扩增tcr信号转导以活化t细胞。cd28和ctla4共有相同的配体:cd80(也称为b7.1)和cd86(也称为b7.2)。ctla4对两种配体具有高得多的总体亲和力,并且通过使cd28在结合cd80和cd86中胜出以及主动向t细胞递送抑制性信号来减弱t细胞的活化。ctla4还通过cd28衔接与cd80和cd86的隔离以及从抗原呈递细胞(apc)表面主动移除cd80和cd86而赋予信号转导依赖性t细胞抑制。在一个实施例中,通过工程化核酸酶在tcrα等位基因中诱导dsb,并且将包括ctla-4翻转受体的供体修复模板导入细胞中并通过同源重组插入tcrα等位基因中。在特定实施例中考虑的ctla-4翻转受体包括人ctla-4受体的细胞外配体结合结构域,来自ctla-4、cd3多肽、cd4、cd8α、cd28、cd134或cd137的跨膜结构域,和来自cd28、cd134、cd137、cd278和/或cd3ζ的内结构域。v.tigit翻转受体t细胞免疫球蛋白和基于免疫受体酪氨酸的抑制性基序[itim]结构域(tigit)是t细胞共抑制性受体,其被标识为在多种实体瘤类型中始终高度表达。tigit限制抗肿瘤和其它cd8+t细胞依赖性慢性免疫反应。tigit在人和小鼠肿瘤浸润性t细胞中高度表达。tigit的基因消融或抗体阻断已被证明可在体外和体内增强nk细胞杀伤和cd4+t细胞致敏(priming),并可加剧cd4+t细胞依赖性自身免疫性疾病(例如,实验性自身免疫性脑炎)的严重程度(goding等人,2013年,joller等人,2011年,levin等人,2011年,lozano等人,2012年,stanietsky等人,2009年,stanietsky等人,2013年,stengel等人,2012年,yu等人,2009年)。相反,给予tigit-fc融合蛋白或激动性抗tigit抗体抑制体外t细胞活化和体内cd4+t细胞依赖性迟发型超敏反应(yu等人,2009年)。tigit可能通过在结合至cd155方面胜出反共刺激受体cd226而发挥其免疫抑制作用。在癌症和慢性病毒感染的模型中,tigit和pd-l1的抗体共阻断协同地且特异性地增强了cd8+t细胞效应子功能,从而分别导致显著的肿瘤和病毒清除。在一个实施例中,通过工程化核酸酶在tcrα等位基因中诱导dsb,并且将包括tigit翻转受体的供体修复模板导入细胞中并通过同源重组插入tcrα等位基因中。在特定实施例中考虑的tigit翻转受体包括人tigit受体的细胞外配体结合结构域,来自tigit、cd3多肽、cd4、cd8α、cd28、cd134或cd137的跨膜结构域,和来自cd28、cd134、cd137、cd278和/或cd3ζ的内结构域。vi.tgfβrii翻转受体转化生长因子-β(tgfβ)是由肿瘤细胞和免疫细胞产生的免疫抑制细胞因子,其可以使免疫系统的许多臂极化。肿瘤细胞和肿瘤浸润淋巴细胞对免疫抑制细胞因子(包含tgfβ)的过量产生有助于免疫抑制肿瘤微环境。tgfβ经常与肿瘤转移和侵袭相关,其抑制免疫细胞的功能,并且在癌症患者中预后不良。在肿瘤特异性ctl中通过tgfβrii的tgfβ信号转导减弱了其在肿瘤中的功能和频率,并且用单克隆抗体阻断cd8+t细胞上的tgfβ信号转导导致更快速的肿瘤监测和在肿瘤部位存在更多的ctl。在一个实施例中,通过工程化核酸酶在tcrα等位基因中诱导dsb,并且将包括tgfβrii翻转受体的供体修复模板导入细胞中并通过同源重组插入tcrα等位基因中。在特定实施例中考虑的tgfβrii翻转受体包括人tgfβrii受体的细胞外配体结合结构域,来自tgfβrii、cd3多肽、cd4、cd8α、cd28、cd134或cd137的跨膜结构域,和来自cd28、cd134、cd137、cd278和/或cd3ζ的内结构域。2.免疫抑制信号减弱子困扰现有过继性细胞疗法的一个限制或问题是由于肿瘤微环境介导的耗竭导致的免疫效应细胞的低反应性。耗竭的t细胞具有与天然、效应或记忆t细胞明显不同的独特分子特征。它们被定义为具有降低的细胞因子表达和效应子功能的t细胞。在特定实施例中,通过免疫抑制因子降低或减弱信号转导,使本文考虑的基因组编辑的免疫效应细胞更耐受耗竭。在一个实施例中,通过在存在编码免疫抑制信号减弱子的供体修复模板的情况下在tcrα基因座中导入dsb来改造t细胞。如本文使用,术语“免疫抑制信号减弱子”是指非天然存在的多肽,其降低免疫抑制信号从肿瘤微环境到t细胞的转导。在一个实施例中,免疫抑制信号减弱子是结合免疫抑制因子的抗体或其抗原结合片段。在优选的实施例中,免疫抑制信号减弱子是指对特定免疫抑制因子或信号转导途径引起抑制、减弱或显性负性效应的多肽,因为减弱子包括结合免疫抑制因子的外结构域、任选的跨膜结构域和任选的经修饰的内结构域(例如,细胞内信号转导结构域)。在特定实施例中,外结构域是识别和结合免疫抑制因子的细胞外结合结构域。在特定实施例中,使经修饰的内结构域变异以降低或抑制免疫抑制信号。合适的突变策略包含但不限于氨基酸取代、添加或缺失。合适的突变进一步包含但不限于移除信号转导结构域的内结构域截短、移除对信号转导基序活性重要的残基的突变内结构域和阻断受体循环的突变内结构域。在特定实施例中,当存在时,内结构域不转导免疫抑制信号或具有显著减少的信号转导。因此,在一些实施例中,免疫抑制信号减弱子充当来自肿瘤微环境的一种或多种免疫抑制因子的汇集点(sink),并抑制t细胞中相应的免疫抑制信号转导途径。一种免疫抑制信号由色氨酸分解代谢介导。在癌细胞中通过吲哚胺2,3-双加氧酶(ido)的色氨酸分解代谢导致产生犬尿氨酸,其已被证明对肿瘤微环境中的t细胞具有免疫抑制作用。参见例如platten等人(2012年),《癌症研究(cancerres.)》,第72(21)期:第5435-40页。在一个实施例中,供体修复模板包括具有犬尿氨酸酶活性的酶。具有适用于特定实施例的犬尿氨酸酶活性的酶的说明性实例包含但不限于l-犬尿氨酸水解酶。在一个实施例中,供体修复模板包括一个或多个编码免疫抑制信号减弱子的多核苷酸,其降低或阻断免疫抑制因子介导的免疫抑制信号转导。在特定实施例中考虑的免疫抑制信号减弱子靶向的免疫抑制因子的说明性实例包含但不限于:程序性死亡配体1(pd-l1)、程序性死亡配体2(pd-l2)、转化生长因子β(tgfβ)、巨噬细胞集落刺激因子1(m-csf1)、肿瘤坏死因子相关凋亡诱导配体(trail)、表达于siso细胞配体上的受体结合癌抗原(rcas1)、fas配体(fasl)、cd47、白细胞介素-4(il-4)、白细胞介素-6(il-6)、白细胞介素-8(il-8)、白细胞介素-10(il-10)和白细胞介素-13(il-13)。在各个实施例中,免疫抑制信号减弱子包括结合免疫抑制因子的抗体或其抗原结合片段。在各个实施例中,免疫抑制信号减弱子包括结合免疫抑制因子的外结构域。在特定实施例中,免疫抑制信号减弱子包括结合免疫抑制因子的外结构域和跨膜结构域。在另一个实施例中,免疫抑制信号减弱子包括结合免疫抑制因子的外结构域、跨膜结构域和不转导免疫抑制信号或具有显著降低的转导免疫抑制信号能力的经修饰的内结构域。如本文使用,术语“外结构域”是指抗原结合结构域。在一个实施例中,外结构域是免疫抑制受体的细胞外配体结合结构域,其将免疫抑制信号从肿瘤微环境转导至t细胞。在特定实施例中,外结构域是指受体的细胞外配体结合结构域,所述受体包括免疫受体酪氨酸抑制性基序(itim)和/或免疫受体酪氨酸开关基序(itsm)。适用于免疫抑制信号减弱子的特定实施例的外结构域的说明性实例包含但不限于抗体或其抗原结合片段,或从以下多肽分离的细胞外配体结合结构域:程序性细胞死亡蛋白1(pd-1)、淋巴细胞活化基因3蛋白(lag-3)、t细胞免疫球蛋白结构域和粘蛋白结构域蛋白3(tim-3)、细胞毒性t淋巴细胞抗原-4(ctla-4)、b和t淋巴细胞衰减子(btla)、基于t细胞免疫球蛋白和免疫受体酪氨酸的抑制性基序结构域(tigit)、转化生长因子β受体ii(tgfβrii)、巨噬细胞集落刺激因子1受体(csf1r)、白细胞介素4受体(il4r)、白细胞介素6受体(il6r)、趋化因子(c-x-c基序)受体1(cxcr1)、趋化因子(c-x-c基序)受体2(cxcr2)、白细胞介素10受体亚单位α(il10r)、白细胞介素13受体亚单位α2(il13rα2)、肿瘤坏死因子相关的凋亡诱导受体(trailr1)、表达于siso细胞上的受体结合癌抗原(rcas1r)和fas细胞表面死亡受体(fas)。在一个实施例中,外结构域包括受体的细胞外配体结合结构域,所述受体选自由以下组成的群组:pd-1、lag-3、tim-3、ctla-4、il10r、tigit、csf1r和tgfβrii。在特定实施例中可以使用多种跨膜结构域。适用于在特定实施例中考虑的免疫抑制信号减弱子的特定实施例的跨膜结构域的说明性实例包含但不限于以下蛋白质的跨膜结构域:t细胞受体的α或β链、cdδ、cd3ε、cdγ、cd3ζ、cd4、cd5、cd8α、cd9、cd16、cd22、cd27、cd28、cd33、cd37、cd45、cd64、cd80、cd86、cd134、cd137、cd152、cd154和pd-1。在特定实施例中,本文考虑的过继性细胞疗法包括免疫抑制信号减弱子,其抑制或阻断通过tgfβrii从肿瘤微环境转导免疫抑制tgfβ信号。在一个实施例中,免疫抑制信号减弱子包括具有tgfβrii细胞外配体结合的外结构域、tgfβrii跨膜结构域和截短的非功能性tgfβrii内结构域。在另一个实施例中,免疫抑制信号减弱子包括具有tgfβrii细胞外配体结合的外结构域、tgfβrii跨膜结构域,并且缺少内结构域。3.工程化抗原受体在特定实施例中,本文考虑的基因组编辑的免疫效应细胞包括工程化抗原受体。在一个实施例中,通过在存在编码工程化抗原受体的供体修复模板的情况下在一个或多个tcrα等位基因中导入dsb来改造t细胞。在特定实施例中,工程化抗原受体是工程化t细胞受体(tcr)、嵌合抗原受体(car)、daric受体或其组分或嵌合细胞因子受体。a.工程化tcr在特定实施例中,本文考虑的基因组编辑的免疫效应细胞包括工程化tcr。在一个实施例中,通过在存在编码工程化tcr的供体修复模板的情况下在一个或多个tcrα等位基因中导入dsb来改造t细胞。在一个特定实施例中,将工程化tcr插入单个tcrα等位基因中的dsb中。另一个实施例,将工程化tcr的α链插入一个tcrα等位基因中的dsb中,并将工程化tcr的β链插入另一个tcrα等位基因中的dsb中。在一个实施例中,本文考虑的工程化t细胞包括未插入tcrα等位基因的工程化tcr,以及免疫抑制信号减弱子、翻转受体、工程化t细胞受体(tcr)的α和/或β链、嵌合抗原受体(car)、daric受体或其组分或嵌合细胞因子受体中的一个或多个,其插入一个或多个tcrα等位基因中的dsb中。天然存在的t细胞受体包括两个亚单位(α链和β链亚单位),每个亚单位是通过每个t细胞基因组中的重组事件产生的独特蛋白质。可以针对其对特定靶抗原的选择性来筛选tcr文库。以这种方式,可以选择、克隆具有高亲合力和对靶抗原反应性的天然tcr,并随后将其导入t细胞群中用于过继性免疫疗法。在一个实施例中,通过将包括编码tcr亚单位的多核苷酸的供体修复模板导入一个或多个tcrα等位基因中的dsb中来修饰t细胞,其中tcr亚单位具有形成tcr的能力,所述tcr赋予t细胞对表达靶抗原的肿瘤细胞的特异性。在特定实施例中,所述亚单位可以与天然存在的亚单位相比具有一个或多个氨基酸取代、缺失、插入或修饰,只要其保留形成tcr并赋予转染的t细胞归巢至靶细胞的能力并且参与免疫相关的细胞因子信号转导即可。工程化tcr优选地还结合表现出具有高亲合力的相关肿瘤相关肽的靶细胞,并任选地介导在体内呈递相关肽的靶细胞的有效杀伤。编码工程化tcr的核酸优选地在t细胞的(天然存在的)染色体中与其天然背景(context)分离,并且可以掺入如本文其它地方所述的合适的载体中。在特定实施例中,核酸和包括它们的载体都可以转移到细胞中,优选转移到t细胞中。然后,经修饰的t细胞能够表达由一个或多个转导的核酸编码的tcr的一条或多条链。在优选的实施例中,工程化tcr是外源tcr,因为它被导入通常不表达特定tcr的t细胞中。工程化tcr的本质方面是它对由主要组织相容性复合物(mhc)或类似免疫组分呈递的肿瘤抗原具有高亲合力。与工程化tcr相反,car被改造成以mhc非依赖性方式结合靶抗原。tcr可以用附着于本发明的tcr的α链或β链的氨基末端或羧基末端部分的其它多肽表达,只要附着的其它多肽不干扰α链或β链形成功能性t细胞受体的能力和mhc依赖性抗原识别即可。在特定实施例中考虑的工程化tcr识别的抗原包含但不限于癌抗原,包含血液癌症和实体瘤上的抗原。说明性抗原包含但不限于α叶酸受体、α叶酸受体、5t4、αvβ6整联蛋白、bcma、b7-h3、b7-h6、caix、cd19、cd20、cd22、cd30、cd33、cd44、cd44v6、cd44v7/8、cd70、cd79a、cd79b、cd123、cd138、cd171、cea、cspg4、egfr,包含erbb2的egfr家族(her2)、egfrviii、egp2、egp40、epcam、epha2、epcam、fap、胎achr、frα、gd2、gd3、磷脂酰肌醇蛋白聚糖-3(gpc3)、hla-a1+mage1、hla-a2+mage1、hla-a3+mage1、hla-a1+ny-eso-1、hla-a2+ny-eso-1、hla-a3+ny-eso-1、il-11rα、il-13rα2、λ、路易斯y、κ、间皮蛋白、muc1、muc16、ncam、nkg2d配体、ny-eso-1、prame、psca、psma、ror1、ssx、存活蛋白、tag72、tem、vegfr2和wt-1。在一个实施例中,供体修复模板包括编码rna聚合酶ii启动子或第一自裂解病毒肽的多核苷酸和编码整合到一个经修饰的和/或非功能性tcrα等位基因中的工程化tcr的α链和/或β链的多核苷酸。在一个实施例中,供体修复模板包括编码rna聚合酶ii启动子或第一自裂解病毒肽的多核苷酸和编码整合到一个经修饰的和/或非功能性tcrα等位基因中的工程化tcr的α链和β链的多核苷酸。在一个特定实施例中,供体修复模板包括5′至3′的编码第一自裂解病毒肽的多核苷酸、编码工程化tcr的α链的多核苷酸、编码第二自裂解病毒肽的多核苷酸和编码整合到一个经修饰的和/或非功能性tcrα等位基因中的工程化tcr的β链的多核苷酸。在这种情况下,另一个tcrα等位基因可能是功能性的,或可能具有降低的功能,或被dsb变为非功能性的并由nhej修复。在一个实施例中,另一个tcrα等位基因已经被本文考虑的工程化核酸酶修饰,并且可能具有降低的功能或已经变为非功能性的。在某个实施例中,两个tcrα等位基因都被修饰并且具有降低的功能或是非功能性的:第一经修饰的tcrα等位基因包括核酸,所述核酸包括编码第一自裂解病毒肽的多核苷酸和编码工程化tcr的α链的多核苷酸;第二经修饰的tcrα等位基因包括编码第二自裂解病毒肽的多核苷酸和编码工程化tcr的β链的多核苷酸。b.嵌合抗原受体(car)在特定实施例中,本文考虑的工程化免疫效应细胞包括一种或多种嵌合抗原受体(car)。在一个实施例中,通过在存在编码car的供体修复模板的情况下在一个或多个tcrα等位基因中导入dsb来改造t细胞。在一个特定实施例中,car插入单个tcrα等位基因中的dsb中。在一个实施例中,本文考虑的工程化t细胞是未插入tcrα等位基因的car,以及免疫抑制信号减弱子、翻转受体、工程化t细胞受体(tcr)的α和/或β链、嵌合抗原受体(car)、daric受体或其组分或嵌合细胞因子受体中的一个或多个,其插入一个或多个tcrα等位基因中的dsb中。在各个实施例中,基因组编辑的t细胞表达将细胞毒性重定向至肿瘤细胞的car。car是将针对靶抗原(例如,肿瘤抗原)的基于抗体的特异性与t细胞受体活化细胞内结构域组合以生成嵌合蛋白的分子,所述嵌合蛋白表现出特异性抗肿瘤细胞免疫活性。如本文使用,术语“嵌合的”是指由不同蛋白质的部分或由来自不同来源的dna构成。在各个实施例中,car包括结合至特定靶抗原的细胞外结构域(也称为结合结构域或抗原特异性结合结构域)、跨膜结构域和细胞内信号转导结构域。car的主要特征是它们能够重定向免疫效应细胞特异性,从而触发增殖、细胞因子产生、能够以主要组织相容性(mhc)非依赖性方式介导靶抗原表达细胞的细胞死亡的分子的吞噬或产生,开发单克隆抗体、可溶性配体或细胞特异性共受体的细胞特异性靶向能力。在特定实施例中,car包括细胞外结合结构域,其特异性结合至在肿瘤细胞上表达的靶多肽(例如,靶抗原)。如本文使用,术语“结合结构域”、“细胞外结构域”、“细胞外结合结构域”、“抗原结合结构域”、“抗原特异性结合结构域”和“细胞外抗原特异性结合结构域”可互换使用,其提供了具有特异性结合至目标靶抗原的能力的嵌合受体,例如car或daric。结合结构域可以包括具有特异性识别并结合至生物分子(例如,细胞表面受体或肿瘤蛋白、脂质、多糖、或其它细胞表面靶分子或其组分)的能力的任何蛋白质、多肽、寡肽或肽。结合结构域包括目标生物分子的任何天然存在的、合成的、半合成的或重组产生的结合配偶体。在特定实施例中,细胞外结合结构域包括抗体或其抗原结合片段。“抗体”是指结合剂,其是包括至少轻链或重链免疫球蛋白可变区的多肽,其特异性识别并结合靶抗原的表位,例如肽、脂质、多糖或含有抗原决定簇的核酸,例如免疫细胞识别的那些。抗体包含抗原结合片段,例如,骆驼ig(骆驼科动物抗体或其vhh片段)、ignar、fab片段、fab′片段、f(ab)′2片段、f(ab)′3片段、fv、单链fv抗体(“scfv”)、bis-scfv、(scfv)2、微抗体、双抗体、三抗体、四抗体、二硫键稳定的fv蛋白(“dsfv”)和单结构域抗体(sdab,纳米抗体)或其其它抗体片段。该术语还包含基因改造形式,例如嵌合抗体(例如,人源化小鼠抗体)、异源缀合抗体(例如,双特异性抗体)及其抗原结合片段。还参见《皮尔斯目录和手册(piercecatalogandhandbook)》,1994年-1995年(piercechemicalco.,罗克福德,伊利诺伊);kuby,j.,《免疫学(immunology)》,第三版,w.h.freeman&co.,纽约,1997年。在一个优选的实施例中,结合结构域是scfv。在另一个优选的实施例中,结合结构域是骆驼科动物抗体。在特定实施例中,car包括结合抗原的细胞外结构域,所述抗原选自由以下组成的群组:α叶酸受体、5t4、αvβ6整联蛋白、bcma、b7-h3、b7-h6、caix、cd16、cd19、cd20、cd22、cd30、cd33、cd44、cd44v6、cd44v7/8、cd70、cd79a、cd79b、cd123、cd138、cd171、cea、cspg4、egfr,包含erbb2的egfr家族(her2)、egfrviii、egp2、egp40、epcam、epha2、epcam、fap、胎achr、frα、gd2、gd3、磷脂酰肌醇蛋白聚糖-3(gpc3)、hla-a1+mage1、hla-a2+mage1、hla-a3+mage1、hla-a1+ny-eso-1、hla-a2+ny-eso-1、hla-a3+ny-eso-1、il-11rα、il-13rα2、λ、路易斯y、κ、间皮蛋白、muc1、muc16、ncam、nkg2d配体、ny-eso-1、prame、psca、psma、ror1、ssx、存活蛋白、tag72、tem、vegfr2和wt-1。在特定实施例中,car包括细胞外结合结构域,例如结合抗原的抗体或其抗原结合片段,其中抗原是mhc-肽复合物,例如i类mhc-肽复合物或ii类mhc-肽复合物。在某些实施例中,car包括各个结构域之间的连接子残基。“可变区连接序列”是将重链可变区与轻链可变区连接的氨基酸序列,其提供与两个亚结合结构域的相互作用相容的间隔区功能,使得所得多肽保持对与包括相同轻链和重链可变区的抗体相同的靶分子的特异性结合亲和力。在特定实施例中,car包括一个、两个、三个、四个或五个或更多个连接子。在特定实施例中,连接子的长度为约1个至约25个氨基酸、约5个至约20个氨基酸、或约10至约20个氨基酸、或任何中间长度的氨基酸。在一些实施例中,连接子的长度是1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个或更多个氨基酸。在特定实施例中,car的结合结构域之后是一个或多个“间隔区结构域”,其是指使抗原结合结构域远离效应细胞表面移动以实现适当的细胞/细胞接触、抗原结合和活化的区域。(patel等人,《基因疗法(genetherapy)》,1999年;第6期:第412-419页)。间隔区结构域可以源自天然、合成、半合成或重组来源。在某些实施例中,间隔区结构域是免疫球蛋白的一部分,包含但不限于一个或多个重链恒定区,例如ch2和ch3。间隔区结构域可以包含天然存在的免疫球蛋白铰链区或改变的免疫球蛋白铰链区的氨基酸序列。在一个实施例中,间隔区结构域包括igg1、igg4或igd的ch2和ch3。在一个实施例中,car的结合结构域与一个或多个“铰链结构域”连接,其在将抗原结合结构域定位成远离效应细胞表面方面起作用以实现适当的细胞/细胞接触、抗原结合和活化。car通常在结合结构域和跨膜结构域(tm)之间包括一个或多个铰链结构域。铰链结构域可以源自天然、合成、半合成或重组来源。铰链结构域可以包含天然存在的免疫球蛋白铰链区或改变的免疫球蛋白铰链区的氨基酸序列。适用于本文所述car的说明性铰链结构域包含衍生自1型膜蛋白的细胞外区域的铰链区,例如cd8α和cd4,其可以是来自这些分子的野生型铰链区或可以被改变。在另一个实施例中,铰链结构域包括cd8α铰链区。在一个实施例中,铰链是pd-1铰链或cd152铰链。“跨膜结构域”是car的一部分,其融合细胞外结合部分和细胞内信号转导结构域并将car锚定在免疫效应细胞的质膜上。tm结构域可以源自天然、合成、半合成或重组来源。说明性tm结构域可以衍生自t细胞受体的α或β链、cd3δ、cd3ε、cd3γ、cd3ζ、cd4、cd5、cd8α、cd9、cd16、cd22、cd27、cd28、cd33、cd37、cd45、cd64、cd80、cd86、cd134、cd137、cd152、cd154和pd-1,即包括至少其跨膜区。在一个实施例中,car包括衍生自cd8α的tm结构域。在另一个实施例中,本文考虑的car包括衍生自cd8α的tm结构域和短寡肽或多肽连接子,优选长度为1个、2个、3个、4个、5个、6个、7个、8个、9个或10个氨基酸,其将tm结构域与car的细胞内信号转导结构域连接起来。甘氨酸-丝氨酸连接子提供了特别合适的连接子。在特定实施例中,car包括细胞内信号转导结构域。“细胞内信号转导结构域”是指car的一部分,其参与将有效car结合至靶抗原的信息转导至免疫效应细胞内部以引发效应细胞功能,例如活化、细胞因子产生、增殖、细胞毒性活性,包含向car结合的靶细胞释放细胞毒性因子,或通过抗原结合至细胞外car结构域引发的其它细胞反应。术语“效应子功能”是指细胞的专化功能。例如,t细胞的效应子功能可以是细胞溶解活性或包含细胞因子分泌的帮助或活性。因此,术语“细胞内信号转导结构域”是指蛋白质的一部分,其转导效应子功能信号并定向细胞以执行专化功能。虽然通常可以使用整个细胞内信号转导结构域,但在许多情况下不必使用整个结构域。在使用细胞内信号转导结构域的截短部分的方面来说,可以使用这种截短的部分代替整个结构域,只要它转导效应子功能信号即可。术语细胞内信号转导结构域意指包含足以转导效应子功能信号的细胞内信号转导结构域的任何截短部分。已知仅通过tcr生成的信号不足以完全活化t细胞,并且还需要辅助信号或共刺激信号。因此,t细胞活化可以说是由两种不同种类的细胞内信号转导结构域介导:通过tcr(例如,tcr/cd3复合物)启动抗原依赖性主要活化的主要信号转导结构域和以抗原非依赖性方式作用以提供辅助信号或共刺激信号的共刺激信号转导结构域。在优选的实施例中,car包括细胞内信号转导结构域,其包括一个或多个“共刺激信号转导结构域”和“主要信号转导结构域”。主要信号转导结构域以刺激方式或以抑制方式调节tcr复合物的主要活化。以刺激方式作用的主要信号转导结构域可以含有被称为基于免疫受体酪氨酸的活化基序或itam的信号转导基序,。含有适用于在特定实施例中考虑的car的主要信号转导结构域的itam的说明性实例包含衍生自fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd3ζ、cd22、cd79a、cd79b和cd66d的那些。在特别优选的实施例中,car包括cd3ζ主要信号转导结构域和一个或多个共刺激信号转导结构域。细胞内主要信号转导和共刺激信号转导结构域可以以任何顺序与跨膜结构域的羧基末端串联连接。在特定实施例中,car包括一个或多个共刺激信号转导结构域,以增强表达car受体的t细胞的疗效和扩增。如本文使用,术语“共刺激信号转导结构域”或“共刺激结构域”是指共刺激分子的细胞内信号转导结构域。适用于在特定实施例中考虑的car的这种共刺激分子的说明性实例包含tlr1、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9、tlr10、card11、cd2、cd7、cd27、cd28、cd30、cd40、cd54(icam)、cd83、cd134(ox40)、cd137(4-1bb)、cd278(icos)、dap10、lat、nkd2c、slp76、trim和zap70。在一个实施例中,car包括一个或多个共刺激信号转导结构域和cd3ζ主要信号转导结构域,所述共刺激信号转导结构域选自由以下组成的群组:cd28、cd137和cd134。在各个实施例中,car包括:结合抗原的细胞外结构域,所述抗原选自由以下组成的群组:bcma、cd19、cspg4、psca、ror1和tag72;从多肽分离的跨膜结构域,所述多肽选自由以下组成的群组:cd4、cd8α、cd154和pd-1;一个或多个从多肽分离的细胞内共刺激信号转导结构域,所述多肽选自由以下组成的群组:cd28、cd134和cd137;和从多肽分离的信号转导结构域,所述多肽选自由以下组成的群组:fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd3ζ、cd22、cd79a、cd79b和cd66d。c.daric受体在特定实施例中,工程化免疫效应细胞包括一种或多种daric受体。如本文使用,术语“daric酶受体”是指多链工程化抗原受体。在一个实施例中,通过在存在编码daric的一种或多种组分的供体修复模板的情况下在一个或多个tcrα等位基因中导入dsb来改造t细胞。在一个特定实施例中,将daric或其一种或多种组分插入单个tcrα等位基因中的dsb中。在一个实施例中,工程化t细胞包括未插入tcrα等位基因的daric,以及免疫抑制信号减弱子、翻转受体、工程化t细胞受体(tcr)的α和/或β链、嵌合抗原受体(car)或daric受体或其组分中的一个或多个,其插入一个或多个tcrα等位基因中的dsb中。daric架构和组分的说明性实例在pct公开第wo2015/017214号和美国专利公开第20150266973号中公开,其各自通过引用整体并入本文。在一个实施例中,供体修复模板包括以下daric组分:信号转导多肽,其包括第一多聚化结构域、第一跨膜结构域和一个或多个细胞内共刺激信号转导结构域和/或主要信号转导结构域;和结合多肽,其包括结合结构域、第二多聚化结构域和任选的第二跨膜结构域。功能性daric包括桥连因子,其促进细胞表面上daric受体复合物的形成,其中桥连因子与信号转导多肽和结合多肽的多聚化结构域缔合并置于其之间。在特定实施例中,第一和第二多聚化结构域与桥连因子缔合,所述桥连因子选自由以下组成的群组:雷帕霉素或其雷帕霉素类似物、库马霉素或其衍生物、赤霉素或其衍生物、脱落酸(aba)或其衍生物、甲氨蝶呤或其衍生物、环孢菌素a或其衍生物、fkcsa或其衍生物、用于fkbp的甲氧苄啶(tmp)-合成配体(slf)或其衍生物、及其任意组合。雷帕霉素类似物(rapalog)的说明性实例包含美国专利第6,649,595中公开的那些,其中雷帕霉素类似物结构通过引用整体并入本文。在某些实施例中,桥连因子是与雷帕霉素相比具有显著降低的免疫抑制作用的雷帕霉素类似物。“显著降低的免疫抑制作用”是指对于等摩尔量的雷帕霉素观察到或预期的至少小于0.1倍至0.005倍的免疫抑制作用的雷帕霉素类似物,如临床上测量或以适当的人免疫抑制活性的体外(例如,t细胞增殖的抑制)或体内替代测量。在一个实施例中,“显著降低的免疫抑制作用”是指雷帕霉素类似物,其在这种体外测定中具有的ec50值比在相同测定中针对雷帕霉素观察到的ec50值大至少10倍至250倍。雷帕霉素类似物的其它说明性实例包含但不限于依维莫司、诺氟莫司、吡美莫司、地磷莫司、他克莫司、替西罗莫司、乌米罗莫司和佐他莫司。在某些实施例中,多聚化结构域将与是雷帕霉素或其雷帕霉素类似物的桥连因子缔合。例如,第一和第二多聚化结构域是选自fkbp和frb的一对。frb结构域是能够与fkbp蛋白和雷帕霉素或其雷帕霉素类似物形成三联复合物的多肽区(蛋白“结构域”)。frb结构域存在于多种天然存在的蛋白质中,包含来自人和其它物种的mtor蛋白(在文献中也称为frap、rapt1或raft);酵母蛋白,包含tor1和tor2;和假丝酵母frap同系物。关于这些蛋白质的核苷酸序列、克隆和其它方面的信息在本领域中是已知的。例如,人mtor的蛋白质序列登录号是基因库登录号l34075.1(brown等人,《自然(nature)》,第369期:第756页,1994年)。适用于本文考虑的特定实施例的frb结构域通常含有至少约85个至约100个氨基酸残基。在某些实施例中,用于本公开的融合蛋白的frb氨基酸序列将包括基于基因库登录号l34075.1的氨基酸序列的93个氨基酸序列ile-2021至lys-2113和t2098l的突变。用于在特定实施例中考虑的daric的frb结构域将能够结合至与雷帕霉素或其雷帕霉素类似物结合的fkbp蛋白的复合物。在某些实施例中,frb结构域的肽序列包括(a)天然存在的肽序列,其至少跨越所示的人mtor的93个氨基酸区或同源蛋白质的相应区域;(b)天然存在的frb的变体,其中缺失、插入或取代了天然存在的肽中至多约十个氨基酸、或约1个至约5个氨基酸或约1个至约3个氨基酸,或在一些实施例中仅缺失、插入或取代了一个氨基酸;或(c)由能够选择性地与编码天然存在的frb结构域的dna分子杂交的核酸分子编码的肽,或者由因为遗传密码的简并性而能够选择性地与编码天然存在的frb结构域的dna分子杂交的dna序列编码的肽。fkbp(fk506结合蛋白)是大环内酯类的细胞溶质受体,例如fk506、fk520和雷帕霉素,其在各物质系(specieslines)中高度保守。fkbp是蛋白质或蛋白结构域,其能够结合至雷帕霉素或其雷帕霉素类似物,并进一步与含有frb的蛋白质或融合蛋白形成三联复合物。fkbp结构域也可以称为“雷帕霉素结合结构域”。关于各种fkbp物质的核苷酸序列、克隆和其它方面的信息是本领域已知的(参见例如staendart等人,《自然(nature)》,第346期:第671页),1990年(人fkbp12);kay,《生物化学杂志(biochem.j.)》,第314期:第361页,1996年)。其它哺乳动物物种、酵母和其它生物体中的同源fkbp蛋白也是本领域已知的,并且可以用于本文公开的融合蛋白中。在特定实施例中考虑的fkbp结构域将能够结合至雷帕霉素或其雷帕霉素类似物并参与含有frb的蛋白质的三联复合物(可以通过任何方式,直接或间接地确定,以检测这种结合)。适用于在特定实施例中考虑的daric的fkbp结构域的说明性实例包含但不限于:天然存在的fkbp肽序列,优选从人fkbp12蛋白(基因库登录号aaa58476.1)或从其分离的肽序列分离,从其它人fkbp分离,从小鼠或其它哺乳动物fkbp分离,或从一些其它动物、酵母或真菌fkbp分离;天然存在的fkbp序列的变体,其中缺失、插入或取代了天然存在的肽中至多约十个氨基酸、或约1个至约5个氨基酸或约1个至约3个氨基酸,或在一些实施例中仅缺失、插入或取代了一个氨基酸;或由能够选择性地与编码天然存在的fkbp的dna分子杂交的核酸分子编码的肽序列,或者由因为遗传密码的简并性而能够选择性地与编码天然存在的fkbp的dna分子杂交的dna序列编码的肽序列。适用于在特定实施例中考虑的daric的多聚化结构域对的其它说明性实例包含但不限于包含fkbp和frb、fkbp和钙调神经蛋白、fkbp和亲环蛋白、fkbp和细菌性dhfr、钙调神经蛋白和亲环蛋白、pyl1和abi1、或gib1和gai、或其变体。在其它实施例中,抗桥连因子阻断信号转导多肽和结合多肽与桥连因子的缔合。例如,环孢菌素或fk506可以用作抗桥连因子以滴定雷帕霉素,因此停止信号转导,因为仅结合一个多聚化结构域。在某些实施例中,抗桥连因子(例如环孢菌素、fk506)是免疫抑制剂。例如,免疫抑制抗桥连因子可以用于阻断或最小化在特定实施例中考虑的daric组分的功能,同时抑制或阻断临床环境中不期望的或病理性的炎性反应。在一个实施例中,第一多聚化结构域包括frbt2098l,第二多聚化结构域包括fkbp12,并且桥连因子是雷帕霉素类似物ap21967。在另一个实施例中,第一多聚化结构域包括frb,第二多聚化结构域包括fkbp12,并且桥连因子是雷帕霉素、替西罗莫司或依维莫司。在特定实施例中,信号转导多肽,第一跨膜结构域,结合多肽包括第二跨膜结构域或gpi锚。第一和第二跨膜结构域的说明性实例从多肽分离,所述多肽独立地选自由以下组成的群组:cd3δ、cd3ε、cd3γ、cd3ζ、cd4、cd5、cd8α、cd9、cd16、cd22、cd27、cd28、cd33、cd37、cd45、cd64、cd80、cd86、cd134、cd137、cd152、cd154和pd-1。在一个实施例中,信号转导多肽包括一个或多个细胞内共刺激信号转导结构域和/或主要信号转导结构域。适用于在特定实施例中考虑的daric信号转导组分的主要信号转导结构域的说明性实例包含衍生自fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd3ζ、cd22、cd79a、cd79b和cd66d的那些。在特别优选的实施例中,daric信号转导组分包括cd3ζ主要信号转导结构域和一个或多个共刺激信号转导结构域。细胞内主要信号转导和共刺激信号转导结构域可以以任何顺序与跨膜结构域的羧基末端串联连接。适用于在特定实施例中考虑的daric信号转导组分的这种共刺激分子的说明性实例包含tlr1、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9、tlr10、card11、cd2、cd7、cd27、cd28、cd30、cd40、cd54(icam)、cd83、cd134(ox40)、cd137(4-1bb)、cd278(icos)、dap10、lat、nkd2c、slp76、trim和zap70。在一个实施例中,daric信号转导组分包括一个或多个共刺激信号转导结构域和cd3ζ主要信号转导结构域,所述共刺激信号转导结构域选自由以下组成的群组:cd28、cd137和cd134;。在特定实施例中,daric结合组分包括结合结构域。在一个实施例中,结合结构域是抗体或其抗原结合片段。抗体或其抗原结合片段包括至少轻链或重链免疫球蛋白可变区,其特异性识别并结合靶抗原的表位,例如肽、脂质、多糖或含有抗原决定簇的核酸,例如免疫细胞识别的那些。抗体包含抗原结合片段,例如,骆驼ig(骆驼科动物抗体或其vhh片段)、ignar、fab片段、fab′片段、f(ab)′2片段、f(ab)′3片段、fv、单链fv抗体(“scfv”)、bis-scfv、(scfv)2、微抗体、双抗体、三抗体、四抗体、二硫键稳定的fv蛋白(“dsfv”)和单结构域抗体(sdab,纳米抗体)或其其它抗体片段。该术语还包含基因改造形式,例如嵌合抗体(例如,人源化小鼠抗体)、异源缀合抗体(例如,双特异性抗体)及其抗原结合片段。还参见《皮尔斯目录和手册(piercecatalogandhandbook)》,1994年-1995年(piercechemicalco.,罗克福德,伊利诺伊);kuby,j.,《免疫学(immunology)》,第三版,w.h.freeman&co.,纽约,1997年。在一个优选的实施例中,结合结构域是scfv。在另一个优选的实施例中,结合结构域是骆驼科动物抗体。在特定实施例中,daric结合组分包括结合抗原的细胞外结构域,所述抗原选自由以下组成的群组:α叶酸受体、5t4、αvβ6整联蛋白、bcma、b7-h3、b7-h6、caix、cd16、cd19、cd20、cd22、cd30、cd33、cd44、cd44v6、cd44v7/8、cd70、cd79a、cd79b、cd123、cd138、cd171、cea、cspg4、egfr,包含erbb2的egfr家族(her2)、egfrviii、egp2、egp40、epcam、epha2、epcam、fap、胎achr、frα、gd2、gd3、磷脂酰肌醇蛋白聚糖-3(gpc3)、hla-a1+mage1、hla-a2+mage1、hla-a3+mage1、hla-a1+ny-eso-1、hla-a2+ny-eso-1、hla-a3+ny-eso-1、il-11rα、il-13rα2、λ、路易斯y、κ、间皮蛋白、muc1、muc16、ncam、nkg2d配体、ny-eso-1、prame、psca、psma、ror1、ssx、存活蛋白、tag72、tem、vegfr2和wt-1。在一个实施例中,daric结合组分包括细胞外结合结构域,例如抗体或其抗原结合片段,其结合mhc-肽复合物,例如i类mhc-肽复合物或ii类mhc-肽复合物。在特定实施例中,本文考虑的daric组分包括连接两个蛋白质、多肽、肽、结构域、区域或基序的连接子或间隔区。在某些实施例中,连接子包括约2个至约35个氨基酸、或约4个至约20个氨基酸、或约8个至约15个氨基酸或约15个至约25个氨基酸。在其它实施例中,间隔区可以具有特定结构,例如抗体ch2ch3结构域、铰链结构域等。在一个实施例中,间隔区包括igg1、igg4或igd的ch2和ch3结构域。在特定实施例中,本文考虑的daric组分包括一个或多个“铰链结构域”,其在定位结构域方面起作用以实现适当的细胞/细胞接触、抗原结合和活化。daric可以在结合结构域和多聚化结构域和/或跨膜结构域(tm)之间或在多聚化结构域和跨膜结构域之间包括一个或多个铰链结构域。铰链结构域可以源自天然、合成、半合成或重组来源。铰链结构域可以包含天然存在的免疫球蛋白铰链区或改变的免疫球蛋白铰链区的氨基酸序列。在特定实施例中,铰链是cd8α铰链或cd4铰链。在一个实施例中,daric包括信号转导多肽,其包括frbt2098l的第一多聚化结构域、cd8跨膜结构域、4-1bb共刺激结构域和cd3ζ主要信号转导结构域;结合多肽包括结合cd19的scfv、fkbp12的第二多聚化结构域和cd4跨膜结构域;并且桥连因子是雷帕霉素类似物ap21967。在一个实施例中,daric包括信号转导多肽,其包括frb的第一多聚化结构域、cd8跨膜结构域、4-1bb共刺激结构域和cd3ζ主要信号转导结构域;结合多肽包括结合cd19的scfv,fkbp12的第二多聚化结构域和cd4跨膜结构域;并且桥连因子是雷帕霉素、替西罗莫司或依维莫司。d.zetakine在特定实施例中,本文考虑的工程化免疫效应细胞包括一种或多种嵌合细胞因子受体。在一个实施例中,通过在存在编码car的供体修复模板的情况下在一个或多个tcrα等位基因中导入dsb来改造t细胞。在一个特定实施例中,嵌合细胞因子受体插入单个tcrα等位基因中的dsb中。在一个实施例中,本文考虑的工程化t细胞包括未插入tcrα等位基因的嵌合细胞因子受体,以及免疫抑制信号减弱子、翻转受体、工程化t细胞受体(tcr)的α和/或β链、嵌合抗原受体(car)、daric受体或其组分或嵌合细胞因子受体中的一个或多个,其插入一个或多个tcrα等位基因中的dsb中。在各个实施例中,基因组编辑的t细胞表达将细胞毒性重定向至肿瘤细胞的嵌合细胞因子受体。zetakine是嵌合跨膜免疫受体,其包括细胞外结构域、跨膜区和细胞内信号转导结构域,所述细胞外结构域包括与能够将细胞外结构域连接至细胞表面的支持区连接的可溶性受体配体。当在t淋巴细胞表面表达时,zetakine将t细胞活性定向至那些表达可溶性受体配体的特异性受体的细胞。zetakine嵌合免疫受体对t细胞的抗原特异性进行重定向,应用于多种癌症的治疗,特别是通过人恶性肿瘤利用的自分泌/旁分泌细胞因子系统。在特定实施例中,嵌合细胞因子受体包括:免疫抑制细胞因子或其细胞因子受体结合变体、连接子、跨膜结构域和细胞内信号转导结构域。在特定实施例中,细胞因子或其细胞因子受体结合变体选自由以下组成的群组:白细胞介素-4(il-4)、白细胞介素-6(il-6)、白细胞介素-8(il-8)、白细胞介素-10(il-10)和白细胞介素-13(il-13)。在某些实施例中,连接子包括ch2ch3结构域、铰链结构域等。在一个实施例中,连接子包括igg1、igg4或igd的ch2和ch3结构域。在一个实施例中,连接子包括cd8α或cd4铰链结构域。在特定实施例中,跨膜结构域选自由以下组成的群组:t细胞受体的α或β链、cd3δ、cd3ε、cd3γ、cd3ζ、cd4、cd5、cd8α、cd9、cd16、cd22、cd27、cd28、cd33、cd37、cd45、cd64、cd80、cd86、cd134、cd137、cd152、cd154和pd-1。在特定实施例中,细胞内信号转导结构域选自由以下组成的群组:含有主要信号转导结构域和/或共刺激结构域的itam。在特定实施例中,细胞内信号转导结构域选自由以下组成的群组:fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd3ζ、cd22、cd79a、cd79b和cd66d。在特定实施例中,细胞内信号转导结构域选自由以下组成的群组:tlr1、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9、tlr10、card11、cd2、cd7、cd27、cd28、cd30、cd40、cd54(icam)、cd83、cd134(ox40)、cd137(4-1bb)、cd278(icos)、dap10、lat、nkd2c、slp76、trim和zap70。在一个实施例中,嵌合细胞因子受体包括一个或多个共刺激信号转导结构域和cd3ζ主要信号转导结构域,所述共刺激信号转导结构域选自由以下组成的群组:cd28、cd137和cd134。e.基因组编辑的细胞通过在特定实施例中考虑的方法制造的基因组编辑的细胞提供了改进的过继性细胞治疗组合物。不希望受任何特定理论的束缚,据信通过本文考虑的方法制造的基因组编辑的免疫效应细胞具有优异的性质,包括提高的、改进的体内安全性、疗效和耐久性。在各个实施例中,基因组编辑的细胞包括免疫效应细胞,例如t细胞,其具有通过本文考虑的组合物和方法编辑的一个或多个tcrα等位基因。在特定实施例中,编辑t细胞群中tcrα等位基因的方法包括活化t细胞群并刺激t细胞群增殖;将工程化核酸酶导入t细胞群;用一种或多种包括供体修复模板的载体转导t细胞群;其中工程化核酸酶的表达在tcrα等位基因的靶位点产生双链断裂,并且在双链断裂(dsb)位点通过同源定向修复(hdr)将供体修复模板掺入tcrα等位基因中。在特定实施例中考虑的基因组编辑的t细胞可以是自体的(autologous/autogeneic)(“自身的”)或非自体的(“非自身的”,例如同种异体的、同源的或异种的)。如本文使用,“自体的”是指来自相同受试者的细胞。如本文使用,“同种异体的”是指相同物种的与比较细胞在遗传学上不同的的细胞。如本文使用,“同源的”是指不同受试者的与比较细胞在遗传学相同的细胞。如本文使用,“异种的”是指与比较细胞不同的物种的细胞。在优选的实施例中,t细胞获自哺乳动物受试者。在一个更优选的实施例中,t细胞获自灵长类动物受试者。在最优选的实施例中,t细胞获自人类受试者。t细胞可以从多种来源获得,包含但不限于外周血单核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、来自感染部位的组织、腹水、胸腔积液、脾脏组织或肿瘤。在某些实施例中,t细胞可以使用任意数量的本领域技术人员已知的技术(诸如沉降,例如ficolltm分离)从受试者采集的血液单位获得。在特定实施例中,使包括t细胞(例如,pbmc)的细胞群经受本文考虑的基因组编辑组合物和方法。在其它实施例中,使用分离的或纯化的t细胞群。可以通过裂解红细胞和剔除单核细胞从外周血单核细胞(pbmc)分离细胞,例如通过percolltm梯度离心。在一些实施例中,在分离pbmc后,可以在活化、扩增和/或遗传修饰之前或之后将细胞毒性和辅助性t淋巴细胞分选为幼稚、记忆和效应t细胞亚群。表达以下标志物(cd3、cd4、cd8、cd28、cd45ra、cd45ro、cd62、cd127和hla-dr)中的一种或多种的特异性t细胞亚群可以通过阳性或阴性选择技术进一步分离。在一个实施例中,表达标志物(选自由以下组成的群组:cd62l、ccr7、cd28、cd27、cd122、cd127、cd197;或cd38或cd62l、cd127、cd197和cd38)中的一种或多种的特异性t细胞亚群通过阳性或阴性选择技术进一步分离。在各个实施例中,制造的t细胞组合物不表达或基本上不表达以下标志物中的一种或多种:cd57、cd244、cd160、pd-1、ctla4、tim3和lag3。在一个实施例中,分离的或纯化的t细胞群表达一种或多种标志物,包含但不限于cd3+、cd4+、cd8+或其组合在某些实施例中,t细胞从个体分离,并首先在进行基因组编辑之前被活化并刺激以体外增殖。为了获得足够治疗剂量的t细胞组合物,t细胞通常经历一轮或多轮刺激、活化和/或扩增。t细胞通常可以使用例如美国专利6,352,694;6,534,055;6,905,680;6,692,964;5,858,358;6,887,466;6,905,681;7,144,575;7,067,318;7,172,869;7,232,566;7,175,843;5,883,223;6,905,874;6,797,514;和6,867,041中所述的方法进行活化和扩增,所述美国专利各自通过引用整体并入本文。在特定实施例中,在将基因组编辑组合物导入t细胞之前,将t细胞活化并扩增约1天至约4天、约1天至约3天、约1天至约2天、约2天至约3天、约2天至约4天、约3天至约4天、或约1天、约2天、约3天或约4天。在特定实施例中,在将基因组编辑组合物导入t细胞之前,将t细胞活化并扩增约6小时、约12小时、约18小时或约24小时。在一个实施例中,在将基因组编辑组合物导入t细胞的同时活化t细胞。在一个实施例中,共刺激配体存在于抗原呈递细胞(例如,aapc、树突细胞、b细胞等)上,其特异性结合t细胞上的同源共刺激分子,从而提供除通过例如tcr/cd3复合物的结合提供的主要信号之外的信号,该信号介导所需的t细胞反应。合适的共刺激配体包含但不限于cd7、b7-1(cd80)、b7-2(cd86)、4-1bbl、ox40l、可诱导共刺激配体(icos-l)、细胞间粘附分子(icam)、cd30l、cd40、cd70、cd83、hla-g、mica、micb、淋巴毒素β受体、ilt3、ilt4、结合toll配体受体的激动剂或抗体、以及与b7-h3特异性结合的配体。在一个特定实施例中,共刺激配体包括特异性结合至t细胞上存在的共刺激分子的抗体或其抗原结合片段,包含但不限于cd27、cd28、4-ibb、ox40、cd30、cd40、icos、淋巴细胞功能相关抗原-1(lfa-1)、cd7、light、nkg2c、b7-h3和与cd83特异性结合的配体。合适的共刺激配体进一步包含靶抗原,其可以以可溶形式提供或在apc或aapc上表达,所述apc或aapc结合在基因组编辑的t细胞上表达的工程化抗原受体。在各个实施例中,编辑t细胞基因组的方法包括活化包括t细胞的细胞群并扩增t细胞群。t细胞活化可以通过提供通过t细胞tcr/cd3复合物或通过刺激cd2表面蛋白的主要刺激信号,并通过辅助分子(例如,cd28)提供辅助共刺激信号来实现。可以通过使t细胞与合适的cd3结合剂(例如,cd3配体或抗cd3单克隆抗体)接触来刺激tcr/cd3复合物。cd3抗体的说明性实例包含但不限于okt3、g19-4、bc3和64.1。在另一个实施例中,cd2结合剂可以用于向t细胞提供主要刺激信号。cd2结合剂的说明性实例包含但不限于cd2配体和抗cd2抗体,例如t11.3抗体与t11.1或t11.2抗体的组合(meuer,s.c.等人(1984年),《细胞(cell)》,第36期:第897-906页)和9.6抗体(其识别与ti1.1相同的表位)与9-1抗体的组合(yang,s.y.等人(1986年),《免疫学杂志(j.immunol.)》,第137期:第1097-1100页)。也可以使用结合至与任何上述抗体相同的表位的其它抗体。可以通过本文其它地方公开的标准技术制备和标识额外的抗体或抗体组合。除了通过tcr/cd3复合物或通过cd2提供的主要刺激信号之外,t细胞反应的诱导需要第二种共刺激信号。在特定实施例中,可以使用cd28结合剂提供共刺激信号。cd28结合剂的说明性实例包含但不限于:天然cd28配体,例如cd28的天然配体(例如,b7蛋白家族的成员,诸如b7-1(cd80)和b7-2(cd86);和能够交联cd28分子的抗cd28单克隆抗体或其片段,例如单克隆抗体9.3、b-t3、xr-cd28、kolt-2、15e8、248.23.2和ex5.3d10。在一个实施例中,提供主要刺激信号的分子(例如,通过tcr/cd3复合物或cd2提供刺激的分子)和共刺激分子偶联于同一表面。在某些实施例中,提供刺激和共刺激信号的结合剂位于细胞表面上。这可以通过用编码结合剂的核酸以适于其在细胞表面上表达的形式转染或转导细胞,或者可替代地通过将结合剂偶联到细胞表面来实现。在另一个实施例中,提供主要刺激信号的分子(例如,通过tcr/cd3复合物或cd2提供刺激的分子)和共刺激分子在抗原呈递细胞上展示。在一个实施例中,提供主要刺激信号的分子(例如,通过tcr/cd3复合物或cd2提供刺激的分子)和共刺激分子提供在分开的表面上。在某个实施例中,提供刺激和共刺激信号的结合剂之一是可溶的(在溶液中提供),而另一试剂在一个或多个表面上提供。在一个特定实施例中,提供刺激和共刺激信号的结合剂均以可溶形式提供(在溶液中提供)。在各个实施例中,本文考虑的t细胞基因组编辑方法包括用抗cd3和抗cd28抗体活化t细胞。在一个实施例中,扩增通过本文考虑的方法活化的t细胞进一步包括培养包括t细胞的细胞群数小时(约3小时)至约7天至约28天或其间的任何小时整数值。在另一个实施例中,可以培养t细胞组合物14天。在一个特定实施例中,培养t细胞约21天。在另一个实施例中,培养t细胞组合物约2至3天。还可能需要几个刺激/活化/扩增循环,使得t细胞的培养时间可以是60天或更长。在特定实施例中,适合t细胞培养的条件包含合适的培养基(例如,最小必需培养基或rpmi培养基1640或x-vivo15,(lonza))以及增殖和存活所必需的一种或多种因子,包含但不限于血清(如胎牛或人血清)、白细胞介素-2(il-2)、胰岛素、ifn-γ、il-4、il-7、il-21、gm-csf、il-10、il-12、il-15、tgfβ和tnf-α或本领域技术人员已知的适用于细胞生长的任何其它添加剂。细胞培养基的另外的说明性实例包含但不限于rpmi1640、click、aim-v、dmem、mem、a-mem、f-12、x-vivo15和x-vivo20、optimizer,添加氨基酸、丙酮酸钠和维生素,无血清或补充适量的血清(或血浆)或一组确定的激素和/或足以用于t细胞生长和扩增的一定量的细胞因子。抗生素,例如青霉素和链霉素,仅包含在实验培养物中,而不包含在要注入受试者的细胞培养物中。将靶细胞维持在支持生长所需的条件下,例如适当的温度(例如37℃)和大气(例如空气加5%co2)。在特定实施例中,在具有适当细胞因子(例如,il-2、il-7和/或il-15)的培养基中,使pbmc或分离的t细胞与刺激剂和共刺激剂(例如,通常附着于珠子或其它表面的抗cd3和抗cd28抗体)接触。在其它实施例中,使用通过改造k562、u937、721.221、t2和c1r细胞制造的人工apc(aapc)定向各种共刺激分子和细胞因子的稳定表达和分泌。在特定实施例中,使用k32或u32aapc定向一种或多种基于抗体的刺激分子在aapc细胞表面上的展示。t细胞群可以通过表达多种共刺激分子的aapc扩增,所述共刺激分子包含但不限于cd137l(4-1bbl)、cd134l(ox40l)和/或cd80或cd86。最后,aapc提供了扩增遗传修饰的t细胞和维持cd8t细胞上cd28表达的有效平台。wo03/057171和us2003/0147869中提供的aapc通过引用整体并入本文。在各个实施例中,用于编辑t细胞中tcrα等位基因的方法包括将本文考虑的一种或多种工程化核酸酶导入t细胞群中。在一个实施例中,在活化和刺激之前将本文考虑的一种或多种核酸酶导入t细胞中。在另一个实施例中,在刺激t细胞的同时将本文考虑的一种或多种核酸酶导入t细胞中。在一个优选的实施例中,在t细胞活化和刺激之后,例如约1天、2天、3天或4天后,将本文考虑的一种或多种核酸酶导入t细胞中。在特定实施例中导入t细胞中的核酸酶包含但不限于核酸内切酶,例如大范围核酸酶、megatal、talen、zfn或crispr/cas核酸酶;和任选的末端加工核酸酶或其生物活性片段,例如5′-3′核酸外切酶、5′-3′碱性核酸外切酶、3′-5′核酸外切酶(例如,trex2)、5′瓣状核酸内切酶、解旋酶或模板非依赖性dna聚合酶活性。核酸内切酶和末端加工核酸酶可以表达为融合蛋白,可以从多顺反子mrna表达或者从一个或多个表达盒独立表达。在特定实施例中,使用载体将一种或多种核酸酶导入t细胞中。在其它实施例中,优选将一种或多种核酸酶作为mrna导入t细胞中。可以通过显微注射、转染、脂质转染、热休克、电穿孔、转导、基因枪、显微注射、deae-葡聚糖介导的转移等将核酸酶导入t细胞中。在特定实施例中考虑的基因组编辑方法包括将本文考虑的一种或多种工程化核酸酶导入活化和刺激的t细胞群中以在靶位点产生dsb,随后将一种或多种供体修复模板导入t细胞群中,其将通过同源重组掺入dsb位点的细胞基因组中。在一个特定实施例中,将包括编码免疫抑制信号减弱子、翻转受体、工程化t细胞受体(tcr)的α和/或β链、嵌合抗原受体(car)或daric受体或其组分的多核苷酸的一种或多种供体模板导入t细胞群中。可以通过显微注射、转染、脂质转染、热休克、电穿孔、转导、基因枪、显微注射、deae-葡聚糖介导的转移等将供体模板导入t细胞中。在一个优选的实施例中,通过mrna电穿孔将一种或多种核酸酶导入t细胞中,并通过病毒转导将一种或多种供体修复模板导入t细胞中。在另一个优选的实施例中,通过mrna电穿孔将一种或多种核酸酶导入t细胞中,并通过aav转导将一种或多种供体修复模板导入t细胞中。aav载体可以包括来自aav2的itr,和来自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9或aav10中任一种的血清型。在优选的实施例中,aav载体可以包括来自aav2的itr和来自aav6的血清型。在另一个优选的实施例中,通过mrna电穿孔将一种或多种核酸酶导入t细胞中,并通过慢病毒转导将一种或多种供体修复模板导入t细胞中。慢病毒载体骨架可以衍生自hiv-1、hiv-2、维斯纳-梅依迪病毒(vmv)病毒、山羊关节炎-脑炎病毒(caev)、马传染性贫血病毒(eiav)、猫免疫缺陷病毒(fiv)、牛免疫缺陷病毒(biv)或猿猴免疫缺陷病毒(siv)。可以在将一种或多种工程化核酸酶导入细胞之前、与其同时或在其之后递送一种或多种供体修复模板。在某些实施例中,一种或多种供体修复模板与一种或多种工程化核酸酶同时递送。在其它实施例中,在一种或多种工程化核酸酶之前递送一种或多种供体修复模板,例如,在一种或多种供体修复模板之前数秒至数小时至数天,包含但不限于在一种或多种工程化核酸酶之前约1分钟至约30分钟、约1分钟至约60分钟、约1分钟至约90分钟、约1小时至约24小时,或在一种或多种工程化核酸酶之前多于24小时。在某些实施例中,在核酸酶之后递送一种或多种供体修复模板,优选在约1小时、2小时、3小时、4小时、5小时、6小时、7小时或8小时内递送;更优选地,在约1小时、2小时、3小时或4小时内;或更优选地,在约4小时内。可以使用与一种或多种工程化核酸酶相同的递送系统递送一种或多种供体修复模板。作为非限制性实例,当同时递送时,供体修复模板和工程化核酸酶可以由相同的载体编码,例如idlv慢病毒载体或aav载体(例如,aav6)。在特定优选的实施例中,通过mrna电穿孔递送工程化核酸酶,并通过用aav载体转导递送供体修复模板。在特定实施例中,当使用crispr/cas核酸酶系统修饰t细胞中的tcrα等位基因时,通过mrna电穿孔将cas核酸酶导入t细胞中,并通过用idlv慢病毒载体或aav载体转导来递送编码在基因组中待编辑的位点附近结合的tracrrna:crrna或sgrna的表达盒和供体修复模板。在特定实施例中,当使用crispr/cas核酸酶系统修饰t细胞中的tcrα等位基因时,通过mrna电穿孔将cas核酸酶和在基因组中待编辑的位点附近结合的tracrrna:crrna或sgrna导入t细胞中,并通过用idlv慢病毒载体或aav载体转导来递送供体修复模板。在一个实施例中,tracrrna:crrna或sgrna是化学合成的rna,其具有化学保护的5和3′末端。在另一个实施例中,cas9作为与化学合成的tracrrna:crrna或sgrna复合的蛋白质递送。在各个实施例中,编辑免疫效应细胞的方法包括使细胞与刺激cd3tcr复合物相关信号的试剂和刺激t细胞表面上的共刺激分子的配体接触。在特定实施例中,编辑免疫效应细胞的方法包括在具有适当细胞因子(例如,il-2、il-7和/或il-15)的培养基中,使细胞与刺激剂和共刺激剂接触,例如可溶性抗cd3和抗cd28抗体,或附着于珠子或其它表面的抗体。在特定实施例中,编辑免疫效应细胞的方法包括在具有适当细胞因子(例如,il-2、il-7和/或il-15)和/或一种或多种调节pi3k/akt/mtor细胞信号转导途径的试剂的培养基中,使细胞与刺激剂和共刺激剂接触,例如可溶性抗cd3和抗cd28抗体,或附着于珠子或其它表面的抗体。如本文使用,术语“akt抑制剂”是指抑制akt的至少一种活性的核酸、肽、化合物或小有机分子。术语“mtor抑制剂”或“抑制mtor的试剂”是指抑制mtor蛋白的至少一种活性的核酸、肽、化合物或小有机分子,所述活性诸如例如在其至少一种底物上的丝氨酸/苏氨酸蛋白激酶活性(例如,p70s6激酶1、4e-bp1、akt/pkb和eef2)。在特定实施例中,编辑免疫效应细胞的方法包括在具有适当细胞因子(例如,il-2、il-7和/或il-15)和/或一种或多种调节pi3k细胞信号转导途径的试剂的培养基中,使细胞与刺激剂和共刺激剂接触,例如可溶性抗cd3和抗cd28抗体,或附着于珠子或其它表面的抗体。如本文使用,术语“pi3k抑制剂”是指结合至并抑制pi3k的至少一种活性的核酸、肽、化合物或小有机分子。pi3k蛋白可分为三类,1类pi3k、2类pi3k和3类pi3k。1类pi3k作为异二聚体存在,由四个p110催化亚单位(p110α、p110β、p110δ和p110γ)中的一个和两个调节亚单位家族中的一个组成。在特定实施例中,pi3k抑制剂靶向1类pi3k抑制剂。在一个实施例中,pi3k抑制剂将显示对1类pi3k抑制剂的一种或多种同种型的选择性(即,对p110α、p110β、p110δ和p110γ或p110α、p110β、p110δ和p110γ中的一种或多种的选择性)。另一方面,pi3k抑制剂不显示同种型选择性并被认为是“泛pi3k抑制剂”。在一个实施例中,pi3k抑制剂将竞争与atp结合至pi3k催化结构域。在某些实施例中,pi3k抑制剂可以例如靶向pi3k以及pi3k-akt-mtor途径中的其它蛋白质。在特定实施例中,靶向mtor和pi3k的pi3k抑制剂可以被称为mtor抑制剂或pi3k抑制剂。仅靶向pi3k的pi3k抑制剂可以被称为选择性pi3k抑制剂。在一个实施例中,选择性pi3k抑制剂可以被理解为是指一种试剂,其表现出的相对于pi3k的50%抑制浓度低于抑制剂相对于mtor和途径中的其它蛋白质的ic50至少10倍、至少20倍、至少30倍、至少50倍、至少100倍、至少1000倍或更多倍。在一个特定实施例中,示例性pi3k抑制剂抑制pi3k,其ic50(抑制50%活性的浓度)为约200nm或更低、优选约100nm或更低、甚至更优选约60nm或更低、约25nm、约10nm、约5nm、约1nm、100μm、50μm、25μm、10μm、1μm或更低。在一个实施例中,pi3k抑制剂抑制pi3k,其ic50为约2nm至约100nm、更优选约2nm至约50nm、甚至更优选约2nm至约15nm。适用于在特定实施例中考虑的t细胞制造方法的pi3k抑制剂的说明性实例包含但不限于bkm120(1类pi3k抑制剂,novartis)、xl147(1类pi3k抑制剂,exelixis)、(泛pi3k抑制剂,glaxosmithkline)和px-866(1类pi3k抑制剂;p110α、p110β和p110γ同种型,oncothyreon)。选择性pi3k抑制剂的其它说明性实例包含但不限于byl719、gsk2636771、tgx-221、as25242、cal-101、zstk474和ipi-145。泛pi3k抑制剂的另外的说明性实例包含但不限于bez235、ly294002、gsk1059615、tg100713和gdc-0941。在一个优选的实施例中,pi3k抑制剂是zstk474。在一个实施例中,与在没有pi3k抑制剂的情况下培养的t细胞群相比,标志物(其选自由以下组成的群组:i)cd62l、cd127、cd197和cd38或ii)cd62l、cd127、cd27和cd8)中的一种或多种的表达增加至少1.5倍、至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少25倍或更多倍。在一个实施例中,t细胞包括cd8+t细胞。在一个实施例中,与用pi3k抑制剂培养的t细胞群相比,标志物(其选自由以下组成的群组:cd57、cd244、cd160、pd-1、ctla4、tim3和lag3)中的一种或多种的表达降低至少1.5倍、至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少25倍或更多倍。在一个实施例中,t细胞包括cd8+t细胞。在一个实施例中,本文考虑的制造方法增加了包括幼稚t细胞或发育能力强的t细胞的一种或多种标志物的t细胞的数量。不希望受任何特定理论的束缚,本发明人认为,用一种或多种pi3k抑制剂培养包括t细胞的细胞群导致发育能力强的t细胞的扩增,并提供相较于现有t细胞疗法更稳健且有效的过继性t细胞免疫疗法。在使用在特定实施例中考虑的方法制造的t细胞中增加的幼稚t细胞或发育能力强的t细胞的标志物的说明性实例包含但不限于i)cd62l、cd127、cd197和cd38或ii)cd62l、cd127、cd27和cd8。在特定实施例中,幼稚t细胞不表达不表达或基本上不表达以下标志物中的一种或多种:cd57、cd244、cd160、pd-1、btla、cd45ra、ctla4、tim3和lag3。关于t细胞,由在特定实施例中考虑的各种扩增方法产生的t细胞群可以具有多种特定表型特性,这取决于所使用的条件。在各个实施例中,扩增的t细胞群包括一种或多种以下表型标志物:cd62l、cd27、cd127、cd197、cd38、cd8和hla-dr。在一个实施例中,此类表型标志物包含cd62l、cd127、cd197和cd38中的一种或多种或全部的增强的表达。在特定实施例中,扩增了以包含cd62l、cd127、cd197和cd38的幼稚t细胞的表型标志物的表达为特征的cd8+t淋巴细胞。在一个实施例中,这种表型标志物包含cd62l、cd127、cd27和cd8中的一种或多种或全部的增强的表达。在特定实施例中,扩增了以包含cd62l、cd127、cd27和cd8的幼稚t细胞的表型标志物的表达为特征的cd8+t淋巴细胞。在特定实施例中,扩增了以包含cd45ro、cd62l、cd127、cd197和cd38的中枢记忆t细胞的表型标志物的表达为特征并且对于粒酶b呈阴性的t细胞。在一些实施例中,中枢记忆t细胞是cd45ro+、cd62l+、cd8+t细胞。在某些实施例中,扩增了以包含cd62l的幼稚cd4+细胞的表型标志物的表达为特征并且对于cd45ra和/或cd45ro的表达呈阴性的cd4+t淋巴细胞。在一些实施例中,cd4+细胞的特征在于包含cd62l的中枢记忆cd4+细胞的表型标志物的表达并且为cd45ro阳性。在一些实施例中,效应cd4+细胞是cd62l阳性和cd45ro阴性。在特定实施例中,通过在存在刺激剂和共刺激剂(例如,抗cd3和抗cd28抗体)和pi3k抑制剂的情况下活化和刺激细胞来编辑免疫效应细胞。在活化和刺激后约1天、2天、3天、4天或5天后,将本文考虑的一种或多种核酸酶导入细胞中。在特定实施例中,在将一种或多种核酸酶导入细胞后约1小时、2小时、3小时、4小时、5小时、6小时、7小时或8小时,用编码供体修复模板的载体转导细胞。在特定实施例中,pi3k抑制剂存在于整个编辑过程中,并且在其它实施例中,pi3k在活化、刺激和扩增期间存在。在一个实施例中,pi2k抑制剂仅在扩增期间存在。f.多肽本文考虑了各种多肽,包含但不限于大范围核酸酶、megatal、talen、zfn、cas核酸酶、末端加工核酸酶、免疫效力增强子、免疫抑制信号减弱子、工程化抗原受体、治疗性多肽、融合多肽和表达多肽的载体。在优选的实施例中,多肽包括seqidno:2、5-7和11中给出的氨基酸序列。除非另有相反的说明,否则“多肽”、“多肽片段”、“肽”和“蛋白质”可互换使用,并且根据常规含义,即用作为氨基酸的序列。在一个实施例中,“多肽”包含融合多肽和其它变体。可以使用各种熟知的重组和/或合成技术中的任意一种制备多肽。多肽不限于特定长度,例如,它们可以包括全长蛋白质序列、全长蛋白质片段或融合蛋白,并且可以包含多肽的翻译后修饰(例如,糖基化、乙酰化、磷酸化等)以及本领域已知的其它修饰(包括天然存在的和非天然存在的)。如本文使用,“分离的肽”或“分离的多肽”等是指从细胞环境以及从与细胞的其它组分的缔合体外分离和/或纯化肽或多肽分子,即它与体内物质没有显著关联。在特定实施例中考虑的多肽的说明性实例包含但不限于大范围核酸酶、megatal、talen、zfn、cas核酸酶、末端加工核酸酶、免疫抑制信号减弱子、翻转受体、工程化tcr、car、daric、治疗性多肽和融合多肽及其变体。多肽包含“多肽变体”。多肽变体与天然存在的多肽的不同之处可以是一个或多个氨基酸取代、缺失、添加和/或插入。这些变体可以是天然存在的或可以通过合成生成,例如,通过修饰上述多肽序列的一个或多个氨基酸。例如,在特定实施例中,可能需要通过将一个或多个取代、缺失、添加和/或插入导入多肽中来改善工程化核酸酶、免疫抑制信号减弱子、翻转受体、工程化tcr、car、daric等的生物学特性。在特定实施例中,多肽包含与本文考虑的任何参考序列具有至少约65%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的氨基酸同一性的多肽,通常其中变体保持参考序列的至少一种生物活性。多肽变体包含生物活性“多肽片段”。如本文使用,术语“生物活性片段”或“最小生物活性片段”是指保留天然存在的多肽活性的至少100%、至少90%、至少80%、的至少70%、至少60%、至少50%、至少40%、至少30%、至少20%、至少10%或至少5%的多肽片段。多肽片段是指多肽,其可以是单体或多聚体,其具有氨基末端缺失、羧基末端缺失和/或天然存在的多肽或重组产生的多肽的一个或多个氨基酸的内部缺失或取代。在某些实施例中,多肽片段可以包括长度为至少5个至约1700个氨基酸的氨基酸链。应当理解,在某些实施例中,片段的长度为至少5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、31个、32个、33个、34个、35个、36个、37个、38个、39个、40个、41个、42个、43个、44个、45个、46个、47个、48个、49个、50个、55个、60个、65个、70个、75个、80个、85个、90个、95个、100个、110个、150个、200个、250个、300个、350个、400个、450个、500个、550个、600个、650个、700个、750个、800个、850个、900个、950个、1000个、1100个、1200个、1300个、1400个、1500个、1600个、1700个或更多个氨基酸。多肽片段的说明性实例包含dna结合结构域、核酸酶结构域、抗体片段、细胞外配体结合结构域、信号转导结构域、跨膜结构域、多聚化结构域等。如上所述,可以以各种方式改变多肽,包含氨基酸取代、缺失、截短和插入。这种操作的方法通常是本领域已知的。例如,参考多肽的氨基酸序列变体可以通过dna中的突变来制备。诱变和核苷酸序列改变的方法是本领域熟知的。参见例如kunkel(1985年,《美国科学院院报(proc.natl.acad.sci.usa.)》,第82期:第488-492页),kunkel等人,(1987年,《酶学方法(methodsinenzymol)》,第154期:第367-382页),美国专利第4,873,192号,watson,j.d.等人,(《基因分子生物学(molecularbiologyofthegene)》,第四版,benjamin/cummings,门洛帕克,加利福尼亚,1987年)和其中引用的参考文献。关于不影响目标蛋白质的生物活性的适当氨基酸取代的指导可以在dayhoff等人的模型中找到,(1978年)《蛋白质序列和结构地图集(atlasofproteinsequenceandstructure)》(国家生物医学研究基金会,华盛顿特区)。在某些实施例中,变体将含有一个或多个保守取代。“保守取代”是其中一种氨基酸取代具有相似性质的另一种氨基酸,使得肽化学领域的技术人员将预期多肽的二级结构和亲/疏水性质(hydropathicnature)基本上不变。可以在特定实施例中考虑的多核苷酸和多肽的结构中进行修饰,多肽包含具有至少约的多肽并且仍然获得编码具有所需特征的变体或衍生多肽的功能分子。当需要改变多肽的氨基酸序列以产生等同的或甚至改进的变体多肽时,本领域技术人员例如可以改变编码dna序列的一个或多个密码子,例如根据表1。表1-氨基酸密码子可以使用本领域熟知的计算机程序,例如dnastar、dnastrider、geneious、macvector或vectornti软件,找到确定哪些氨基酸残基可以在不消除生物活性的情况下被取代、插入或缺失的指导。优选地,本文公开的蛋白质变体中的氨基酸变化是保守氨基酸变化,即相似带电荷或不带电荷氨基酸的取代。保守氨基酸改变涉及在其侧链中相关的氨基酸家族之一的取代。天然存在的氨基酸通常分为四个家族:酸性(天冬氨酸盐、谷氨酸盐)、碱性(赖氨酸、精氨酸、组氨酸)、非极性(丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、蛋氨酸、色氨酸)、不带电荷极性(甘氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、丝氨酸、苏氨酸、酪氨酸)氨基酸。苯丙氨酸、色氨酸和酪氨酸有时被主要分类为芳香族氨基酸。在肽或蛋白质中,合适的氨基酸保守取代是本领域技术人员已知的,并且通常可以在不改变所得分子的生物活性的情况下进行。本领域技术人员认识到,通常,多肽的非必需区中的单个氨基酸取代基本上不改变生物活性(参见例如watson等人,《基因分子生物学(molecularbiologyofthegene)》,第4版,1987年,thebeniamin/cummingspub.co.,第224页)。在进行这种改变时,可以考虑氨基酸的亲/疏水指数。亲/疏水氨基酸指数在赋予蛋白质相互作用生物学功能方面的重要性通常在本领域中被理解(kyte和doolittle,1982年,通过引用并入本文)。基于其疏水性和电荷特征,每种氨基酸都被赋予了亲/疏水指数(kyte和doolittle,1982年)。这些值是:异亮氨酸(+4.5);缬氨酸(+4.2);亮氨酸(+3.8);苯丙氨酸(+2.8);半胱氨酸/半胱氨酸(+2.5);蛋氨酸(+1.9);丙氨酸(+1.8);甘氨酸(-0.4);苏氨酸(-0.7);丝氨酸(-0.8);色氨酸(-0.9);酪氨酸(-1.3);脯氨酸(-1.6);组氨酸(-3.2);谷氨酸盐(-3.5);谷氨酰胺(-3.5);天冬氨酸盐(-3.5);天冬酰胺(-3.5);赖氨酸(-3.9);和精氨酸(-4.5)。本领域已知某些氨基酸可被具有相似亲/疏水指数或分数的其它氨基酸取代,并仍然产生具有相似生物活性的蛋白质,即仍然获得生物学功能等同的蛋白质。在进行这种改变时,优选其亲/疏水指数在±2内的氨基酸取代,特别优选在±1内的氨基酸取代,甚至更优选在±0.5内的氨基酸取代。本领域还应理解,可以基于亲水性有效地取代相似的氨基酸。如美国专利第4,554,101号中所详述,已为氨基酸残基赋予了以下亲水性值:精氨酸(+3.0);赖氨酸(+3.0);天冬氨酸盐(+3.0+1);谷氨酸盐(+3.0±1);丝氨酸(+0.3);天冬酰胺(+0.2);谷氨酰胺(+0.2);甘氨酸(0);苏氨酸(-0.4);脯氨酸(-0.5±1);丙氨酸(-0.5);组氨酸(-0.5);半胱氨酸(-1.0);蛋氨酸(-1.3);缬氨酸(-1.5);亮氨酸(-1.8);异亮氨酸(-1.8);酪氨酸(-2.3);苯丙氨酸(-2.5);色氨酸(-3.4)。应当理解,一种氨基酸可以取代具有相似亲水性值的另一种氨基酸,并且仍然获得生物学上等同的且特别是免疫学上等同的蛋白质。在这种变化中,优选其亲水性值在±2内的氨基酸取代,特别优选在±1内的氨基酸取代,更特别优选在±0.5内的氨基酸取代。如上所述,氨基酸取代可以基于氨基酸侧链取代基的相对相似性,例如,它们的疏水性、亲水性、电荷、大小等。多肽变体进一步包含糖基化形式,与其它分子的聚集缀合物以及与不相关化学部分(例如,聚乙二醇化分子)的共价缀合物。如本领域已知,可以通过将官能团连接到氨基酸链中或n-或c-末端残基上的基团来制备共价变体。变体还包含等位基因变体、物种变体和突变蛋白。不影响蛋白质功能活性的区域的截短或缺失也是变体。在一个实施例中,当需要表达两种或更多种多肽时,编码它们的多核苷酸序列可以通过ires序列分开,如本文其它地方所公开。在特定实施例中考虑的多肽包含融合多肽。在特定实施例中,提供了融合多肽和编码融合多肽的多核苷酸。融合多肽和融合蛋白是指具有至少两个、三个、四个、五个、六个、七个、八个、九个或十个多肽片段的多肽。在另一个实施例中,两种或更多种多肽可以表达为包括一个或多个本文其它地方公开的自裂解多肽序列的融合蛋白。在一个实施例中,本文考虑的融合蛋白包括一个或多个dna结合结构域和一个或多个核酸酶,以及一个或多个连接子和/或自裂解多肽。在一个实施例中,本文考虑的融合蛋白包括一个或多个外结构域、细胞外配体结合结构域、或抗原结合结构域、跨膜结构域、和/或一个或多个细胞内信号转导结构域、和任选的一个或多个多聚化结构域。在特定实施例中考虑的融合蛋白的说明性实例,多肽包含具有至少约的多肽,包含但不限于:megatal、talen、zfn、cas核酸酶、末端加工核酸酶、免疫效力增强子、免疫抑制信号减弱子、工程化抗原受体和其它多肽。融合多肽可以包括一个或多个多肽结构域或片段,包含但不限于信号肽、细胞渗透肽结构域(cpp)、dna结合结构域、核酸酶结构域、染色质重塑结构域、组蛋白修饰结构域、表观遗传修饰结构域、外结构域、细胞外配体结合结构域、抗原结合结构域、跨膜结构域、细胞内信号转导结构域、多聚化结构域、表位标签(例如,麦芽糖结合蛋白(“mbp”)、谷胱甘肽s转移酶(gst)、his6、myc、flag、v5、vsv-g和ha)、多肽连接子和多肽切割信号。融合多肽通常是c-末端至n-末端连接的,但它们也可以是c-末端至c-末端、n-末端至n-末端或n-末端至c-末端连接的。在特定实施例中,融合蛋白的多肽可以是任何顺序。融合多肽或融合蛋白还可以包含保守修饰的变体、多态变体、等位基因、突变体、亚序列和种间同源物,只要保留了融合多肽的所需活性即可。融合多肽可以通过化学合成方法或通过两个部分之间的化学连接产生,或者通常可以使用其它标准技术制备。包括融合多肽的连接dna序列与合适的转录或翻译控制元件可操作地连接,如本文其它地方所公开。在各个实施例中,本文考虑的核酸酶是催化失活的变体并且包括阻遏转录的结构域,包含但不限于转录因子的阻遏结构域、组蛋白甲基化酶或脱甲基酶结构域、组蛋白乙酰化酶或脱乙酰酶结构域、sumo化结构域、泛素化结构域或dna甲基化酶结构域。在一个实施例中,本文考虑的核酸酶是催化失活的变体并且包括阻遏结构域,其选自由以下组成的群组:来自拟南芥superman蛋白的msin相互作用结构域(sid)、sid4x、kruppel相关盒(krab)结构域或srdx结构域。如本文使用,sid结构域是相互作用结构域,其存在于几种转录阻遏蛋白中并且可以与额外的阻遏结构域和辅阻遏物一起作用。如本文使用,sid4x是通过短肽连接子连接在一起的四个sid结构域的串联重复。如本文使用,krab结构域是通常在几个基于锌指蛋白的转录因子(例如,kox1)的n-末端中发现的结构域。在一个实施例中,本文考虑的核酸酶是催化失活的变体并且包括krab结构域。在各个实施例中,本文考虑的包括阻遏转录的结构域的催化失活的核酸酶突变体可以用于靶向基因以转录敲落或敲除靶基因的表达。在一个实施例中,融合配偶体包括有助于以比天然重组蛋白更高的产率表达蛋白质(表达增强子)的序列。可以选择其它融合配偶体以增加蛋白质的溶解度或使蛋白质能够靶向期望的细胞内隔室或促进融合蛋白通过细胞膜的转运。在各个实施例中,融合多肽包括一种或多种cpp。给予多肽化合物的一个重要因素是确保多肽具有穿过细胞质膜或细胞内隔室(例如,细胞核)膜的能力。细胞膜由脂质-蛋白质双层组成,其可自由渗透小的非离子亲脂性化合物,并且固有地对于极性化合物、大分子和治疗或诊断剂不可渗透。然而,已经描述了具有使多肽跨细胞膜移位的能力的蛋白质、脂质和其它化合物。可以促进蛋白质摄入细胞的肽序列的实例包含但不限于:hivtat多肽;对应于p16蛋白的氨基酸84-103的20残基肽序列(参见fahraeus等人,1996年,《现代生物学(curr.biol.)》,第6期:第84页);触角足突变的60个氨基酸长的同源结构域的第三螺旋(derossi等人,1994年,《生物化学杂志(j.biol.chem.)》,第269期:第10444页);信号肽的h区,例如卡波西成纤维细胞生长因子(k-fgf)h区;和来自hsv的vp22移位结构域(elliot等人,1997年,《细胞(cell)》,第88期:第223-233页)。此外,几种细菌毒素,包含产气荚膜梭菌毒素微小毒素、白喉毒素(dt)、假单胞菌外毒素a(pe)、百日咳博代氏杆菌毒素(pt)、炭疽杆菌毒素和百日咳博德特氏菌腺苷酸环化酶(cya),已被用于将肽作为内部或氨基末端融合物递送至细胞溶质。arora等人,1993年,《生物化学杂志(j.biol.chem.)》,第268期:第3334-3341页;perelle等人,1993年,《感染与免疫(infect.immun.)》,第61期:第5147-5156页;stenmark等人,1991年,《细胞生物学杂志(j.cellbiol.)》,第113期:第1025-1032页;donnelly等人,1993年,《美国国家科学院学报(proc.natl.acad.sci.usa)》,第90期:第3530-3534页;carbonetti等人,1995年,《美国微生物学会年会简报(abstr.annu.meet.am.soc.microbiol.)》,第95期:第295页;sebo等人,1995年,《感染与免疫(infect.immun.)》,第63期:第3851-3857页;klimpel等人,1992年,《美国国家科学院学报(proc.natl.acad.sci.usa.)》,第89期:第10277-10281页;和novak等人,1992年,《生物化学杂志(j.biol.chem.)》,第267期:第17186-17193页。其它示例性cpp氨基酸序列包含但不限于:rkkrrqrrr(seqidno:23)、kkrrqrrr(seqidno:24)和rkkrrqrr(seqidno:25)(衍生自hivtat蛋白);rrrrrrrrr(seqidno:26);kkkkkkkkk(seqidno:27);rqikiwfqnrrmkwkk(seqidno:28)(来自果蝇antp蛋白);rqikiwfqnrrmkskk(seqidno:29)(来自果蝇ftz蛋白);rqikiwfqnkrakikk(seqidno:30)(来自果蝇engrailed蛋白);rqikiwfqnrrmkwkk(seqidno:31)(来自人hox-a5蛋白);和rvirvwfqnkrckdkk(seqidno:32)(来自人isl-1蛋白)。这种子序列可以用于促进跨细胞膜的多肽移位,包含本文考虑的融合多肽。融合多肽可以任选地包括可以用于连接多肽内的一个或多个多肽或结构域的连接子。肽连接子序列可以用于将任何两个或更多个多肽组分分开足够的距离,以确保每个多肽折叠成其合适的二级和三级结构,从而使多肽结构域发挥其所需功能。使用本领域的标准技术将这种肽连接子序列掺入融合多肽中。可以基于以下因素选择合适的肽连接子序列:(1)它们能够采用柔性延伸构象;(2)它们不能采用可与第一和第二多肽上的功能性表位相互作用的二级结构;(3)缺少可能与多肽功能性表位反应的疏水或带电残基。优选的肽连接子序列含有gly、asn和ser残基。其它近中性氨基酸,例如thr和ala,也可以用于连接子序列。可以用作连接子的氨基酸序列包含maratea等人,《基因(gene)》,第40期:第39-46页,1985年;murphy等人,《美国国家科学院学报(proc.natl.acad.sci.usa)》,第83期:第8258-8262页,1986年;美国专利第4,935,233号和美国专利第4,751,180号中公开的那些。当特定融合多肽片段含有可以用于分开功能结构域并防止空间干扰的非必需n-末端氨基酸区时,不需要连接子序列。优选的连接子通常是柔性氨基酸子序列,其作为重组融合蛋白的一部分合成。连接子多肽的长度可以是1至200个氨基酸、1至100个氨基酸,或者1至50个氨基酸,包含其间的所有整数值。示例性连接子包含但不限于以下氨基酸序列:甘氨酸聚合物(g)n;甘氨酸-丝氨酸聚合物(g1-5s1-5)n,其中n是至少一、二、三、四或五的整数;甘氨酸-丙氨酸聚合物;丙氨酸-丝氨酸聚合物;ggg(seqidno:33);dgggs(seqidno:34);tgekp(seqidno:35)(参见例如liu等人,《美国科学院院报(pnas)》,第5525-5530页(1997年));ggrr(seqidno:36)(pomerantz等人,1995年,同上);(ggggs)n,其中n=1、2、3、4或5(seqidno:37)(kim等人,《美国科学院院报(pnas)》,第93期,第1156-1160页(1996年);egkssgsgseskvd(seqidno:38)(chaudhary等人,1990年,《美国科学院院报(proc.natl.acad.sci.u.s.a.)》,第87期:第1066-1070页);kesgsvsseqlaqfrsld(seqidno:39)(bird等人,1988年,《科学(science)》,第242期:第423-426页),ggrrgggs(seqidno:40);lrqrdgerp(seqidno:41);lrqkdgggserp(seqidno:42);lrqkd(gggs)2erp(seqidno:43)。可替代地,柔性连接子可以使用能够对dna结合位点和肽本身进行建模的计算机程序(desjarlais和berg,《美国科学院院报(pnas)》,第90期:第2256-2260页(1993年),《美国科学院院报(pnas)》,第91期:第11099-11103页(1994年))或通过噬菌体展示方法来合理设计。融合多肽可以进一步包括在本文描述的每个多肽结构域之间或在内源性开放阅读框和由供体修复模板编码的多肽之间的多肽切割信号。另外,可以将多肽切割位点置于任何连接子肽序列中。示例性多肽切割信号包含多肽切割识别位点,例如蛋白酶切割位点、核酸酶切割位点(例如,稀有限制酶识别位点、自裂解核酶识别位点)和自裂解病毒寡肽(参见defelipe和ryan,2004年,《运输(traffic)》,第5(8)期;第616-26页)。合适的蛋白酶切割位点和自裂解肽是本领域技术人员已知的(参见例如ryan等人,1997年,《普通病毒学杂志(j.gener.virol.)》,第78期,第699-722页;scymczak等人(2004年),《自然生物技术(naturebiotech.)》,第5期,第589-594页)。示例性蛋白酶切割位点包含但不限于马铃薯y病毒nia蛋白酶(例如,烟草蚀刻病毒蛋白酶)、马铃薯y病毒hc蛋白酶、马铃薯y病毒p1(p35)蛋白酶、大麦花叶病毒(byovirus)nia蛋白酶、大麦花叶病毒rna-2编码的蛋白酶、口疮病毒l蛋白酶、肠病毒2a蛋白酶、鼻病毒2a蛋白酶、小rna病毒3c蛋白酶、豇豆花叶病毒24k蛋白酶、线虫传多面体病毒24k蛋白酶、rtsv(水稻东格鲁球状病毒)3c样蛋白酶、pyvf(欧防风黄点病毒)3c样蛋白酶、肝素、凝血酶、因子xa和肠激酶的切割位点。由于其高切割严格性,在一个实施例中优选tev(烟草蚀刻病毒)蛋白酶切割位点,例如exxyxq(g/s)(seqidno:44),例如enlyfqg(seqidno:45)和enlyfqs(seqidno:46),其中x代表任何氨基酸(由tev引起的发生在q和g或q和s之间的切割)。在某些实施例中,自裂解多肽位点包括2a或2a样位点、序列或结构域(donnelly等人,2001年,《普通病毒学杂志(j.gen.virol.)》,第82期:第1027-1041页)。在一个特定实施例中,病毒2a肽是口疮病毒2a肽、马铃薯y病毒2a肽或心病毒2a肽。在一个实施例中,病毒2a肽选自由以下组成的群组:口蹄疫病毒(fmdv)2a肽、马鼻炎a病毒(erav)2a肽、明脉扁刺蛾β四体病毒(tav)2a肽、猪捷申病毒-1(ptv-1)2a肽、泰勒病毒2a肽和脑心肌炎病毒2a肽。表2中提供了2a位点的说明性实例。表2:示例性2a位点包含以下序列:seqidno:47gsgatnfsllkqagdveenpgpseqidno:48atnfsllkqagdveenpgpseqidno:49llkqagdveenpgpseqidno:50gsgegrgslltcgdveenpgpseqidno:51egrgslltcgdveenpgpseqidno:52lltcgdveenpgpseqidno:53gsgqctnyallklagdvesnpgpseqidno:54qctnyallklagdvesnpgpseqidno:55llklagdvesnpgpseqidno:56gsgvkqtlnfdllklagdvesnpgpseqidno:57vkqtlnfdllklagdvesnpgpseqidno:58llklagdvesnpgpseqidno:59llnfdllklagdvesnpgpseqidno:60tlnfdllklagdvesnpgpseqidno:61llklagdvesnpgpseqidno:62nfdllklagdvesnpgpseqidno:63qllnfdllklagdvesnpgpseqidno:64apvkqtlnfdllklagdvesnpgpseqidno:65vtellyrmkraetycprpllaihptearhkqkivapvkqtseqidno:66lnfdllklagdvesnpgpseqidno:67llaihptearhkqkivapvkqtlnfdllklagdvesnpgpseqidno:68earhkqkivapvkqtlnfdllklagdvesnpgp在各个实施例中,由一种或多种蛋白质去稳定化序列或蛋白质降解序列(降解决定子)调节本文考虑的多肽或融合多肽的表达或稳定性。本文考虑了几种使蛋白质去稳定化以执行其快速蛋白酶体转换的策略。蛋白质去稳定化序列的说明性实例包含但不限于:去稳定化盒(d盒),细胞周期依赖性蛋白中存在的九个氨基酸,其必须经历快速且完全的泛素介导的蛋白水解以实现细胞周期内的循环(参见例如yamano等人,1998年,《embo杂志(emboj)》,第17期:第5670-8页);ken盒,由cdh1靶向的apc识别信号(参见例如pfleger等人,2000年,《基因发展(genesdev)》,第14期:第655-65页);o盒,原始识别复合蛋白1(orc1)中存在的基序,其在m期结束时和由fzr/cdh1活化的后期促进复合物(apc)引起的g1的大部分时间内降解(参见例如araki等人,2005年,《基因发展(genesdev)》,第19(20)期:第2458-2465页);a盒,aurora-a中存在的基序,其在由cdh1引起的有丝分裂退出期间降解(参见例如littlepage等人,2002年,《基因发展(genesdev)》,第16期:第2274-2285页);pest结构域,富含脯氨酸(p)、谷氨酸(e)、丝氨酸(s)和苏氨酸(t)残基并靶向蛋白质以用于快速蛋白酶体破坏的基序,(rechsteiner等人,1996年,《生物化学的发展趋势(trendsbiochemsci.)》,第21(7)期:第267-271页);n-末端规则基序、n-降解决定子基序和泛素-融合降解(ufd)基序,其被快速加工以用于蛋白酶体破坏(参见例如dantuma等人,2000年,《自然生物技术(natbiotechnol)》,第18期:第538-4页)。适用于特定实施例的降解决定子的另外的说明性实例包含但不限于配体可控降解决定子和温度可调降解决定子。配体可控降解决定子的非限制性实例包含由shie1d1稳定的那些(参见例如bonger等人,2011年,《自然化学生物学(natchemviol.)》,第7(8)期:第531-537页)、由生长素去稳定化的那些(参见例如nishimura等人,2009年,《自然方法(natmethods)》,第6(12)期:第917-922页)、和由甲氧苄啶稳定化的那些(参见例如iwamoto等人,2010年,《化学生物学(chembiol.)》,第17(9)期:第981-8页)。温度可调降解决定子的非限制性实例包含但不限于dhfrts降解决定子(参见例如dohmen等人,1994年,《自然(science)》,第263(5151)期:第1273-1276页)。在特定实施例中,本文考虑的多肽包括一种或多种降解序列,其选自由以下组成的群组:d盒、o盒、a盒、ken基序、pest基序、细胞周期蛋白a和ufd结构域/底物、配体可控降解决定子和温度可调降解决定子。g.多核苷酸在特定实施例中,提供了编码本文考虑的一种或多种大范围核酸酶、megatal、talen、zfn、cas核酸酶、末端加工核酸酶、免疫抑制信号减弱子、翻转受体、工程化的tcr、car、daric、治疗性多肽、融合多肽的多核苷酸。如本文使用,术语“多核苷酸”或“核酸”是指脱氧核糖核酸(dna)、核糖核酸(rna)和dna/rna杂合体。多核苷酸可以是单链或双链的。多核苷酸包含但不限于:前信使rna(前mrna)、信使rna(mrna)、rna、短干扰rna(sirna)、短发夹rna(shrna)、微rna(mirna)、核酶、合成rna、基因组rna(grna)、正链rna(rna(+))、负链rna(rna(-))、tracrrna、crrna、单向导rna(sgrna)、合成rna、基因组dna(gdna)、pcr扩增dna、互补dna(cdna)、合成dna或重组dna。多核苷酸是指长度为至少5个、至少10个、至少15个、至少20个、至少25个、至少30个、至少40个、至少50个、至少100个、至少200个、至少300个、至少400个、至少500个、至少1000个、至少5000个、至少10000个或至少15000个或更多个核苷酸的核苷酸聚合形式,或是核糖核苷酸,或是脱氧核糖核苷酸,或是任一类型核苷酸的修饰形式,以及所有中间长度。容易理解的是,在这种情况下,“中间长度”表示引用值之间的任何长度,例如6个、7个、8个、9个核苷酸等,101个、102个、103个核苷酸等;151个、152个、153个核苷酸等;201个、202个、203个等;在特定实施例中,多核苷酸或变体与参考序列具有至少或约50%、55%、60%、65%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性。多核苷酸的说明性实例包含但不限于编码seqidno:2、5-7和11的多核苷酸和seqidno:1、3、4、8-10和12-22中给出的多核苷酸序列。在各个说明性实施例中,本文考虑的多核苷酸包含但不限于编码大范围核酸酶、megatal、talen、zfn、cas核酸酶、末端加工核酸酶、免疫抑制信号减弱子、翻转受体、工程化tcr、car、daric、治疗性多肽的多核苷酸,和包括表达载体、病毒载体和转移质粒的多核苷酸。如本文使用,术语“多核苷酸变体”和“变体”等是指表现出与参考多核苷酸序列的基本序列同一性的多核苷酸或在下文定义的严格条件下与参考序列杂交的多核苷酸。这些术语还涵盖通过添加、缺失、取代或修饰至少一个核苷酸而区别于参考多核苷酸的多核苷酸。因此,术语“多核苷酸变体”和“变体”包含其中已添加或缺失或修饰一个或多个核苷酸或已用不同核苷酸取代一个或多个核苷酸的多核苷酸。在这一点,本领域充分理解,可以对参考多核苷酸进行某些改变,包含突变、添加、缺失和取代,由此改变的多核苷酸保留参考多核苷酸的生物学功能或活性。在一个实施例中,多核苷酸包括在严格条件下与靶核酸序列杂交的核苷酸序列。在“严格条件”下杂交描述了杂交方案,其中彼此具有至少60%同一性的核苷酸序列保持杂交。通常,严格条件选择为在确定的离子强度和ph下比特定序列的热熔点(tm)低约5℃。tm是温度(在确定的离子强度、ph和核酸浓度下),在此温度下,50%与靶序列互补的探针在平衡时与靶序列杂交。由于靶序列通常过量存在,所以在tm下,50%的探针在平衡时被占用。如本文使用,叙述“序列同一性”或例如包括“与......具有50%同一性的序列”是指序列在比较窗口上在逐个核苷酸的基础上或在逐个氨基酸的基础上具有同一性的程度。因此,“序列同一性百分比”可以通过以下计算:在比较窗口上比较两个最佳比对序列,确定两个序列中存在相同的核酸碱基(例如,a、t、c、g、i)或相同的氨基酸残基(例如,ala、pro、ser、thr、gly、val、leu、ile、phe、tyr、trp、lys、arg、his、asp、glu、asn、gln、cys和met)的位置的数量以得到匹配位置的数量,用匹配位置的数量除以比较窗口中的位置总数(即,窗口大小),并将结果乘以100以得到序列同一性百分比。包含与本文所述的任何参考序列具有至少约50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%的序列同一性的核苷酸和多肽,通常其中多肽变体保持参考多肽的至少一种生物活性。用于描述两个或更多个多核苷酸或多肽之间的序列关系的术语包含“参考序列”、“比较窗口”、“序列同一性”、“序列同一性百分比”和“基本同一性”。“参考序列”的长度为至少12个单体单元,但通常为15至18个单体单元,在大多数情况下为至少25个单体单元,所述单体单元包含核苷酸和氨基酸残基。因为两个多核苷酸可以各自包括(1)两个多核苷酸之间相似的序列(即,仅完整多核苷酸序列的一部分),和(2)两个多核苷酸之间不同的序列,通常通过在“比较窗口”上比较两个多核苷酸的序列来进行两个(或更多个)多核苷酸之间的序列比较,以标识和比较序列相似性的局部区域。“比较窗口”是指至少6个连续位置,通常约50个至约100个连续位置,更通常约100个至约150个连续位置的概念性片段,其中将序列与连续位置数量相同的参考序列进行比较,然后对两个序列进行最佳比对。对于两个序列的最佳比对,比较窗口可以包括与参考序列(其不包括添加或缺失)相比约20%或更低的添加或缺失(即,间隙)。用于比对比较窗口的序列的最佳比对可以通过算法的计算机化实现(威斯康星遗传学软件包7.0版本中的gap、bestfit、fasta和tfasta,geneticscomputergroup,575sciencedrivemadison,wi,usa)进行,或者通过选择的各个方法中的任一个生成的检查和最佳比对(即,导致比较窗口上的同源性百分比最高)。还可以参考blast程序家族,例如altschul等人,1997年,《核酸研究(nucl.acidsres.)》,第25期:第3389页。序列分析的详细讨论可以在ausubel等人,《现代分子生物学实验指南(currentprotocolsinmolecularbiology)》,johnwiley&sonsinc.,1994-1998年,第15章的单元19.3中找到。如本文使用,“分离的多核苷酸”是指从天然存在状态侧翼的序列中纯化的多核苷酸,例如已从通常与片段相邻的序列中移除的dna片段。在特定实施例中,“分离的多核苷酸”是指互补dna(cdna)、重组多核苷酸、合成多核苷酸或天然不存在并且由人工制造的其它多核苷酸。描述多核苷酸方向的术语包含:5′(通常是具有游离磷酸根基团的多核苷酸的末端)和3′(通常是具有游离羟基(oh)基团的多核苷酸的末端)。多核苷酸序列可以以5′至3′方向或3′至5′方向注释。对于dna和mrna,5′至3′链被称为“正义”、“正”或“编码”链,因为其序列与前信使(前mrna)的序列相同[rna中的尿嘧啶(u)除外,而不是dna中的胸腺嘧啶(t)]。对于dna和mrna,互补3′至5′链,其是由rna聚合酶转录的链,被称为“模板”、“反义”、“负”或“非编码”链。如本文使用,术语“反向”是指以3′至5′方向写入的5′至3′序列或以5′至3′方向写入的3′至5′序列。术语“互补的”和“互补性”是指通过碱基配对规则相关的多核苷酸(即,核苷酸序列)。例如,dna序列5′agtcatg3′的互补链是3′tcagtac5′。后一序列通常写为反向互补,其中5′末端在左,3′末端在右,5′catgact3′。与其反向互补相等的序列称为回文序列。互补性可以是“部分的”,其中根据碱基配对规则仅匹配一些核酸碱基。或者,核酸之间可存在“完全”或“全”互补性。如本文使用,术语“核酸盒”或“表达盒”是指载体内可以表达rna并随后表达多肽的遗传序列。在一个实施例中,核酸盒含有目标基因,例如目标多核苷酸。在另一个实施例中,核酸盒含有一个或多个表达控制序列,例如启动子、增强子、聚(a)序列和目标基因,例如,目标多核苷酸。载体可以包括1个、2个、3个、4个、5个、6个、7个、8个、9个或10个或更多个核酸盒。核酸盒在载体内定位和顺序定向,使得盒中的核酸可以转录成rna,并且在必要时翻译成蛋白质或多肽,经历转化的细胞中活性所需的适当翻译后修饰,通过靶向合适的细胞内隔室或分泌到细胞外隔室中移位到生物活性所需的适当隔室。优选地,盒具有适于容易插入载体的3′末端和5′末端,例如,其在每个末端具有限制性核酸内切酶位点。在一个优选的实施例中,核酸盒含有用于治疗、预防或改善遗传病症的治疗基因的序列。可以移除盒并将其作为单个单元插入质粒或病毒载体中。多核苷酸包含目标多核苷酸。如本文使用,术语“目标多核苷酸”是指编码多肽或融合多肽的多核苷酸或用作抑制性多核苷酸转录的模板的多核苷酸,如本文所考虑。此外,本领域普通技术人员将理解,由于遗传密码的简并性,存在许多核苷酸序列,其可以编码如本文考虑的多肽或其变体的片段。这些多核苷酸中的一些与任何天然基因的核苷酸序列具有最小的同源性。尽管如此,在特定实施例中特别考虑了由于密码子使用的差异而不同的多核苷酸,例如针对人和/或灵长类动物密码子选择而优化的多核苷酸。在一个实施例中,提供了包括特定等位基因序列的多核苷酸。等位基因是内源多核苷酸序列,其由于一个或多个突变而改变,例如核苷酸的缺失、添加和/或取代。在某个实施例中,目标多核苷酸包括编码大范围核酸酶、megatal、talen、zfn、cas核酸酶、末端加工核酸酶、免疫抑制信号减弱子、翻转受体、工程化tcr、car、daric、治疗性多肽或融合多肽的供体修复模板。在某个实施例中,目标多核苷酸包括抑制性多核苷酸,包含但不限于crrna、tracrrna、单向导rna(sgrna)、sirna、mirna、shrna、核酶或其它抑制性rna。如本文使用,术语“sirna”或“短干扰rna”是指在动物中介导序列特异性转录后基因沉默、翻译抑制、转录抑制或表观遗传rnai的过程的短多核苷酸序列(zamore等人,2000年,《细胞(cell)》,第101期,第25-33页;fire等人,1998年,《自然(nature)》,第391期,第806页;hamilton等人,1999年,《科学(science)》,第286期,第950-951页;lin等人,1999年,《自然(nature)》,第402期,第128-129页;sharp,1999年,《基因发展(genes&dev.)》,第13期,第139-141页;和strauss,1999年,《科学(science)》,第286期,第886页)。在优选的实施例中,sirna靶向编码免疫抑制信号转导途径的组分的mrna。在某些实施例中,sirna包括具有相同数目核苷的第一链和第二链;然而,第一和第二链是偏移的,使得第一和第二链上的两个末端核苷不与互补链上的残基配对。在某些情况下,未配对的两个核苷是胸苷残基。sirna应包含与靶基因具有足够同源性的区域,并且就核苷酸而言具有足够的长度,使得sirna或其片段可以介导靶基因的下调。因此,sirna包含与靶rna至少部分互补的区域。sirna和靶标之间不必存在完美互补性,但该对应性必须足以使sirna或其切割产物能够指导序列特异性沉默,例如通过靶rna的rnai切割。在反义链中,与靶链的互补性或同源性程度是最关键的。虽然通常需要完美互补性,特别是在反义链中,但是一些实施例包含相对于靶rna的一个或多个,但优选10个、8个、6个、5个、4个、3个、2个或更少的错配。在末端区中最容许错配,并且如果存在,则优选在一个或多个末端区中,例如在5′和/或3′末端的6个、5个、4个或3个核苷酸内。正义链仅需要与反义链充分互补以维持分子的整体双链特征。sirna的每条链的长度可以等于或小于30个、25个、24个、23个、22个、21个或20个核苷酸。链长度优选为至少19个核苷酸。例如,每条链的长度可以在21至25个核苷酸之间。优选的sirna具有17个、18个、19个、29个、21个、22个、23个、24个或25个核苷酸对的双链体区,以及2至3个核苷酸的一个或多个突出端,优选2至3个核苷酸的一个或两个3′突出端。如本文使用,术语“mirna”或“微rna”是指20至22个核苷酸的小非编码rna,通常从~70核苷酸的折回rna前体结构(称为前mirna)切除。mirna以两种方式之一负向调节其靶标,这取决于mirna和靶标之间的互补性程度。在优选的实施例中,mirna靶向编码免疫抑制信号转导途径的组分的mrna。首先,以完美互补性或接近完美互补性结合至蛋白质编码mrna序列的mirna诱导rna介导的干扰(rnai)途径。通过结合至其mrna靶标的3′非翻译区(utr)内的不完美互补位点而发挥其调节作用的mirna,通过与rnai途径所用类似或可能相同的risc复合物在转录后阻遏靶基因表达,在翻译水平上较明显。与翻译控制一致,使用该机制的mirna降低了其靶基因的蛋白质水平,但这些基因的mrna水平仅受到最小程度的影响。mirna涵盖天然存在的mirna以及可以特异性靶向任何mrna序列的人工设计的mirna。例如,在一个实施例中,技术人员可以设计表达为人mirna(例如,mir-30或mir-21)初级转录物的短发夹rna构建体。该设计为发夹构建体添加了drosha加工位点,并且已经显示出可大大地提高敲落效率(pusch等人,2004年)。发夹茎由22ntdsrna(例如,反义与所需靶标具有完美互补性)和来自人mir的15至19nt环组成。与不含微rna的常规shrna设计相比,在发夹的任一侧或两侧添加mir环和mir30侧翼序列导致表达的发夹的drosha和dicer加工增加超过10倍。增加的drosha和dicer加工翻译为更大的sirna/mirna产量和更高的表达发夹效力。如本文使用,术语“shrna”或“短发夹rna”是指由单个自身互补rna链形成的双链结构。在优选的实施例中,shrna靶向编码免疫抑制信号转导途径的组分的mrna。含有与靶基因的编码或非编码序列的一部分相同的核苷酸序列的shrna构建体优选用于抑制。还发现相对于靶序列具有插入、缺失和单点突变的rna序列对抑制有效。优选抑制性rna与靶基因部分之间大于90%的序列同一性或甚至100%的序列同一性。在某些优选的实施例中,shrna的双链体形成部分的长度长度为至少20个、21个或22个核苷酸,例如,对应于通过dicer依赖性切割产生的rna产物的大小。在某些实施例中,shrna构建体的长度为至少25个、50个、100个、200个、300个或400个碱基。在某些实施例中,shrna构建体的长度为400个至800个碱基。shrna构建体高度耐受环序列和环大小的变化。如本文使用,术语“核酶”是指能够对靶mrna进行位点特异性切割的催化活性rna分子。在优选的实施例中,核酶靶向编码免疫抑制信号转导途径的组分的mrna。已经描述了几种亚型,例如锤头和发夹核酶。通过在非催化碱基上用脱氧核糖核苷酸取代核糖核苷酸,可以改善核酶催化活性和稳定性。虽然在位点特异性识别序列处切割mrna的核酶可以用于破坏特定mrna,但优选使用锤头核酶。锤头核酶在由侧翼区指示的位置切割mrna,所述侧翼区与靶mrna形成互补碱基对。唯一的要求是靶mrna具有以下两个碱基的序列:5′-ug-3′。锤头核酶的构建和生产在本领域中是众所周知的。在一个实施例中,包括抑制性rna的供体修复模板包括一个或多个调节序列,诸如例如强组成型poliii,例如人或小鼠u6snrna启动子、人和小鼠h1rna启动子、或人trna-val启动子、或强组成型polii启动子,如本文其它地方所述。无论编码序列本身的长度,在特定实施例中考虑的多核苷酸可以与其它dna序列组合,例如启动子和/或增强子、非翻译区(utr)、kozak序列、多腺苷酸化信号、其它限制酶位点、多克隆位点、内部核糖体进入位点(ires)、重组酶识别位点(例如,loxp、frt和att位点)、终止密码子、转录终止信号、转录后反应元件、和编码自裂解多肽的多核苷酸、表位标签,如本文其它地方所公开或本领域已知,使得它们的总长度可以相当大地不同。因此在特定实施例中考虑,可以使用几乎任何长度的多核苷酸片段,其总长度优选受在预期的重组dna方案中的制备和使用的容易性的限制。可以使用本领域已知和可获得的各种成熟技术中的任何一种来制备、操作,表达和/或递送多核苷酸。为了表达所需多肽,可以将编码多肽的核苷酸序列插入合适的载体中。载体的说明性实例包含但不限于质粒、自主复制序列和转座因子,例如sleepingbeauty、piggybac。载体的额外的说明性实例包含但不限于质粒、噬菌粒、粘粒、人工染色体(例如,酵母人工染色体(yac)、细菌人工染色体(bac)或p1衍生的人工染色体(pac))、噬菌体(例如,λ噬菌体或m13噬菌体)和动物病毒。可用作载体的病毒的说明性实例包含但不限于逆转录病毒(包含慢病毒)、腺病毒、腺相关病毒、疱疹病毒(例如,单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒和乳多空病毒(例如,sv40)。表达载体的说明性实例包含但不限于用于在哺乳动物细胞中的表达的pclneo载体(promega);用于慢病毒介导的基因转移和在哺乳动物细胞中的表达的plenti4/v5-desttm、plenti6/v5-desttm和plenti6.2/v5-gw/lacz(invitrogen)。在特定实施例中,本文公开的多肽的编码序列可以连接到这种用于在哺乳动物细胞中表达多肽的表达载体中,。在特定实施例中,载体是附加型载体或在染色体外维持的载体。如本文使用,术语“附加型的”是指能够复制而不整合到宿主的染色体dna中且不会从分裂的宿主细胞中逐渐丧失的载体,这也表示所述载体在染色体外或附加地复制。该载体被改造成含有编码dna复制起点的序列或来自α、β或γ疱疹病毒、腺病毒、sv40、牛乳头瘤病毒或酵母的“ori”。通常,宿主细胞包括活化复制的病毒复制反式活化蛋白。α疱疹病毒具有相对短的生殖周期、可变的宿主范围,有效地破坏受感染的细胞并主要在感觉神经节中建立潜伏感染。α疱疹病毒的说明性实例包含hsv1、hsv2和vzv。β疱疹病毒具有长生殖周期和受限的宿主范围。受感染的细胞通常会扩大。可以在血液、肾脏、分泌腺和其它组织的白细胞中维持潜伏期。β疱疹病毒的说明性实例包含cmv、hhv-6和hhv-7。γ-疱疹病毒对t或b淋巴细胞具有特异性,并且通常在淋巴组织中表现出潜伏期。γ疱疹病毒的说明性实例包含ebv和hhv-8。表达载体中存在的“表达控制序列”、“控制元件”或“调节序列”是载体的非翻译区——复制起点、选择盒、启动子、增强子、翻译起始信号(shinedalgarno序列或kozak序列)内含子、多腺苷酸化序列、5′和3′非翻译区——其与宿主细胞蛋白相互作用以进行转录和翻译。这些元件的强度和特异性可能不同。取决于利用的载体系统和宿主,可以使用任何数量的合适的转录和翻译元件,包含普遍存在的启动子和可诱导启动子。在特定实施例中,多核苷酸是载体,包含但不限于表达载体和病毒载体,并且包含外源、内源或异源控制序列,例如启动子和/或增强子。“内源控制序列”是与基因组中的给定基因天然连接的序列。“外源控制序列”是通过遗传操作(即,分子生物学技术)与基因并置放置的序列,使得该基因的转录由连接的增强子/启动子指导。“异源控制序列”是来自与遗传操作的细胞不同的物种的外源序列。“合成的”控制序列可以包括一个或多个内源和/或外源序列的元件,和/或体外或计算机中确定的序列,其为特定基因疗法提供最佳启动子和/或增强子活性。如本文使用的术语“启动子”是指rna聚合酶结合的多核苷酸(dna或rna)的识别位点。rna聚合酶启动并转录与启动子可操作地连接的多核苷酸。在特定实施例中,在哺乳动物细胞中起作用的启动子包括位于转录起始位点上游约25至30个碱基的富含at的区域和/或在转录起始上游70至80个碱基处发现的另一个序列cncaat区域,其中n可以是任何核苷酸。术语“增强子”是指dna片段,其含有能够提供增强的转录的序列,并且在某些情况下可以独立于其相对于另一个控制序列的方向而起作用。增强子可以与启动子和/或其它增强子元件协同或相加地起作用。术语“启动子/增强子”是指dna片段,其含有能够提供启动子和增强子功能的序列。术语“可操作地连接”是指并置,其中所述组分处于允许它们以其预期方式起作用的关系中。在一个实施例中,该术语是指核酸表达控制序列(例如,启动子和/或增强子)与第二多核苷酸序列(例如,目标多核苷酸)之间的功能性连接,其中表达控制序列指导对应于第二序列的核酸的转录。如本文使用,术语“组成型表达控制序列”是指持续地或连续地允许可操作地连接的序列的转录的启动子、增强子或启动子/增强子。组成型表达控制序列可以分别是允许在多种细胞和组织类型中的表达的“普遍存在的”启动子、增强子或启动子/增强子,或允许在受限制的多种细胞和组织类型中的表达的“细胞特异性”、“细胞类型特异性”、“细胞谱系特异性”或“组织特异性”启动子、增强子或启动子/增强子。适用于特定实施例的示例性普遍存在的表达控制序列包含但不限于巨细胞病毒(cmv)立即早期启动子、病毒猿猴病毒40(sv40)(例如,早期或晚期)、莫洛尼小鼠白血病病毒(momlv)ltr启动子、劳氏肉瘤病毒(rsv)ltr、单纯疱疹病毒(hsv)(胸苷激酶)启动子、来自牛痘病毒的h5、p7.5和p11启动子、短延长因子1-α(ef1a-短)启动子、长延长因子1-α(ef1a-长)启动子、早期生长反应1(egr1)、铁蛋白h(ferh)、铁蛋白l(ferl)、甘油醛3-磷酸脱氢酶(gapdh)、真核翻译起始因子4a1(eif4a1)、热休克70kda蛋白5(hspa5)、热休克蛋白90kdaβ成员1(hsp90b1)、热休克蛋白70kda(hsp70)、β-驱动蛋白(β-kin)、人rosa26基因座(irions等人,《自然生物技术(naturebiotechnology)》,第25期,第1477-1482页(2007年))、泛素c启动子(ubc)、磷酸甘油酸激酶-1(pgk)启动子、巨细胞病毒增强子/鸡β-肌动蛋白(cag)启动子、β-肌动蛋白启动子和骨髓增生性肉瘤病毒增强子、阴性对照区缺失的d1587rev引物结合位点取代(mnd)启动子(challita等人,《病毒学杂志(jvirol.)》,第69(2)期:第748-55页(1995年))。在一个特定实施例中,可能需要使用细胞、细胞类型、细胞谱系或组织特异性表达控制序列来实现所需多核苷酸序列的细胞类型特异性、谱系特异性或组织特异性表达(例如,以表达仅在细胞类型、细胞谱系或组织的子集中或在特定发育阶段期间编码多肽的特定核酸。如本文使用,“条件表达”可以是指任何类型的条件表达,包含但不限于可诱导的表达;可阻遏的表达;在具有特定生理、生物或疾病状态等的细胞或组织中的表达。该定义不旨在排除细胞类型或组织特异性表达。某些实施例提供了目标多核苷酸的条件表达,例如,通过使细胞、组织、生物等经受治疗,或受到导致多核苷酸表达的条件,或受到引起由目标多核苷酸编码的多核苷酸的表达的增加或减少的条件来控制表达。可诱导启动子/系统的说明性实例包含但不限于类固醇可诱导启动子,例如编码糖皮质激素或雌激素受体的基因的启动子(可通过用相应的激素治疗诱导)、金属硫蛋白启动子(可通过用各种重金属治疗诱导)、mx-1启动子(可被干扰素诱导)、“基因开关”米非司酮可调系统(sirin等人,2003年,《基因(gene)》,第323期:第67页),异丙基苯甲酸(cumate)可诱导基因开关(wo2002/088346)、四环素依赖性调节系统等。也可以通过使用位点特异性dna重组酶实现条件表达。根据某些实施例,多核苷酸包括至少一个(通常两个)位点,用于由位点特异性重组酶介导的重组。如本文使用,术语“重组酶”或“位点特异性重组酶”包含涉及一个或多个重组位点(例如,两个、三个、四个、五个、六个、七个、八个、九个、十个或更多个)的重组反应中涉及的切除或整合蛋白、酶、辅因子或相关蛋白,其可能是野生型蛋白质(参见landy,《生物技术发展现状(currentopinioninbiotechnology)》,第3期:第699-707页(1993年)),或其突变体、衍生物(例如,含有重组蛋白序列或其片段的融合蛋白)、片段和变体。适用于特定实施例的重组酶的说明性实例包含但不限于:cre、int、ihf、xis、flp、fis、hin、gin、φc31、cin、tn3解离酶、tndx、xerc、xerd、tnpx、hjc、gin、spcce1和para。多核苷酸可以包括多种位点特异性重组酶中的任何一种的一个或多个重组位点。应当理解,位点特异性重组酶的靶位点是整合载体(例如,逆转录病毒载体或慢病毒载体)所需的任何位点的补充。如本文使用,术语“重组序列”、“重组位点”或“位点特异性重组位点”是指重组酶识别并结合的特定核酸序列。例如,cre重组酶的一个重组位点是loxp,其是34碱基对序列,其包括位于8碱基对核心序列侧翼的两个13碱基对反向重复(用作重组酶结合位点)(参见sauer,b.,《生物技术发展现状(currentopinioninbiotechnology)》,第5期:第521-527页(1994年)的图1)。其它示例性loxp位点包含但不限于:lox511(hoess等人,1996年;bethke和sauer,1997年)、lox5171(lee和saito,1998年)、lox2272(lee和saito,1998年)、m2(langer等人,2002年)、lox71(albert等人,1995年)和lox66(albert等人,1995年)。flp重组酶的合适识别位点包含但不限于:frt(mcleod等人,1996年)、f1、f2、f3(schlake和bode,1994年)、f4、f5(schlake和bode,1994年)、frt(le)(senecoff等人,1988年)、frt(re)(senecoff等人,1988年)。识别序列的其它实例是attb、attp、attl和attr序列,其被重组酶λ整合酶识别,例如。ssr仅介导异型位点attb(长度为34bp)和attp(长度为39bp)之间的重组(groth等人,2000年)。attb和attp分别以细菌和噬菌体基因组上噬菌体整合酶的附着位点命名,均含有可能由同源二聚体结合的不完美反向重复(groth等人,2000年)。产物位点attl和attr对进一步的介导的重组有效惰性(belteki等人,2003年),从而使反应不可逆。对于催化插入,已发现具有attb的dna插入基因组attp位点要比attp位点插入基因组attb位点简单(thyagarajan等人,2001年;belteki等人,2003年)。因此,典型的策略通过同源重组将具有attp的“对接位点”定位到限定的基因座中,然后该基因座与具有attb的进入序列配合用于插入。在一个实施例中,本文考虑的多核苷酸包括侧翼为一对重组酶识别位点的修复模板多核苷酸。在特定实施例中,修复模板多核苷酸侧翼为loxp位点、frt位点或att位点。在特定实施例中,本文考虑的多核苷酸包含编码一个或多个多肽的一个或多个目标多核苷酸。在特定实施例中,为了实现多个多肽中的每一个的有效翻译,可以通过一种或多种ires序列或编码自裂解多肽的多核苷酸序列分开多核苷酸序列。如本文使用,“内部核糖体进入位点”或“ires”是指促进直接内部核糖体进入顺反子(蛋白质编码区)的起始密码子(例如,atg)的元件,从而导致基因的帽非依赖性翻译。参见例如jackson等人,1990年,《生物化学的发展趋势(trendsbiochemsci)》,第15(12)期:第477-83页)和jackson和kaminski,1995年,《核糖核酸(rna)》,第1(10)期:第985-1000页。本领域技术人员通常采用的ires的实例包含美国专利第6,692,736号中所述的那些。本领域已知的“ires”的另外的实例包含但不限于可从小核糖核酸病毒获得的ires(jackson等人,1990年)和可从病毒或细胞mrna来源获得的ires,诸如例如免疫球蛋白重链结合蛋白(bip)、血管内皮生长因子(vegf)(huez等人,1998年,《分子细胞生物学(mol.cell.biol.)》,第18(11)期:第6178-6190页)、成纤维细胞生长因子2(fgf-2)和胰岛素样生长因子(igfii)、翻译起始因子eif4g和酵母转录因子tfiid和hap4、可从novagen商购获得的脑心肌炎病毒(emcv)(duke等人,1992年,《病毒学杂志(j.virol)》,第66(3)期:第1602-9页)和vegfires(huez等人,1998年,《分子细胞生物学(molcellbiol)》,第18(11)期:第6178-90页)。在小核糖核酸病毒科、二顺反子病毒科和黄病毒科种的病毒基因组中以及hcv、弗里德小鼠白血病病毒(frmlv)和莫洛尼小鼠白血病病毒(momlv)中也报道了ires。在一个实施例中,本文考虑的多核苷酸中使用的ires是emcvires。在特定实施例中,多核苷酸包括具有共有kozak序列并编码所需多肽的多核苷酸。如本文使用,术语“kozak序列”是指短核苷酸序列,其极大地促进mrna与核糖体的小亚单位的初始结合并增加翻译。共有kozak序列是(gcc)rccatgg(seqidno:69),其中r是嘌呤(a或g)(kozak,1986年,《细胞(cell)》,第44(2)期:第283-92页,和kozak,1987年,《核酸研究(nucleicacidsres.)》,第15(20)期:第8125-48页)。指导异源核酸转录物的有效终止和多腺苷酸化的元件增加了异源基因表达。通常在多腺苷酸化信号的下游发现转录终止信号。在特定实施例中,载体包括编码待表达多肽的多核苷酸的聚腺苷酸化序列3′。本文使用的术语“聚a位点”或“聚a序列”表示通过rna聚合酶ii指导新生rna转录物的终止和多聚腺苷酸化的dna序列。聚腺苷酸化序列可以通过向编码序列的3′末端添加聚a尾来促进mrna稳定性,因此有助于提高翻译效率。重组转录物的有效多聚腺苷酸化是理想的,因为缺少聚a尾的转录物是不稳定的并且快速降解。可用于载体的聚a信号的说明性实例包含理想的聚a序列(例如,aataaa、attaaa、agtaaa)、牛生长激素聚a序列(bghpa)、兔β-球蛋白聚a序列(rβgpa)、或本领域已知的另一种合适的异源或内源聚a序列。在一些实施例中,多核苷酸或携带多核苷酸的细胞利用自杀基因,包含可诱导自杀基因,以降低直接毒性和/或不受控制的增殖的风险。在具体实施例中,自杀基因对携带多核苷酸或细胞的宿主没有免疫原性。可以使用的自杀基因的某个实例是半胱天冬酶-9或半胱天冬酶-8或胞嘧啶脱氨酶。半胱天冬酶-9可以使用特定的二聚化学诱导剂(cid)活化。在某些实施例中,多核苷酸包括基因片段,其导致本文考虑的遗传修饰的细胞易于在体内进行阴性选择。“阴性选择”是指由于个体体内条件的改变而可以消除的输注细胞。阴性可选择表型可以通过赋予给予试剂(例如,化合物)敏感性的基因的插入而产生。阴性选择基因是本领域已知的,包含但不限于:赋予更昔洛韦敏感性的单纯疱疹病毒i型胸苷激酶(hsv-1tk)基因;细胞次黄嘌呤磷酸核糖转移酶(hprt)基因、细胞腺嘌呤磷酸核糖转移酶(aprt)基因和细菌胞嘧啶脱氨酶。在一些实施例中,遗传修饰的细胞包括进一步包括阳性标志物的多核苷酸,所述阳性标志物使得能够在体外选择阴性可选择表型的细胞。阳性可选择标志物可以是基因,其在被导入宿主细胞后表达显性表型,允许携带该基因的细胞的阳性选择。这种类型的基因是本领域已知的,包含但不限于赋予潮霉素b耐药性的潮霉素-b磷酸转移酶基因(hph)、来自编码抗生素g418耐药性的tn5的氨基糖苷磷酸转移酶基因(neo或aph)、二氢叶酸还原酶(dhfr)基因、腺苷脱氨酶基因(ada)和多药耐药性(mdr)基因。在一个实施例中,阳性可选择标志物和阴性可选择元件连接,使得阴性可选择元件的损失也必然伴随着阳性可选择标志物的损失。在一个特定实施例中,阳性和阴性可选择标志物被融合,使得一种必需标志物的损失导致另一种标志物的损失。作为表达产物产生的融合多核苷酸的实例是赋予上述所需的阳性和阴性选择特征的多肽,其是潮霉素磷酸转移酶胸苷激酶融合基因(hytk)。该基因的表达产生了赋予用于体外阳性选择的潮霉素b耐药性以及用于体内阴性选择的更昔洛韦敏感性的多肽。还参见s.d.lupton的pctus91/08442和pct/us94/05601的出版物,其描述了通过使显性阳性可选择标志物与阴性可选择标志物融合而得到的双功能可选择融合基因的使用。优选的阳性可选择标志物衍生自基因,所述基因选自由以下组成的群组:hph、nco和gpt,优选的阴性可选择标志物衍生自基因,所述基因选自由以下组成的群组:胞嘧啶脱氨酶、hsv-1tk、vzvtk、hprt、aprt和gpt。在特定实施例中考虑的示例性双功能可选择融合基因包含但不限于其中阳性可选择标志物衍生自hph或neo,阴性可选择标志物衍生自胞嘧啶脱氨酶或tk基因或可选择标志物的基因。在特定实施例中,通过非病毒和病毒方法,可以将编码一种或多种大范围核酸酶、megatal、talen、zfn、cas核酸酶、末端加工核酸酶、免疫抑制信号减弱子、翻转受体、工程化tcr、car、daric、治疗性多肽、融合多肽的多核苷酸导入免疫效应细胞中,例如t细胞中。在特定实施例中,可以通过相同的方法或通过不同的方法,和/或通过相同的载体或通过不同的载体提供一种或多种编码核酸酶和/或供体修复模板的多核苷酸的递送。术语“载体”在本文中用于指能够转移或转运另一种核酸分子的核酸分子。转移的核酸通常与载体核酸分子连接,例如插入载体核酸分子中。载体可以包含指导细胞中自主复制的序列,或者可以包含足以允许整合到宿主细胞dna中的序列。在特定实施例中,非病毒载体用于将本文考虑的一个或多个多核苷酸递送至t细胞。非病毒载体的说明性实例包含但不限于质粒(例如,dna质粒或rna质粒)、转座子、粘粒、细菌人工染色体和病毒载体。在特定实施例中考虑的非病毒递送多核苷酸的说明性包含包括但不限于:电穿孔、声致穿孔、脂质转染、显微注射、基因枪(biolistics)、病毒体、脂质体、免疫脂质体、纳米粒子,聚阳离子或脂质:核酸缀合物、裸dna、人工病毒粒子、deae-葡聚糖介导的转移、基因枪和热休克。适用于在特定实施例中考虑的特定实施例的多核苷酸递送系统的说明性实例包含但不限于由amaxabiosystems、maxcyte,inc.、btxmoleculardeliverysystems和copernicustherapeuticsinc.提供的那些。脂质转染试剂是市售的(例如,transfectamtm和lipofectintm)。适用于多核苷酸的有效受体识别脂质转染的阳离子和中性脂质已在文献中描述。参见例如liu等人(2003年),《基因疗法(genetherapy)》,第10期:第180-187页;和balazs等人(2011年),《药物递送杂志(journalofdrugdelivery)》,第2011期:第1-12页。在特定实施例中还考虑了抗体靶向的、细菌衍生的、基于非生物纳米细胞的递送。包括在特定实施例中考虑的多核苷酸的病毒载体可以通过给予个体患者而体内递送,通常通过全身给药(例如,静脉内、腹膜内、肌肉内、皮下或颅内输注)或局部应用,如下所描述。可替代地,可以将载体离体递送至细胞,例如从个体患者(例如,动员的外周血、淋巴细胞、骨髓穿刺液、组织活检等)或通用供体造血干细胞移出的细胞,然后将细胞重新植入患者体内。在一个实施例中,将包括工程化核酸酶和/或供体修复模板的病毒载体直接给予于生物体以在体内转导细胞。可替代地,可以给予裸dna。给药是通过通常用于导入分子与血液或组织细胞最终接触的任何途径,包含但不限于注射、输注、局部给予和电穿孔。给予这种核酸的合适方法是本领域技术人员可获得的并且是公知的,并且尽管可以使用多于一种途径来给予特定组合物,但是特定途径通常可以提供比另一途径更直接且更有效的反应。适用于本文考虑的特定实施例的病毒载体系统的说明性实例包含但不限于腺相关病毒(aav)、逆转录病毒、单纯疱疹病毒、腺病毒、用于基因转移的牛痘病毒载体。在各个实施例中,通过用包括一种或多种多核苷酸的重组腺相关病毒(raav)转导细胞,将编码工程化核酸酶和/或供体修复模板的一种或多种多核苷酸导入免疫效应细胞中,例如t细胞中。aav是一种小的(~26nm)复制缺陷型(主要是附加型)无包膜病毒。aav可以感染分裂细胞和非分裂细胞,并且可以将其基因组掺入宿主细胞的基因组中。重组aav(raav)通常至少由转基因及其调节序列和5′和3′aav反向末端重复(itr)构成。itr序列的长度为约145bp。在特定实施例中,raav包括与aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9或aav10分离的itr和衣壳序列。在一些实施例中,使用嵌合raav,itr序列从一种aav血清型分离,并且衣壳序列从不同的aav血清型分离。例如,具有衍生自aav2的itr序列和衍生自aav6的衣壳序列的raav称为aav2/aav6。在特定实施例中,raav载体可以包括来自aav2的itr,和来自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9或aav10中任一种的衣壳蛋白。在一个优选的实施例中,raav包括衍生自aav2的itr序列和衍生自aav6的衣壳序列。在一些实施例中,可以将改造和选择方法应用于aav衣壳,以使它们更可能转导目标细胞。raav载体的构建及其生产和纯化已公开于例如美国专利第9,169,494号;第9,169,492号;第9,012,224号;第8,889,641号;第8,809,058号;和第8,784,799号,其每一个通过引用整体并入本文。在各个实施例中,通过用包括一种或多种多核苷酸的逆转录病毒(例如,慢病毒)转导细胞,将编码工程化核酸酶和/或供体修复模板的一种或多种多核苷酸导入免疫效应细胞中,例如t细胞中。如本文使用,术语“逆转录病毒”是指rna病毒,其将其基因组rna逆转录为线性双链dna拷贝,随后将其基因组dna共价整合到宿主基因组中。适用于特定实施例的说明性逆转录病毒包含但不限于:莫洛尼小鼠白血病病毒(m-mulv)、莫洛尼小鼠肉瘤病毒(momsv)、哈维小鼠肉瘤病毒(hamusv)、小鼠乳腺肿瘤病毒(mumtv)、长臂猿白血病病毒(galv)、猫白血病病毒(flv)、泡沫病毒、弗里德小鼠白血病病毒、小鼠干细胞病毒(mscv)和劳氏肉瘤病毒(rsv)和慢病毒。如本文使用,术语“慢病毒”是指复杂逆转录病毒的组(或属)。示例性慢病毒包含但不限于:hiv(人免疫缺陷病毒;包含hiv1型和hiv2型);维斯纳-梅依迪病毒(vmv)病毒;山羊关节炎-脑炎病毒(caev);马传染性贫血病毒(eiav);猫免疫缺陷病毒(fiv);牛免疫缺陷病毒(biv);和猿猴免疫缺陷病毒(siv)。在一个实施例中,优选基于hiv的载体骨架(即,hiv顺式作用序列元件)。在各个实施例中,本文考虑的慢病毒载体包括一种或多种ltr,以及以下辅助元件中的一种或多种或全部:cppt/flap、psi(ψ)包装信号、输出元件、聚(a)序列,并且可以任选地包括wpre或hpre、绝缘子元件、可选择标志物和细胞自杀基因,如本文其它地方所讨论。在特定实施例中,本文考虑的慢病毒载体可以是整合型慢病毒或非整合型慢病毒或整合缺陷型慢病毒。如本文使用,术语“整合缺陷型慢病毒”或“是指具有整合酶的慢病毒,所述整合酶缺少将病毒基因组整合到宿主细胞基因组中的能力。在专利申请wo2006/010834中已描述了不能整合的病毒载体,该专利申请通过引用整体并入本文。适于降低整合酶活性的hiv-1pol基因中的说明性突变包含但不限于:h12n、h12c、h16c、h16v、s81r、d41a、k42a、h51a、q53c、d55v、d64e、d64v、e69a、k71a、e85a、e87a、d116n、d1161、d116a、n120g、n1201、n120e、e152g、e152a、d35e、k156e、k156a、e157a、k159e、k159a、k160a、r166a、d167a、e170a、h171a、k173a、k186q、k186t、k188t、e198a、r199c、r199t、r199a、d202a、k211a、q214l、q216l、q221l、w235f、w235e、k236s、k236a、k246a、g247w、d253a、r262a、r263a和k264h。术语“长末端重复(ltr)”是指位于逆转录病毒dna末端的碱基对的结构域,其在其天然序列环境中是直接重复并含有u3、r和u5区。如本文使用,术语“flap元件”或“cppt/flap”是指核酸,其序列包含逆转录病毒(例如,hiv-1或hiv-2)的中心多嘌呤管道和中心终止序列(cppt和cts)。合适的flap元件描述于美国专利第6,682,907号和zennou等人,2000年,《细胞(cell)》,第101期:第173页。如本文使用,术语“包装信号”或“包装序列”是指位于逆转录病毒基因组内的psi[ψ]序列,其是将病毒rna插入病毒衣壳或粒子所需的,参见例如clever等人,1995年,《病毒学杂志(j.ofvirology)》,第69卷,第4期;第2101-2109页。术语“输出元件”是指顺式作用的转录后调节元件,其调节rna转录物从细胞核到细胞质的转运。rna输出元件的实例包含但不限于人免疫缺陷病毒(hiv)rev反应元件(rre)(参见例如cullen等人,1991年,《病毒学杂志(j.virol.)》,第65期:第1053页;和cullen等人,1991年,《细胞(cell)》,第58期:第423页),和乙型肝炎病毒转录后调节元件(hpre)。在特定实施例中,通过将转录后调节元件、有效的多腺苷酸化位点和任选的转录终止信号掺入载体中来增加病毒载体中异源序列的表达。多种转录后调节元件可以增加异源核酸在蛋白质上的表达,例如土拨鼠肝炎病毒转录后调节元件(wpre;zufferey等人,1999年,《病毒学杂志(j.virol.)》,第73期:第2886页);乙型肝炎病毒中存在的转录后调节元件(hpre)(huang等人,《分子细胞生物学(mol.cell.biol.)》,第5期:第3864页);等(liu等人,1995年,《基因发展(genesdev.)》,第9期:第1766页)。由于修饰ltr,慢病毒载体优选含有几种安全性增强作用。“自失活”(sin)载体是指复制缺陷型载体,例如,其中右(3′)ltr增强子-启动子区(称为u3区)已被修饰(例如,通过缺失或取代)以防止病毒转录超过第一轮病毒复制。通过用异源启动子替换5′ltr的u3区来提供额外的安全性增强,以在病毒粒子的产生过程中驱动病毒基因组的转录。可以使用的异源启动子的实例包含例如病毒猿猴病毒40(sv40)(例如,早期或晚期)、巨细胞病毒(cmv)(例如,立即早期)、莫洛尼小鼠白血病病毒(momlv)、劳氏肉瘤病毒(rsv)和单纯疱疹病毒(hsv)(胸苷激酶)启动子。本文使用的术语“假型”或“假型分型”是指其病毒包膜蛋白已被具有优选特征的另一种病毒的病毒包膜蛋白取代的病毒。例如,hiv可以用水疱性口炎病毒g蛋白(vsv-g)包膜蛋白假型化,这允许hiv感染更广泛的细胞,因为hiv包膜蛋白(由env基因编码)通常将病毒靶向cd4+呈递细胞。在某些实施例中,根据已知方法生产慢病毒载体。参见例如kutner等人,《bmc生物技术(bmcbiotechnol.)》,2009年;第9期:第10页,doi:10.1186/1472-6750-9-10;kutner等人,《自然实验手册(nat.protoc.)》,2009年;第4(4)期:第495-505页,doi:10.1038/nprot.2009.22。根据本文考虑的某些具体实施例,大多数或所有病毒载体骨架序列衍生自慢病毒,例如hiv-1。然而,应当理解,可以使用或组合许多不同的逆转录病毒和/或慢病毒序列来源,并且可以适应某些慢病毒序列中的许多取代和改变而不损害转移载体执行本文所述功能的能力。此外,本领域已知多种慢病毒载体,参见naldini等人,(1996年a、1996年b和1998年);zufferey等人,(1997年);dull等人,1998年,美国专利第6,013,516号;和第5,994,136号,其中许多可以适于生产本文考虑的病毒载体或转移质粒。在各个实施例中,通过用包括一种或多种多核苷酸的腺病毒转导细胞,将编码工程化核酸酶和/或供体修复模板的一种或多种多核苷酸导入免疫效应细胞中。基于腺病毒的载体在许多细胞类型中具有非常高的转导效率,并且不需要细胞分裂。使用这种载体,已经获得了高滴度和高水平的表达。该载体可以在相对简单的系统中大量生产。大多数腺病毒载体被改造,使得转基因取代ade1a、e1b和/或e3基因;随后,复制缺陷型载体在人293细胞中繁殖,该细胞反式提供缺失的基因功能。ad载体可以在体内转导多种类型的组织,包含非分裂的分化细胞,例如在肝、肾和肌肉中发现的那些。常规ad载体具有较大承载能力。当前的复制缺陷型腺病毒载体的生成和繁殖可利用命名为293的独特辅助细胞系,其通过ad5dna片段从人胚胎肾细胞转化并组成型表达e1蛋白(graham等人,1977年)。由于e3区是腺病毒基因组中非必需的(jones和shenk,1978年),当前的腺病毒载体,在293细胞的辅助下,在e1区、d3区或两个区携带外源dna(graham和prevec,1991年)。腺病毒载体已用于真核基因表达(levrero等人,1991年;gomez-foix等人,1992年)和疫苗开发(grunhaus和horwitz,1992年;graham和prevec,1992年)。向不同组织给予重组腺病毒的研究包含气管滴注(rosenfeld等人,1991年;rosenfeld等人,1992年)、肌肉注射(ragot等人,1993年)、外周静脉注射(herz和gerard,1993年)和立体定向接种到大脑(legallasalle等人,1993年)。在临床试验中使用ad载体的实例涉及用于肌肉内注射的抗肿瘤免疫的多核苷酸疗法(sterman等人,《人类基因疗法(hum.genether.)》,第7期:第1083-9页(1998年))。在各个实施例中,通过用包括一种或多种多核苷酸的单纯疱疹病毒(例如,hsv-1、hsv-2)转导细胞,将编码工程化核酸酶和/或供体修复模板的一种或多种多核苷酸导入免疫效应细胞中。成熟的hsv病毒粒子由包膜的二十面体衣壳组成,其中病毒基因组由152kb的线性双链dna分子组成。在一个实施例中,基于hsv的病毒载体缺少一种或多种必需或非必需的hsv基因。在一个实施例中,基于hsv的病毒载体是复制缺陷型的。大多数复制缺陷型hsv载体含有缺失以移除一个或多个中早期、早期或晚期hsv基因以防止复制。例如,hsv载体可能缺少立即早期基因,所述立即早期基因选自由以下组成的群组:icp4、icp22、icp27、icp47及其组合。hsv载体的优点是其进入潜伏期的能力,其可以导致长期dna表达,并且其较大的病毒dna基因组可以容纳高达25kb的外源dna插入物。基于hsv的载体描述于例如美国专利第5,837,532号、第5,846,782号和第5,804,413号,以及国际专利申请wo91/02788、wo96/04394、wo98/15637和wo99/06583,它们各自通过引用整体并入本文。h.组合物和制剂在特定实施例中考虑的组合物可以包括一个或多个多肽、多核苷酸、包括其的载体和免疫效应细胞组合物,如本文所考虑。组合物包含但不限于药物组合物。“药物组合物”是指药学上可接受的或生理学上可接受的溶液中配制的组合物,其单独或与一种或多种其它治疗方式组合给予于细胞或动物。还应理解,如果需要,组合物也可以与其它试剂联合给予,例如细胞因子、生长因子、激素、小分子、化学治疗剂、前药、药物、抗体或其它各种药物活性剂。对组合物中也可能包含的其它组分实际上没有限制,条件是额外的试剂不会不利地影响组合物递送预期治疗的能力。短语“药学上可接受的”在本文中用于指在合理的医学判断范围内适合用于与人类和动物的组织接触而不引起过量毒性、刺激、过敏反应或其它问题或并发症,与合理的利益/风险比相称的那些化合物、材料、组合物和/或剂型。如本文使用,“药学上可接受的载体、稀释剂或赋形剂”包含但不限于任何已经被美国食品和药物管理局批准可用于人或家畜的佐剂、载体、赋形剂、助流剂、甜味剂、稀释剂、防腐剂、染料/着色剂、增味剂、表面活性剂、润湿剂、分散剂、混悬剂、稳定剂、等渗剂、溶剂、表面活性剂或乳化剂。示例性的药学上可接受的载体包含但不限于糖,例如乳糖、葡萄糖和蔗糖;淀粉,例如玉米淀粉和马铃薯淀粉;纤维素及其衍生物,例如羧甲基纤维素钠、乙基纤维素和醋酸纤维素;黄蓍胶;麦芽糖;明胶;滑石;可可脂、蜡、动植物油脂、石蜡、硅酮、膨润土、硅酸、氧化锌;油,例如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油和豆油;二醇,例如丙二醇;多元醇,例如甘油、山梨糖醇、甘露醇和聚乙二醇;酯,例如油酸乙酯和月桂酸乙酯;琼脂;缓冲剂,例如氢氧化镁和氢氧化铝;海藻酸;无热原水;等渗盐水;林格氏溶液;乙醇;磷酸盐缓冲液;以及药物制剂中使用的任何其它相容物质。在特定实施例中,组合物包括通过本文考虑的方法制造的基因组编辑的t细胞。在优选的实施例中,药物t细胞组合物包括基因组编辑的t细胞,其包括一个或多个经修饰的和/或非功能性tcrα等位基因并且表达一种或多种免疫抑制信号减弱子、翻转受体、工程化tcr、car、daric或其它治疗性多肽。通常可以说,包括通过在特定实施例中考虑的方法制造的t细胞的药物组合物可以以约102个至约1010个细胞/kg体重、约105个至约109个细胞/kg体重、约105个至约108个细胞/kg体重、约105个至约107个细胞/kg体重、约107个至约109个细胞/kg体重或约107个至约108个细胞/kg体重(包括这些范围内的所有整数值)的剂量给药。细胞的数量将取决于组合物预期的最终用途以及其中包含的细胞类型。对于本文提供的用途,细胞通常为1升或更小的体积,可以为500ml或更小,甚至250ml或100ml或更小。因此,期望细胞的密度通常大于约106个细胞/ml,并且通常大于约107个细胞/ml,通常约108个细胞/ml或更大。临床相关数量的免疫细胞可以分配到多次输注中,其累积等于或超过约105个、106个、107个、108个、109个、1010个、1011个或1012个细胞。在一些实施例中,特别是因为所有输注的细胞将被重定向至特定的靶抗原,可以给予在106/千克(每个患者106-1011)的范围内的较低数量的细胞。经修饰以表达工程化tcr、car或daric的t细胞可以以这些范围内的剂量多次给予。对于接受治疗的患者,细胞可以是同种异体的、同源的、异种的或自体的。如果需要,治疗还可以包含给予有丝分裂原(例如,pha)或如本文所述的淋巴因子、细胞因子和/或趋化因子(例如,ifn-γ、il-2、il-7、il-15、il-12、tnf-α、il-18、和tnf-β、gm-csf、il-4、il-13、flt3-l、rantes、mip1α等),以增强输注的t细胞的植入和功能。通常,包括如本文所述活化和扩增的细胞的组合物可以用于治疗和预防免疫受损个体中出现的疾病。特别地,包括通过本文考虑的方法制造的经修饰的t细胞的组合物用于治疗癌症。在特定实施例中考虑的基因组编辑的t细胞可以单独给予,或作为药物组合物与载体、稀释剂、赋形剂和/或与其它组分(例如,il-2、il-7和/或il-15或其它细胞因子或细胞群)组合给予。在特定实施例中,本文考虑的药物组合物包括一定量的基因组编辑的t细胞,以及一种或多种药学上或生理学上可接受的载体、稀释剂或赋形剂。包括在特定实施例中考虑的基因组编辑的t细胞的药物组合物可以进一步包括缓冲剂,例如中性缓冲盐水、磷酸盐缓冲盐水等;碳水化合物,例如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇;蛋白质;多肽或氨基酸,例如甘氨酸;抗氧化剂;螯合剂,例如edta或谷胱甘肽;佐剂(例如,氢氧化铝);和防腐剂。在特定实施例中考虑的组合物优选配制用于肠胃外给药,例如血管内(静脉内或动脉内)、腹膜内或肌肉内给药。液体药物组合物,无论它们是溶液、混悬液或其它类似形式,可以包含以下中的一种或多种:无菌稀释剂,例如注射用水、盐溶液(优选生理盐水)、林格氏溶液、等渗氯化钠、固定油(例如,可用作溶剂或混悬介质的作为合成甘油单酯或甘油二酯)、聚乙二醇、甘油、丙二醇或其它溶剂;抗菌剂,例如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,例如抗坏血酸或亚硫酸氢钠;螯合剂,例如乙二胺四乙酸;缓冲剂,例如乙酸盐、柠檬酸盐或磷酸盐,以及调节张力的试剂,例如氯化钠或葡萄糖。肠胃外制剂可以封装在安瓿、一次性注射器或由玻璃或塑料制成的多剂量小瓶中。可注射药物组合物优选是无菌的。在一个实施例中,将本文考虑的基因组编辑的t细胞组合物配制在药学上可接受的细胞培养基中。这种组合物适合于对人类受试者给药。在特定实施例中,药学上可接受的细胞培养基是无血清培养基。与含有血清的培养基相比,无血清培养基具有几个优点,包含简化和更明确的组成、降低的污染程度、消除了潜在的传染剂来源和更低的成本。在各个实施例中,无血清培养基是无动物源性的,并且可以任选地不含蛋白质。任选地,培养基可含有生物药学上可接受的重组蛋白。“无动物源性的”培养基是指其中组分源自非动物来源的培养基。重组蛋白在无动物源性培养基中代替天然动物蛋白,并且营养物质从合成、植物或微生物来源获得。相反,“无蛋白质的”培养基定义为基本上不含蛋白质。用于特定组合物的无血清培养基的说明性实例包含但不限于qbsf-60(qualitybiological,inc.)、stempro-34(lifetechnologies)和x-vivo10。在一个优选的实施例中,将包括本文考虑的基因组编辑的t细胞的组合物配制在包括勃脉力a的溶液中。在另一个优选的实施例中,将包括本文考虑的基因组编辑的t细胞的组合物配制在包括冷冻保存培养基的溶液中。例如,具有冷冻保存剂的冷冻保存介质可以用于在解冻后维持高细胞活力结果。用于特定组合物的冷冻保存介质的说明性实例包含但不限于cryostorcs10、cryostorcs5和cryostorcs2。在一个更优选的实施例中,将包括本文考虑的基因组编辑的t细胞的组合物配制在包括50∶50勃脉力a/cryostorcs10的溶液中。在一个特定实施例中,本文考虑的组合物包括单独的有效量的扩增的基因组编辑的t细胞组合物,或其与一种或多种治疗剂的组合。因此,t细胞组合物可以单独给予或与其它已知的癌症治疗(例如,放射疗法、化学疗法、移植、免疫疗法、激素疗法、光动力疗法等)组合给予。组合物还可以与抗生素组合给予。本领域可以接受这种治疗剂作为如本文所述的特定疾病状态(例如,特定癌症)的标准治疗。在特定实施例中考虑的示例性治疗剂包含细胞因子、生长因子、类固醇、nsaid、dmard、抗炎剂、化学治疗剂、放射治疗剂、治疗性抗体或其它活性和辅助剂。在某些实施例中,包括本文考虑的t细胞的组合物可以与任何数量的化学治疗剂联合给予。化学治疗剂的说明性实例包含烷化剂,例如噻替哌和环磷酰胺(cytoxantm);烷基磺酸盐,例如白消安、英丙舒凡和哌泊舒凡;氮丙啶,例如苯并多巴(benzodopa)、卡波醌、美妥多巴(meturedopa)和乌瑞多巴(uredopa);乙烯亚胺和甲基蜜胺,包含六甲蜜胺、三亚乙基蜜胺、三亚乙基磷酰胺、三亚乙基硫代磷酰胺和三羟甲基蜜胺;氮芥,例如苯丁酸氮芥、萘氮芥、环磷酰胺、雌莫司汀、异环磷酰胺、二氯甲基二乙胺、盐酸氧氮芥、美法仑、新恩比兴、苯芥胆甾醇、泼尼莫司汀、曲磷胺、尿嘧啶氮芥;亚硝基脲,例如卡莫司汀、氯脲霉素、福莫司汀、洛莫司汀、尼莫司汀和雷莫司汀;抗生素,例如阿克拉霉素、放线菌素、氨茴霉素、重氮丝氨酸、博来霉素、放线菌素c、卡拉比星(carabicin)、洋红霉素、嗜癌素、色霉素、放线菌素d、柔红霉素、地托比星、6-重氮-5-氧代-l-正亮氨酸、多柔比星、表柔比星、依索比星、伊达比星、麻西罗霉素、丝裂霉素、霉酚酸、诺加霉素、橄榄霉素、培洛霉素、泊非霉素(potfiromycin)、嘌呤霉素、三铁阿霉素、罗多比星、链黑菌素、链佐星、杀结核菌素、乌苯美司、净司他丁、佐柔比星;抗代谢物,例如甲氨蝶呤和5-氟尿嘧啶(5-fu);叶酸类似物,例如二甲叶酸、甲氨蝶呤、蝶罗呤、三甲曲沙;嘌呤类似物,例如氟达拉滨、6-巯基嘌呤、硫咪嘌呤、硫鸟嘌呤;嘧啶类似物,例如安西他滨、阿扎胞苷、6-氮尿苷、卡莫氟、阿糖胞苷、双脱氧尿苷、去氧氟尿苷、依诺他滨、氟尿苷、5-fu;雄激素,例如卡鲁睾酮、丙酸屈他雄酮、环硫雄醇、美雄烷、睾内酯;抗肾上腺素,例如氨鲁米特、米托坦、曲洛司坦;叶酸补充剂,例如亚叶酸(frolinicacid);醋葡醛内酯;醛磷酰胺糖苷;氨基乙酰丙酸;安吖啶;贝斯布西(bestrabucil);比生群;依达曲沙;地磷酰胺(defofamine);地美可辛;地吖醌;依氟鸟氨酸;依利醋铵;依托格鲁;硝酸镓;羟脲;香菇多糖;氯尼达明;米托胍腙;米托蒽醌;莫哌达醇;硝基可润;喷司他丁;苯来美特;吡柔比星;鬼臼酸;2-乙基酰肼;甲基苄肼;雷佐生;西佐喃;螺环锗;细交链孢菌酮酸;三亚胺醌;2,2′,2”-三氯三乙胺;氨基甲酸乙酯;长春地辛;达卡巴嗪;甘露醇氮芥;二溴甘露醇;二溴卫矛醇;哌泊溴烷;格斯托辛(gacytosine);阿拉伯糖苷(“ara-c”);环磷酰胺;塞替派;紫杉烷,例如紫杉醇和多西他赛苯丁酸氮芥;吉西他滨;6-硫鸟嘌呤;巯基嘌呤;甲氨蝶呤;铂类似物,例如顺铂和卡铂;长春碱;铂;依托泊苷(vp-16);异环磷酰胺;丝裂霉素c;米托蒽醌;长春新碱;长春瑞滨;长春瑞滨;诺维本;替尼泊苷;柔红霉素;氨蝶呤;希罗达;伊班膦酸盐;cpt-11;拓扑异构酶抑制剂rfs2000;二氟甲基鸟氨酸(dmfo);视黄酸衍生物,例如targretintm(贝沙罗汀)、panretintm(阿利维a酸);ontaktm(地尼白介素连接物(denileukindiftitox));埃斯培拉霉素;卡培他滨;和任何上述药学上可接受的盐、酸或衍生物。该定义还包含用于调节或抑制对肿瘤的激素作用的抗激素剂,例如抗雌激素,包含例如他莫昔芬、雷洛昔芬、芳香酶抑制4(5)-咪唑、4-羟基他莫昔芬、曲沃昔芬、那洛昔芬(keoxifene)、ly117018、奥那司酮和托瑞米芬(fareston);和抗雄激素,例如氟他胺、尼鲁米特、比卡鲁胺、亮脯利特和戈舍瑞林;和任何上述药学上可接受的盐、酸或衍生物。多种其它治疗剂可以与本文考虑的组合物联合使用。在一个实施例中,包括t细胞的组合物与抗炎剂一起给予。抗炎剂或药物包含但不限于类固醇和糖皮质激素(包含倍他米松、布地奈德、地塞米松,醋酸氢化可的松、氢化可的松、氢化可的松、甲基强的松龙、强的松龙、强的松、去炎松)、非类固醇抗炎药物(nsaids)(包含阿司匹林、布洛芬、萘普生、甲氨蝶呤、柳氮磺胺吡啶、来氟米特、抗tnf药物、环磷酰胺和霉酚酸酯)。其它示例性nsaid选自由以下组成的群组:布洛芬、萘普生、萘普生钠、cox-2抑制剂(例如(罗非昔布)和(塞来昔布))和唾液酸盐。示例性止痛剂选自由以下组成的群组:对乙酰氨基酚、羟考酮、盐酸丙氧芬的曲马多。示例性糖皮质激素选自由以下组成的群组:可的松、地塞米松、氢化可的松、甲基强的松龙、强的松龙或强的松。示例性生物反应调节剂包含针对细胞表面标志物的分子(例如cd4、cd5等)、细胞因子抑制剂(诸如tnf拮抗剂(例如,依那西普)、阿达木单抗和英夫利昔单抗)、趋化因子抑制剂和粘附分子抑制剂。生物反应调节剂包含单克隆抗体以及重组形式的分子。示例性dmard包含硫唑嘌呤、环磷酰胺、环孢菌素、甲氨蝶呤、青霉胺、来氟米特、柳氮磺胺吡啶、羟氯喹、金(口服(金诺芬)和肌肉注射))和米诺环素。适合与在特定实施例中考虑的基因组编辑的t细胞组合的治疗性抗体的说明性实例包含但不限于阿巴伏单抗、阿德木单抗、阿夫土珠单抗、阿仑单抗、阿妥莫单抗、阿麦妥昔、安那莫单抗、阿西莫单抗、巴维昔单抗、贝妥莫单抗、贝伐单抗、比伐珠单抗、布利妥莫单抗、贝伦妥单抗、坎妥珠单抗、卡妥索单抗、西妥昔单抗、西他珠单抗、西妥木单抗、克莱维珠单抗、可那木单抗、达雷木单抗、卓齐妥单抗、度利戈妥单抗、度司妥单抗、地莫单抗、达西珠单抗、达洛珠单抗、依美昔单抗、依洛珠单抗、恩司昔单抗、厄马索单抗、埃达珠单抗、法勒珠单抗、芬克拉妥珠单抗、芬妥木单抗、弗拉伏妥单抗、伏妥昔单抗、加尼妥单抗、吉妥珠单抗、吉瑞昔单抗、格莱木单抗、伊莫单抗、伊戈伏单抗、英加妥珠单抗、英达西单抗、伊珠单抗、英妥木单抗、伊匹木单抗、伊妥木单抗、拉贝珠单抗、来沙木单抗、林妥珠单抗、洛伏珠单抗、鲁卡木单抗、马帕木单抗、马妥珠单抗、米拉珠单抗、明瑞莫单抗、米妥莫单抗、莫西妥莫单抗、纳那妥单抗、他那莫单抗、奈昔木单抗、尼妥珠单抗、诺菲妥莫单抗、奥卡拉妥珠单抗、奥法木单抗、奥拉单抗、奥纳珠单抗、莫奥珠单抗、奥戈伏单抗、帕尼单抗、巴萨妥珠单抗、帕曲土单抗、培妥莫单抗、培妥珠单抗、平妥单抗、普立木单抗、雷妥莫单抗、雷得妥单抗、利妥木单抗、利妥昔单抗、罗妥木单抗、沙妥莫单抗、西罗珠单抗、司妥昔单抗、西妥珠单抗、索利特单抗、他卡妥珠单抗、他莫单抗、替妥莫单抗、替妥木单抗、替加珠单抗、托西莫单抗、曲妥珠单抗、妥可妥珠单抗、乌布利妥昔单抗、维妥珠单抗、沃妥珠单抗、伏妥昔单抗、扎芦木单抗、cc49和3e8。在某些实施例中,本文考虑的组合物与细胞因子联合给予。本文使用的“细胞因子”是指由一种细胞群释放的作为细胞间介质作用于另一种细胞的蛋白质的专业术语。这种细胞因子的实例是淋巴因子、单核因子、趋化因子和传统的多肽激素。细胞因子中包含生长激素,例如人生长激素、n-甲硫氨酰人生长激素和牛生长激素;甲状旁腺激素;甲状腺素;胰岛素;胰岛素原;松弛素;松弛素原;糖蛋白激素,例如促卵泡激素(fsh)、促甲状腺激素(tsh)和黄体化激素(lh);肝生长因子;成纤维细胞生长因子;催乳素;胎盘催乳素;肿瘤坏死因子-α和-β;缪勒管抑制物质;小鼠促性腺激素相关肽;抑制素;活化素;血管内皮生长因子;整合;促血小板生成素(tpo);神经生长因子,例如ngf-β;血小板生长因子;转化生长因子(tgf),例如tgf-α和tgf-β;胰岛素样生长因子-i和-ii;促红细胞生成素(epo);骨诱导因子;干扰素,例如干扰素-α、β和-γ;集落刺激因子(csf),例如巨噬细胞-csf(m-csf);粒细胞-巨噬细胞-csf(gm-csf);和粒细胞-csf(g-csf);白细胞介素(il),例如il-1、il-1α、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10、il-11、il-12;il-15,肿瘤坏死因子,例如tnf-α或tnf-β;和其它多肽因子,包含lif和试剂盒配体(kl)。如本文使用,术语细胞因子包含来自天然来源或来自重组细胞培养物的蛋白质,以及天然序列细胞因子的生物活性等同物。在特定实施例中,组合物包括本文考虑的基因组编辑的t细胞,所述基因组编辑的t细胞在存在如本文公开的pi3k抑制剂的情况下培养并表达一种或多种以下标志物:cd3、cd4、cd8、cd27、cd28、cd45ra、cd45ro、cd62l、cd127和hla-dr可通过阳性或阴性选择技术进一步分离。在一个实施例中,表达标志物(选自由以下组成的群组:i)cd62l、ccr7、cd28、cd27、cd122、cd127、cd197;ii)cd62l、cd127、cd197、cd38;和iii)cd62l、cd27、cd127和cd8)中的一种或多种的特异性t细胞亚群通过阳性或阴性选择技术进一步分离。在各个实施例中,组合物不表达或基本上不表达以下标志物中的一种或多种:cd57、cd244、cd160、pd-1、ctla4、tim3和lag3。在一个实施例中,与在没有pi3k抑制剂的情况下活化和扩增的t细胞群相比,标志物(选自由以下组成的群组:cd62l、cd127、cd197和cd38)中的一种或多种的表达增加至少1.5倍、至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少25倍或更多倍。在一个实施例中,与在没有pi3k抑制剂的情况下活化和扩增的t细胞群相比,标志物(选自由以下组成的群组:cd62l、cd127、cd27和cd8)中的一种或多种的表达增加至少1.5倍、至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少25倍或更多倍。在一个实施例中,与在没有pi3k抑制剂的情况下活化和扩增的t细胞群相比,标志物(选自由以下组成的群组:cd57、cd244、cd160、pd-1、ctla4、tim3和lag3)中的一种或多种的表达增加至少1.5倍、至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少25倍或更多倍。i.靶细胞实施例,预期基因组编辑的免疫效应细胞重定向至靶细胞,例如肿瘤或癌细胞,并且包括具有结合至细胞上靶抗原的结合结构域的工程化tcr、car或daric。这种基因组编辑的免疫效应细胞包含进一步包括一种或多种免疫抑制信号减弱子、翻转受体或其它治疗性多肽的t细胞。在一个实施例中,靶细胞表达抗原,例如基本上不存在于其它正常(所需)细胞表面上的靶抗原。在一个实施例中,靶细胞是骨细胞、造骨细胞、成骨细胞、脂肪细胞、软骨细胞、成软骨细胞、肌细胞、骨骼肌细胞、成肌细胞、肌肉细胞、平滑肌细胞、膀胱细胞、骨髓细胞、中枢神经系统(cns)细胞、周围神经系统(pns)细胞、胶质细胞、星形胶质细胞、神经元、色素细胞、上皮细胞、皮肤细胞、内皮细胞、血管内皮细胞、乳腺细胞、结肠细胞、食道细胞、胃肠细胞、胃细胞、结肠细胞、头细胞、颈细胞、牙龈细胞、舌细胞、肾细胞、肝细胞、肺细胞、鼻咽细胞、卵巢细胞、滤泡细胞、宫颈细胞、阴道细胞、子宫细胞、胰腺细胞、胰腺实质细胞、胰腺导管细胞、胰岛细胞、前列腺细胞、阴茎细胞、性腺细胞、睾丸细胞、造血细胞、淋巴细胞或髓样细胞。在一个实施例中,靶细胞是实体癌细胞。可以通过在特定实施例中考虑的组合物和方法靶向的细胞的说明性实例包含但不限于以下实体癌:肾上腺癌、肾上腺皮质癌、肛门癌、阑尾癌、星形细胞瘤、非典型畸胎瘤/横纹肌样瘤、基底细胞癌、胆管癌、膀胱癌、骨癌、脑/cns癌、乳腺癌、支气管肿瘤、心脏肿瘤、宫颈癌、胆管癌、软骨肉瘤、脊索瘤、结肠癌、结直肠癌、颅咽管瘤、原位管癌(dcis)子宫内膜癌、室管膜瘤、食道癌、鼻腔神经胶质瘤、尤文氏肉瘤、颅外生殖细胞瘤、性腺外生殖细胞瘤、眼癌、输卵管癌、纤维组织肉瘤、纤维肉瘤、胆囊癌、胃癌、胃肠道类癌、胃肠道间质肿瘤(gist)、生殖细胞肿瘤、胶质瘤、成胶质细胞瘤、头颈癌、成血管细胞瘤、肝细胞癌、下咽癌、眼内黑素瘤、卡波西肉瘤、肾癌、喉癌、平滑肌肉瘤、唇癌、脂肪肉瘤、肝癌、肺癌、非小细胞肺癌、肺类癌肿瘤、恶性间皮瘤、髓样癌、成神经管细胞瘤、脑膜瘤、黑素瘤、梅克尔细胞癌、中线癌、口癌、粘液肉瘤、骨髓增生异常综合征、骨髓增殖性肿瘤、鼻腔和鼻窦癌、鼻咽癌、成神经细胞瘤、少突神经胶质瘤、口部癌、口腔癌、口咽癌、骨肉瘤、卵巢癌、胰腺癌、胰岛细胞瘤、乳头状癌、副神经节瘤、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、松果体瘤、垂体瘤、胸膜肺母细胞瘤、原发性腹膜癌、前列腺癌、直肠癌、成视网膜细胞瘤、肾细胞癌、肾盂和输尿管癌、横纹肌肉瘤、唾液腺癌、皮脂腺癌、皮肤癌、软组织肉瘤、鳞状细胞癌、小细胞肺癌、小肠癌、胃癌、汗腺癌、滑膜瘤、睾丸癌、咽喉癌、胸腺癌、甲状腺癌、尿道癌、子宫癌、子宫肉瘤、阴道癌、血管癌、外阴癌和维尔姆斯瘤。在一个实施例中,靶细胞是液体癌或血液癌细胞。血液癌的说明性实例包含但不限于:白血病、淋巴瘤和多发性骨髓瘤。可以通过在特定实施例中考虑的组合物和方法靶向的细胞的说明性实例包含但不限于以下白血病中的那些:急性淋巴细胞白血病(all)、急性骨髓性白血病(aml)、成髓细胞、早幼粒细胞、髓单核细胞、单核细胞、红白血病、毛细胞白血病(hcl)、慢性淋巴细胞白血病(cll)和慢性骨髓性白血病(cml)、慢性髓单核细胞白血病(cmml)和真性红细胞增多症。可以通过在特定实施例中考虑的组合物和方法靶向的细胞的说明性实例包含但不限于以下淋巴瘤中的那些:霍奇金淋巴瘤、结节性淋巴细胞为主的霍奇金淋巴瘤和非霍奇金淋巴瘤,包含但不限于b细胞非霍奇金淋巴瘤:伯基特淋巴瘤、小淋巴细胞淋巴瘤(sll)、弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤、免疫母细胞性大细胞淋巴瘤、前体b淋巴母细胞淋巴瘤、边缘区淋巴瘤和套细胞淋巴瘤;和t细胞非霍奇金淋巴瘤:蕈样肉芽肿、间变性大细胞淋巴瘤、赛塞里综合征和前体t淋巴母细胞淋巴瘤。可以通过在特定实施例中考虑的组合物和方法靶向的细胞的说明性实例包含但不限于以下多发性骨髓瘤中的那些:明显多发性骨髓瘤、阴燃多发性骨髓瘤、浆细胞白血病、非分泌性骨髓瘤、igd骨髓瘤、骨硬化性骨髓瘤、骨孤立性浆细胞瘤和髓外浆细胞瘤。在另一个特定实施例中,靶细胞是癌细胞,例如患有癌症的患者的细胞。在一个实施例中,靶细胞是细胞,例如被病毒(包含但不限于cmv、hpv和ebv)感染的癌细胞。在一个实施例中,靶抗原是α叶酸受体、5t4、αvβ6整联蛋白、bcma、b7-h3、b7-h6、caix、cd19、cd20、cd22、cd30、cd33、cd44、cd44v6、cd44v7/8、cd70、cd79a、cd79b、cd123、cd138、cd171、cea、cspg4、egfr的表位,包含erbb2的egfr家族(her2)、egfrviii、egp2、egp40、epcam、epha2、epcam、fap、胎achr、frα、gd2、gd3、磷脂酰肌醇蛋白聚糖-3(gpc3)、hla-a1+mage1、hla-a2+mage1、hla-a3+mage1、hla-a1+ny-eso-1、hla-a2+ny-eso-1、hla-a3+ny-eso-1、il-11rα、il-13rα2、λ、路易斯y、κ、间皮蛋白、muc1、muc16、ncam、nkg2d配体、ny-eso-1、prame、psca、psma、ror1、ssx、存活蛋白、tag72、tem、vegfr2和wt-1。j.治疗方法由本文考虑的组合物和方法制造的基因组编辑的免疫效应细胞提供了改进的过继性细胞疗法,用于治疗各种病状,包含但不限于癌症、感染性疾病、自身免疫疾病、炎性疾病和免疫缺陷。在特定实施例中,通过用本文考虑的工程化tcr、car或daric遗传修饰原代t细胞,将原代t细胞的特异性重定向至肿瘤或癌细胞。在一个实施例中,将基因组编辑的t细胞输注给有需要的受体。输注的细胞能够杀死受体中的肿瘤细胞。与抗体疗法不同,基因组编辑的t细胞能够在体内复制;因此,有助于长期持久性,可以导致持续的癌症治疗。此外,在特定实施例中考虑的基因组编辑的t细胞提供了更安全且更有效的过继性细胞疗法,因为它们基本上缺乏功能性内源性tcr表达,从而减少潜在的移植物排斥;并且包括一种或多种包括一种或多种免疫抑制信号减弱子、翻转受体,其增加t细胞在肿瘤微环境中的耐久性和持久性。在一个实施例中,本文考虑的基因组编辑的t细胞可以经历稳健的体内t细胞扩增并且可以持续延长的时间量。在另一个实施例中,本文考虑的基因组编辑的t细胞进化为特异性记忆t细胞,其可以被重新活化以抑制任何额外的肿瘤形成或生长。在特定实施例中,本文考虑的基因组编辑的t细胞用于治疗实体瘤或癌症。在特定实施例中,本文考虑的基因组编辑的t细胞用于治疗实体瘤或癌症,包含但不限于:肾上腺癌、肾上腺皮质癌、肛门癌、阑尾癌、星形细胞瘤、非典型畸胎瘤/横纹肌样瘤、基底细胞癌、胆管癌、膀胱癌、骨癌、脑/cns癌、乳腺癌、支气管肿瘤、心脏肿瘤、宫颈癌、胆管癌、软骨肉瘤、脊索瘤、结肠癌、结直肠癌、颅咽管瘤、原位管癌(dcis)子宫内膜癌、室管膜瘤、食道癌、鼻腔神经胶质瘤、尤文氏肉瘤、颅外生殖细胞瘤、性腺外生殖细胞瘤、眼癌、输卵管癌、纤维组织肉瘤、纤维肉瘤、胆囊癌、胃癌、胃肠道类癌、胃肠道间质肿瘤(gist)、生殖细胞肿瘤、胶质瘤、成胶质细胞瘤、头颈癌、成血管细胞瘤、肝细胞癌、下咽癌、眼内黑素瘤、卡波西肉瘤、肾癌、喉癌、平滑肌肉瘤、唇癌、脂肪肉瘤、肝癌、肺癌、非小细胞肺癌、肺类癌肿瘤、恶性间皮瘤、髓样癌、成神经管细胞瘤、脑膜瘤、黑素瘤、梅克尔细胞癌、中线癌、口癌、粘液肉瘤、骨髓增生异常综合征、骨髓增殖性肿瘤、鼻腔和鼻窦癌、鼻咽癌、成神经细胞瘤、少突神经胶质瘤、口部癌、口腔癌、口咽癌、骨肉瘤、卵巢癌、胰腺癌、胰岛细胞瘤、乳头状癌、副神经节瘤、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、松果体瘤、垂体瘤、胸膜肺母细胞瘤、原发性腹膜癌、前列腺癌、直肠癌、成视网膜细胞瘤、肾细胞癌、肾盂和输尿管癌、横纹肌肉瘤、唾液腺癌、皮脂腺癌、皮肤癌、软组织肉瘤、鳞状细胞癌、小细胞肺癌、小肠癌、胃癌、汗腺癌、滑膜瘤、睾丸癌、咽喉癌、胸腺癌、甲状腺癌、尿道癌、子宫癌、子宫肉瘤、阴道癌、血管癌、外阴癌和维尔姆斯瘤。在特定实施例中,本文考虑的基因组编辑的t细胞用于治疗实体瘤或癌症,包含但不限于肝癌、胰腺癌、肺癌、乳腺癌、膀胱癌、脑癌、骨癌、甲状腺癌、肾癌或皮肤癌。在特定实施例中,本文考虑的基因组编辑的t细胞用于治疗各种癌症,包含但不限于胰腺癌、膀胱癌和肺癌。在特定实施例中,本文考虑的基因组编辑的t细胞用于治疗液体癌或血液癌。在特定实施例中,本文考虑的基因组编辑的t细胞用于治疗b细胞恶性肿瘤,包含但不限于:白血病、淋巴瘤和多发性骨髓瘤。在特定实施例中,本文考虑的基因组编辑的t细胞用于治疗液体癌,包含但不限于白血病、淋巴瘤和多发性骨髓瘤:急性淋巴细胞白血病(all)、急性骨髓性白血病(aml)、成髓细胞、早幼粒细胞、髓单核细胞、单核细胞、红白血病、毛细胞白血病(hcl)、慢性淋巴细胞白血病(cll)和慢性骨髓性白血病(cml)、慢性髓单核细胞白血病(cmml)和真性红细胞增多症、霍奇金淋巴瘤、结节性淋巴细胞为主的霍奇金淋巴瘤、伯基特淋巴瘤、小淋巴细胞淋巴瘤(sll)、弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤、免疫母细胞性大细胞淋巴瘤、前体b淋巴母细胞淋巴瘤、套细胞淋巴瘤、边缘区淋巴瘤、蕈样肉芽肿、间变性大细胞淋巴瘤、赛塞里综合征、前体t淋巴细胞淋巴瘤、多发性骨髓瘤、明显多发性骨髓瘤、阴燃多发性骨髓瘤、浆细胞白血病、非分泌性骨髓瘤、igd骨髓瘤、骨硬化性骨髓瘤、骨孤立性浆细胞瘤和髓外浆细胞瘤。在特定实施例中,提供了包括将治疗有效量的本文考虑的基因组编辑的t细胞或包括其的组合物单独或与一种或多种治疗剂组合给予有需要的患者的方法。在某些实施例中,细胞用于治疗患有癌症风险的患者。因此,特定实施例包括治疗或预防或改善癌症的至少一种症状,包括向有需要的受试者给予治疗有效量的本文考虑的基因组编辑的t细胞。在一个实施例中,治疗有需要的受试者的癌症的方法包括给予有效量(例如,治疗有效量)的包括本文考虑的基因组编辑的t细胞的组合物。给药的数量和频率将由一些因素确定的,例如患者的病状以及患者的疾病的类型和严重程度,但是可以通过临床试验确定适当的剂量。在一个实施例中,给予于受试者的组合物中免疫效应细胞(例如,t细胞)的数量为至少0.1x105个细胞、至少0.5x105个细胞、至少1x105个细胞、至少5x105个细胞、至少1x106个细胞、至少0.5x107个细胞、至少1x107个细胞、至少0.5x108个细胞、至少1x108个细胞、至少0.5x109个细胞、至少1x109个细胞、至少2x109个细胞、至少3x109个细胞、至少4x109个细胞、至少5x109个细胞或至少1x1010个细胞。在特定实施例中,向受试者给予约1x107个t细胞至约1x109个t细胞、约2x107个t细胞至约0.9x109个t细胞、约3x107个t细胞至约0.8x109个t细胞、约4x107个t细胞至约0.7x109个t细胞、约5x107个t细胞至约0.6x109个t细胞、或约5x107个t细胞至约0.5x109个t细胞。在一个实施例中,给予于受试者的组合物中免疫效应细胞(例如,t细胞)的数量为至少0.1x104个细胞/kg体重、至少0.5x104个细胞/kg体重、至少1x104个细胞/kg体重、至少5x104个细胞/kg体重、至少1x105个细胞/kg体重、至少0.5x106个细胞/kg体重、至少1x106个细胞/kg体重、至少0.5x107个细胞/kg体重、至少1x107个细胞/kg体重、至少0.5x108个细胞/kg体重、至少1x108个细胞/kg体重、至少2x108个细胞/kg体重、至少3x108个细胞/kg体重、至少4x108个细胞/kg体重、至少5x108个细胞/kg体重、或至少1x109个细胞/kg体重。在特定实施例中,向受试者给予约1x106个t细胞/kg体重至约1x108个t细胞/kg体重、约2x106个t细胞/kg体重至约0.9x108个t细胞/kg体重、约3x106个t细胞/kg体重至约0.8x108个t细胞/kg体重、约4x106个t细胞/kg体重至约0.7x108个t细胞/kg体重、约5x106个t细胞/kg体重至约0.6x108个t细胞/kg体重、或约5x106个t细胞/kg体重至约0.5x108个t细胞/kg体重。本领域普通技术人员将认识到,可能需要多次给予在特定实施例中考虑的组合物以实现期望的疗法。例如,组合物可以在1周、2周、3周、1个月、2个月、3个月、4个月、5个月、6个月、1年、2年、5年、10年或更长时间内给予1次、2次、3次、4次、5次、6次、7次、8次、9次或10次或更多次。在某些实施例中,可能需要将活化的t细胞给予于受试者,然后随后重新抽取血液(或进行单采血液成分术),从中活化t细胞,并用这些活化和扩增的t细胞重新输注患者。该过程可以每隔几周进行多次。在某些实施例中,可以从10cc至400cc的血液抽取活化t细胞。在某些实施例中,从20cc、30cc、40cc、50cc、60cc、70cc、80cc、90cc、100cc、150cc、200cc、250cc、300cc、350cc或400cc或更多的血液抽取活化t细胞。不受理论束缚,使用该多次抽血/多次重新输注方案可以用于选择某些t细胞群。在特定实施例中考虑的组合物的给予可以以任何方便的方式进行,包含通过气溶胶吸入、注射、摄取、输血、植入或移植。在一个优选的实施例中,肠胃外给予组合物。本文使用的短语“肠胃外给药(parenteraladministration/administeredparenterally)”是指除肠内和局部给药以外的给药方式,通常通过注射,包含但不限于血管内、静脉内、肌肉内、动脉内、鞘内、囊内、眶内、瘤内、心内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内和胸骨内注射和输注。在一个实施例中,通过直接注射到肿瘤、淋巴结或感染部位将本文考虑的组合物给予于受试者。在一个实施例中,向有需要的受试者给予有效量的组合物以增加对受试者中癌症的细胞免疫反应。免疫反应可以包含由能够杀死感染细胞的细胞毒性t细胞、调节性t细胞和辅助t细胞反应介导的细胞免疫反应。还可以诱导主要由能够激活b细胞从而导致抗体生产的辅助t细胞介导的体液免疫反应。可以使用多种技术来分析由组合物诱导的免疫反应的类型,这在本领域中有很好的描述;例如,《现代免疫学实验指南(currentprotocolsinimmunology)》,编辑:johne.coligan,adam.kruisbeek,davidh.margulies,ethanm.shevach,warrenstrober(2001年)johnwiley&sons,纽约,纽约州。在一个实施例中,治疗被诊断患有癌症的受试者的方法包括从受试者中移除免疫效应细胞,编辑所述免疫效应细胞的基因组并生产基因组编辑的免疫效应细胞群,以及向同一受试者给予基因组编辑的免疫效应细胞群。在一个优选的实施例中,免疫效应细胞包括t细胞。用于给予在特定实施例中考虑的细胞组合物的方法包含任何有效导致离体基因组编辑的免疫效应细胞的重新导入,或有效于免疫效应细胞的基因组编辑的祖细胞的重新导入或有效于分化的成熟免疫效应细胞导入受试者的方法。一种方法包括对外周血t细胞进行离体基因组编辑并将转导的细胞返回受试者。本说明书中引用的所有出版物、专利申请和授权专利均通过引用结合到本文中,如同每个单独的出版物、专利申请或授权专利被具体地和单独地指出以通过引用并入。尽管为了清楚理解的目的已经通过说明和实例详细地描述了前述实施例,但是根据本文考虑的教导,本领域普通技术人员将容易明白,某些改变和修改可以是在不脱离所附权利要求的精神或范围的情况下做出。以下实例仅以说明的方式提供,而不是作为限制。本领域技术人员将容易地认识到可以改变或修改以产生基本相似结果的各种非关键参数。实例实例1将编码荧光蛋白的转基因同源重组入t细胞受体α(tcrα)基因座设计并构建了含有转基因盒的腺相关病毒(aav)质粒(seqidno:8和9),所述转基因盒包括启动子、编码荧光蛋白的转基因和多腺苷酸化信号。用xmai酶切液(digest)证实aavitr元件的完整性。将转基因盒置于tcrα基因恒定区的外显子1内的两个同源区之间,以通过同源重组(aav靶向载体)进行靶向。5′和3′同源区的长度分别为~1500bp和~1000bp,并且两个同源区都不含有完整的megatal靶位点(seqidno:10)。示例性表达盒含有短延长因子1α(sef1α)或骨髓增生性肉瘤病毒增强子、阴性对照区缺失的d1587rev引物结合位点取代的(mnd)启动子,其可操作地连接到编码荧光多肽的多核苷酸,所述荧光多肽例如蓝色荧光蛋白(bfp)、红色荧光蛋白(rfp)、青色荧光蛋白(cfp)、绿色荧光蛋白(gfp)等。图1a。表达盒还含有sv40晚期多腺苷酸化信号。通过用一种或多种质粒瞬时共转染hek293t细胞制备重组aav(raav),所述质粒提供必需的复制、衣壳和腺病毒辅助元件。使用超速离心以基于碘克沙醇的梯度从共转染的hek293t细胞培养物中纯化raav。在用cd3和cd28活化的原代人t细胞中评价megatal诱导的同源重组,并在补充有il-2的完全培养基中培养。3天后,洗涤t细胞并用编码靶向megatal的tcrα(seqidno:11)的体外转录mrna电穿孔,随后用编码sef1α-bfp或mnd-gfp转基因盒的纯化重组aav转导。对照仅包含含有megatal或raav靶向载体的t细胞。在多个时间点使用流式细胞术来测量表达荧光蛋白的t细胞的频率,并区分荧光蛋白与非整合的raav靶向载体的瞬时表达。通过cd3染色的损失检测megatal介导的tcrα基因破坏。图1b。在用megatal和raav靶向载体治疗的20-60%的t细胞中观察到长期转基因表达。用定量pcr和southern印迹分析证实同源重组。在对照样品中,单独的raav治疗产生不同水平的瞬时荧光蛋白表达(用mnd-gfp转基因观察到更高的瞬时表达)和在治疗的t细胞中非常低水平(<1%)的长期荧光蛋白表达,这与缺少整合至基因组中相一致。tcrα基因座的megatal破坏范围为50%至90%(cd3表面表达的损失)。megatal和megatal加上raav靶向载体治疗的t细胞之间的megatal活性相似,表明hr介导的转基因盒插入取代了非同源末端连接(nhej)驱动的插入/缺失事件。cd3阴性隔室内的gfp+细胞的富集强烈地表明hr发生在功能性和非功能性tcrα等位基因中。在从几个独立供体分离的t细胞上进行的实验中证实了结果。图1d。实例2将编码嵌合抗原受体(car)的转基因同源重组入tcrα基因座设计、构建并验证了含有启动子、编码嵌合抗原受体(car)的转基因和多腺苷酸化信号的腺相关病毒(aav)质粒(seqidno:12)。图2a。car表达盒含有与car可操作地连接的mnd启动子,其包括cd8α衍生的信号肽、靶向cd19抗原的单链可变片段(scfv)、cd8α衍生的铰链区和跨膜结构域、细胞内4-1bb共刺激结构域和cd3ζ信号转导结构域。为了使用较大的car转基因实现有效的raav生产,5′和3′同源区各自减少至~650bp。如实例1中所述,用cd3和cd28活化原代人t细胞。使用用编码tcrα靶向megatal的体外转录mrna电穿孔的活化原代人t细胞评价megatal诱导的使car转基因进入tcrα基因座的hr。用编码抗cd19car的raav转导电穿孔的t细胞,并在存在il2的情况下于37℃培养。在电穿孔后7天(10天总培养)进行car染色。对照仅包含含有megatal或aav治疗的t细胞,以及用包括抗cd19car表达盒的慢病毒(lv)载体转导的t细胞。通过用pe缀合的cd19-fc染色,通过流式细胞术分析抗cd19-car表达。用megatalmrna和raav-car治疗的t细胞在30-60%的总细胞中表现出抗cd19car表达。在未经治疗的、lv治疗的(lv-t)、megatal治疗的和megatal/raavcar治疗的t细胞之间观察到类似的t细胞扩增速率和类似的t细胞表型。图2b。使用稳定表达cd19肿瘤抗原(k562-cd19+)的k562红白血病细胞系进行功能分析。在t细胞中分析t细胞细胞毒性和细胞因子产生,所述t细胞包括以1∶1比例与k562-cd19+细胞混合的整合到tcrα基因座(hr-car+t细胞)中的抗cd19car(图2c)。在高效应子∶靶标(e∶t)比例下观察到类似的细胞毒性率,与较低e∶t比例的lv治疗的细胞相比,hr-car+t细胞表现出略微降低的细胞毒性。相反,与lv治疗的细胞相比,hr-car+t细胞培养物中ifnγ的产生更高。实例3将编码嵌合抗原受体(car)的转基因同源重组入tcrα基因座设计、构建并验证了含有启动子、编码嵌合抗原受体(car)的转基因和多腺苷酸化信号的腺相关病毒(aav)质粒(seqidno:12)。还设计、构建和验证了编码car的慢病毒载体。图3a。car表达盒含有与car可操作地连接的mnd启动子,其包括cd8α衍生的信号肽、靶向cd19抗原的单链可变片段(scfv)、cd8α衍生的铰链区和跨膜结构域、细胞内4-1bb共刺激结构域和cd3ζ信号转导结构域。为了使用较大的car转基因实现有效的raav生产,5′和3′同源区各自减少至~650bp。如实例1中所述,用cd3和cd28活化原代人t细胞。使用用编码tcrα靶向megatal的体外转录mrna电穿孔的活化原代人t细胞评价megatal诱导的使car转基因进入tcrα基因座的hr。用编码抗cd19car的raav转导电穿孔的t细胞,并在存在il2的情况下于37℃培养。在电穿孔后7天(10天总培养)进行car染色。对照仅包含含有megatal或aav治疗的t细胞,以及用包括抗cd19car表达盒的慢病毒(lv)载体转导的t细胞。通过用pe缀合的cd19-fc染色,通过流式细胞术分析抗cd19-car表达。图3b示出了t细胞中的cd19表达,其中car通过hr导入tcrα恒定区的外显子1或通过lvv导入。还示出了cd62l和cd45ra的表达。使用稳定表达cd19肿瘤抗原(k562-cd19+)的k562红白血病细胞系进行功能分析。在t细胞中分析t细胞细胞毒性和细胞因子产生,所述t细胞包括以1∶1比例与k562-cd19+细胞混合的整合到tcrα基因座(hr-car+t细胞)中的抗cd19car。用hr-car+和lv-car+t细胞样品观察到类似的细胞毒性率(图3c)。在与k56-cd19+靶细胞共培养后,用hr-car+和lv-car+t细胞的细胞因子产生也类似(图3d)。在与靶细胞共培养后,对t细胞进行表型分型以表达耗竭标志物,例如pd1、tim3和ctla4。在与k562-cd19+靶细胞共培养后,hr-car+和lv-car+t细胞表现出相似的表达耗竭标志物谱。图3e。实例4将独特的启动子转基因盒多重同源重组入tcrα基因座的两个等位基因设计、构建并验证了含有启动子、荧光报告基因转基因和多腺苷酸化信号的腺相关病毒(aav)质粒(seqidno:8和9)。图4a。通过瞬时共转染hek293t细胞制备两个不同的raav载体批次。第一raav载体含有与bfp可操作地连接的sef1α启动子和sv40晚期多腺苷酸化信号,第二载体含有与gfp可操作地连接的mnd启动子和sv40晚期多腺苷酸化信号。两种载体具有相同长度的tcrα同源臂,并如实例1中所述使用碘克沙醇梯度进行纯化。在不存在同源重组的情况下,raav-sef1α-bfp载体产生最小的bfp表达。如实例1中所述,用cd3和cd28活化原代人t细胞。如实例1中所述,活化原代人t细胞并用编码tcrα靶向megatal的mrna电穿孔。用raav-mnd-gfp靶向载体或raav-sef1α-bfp靶向载体转导电穿孔的t细胞。对照仅包含含有megatal或raav靶向载体的t细胞。在转导后的不同时间通过流式细胞术分析同源重组以区分瞬时与长期转基因表达。与用megatal和raav靶向载体治疗的样品相比,仅含有megatal或raav靶向载体的t细胞表现出非常低水平(<1.5%)的长期表达。在用megatal和raav-sef1α-bfp或raav-mnd-gfp靶向载体(hr+细胞)治疗的样品中观察到明确定义的群体(20-30%bfp+或gfp+)。hr+细胞包含在一个或两个tcrα等位基因上经历hr的细胞。图4b。用megatal和raav-sef1α-bfp和raav-mnd-gfp靶向载体治疗的t细胞产生几种独立的细胞群:gfp+阳性细胞;bfp+细胞;gfp+/bfp+细胞(dp);和不表达报告基因的细胞(dn)。gfp+和bfp+细胞群由在一个或两个tcrα等位基因上经历同源重组的细胞组成,而dp细胞在两个等位基因上经历hr。与该观察结果一致,在gfp+和bfp+细胞中均存在明显的(10-15%)cd3+群体。cd3+群体代表在一个tcrα等位基因上经历hr的那些细胞。值得注意的是,dp细胞几乎没有可检测的cd3+细胞(<2%),与两个tcrα等位基因的hr一致。图4b。实例5将编码荧光蛋白或car的无启动子转基因同源重组入tcrα基因座设计、构建并验证了含有病毒自裂解肽(例如,t2a肽)、荧光报告基因转基因和多腺苷酸化信号的腺相关病毒(aav)质粒(seqidno:13)。图5a。t2a肽将荧光报告基因转基因的表达与内源性tcrαmrna联系起来,将荧光信号或car表达置于内源性tcrα启动子的控制之下。在不存在同源重组的情况下未观察到转基因表达。如实例1中所述,用cd3和cd28活化原代人t细胞。用体外转录megatalmrna电穿孔活化的原代人t细胞。用编码含t2a的荧光报告基因的raav转导电穿孔的t细胞。对照仅包含含有megatal或raav靶向载体的t细胞。在转染后的不同时间通过流式细胞术分析荧光报告基因表达。在仅含有megatal或raav靶向载体的t细胞中没有观察到报告基因表达。在有或没有aav转导的情况下观察到相似的megatal活性率。然而,仅接受megatal和含同源物的aav靶向载体的t细胞产生荧光细胞群。与外源启动子驱动的受体表达相比,由内源性tcrα启动子驱动的荧光报告基因表达显著降低(荧光强度降低~5倍,参见实例1)。图5b。设计、构建并验证了含有病毒自裂解肽(例如,t2a肽)、cd19-car转基因和多腺苷酸化信号的腺相关病毒(aav)质粒(seqidno:20)。图5c。连接car与内源性tcrαmrna的t2a肽确保car表达受内源性tcrα启动子的调节。在没有同源重组的情况下未观察到转基因表达。用cd19-car慢病毒载体治疗的细胞与用2a-hdr-car构建体治疗的细胞的比较在hdr-car-敲入样品中表现出较低的car表达(图5d)。然而,lv-car和hdr-car-敲入样品都具有与k562-cd19+肿瘤细胞相似的细胞毒性(图5e)。实例6通过操控转染和转导方案使同源重组(hr)结果与非同源末端连接(nhej)产生偏差可以通过改变重组反应的温度来调节nhej相对于hr的相对率。已经证明核酸酶治疗的细胞瞬时暴露于低温条件(<37°)增加了nhej活性,但尚未研究温度对t细胞中同源重组的影响并且对其知之甚少。设计、构建并验证了含有mnd-car报告基因转基因的raav(seqidno:12)。如实例1所述,用体外转录megatalmrna电穿孔活化的t细胞并用raav靶向载体转导。将转导的t细胞在37℃或30℃培养~22小时,并通过在转染后的不同时间用pe缀合的cd19-fc染色分析同源重组/car表达。评价cd3染色的损失作为tcrα基因座处megatal介导的nhej活性的指标。图6。与在标准37℃条件下培养megatal治疗的细胞相比,megatal治疗的t细胞瞬时暴露于30℃温育步骤导致nhej活性大大增加。此外,在37℃和30℃条件下培养的t细胞中,通过car表达确定的hr活性略微降低。相反,对于37°培养的细胞,hr∶nhej事件的相对比例要大得多;相较于在瞬时30℃温育后~25%的cd3-细胞,在37°温育后,近50%的cd3-细胞是car+。偏差与瞬时低温一致,这显著增加nhej事件的频率,同时对总体hr效率具有相对较小的影响。实例7将编码多蛋白的转基因同源重组入tcrα基因座设计、构建并验证了包含启动子、编码由自裂解病毒2a肽分开的两种蛋白质(多蛋白)的转基因和晚期sv40多腺苷酸化信号的腺相关病毒(aav)质粒(seqidno:14)。图7a。多蛋白转基因编码药物调节的cd19靶向嵌合抗原受体(daric)(seqidno:15)的两个独立组分。自裂解病毒2a肽能够从单个mrna转录物中表达两种不同的蛋白质。如实例2中所述,转基因侧翼为最小tcrα同源臂。如实例1中所述,通过瞬时转染hek293t细胞生成raav。如实例1中所述,用cd3和cd28活化原代人t细胞。用体外转录megatalmrna电穿孔活化的t细胞,并用编码多蛋白转基因的raav转导。对照仅包含含有megatal或aav靶向载体的t细胞,以及用编码相同多蛋白表达盒的lv转导的t细胞。使用pe缀合的cd19-fc通过流式细胞术分析cd19-daric表达。图7b。仅在接受megatal和aav靶向载体的样品中观察到cd19-fc反应性。实例8同源臂长度对hr效率的影响设计、构建并验证了一系列含有不同长度同源臂、启动子、编码gfp的转基因和多腺苷酸化信号的腺相关病毒(aav)质粒。图8a。fl构建体具有~1500bp的5′同源臂和~1000bp的3′同源臂;m构建体具有~1000bp的5′同源臂和~600bp的3′同源臂;s构建体具有~600bp的5′同源臂和~600bp的3′同源臂。如实例1中所述,通过瞬时转染hek293t细胞生成raav。如实例1中所述,用cd3和cd28活化原代人t细胞。用体外转录megatalmrna电穿孔活化的原代人t细胞,并用编码具有不同同源臂长度的gfp的raav靶向载体转导。对照包含未转染的样品和仅用megatal治疗的样品。通过流式细胞术分析gfp表达。构建体表现出类似的hr效率。图8b。实例9将抗cd19car转基因同源重组入tcrα基因座与t细胞耗尽标志物的表达降低有关设计、构建并验证了含有启动子、编码抗cd19car的转基因和多腺苷酸化信号的腺相关病毒(aav)质粒。如实例1中所述,通过瞬时转染hek293t细胞生成raav。慢病毒载体含有car表达盒,其包括与car可操作地连接的mnd启动子,所述car包括cd8α衍生的信号肽、抗cd19scfv、cd8α衍生的铰链区和跨膜结构域、细胞内4-1bb共刺激结构域和cd3ζ信号转导结构域。使用已建立的方案制备慢病毒。参见例如kutner等人,《bmc生物技术(bmcbiotechnol.)》,2009年;第9期:第10页,doi:10.1186/1472-6750-9-10;kutner等人,《自然实验手册(nat.protoc.)》,2009年;第4(4)期:第495-505页,doi:10.1038/nprot.2009.22。如实例1中所述,用cd3和cd28活化原代人t细胞。用体外转录megatalmrna电穿孔活化的原代人t细胞,并用编码抗cd19car转基因(hr-cart细胞)的raav靶向载体转导;或用编码抗cd19car(lv-cart细胞)的慢病毒转导活化的原代人t细胞。将lv-t和hr-t细胞与cd19表达nalm-6细胞以1∶1的效应细胞(e)细胞/靶(t)细胞比例共培养。在共培养的24小时和72小时测量t细胞耗竭标志物表达(pd-l1、pd-1和tim-3)。在24小时,与lv-cart细胞相比,hr-cart细胞表现出pd-1和pd-l1的上调减少。图9a。在72小时,与lv-cart细胞相比,hr-cart细胞表现出pd-1和tim-3的上调减少。图9b。实例10将编码car和wpre的转基因同源重组入tcrα基因座设计、构建并验证了含有启动子、编码嵌合抗原受体(car)的转基因、多聚腺苷酸化信号和wpre的腺相关病毒(aav)质粒(seqidno:9)。图10a。转基因侧翼为~650bp的tcrα同源臂。如实例1中所述,通过瞬时转染hek293t细胞生成raav。如实例1中所述,用cd3和cd28活化原代人t细胞。用体外转录megatalmrna电穿孔活化的原代人t细胞,并用编码抗cd19car的raav靶向载体转导。对照仅包含megatal或raav靶向载体。通过用pe缀合的cd19-fc染色,通过流式细胞术分析抗cd19-car表达。将wpre元件掺入aav骨架中极大地增强了通过平均荧光强度(mfi)确定的cd19car转基因的表达。图10b实例11将编码含内含子的car的转基因同源重组入tcrα基因座设计、构建并验证了含有启动子、编码含内含子的嵌合抗原受体(car)的转基因和多腺苷酸化信号的腺相关病毒(aav)质粒(seqidno:17和18)。图11a。在一些实施例中,将内含子直接置于转基因起始密码子的5′。在其它实施例中,使用双内含子分裂car转基因并模拟tcrα基因座处的内源mrna剪接。转基因侧翼为~650bp的tcrα同源臂。如实例1中所述,通过瞬时转染hek293t细胞生成raav。如实例1中所述,用cd3和cd28活化原代人t细胞。用体外转录megatalmrna电穿孔活化的原代人t细胞,并用编码抗cd19car的raav靶向载体转导。对照仅包含megatal或raav靶向载体。通过用pe缀合的cd19-fc染色,通过流式细胞术分析抗cd19-car表达。将5′内含子掺入raav骨架中对tcrα基因座中的cd19car转基因表达产生负面影响。与具有5′内含子或完全缺少内含子的构建体相比,将内部内含子掺入cd19car转基因进一步减少了表达。图11b。实例12将双启动子转基因同源重组入tcrα基因座设计、构建并验证了含有双启动子、两个编码嵌合抗原受体(car)的转基因(抗cd19car和tgfβr1i-显性负性(dn))和两个多腺苷酸化位点的腺相关病毒(aav)质粒(seqidno:19和21)。转基因侧翼为~650bp的tcrα同源臂。变体使用单个mnd启动子来驱动car和tgfβrii-dn转基因的表达,其由可自裂解的t2a连接子分开。图12a。如实例1中所述,用cd3和cd28活化原代人t细胞。用体外转录megatalmrna电穿孔活化的原代人t细胞,并用编码抗cd19car的raav靶向载体转导。对照仅包含megatal或raav靶向载体。通过用pe缀合的cd19-fc染色,通过流式细胞术分析抗cd19-car表达,并通过用标记的tgfβ染色分析tgfβr1-dn表达。掺入双启动子导致car和tgfβrii-dn的表达减少但可检测。与单个启动子car或使用t2a元件将cd19-car与tgfβrii-dn转基因组合的双转基因构建体相比,表达降低。图12b。实例13将t细胞受体(tcr)同源重组入tcrα基因座将t细胞特异性重定向至新靶标是基因组编辑技术的关键优势。设计、构建并验证了含有启动子、对维尔姆斯瘤抗原1(wt1-tcr)具有特异性的t细胞受体的α和β链和多腺苷酸化信号的腺相关病毒(aav)质粒,例如seqidno:22。图13a。tcrα和β链的编码序列由自裂解病毒2a肽序列分开。如实例1中所述,通过瞬时转染hek293t细胞生成raav。如实例1中所述,用cd3和cd28活化原代人t细胞。用体外转录megatalmrna电穿孔活化的原代人t细胞,并用编码wt-1tcr转基因的raav靶向载体转导。通过用pe缀合的wt-1四聚体染色确定成功的同源重组,并通过流式细胞术分析。用megatal和aavwt-1tcr转基因(hr+t细胞)治疗的t细胞的功能竞争力通过用人白细胞抗原(hla)匹配的wt-1+靶细胞培养hr+t细胞并分析细胞因子产生和靶细胞溶解来确定。通过用wt1四聚体染色确定wt-1tcr转基因的表达。所有wt1-四聚体+细胞也对cd3表达呈阳性,表明在成功的wt-1tcr转基因hdr后tcr表达的恢复。图13b。实例14将异种调节的t细胞受体(tcr)组分同源重组入tcrα基因座的分开的等位基因内源性t细胞受体通过共表达两条不同的α/β链形成。通过将α或β链递送到单个tcrα等位基因中,同源重组能够对内源转录机制进行精确建模。设计、构建并验证了含有启动子、对维尔姆斯瘤抗原1(wt1-tcr)具有特异性的t细胞受体的α或β链和多腺苷酸化信号的单独的腺相关病毒(aav)质粒。图14。如实例1中所述,通过瞬时转染hek293t细胞生成raav。如实例1中所述,用cd3和cd28活化原代人t细胞。用体外转录megatalmrna电穿孔活化的原代人t细胞,并用编码wt-1tcr转基因的α或β链的两种独特的raav靶向载体转导。通过用pe缀合的wt-1四聚体染色确定成功的同源重组,并通过流式细胞术分析。用megatal和aavwt-1tcr转基因(hr+t细胞)治疗的t细胞的功能竞争力通过用hla匹配的wt-1+靶细胞培养hr+t细胞并分析细胞因子产生和靶细胞溶解来确定。实例15将内源调节的t细胞受体(tcr)组分同源重组入tcrα基因座的分开的等位基因同源重组允许用于表达多组分转基因的细胞转录机制的精确建模。设计、构建并验证了含有自裂解病毒2a肽、对维尔姆斯瘤抗原1(wt1-tcr)具有特异性的t细胞受体的α或β链和多腺苷酸化信号的单独的腺相关病毒(aav)质粒。图15。如实例1中所述,通过瞬时转染hek293t细胞生成raav。如实例1中所述,用cd3和cd28活化原代人t细胞。用体外转录megatalmrna电穿孔活化的原代人t细胞,并用编码wt-1tcr转基因的α或β链的两种独特的raav靶向载体转导。在成功的同源重组后,α或β链的表达受内源性tcrα启动子的调节。通过用pe缀合的wt-1四聚体染色确定成功的同源重组,并通过流式细胞术分析。用megatal和aavwt-1tcr转基因(hr+t细胞)治疗的t细胞的功能竞争力通过用hla匹配的wt-1+靶细胞培养hr+t细胞并分析细胞因子产生和靶细胞溶解来确定。实例16将异种调节的pd1翻转受体同源重组入tcrα基因座pd1翻转受体的同源重组将潜在抑制性输入转化为阳性共刺激输出。设计、构建并验证了含有启动子、pd1外结构域、cd28跨膜结构域、cd28细胞内信号转导结构域和多腺苷酸化信号的单独的腺相关病毒(aav)质粒。图16。如实例1中所述,通过瞬时转染hek293t细胞生成raav。如实例1中所述,用cd3和cd28活化原代人t细胞。用体外转录megatalmrna电穿孔活化的原代人t细胞,并用编码pd1-cd28翻转受体的raav靶向载体转导。通过对治疗的细胞进行分子分析确定成功的同源重组。用megatal和aavpd1-翻转受体(hr+t细胞)治疗的t细胞的功能竞争力通过用pd-l1表达靶细胞培养hr+t细胞并在用αcd3治疗或αcd3/αcd28刺激后分析细胞因子产生来确定。实例17将内源调节的pd1翻转受体同源重组入tcrα基因座pd1翻转受体的同源重组将潜在抑制性输入转化为阳性共刺激输出。设计、构建并验证了含有自裂解病毒2a肽序、pd1外结构域、cd28跨膜结构域、cd28细胞内信号转导结构域和多腺苷酸化信号的单独的腺相关病毒(aav)质粒。图17。如实例1中所述,通过瞬时转染hek293t细胞生成raav。如实例1中所述,用cd3和cd28活化原代人t细胞。用体外转录megatalmrna电穿孔活化的原代人t细胞,并用编码pd1-cd28翻转受体的raav靶向载体转导。在成功的同源重组后,pd1-cd28翻转受体的表达受内源性tcrα启动子的调节。通过对治疗的细胞进行分子分析确定成功的同源重组。用megatal和aavpd1-翻转受体(hr+t细胞)治疗的t细胞的功能竞争力通过用pd-l1表达靶细胞培养hr+t细胞并在用αcd3治疗或αcd3/αcd28刺激后分析细胞因子产生来确定。实例18将异种调节的双顺反子转基因同源重组入tcrα基因座的单独的等位基因同源重组允许将多个转基因递送到靶基因座的单独的等位基因中。设计、构建并验证了含有启动子、对维尔姆斯瘤抗原1(wt1-tcr)具有特异性的t细胞受体的α链、自裂解病毒2a肽序列、pd1-cd28翻转受体和多腺苷酸化信号的单独的腺相关病毒(aav)质粒。此外,设计、构建并验证了含有启动子、对维尔姆斯瘤抗原1(wt1-tcr)具有特异性的t细胞受体的β链、自裂解病毒2a肽序列、显性负性tgfβrii外结构域和多腺苷酸化信号的腺相关病毒(aav)质粒。图18。如实例1中所述,通过瞬时转染hek293t细胞生成raav。如实例1中所述,用cd3和cd28活化原代人t细胞。用体外转录megatalmrna电穿孔活化的原代人t细胞,并用编码wt-1tcr转基因的α或β链的两种独特的raav靶向载体转导,所述wt-1tcr转基因与辅助pd1-cd28翻转或tgfβrii显性负性受体结合。通过用pe缀合的wt-1四聚体染色确定成功的同源重组,并通过流式细胞术分析。使用抗tgfβrii抗体,通过流式细胞术分析记录tgfβrii显性负性受体的成功表达。通过分子分析确定pd1-cd28翻转受体的同源重组。用megatal和aavwt-1tcr转基因(hr+t细胞)治疗的t细胞的功能竞争力通过用hla匹配的wt-1+靶细胞培养hr+t细胞并分析细胞因子产生和靶细胞溶解来确定。tgfβrii显性负性组分的功能竞争力通过添加确定量的tgfβ并在存在hla匹配的wt-1+靶细胞的情况下分析t细胞增殖和细胞因子产生来确定。pd1-cd28翻转受体的功能竞争力通过在存在hla匹配的pd-l1+wt1+靶细胞的情况下培养t细胞并分析细胞因子产生和靶细胞溶解来确定。实例19将内源调节的双顺反子转基因同源重组入tcrα基因座的单独的等位基因同源重组允许将多个转基因递送到靶基因座的单独的等位基因中。设计、构建并验证了含有自裂解病毒2a肽序列、对维尔姆斯瘤抗原1(wt1-tcr)具有特异性的t细胞受体的α链、第二2a肽序列、pd1-cd28翻转受体和多腺苷酸化信号的单独的腺相关病毒(aav)质粒。此外,设计、构建并验证了含有自裂解病毒2a肽序列、对维尔姆斯瘤抗原1(wt1-tcr)具有特异性的t细胞受体的β链、第二2a肽序列、显性负性tgfβrii外结构域和多腺苷酸化信号的腺相关病毒(aav)质粒。图19。如实例1中所述,通过瞬时转染hek293t细胞生成raav。如实例1中所述,用cd3和cd28活化原代人t细胞。用体外转录megatalmrna电穿孔活化的原代人t细胞,并用编码wt-1tcr转基因的α或β链的两种独特的raav靶向载体转导,所述wt-1tcr转基因与辅助pd1-cd28翻转或tgfβrii显性负性受体结合。通过用pe缀合的wt-1四聚体染色确定成功的同源重组,并通过流式细胞术分析。使用抗tgfβrii抗体,通过流式细胞术分析记录tgfβrii显性负性受体的成功表达。通过分子分析确定pd1-cd28翻转受体的同源重组。用megatal和aavwt-1tcr转基因(hr+t细胞)治疗的t细胞的功能竞争力通过用hla匹配的wt-1+靶细胞培养hr+t细胞并分析细胞因子产生和靶细胞溶解来确定。tgfβrii显性负性组分的功能竞争力通过添加确定量的tgfβ并在存在hla匹配的wt-1+靶细胞的情况下分析t细胞增殖和细胞因子产生来确定。pd1-cd28翻转受体的功能竞争力通过在存在hla匹配的pd-l1+wt1+靶细胞的情况下培养t细胞并分析细胞因子产生和靶细胞溶解来确定。通常,在以下权利要求中,所使用的术语不应被解释为将权利要求限制于说明书和权利要求中公开的特定实施例,而是应该被解释为包含所有可能的实施例以及这些权利要求所限定的等同内容的全部范围。因此,权利要求不受本公开的限制。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1