药物疗法对癌的效果的预测方法与流程
本发明涉及药物疗法对癌的效果的预测方法。
背景技术:
目前,作为癌的治疗法,进行了药物疗法、外科手术等。例如,在日本乳腺癌学会的指南中,在没有远端转移的乳腺癌患者的治疗时原则上推荐全部病例都进行外科手术。但是,外科的手术、特别是乳房全切除手术虽然治愈乳腺癌的可能性高,但对于患者而言,失去乳房的痛苦很大。因此,在是否需要将外科手术应用于全部病例、包括术前药物疗法有效果的病例是有争议的。
另外,作为癌等疾病的指标(例如,诊断标志物、疾病的风险评价标志物),已知例如有无特定的基因或蛋白质的表达或其量的变化、有无特定的代谢产物或其量的变化、遗传多态性(例如,snp、单体型)、有无易位、基因组dna的甲基化或其程度。作为这样的指标,例如可以进行her2阳性乳腺癌的基因组dna甲基化的分析,发现多个能够与her2阳性乳腺癌的行为相关的甲基化位点(非专利文献1)。
现有技术文献
非专利文献
非专利文献1:oncology2015;88:pp.377-384
技术实现要素:
发明要解决的课题
然而,在her2阳性癌等癌症例中,对于可以预测能够用术前药物疗法治愈的病例的指标,尚不明确。
本发明的目的在于提供能够预测药物疗法对her2阳性癌等癌的效果的指标。
解决课题的方法
本发明人等进行了深入研究,结果发现,作为能够预测药物疗法对癌的效果的指标,可以利用hsd17b4基因的非编码区域中特定的cpg位点的甲基化率,从而完成了本发明。
即,本发明如下所述。
〔1〕一种药物疗法对癌的效果的预测方法,该方法包括以下(1)及(2):
(1)在从人受试者采集的样品中,对位于hsd17b4基因的启动子区域、非翻译区域或翻译区域的碱基序列内存在的1个以上的cpg位点中的胞嘧啶残基的甲基化率进行分析;以及
(2)基于分析后的甲基化率预测药物疗法对癌的效果。
〔2〕根据〔1〕中记载的方法,其中,从人受试者采集的样品是选自血液、体液、组织及细胞中的1种或2种以上的样品。
〔3〕根据〔1〕或〔2〕中记载的方法,其中,cpg位点是以转录起始点为基准而在56位~94位之间标准存在的cpg位点。
〔4〕根据〔3〕中记载的方法,其中,cpg位点是以转录起始点为基准而在92位及93位标准存在的cpg位点。
〔5〕根据〔1〕~〔4〕中任一项所述的方法,其中,癌是her2阳性癌。
〔6〕根据〔1〕~〔5〕中任一项所述的方法,其中,癌是乳腺癌。
〔7〕根据〔6〕中记载的方法,该方法进一步包括:在样品中测定雌激素受体的表达。
〔8〕根据〔1〕~〔7〕中任一项所述的方法,其中,药物疗法是利用her2抑制剂进行的治疗。
〔9〕根据〔8〕中记载的方法,其中,her2抑制剂为抗体。
〔10〕根据〔9〕中记载的方法,其中,抗体为曲妥珠单抗(trastuzumab)。
〔11〕根据〔1〕~〔10〕中任一项所述的方法,其中,分析使用选自亚硫酸氢盐、1种以上的引物、1种以上的核酸探针、限制酶、抗甲基化胞嘧啶抗体、以及纳米孔中的1种或2种以上的方式进行。
〔12〕根据〔1〕~〔11〕中任一项所述的方法,其中,分析通过以下方法进行:重亚硫酸盐测序法、重亚硫酸盐/焦磷酸测序法、甲基化特异性pcr法、限制性酶切标记基因组扫描(rlgs)法、单核苷酸引物延伸(snupe)法、cpg岛微阵列法、甲基化荧光检测法、cobra法、质量分析(massarray)法、甲基化特异性限制酶的使用、高分辨率熔解曲线分析(hrm)法、纳米孔分析法、icon探针法、甲基化特异性mlpa法、或者免疫测定法。
〔13〕一种药物疗法对癌的效果的诊断试剂盒,其包含对位于hsd17b4基因的启动子区域、非翻译区域或翻译区域的碱基序列内存在的1个以上cpg位点中的胞嘧啶残基的甲基化进行分析的分析装置。
〔14〕根据〔13〕中记载的诊断试剂盒,其中,cpg位点是以转录起始点为基准而在56位~94位之间标准存在的cpg位点。
〔15〕根据〔14〕中记载的诊断试剂盒,其中,cpg位点是以转录起始点为基准而在92及93位标准存在的cpg位点。
〔16〕根据〔13〕~〔15〕中任一项所述的诊断试剂盒,其中,分析装置是选自亚硫酸氢盐、1种以上的引物、1种以上的核酸探针、限制酶、抗甲基化胞嘧啶抗体、以及纳米孔中的1种或2种以上的装置。
〔17〕一种对癌的药物疗法,该方法包括以下(1)~(4):
(1)在从人受试者采集的样品中,对位于hsd17b4基因的启动子区域、非翻译区域或翻译区域的碱基序列内存在的1个以上cpg位点中的胞嘧啶残基的甲基化率进行分析;以及
(2)基于分析后的甲基化率预测药物疗法对癌的效果;
(3)选择被预测为药物疗法对癌具有效果的人;以及
(4)对选择的人进行药物疗法。
〔18〕一种对癌的治疗的选择方法,该方法包括以下(1)及(2):
(1)在从人受试者采集的样品中,对位于hsd17b4基因的启动子区域、非翻译区域或翻译区域的碱基序列内存在的1个以上cpg位点中的胞嘧啶残基的甲基化率进行分析;以及
(2)基于分析后的甲基化率选择对癌的治疗。
发明的效果
本发明的预测方法作为例如对于her2阳性癌等癌的患者是否进行外科手术及药物疗法的选择的判断的指标是有用的。
本发明的试剂盒例如在本发明的预测方法的简便实施方面是有用的。
本发明的药物疗法在利用抗癌剂进行有效的治疗方面是有用的。
附图说明
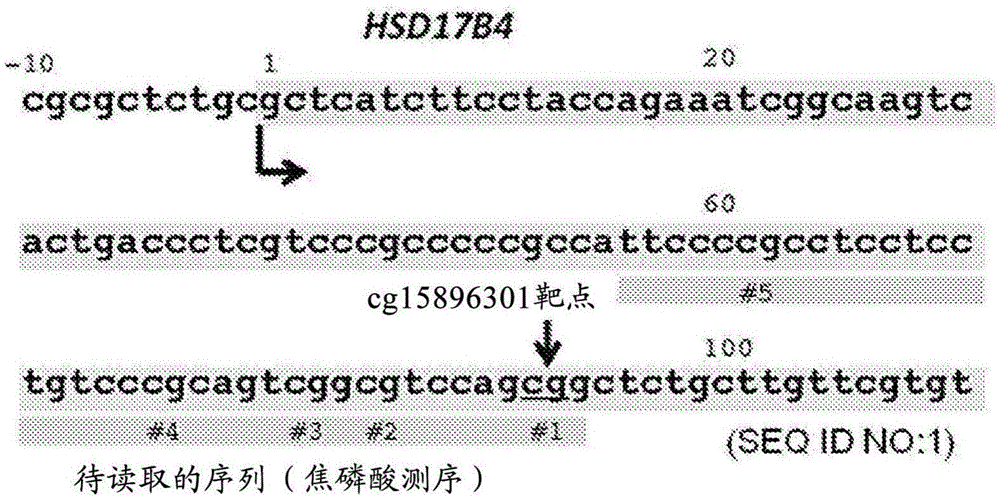
图1是示出hsd17b4基因的转录起始点附近的结构的图。通过焦磷酸测序法读取核苷酸序列,所述核苷酸序列以转录起始点的g为1位、且包括包含5个cpg位点(#1~#5)的56~94位的核苷酸残基。
图2是示出病理学上完全起效的(pcr)22例及除pcr以外的45例中的、hsd17b4基因的#1的cpg位点的甲基化率的图。
图3是示出起效例49例及非起效例18例中的、hsd17b4基因的#1的cpg位点的甲基化率的图。
具体实施方式
本发明提供对癌的药物疗法的效果的预测方法。
癌为任意的癌。作为癌,可以列举例如:乳腺癌(例如,乳腺浸润性导管癌、浸润性小叶癌)、卵巢癌、子宫癌(例如,子宫内膜癌、宫颈癌)、肺癌(例如,鳞状细胞癌、腺癌及大细胞癌(largecellcancer)等非小细胞癌、以及小细胞癌)、消化器系癌(例如,胃癌、小肠癌、大肠癌、直肠癌)、胰腺癌、肾癌、肝癌、胸腺癌、脾癌、甲状腺癌、肾上腺癌、前列腺癌、膀胱癌、骨癌、皮肤癌、脑瘤、肉瘤、黑色素瘤、胚细胞瘤(例如,神经母细胞瘤)、腺癌、鳞状细胞癌、实体瘤、上皮性癌、间皮瘤,优选为乳腺癌。另外,作为癌,可以列举例如:her2阳性癌、egfr阳性癌、c-met阳性癌、alk阳性癌、pdgfr阳性癌、c-kit阳性癌,优选为her2阳性癌。特别优选癌为her2阳性乳腺癌。
作为对癌的药物疗法,可以列举例如利用抗癌剂进行的治疗。作为抗癌剂,可以列举例如:微管抑制剂、抗癌抗生素、拓扑异构酶抑制剂、铂制剂、烷化剂。另外,抗癌剂可以为分子靶向药物。作为这样的分子靶向药物,可以列举例如:her2抑制剂、egfr抑制剂(例如,吉非替尼、拉帕替尼、厄洛替尼(erlotinib)、西妥昔单抗)、c-met抑制剂(例如,pha-665752、su11274、xl-880)、alk抑制剂(例如,whi-p154、tae684、pf-2341066)、pdgfr抑制剂(例如,伊马替尼、达沙替尼(dasatinib)、瓦他拉尼)、c-kit抑制剂(例如,舒尼替尼、马赛替尼、莫特塞尼)。
对癌的药物疗法优选为利用her2抑制剂进行的治疗。her2是属于与表皮生长因子(egfr)相同家族的受体型酪氨酸激酶。her2具有细胞外结构域、跨膜结构域、以及具有酪氨酸激酶活性的细胞内结构域通过单链连接而成的结构(例如,参照coussens等,science,1985,vol.230,no.4730,pp.1132-1139、以及genebank收录号:np_001005862.1)。作为her2抑制剂,可以列举例如:抗体(例如,曲妥珠单抗(trastuzumab)、帕妥珠单抗)、低分子有机化合物(例如,拉帕替尼、来那替尼、阿法替尼等her2酪氨酸激酶抑制剂)、药物结合抗体(例如,t-dm1)。
在对癌的药物疗法中,可以组合使用多种抗癌剂。作为组合使用的多种抗癌剂,可以列举例如:上述的2种以上抗癌剂的组合、以及上述的1种以上抗癌剂与其它抗癌剂的组合。作为其它抗癌剂,可以列举例如:紫杉烷类抗癌剂(例如,紫杉醇)等微管抑制剂、蒽环类(例如,阿霉素)、芳香酶抑制剂(例如,来曲唑)。
作为对癌的药物疗法,除了使用上述已知的抗癌剂以外,还可以列举使用能够抑制或促进hsd17b4基因表达的医药、特别是能够抑制表达的医药、以及能够将hsd17b4基因的特别是非编码区域甲基化的医药等。
本发明的方法包括以下(1)及(2):
(1)在从人受试者采集的样品中,对位于hsd17b4基因的启动子区域、非翻译区域或翻译区域的碱基序列内存在的1个以上的cpg位点中的胞嘧啶残基的甲基化率进行分析;以及
(2)基于分析后的甲基化率预测药物疗法对癌的效果。
在工序(1)中,作为样品,可以使用选自血液、体液、组织及细胞中的1种或2种以上的样品,可以优选使用与上述的癌相对应的组织样品。在本发明中,对于这样的癌组织样品中含有的基因组dna而言,分析特定的cpg位点。基因组dna可以通过任意方法从癌组织样品中适当提取。作为癌组织样品,例如可以使用通过针取活检等活检而采集的样品。癌组织样品可以进行预处理。作为这样的预处理,可以列举例如:提取、细胞固定、组织固定、组织薄片化、细胞解离处理、加热、冷冻、冷藏、液化。
癌组织样品通常是包含癌细胞和正常细胞(非癌细胞)的细胞团的样品。因此,为了实际测定纯粹的癌细胞团的基因组dna的甲基化率,可以从癌组织样品中筛选癌细胞团进行回收。能够进行这样的回收的优选方法的例子为激光显微切割(lmd)法。根据lmd法,可以通过用激光(例如,红外线激光、紫外线激光)切下组织切片中含有的癌细胞团来进行回收。lmd法例如可以使用lmd6500/7000(leica)、palmmicrobeam(zeiss)等装置来进行。另外,作为能够进行这样的回收的其它方法,可以举出例如能够利用癌细胞标志物(例如,蛋白质标志物)及根据需要加入的标记(例如,荧光标记)来筛选癌细胞的任意方法(例如,facs)。
本发明中分析的cpg位点是在位于hsd17b4基因的启动子区域、非翻译区域或翻译区域的碱基序列内存在的1个以上的cpg位点。特别优选为以转录起始点为基准而在56位~94位之间标准存在的cpg位点,更优选为以hsd17b4基因的转录起始点为基准而在92及93位标准存在的cpg位点(参照图1的cg15896301)。需要说明的是,在本说明书中,“转录起始点”是基于grch37(genomereferenceconsortiumhumanbuild37)及hg19(ucschumangenome19)而确定的。对于这样的cpg位点而言,在图1所示的序列号1的核苷酸序列(从转录起始点-10位的核苷酸残基开始的核苷酸序列)中存在于第102及103号核苷酸残基的位置,在记载了hsd17b4基因中的转录起始点附近的核苷酸序列的序列号2的核苷酸序列中位于第1092及1093号的核苷酸残基的位置。当然,由于在人受试者之间存在基因组dna的突变(例如,dna的缺失、插入、取代),因此上述位置及上述序列号的核苷酸序列存在不同。例如,在存在hsd17b4基因的转录起始点与上述cpg位点之间插入或缺失1个核苷酸残基的snp(单核苷酸多态性)的情况下,上述位置有1个不同。另外,在基因组dna中存在突变的情况下,上述序列号的核苷酸序列不同。因此,上述位置及上述序列号的核苷酸序列是为了便于参照的“标准的”位置。或者,本发明中分析的cpg位点也可以定义为在hsd17b4基因的转录起始点下游的非编码区域中存在的cagcggct(例如,序列号1的核苷酸序列中第99~106号核苷酸残基、或序列号2的核苷酸序列中第1089~1096号核苷酸残基)中的cg部分(5’侧的cag部分及3’侧的gct部分未发生突变的情况)。对于本领域技术人员而言,对于确认到基因组dna突变的人受试者,可以考虑基因组dna的突变而适当确定与在上述位置存在的cpg位点相当的cpg位点。
本发明中分析的甲基化是胞嘧啶残基的5位的甲基化。
甲基化率的分析可以通过该领域中公知的任意方法来进行。例如,分析可以使用选自亚硫酸氢盐、1种以上的引物、1种以上的核酸探针、限制酶、抗甲基化胞嘧啶抗体、以及纳米孔(nanopore)中的1种或2种以上的分析方式来进行。
亚硫酸氢盐〔重亚硫酸盐(bisulfite)〕将非甲基化胞嘧啶转变为尿嘧啶,而另一方面,不将甲基化胞嘧啶转变为尿嘧啶。因此,由于这样的性质,重亚硫酸氢盐在甲基化胞嘧啶的分析中与其它分析方式组合而被广泛使用。
1个以上的引物(例如,1~3个引物)是测序用引物、或者基因扩增用引物(例如,pcr引物)、或其组合。引物可以适当设计为能够对目标cpg位点进行分析。例如,引物可以设计为在目标cpg位点的下游区域(例如,序列号2的核苷酸序列中由第1094~2001号核苷酸残基构成的部分中的任意区域)发生退火,或者为了对包含目标cpg位点的基因区域进行扩增而设计为在目标cpg位点的上游区域(例如,序列号2的核苷酸序列中由第1~1091号核苷酸残基构成的部分中的任意区域)及下游区域(例如,序列号2的核苷酸序列中由第1094~2001号核苷酸残基构成的部分中的任意区域)中正义链及反义链发生退火。
1个以上的核酸探针(例如,1~3个的核酸探针)可以设计为在包含目标cpg位点的区域(例如,序列号1的核苷酸序列中由第1~120号核苷酸残基构成的部分中包含目标cpg位点的部分)或其上游区域(例如,序列号2的核苷酸序列中由第1~1091号核苷酸残基构成的部分中的任意区域)或下游区域(例如,序列号2的核苷酸序列中由第1094~2001号核苷酸残基构成的部分中的任意区域)发生杂交。核酸探针可以以游离的形态、或固定于固相的形态使用。作为固相,可以列举例如:粒子(例如,磁性粒子);阵列、膜(例如,硝化纤维素膜、滤纸)、柱等支撑体;以及板(例如,多孔板)、管等容器。作为固相的材料,可以列举例如:玻璃、塑料及金属。另外,核酸探针可以是使用抗甲基化胞嘧啶抗体的甲基化胞嘧啶分析中详细说明的核酸探针。
限制酶是甲基化特异性或非特异性限制酶,可以将上述的亚硫酸氢盐、1种以上的引物、1种以上的核酸探针适当组合使用。
具体而言,作为使用上述的分析方式的分析方法,可以列举例如:重亚硫酸盐测序法、重亚硫酸盐/焦磷酸测序(pyrosequencing)法、甲基化特异性pcr法、限制性酶切标记基因组扫描(rlgs)法、单核苷酸引物延伸(snupe)法、cpg岛微阵列法、甲基化荧光检测(methylight)法、cobra法、质量分析(massarray)法、甲基化特异性限制酶的使用、高分辨率熔解曲线分析(hrm)法、纳米孔分析法、icon探针法、甲基化特异性mlpa法。这些方法在该领域中是公知的(例如,日本特开2012-090555号公报、日本特开2014-036672号公报、日本特表2010-538638号公报、日本再表2009/136501号公报)。
另外,分析可以使用抗甲基化胞嘧啶抗体来进行。使用抗甲基化胞嘧啶抗体的甲基化胞嘧啶分析在该领域是公知的(例如,wo2015/025862;wo2015/025863;wo2015/025864;wo2016/052368;日本特开2012-230019号公报;dnaresearch13,37-42(2006);anal.chem.2012,84,7533-7538)。抗甲基化胞嘧啶抗体可以将上述的1种或2种以上的分析方式组合使用。具体而言,作为使用这样的分析方式的方法,可以列举例如:组合使用抗甲基化胞嘧啶抗体及异种核酸探针(例如,正常rna探针、修饰rna探针)的方法(例如,wo2015/025862);组合使用抗甲基化胞嘧啶抗体、固相探针及捕获探针的方法(例如,wo2015/025863);组合使用抗甲基化胞嘧啶抗体、吸收剂多核苷酸及捕获探针的方法(例如,wo2015/025864);组合使用抗甲基化胞嘧啶抗体及修饰核酸碱基配合性异种核酸探针的方法(例如,wo2016/052368)。可与抗甲基化胞嘧啶抗体组合使用的核酸探针可以设计为在包含本发明中分析的上述cpg位点的dna链杂交而形成由该dna链与核酸探针构成的双链结构部分时,cpg位点中的甲基胞嘧啶残基与核酸探针形成未配对部分(换言之,未互补地结合)(例如,wo2015/025862)。因此,核酸探针可以具有能够与甲胞嘧啶残基互补结合的除鸟嘌呤残基以外的核苷酸残基(例如,胞嘧啶残基、胸腺嘧啶残基、腺嘌呤残基、尿嘧啶残基)作为与未配对部分对应的核苷酸残基。或者,核酸探针可以设计为未形成这样的未配对部分(例如,wo2016/052368)。
使用抗甲基化胞嘧啶抗体的方法可以通过该领域中公知的任意免疫学方法来进行。具体而言,作为这样的方法,可以列举例如:酶免疫测定法(eia)(例如,cleia、elisa)、荧光免疫测定法、化学发光免疫测定法、电化学发光免疫测定法、凝聚法、免疫染色、流式细胞仪法、生物膜层干涉法、insitupla法、化学扩大型发光接近均相分析(luminescenceproximityhomogeneousassay)、线性印迹法、蛋白质印迹法。
本发明中分析的甲基化率是癌细胞中上述cpg中的胞嘧啶残基的甲基化比例。甲基化率的测定在该领域中是公知的(例如,日本特开2012-090555号公报、日本特开2014-036672号公报、日本特表2010-538638号公报、日本再表2009/136501号公报)。
在一个实施方式中,甲基化率可以不从癌组织样品中筛选癌细胞而进行分析。癌组织样品通常包含癌细胞和正常细胞。在这样的癌组织样品中分析甲基化率的情况下,癌细胞的甲基化率可以通过用癌组织样品中的癌细胞率〔癌细胞/(癌细胞+正常细胞)〕校正实际测定的甲基化率来进行计算。癌组织样品中的癌细胞率可以通过该领域中的任意方法而得到。例如,癌细胞率可以通过使用镜检试验、或者癌细胞和/或正常细胞标志物(例如,蛋白质标志物)以及标记(例如,荧光标记)的方法而得到。或者,在这样的癌组织样品中分析甲基化率的情况下,甲基化率可以考虑癌组织样品中的正常细胞存在率〔正常细胞/(癌细胞+正常细胞)〕及正常细胞的甲基化率而进一步进行校正。
在其它实施方式中,甲基化率在从癌组织样品中筛选了癌细胞之后进行分析。在该情况下,作为甲基化率,可以直接利用实际测定的甲基化率。从癌组织样品中筛选癌细胞可以通过上述方法进行。
在工序(2)中,基于分析的甲基化率,可以预测药物疗法对于癌的效果。分析的甲基化率可以作为用于与基准值比较的指标来使用。与药物疗法对癌无效的受试者组(非有效组)相比,药物疗法对癌有效的受试者组(有效组)的上述cpg位点的甲基化率显著更高。因此,根据本发明的方法,在上述cpg位点的甲基化率为基准值以上时,对于受试者而言,可以预测药物疗法对癌有效的可能性高、和/或药物疗法对癌无效的可能性低。另外,在上述cpg位点的甲基化率低于基准值时,对于受试者而言,可以预测药物疗法对癌有效的可能性低、和/或药物疗法对癌无效的可能性高。
有效组及非有效组的设定可以通过适当地定义有效性的基准来进行。例如,有效性可以将病理学上完全起效(pathologicalcompleteresponse:pcr)、或起效(response)设定为基准。对于病理学上完全起效及起效的详细情况,可以参照实施例。
作为上述基准值,例如,可以利用适当设定为能够鉴别有效组及非有效组的截止值。对于截止值而言,在以该值作为基准来判定疾病的情况下,是满足高诊断灵敏度(真阳性率、truepositiveratio)及高诊断特异度(真阴性率、truenegativeratio)两者的值。
诊断灵敏度(或简称为灵敏度)是具有特定状态的受试者中,正确诊断的受试者的比例。对于具有特定状态的全部受试者,在得到“阳性”的结果的情况下,灵敏度为100%。
诊断特异度(或简称为特异度)是不具有特定状态的受试者中,正确诊断的受试者的比例。对于不具有特定状态的全部受试者,在得到“阴性”的结果的情况下,特异度为100%。
截止值的计算方法在本领域中是公知的。例如,在有效组及非有效组中对上述cpg位点的甲基化率进行分析,求出任意的甲基化率的有效组和非有效组的诊断灵敏度及诊断特异度,基于这些值,制成roc(receiveroperatingcharacteristic)曲线。然后,可以求出诊断灵敏度及诊断特异度达到最大的甲基化率,将该值作为截止值。另外,也可以求出任意的甲基化率的诊断效率(真阳性病例和真阴性病例的总数相对于全部病例数的比例),将计算出最高的诊断效率的甲基化率作为截止值。或者,从尽量排除药物疗法对癌原本无效的受试者被错误预测为药物疗法对癌有效(假阳性)的情况(进而延误外科治疗的实施时期而使病情恶化的情况)的观点考虑,可以更重视诊断特异度来确定截止值。
本发明的方法可以进一步包括在癌组织样品中对与癌的性质相关的的其它标志物进行测定。作为其它的标志物,可以列举例如:有无特定的基因、non-codingrna或蛋白质的表达或其量的变化、有无特定的代谢产物(例如,磷酸化蛋白质等修饰蛋白质)或其量的变化、遗传多态性(例如,snp、单体型)、易位、基因组dna的甲基化或其程度。本发明的方法可以通过进一步测定其它癌标志物来提高诊断的特异度。例如,对于乳腺癌而言,在病理诊断中雌激素受体为阴性的情况下,确认了诊断的特异度进一步提高(实施例)。需要说明的是,在本说明书中,只要没有特别说明,雌激素受体是指erα。对于检测有无雌激素受体表达的方法,没有特别限制,可以优选使用通常使用的酶抗体法(lsab)。
另外,本发明提供一种药物疗法对癌的效果的诊断试剂盒。
本发明的诊断试剂盒包含位于hsd17b4基因的启动子区域、非翻译区域或翻译区域的碱基序列内存在的1个以上的cpg位点、更优选为以转录起始点为基准而在56位~94位之间标准存在的cpg位点、进一步优选为以hsd17b4基因的转录起始点为基准而在92及93位存在的cpg位点中的胞嘧啶残基的甲基化的分析装置。作为这样的分析装置,可以列举例如:选自上述的亚硫酸氢盐、1种以上的引物、1种以上的核酸探针、限制酶、抗甲基化胞嘧啶抗体、以及纳米孔中的1种或2种以上的装置。本发明的诊断试剂盒可以用于实施上述的分析方法。
本发明的诊断试剂盒优选包含可进行上述cpg位点的特异性分析的装置和可进行甲基化胞嘧啶的分析的装置(例如,亚硫酸氢盐、抗甲基化胞嘧啶抗体或甲基化特异性限制酶)的组合。作为可进行上述cpg位点的特异性分析的装置,可以列举例如:1种以上的引物、1种以上的核酸探针、限制酶、纳米孔,优选为1种以上的引物或1种以上的核酸探针。核酸探针可以固定于固相。作为可进行甲基化胞嘧啶的分析的装置,可以列举例如:亚硫酸氢盐、测序用引物、抗甲基化胞嘧啶抗体、甲基化特异性限制酶、icon探针法,优选为亚硫酸氢盐或抗甲基化胞嘧啶抗体。
本发明的诊断试剂盒不仅包含上述分析装置,还可以包含辅助性装置。作为这样的辅助性装置,可以列举例如:脱氧核糖核苷三磷酸(dntp)、缓冲液、稳定剂、酶(例如,dna聚合酶、硫酸化酶、三磷酸腺苷双磷酸酶)、标记物、以及酶的底物。
另外,在包含抗甲基化胞嘧啶抗体的情况下,本发明的诊断试剂盒例如可以进一步包含2次抗体(例如,抗igg抗体)、2次抗体的检测试剂。
本发明的诊断试剂盒可以进一步包含能够采集活体样品的器具。能够采集活体样品的器具只要能够从受试者获得活体样品即可,没有特别限定,可以举出例如活检针等活检器具。
在实施例中使用的重亚硫酸盐/焦磷酸测序中,作为可进行上述cpg位点的特异性分析的方式,可以使用(a)一对pcr引物及(b)测序引物,作为可进行甲基化胞嘧啶的分析的方式,可以使用(c)dna聚合酶、(d)硫酸化酶、(e)荧光素酶及荧光素、(f)三磷酸腺苷双磷酸酶、(g)dntp、(h)亚硫酸氢盐。因此,在本发明的诊断试剂盒为对上述cpg位点进行重亚硫酸盐/焦磷酸测序用试剂盒的情况下,例如也可以包含上述(a)~(h)的构成要素。
另外,本发明提供一种对癌的药物疗法。
本发明的药物疗法包括以下(1)~(4):
(1)在从人受试者采集的癌组织样品中,对位于hsd17b4基因的启动子区域、非翻译区域或翻译区域的碱基序列内存在的1个以上cpg位点中的胞嘧啶残基的甲基化率进行分析;
(2)基于分析后的甲基化率预测药物疗法对癌的效果;
(3)选择被预测为药物疗法对癌具有效果的人;以及
(4)对选择的人进行药物疗法。
本发明的药物疗法中的(1)及(2)可以与本发明的预测方法中的(1)及(2)同样地进行。
本发明的药物疗法中的(3)可以基于(2)的预测,通过选择预测为药物疗法对癌具有效果的人来进行。
在本发明的药物疗法中的(4)中,可以对选择的人进行药物疗法。药物疗法是利用上述的抗癌剂进行的治疗。例如,在癌为her2阳性癌的情况下,可以进行利用her2抑制剂进行的药物疗法。利用抗癌剂进行的治疗可以通过对于该抗癌剂采用的通常方式来进行。
另外,本发明提供一种对癌的治疗的选择方法:
(1)在从人受试者采集的样品中,对位于hsd17b4基因的启动子区域、非翻译区域或翻译区域的碱基序列内存在的1个以上cpg位点中的胞嘧啶残基的甲基化率进行分析;以及
(2)基于分析后的甲基化率选择对癌的治疗。
本发明的选择方法中的(1)可以与本发明的预测方法中的(1)同样地进行。
本发明的选择方法中的(2)的甲基化率的分析可以与本发明的预测方法中的(2)的分析同样地进行。对于(2)中分析得到的甲基化率而言,在基于现有的抗癌剂(例如,曲妥珠单抗)的药物疗法没有效果的情况下,例如,可以选择变更其它抗癌剂、或组合使用其它抗癌剂。另外,也可以选择将能够抑制或促进hsd17b4基因表达的医药、能够对hsd17b4基因特别是非编码区域进行甲基化的医药组合使用。另外,还可以选择将放射线疗法等其它非外科疗法组合。由此,在本发明的方法中,基于(2)中分析后的甲基化率,可以对作为治疗对象的人选择更有效的治疗方法。
实施例
以下,通过实施例对本发明更详细地进行说明,但本发明并不限定于这些实施例。
1.组织样品
从术前疗法的临床试验中登记的67人患者中采集了组织样品。该试验中的全部样品采集自每周接受紫杉醇(80mg/m2·周)和曲妥珠单抗(初次给药量4mg/kg、接下来2mg/kg·周)的给药、接受总计12次的患者。对患者实施乳腺切除术,对治疗效果进行了病理学判定。该试验的方案得到国立癌研究中心伦理委员会批注,并在umin临床试验注册系统中注册。对于所有患者实施了书面的知情同意。
采集了开始术前疗法前的原发肿瘤的针活检检体。对每1个患者采集2个样品,用2种方法固定。1个样品用中性缓冲福尔马林固定,然后对薄层进行h&e染色,供于镜检试验。另1个样品使用paxgenetissuesystem(qiagen公司、德国)固定,然后用低熔点石蜡包埋,从10片10μm厚的薄片中实施了dna/rna提取。由病理学家对活检试样的镜检试验中的全部细胞计算出癌细胞分级,进行了包含对分子分析足够数量的肿瘤细胞的活检试样的筛选。另外,由病理学家根据手术时的试样的分析进行了治疗效果判定。
在本发明中,病理学上完全起效(pathologicalcompleteresponse:pcr)是指符合表1的治疗效果判定基准(引用自日本乳腺癌学会编“临床/病理乳腺癌处理规程”第17版84页(2012)金原出版)的grade3、且未观察到乳腺导管内的癌细胞残留的情况。另一方面,即使在无法分类为pcr的情况下,对于表1的grade2以上的患者,也可以预测术前治疗的效果高,因此在本说明书中,将这些患者作为与pcr不同的“起效例”来处理。
表1
67例her2阳性乳腺癌被分类为乳腺浸润性导管癌64例、浸润性小叶癌2例、其它组织型1例。关于激素,34例(50.7%)为雌激素受体阳性,26例(38.8%)为孕酮受体阳性。仅使用了肿瘤分级(组织样品中的癌细胞率)为40%以上的样品。将67例her2阳性乳腺癌患者的详细的临床病理学特性示于表2。
表2.her2阳性乳腺癌患者的临床病理学特性
2.hsd17b4基因区域的重亚硫酸盐/焦磷酸测序
图1示出了hsd17b4基因的部分核苷酸序列。在焦磷酸测序中读取以hsd17b4基因的转录起始点的g作为1位、且包含5个cpg位点(#1~#5)的56~94位的核苷酸残基的核苷酸序列。通过以下步骤测定并计算出5个cpg位点的甲基化率。
通过已报道(t.yoshidaetal.,int.j.cancer128(2011)pp.33-39)的方法实施了使用基因组dna1μg的亚硫酸氢钠修饰。将修饰dna悬浮于tris-edta缓冲液40μl,分取其中的2μl,供于重亚硫酸盐/焦磷酸测序。用于焦磷酸测序的引物由qiagen公司(pyromarkcpgassay)获得。将生物素标记后的pcr产物退火于0.2μm焦磷酸测序引物,使用psq96焦磷酸测序系统(qiagen公司、美国加利福尼亚州)实施了焦磷酸测序。甲基化率使用psqassaydesign软件(qiagen公司)计算。
甲基化率以0(完全未甲基化)~1(完全甲基化)的范围的β值的形式计算,并将其以百分率表示。另外,甲基化率的测定值使用试样中的癌细胞率进行了校正。具体的校正式如下所述。校正甲基化率的上限值设为100,在通过下式得到的计算值超过100时,作为“校正甲基化率100%”进行了分析。
校正甲基化率(%)=100×实测甲基化率(%)/试样中的癌细胞率(%)
这里所谓的癌细胞率通过镜检试验求出。
3.统计分析
2组之间的相对频率的显著差异使用fisher精确检验计算。治疗响应病例组与治疗非响应病例组之间的校正甲基化率的显著差异通过曼-惠特尼u检验进行评价。在单变量分析中,计算出比值比(ors)及95%置信区间(95%ci)。关于对曲妥珠单抗和化学疗法的组合使用的响应性,为了找到能够与明确的倾向独立相关的指标,在去除了混杂因素之后进行了多变量逻辑回归分析。统计分析全部使用paswstatisticsver.18.0.0(spss株式会社)来实施。
4.结果
对于pcr组、其它病例组中的图1中#1的cpg位点的校正甲基化率、#1~#5cpg位点的校正甲基化率的平均值,在表3中示出了各组的平均值及2组之间的显著差异(p值)。可知,在pcr组中,#1的cpg位点的校正甲基化率、#1~#5的校正甲基化率的平均值也显著增高。特别是可知,如图2所示,在#1的cpg位点上,pcr组中,与其它病例组相比,校正甲基化率明显更高(p=0.001)。另一方面,对于#1的cpg位点而言,起效例组(g2a以上)的校正甲基化率没有比非起效例显著更高(p=0.176、图3)。
表3.各cpg位点的校正甲基化率
*通过曼-惠特尼u检验计算
以下,只要没有特别说明,“hsd17b4基因的甲基化”表示hsd17b4基因的#1的cpg位点的甲基化。将hsd17b4基因的甲基化率的截止值设定为50%,将50%以上判定为“阳性”,将低于50%判定为“阴性”,将以pcr为阳性、以其它症例为阴性时的临床诊断成绩示于表4。同样地将以起效例为阳性、以非起效例为阴性时的临床诊断成绩示于表5。以pcr为阳性时的甲基化率的临床诊断成绩的灵敏度为77.2%,特异度为84.4%。另一方面,以起效例为阳性时的甲基化率的临床诊断成绩的灵敏度为40.8%,特异度为77.8%。
表4.临床诊断成绩(阳性:pcr;阴性:其它病例)
灵敏度:77.2%
特异度:84.4%
阳性预测值:70.8%
表5.临床诊断成绩(阳性:起效例;阴性:非起效例)
灵敏度:40.8%
特异度:77.8%
阳性预测值:83.3%
将67个病例的临床病理学特性分为hsd17b4基因的甲基化率的阳性组、阴性组进行总计的结果示于表5。在表6所示的多个临床指标中,激素受体、特别是雌激素受体的阳性/阴性判定结果表明,甲基化率阳性组与阴性组之间的显著差异高,与甲基化率具有高相关性。根据临床肿瘤阶段(ct)、淋巴结转移阶段(cn)、临床病期(cstage)、雌激素受体(er)、孕酮受体(pgr)、以及ki-67标记指数的多变量分析表明,hsd17b4基因的甲基化是对her2靶向疗法响应性的独立预测因子(表7)。
[表6]
表6.hsd17b4基因的甲基化与临床病理学特性的相关性
*p值通过fisher精确检验而计算
表7.利用多变量逻辑回归分析判定与对her2靶向疗法的响应性相关的独立要素
为了提高对her2靶向疗法的响应性预测的精度(特异度),将雌激素受体的结果与hsd17b4基因的甲基化率组合进行了临床评价。需要说明的是,乳腺癌患者基本上全部按照公知的方法实施雌激素受体的检查,对于本实施例的67例也同样地进行了检查。将hsd17b4基因的甲基化率为阳性、且雌激素受体为阴性的病例判定为“阳性”,将其它病例判定为“阴性”,将以pcr为阳性、以其它情况为阴性时的临床诊断成绩示于表8。同样地将以起效例为阳性、以非起效例为阴性时的临床诊断成绩示于表9。对于pcr为阳性时的甲基化率及雌激素受体的组合的临床诊断成绩而言,灵敏度为59.1%,特异度为91.1%。另一方面,对于以起效例为阳性时的甲基化率及雌激素受体的组合的临床诊断成绩而言,灵敏度为32.7%,特异度为94.4%。需要说明的是,表9中判定为“阳性”的非起效例中的1例的肿瘤尺寸非常大,是无论术前疗法有无效果都强烈建议进行外科手术的病例。
表8.临床诊断成绩(阳性:pcr;阴性:其它病例)
*er:雌激素受体
灵敏度:59.1%
特异度:91.1%
阳性预测值:76.5%
表9.临床诊断成绩(阳性:pcr;阴性:其它病例)
*er:雌激素受体
灵敏度:32.7%
特异度:94.4%
阳性预测值:94.1%
序列表
<110>国立研究开发法人国立癌症研究中心
srl株式会社
富士rebio株式会社
<120>药物疗法对癌的效果的预测方法
<130>prba-18383
<150>jp2016-116367
<151>2016-06-10
<160>2
<170>patentinversion3.5
<210>1
<211>120
<212>dna
<213>智人
<220>
<221>cpg_位点
<222>(102)..(103)
<223>hsd17b4的cg15896301靶点
<400>1
cgcgctctgcgctcatcttcctaccagaaatcggcaagtcactgaccctcgtcccgcccc60
cgccattccccgcctcctcctgtcccgcagtcggcgtccagcggctctgcttgttcgtgt120
<210>2
<211>2001
<212>dna
<213>智人
<220>
<221>cpg_位点
<222>(1092)..(1093)
<223>hsd17b4的cg15896301靶点
<400>2
tttgggaactgataaatgtccgtgaaatcttcacaatttatgttcctctgctgcggctct60
agcaggtccctctgtttggggtccatgacttcccgcaacatccaatcaatcctccataat120
gggcaaagtgatctttccatagtgtaaatgtgttcccaccactctctggagtaatcctac180
ttaaaaccgttttcagcacaaaattcaaacatctaaacatgatcttgctggctttgcttt240
tgtggctttaccctctttctccccaaacctagctagtgtttgtgctgcctgtaatgccct300
tctttctttgcaggggtcgccactttaggtcctggtcctccttcagaaagtttttcctct360
ttctccccagcggggatagggtctgtttattttgacaccattagctcacttacacacatt420
ggtcacaagtctaggctgcaccgttattgaaagtttaccatctgactctgagtagcttga480
ggatcctatcaaaactcaggagatgctcagtaaatgttgattgaactatgactgttctca540
acatacaaacgcaagatcatttaggaacacttgtcaaaatgtttttgccccttgagattc600
tattttgggaggtaagcagtgggggtccaggactctgcattttgacagtcccctgatgtt660
tgcatgtagaagtgcagggattattacactgacaaatctttaccatccctaagggggact720
ttccttcccaggggctatctctggaagcccctcaaggataggggccgcatgctgtttctc780
taggtcagcaactaaacccagaaaacgtttattgagtgaatgatgaaacgacaggtgaat840
agatgaacgcaaggtgtcgagttaactattcttctacacaagtcctagcagctcccattg900
cttccagccgcagaaatggcccctggaaggcaagtcttccagcgagtggagtcactctta960
actacatttcccaggattccaagggagccgcgcgctctgcgctcatcttcctaccagaaa1020
tcggcaagtcactgaccctcgtcccgcccccgccattccccgcctcctcctgtcccgcag1080
tcggcgtccagcggctctgcttgttcgtgtgtgtgtcgttgcaggccttattcatgggct1140
caccgctgaggttcgacgggcgggtggtactggtcaccggcgcgggggcaggtgagcatg1200
cgaaggttggaggccgcgccccttgctgaggcgcagctggctgctcttttcgggccggca1260
tacgcgcgcagccgcagctgaggtcaccccgctgaggtggtggggaggggaatggttatt1320
cttgaggcaccgcatctcttgaggaggaaagagccggaaacacctggtctctcaagcagg1380
tacagcccgcttctccccagcaccccggtgtgggcttcccaaggtcctgcctgagaggag1440
aggccaggctgggctgctgattgcaaaactgggtgaaagttctccctgacccttatctgt1500
gggcatcgattgttactcttcctgcaattaactctcttagatctttgcctagtcttttaa1560
aggactgaaaagccgcgaggggcgggggctggaattcgccccctgaagcgcagagatgtc1620
agctcctgaaaagtcattcggtcgttcagtgtttgtttccctctgtcgtaagattttaag1680
ttcgtgagaggaccttctttaaagagggcgtctgataagagcccttccccgttggagttt1740
gtatgcttagcaagtcacaatctgttctcgaaatccactggagtcttggcagaggttgta1800
agctcaaatgcgcacaggggtcaggcgtatgatggagaaagaaaatgggagtaggatggg1860
cacatctgaggaactggagagcagagaattccgaagtggaccggccagtgggaaagttgc1920
ctgtatttcaggagcggcaaaatggaaaattgttatgtgaaatagccccattttttaaag1980
tacaaaaaattaaaacaaacc2001
- 还没有人留言评论。精彩留言会获得点赞!