使用原卟啉原氧化酶或其变体赋予和/或增强除草剂耐受性的方法和组合物与流程
提供了源自原核生物的原卟啉原氧化酶或其变体,以及使用该原卟啉原氧化酶或其变体赋予和/或增强植物和/或藻类的除草剂耐受性的技术。
背景技术:
卟啉生物合成途径用于合成在植物代谢中起重要作用的叶绿素和血红素,并且其发生在叶绿体中。在该途径中,原卟啉原ix氧化酶(下文称为ppo;ec:1.3.3.4)催化原卟啉原ix氧化成原卟啉ix。原卟啉原ix氧化成原卟啉ix后,原卟啉ix通过镁螯合酶与镁结合来合成叶绿素,或通过铁螯合酶与铁结合来合成血红素。
因此,当ppo活性受到抑制时,叶绿素和血红素的合成受到抑制,并且底物原卟啉原ix离开正常的卟啉生物合成途径,导致原卟啉原ix从叶绿体快速输出到细胞质,以及由氧化引起的细胞质原卟啉ix的累积。累积的原卟啉ix在光和氧分子的存在下产生高反应性的单线态氧(1o2),它们破坏细胞膜并迅速导致植物细胞死亡。基于该原理,已经开发出抑制ppo活性的除草剂。迄今为止,已有根据其化学结构分类的9个家族的ppo抑制性除草剂,包括嘧啶二酮、二苯基醚、苯基吡唑、n-苯基邻苯二甲酰亚胺、噻二唑、
此外,为了在使用除草剂时防止这些除草剂对作物生长的影响,需要为作物提供除草剂耐受性。
同时,藻类是光合生物,其可将光能转化为可用于合成各种有用的化合物的化学能。例如,藻类可通过光合作用固定碳并将二氧化碳转化为糖、淀粉、脂质、脂肪或其他生物分子,从而从大气中除去温室气体。此外,藻类的大规模培养可以产生多种物质,例如工业酶、治疗化合物和蛋白、营养素、商业物质和燃料物质。
然而,在生物反应器或开放或封闭池塘中大规模培养藻类的情况下,可能发生由不期望的竞争性生物(例如不期望的藻类、真菌、轮虫或浮游动物)导致的污染。
因此,需要一种技术来在赋予对所期望植物和/或藻类的除草剂耐受性后通过在抑制竞争性生物生长而没有除草剂耐受性的浓度下处理除草剂来大规模地收获所期望的植物和/或藻类。
参考文献
(专利文献1)美国专利申请登记公开us6,308,458(2001年10月30日)
(专利文献2)美国专利申请登记公开us6,808,904(2004年10月26日)
(专利文献3)美国专利申请登记公开us7,563,950(2009年07月21日)
(专利文献4)国际专利申请公开wo2011/085221(2011年07月14日)
(非专利文献1)lix,volrathsl,chilcottce,johnsonma,warder,lawmd,原卟啉原氧化酶作为根癌农杆菌介导的玉米转化的有效选择标记的开发(developmentofprotoporphyrinogenoxidaseasanefficientselectionmarkerforagrobacteriumtumefaciens-mediatedtransformationofmaize),植物生理学(plantphysiology)133:736-747,2003
技术实现要素:
技术问题
在本说明书中,发现来源于原核生物的hemy型ppo基因及其突变体对原卟啉原氧化酶(ppo)抑制性除草剂显示出广泛的除草剂耐受性,从而提出如果向植物和/或藻类提供hemy型ppo基因及其突变体,可以赋予和/或增强除草剂耐受性。
一种实施方式提供了多肽变体,其包含、基本上由以下组成或由以下组成:
(1)以下氨基酸序列,所述氨基酸序列中,选自由影响ppo抑制性除草剂与ppo多肽seqidno:2之间相互作用的氨基酸(例如位于与ppo抑制性除草剂相互作用的seqidno:2的结合位点上的氨基酸)组成的组中的一种或多种分别并且独立地缺失或被与相应位置上的原始氨基酸不同的氨基酸取代,或
(2)与氨基酸序列(1)具有95%或更高、98%或更高、或99%或更高序列同源性的氨基酸序列。
选自由影响ppo抑制性除草剂与ppo多肽seqidno:2之间相互作用的氨基酸组成的组中的一种或多种可以是选自由seqidno:2的氨基酸序列中的n59、s60、r89、f161、v165、a167、q184、p303、v305、f324、l327、i340、f360和i408组成的组中的一种或多种。
另一种实施方式提供了多肽变体,其包含、基本上由以下组成或由以下组成:
(1)以下氨基酸序列,所述氨基酸序列中,选自由影响ppo抑制性除草剂与ppo多肽seqidno:4之间相互作用的氨基酸(例如位于与ppo抑制性除草剂相互作用的seqidno:4的结合位点上的氨基酸)组成的组中的一种或多种分别并且独立地缺失或被与相应位置上的原始氨基酸不同的氨基酸取代,或者
(2)与氨基酸序列(1)具有95%或更高、98%或更高、或99%或更高同源性的氨基酸序列。
选自由影响ppo抑制性除草剂与ppo多肽seqidno:4之间相互作用的氨基酸组成的组中的一种或多种可以是选自由seqidno:4的氨基酸序列中的r101、f171、v175、a177、g194、p316、v318、f337、l340、i353和f373组成的组中的一种或多种。
其他实施方式提供了编码多肽或多肽变体的多核苷酸。
其他实施方式提供了包含该多核苷酸的重组载体。
其他实施方式提供了包含该重组载体的重组细胞。
其他实施方式提供了用于赋予或增强植物或藻类的除草剂耐受性的组合物,其包含选自由以下组成的组中的一种或多种:
seqidno:2的多肽、seqidno:4的多肽、如上所述的多肽变体、和氨基酸序列为与所述多肽或多肽变体具有95%或更高、98%或更高、或99%或更高序列同源性的多肽;
编码多肽的多核苷酸,多肽变体和氨基酸序列为与所述多肽或变体具有95%或更高、98%或更高、或99%或更高的氨基酸序列序列同源性的多肽;
包含该多核苷酸的重组载体;和
包含该重组载体的重组细胞。
例如,编码seqidno:2的多肽的多核苷酸可以包含seqidno:1的多核苷酸序列,并且编码seqidno:4的多肽的多核苷酸可以包含seqidno:3的多核苷酸序列,但不限于此。
除草剂可以是原卟啉原氧化酶抑制性除草剂。
作为具体实施方式,除草剂可以是选自由嘧啶二酮、二苯基醚、苯基吡唑、n-苯基邻苯二甲酰亚胺、苯基酯、噻二唑、
作为具体实施方式,除草剂可以是选自由以下组成的组中的一种或多种:氟丙嘧草酯、苯嘧磺草胺、双苯嘧草酮、汰芬那(tiafenacil)、氟磺胺草醚、乙氧氟草醚、苯草醚、三氟羧草醚、治草醚(bifenox)、氯乳醚(ethoxyfen)、乳氟禾草灵(lactofen)、甲氧除草醚(chlomethoxyfen)、氯除草醚(chlorintrofen)、乙羧氟草醚(fluoroglycofen-ethyl)、氟硝磺酰胺(halosafen)、氟唑草酯(pyraflufen-ethyl)、异丙吡草酯(fluazolate)、丙炔氟草胺(flumioxazin)、吲哚酮草酯(cinidon-ethyl)、氟烯草酸(flumiclorac-pentyl)、嗪草酸(fluthiacet)、噻二唑草胺(thidiazimin)、丙炔
植物是指具有光合能力的多细胞真核生物,其可以是单子叶植物或双子叶植物,并且可以是草本植物或木本植物。藻类是指具有光合能力的单细胞生物,其可以是原核藻类或真核藻类。
在一种实施方式中,对植物和藻类进行遗传操作以进一步包含第二除草剂耐受性多肽或其编码基因,并且可以赋予和/或增强对第二除草剂的更广泛的除草剂耐受性。为了更多地包含第二除草剂耐受性多肽或其编码基因而进行遗传操作的植物和藻类可以使用用于赋予和/或增强对除草剂的耐受性的组合物来制备,所述组合物中进一步包含第二除草剂耐受性多肽或其编码基因。因此,用于赋予和/或增强对除草剂的耐受性的组合物可以进一步包含第二除草剂耐受性多肽或其编码基因。
作为具体实施方式,第二除草剂可包括细胞分裂抑制性除草剂、光合作用抑制性除草剂、氨基酸合成抑制性除草剂、质体抑制性除草剂和细胞膜抑制性除草剂,但不限于此。
作为具体实施方式,第二除草剂的实例可以是草甘膦、草铵膦、麦草畏、2,4-d(2,4-二氯苯氧基乙酸)、异
作为具体实施方式,第二除草剂的实例可以是选自由以下组成的组中的一种或多种:草甘膦除草剂耐受性epsps(草甘膦耐受性5-烯醇丙酮莽草酸-3-磷酸合酶)、gox(草甘膦氧化酶)、gat(草甘膦-n-乙酰转移酶)或草甘膦脱羧酶;草铵膦除草剂耐受性pat(草丁膦-n-乙酰转移酶);麦草畏除草剂耐受性dmo(麦草畏单加氧酶);2,4-d除草剂耐受性2,4-d单加氧酶或aad(芳氧基链烷酸酯双加氧酶(aryloxyalkanoatedioxygenase));als抑制性磺酰脲基除草剂耐受性als(乙酰乳酸合酶)、ahas(乙酰羟酸合酶)或athahasl(乙酰羟酸合酶大亚基);光系统ii抑制性除草剂耐受性光系统ii蛋白d1;苯脲基除草剂耐受性细胞色素p450;质体抑制性除草剂耐受性hppd(羟基苯丙酮酸双加氧酶);溴苯腈除草剂耐受性腈水解酶;及其组合,但不限于此。
进一步地,编码第二除草剂耐受性多肽的基因的实例可以是选自由以下组成的组中的一种或多种:草甘膦除草剂耐受性cp4epsps、epsps(ag)、mepsps、2mepsps、goxv247、gat4601或gat4621基因;草铵膦除草剂耐受性bar、pat或pat(syn)基因;麦草畏除草剂耐受性dmo基因;2,4-d除草剂耐受性aad-1、aad-12基因;als抑制性磺酰脲基除草剂耐受性als、gm-hra、s4-hra、zm-hra、csr1、csr1-1、csr1-2、sura或surb;光系统ii抑制性除草剂耐受性psba基因;苯脲除草剂耐受性cyp76b1基因;异
其他实施方式提供了具有除草剂耐受性的植物和/或藻类的转化体,其用多核苷酸或其克隆或后代转化。
其他实施方式提供了制备具有除草剂耐受性的植物或藻类的方法,其包括用所述多核苷酸转化植物和/或藻类的步骤。
其他实施方式提供赋予或增强植物和/或藻类的除草剂耐受性的方法,其包括用所述多核苷酸转化植物和/或藻类的步骤。
可以对藻类和/或植物的细胞、原生质体、愈伤组织、下胚轴、种子、子叶、枝条或整株植物进行转化。
转化体可以是藻类和/或植物的细胞、原生质体、愈伤组织、下胚轴、种子、子叶、枝条或整株植物。
其他实施方式提供了一种控制农田中杂草的方法,包括:
向农田提供植物的步骤,所述植物包含选自seqidno:2或4的多肽、多肽变体、编码其的多核苷酸、包含该多核苷酸的重组载体和包含该重组载体的重组细胞中的一种或多种;和
将有效剂量的原卟啉原氧化酶抑制性除草剂施用于农田(或植物)的步骤。
作为一种具体实施方式,将有效剂量的原卟啉原氧化酶抑制性除草剂施用于农田的步骤可以通过依次或同时施用有效剂量的两种或更多种原卟啉原氧化酶抑制性除草剂来进行。
作为其他实施方式,可以对植物进行遗传操作以进一步包含第二除草剂耐受性多肽或其编码基因,并且可以依次或同时施用有效剂量的原卟啉原氧化酶抑制性除草剂和第二除草剂。
其他实施方式提供了从培养基中除去不希望的水生生物的方法,包括:向培养基提供藻类的步骤,所述藻类包含选自由多肽,多肽变体、编码多肽或多肽变体的多核苷酸、包含该多核苷酸的重组载体、和包含该重组载体的重组细胞组成的组中的一种或多种;以及将有效剂量的原卟啉原氧化酶抑制性除草剂施用于培养基的步骤。
技术方案
提供了赋予和/或增强植物或藻类的除草剂耐受性的技术。
本文中,“赋予和/或增强植物或藻类的除草剂耐受性”或“增强植物或藻类的除草剂耐受性”被解释为对不具有除草剂耐受性的植物或藻类赋予耐受性,或增强具有除草剂耐受性的植物或藻类的耐受性,或涵盖两者的广泛含义。
如本文所用,使用“由序列组成”、“基本上由序列组成”或“包括序列”,是为了指包括所描述的序列或必要地包括该序列的两种情况,并且可以被解释为包括除了所描述的序列之外的序列和/或包含突变(氨基酸或核酸的添加、缺失和/或取代)的意思,只要其保持蛋白、多肽或核酸分子的内在活性并显示预期的功能。
在一种实施方式中,提供了选自由以下组成的组中的一种或多种多肽变体:
多肽变体,其包含以下氨基酸序列、基本上由以下氨基酸序列组成或由以下氨基酸序列组成,在所述氨基酸序列中,选自由影响ppo抑制性除草剂与ppo多肽seqidno:2之间相互作用的氨基酸(例如位于与ppo抑制性除草剂相互作用的seqidno:2的结合位点上的氨基酸)组成的组中的一种或多种分别并且独立地缺失或被与原始氨基酸不同的其它氨基酸取代;或与所述多肽的氨基酸序列具有95%或更高、98%或更高、或99%或更高同源性的氨基酸序列;和
多肽变体,其包含以下氨基酸序列、基本上由以下氨基酸序列组成或由以下氨基酸组成,影响ppo抑制性除草剂与ppo多肽seqidno:4之间的相互作用的氨基酸(例如位于与ppo抑制性除草剂相互作用的seqidno:4的结合位点上的氨基酸),所述氨基酸分别并且独立地缺失或被与相应位置上的原始氨基酸不同的其它氨基酸取代;或与所述多肽的氨基酸序列具有95%或更高、98%或更高、或99%或更高同源性的氨基酸序列。
在其他实施方式中,提供了编码多肽或多肽变体的多核苷酸、包含该多核苷酸的重组载体、和包含该重组载体的重组细胞。可以设计多核苷酸,以使编码每个氨基酸的密码子中优化的密码子被包含在待转化的细胞中。优化的密码子对本领域技术人员来说是容易知道的(例如,参照“http://www.genscript.com/codon-opt.html”,“http://sg.idtdna.com/codonopt”等)。
在其他实施方式中,提供了用于赋予或增强植物或藻类的除草剂耐受性的组合物,其包含选自由以下组成的组中的一种或多种:
seqidno:2的多肽、seqidno:4的多肽、其多肽变体、和氨基酸序列为与该多肽或多肽变体的氨基酸序列具有95%或更高、98%或更高、或99%或更高同源性的多肽;
编码该多肽或多肽变体的多核苷酸;
包含该多核苷酸的重组载体;和
包含该重组载体的重组细胞。
例如,编码seqidno:2的多肽的多核苷酸可以包含seqidno:1的多核苷酸序列,并且编码seqidno:4的多肽的多核苷酸可以包含seqidno:3的多核苷酸序列,但不限于此。
另一种实施方式提供了具有除草剂耐受性的植物或藻类的转化体,其用编码多肽或多肽变体的多核苷酸转化。可以设计多核苷酸,以使编码每个氨基酸的密码子中优化的密码子被包含在待转化的细胞中。优化的密码子对本领域技术人员来说是容易知道的(例如,参照“http://www.genscript.com/codon-opt.html”,“http://sg.idtdna.com/codonopt”等)。
在其他实施方式中,提供了制备具有除草剂耐受性的植物或藻类的方法,其包括用所述多核苷酸转化藻类,或植物的细胞、原生质体、愈伤组织、下胚轴、种子、子叶、枝条或整株植物的步骤。
在其他实施方式中,提供了赋予或增强植物或藻类的除草剂耐受性的方法,其包括用所述多核苷酸转化藻类,或植物的细胞、原生质体、愈伤组织、下胚轴、种子、子叶、枝条或整株植物的步骤。
在下文中,将更详细地描述本发明。
具有seqidno:2或4的氨基酸序列、或与其具有95%或更高、98%或更高、或99%或更高同源性的氨基酸序列及其在本文中提供的变体的多肽是来源于原核生物(例如蓝细菌)的ppo蛋白,并且是对于ppo抑制性除草剂具有耐受性的除草剂耐受性ppo蛋白。具体地,提供来源于细长噬热聚球藻(thermosynechococcuselongatus)bp-1的ppo蛋白,将其命名为cyppo10,其氨基酸序列由seqidno:2表示,并且其编码基因的核苷酸序列由seqidno:1表示。另外,提供了来源于聚球藻属(thermosynechococcussp.)ja-3-3ab株的ppo蛋白,将其命名为cyppo13,其氨基酸序列由seqidno:4表示,并且其编码基因的核苷酸序列由seqidno:3表示。
本文中,上述多肽和多肽变体可分别表示为对ppo抑制性除草剂具有耐受性的除草剂耐受性ppo蛋白或除草剂耐受性ppo蛋白变体。此外,如本文所用,“除草剂耐受性ppo或其变体”可用于表示上述除草剂耐受性ppo蛋白或除草剂耐受性ppo蛋白变体、除草剂耐受性ppo蛋白编码基因或除草剂耐受性ppo蛋白变体编码基因、或它们全部。
蓝细菌来源的ppo蛋白本身具有比植物ppo更优异的酶活性,并且这些ppo蛋白可以赋予对ppo抑制性除草剂的耐受性,并通过在整体上维持酶活性的范围内包含相对于野生型ppo蛋白的氨基酸突变来增强除草剂耐受性。这种氨基酸突变可以包括取代、缺失、添加和/或导入选自ppo蛋白与除草剂之间相互作用位点的氨基酸残基的氨基酸中的一种或多种。
将更详细地如下描述ppo蛋白变体。
一种实施方式提供了多肽变体,其包含以下氨基酸序列、基本上由以下氨基酸序列组成或由以下氨基酸序列组成:
氨基酸序列,其中选自由影响ppo抑制性除草剂与ppo多肽seqidno:2(cyppo10)之间相互作用的氨基酸(例如位于与ppo抑制性除草剂相互作用的seqidno:2的结合位点上的氨基酸)组成的组中的一种或多种分别并且独立地缺失或被与原始氨基酸(即野生型的相应位置上的氨基酸)不同的其它氨基酸取代,或
与所述氨基酸序列具有95%或更高、98%或更高、或99%或更高同源性的氨基酸序列。
seqidno:2的多肽的缺失或被与原始氨基酸不同的其他氨基酸取代的氨基酸残基(即,选自由位于seqidno:2的多肽与ppo抑制性除草剂的结合位点上的氨基酸组成的组中的一种或多种)可以是选自由seqidno:2的氨基酸序列的n59(意指“第59位上的n(asn)”;以下氨基酸残基的表示以相同方式解释)、s60、r89、f161、v165、a167、q184、p303、v305、f324、l327、i340、f360和i408组成的组中的一种或多种。
在一种具体实施方式中,多肽变体可包含以下氨基酸序列、基本上由以下氨基酸序列组成或由以下氨基酸序列组成:
氨基酸序列,其中选自由seqidno:2的氨基酸序列中的n59、s60、r89、f161、v165、a167、q184、p303、v305、f324、l327、i340、f360和i408组成的组中的一种或多种分别并且独立地缺失或被选自由m(met)、v(val)、i(ile)、t(thr)、l(leu)、c(cys)、a(ala)、s(ser)、f(phe)、p(pro)、w(trp)、n(asn)、q(gln)、g(gly)、y(tyr)、d(asp)、e(glu)、r(arg)、h(his)、k(lys)等组成的组并且与相应位置上的原始氨基酸不同的氨基酸取代(例如,被选自由m(met)、v(val)、i(ile)、t(thr)、l(leu)、c(cys)、a(ala)、s(ser)、r(arg)、w(trp)、g(gly)等组成的组并且与野生型中相应位置上的原始氨基酸不同的氨基酸取代),或
与所述氨基酸序列具有95%或更高、98%或更高、或99%或更高同源性的氨基酸序列。
例如,多肽变体可包含以下氨基酸序列、基本上由以下氨基酸序列组成或由以下氨基酸序列组成:
氨基酸序列,其包含选自由seqidno:2的氨基酸序列中的f360m(意指“第360位上的氨基酸残基由f(phe)被取代成m(met)”;以下氨基酸突变的表示以相同方式解释)、f360v、f360i、f360t、f360l、f360c、a167c、a167l、a167i、p303l、v305l、v305m、v305t、n59t、s60t、r89a、r89l、r89v、f161a、v165s、v165c、q184g、f324v、l327t、i340t、i408r和i408w组成的组中的一种或多种氨基酸突变,或
与所述氨基酸序列具有95%或更高、98%或更高、或99%或更高同源性的氨基酸序列。
更具体地,多肽变体可包含以下氨基酸序列、基本上由以下氨基酸序列组成或由以下氨基酸序列组成:
氨基酸序列,其包含选自由seqidno:2的氨基酸序列中的f360m、f360v、f360i、f360t、f360l、f360c、a167c、a167l、a167i、p303l、n59t、s60t、r89a、r89l、r89v、f161a、v165s、v165c、q184g、v305l、v305m、v305t、f324v、l327t、i340t、i408r、i408w、p303l+v305l(意指包括所有第303位残基由p到l的取代和第305位残基由v到l的取代的突变体或突变;以下两种或更多种突变的表示以相同方式解释)、n59t+f360v、s60t+v165s+f360m、s60t+v165s+f360i、s60t+i340t+f360i、r89a+f360m、r89a+f360i、r89a+f360l、r89l+f360i、r89v+f360i、r89a+a167l+f360m、r89a+v305t+f360m、v165s+f360m、v165s+f360i、v165s+f360l、v165s+f360v、v165c+f360m、v165c+a167c+f360m、v165c+a167i+f360m、v165c+a167l+f360m、a167l+f360m、a167l+f360i、a167c+f360m、a167c+f360i、a167i+f360m、v305m+f360m、v305t+f360i、v305l+f360m、i408r+f360m、或i408w+f360m的氨基酸突变组成的组中的一种或多种氨基酸突变,或
与所述氨基酸序列具有95%或更高、98%或更高、或99%或更高同源性的氨基酸序列。
其他实施方式提供了多肽变体,其包含以下氨基酸序列、基本上由以下氨基酸序列组成或由以下氨基酸序列组成:
氨基酸序列,其中选自由影响ppo抑制性除草剂与ppo多肽seqidno:4(cyppo13)之间相互作用的氨基酸(例如位于与ppo抑制性除草剂相互作用的seqidno:4的多肽的结合位点上的氨基酸)组成的组中的一种或多种分别并且独立地缺失或被与相应位置上的原始氨基酸(即野生型的相应位置上的氨基酸)不同的其它氨基酸取代,或
与所述氨基酸序列具有95%或更高、98%或更高、或99%或更高同源性的氨基酸序列。
seqidno:4的多肽的缺失或被与相应位置上的原始氨基酸不同的其他氨基酸取代(例如,选自由位于seqidno:3的多肽与ppo抑制性除草剂的结合位点上的氨基酸组成的组中的一种或多种)的氨基酸残基可以是选自由seqidno:4的氨基酸序列中的r101、f171、v175、a177、g194、p316、v318、f337、l340、i353和f373组成的组中的一种或多种。
在一种具体实施方式中,多肽变体可包含以下氨基酸序列、基本上由以下氨基酸序列组成或由以下氨基酸序列组成:
氨基酸序列,其中选自由seqidno:4的氨基酸序列中的r101、f171、v175、a177、g194、p316、v318、f337、l340、i353和f373组成的组中的一种或多种分别并且独立地缺失或被选自由m(met)、v(val)、i(ile)、t(thr)、l(leu)、c(cys)、a(ala)、s(ser)、f(phe)、p(pro)、w(trp)、n(asn)、q(gln)、g(gly)、y(tyr)、d(asp)、e(glu)、r(arg)、h(his)、k(lys)等组成的组并且与野生型中相应位置上的原始氨基酸不同的氨基酸取代(例如,被选自由m(met)、v(val)、i(ile)、t(thr)、l(leu)、c(cys)、a(ala)、e(glu)、q(gln)、k(lys)、r(arg)、h(his)、n(asn)等组成的组,并且与野生型中相应位置上的氨基酸不同的氨基酸取代),或
与所述氨基酸序列具有95%或更高、98%或更高、或99%或更高同源性的氨基酸序列。
例如,多肽变体可包含以下氨基酸序列、基本上由以下氨基酸序列组成或由以下氨基酸序列组成:
氨基酸序列,其包含选自由seqidno:4的氨基酸序列中的f373m、f373v、f373i、f373t、f373l、f373c、f373n、f373h、a177c、a177l、a177i、p316a、p316l、v318l、v318m、r101a、f171a、v175c、v175l、g194e、g194q、g194m、g194k、g194r、f337v、l340t和i353t组成的组中的一种或多种氨基酸突变,或与所述氨基酸序列具有95%或更高、98%或更高、或99%或更高同源性的氨基酸序列。更具体地,多肽变体可包含:氨基酸序列,其包含选自由seqidno:4的氨基酸序列中的f373m、f373v、f373i、f373t、f373l、f373c、f373n、f373h、a177c、a177l、a177i、p316a、p316l、v318l、v318m、r101a、f171a、v175c、v175l、g194e、g194q、g194m、g194k、g194r、f337v、l340t、i353t、p316l+v318l、p316a+v318l、r101a+f373m、a177c+f373m、a177i+f373m、a177l+f373m、a177l+f373i、a177l+f373l、a177l+f373t、a177l+f373v、a177c+f373t、a177c+f373v、v175l+f373m、g194e+f373m、g194q+f373m、g194m+f373m、g194k+f373m、g194r+f373m或v318m+f373m的氨基酸突变组成的组中的一种或多种氨基酸突变,或
与所述氨基酸序列具有95%或更高、98%或更高、或99%或更高同源性的氨基酸序列。
包含具有本文所描述的序列同源性(例如95%或更高、98%或更高、或99%或更高的序列同源性)的氨基酸序列的多肽变体可保持与具有作为序列同源性鉴定标准的氨基酸序列的多肽(例如,具有上述氨基酸突变的ppo蛋白)等价的酶活性,例如,与植物中(整株植物中、植物细胞或细胞培养物中、植物组织中等)、藻类中、和/或体外的具有作为标准的氨基酸序列的多肽相比,所述多肽变体具有5%或更高、10%或更高、20%或更高、30%或更高、40%或高于、50%或更高、60%或更高、70%或更高、80%或更高、90%或更高、或95%或更高的酶活性,并且具有赋予除草剂耐受性的功能。使用序列同源性的描述是为了阐明本文所描述的除草剂耐受性ppo蛋白变体或多肽变体可包含满足上述条件范围内的所有序列突变(维持酶活性,并具有赋予除草剂耐受性的功能)。
描述中使用的氨基酸的名称排列如下:
除草剂耐受性ppo蛋白变体可以维持ppo蛋白的酶活性,并且与野生型相比表现出增强的除草剂耐受性。
此外,除草剂耐受性ppo蛋白变体可以包含对由seqidno:2或seqidno:4或具有上述氨基酸突变的氨基酸序列组成的多肽表现出生物学上相同活性的进一步突变。例如,另外的突变可以是氨基酸取代,其不会总体改变分子活性,并且这种氨基酸取代在本领域是公知的。在一种实例中,额外的取代可以是氨基酸残基ala/ser、val/ile、asp/glu、thr/ser、ala/gly、ala/thr、ser/asn、ala/val、ser/gly、thr/phe、ala/pro、lys/arg、asp/asn、leu/ile、leu/val、ala/glu或asp/gly的取代,但不限于此。在一些情况下,除草剂耐受性ppo蛋白变体可以具有通过选自由磷酸化、硫酸化、酰化、糖基化、甲基化、法尼基化等组成的组中的一种或多种而进行的修饰。此外,除草剂耐受性ppo蛋白变体可包含蛋白变体,其中蛋白对热、ph等的结构稳定性或蛋白活性通过氨基酸突变和/或修饰而增加。
术语“序列同源性”是指与野生型或参比氨基酸序列或核苷酸序列的相似程度,并且任何蛋白可包括在本发明的范围内,只要其包含与除草剂耐受性ppo蛋白的氨基酸序列具有60%或更高、65%或更高、70%或更高、75%或更高、80%或更高、85%或更高、90%或更高、95%或更高、98%或更高、或99%或更高同一性的氨基酸序列并且保持与除草剂耐受性ppo蛋白变体等价的生物学活性即可。这些蛋白同源物可包含与靶蛋白等价的活性位点。可以进行这种同源性比较或借助于容易获得的比较程序进行这种同源性比较。可以使用在线可用分析程序将两个或更多个序列之间的同源性计算为百分比(%)。用于序列比较的序列比对可以通过相关领域中已知的任何常规方法进行,例如,常规方法可以包括但不限于gap、bestfit、blast和clustalomega。
除草剂耐受性ppo蛋白或其变体可以通过本领域熟知的方法通过从自然界中提取并纯化而获得。另外,它可以使用基因重组技术作为重组蛋白而获得。在使用基因重组技术的情况下,重组蛋白可以通过以下方法获得:将编码除草剂耐受性ppo蛋白或其变体的核酸导入适当的表达载体,并用该载体转化宿主细胞以表达靶蛋白,然后从宿主细胞收集除草剂耐受性ppo蛋白或其变体。蛋白在选定的宿主细胞中表达后,可以使用一般的生化分离技术来对其分离和纯化,例如用蛋白沉淀剂处理(盐析)、离心、超声破碎、超滤、透析、色谱(例如分子筛色谱(凝胶过滤)、吸附色谱、离子交换色谱、亲和色谱)等,并且为了以高纯度分离蛋白,这些方法可以组合使用。
可以使用标准分子生物学技术(例如化学合成或重组方法)分离或制备除草剂耐受性ppo核酸分子(编码ppo蛋白或其变体的多核苷酸),或者可以使用商业上可获得的技术。
在一种具体实施方式中,在使用ppo缺陷型大肠杆菌(e.coli)bt3(δppo)的除草剂耐受性测试系统中,发现ppo蛋白对根据化学结构分类的代表性的9个家族的ppo抑制性除草剂表现出广泛的除草剂耐受性。还发现它们也可以通过使用转运肽(tp)在植物的叶绿体中表达。进一步地,发现ppo蛋白也可以通过植物表达载体在拟南芥哥伦比亚生态型(a.thalianaecotypecolumbia)中表达。即使用ppo抑制性除草剂处理转化的植物,也观察到植物的萌发和生长。此外,通过遗传研究证实了上述除草剂耐受性状对下一代的遗传。
因此,可将本文提供的ppo蛋白及其变体导入植物或藻类中,从而用于增强植物或藻类的除草剂耐受性。
本文的除草剂是指杀死、控制或以其他方式不利地改变植物或藻类生长的活性成分。此外,除草剂耐受性或除草剂耐受性是指,与正常植物或野生型植物相比,甚至在用通常杀死正常或野生型植物或通常抑制其生长的除草剂处理后,植物生长的抑制也会减弱或消除,因此植物继续生长。除草剂包括抑制植物或藻类的原卟啉原氧化酶(ppo)的除草剂。根据它们的化学结构,这种ppo抑制性除草剂可分为嘧啶二酮类、二苯基醚类、苯基吡唑类、n-苯基邻苯二甲酰亚胺类、噻二唑类、
作为具体实施方式,嘧啶二酮类除草剂包括氟丙嘧草酯、苯嘧磺草胺、双苯嘧草酮和汰芬那,但不限于此。
二苯基醚类除草剂包括氟磺胺草醚、乙氧氟草醚、苯草醚、三氟羧草醚、治草醚、氯乳醚、乳氟禾草灵、甲氧除草醚、氯除草醚(chlorintrofen)、乙羧氟草醚和氟硝磺酰胺,但不限于此。
苯基吡唑类除草剂包括氟唑草酯和异丙吡草酯,但不限于此。
苯基邻苯二甲酰亚胺类除草剂包括丙炔氟草胺、吲哚酮草酯和氟烯草酸,但不限于此。
苯基酯类除草剂包括吡落草(2,4-二氯苯基1-吡咯烷羧酸盐)和吡落草的氨基甲酸酯类似物(例如,o-苯基吡咯烷基-和哌啶子基氨基甲酸酯类似物(参考“ujjanab.nandihalli、maryv.duke、stepheno.duke,o-苯基吡咯烷基-和哌啶子基氨基甲酸酯除草剂的分子性质与生物活性之间的关系(relationshipsbetweenmolecularpropertiesandbiologicalactivitiesofo-phenylpyrrolidino-andpiperidinocarbamateherbicides.),j.agric.foodchem.,1992,40(10)1993-2000”)),但不限于此。在一种实施方式中,吡落草的氨基甲酸酯类似物可以是选自由以下组成的组中的一种或多种:吡咯烷-1-羧酸苯酯(cas号55379-71-0)、1-吡咯烷羧酸、2-氯苯酯(cas号143121-06-6)、4-氯苯基吡咯烷-1-羧酸酯(cas号1759-02-0)、氨基甲酸、二乙基-、2,4-二氯-5-(2-丙炔氧基)苯基酯(9ci)(cas号143121-07-7)、1-吡咯烷羧酸、2,4-二氯-5-羟基苯基酯(cas号143121-08-8)、2,4-二氯-5-(甲氧基羰基)苯基吡咯烷-1-羧酸酯(cas号133636-94-9)、2,4-二氯-5-[(丙-2-基氧基)羰基]苯基吡咯烷-1-羧酸酯(cas号133636-96-1)、1-哌啶羧酸、2,4-二氯-5-(2-丙炔氧基)苯酯(cas号87374-78-5)、2,4-二氯-5-(丙-2-炔-1-基氧基)苯基吡咯烷-1-羧酸酯(cas号87365-63-7)、2,4-二氯-5-(丙-2-炔-1-基氧基)苯基4,4-二氟哌啶-1-羧酸酯(cas号138926-22-4)、1-吡咯烷羧酸、3,3-二氟-、2,4-二氯-5-(2-丙炔-1-基氧基)苯基酯(cas号143121-10-2)、4-氯-2-氟-5-[(丙-2-基氧基)羰基]苯基吡咯烷-1-羧酸酯(cas号133636-98-3)等。
噻二唑类除草剂包括嗪草酸和噻二唑草胺,但不限于此。
三唑啉酮类除草剂包括唑酮草酯、甲磺草胺和唑啶草酮,但不限于此。
其他除草剂包括双唑草腈、氟哒嗪草酯和氟唑草胺,但不限于此。
可以通过本领域已知的各种方法,优选地,通过使用用于植物或藻类转化的表达载体,将本文提供的除草剂耐受性ppo基因导入植物或藻类中。
在植物转化的情况下,可以包含在载体中的合适的启动子可以是本领域通常用于将基因导入植物的任何启动子。例如,启动子可包括sp6启动子、t7启动子、t3启动子、pm启动子、玉米泛素启动子、花椰菜花叶病毒(camv)35s启动子、胭脂碱合酶(nos)启动子、玄参花叶病毒35s启动子、甘蔗杆状病毒启动子、鸭跖草属黄斑驳病毒启动子、来自核酮糖-1,5-二磷酸羧化酶小亚基(ssrubisco)的光诱导型启动子、水稻细胞溶质磷酸丙糖异构酶(tpi)启动子、拟南芥属(arabidopsis)的腺嘌呤磷酸核糖基转移酶(aprt)启动子、章鱼碱合酶启动子和bcb(蓝铜结合蛋白)启动子,但不限于此。
进一步地,载体可以包括引起3′-末端多聚腺苷酸化的polya信号序列,例如,它可以包括来源于根癌农杆菌(agrobacteriumtumefaciens)的胭脂碱合酶基因的nos3′-端、来自根癌农杆菌的章鱼碱合酶的章鱼碱合酶终止子、番茄或马铃薯的蛋白酶抑制剂i或ii基因的3′-端、camv35s终止子、水稻α淀粉酶终止子ramy1a和菜豆碱终止子,但并不限于此。
另外,叶绿体特异性启动子,核启动子,组成型启动子或诱导型启动子可作为启动子用于将基因导入藻类中。可以设计本文提供的除草剂耐受性ppo基因或其变体,以便可操作地连接到5′utr或3′utr,从而在藻类的细胞核中表达功能。此外,载体可以进一步包含适合于藻类转化的转录调控序列。可以将赋予除草剂耐受性的重组基因整合到宿主藻类的叶绿体的基因组或细胞核的基因组中,但不限于此。
另外,在载体中,靶向于叶绿体所需的转运肽可以与ppo基因的5′-端连接,以便在叶绿体中表达除草剂耐受性ppo基因。
此外,任选地,载体可以进一步包括作为报告分子的编码选择标记的基因,该选择标记的实例可以包括抗生素(例如,新霉素、羧苄青霉素、卡那霉素、壮观霉素、潮霉素、博来霉素、氯霉素等)或除草剂(草甘膦、草铵膦、草丁膦等)耐受基因,但不限于此。
进一步地,用于植物表达的重组载体可以包括农杆菌二元载体、共整合载体或不具有t-dna区域但设计为在植物中表达的一般载体。其中,二元载体是指含有两种独立的载体系统的载体,该两种独立的载体系统含有一种负责迁移的一种质粒,所述质粒由ti(肿瘤诱导型)质粒中的左边界(lb)和右边界(rb)组成,另一种质粒用于靶基因-转移,该载体可包括用于在植物中表达的启动子区和多腺苷酸化信号序列。
当使用二元载体或共整合载体时,用于将重组载体转化到植物中的菌株优选是农杆菌(农杆菌介导的转化)。在这方面,可以使用根癌农杆菌或毛根农杆菌(agrobacteriumrhizogenes)。另外,当使用不具有t-dna区域的载体时,可以使用电穿孔、粒子轰击、聚乙二醇介导的摄取等将重组质粒导入植物中。
通过上述方法用基因转化的植物可以使用本领域已知的标准技术通过愈伤组织诱导、根茎生长和土壤适应性再分化成植物。
本文中经历转化的植物通过包括植物细胞(含有悬浮培养的细胞)、原生质体、愈伤组织、下胚轴、种子、子叶、枝条以及成熟植物的含义来理解。
此外,转化体的范围包括导入基因的转化体以及其克隆或后代(t1代、t2代、t3代、t4代、t5代或任何后代)。例如,转化的植物还包括作为用本文提供的基因转化的植物的有性和无性后代的具有遗传的除草剂耐受性性状的植物。本发明的范围还包括显示初始转化的植物的特征的所有突变体和变体,以及用本文提供的基因转化的植物的所有杂交和融合产物。此外,本发明的范围还包括植物的一部分,例如种子、花、茎、果实、叶、根、块茎和/或块根,该部分来源于通过本发明的方法预先转化的转化植物或其后代,以及由至少一部分转化细胞组成。
施用本发明的植物不特别限于,但包括单子叶植物或双子叶植物。此外,该植物包括草本植物或木本植物。单子叶植物可包括属于如下科的植物:泽泻科(alismataceae)、水鳖科(hydrocharitaceae)、水麦冬科(juncaginaceae)、芝菜科(scheuchzeriaceae)、眼子菜科(potamogetonaceae)、茨藻科(najadaceae)、大叶藻科(zosteraceae)、百合科(liliaceae)、血皮草科(haemodoraceae)、龙舌兰科(agavaceae)、石蒜科(amaryllidaceae)、薯蓣科(dioscoreaceae)、雨久花科(pontederiaceae)、鸢尾科(iridaceae)、水玉簪科(burmanniaceae)、灯芯草科(juncaceae)、鸭跖草科(commelinaceae)、谷精草科(eriocaulaceae)、禾本科(gramineae/poaceae)、天南星科(araceae)、浮萍科(lemnaceae)、黑三棱科(sparganiaceae)、香蒲科(typhaceae)、莎草科(cyperaceae)、芭蕉科(musaceae)、姜科(zingiberaceae)、美人蕉科(cannaceae)、兰科(orchidaceae),但不限于此。
双子叶植物可包括属于如下科的植物:岩梅科(diapensiaceae)、山柳科(clethraceae)、鹿蹄草科(pyrolaceae)、杜鹃花科(ericaceae)、紫金牛科(myrsinaceae)、报春花科(primulaceae)、蓝雪科(plumbaginaceae)、柿树科(ebenaceae)、安息香科(styracaceae)、山矾科(symplocaceae)、木犀科(oleaceae)、马钱科(loganiaceae)、龙胆科(gentianaceae)、睡菜科(menyanthaceae)、夹竹桃科(apocynaceae)、萝藦科(asclepiadaceae)、茜草科(rubiaceae)、花荵科(polemoniaceae)、旋花科(convolvulaceae)、紫草科(boraginaceae)、马鞭草(verbenaceae)、唇形科(labiatae)、茄科(solanaceae)、玄参科(scrophulariaceae)、紫葳科(bignoniaceae)、爵床科(acanthaceae)、胡麻科(pedaliaceae)、列当科(orobanchaceae)、苦苣苔科(gesneriaceae)、狸藻科(lentibulariaceae)、透骨草科(phrymaceae)、车前科(plantaginaceae)、忍冬科(caprifoliaceae)、五福花科(adoxaceae)、败酱科(valerianaceae)、川续断科(dipsacaceae)、桔梗科(campanulaceae)、菊科(compositae)、杨梅科(myricaceae)、胡桃科(juglandaceae)、杨柳科(salicaceae)、桦科(betulaceae)、壳斗科(fagaceae)、榆科(ulmaceae)、桑科(moraceae)、荨麻科(urticaceae)、檀香科(santalaceae)、桑寄生科(loranthaceae)、蓼科(polygonaceae)、商陆科(phytolaccaceae)、紫茉莉科(nyctaginaceae)、番杏科(aizoaceae)、马齿苋科(portulacaceae)、石竹科(caryophyllaceae)、藜亚科(chenopodiaceae)、苋科(amaranthaceae)、仙人掌科(cactaceae)、木兰科(magnoliaceae)、八角茴香科(illiciaceae)、樟科(lauraceae)、连香树科(cercidiphyllaceae)、毛茛科(ranunculaceae)、小檗科(berberidaceae)、木通科(lardizabalaceae)、防己科(menispermaceae)、睡莲科(nymphaeaceae)、金鱼藻科(ceratophyllaceae)、莼菜科(cabombaceae)、三白草科(saururaceae)、胡椒科(piperaceae)、金粟兰科(chloranthaceae)、马兜铃科(aristolochiaceae)、猕猴桃科(actinidiaceae)、山茶科(theaceae)、藤黄科(guttiferae)、茅膏菜(droseraceae)、罂粟科(papaveraceae)、白花菜科(capparidaceae)、十字花科(cruciferae)、悬铃木科(platanaceae)、金缕梅科(hamamelidaceae)、景天科(crassulaceae)、虎耳草科(saxifragaceae)、杜仲科(eucommiaceae)、海桐花科(pittosporaceae)、蔷薇科(rosaceae)、豆科(leguminosae)、酢浆草科(oxalidaceae)、牻牛儿苗科(geraniaceae)、旱金莲科(tropaeolaceae)、蒺藜科(zygophyllaceae)、亚麻科(linaceae)、大戟科(euphorbiaceae)、水马齿科(callitrichaceae)、芸香科(rutaceae)、苦木科(simaroubaceae)、楝科(meliaceae)、远志科(polygalaceae)、漆树科(anacardiaceae)、槭树科(aceraceae)、无患子科(sapindaceae)、七叶树科(hippocastanaceae)、清风藤科(sabiaceae)、凤仙花科(balsaminaceae)、冬青科(aquifoliaceae)、卫矛科(celastraceae)、省沽油科(staphyleaceae)、黄杨科(buxaceae)、岩高兰科(empetraceae)、鼠李科(rhamnaceae)、葡萄科(vitaceae)、杜英科(elaeocarpaceae)、椴树(tiliaceae)、锦葵科(malvaceae)、梧桐科(sterculiaceae)、瑞香科(thymelaeaceae)、胡颓子科(elaeagnaceae)、大风子科(flacourtiaceae)、堇菜科(violaceae)、西番莲科(passifloraceae)、柽柳科(tamaricaceae)、沟繁缕科(elatinaceae)、秋海棠科(begoniaceae)、葫芦科(cucurbitaceae)、千屈菜科(lythraceae)、石榴科(punicaceae)、柳叶菜科(onaraceae)、小二仙草科(haloragaceae)、八角枫科(alangiaceae)、山茱萸科(cornaceae)、五加科(araliaceae)、伞形科(umbelliferae/apiaceae),但不限于此。
在一种具体实施方式中,植物可以是选自由以下组成的组中的一种或多种:粮食作物,例如水稻、小麦、大麦、玉米、大豆、马铃薯、红豆、燕麦和高粱;蔬菜作物,例如大白菜、萝卜、红辣椒、草莓、番茄、西瓜、黄瓜、卷心菜、薄皮甜瓜、南瓜、威尔士负离子(welshanion)、负离子(anion)和胡萝卜;特殊用途作物,例如人参、烟草、棉花、青饲料(soilage)、草料(forage)、芝麻、甘蔗、甜菜、紫苏属(perillasp.)、花生、油菜、草和蓖麻油植物;果树,例如苹果树、梨树、枣树、桃树、猕猴桃果树、葡萄树、柑橘果树、柿子树、李子树、杏树和香蕉树;木本植物,例如松树、棕榈油和桉树;开花作物,例如玫瑰、唐菖蒲、非洲菊、康乃馨、菊花、百合和郁金香;饲料作物,例如黑麦草、红三叶草、果树草、苜蓿、高羊茅和多年生黑麦草,但不限于此。作为具体实施方式,植物可以是选自由以下组成的组中的一种或多种:双子叶植物,例如拟南芥、马铃薯、茄子、烟草、红辣椒、番茄、牛蒡、茼蒿、莴苣、桔梗花、菠菜、甜菜、红薯、芹菜、胡萝卜、水芹、欧芹、大白菜、卷心菜、萝卜、西瓜、薄皮甜瓜、黄瓜、南瓜、葫芦、草莓、大豆、绿豆、芸豆和豌豆;以及单子叶植物,例如水稻、小麦、大麦、玉米、高粱等、但不限于此。
施用本发明的藻类不特别限于,但包括原核藻类或真核藻类。例如,藻类可以是蓝细菌、绿藻、红藻、褐藻,大型藻类或微型藻类。
蓝细菌包括:色球藻门(chroococcalesphylum)(例如,隐球藻属(aphanocapsa)、隐杆藻属(aphanothece)、管孢藻属(chamaesiphon)、骨囊藻属(chondrocystis)、色球藻属(chroococcus)、色粘囊藻属(chroogloeocystis)、鳄球藻属(crocosphaera)、藻青菌属(cyanobacterium)、蓝菌属(cyanobium)、蓝网藻属(cyanodictyon)、蓝八联藻属(cyanosarcina)、蓝杆藻属(cyanothece)、蓝纤维藻属(dactylococcopsis)、粘球藻属(gloeocapsa)、粘杆藻属(gloeothece)、盐杆藻属(halothece)、拟丝藻属属(johannesbaptistia)、平裂藻属(merismopedia)、微囊藻属(microcystis)、放射囊藻属(radiocystis)、棒条藻属(rhabdoderma)、小雪藻属(snowella)、聚球藻属(synechococcus)、集胞藻属(synechocystis)、嗜热聚球藻属(thermosynechococcus)、乌龙藻属(woronichinia)),粘菌藻门(gloeobacteriaphylum)、念珠藻门(nostocalesphylum)(例如,微毛藻科(microchaetaceae)、念珠藻科(nostocaceae)、胶须藻科(rivulariaceae)、伪枝藻科(scytonemataceae))、颤藻门(oscillatorialesphylum)(例如,节藻属(arthronema)、节旋藻属(arthrospira)、布棱藻属(blennothrix)、发毛针藻属(crinalium)、盖丝藻属(geitlerinema)、盐微藻(halomicronema)、盐螺旋藻属(halospirulina)、水鞘藻属(hydrocoleum)、贾丝藻属(jaaginema)、假膜藻(katagnymene)、柯孟藻(komvophoron)、细鞘丝藻属(leptolyngbya)、湖丝藻属(limnothrix)、鞘丝藻属(lyngbya)、微鞘藻属(microcoleus)、颤藻属(oscillatoria)、席藻属(phormidium)、拟浮丝藻属(planktothricoides)、浮丝藻属(planktothrix)、织线藻属(plectonema)、假鱼腥藻属(pseudanabaena)、假席藻属(pseudophormidium)、裂须藻属(schizothrix)、螺旋藻属(spirulina)、斯特藻属(starria)、束藻属(symploca)、束毛藻属(trichodesmium)、常丝藻属(tychonema)),宽球藻门(pleurocapsalesphylum)(例如,拟色球藻属(chroococcidiopsis)、皮果藻属(dermocarpa)、小皮果藻属(dermocarpella)、粘囊藻属(myxosarcina)、厚皮藻属(pleurocapsa)、索伦藻属(solentia)、立毛藻属(stanieria)、异球藻属(xenococcus))、原绿藻门(prochloralesphylum)或真枝藻门(stigonematalesphylum)(例如,蒴链藻属(capsosira)、拟绿粘藻属(chlorogloeopsis)、侧生藻属(fischerella)、软管藻属(hapalosiphon)、拟鞭枝藻属(mastigocladopsis)、鞭枝藻属(mastigocladus)、拟念珠藻属(nostochopsis)、真枝藻属(stigonema)、聚线藻属(symphyonema)、拟聚线藻属(symphonemopsis)、梅崎藻属(umezakia)、拟惠氏藻属(westiellopsis))等。
作为藻类的另一个实例,可以例示绿藻门(chlorophyta)、衣藻属(chlamydomonas)、团藻目(volvacales)、杜氏藻属(dunaliella)、栅藻属(scenedesmus)、小球藻属(chlorella)或红球藻属(hematococcm)。
作为藻类的其他实例,可以例示三角褐指藻(phaeodactylumtricornutum)、透明茧形藻(amphiprorahyaline)、双眉藻属(amphoraspp.)、牟氏角毛藻(chaetocerosmuelleri)、腐生舟形藻(naviculasaprophila)、普通菱形藻(nitzschiacommunis)、二形栅藻(scenedesmusdimorphus)、斜生栅藻(scenedesmusobliquus)、瑞典四爿藻(tetraselmissuecica)、莱茵衣藻(chlamydomonasreinhardtii)、普通小球藻(chlorellavulgaris)、雨生红球藻(haematococcuspluvialis)、富油新绿藻(neochlorisoleoabundans)、细长聚球藻(synechococcuselongatus)、布朗葡萄藻(botryococcusbraunii)、紫色粘菌藻(gloeobacterviolaceus)、集胞藻属(synechocystis)、细长嗜热聚球藻(thermosynechococcuselongatus)、眼点微拟球藻(nannochloropsisoculata)、盐微拟球藻(nannochloropsissalina)、海洋富油微拟球藻(nannochloropsisgaditana)、球等鞭金藻(isochrysisgalbana)、苏德台葡萄藻(botryococcussudeticus)、纤细眼虫藻(euglenagracilis)、富油新绿藻(neochlorisoleoabundans)、谷皮菱形藻(nitzschiapalea)、卡特颗石藻(pleurochrysiscarterae)、朱氏四爿藻(tetraselmischuii)、巴夫藻属(pavlovaspp.)、隐球藻属(aphanocapsaspp.)、集胞藻属(synechosystisspp.)、微绿藻属(nannochlorisspp.)等。然而,不仅限于上面列出的种类,可以包括属于其他不同的属和科的藻类。
导入本文提供的除草剂耐受性ppo或其变体的植物或藻类可表现出对两种或更多种ppo抑制性除草剂的耐受性。
因此,通过依次或同时使用两种或更多种抑制ppo的除草剂,本文提供的技术可用于控制杂草或除去不希望的水生生物。
一种实施方式提供了一种控制农田中杂草的方法,包括向农田提供包含上述除草剂耐受性ppo蛋白、其变体或其编码基因的植物的步骤,以及将有效剂量的原卟啉原氧化酶抑制性除草剂施用于农田的步骤。
另一种实施方式提供了从培养基中除去不希望的水生生物的方法,包括向培养基提供包含上述除草剂耐受性ppo蛋白、其变体或其编码基因的藻类的步骤,以及将有效剂量的原卟啉原氧化酶抑制性除草剂施用于培养基的步骤。
此外,本文提供的除草剂耐受性ppo蛋白、其变体或其编码基因可以与第二除草剂耐受性多肽或其编码基因组合使用。
因此,导入本文提供的除草剂耐受性ppo的植物或藻类可以表现出对作用机理上彼此不同的两种或更多种除草剂的耐受性。在本发明中,可以依次或同时使用作用机理上彼此不同的两种或更多种不同的除草剂(包括ppo抑制性除草剂),从而控制杂草和/或除去不希望的水生生物。在下文中,作用机理上与ppo抑制性除草剂不同的除草剂被称为“第二除草剂”。
一种实施方式提供了用于赋予或增强植物或藻类的除草剂耐受性的组合物,其包含上述除草剂耐受性ppo蛋白、其变体或其编码基因;和第二除草剂耐受性多肽或其编码基因。
另一种实施方式提供了植物或藻类的具有除草剂耐受性的转化体、其克隆或后代,所述转化体、其克隆或后代包含上述的除草剂耐受性ppo蛋白、其变体或其编码基因;和第二除草剂耐受性多肽或其编码基因。
其他实施方式提供了制备具有除草剂耐受性的植物或藻类的方法,所述方法包括用以下转化藻类,或植物的细胞、原生质体、愈伤组织、下胚轴、种子、子叶、枝条或整株植物的步骤:上述除草剂耐受性ppo蛋白、其变体或其编码基因;和第二除草剂耐受性多肽或其编码基因。
其它实施方式提供了一种控制农田中杂草的方法,包括:向农田提供植物的步骤,所述植物包含上述除草剂耐受性ppo蛋白、其变体或其编码基因;第二除草剂耐受性多肽或其编码基因;以及将有效剂量的原卟啉原氧化酶抑制性除草剂施用于农田的步骤。
其他实施方式提供了从培养基中除去不希望的水生生物的方法,包括:向培养基提供藻类的步骤,所述藻类包含除草剂耐受性ppo蛋白、其变体或其编码基因;第二除草剂耐受性多肽或其编码基因;以及将有效剂量的原卟啉原氧化酶抑制性除草剂施用于培养基的步骤。
例如,植物或藻类还包括第二除草剂耐受性多肽或其编码基因,从而对第二除草剂具有新的和/或增强的耐受性。
例如,第二除草剂可包括细胞分裂抑制性除草剂、光合作用抑制性除草剂、氨基酸合成抑制性除草剂、质体抑制性除草剂、细胞膜抑制性除草剂和/或其任何组合,但不限于此。第二除草剂可以例示为草甘膦、草铵膦、麦草畏、2,4-d(2,4-二氯苯氧基乙酸)、als(乙酰乳酸合酶)抑制性除草剂(例如,咪唑啉酮、磺酰脲、三唑嘧啶、磺苯胺、嘧啶硫代苯甲酸等),光系统ii抑制性除草剂、苯脲基除草剂、质体抑制性除草剂,溴苯腈基除草剂,和/或其任意组合,但不限于此。
例如,第二除草剂耐受性多肽可以例示为选自由以下组成的组中的一种或多种:草甘膦除草剂耐受性epsps(草甘膦耐受性5-烯醇丙酮莽草酸-3-磷酸合酶)、gox(草甘膦氧化酶)、gat(草甘膦-n-乙酰转移酶)或草甘膦脱羧酶;草铵膦除草剂耐受性pat(草丁膦-n-乙酰转移酶);麦草畏除草剂耐受性dmo(麦草畏单加氧酶);2,4-d除草剂耐受性2,4-d单加氧酶或aad(芳氧基链烷酸酯双加氧酶);als抑制性磺酰脲基除草剂耐受性als(乙酰乳酸合酶)、ahas(乙酰羟酸合酶)或atahasl(乙酰羟酸合酶大亚基);光系统ii抑制性除草剂耐受性光系统ii蛋白d1;苯脲基除草剂耐受性细胞色素p450;质体抑制性除草剂耐受性hppd(羟基苯丙酮酸双加氧酶);溴苯腈除草剂耐受性腈水解酶;及其组合,但不限于此。
进一步地,第二除草剂耐受性多肽的编码基因可以例示为选自由以下组成的组中的一种或多种:草甘膦除草剂耐受性cp4epsps、epsps(ag)、mepsps、2mepsps、goxv247、gat4601或gat4621基因;草铵膦除草剂耐受性bar、pat或pat(syn)基因;麦草畏除草剂耐受性dmo基因;2,4-d除草剂耐受性aad-1或aad-12基因;als抑制性磺酰脲基除草剂耐受性als、gm-hra、s4-hra、zm-hra、csr1、csr1-1、csr1-2、sura或surb;光系统ii抑制性除草剂耐受性psba基因;苯脲除草剂耐受性cyp76b1基因;异
有益效果
将本文提供的除草剂耐受性ppo蛋白的变体或其编码基因施用于植物或藻类,从而赋予和/或增强更优异的除草剂耐受性性状,并且使用除草剂进行选择性控制,从而经济地控制杂草或去除水生生物。
附图说明
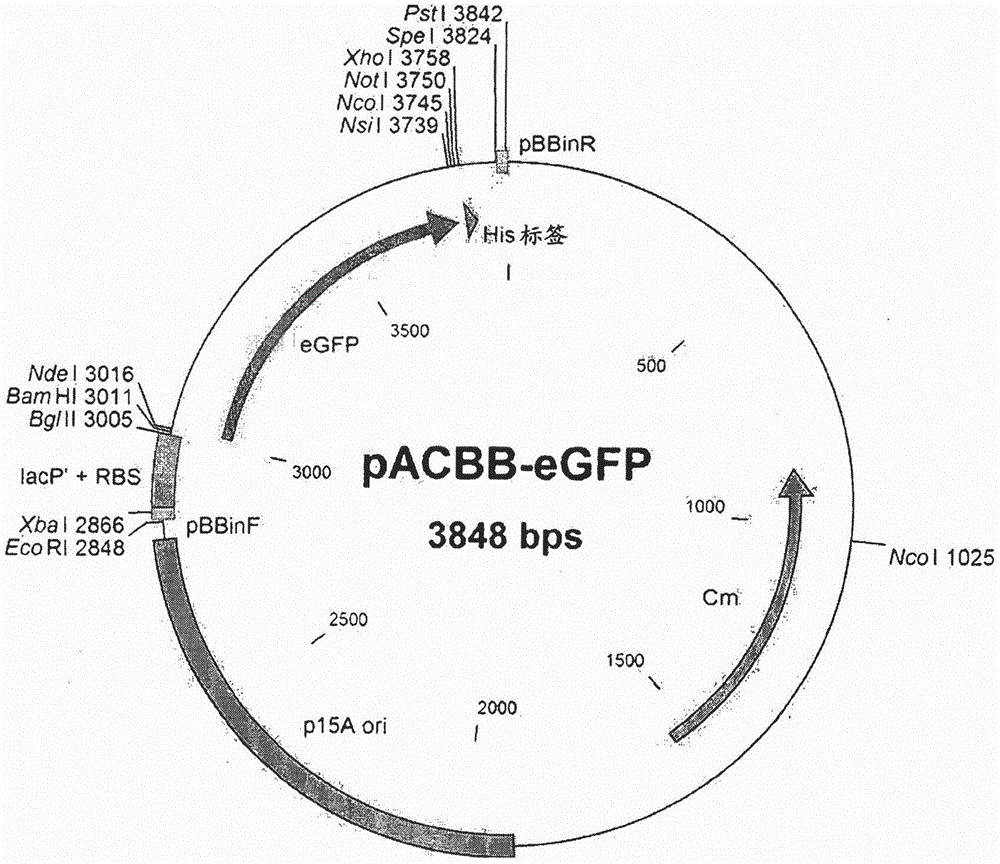
图1是pacbb载体的图谱。
图2示出了用pacbb-egfp载体对照(v)、ppo易感性拟南芥、ppo1基因(atppo1wt)、ppo耐受性拟南芥ppo1突变基因(atppo1slym)、cyppo10基因(cy10wt)和cyppo13基因(cy13wt)分别转化的ppo缺陷型bt3大肠杆菌分别在用浓度为0μm(微摩尔)、100μm或400μm的汰芬那处理后的细胞生长水平。
图3是pet303-ct-his载体的图谱。
图4示出了融合蛋白的重组载体的示意图,其中融合了mbp(麦芽糖结合蛋白)和ppo蛋白。
图5是pmal-c2x载体的图谱。
图6是示例性地示出了用于cyppo基因的植物转化的二元载体的结构示意图。
图7是蛋白质印迹的结果,示出了用cyppo10变体(f360i变体或f360m变体)或cyppo13变体(f373m变体)基因转化的t2拟南芥中cyppo变体蛋白的表达水平。
图8示出了当用1μm的汰芬那处理时,用cyppo10或cyppo13野生型基因转化的拟南芥转化体(t3)的损伤水平。col-o表示非转基因拟南芥。
图9示出了当用浓度为1μm、5μm或25μm的汰芬那处理时,用编码cyppo10变体(f360c、f360i、f360l、f360m、f360v、f360t、a167c、a167l、a167l+f360m或a167c+f360i)的基因转化的拟南芥转化体(t2)的损伤水平。
图10示出了当用浓度为1μm或10μm的汰芬那处理时,用编码cyppo13变体(a177c、f373c、f373i、f373m、a177l+f373l或a177l+f373i)的基因转化的拟南芥转化体(t2)的损伤水平。
图11示出了当用浓度分别为0μm、5μm、25μm、50μm、100μm和200μm的汰芬那处理时,用cyppo10野生型基因(表示为cy10wt)或各种cyppo10突变基因转化的ppo缺陷型bt3大肠杆菌(δppo)转化体的细胞生长水平。
图12示出了当用浓度分别为0μm、5μm、25μm、50μm、100μm和200μm的苯嘧磺草胺处理时,用cy10wt或各种cyppo10突变基因转化的ppo缺陷型bt3(δppo)转化体的细胞生长水平。
图13示出了当用浓度分别为0μm、5μm、25μm、50μm、100μm和200μm的氟磺胺草醚处理时,用cy10wt或各种cyppo10突变基因转化的ppo缺陷型bt3(δppo)转化体的细胞生长水平。
图14示出了当用浓度分别为0μm、5μm、25μm、50μm、100μm和200μm的三氟羧草醚处理时,用cy10wt或各种cyppo10突变基因转化的ppo缺陷型bt3(δppo)转化体的细胞生长水平。
图15示出了当用浓度分别为0μm、5μm、25μm、50μm、100μm和200μm的丙炔氟草胺处理时,用cy10wt或各种cyppo10突变基因转化的ppo缺陷型bt3(δppo)转化体的细胞生长水平。
图16示出了当用浓度分别为0μm、5μm、25μm、50μm、100μm和200μm的甲磺草胺处理时,用cy10wt或各种cyppo10突变基因转化的ppo缺陷型bt3(δppo)转化体的细胞生长水平。
图17示出了当用浓度分别为0μm、5μm、25μm、50μm、100μm和200μm的环戊
图18示出当用浓度分别为0μm、5μm、25μm、50μm、100μm和200μm的氟唑草酯处理时,用cy10wt或各种cyppo10突变基因转化的ppo缺陷型bt3(δppo)转化体的细胞生长水平。
图19示出了当用浓度分别为0μm、5μm、25μm、50μm、100μm和200μm的双唑草腈处理时,用cy10wt或各种cyppo10突变基因转化的ppo缺陷型bt3(δppo)转化体的细胞生长水平。
图20示出了当用浓度分别为0μm、5μm、25μm和50μm的汰芬那处理时,用cyppo13野生型基因(表示为cy13wt)或各种cyppo13突变基因转化的ppo缺陷型bt3(δppo)转化体的细胞生长水平。
图21示出了当用浓度分别为0μm、5μm、25μm和50μm的苯嘧磺草胺处理时,用cy13wt或各种cyppo13突变基因转化的ppo缺陷型bt3(δppo)转化体的细胞生长水平。
图22示出了当用浓度分别为0μm、5μm、25μm、50μm、100μm和200μm的氟磺胺草醚处理时,用cy13wt或各种cyppo13突变基因转化的ppo缺陷型bt3(δppo)转化体的细胞生长水平。
图23示出了当用浓度分别为0μm、5μm、25μm、50μm、100μm和200μm的三氟羧草醚处理时,用cy13wt或各种cyppo13突变基因转化的ppo缺陷型bt3(δppo)转化体的细胞生长水平。
图24示出了当用浓度分别为0μm、5μm、25μm和50μm的丙炔氟草胺处理时,用cy13wt或各种cyppo13突变基因转化的ppo缺陷型bt3(δppo)转化体的细胞生长水平。
图25示出了当用浓度分别为0μm、5μm、25μm、50μm、100μm和200μm的甲磺草胺处理时,用cy13wt或各种cyppo13突变基因转化的ppo缺陷型bt3(δppo)转化体的细胞生长水平。
图26示出了当用浓度分别为0μm、5μm、25μm、50μm、100μm和200μm的环戊
图27示出了当用浓度分别为0μm、5μm、25μm、50μm、100μm和200μm的氟唑草酯处理时,用cy13wt或各种cyppo13突变基因转化的ppo缺陷型bt3(δppo)转化体的细胞生长水平。
图28示出了当用浓度分别为0μm、5μm、25μm、50μm、100μm和200μm的双唑草腈处理时,用cy13wt或各种cyppo13突变基因转化的ppo缺陷型bt3(δppo)转化体的细胞生长水平。
图29示出了当用浓度分别为0μm、5μm、25μm、50μm、100μm和200μm的
图30是pet29b载体的图谱。
图31a至31c示出了在含有各种除草剂的1/2ms培养基上播种后的第7天,用cyppo10或cyppo13野生型基因或其突变基因转化的拟南芥转化体的种子萌发结果。col-0表示非转基因拟南芥。
图32示出了当用浓度为25μm汰芬那或100μm苯嘧磺草胺处理时,用cyppo10变体(f360i、f360l、f360m、a167c+f360i、a167c+f360m、或v305m+f360m)的编码基因转化的拟南芥转化体(t3)的损伤水平。
图33a示出了当用浓度为50μm的汰芬那、苯嘧磺草胺、丙炔氟草胺或甲磺草胺分别处理时,用cyppo10变体(f360i或a167l+f360m)的编码基因转化的拟南芥转化体(t3)的损伤水平。
图33b示出了当用浓度为50μm的苯嘧磺草胺、汰芬那、丙炔氟草胺、甲磺草胺、乙氧氟草醚或双唑草腈分别处理时,用cyppo13变体(a177l+f373l或a177l+f373i)的编码基因转化的拟南芥转化体(t3)的损伤水平。
图34示出了当用15μm的汰芬那和150μm的苯嘧磺草胺处理时,用cyppo10f360i转化的拟南芥转化体(t4)的损伤水平。
图35示出了当用15μm的汰芬那或150μm的苯嘧磺草胺处理时,用cyppo10f360i转化的拟南芥转化体(t5)的损伤水平。col-0表示非转基因拟南芥。
图36是蛋白质印迹的结果,示出了cyppo10f360i蛋白在用cyppo10f360i转化的拟南芥转化体(t4或t5)中的表达。
图37是pb2gw7.0二元载体的图谱。
图38示出了当用5μm或15μm的汰芬那处理时,用cyppo10a167l+f360m突变基因转化的t0大豆的叶中的损伤水平。广安大豆(kwangansoybean)是指非转基因大豆(栽培品种)。
图39提供了dna(southern)印迹结果,示出了在cyppo10a167l+f360m转化的大豆中存在转基因。
图40示出了在用25μm的汰芬那或150μm的苯嘧磺草胺喷雾处理后5天,t1转基因大豆(cyppo10a167l+f360m)的除草剂耐受性。广安大豆大豆是指非转基因大豆(栽培品种)。
图41示出了在含有除草剂的培养基中培养时用cyppo10的突变基因转化的bt3(δppo)大肠杆菌的细胞生长水平。
具体实施方式
在下文中,将通过实施例详细描述本发明。然而,以下实施例仅用于说明目的,并且本发明不受以下实施例的限制。
实施例1.从原核生物中分离ppo基因
使用细长噬热聚球藻bp-1和聚球藻属ja-3-3ab的genbank数据库收集ppo基因,针对在bt3大肠杆菌中进行有效的除草剂抗性筛选用密码子优化的信息合成ppo基因。使用表1的引物在以下条件下扩增合成的ppo基因以克隆在pacbb载体上。
通过混合1μl模板(每种基因的合成dna)、5μl10x缓冲液、1μldntp混合物(各10mm)、1μl正向引物(参见表1;10μm)、1μl反向引物(参见表1;10μm)、40μlddw和1μlpfu-x(solgent,2.5单位/μl)来制备50微升(50μl)pcr反应混合物,并在以下条件下进行扩增:94℃下4分钟,1个循环;94℃下30秒、56℃下30秒和72℃下1.5分钟,25个循环;72℃下5分钟,1个循环。
分别地,从细长噬热聚球藻bp-1分离的ppo被命名为cyppo10,从聚球藻属ja-3-3ab株分离的ppo被命名为cyppo13。
表1
实施例2.cyppo10和cyppo13的除草剂耐受性
使用ppo缺陷型大肠杆菌测试cyppo10和cyppo13对除草剂的耐受性。
在用cyppo10或cyppo13转化ppo缺陷型bt3大肠杆菌(δppo)后,将转化的bt3(δppo)在含有ppo抑制性除草剂的lb琼脂平板上培养,以检测转化的bt3(δppo)的生长水平。bt3(δppo)菌株获自北海道大学(日本)。bt3(δppo)菌株缺乏hemg型ppo并具有卡那霉素耐受性(参见watanabe等人,通过替代使用两种框内抑制密码子菠菜原卟啉原氧化酶ii对线粒体和叶绿体双重靶向(dualtargetingofspinachprotoporphyrinogenoxidaseiitomitochondriaandchloroplastsbyalternativeuseoftwoin-frameinhibitioncodons),jbc2001276(23):20474-20481;che等人,在菠菜叶绿体中原生卟啉原氧化酶的分子特征和亚细胞定位(molecularcharacterizationandsubcellularlocalizationofprotoporphyrinogenoxidaseinspinachchloroplasts),plantphysiol.2000sep;124(1):59-70″)
具体测试过程如下:
将cyppo10和cyppo13基因克隆到pacbb载体(质粒#32551;addgene;参见图1)中。
具体地,用bamhi和xhoi限制酶(newenglandbiolabs)处理实施例1中扩增的pcr产物,并与用相同限制酶处理的pacbb-egfp载体连接。
限制酶的处理在以下条件下进行:
30μl(微升)pcr产物、bamhi和xhoi(newenglandbiolabs)各0.5μl、4μl10x缓冲液和5.5μl水;限制酶反应在37℃下进行1小时
在以下条件下进行连接反应:
0.5μlt4dna连接酶(rbc)、1μla缓冲液、1μlb缓冲液、用限制酶处理的pcr产物和载体,总共10μl;22℃下进行30分钟。
将克隆的质粒分别添加100μlbt3感受态细胞(北海道大学;日本)中,从而通过热激法转化。将用每种ppo基因转化的大肠杆菌在含有氯霉素(duchefa)的lb(luria-bertani)琼脂培养基中培养。
对于用每种基因转化的大肠杆菌的种子培养,将如上提供的每个单个大肠杆菌转化体菌落在含有氯霉素的3mllb肉汤中培养过夜(220rpm,37℃),并且50至100μl在新的3mllb肉汤中传代培养,直到吸光度(od600)为0.5至1,用lb肉汤稀释到吸光度(od600)为0.5。用lb肉汤将稀释的溶液再次以十分之一的系数连续稀释5次。此后,在含有浓度为0μm、100μm和400μm的汰芬那的lb琼脂培养基(培养皿)上,滴加10μl各稀释溶液。将lb琼脂培养基在37℃下在光照条件下温育,在温育16至20小时后观察到抑制生长的水平。
为了比较,使用用pacbb-egfp载体(质粒#32551;addgene;参见图1)转化的bt3大肠杆菌转化体(v;pacbb-egfp载体);用野生型拟南芥ppo1基因(atppo1wt,野生型atppo1;ppo易感性)(seqidno:6)转化的bt3大肠杆菌转化体;以及用编码突变atppo1(atppo1slym,seqidno:7)的拟南芥突变体ppo1基因转化的bt3大肠杆菌转化体进行相同的测试,所述突变atppo1具有基于野生型atppo1的氨基酸序列(seqidno:5)的y426m(第426个氨基酸残基酪氨酸被甲硫氨酸取代)和s305l(第305个氨基酸残基丝氨酸被亮氨酸取代)的氨基酸取代(li等人.原卟啉原氧化酶作为根癌农杆菌介导的玉米转化的有效选择标记的开发(developmentofprotoporphyrinogenoxidaseasanefficientselectionmarkerforagrobacteriumtumefaciens-mediatedtransformationofmaize).plantphysiol.2003133:736-747)。
图2中示出了获得的结果。如图2所示,在不含除草剂(汰芬那0μm)的培养基上,用未导入ppo基因的pacbb-egfp转化的bt3转化体(v)的生长未恢复,而用ppo易感性拟南芥ppo1野生型基因转化的bt3转化体(atppo1wt)、ppo耐受性拟南芥ppo1突变基因转化的bt3转化体(atppo1slym)、cyppo10基因转化的bt3转化体(cy10wt)、或cyppo13基因转化的bt3转化体(cy13wt)的生长恢复,因为每个导入的基因都在bt3中起着ppo酶的作用。这些结果表明cyppo10和cyppo13都发挥正常的ppo功能。
用对汰芬那易感的拟南芥ppo1野生型基因转化的bt3转化体(atppo1wt)正常地在不含除草剂的培养基中生长,但在含有100μm的汰芬那的培养基中不生长。用对汰芬那耐受的拟南芥ppo1突变基因转化的bt3转化体(atppo1slym)从100μm的汰芬那开始逐渐开始表现出生长抑制,并且在400μm时几乎不生长。用cyppo10或cyppo13基因转化的bt3转化体在含有100μm的汰芬那的培养基中生长,其生长水平与不含汰芬那的培养基相似,并且即使在含有400μm的汰芬那的培养基中也生长良好。根据这些结果,证明与对汰芬那易感的拟南芥ppo1野生型相比,cyppo10和cyppo13基因可以表现出显著更高的对汰芬那耐受性,与具有汰芬那耐受性的拟南芥ppo1突变型相比,表现出相似或更高的汰芬那耐受性。
实施例3.从ppo和ppo抑制性除草剂复合物中确定与ppo抑制性除草剂相互作用的ppo氨基酸残基
为了研究ppo蛋白与除草剂的结合结构信息,使用了汰芬那、苯嘧磺草胺、丙炔氟草胺或甲磺草胺作为ppo抑制性除草剂的代表性实例。将编码cyppo10蛋白的基因克隆到pet29b载体(目录号:69872-3;emdbiosciences;参见图30)中,并使用大肠杆菌系统表达为cyppo10蛋白。通过镍亲和层析纯化表达的cyppo10蛋白,并与ppo抑制性除草剂结晶。然后,使用同步辐射加速器,获得cyppo10与汰芬那、苯嘧磺草胺、丙炔氟草胺或甲磺草胺的复合物的
通过分析cyppo10与汰芬那复合物的结构,得出以下结论:cyppo10蛋白(seqidno:2)的n59、s60、r89、f161、v165、a167、q184、p303、v305、f324、l327、i340、f360和i408氨基酸与汰芬那相互作用。
使用来源于cyppo10-汰芬那复合物结构的结合信息,通过cyppo10(seqidno:2)与cyppo13的氨基酸之间的序列同源性分析鉴定cyppo13(seqidno:4)蛋白中与汰芬那相互作用的氨基酸残基(ncbiblast,http://blast.ncbi.nlm.nih.gov/blast.cgi?program=blastp&page_type=blastsearch&link_loc=blasthome)。
结果,可以理解,cyppo13蛋白(seqidno:4)的r101、f171、v175、a177、g194、p316、v318、f337、l340、i353和f373位置的氨基酸与汰芬那相互作用。
实施例4.ppo变体的制备
为了增强对cyppo10和cyppo13的ppo抑制性除草剂耐受性,使两种基因均在如实施例3中所鉴定的与除草剂相互作用的氨基酸位置发生突变,从而制备增加抑制ppo的除草剂耐受性的突变基因。
使用表3的引物,分离突变的ppo基因并在以下条件下通过pcr扩增该突变的ppo基因:
材料
模板(cyppo10或cyppo13的合成dna)1μl
10x缓冲液5μl
dntp混合物(各10mm)1μl
正向引物(10μm)1μl
反向引物(10μm)1μl
ddw40μl
pfu-x(solgent,2.5单位/μl)1μl
总计50μl
表2
pcr条件
表3
用xbai和xhoi切割扩增的基因产物和pet303-cthis载体(vt0163;novagen;参见图3),然后用t4dna连接酶(rbc,3单位/μl)分别制备pet303-cyppo10和pet303-cyppo13质粒。
通过在下列条件下使用下表5和6的引物进行pcr,并使用克隆到pet303-cthis载体的cyppo10和cyppo13作为模板,制备cyppo10和cyppo13的突变基因。
材料
模板1μl
10x缓冲液5μl
dntp混合物(各10mm)1μl
正向引物(10μm)1μl
反向引物(10μm)1μl
ddw40μl
pfu-x(solgent,2.5单位/μl)1μl
总计50μl
表4
pcr条件
表5
用于构建cyppo13突变基因的引物列表
表6
用于构建cyppo13突变基因的引物列表
实施例5.ppo及其变体的ppo抑制性除草剂耐受性
为了增强对cyppo10和cyppo13的ppo抑制性除草剂耐受性,对如实施例3中所鉴定的与除草剂相互作用的氨基酸进行突变。用具有这种突变的ppo基因转化ppo缺陷型bt3大肠杆菌(δppo)后,与ppo抑制性除草剂培养,以观察转化的大肠杆菌的生长情况,如下:
将实施例4中制备的pet303-cyppo10或pet303-cyppo13质粒和含有各突变基因的质粒通过热休克法转化到bt3感受态细胞中,并在含有氨苄青霉素(100μg/ml)的lb琼脂培养基中培养。
对于bt3转化体的种子培养,将其单个菌落在3ml含有氨苄青霉素的lb肉汤(lpss)中培养12小时或更长时间,并进一步取50-100μl培养液培养直至吸光度(od600)达到0.5至1。然后,用lb肉汤稀释所得培养液,以将吸光度(od600)调节至0.5,用lb肉汤以十分之一的系数再稀释5次。
将lb(25g/l)、bacto琼脂(12g/l)、氨苄青霉素(100μg/ml)和各种除草剂(0至200μm)混合,制备含除草剂的培养基。
将10微升稀释的溶液滴在含有除草剂的培养基上,并将培养基在37℃下在光照下温育16至20小时。评估了用每种基因转化的bt3的生长水平和ppo抑制性除草剂耐受性。
试验中使用的除草剂列于下表7中:
表7
与cyppo野生型相比,相对地评价除草剂耐受性,并示于下表8至11和图11到29中。
表8
nt(未测试)
表9
nt(未测试)
表10
nt(未测试)
表11
nt(未测试)
在表8至表11中,野生型的除草剂耐受性水平用“-”表示,除草剂耐受性水平通过用“-”表示相同的耐受水平,若更高则添加“+”直到最大大“+++++”来渐变表示。
图11至19(cyppo10的野生型和变体)和图20至29(cyppo13的野生型和变体)示出了用cyppo基因(野生型和变体型)转化的大肠杆菌的培养结果,并且图上面描述的浓度是处理的除草剂的浓度。将各浓度的6个柱,使用大肠杆菌培养液向右以十分之一的系数依次稀释5倍,最左侧柱是大肠杆菌培养液的结果od600=0.5。
如表8至11和图11至29所示,与转化野生型基因的转化体相比,证明了用cyppo10和cyppo13的突变基因转化的所有转化体对各种除草剂表现出相同水平或增加水平的除草剂耐受性。
实施例6:通过ppo的除草剂测量酶活性和ic50值
检测ppo蛋白和ppo蛋白变体的酶活性,并进行ppo抑制性除草剂的抑制试验。已证实ppo蛋白具有低水溶性,但在表达为与mbp(麦芽糖结合蛋白)的融合蛋白(mbp-ppo)的情况下,ppo蛋白能够稳定表达为水溶性形式。因此,在本试验中使用以与mbp的融合蛋白形式表达的野生型和变体蛋白(参见图4)。
为了表达cyppo10和cyppo13的野生型基因和突变基因(参见实施例1和实施例4),将这些基因分别导入pmal-c2x载体(参见图5),然后克隆至bl21(de3)大肠杆菌(codonplus)。
在以下条件下培养转化的大肠杆菌以表达导入的ppo基因:
诱导:od600=0.2,添加iptg至0.3mm终浓度;
表达温度:23℃,200rpm振荡培养;
表达时间:16小时;
培养规模:200ml/1000ml烧瓶。
通过以下方法对培养的大肠杆菌细胞进行细胞裂解和蛋白提取:
提取缓冲液:柱缓冲液(50mmtris-cl,ph8.0,200mmnacl)5ml缓冲液/g细胞;
超声处理:sonics&materialsvcx130(130瓦);
15秒开(on),10秒关闭(off),冰上进行5分钟;
在4℃的条件下离心20分钟(20,000×g);用柱缓冲液以1∶6的比例稀释离心得到的上清。
以下纯化ppo蛋白的方法在4℃冷室中进行。将直链淀粉树脂(newenglandbiolabs)填充到1.5×15cm柱(bio-radecono柱1.5×10cm,玻璃色谱柱,最大体积)中,并将获得的蛋白提取物以0.2ml/分钟的流速加载到柱中。用3倍柱体积的缓冲液洗涤柱,检测洗涤溶液中蛋白的量。当不再检测到蛋白时,终止洗涤。然后,用约2倍柱体积的含有20mm麦芽糖的缓冲液洗脱mbp-ppo蛋白。测定每个洗脱液的蛋白浓度,并在不再检测到蛋白时停止洗脱。研究10微升每种级分进行蛋白定量和sds-page分析。将具有ppo蛋白的高纯度级分用于酶活性测定。
通过以下方法测量纯化的cyppo10和cyppo13的野生型蛋白和变体蛋白的酶活性。
首先,合成了ppo蛋白原卟啉原ix的底物。该过程在氮气流动的空间中进行。将6mg原卟啉ix溶解于20%(v/v)20mletoh中,并在黑暗条件下搅拌30分钟。将得到的原卟啉原ix溶液以800μl的量放入15ml螺旋管中,用氮气冲洗5分钟。向其中添加1g钠汞齐,并剧烈振荡2分钟。打开盖子以排出管中的氢气。此后,关闭盖子并温育3分钟。使用注射器和纤维素膜过滤器过滤原卟啉ix溶液。向600μl所获得的原卟啉ix溶液中添加量为约300μl的2mmops[3-(n-吗啉代)丙磺酸],从而将ph调节至8.0。为了确定ppo蛋白的酶活性,用以下组成(基于10ml)制备反应混合物:50mmtris-cl(ph8.0);50mmnacl;0.04%(v/v)吐温20;40mm葡萄糖(0.072g);5单位葡萄糖氧化酶(16.6毫克);和10单位过氧化氢酶(1μl)。
将含有纯化的ppo蛋白的200微升(200μl)反应混合物置于96孔板中,并在室温下预温育30分钟以通过葡萄糖氧化酶-过氧化氢酶的反应降低氧浓度。将矿物油分层,然后通过添加底物原卟啉ix溶液至终浓度为50μm使反应开始。反应在室温下进行30分钟,并使用酶标仪(sense,hidex)测量原卟啉ix的荧光(激发:405nm;发射:633nm)。为了计算ppo酶活性,将原卟啉原ix溶液在空气中保持开放以氧化溶液(过夜)。向其中添加2.7nhcl,测量408nm处的吸光度。使用标准原卟啉ix产生标准曲线,通过使用原卟啉ix的标准曲线校准原卟啉ix来测量ppo活性。
获得的ppo野生型和变体的酶活性显示在表12中。
同时,计算每种酶的米氏常数(km)和最大速度(vmax)值,以评估ppo蛋白(cyppo10和cyppo13)的动力学参数。测量初始反应速度,其中反应速度与底物浓度成比例,并且作为酶促反应产物的产生的原卟啉ix的量在室温下根据时程测量20分钟。用酶动力学分析程序通过米氏方程计算km和vmax值,并用植物ppo作为对照组。获得的结果如表12所示:
表12
如表12所示,cyppo10和cyppo13作为ppo酶具有优于拟南芥ppo1(atppo1)和苋属ppo1的能力。
测量每种除草剂抑制ppo酶活性到50%时的ppo抑制性除草剂的浓度(ic50)。每种除草剂的最终浓度如下:
0、10、50、100、250、500、1,000、2,500、5,000nm
将ic50值计算为抑制ppo酶活性到50%的除草剂浓度,然后添加上述浓度的除草剂以进行上述酶活性测量过程。
不同除草剂的ic50值示于下表13中。
表13
nt(未测试)
如表13所示,与野生型cyppo蛋白相比,cyppo蛋白变体表现出增加跟多的ic50值。这些结果表明,ppo蛋白某些位置的氨基酸突变可导致除草剂耐受性增加。尽管本数据显示cyppo蛋白变体与野生型相比具有降低的酶活性,但这可能由蛋白折叠的不同条件和/或重组体ppo与天然ppo相比的疏水性引起。虽然天然ppo是疏水性的并且定位于植物中叶绿体的膜,但是在大肠杆菌中产生的含有mbp作为融合配偶体的重组ppo是亲水性的。因此,当ppo变体适当组装并定位于植物的叶绿体膜中时,酶活性不会受到显著影响。
实施例7.使用cyppo及其变体产生拟南芥转化体和ppo抑制性除草剂耐受性试验
7-1.构建拟南芥转化载体和转化拟南芥
用二元载体转化拟南芥,该二元载体具有选择性标记的orf、bar基因(草铵膦耐受)和cyppo10或cyppo13变体的每种编码基因的orf。检查转基因植物对草铵膦和ppo抑制性除草剂的交叉耐受性。bar基因也用于检查转基因是否在世代中稳定遗传。nos启动子和e9终止子用于bar基因表达。
为了分别在植物中表达cyppo10、cyppo10变体、cyppo13和cyppo13变体,使用camv35s启动子和nos终止子。使用xhoi和bamhi限制酶克隆cyppo10、cyppo10变体、cyppo13和cyppo13变体的编码基因。为了鉴定表达的蛋白,使用bamhi和saci限制酶将血凝素(ha)标签与3′末端区融合。在ha标签后插入nos终止子,从而终止ppo基因的转录。另外,为了将蛋白转运至叶绿体,使用xbai和xhoi限制酶将atppo1基因的转运肽(tp)(seqidno:10)插入所插入基因的5′前方。插入载体中的转运肽区由seqidno:27表示,插入的ha标签序列由seqidno:28表示。植物转化二元载体的示意图在图6中示出。
通过冻融法将上述每种构建的载体导入根癌农杆菌gv3101感受态细胞中。为了制备农杆菌gv3101感受态细胞,在30℃,200rpm的条件下在5mllb培养基中对农杆菌gv3101株种子培养12小时。将培养基接种到200mllb培养基中,然后在30℃下以200rpm培养3至4小时,并在4℃下以3000×g离心20分钟。用无菌蒸馏水洗涤沉淀,并重悬于20mllb培养基中。将用液氮速冻的200μl等分试样储存在深冻冰箱中。
将每种转化的农杆菌在抗生素培养基(含有壮观霉素的lb琼脂)中培养并筛选。筛选的菌落在lb肉汤中液体培养。从培养基中收获农杆菌后,将其以0.8的吸光度(od600)重悬于5%(w/v)蔗糖、0.05%(v/v)silwetl-77溶液(迈图性能材料公司)中。通过花序转染(floraldipping)法,转化col-0生态型拟南芥野生型,然后在1至2个月后收获种子(t1)。
二元载体中的bar基因用于筛选单个转化体。将获得的t1种子播种在补充有25μm草铵膦的1/2ms培养基(2.25g/lms盐,10g/l蔗糖,7g/l琼脂)中,并在播种7天后选择存活的植物,并移植到土壤中。
为了检测转基因植物对ppo抑制性除草剂的耐受性,对每个40×60cm的区域(0.24m2)的4周龄植物均匀喷洒100ml1μm的汰芬那溶液(0.05%silwetl-77)。虽然野生型拟南芥(col-0生态型;哥伦比亚-0生态型)在处理后7天内完全死亡,但每个转化体均未显示对ppo抑制性除草剂处理的损害。
将从存活植物收获的t2种子播种到补充有25μm草铵膦的1/2ms培养基(2.25g/lms盐,10g/l蔗糖,7g/l琼脂)中,并且在1周后,将存活的植物移植到土壤中。
为了确认每个品系的拷贝数,用t2种子研究分离比率。
通过对每个40×60cm的区域(0.24m2)喷洒100ml汰芬那溶液(1μm、5μm、10μm或25μm汰芬那+0.05%silwetl-77),确认4周龄转化体的汰芬那耐受性。从汰芬那耐受性t2植物收获t3种子。
在含有25μm草铵膦的1/2ms培养基中选择种子,并且其中所有个体都耐受草铵膦的品系被判定为同品系(homoline)。
7-2.种子萌发
确认了导入cyppo10和cyppo13的野生型或变体基因的拟南芥转化体的除草剂耐受性。
将每个转化体的t3代种子播种在含有除草剂的1/2ms培养基中。用col-0生态型(野生型拟南芥)种子作为对照。除草剂的种类和浓度如下:
图31a:25μm草铵膦(ppt)、70nm汰芬那、100nm苯嘧磺草胺、25μm草铵膦+70nm汰芬那、或25μm草铵膦+30nm汰芬那+40nm苯嘧磺草胺;
图31b和31c:25μm草铵膦(ppt)、0.1μm或1μm的汰芬那、0.3μm或3μm的苯嘧磺草胺、0.1μm或1μm的丙炔氟草胺、0.5μm或5μm的双唑草腈、或1μm或10μm的甲磺草胺。
播种后7天种子萌发的结果在图31a、31b和31c中示出。在图31a至31c中,10-3指cyppo10野生型,10fm-4-7指cyppo10f360m转基因品系,10fl-1-9指cyppo10f360l转基因品系,10fc-3-5指cyppo10f360c转基因品系、10ac-5-4指cyppo10a167c转基因品系、13-1指cyppo13野生型、13fm-3-1指cyppo13f373m转基因品系、13fc-1-1指cyppo13f373c转基因品系、13fi-2-1指cyppo13f373i转基因品系、13ac-1-3指cyppo13a177c转基因品系、cyppo13_alfl指cyppo13a177l+f373l转基因品系、cyppo13_alfi指cyppo13a177l+f373i转基因品系。
如图31a至31c所示,虽然野生型拟南芥(col-0生态型)在不含除草剂的1/2ms培养基中萌发,但在含有除草剂的1/2ms培养基中不萌发。因此,含有除草剂的培养基上的萌发试验可用于评估除草剂耐受性。
同时,转化拟南芥t3品系,其中cyppo10野生型、cyppo10突变基因(f360m、f360i、f360l、f360c、a167c)、cyppo13野生型或cyppo13突变基因(f373m、f373c、f373i、a177c、a177l+f373l、a177l+f373i)在含有除草剂(含有25μm草铵膦、25μm草铵膦+70nm汰芬那、或25μm草铵膦+30nm汰芬那+40nm苯嘧磺草胺)的培养基中萌发。这些结果表明bar基因(草铵膦耐受基因)和cyppo基因(ppo抑制性除草剂耐受基因)在转基因植物中同时且独立地起到除草剂耐受性状的作用。
如图31a至31c所示,在含有各种种类和各种浓度的ppo抑制性除草剂的培养基中,转化的拟南芥通常萌发并存活,而col-0通常不萌发。这样的结果表明转化的拟南芥通过转化体的插入基因而被赋予对各种ppo抑制性除草剂的耐受性或保持对各种ppo抑制性除草剂的增强的耐受性。
7-3.导入cyppo基因的拟南芥(t2)中cyppo蛋白表达的研究
在分别插入编码cyppo10、cyppo10变体(f360i或f360m)、cyppo13或cyppo13变体(f373m)的基因的拟南芥转化体(t2)中,研究每种蛋白的表达。
用液氮研磨4周龄的拟南芥转化体叶,添加蛋白提取缓冲液(0.05mtris-clph7.5,0.1mnacl,0.01medta,1%tritonx-100,1mmdtt)提取蛋白。然后,使用抗ha抗体(santacruz)进行蛋白质印迹。使用ha标签检测转化体中表达的蛋白。为了比较加载的蛋白的量,通过考马斯蓝染色证实rubisco大亚基的量。测试每种变体的两个独立品系,并使用col-0作为对照。
结果在图7中示出。导入cyppo10变体(f360i变体或f360m变体)或cyppo13变体(f373m变体)基因的所有拟南芥转化体均表现出ppo蛋白的成功表达。
7-4.转化拟南芥(t2或t3)的除草剂耐受性的验证
用分别导入编码cyppo10、cyppo10变体(f360c、f360i、f360l、f360m、f360v、f360t、a167c、a167l、a167l+f360m、a167c+f360m、a167c+f360i或v305m+f360m)、cyppo13或cyppo13变体(a177c、f373c、f373i、f373m、a177l+f373i或a177l+f373l)的基因的拟南芥转化体(t2或t3)测试除草剂耐受性。
用汰芬那溶液(1μm汰芬那+0.05%(v/v)silwetl-77)以每个40×60cm的区域(0.24m2)100ml的量处理cyppo10或cyppo13转化体(t3)后,在第7天判定植物的损伤水平。为了比较,使用野生型拟南芥(col-0生态型)进行相同的测试。
结果在图8中示出。
此外,每40×60cm区域(0.24m2)用100ml汰芬那溶液(1μm、5μm、10μm或25μm汰芬那+0.05%(v/v)silwetl-77)对具有cyppo10变体(f360c、f360i、f360l、f360m、f360v、f360t、a167c、a167l、a167l+f360m或a167c+f360i)或cyppo13变体(a177c、f373c、f373i、f373m、a177l+f373i或a177l+f373l)的编码基因的转化体进行处理后,在第7天判定植物的损伤水平。
结果在图9(导入cyppo10变体基因的t2转化体)和图10(导入cyppo13变体基因的t2转化体)中示出。
另外,图8至10中的汰芬那处理后各品系的损伤水平(损伤指数)在下表14作为数值指数示出。
表14
t2损伤指数(损伤水平)
每40×60cm区域(0.24m2)用100ml量的汰芬那溶液(25μm汰芬那+0.05%(v/v)silwetl-77)或苯嘧磺草胺溶液(100μm苯嘧磺草胺+0.05%(v/v)silwetl-77)对导入cyppo10变体(f360i、f360l、f360m、a167c+f360i、a167c+f360m或v305m+f360m)的编码基因的转化体(t3)进行处理后,在第7天判定植物的损伤水平。
导入cyppo10变体编码基因的t3转化体的结果在图32中示出。
另外,导入cyppo10突变基因的拟南芥转化体通过汰芬那或苯嘧磺草胺处理的损伤水平(损伤指数)在下表15作为数值指数示出。
表15
t3损伤指数(损伤水平)
表14和15示出了根据下表16的标准测试的个体(10至20个个体)的损伤水平的平均值。
表16
损伤水平的定义
在汰芬那、苯嘧磺草胺、丙炔氟草胺或甲磺草胺(每种50μm)处理之后,确认导入cyppo10突变基因(f360i或a167l+f360m)或cyppo13突变基因(a177l+f373l或a177l+f373i)的拟南芥转化体(t3)的耐受水平。为了比较,以相同条件测试拟南芥野生型或已知具有ppo抑制性除草剂耐受性的拟南芥ppo1slym(atppo1slym,s305l+y426m)转化体(t3)。
在使用各种除草剂的耐受性实验中,每个40×60cm的区域(0.24m2)均匀喷洒100ml浓度为50μm的每种除草剂。汰芬那、苯嘧磺草胺、丙炔氟草胺和甲磺草胺的分子量(mw)分别为511.87、500.85、354.34和387.18。转换的处理剂量对应于汰芬那为106.7gai/ha,苯嘧磺草胺为104.4gai/ha,丙炔氟草胺为73.8gai/ha和甲磺草胺为80.7gai/ha。
结果如图33a和33b所示。
另外,转化体的损伤水平(损伤指数)在图33和表17中作为数值指数示出。
表17
t3损伤指数(损伤水平)
在图33a和表17中,cy10fi、atppo1slym、cy10alfm分别代表cyppo10f360i转化体、atppo1的s305l+y426m转化体(对照)和cyppo10a167l+f360m转化体。
在图33b中,col-0、cy13alfl和cy13alfi分别代表野生型、cyppo13a177l+f373l转化体和cyppo13a177l+f373i转化体。
如图33a所示,突变基因的转化体具有与atppo1slym相同或更高的耐受性。证实了,与atppo1slym相比,所有cyppo10fi和cyppo10alfm均赋予对各种除草剂更高的耐受性。
如表14和图8所示,在1μm的汰芬那处理后,几乎所有具有cyppo10野生型、其变体基因、cyppo13野生型或其变体基因的转化体都生长,而野生型拟南芥(col-0)死亡。
另外,如表15和17、图9至10和图32至33所示,在超过5μm的汰芬那处理后,导入cyppo10或cyppo13变体基因的拟南芥转化体未显示损伤或显示弱损伤。结果表明,通过导入cyppo10、cyppo13或其突变基因赋予和/或增强拟南芥的除草剂耐受性。
证实了除草剂耐受性维持t2至t3代,这表明即使世代发展也能稳定地转移除草剂耐受性。
根据该结果,预期cyppo变体对其他植物以及拟南芥提供各种ppo抑制性除草剂耐受性。
7-5.在发生传代期间确认转基因稳定性
在该实施例中,证实了拟南芥中导入的基因是否在世代中稳定遗传。
用cyppo10f360i转化的t3品系7-2、10-2和10-5转化体进一步发展为t4、t5代,从而确认每种品系中汰芬那或苯嘧磺草胺耐受性和导入基因在t4和t5代中的表达。
蛋白提取
从每代植物中提取蛋白。在使用液氮研磨幼苗后,添加蛋白提取缓冲液(0.05mtris-clph7.5,0.1mnacl,0.01medta,1%tritonx-100,1mmdtt),并提取总蛋白。在电泳后将提取的蛋白转移至pvdf膜,然后使用抗ha抗体(santacruz)进行蛋白质印迹。
确认除草剂耐受性
在移植后4周,将100毫升含有15μm的汰芬那或150μm的苯嘧磺草胺的除草剂溶液均匀地喷洒在40×60cm的区域(0.24m2)的拟南芥中。在处理后第7天观察除草剂损伤水平。
除草剂耐受性的结果在图34(t4)和图35(t5)中示出,除草剂对转化体的损伤水平(损伤指数)在表18中示出。
表18
t4和t5损伤指数(损伤水平)
虽然阴性对照(col-0;拟南芥野生型)对除草剂处理敏感,但cyppo10f360i的t4和t5拟南芥转化体是耐受的。
另外,转基因表达的蛋白质印迹分析在图36中示出。仅在所有t4和t5代转化体中检测到cyppo10f360i蛋白。
因此,证明通过到入cyppo10变体得到的除草剂耐受性经t4和t5代稳定遗传并维持。
实施例8.使用cyppo及其变体构建大豆转化体和ppo抑制性除草剂耐受性测试
8-1.用于大豆转化的重组载体和使用该重组载体构建大豆转化体
构建了用于大豆植物转化以通过表达cyppo10a167l+f360m基因赋予汰芬那耐受性的载体。
具体地,使用用于拟南芥转化的载体(参见图6)作为模板,通过pcr扩增与拟南芥ppo1基因的转运肽组合的cyppo10a167l+f360m基因。使用pentrdirectionaltopo克隆试剂盒(invitrogen)克隆扩增产物,并转化至dh5α感受态细胞(invitrogen)。然后,使用gatewaylrclonaseii酶混合物(invitrogen)试剂盒将克隆的基因移至用于植物转化的载体pb2gw7.0二元载体(图37)。在混合其中克隆了cyppo10a167l+f360m基因的pentr/d-topo载体、te缓冲液和lrclonaseii酶混合物后,将其在25℃下温育1小时。将蛋白酶k溶液(invitrogen)添加到反应混合物中后,将其在37℃下温育10分钟,并转化到dh5α感受态细胞中。
用如上构建的二元载体对农杆菌eha105进行电转化。
广安大豆植物用于构建大豆转化体。
从大豆种子中去除种皮后,通过外科手术刀(#11刀)切割下胚轴并使其损伤7-8次。将大约50个外植体与转化的根癌农杆菌eha105(hood等人,用于基因转移到植物的新的农杆菌辅助质粒(eha105)(newagrobacteriumhelperplasmidforgenetransfertoplants(eha105)).transres.19932:208-218)混合,并将混合物超声处理20秒,然后温育30分钟进行接种。将其置于ccm(共培养基;0.32g/lgamborgb5,4.26g/lmes,30g/l蔗糖,0.7%琼脂)上。然后,将其在生长室(25℃,18小时光照/6小时黑暗)中共培养5天。
之后,将其在液体1/2sim(枝条诱导培养基;3.2g/lgamborgb5,1.67mg/lba,3mmmes,0.8%(w/v)琼脂,3%(w/v)蔗糖,250mg/l头孢噻肟,50mg/l万古霉素,100mg/l替卡西林,ph5.6)中洗涤10分钟并置于不含抗生素的sim上并在生长室(25℃,18小时光照/6小时黑暗)中培养2周。
将枝条诱导的外植体移植到sim-1(补充有10mg/ldl-草丁膦的sim培养基,ph5.6)上。
将褐色的枝条移植到sem上(枝条伸长培养基;4.4g/lms盐,3mmmes,0.5mg/lga3,50mg/l天冬酰胺,100mg/l焦谷氨酸,0.1mg/liaa,1mg/l玉米素,3%(w/v)蔗糖,0.8%(w/v)琼脂,250mg/l头孢噻肟,50mg/l万古霉素,100mg/l替卡西林,5mg/ldl-草丁膦,ph5.6)。将高度为4cm的伸长的枝条转移到rim(根诱导培养基;4.4g/lms盐,3mmmes,3%蔗糖,0.8%琼脂,50mg/l头孢噻肟,50mg/l万古霉素,50mg/l替卡西林,25mg/l天冬酰胺,25mg/l焦谷氨酸,ph5.6)。
当根充分生长时,将植物移至与蛭石以2∶1(v/v)混合的床土(bioplug编号2,farmhannong)。10天后,用100mg/ldl-膦丝菌素涂叶子。
8-2.验证转化大豆的除草剂耐受性
将5微摩尔或15μm的汰芬那在cyppo10a167l+f360m转化大豆(t0代)的2号品系和未转化大豆(广安;野生型大豆,对照)的叶子上用刷子涂2至3次。汰芬那溶液含有作为表面活性剂的0.05%(v/v)silwetl-77。
如图38所示,广安(非转化大豆)在5μm的汰芬那处理后7天表现出严重损伤,但cyppo10a167l+f360m转化的大豆即使在15μm的汰芬那处理后也没有显示出损伤。
同时,在v2至3阶段,用汰芬那或苯嘧磺草胺处理cyppo10a167l+f360m转化体2号品系的t1代。将100ml的25μm的汰芬那或150μm的苯嘧磺草胺均匀地喷洒在40×60cm的区域(0.24m2)上,并在喷雾后5天评估损伤水平。
在图40中,用广安大豆作为对照。与对照相比,cyppo10a167l+f360m(10alfm)转化体大豆即使在用相对高浓度的汰芬那或苯嘧磺草胺处理后也未显示出损伤。
8-3.确认转化大豆中插入基因的数量
用cyppo10a167l+f360m转化的2号或23号品系的250mg叶组织提取基因组dna,以分析转基因的拷贝数。
使用ctab缓冲液法提取基因组dna。用研杵和研钵在液氮中研磨叶组织后,添加1.25mldna分离缓冲液(2%(w/v)ctab,1.5mnacl,25mmedta,0.2%(v/v)β-巯基乙醇,100mmtris-cl(ph8.0))并涡旋。在60℃下加热1小时后,添加1体积的氯仿∶异戊醇(24∶1)并颠倒混合。在4℃下以7000×g离心10分钟后,将上清转移到新管中,并混合2.5体积的乙醇。在4℃下以5000×g离心5分钟后,弃去上清,用te缓冲液(lpss)溶解沉淀。添加20μg/mlrna酶a(bioneer)后,将其在37℃下培养30分钟。添加1体积的苯酚∶氯仿(1∶1)后,将其混合并在4℃下以10,000×g离心10分钟。将上清转移到新管中,然后添加1体积氯仿∶异戊醇(24∶1)并混合。在4℃下以10,000×g离心10分钟后,将上清转移到新管中,添加0.1体积的naoac(ph5.2)和2体积的乙醇并混合。在4℃下以5,000×g离心5分钟后,用70%乙醇洗涤。空气干燥后,用适量的te缓冲液溶解基因组dna。
使用ecori(enzynomics)将10至40μg提取的dna消化过夜。
然后,在0.8%(w/v)琼脂糖凝胶电泳(50v)后,如下处理凝胶:
1)脱嘌呤:0.25nhcl,摇动15分钟
2)变性:0.5mnaoh,1.5mnacl,摇动30分钟
3)中和:0.5mtris(ph7.5),1.5mnacl,摇动20分钟
此后,使用毛细管转移法将dna片段移至硝酸纤维素膜上,使用uv交联剂(uvc-508;ultraluminc.)进行交联。
通过以下方法进行杂交:将硝酸纤维素膜浸入digeasy杂交溶液(roche)中,并在42℃下温育3小时。然后,弃去溶液,替换为具有dig标记的探针的新鲜digeasy杂交溶液,并在42℃温育16至18小时。
探针(dig标记的cyppo8-m探针)通过pcr反应标记如下:
探针pcr
使用digdutp(jenabioscience)扩增dig标记的bar基因,使用的引物如下:
bar探针的正向引物:5′-ttccgtaccgagccgcagga-3′(seqidno:124)
bar探针的反向引物:5′-cgttgggcagcccgatgaca-3′(seqidno:125)
pcr:使用solgente-taq试剂盒
条件:95℃下5分钟;94℃下30秒,60℃下30秒,72℃下30秒,共35个循环;72℃下2分钟
杂交后,在低严格度的洗涤缓冲液(2×ssc,0.1%sds)和高严格度的洗涤缓冲液(0.5×ssc,0.1%sds)中洗涤膜。dna印迹信号检测如下:
1)在膜上添加封闭缓冲液(roche)后振荡30分钟
2)添加dig抗体(抗地高辛-apfab片段,roche)后振荡30分钟
3)在洗涤缓冲液中振荡15分钟(roche)
4)添加检测缓冲液(roche)后振荡3分钟
5)在膜上施加cdp-star(roche)后,在x射线胶片上使印迹显影。
对于阴性对照,将未转化的广安大豆植物的基因组dna用于dna印迹。
在图39中,膜上显示的条带数表示转基因的数量。由于在cyppo10a167l+f360m转化体2号和23号品系中观察到一条带,因此确定每种转基因植物具有单拷贝转基因。
实施例9:与ppo变体具有序列同源性的突变基因的活性测试
使用cyppo质粒(pacbb载体)作为模板,在以下条件下进行易错pcr,从而在cyppo中诱导随机突变:
10×缓冲液:100mmtris-cl,ph8.3;500mmkcl,70mmmgcl2,0.1%(w/v)明胶
dntp:10mmdatp,10mmdgtp,100mmdctp,100mmdttp
94℃下3分钟;(94℃下30秒,57℃下30秒,72℃下1.5分钟,72℃下5分钟)35个循环
引物序列:
cyppo10_bamhif
ccccggatccatgattgaagtggatgtggcta(seqidno:126)
cyppo10_xhoir
ccccctcgagtgattgtccaccagcgaggtaag(seqidno:127)
cyppo13_bamhif
ccccggatccatgaaccctgctacccctgaac(seqidno:128)
cyppo13_xhoir
ccccctcgagcacctgtgataacaactgctgag(seqidno:129)
将获得的易错pcr产物在琼脂糖凝胶中电泳,然后从凝胶中纯化,并用bamhi和xhoi限制酶消化pacbb载体和pcr产物。纯化在琼脂糖凝胶中电泳的消化的载体和pcr产物,并进行连接。将连接产物转化到bt3感受态细胞中,并对来自生长的bt3菌落中的突变cyppo基因进行测序。确认具有突变cyppo基因的bt3在含有不同浓度(0μm、50μm、100μm和200μm)的汰芬那或苯嘧磺草胺的lb平板上长出斑点,由此研究大肠杆菌的生长,并测试除草剂耐受性的水平。
在突变克隆中,将具有以下突变的克隆用于该除草剂耐受性测试:
cyppo10m-6:包含9个氨基酸突变(e225g、g258s、q266l、t336i、v356f、f360m、a364d、r406g、w419r);核酸序列-seqidno:130,氨基酸序列-seqidno:131(与野生型cyppo10的氨基酸序列具有98%序列同源性)
将用cyppo10的突变基因转化的bt3细胞在含有除草剂的培养基中培养,测定细胞生长抑制。在图41中,分别地,′atppo1wt′是指拟南芥的野生型ppo1,′atppo1slym′是指拟南芥的突变体ppo1(y426m+s305l),′cyppo10wt′是指野生型cyppo10,′cyppo10m-6′是指如上所述的突变的cyppo10。
如图41所示,用与野生型cyppo10具有98%或更高序列同源性的cyppo10突变体转化的细胞表现出与具有野生型cyppo10转化的细胞相似的细胞活性,甚至在含有高浓度(高达200μm)的汰芬那或苯嘧磺草胺的培养基的情况下也是如此。该结果表明,具有98%或更高序列同源性的cyppo10突变体可以保留野生型的除草剂耐受性(在含有除草剂的培养基中的活力)。
- 还没有人留言评论。精彩留言会获得点赞!