转录因子控制干细胞的分化的制作方法
本申请要求2016年9月12日提交的美国临时申请号62/393,324的优先权,其全部内容通过引用并入本文用于所有目的。
政府利益声明
本发明是在国立卫生研究院授予的5p50hg005550和hg008525的政府支持下完成的。政府拥有本发明的某些权利。
本公开涉及细胞命运的领域。特别是,它一方面涉及对分化的细胞的诱导,另一方面涉及干细胞的维持。
技术背景
小鼠胚胎干细胞(esc),人esc以及小鼠和人诱导多能干细胞(hipsc)的发现扩展了生物学的工作模式:不像研究生物学现象如分化、体内获得和维持细胞身份,我们现在理论上能够在培养皿中模仿这些过程中的一些。hipsc的使用有助于在伦理批准的环境中研究人细胞类型的发生,并且能够产生用于研究和医学的医学相关细胞类型。然而,只在很少的分化细胞类型中才能利用干细胞的完全分化潜能。到目前为止,干细胞分化方案是多方面的,并针对各细胞类型进行个性化定制。这些方案通常产生高度异质的群体,这可能掩盖了目的细胞类型。尽管已知驱动干细胞脱离多能性的初始触发因素,但我们对分化期间发生的后续分子事件知之甚少。例如,初始触发因素包括分化培养基的应用,小分子的添加,生长因子的应用或3d培养技术。这些刺激通过细胞信号传导级联起作用并汇集到转录因子(tf)上,转录因子通过激活和/或抑制来改变基因表达。这些级联中的一些可能类似体内发育,例如3d视网膜类器官中的视网膜发生,而单层培养似乎遵循替代的分子分化途径,尽管最终细胞类型可以与体内细胞类型具有高度相似性。在体内自然发育过程中和在合成体外系统中,细胞身份转换的实例证明了控制这些转录程序的重要性。控制细胞身份的能力导致了目前对干细胞领域的关注,因为对类似原代人细胞的容易获取将使得在疾病建模、药物筛选和再生医学中许多应用可行。从根本上说,发现和控制细胞身份之间转换的能力将极大地增强我们对细胞身份的理解。
在获得细胞身份后,其维持是多细胞生物的中心特征。这包括终末分化的细胞以及生理干细胞,其可以在体内产生特定细胞类型。为了维持干细胞库,转录程序在很大程度上通过转录因子参与在阻止这些细胞的分化中起作用。在体外,维持esc或ipsc的多能性对于扩展和维持这些细胞用于下游应用是必不可少的。已经开发了劳动密集型和精细的培养技术以维持多能性并避免自发分化。培养基配方的进步显著提高了干细胞维持的稳健性,使饲养细胞共培养可有可无,并将干细胞的使用开放给更大的科学界。
由于依赖转录程序来维持或转换细胞身份,因此需要在转录组水平上获得直接控制。对lac操纵子的转录控制的详细研究是第一个实例,即某类dna结合蛋白即转录因子启动、增强或抑制转录。结果表明,人们可以通过异位tf表达来获得在同一胚层内细胞命运转化的转录控制,这是通过在成纤维细胞中过表达myod而开拓的,其中成纤维细胞随后转化为成肌细胞,并且c/ebp-α将b细胞转化为巨噬细胞。强制tf诱导还可以转化由不同胚层产生的细胞,由三种tf即brn2、ascl1和myt1l(bam)开拓,将成纤维细胞转化为神经元。还已经表明,某些组的tf可以改变活体动物中神经元的身份。另一个突出的实例是通过在成纤维细胞中过表达oct3/4、sox2、klf4和c-myc(“yamanaka因子”)来产生ipsc。tf的选择主要是“生物学启发的”;体内发育中已知的那些在体外手动测试或通过计算方法提出。这种偏好选择的异位tf导致成功地产生了少数细胞类型。值得注意的是,所选择的tf从干细胞诱导所需细胞类型的失败率相对较高,要么根本不起作用,要么导致意外的细胞命运。由于实验和技术差异,例如基因递送途径,瞬时或诱导型tf表达或者起始细胞类型的差异,我们不能轻易地解决这些结果。由于人干细胞中的强制tf表达可以非常有效,我们想知道如何系统地将这种分化途径赋予产生其他细胞类型。显然,需要标准化tf递送、表达、筛选和分析的技术方面。与“生物学启发的”tf相反,无偏向的系统的tf文库筛选以识别将干细胞转化为其他细胞类型或增强多能性的新tf将是期望的和互补的。
到目前为止,还没有用于转换细胞身份的无偏向、系统的开放阅读框(orf)筛选。最近,已经进行了基于crispr的激活子筛选,但没有用于细胞转化。用于细胞转化的基于crispr的激活子似乎不足以克服对细胞身份转化的障碍。系统的、基于rnai的筛选揭示了理解干细胞生物学的重要多能性因子,但过度表达以维持多能性尚未系统地进行。
衍生自人诱导多能干细胞(hipsc)的细胞类型对于生物医学研究和医学具有高度相关性,但对于许多细胞类型缺乏稳健、有效和快速的方案:我们是否可以生成新的方案来生成细胞类型?
本领域一直需要改变细胞命运和维持细胞命运的方法,使得可用于细胞移植和药物筛选的细胞群体可以更好地反映人体中不同的细胞类型。
发明概述
本公开内容的一个方面是诱导被诱导的多能干细胞进行分化的方法。将包含编码转录因子的开放阅读框(orf)、转录因子(tf)蛋白质或编码转录因子的基因的转录激活子的核酸递送至被诱导的多能干细胞。结果被诱导的多能干细胞中转录因子的量增加,并且被诱导的多能干细胞分化形成分化的细胞。
本公开的另一方面是维持被诱导的多能干细胞的多能性的方法。将包含编码蛋白质的开放阅读框、所述蛋白质或编码该蛋白质的开放阅读框的转录激活子的核酸递送至被诱导的多能干细胞。所述蛋白质是转录因子,其在将转录因子文库递送至被诱导的多能干细胞群体后,相对于分化的细胞而言在高比例的干细胞中发现。作为递送的结果,被诱导的多能干细胞维持角蛋白硫酸细胞表面抗原tra-1-60的表达,其中tra-1-60是干细胞身份的标志物。
本公开内容的另一方面是工程改造的人分化细胞,其包含含有开放阅读框的一种或多种核酸。所述一个或多个orf编码选自以下的转录因子:atoh1、neurog3、{neurog1和neurog2}、{neurog1和neurog2和emx1}、{neurog1和neurog2和emx2}、{neurog1和neurog2和tbr1}、{neurog1和neurog2和foxg1}、etv2、myog、foxc1、mitf、sox14、wt1、tfpd3、cdx2、smad3和zscan1。
本公开的又一方面是工程改造的人分化细胞,其包含含有编码蛋白质的开放阅读框的核酸。该蛋白质选自znf70;znf461;tfap2b;znf426;mitf;cdx2;meox2;akna;nkx2-8;nkx3-2;nkx2-3;znf16/hzf1;etv2;tfdp3;rela/p65;neurog1;id4;hes7;mxd4;sox14;foxp1;e2f2;neurog3;znf148/zbp89;grlf1/arhgap35;bola2;znf616;max;atoh1;prdm5;lhx5;znf273;mafk;hoxa1;hif2a/epas1;mafb;e2f3;prdm7;znf44;hmga1;nrl;batf3;myog;klf15;lmx1a;hoxb6;dmrtb1;atf7;scrt2;znf593;hes2;zscan2;msx2;id3;sox12;gli1;dprx;smad3;zbed3;camta2;msc;ascl3;barx1;dmrt1;hoxa10;tsc22d3;znf837;mxd3;znf692;nhlh2;znf626;thap3;sry;wt1;shox;znf43和zscan1。
本公开的又一方面是被诱导的多能干细胞,其包含含有编码蛋白质的开放阅读框的核酸。该蛋白质是转录因子,其在将转录因子文库递送至被诱导多能干细胞群体后,相对于分化的细胞而言在高比例的干细胞中发现。被诱导的多能干细胞表达角蛋白硫酸细胞表面抗原tra-1-60。转录因子可以是以下中的一种或多种:aebp2;aire;arnt2;arntl;atf6;bach1;barx2;casz1;clock;crebrf;ctcfl;cxxc1;dlx2;e2f1;ebf1;egr1;elf4;elf5;emx2;ets1;etv1;etv7;fezf1;foxj3;foxl2;foxn2;foxo1;foxp3;foxs1;gata1;gcm1;hmbox1;hoxb9;hoxc10;hoxc6;hoxd10;hoxd3;hoxd8;hsf2;hsfy1;irf5;irf9;irx2;kcmf1;klf1;klf13;klf16;klf7;klf8;lbx1;lcorl;maf;mef2a;meis2;mnt;mybl2;myf6;myrf;nanog;neurod1;nfe2l2;nfe2l3;nfib;nfix;nkrf;noto;nr0b1;nr1b1;nr1b3;nr1c2;nr1c3;nr1f3;nr1i2;nr2b2;nr2c1;nr3a1;nr3a2;nr3c4;nr5a2;osr1;pax6;pax7;pax9;phox2b;pknox1;plagl1;preb;prrx1;rbpj;rc3h2;rfx5;satb1;smad2;smad4;sp1;sp4;sp6;srebf1;stat3;tal2;tbx14;tbx18;tbx21;tbx22;tbx5;tead2;terf1;terf2;tfap2a;tfdp2;tfeb;thap1;thap10;tp63;tshz3;yeats2;zbed2;zbtb12;zbtb14;zbtb17;zbtb21;zbtb35;zbtb9;zeb1;zfhx3;zfpm2;zfy;zfyve26;zic4;zkscan1;zkscan12;zkscan14;zkscan19;zkscan24;zkscan4;zkscan5;zmat2;znf114;znf138;znf146;znf227;znf253;znf266;znf280a;znf280c;znf282;znf296;znf311;znf317;znf337;znf34;znf35;znf350;znf366;znf396;znf398;znf41;znf415;znf460;znf485;znf497;znf511;znf512;znf517;znf543;znf550;znf586;znf613;znf615;znf619;znf641;znf644;znf645;znf648;znf655;znf658;znf662;znf664;znf669;znf704;znf740;znf754;znf75a;znf774;znf789;znf8;znf80;znf84;zscan16;zscan22;zscan32;zxda;zxdc和zzz3。
本公开的另一方面是诱导被诱导的多能干细胞进行分化的方法。诱导表达增加的基因选自atoh1、neurog3、{neurog1和neurog2}、{neurog1和neurog2和emx1}、{neurog1和neurog2和emx2}、{neurog1和neurog2和tbr1}、{neurog1和neurog2和foxg1}、etv2、myog、foxc1、mitf、sox14、wt1、tfpd3、cdx2、smad3和zscan1。被诱导的多能干细胞由此分化形成分化的细胞。
本公开的又一方面是诱导被诱导的多能干细胞进行分化的方法。基因的表达被诱导。所述基因选自atoh1、neurog3、{neurog1和neurog2}、{neurog1和neurog2和emx1}、{neurog1和neurog2和emx2}、{neurog1和neurog2和tbr1}、{neurog1和neurog2和foxg1}、etv2、myog、foxc1、mitf、sox14、wt1、tfpd3、cdx2、smad3和zscan1。被诱导的多能干细胞由此分化形成分化的细胞。
在阅读本说明书后对于本领域技术人员显而易见的这些和其他实施方案为本领域提供了用于控制干细胞群体的细胞命运的工具和方法。
附图说明
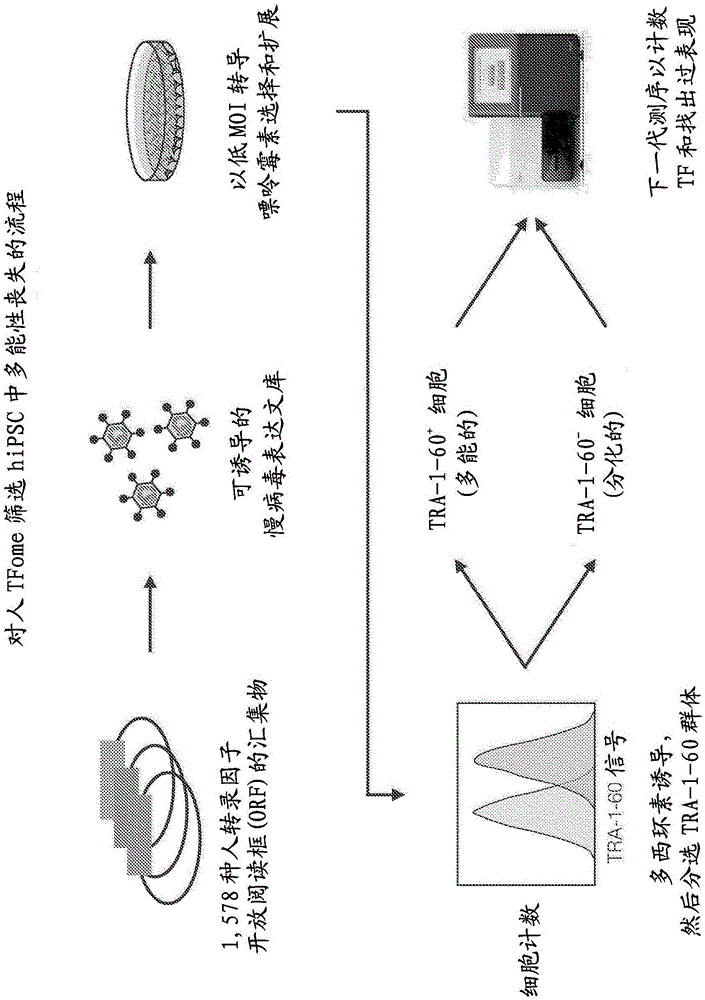
图1.用于筛选人转录因子组(1,578个人转录因子(tf)克隆的全面表达文库,完全覆盖主要tf家族)的工作流程,用于hipsc(人诱导多能干细胞)中的多能性的丧失。
图2.细胞类型转换的高通量筛选的一般策略。
图3.人转录因子组表达文库。
图4.用于递送人转录因子组的表达载体。
图5.高通量筛选干细胞分化[人诱导多能干细胞中干细胞身份(tra-1-60)的丧失]的命中。
图6.富集发育基因和蛋白结构域的命中。
图7.选择的诱导干细胞分化的转录因子。
图8.atoh1在干细胞培养基中诱导hipscs的神经元分化,没有胚状体形成、其他生长因子或机械操作。
图9.neurog3在干细胞培养基中诱导hipscs的神经元分化,没有胚状体形成、其他生长因子或机械操作。
图10.etv2在干细胞培养基中诱导hipscs的内皮分化,没有胚状体形成、其他生长因子或机械操作。
图11.myog在干细胞培养基中诱导hipscs的肌肉分化,没有胚状体形成、其他生长因子或机械操作。
图12.foxc1在干细胞培养基中诱导hipsc的分化,没有胚状体形成、额外的生长因子或机械操作。
图13.mitf在干细胞培养基中诱导hipscs的分化,没有胚状体形成、其他生长因子或机械操作。
图14.sox14在干细胞培养基中诱导hipsc的分化,没有胚状体形成、其他生长因子或机械操作。
图15.zscan1在干细胞培养基中诱导hipsc分化,没有胚状体形成、其他生长因子或机械操作。
图16.wt1在干细胞培养基中诱导hipsc分化,没有胚状体形成、其他生长因子或机械操作。
图17.neurogenin1和neurogenin2在干细胞培养基中诱导hipscs的神经元分化,没有胚状体形成、其他生长因子或机械操作。
图18.neurogenin1和neurogenin2和emx1在干细胞培养基中诱导hipscs的皮质神经元分化,没有胚状体形成、其他生长因子或机械操作。
图19.neurogenin1和neurogenin2和emx2在干细胞培养基中诱导hipscs的皮质神经元分化,没有胚状体形成、其他生长因子或机械操作。
图20.neurogenin1和neurogenin2和tbr1在干细胞培养基中诱导hipscs的皮质神经元分化,没有胚状体形成、其他生长因子或机械操作。
图21.neurogenin1和neurogenin2和foxg1在干细胞培养基中诱导hipscs的皮质神经元分化,没有胚状体形成、其他生长因子或机械操作。
图22.与持家基因(显示的最后三个)相比较,选择的转录因子(显示的前九个)在hipsc中以低水平表达或根本不表达。
图23.整合到hipsc基因组中的tforf的平均拷贝数。
发明详述
发明人已经开发了用于诱导干细胞分化成特定细胞谱系的技术,以及用于诱导干细胞继续作为干细胞进行增殖的技术。该技术不使用特殊的生长条件、小分子或生长因子,而是采用转录因子(tf)来触发分化程序或阻止分化的干细胞更新程序。
如所确定的,某些转录因子能够诱导干细胞分化成特定谱系。例如,mitf导致干细胞形成黑素细胞。类似地,cdx2导致干细胞形成胎盘细胞。myog导致干细胞形成平滑肌细胞。分化的初始指标可以是干细胞特异性标志物的丧失。例如,可以在细胞中测定角蛋白硫酸盐细胞表面抗原tra-1-60,因为它在分化过程的早期丧失。使用干细胞标志物的丧失作为指示物也提供了检测相关转录因子的一般手段,而不是寻求获得在特定细胞谱系的分化期间新表达的标志物。标志物丧失筛选可以应用于除干细胞之外的细胞类型,例如以识别直接将成纤维细胞转化为目标细胞类型的tf。在一些方面,转录因子的组合可用于实现向特定细胞谱系的分化。该组合可以实现单独的转录因子不能实现的细胞类型或细胞亚型。备选地,该组合可以实现与单独转录因子之一相同的细胞类型,但可以更有效地实现它。
可以通过各种手段从分化的细胞或正在分化的细胞中分选干细胞,通常基于差异基因表达。例如,荧光激活细胞分选可以用于基于它们表达tra-1-60来分离细胞。备选地,某些分化的细胞可以基于其谱系特异性细胞表面抗原的表达而从其他分化的细胞和从细胞中分选。另一种方法是通过单细胞rna测序来在rna水平评估表达,无需任何分选或预选步骤。这些技术在本领域中是已知的,并且可以根据对特定应用的适用和方便来使用。
可以使用本领域已知的用于增加干细胞中转录因子的量的任何方法。这可以包括递送包含编码转录因子的开放阅读框的核酸,递送转录因子本身,或递送转录因子的激活子或其表达。可以使用本领域已知的用于这种递送的任何技术。例如,为了递送cdna,可以使用病毒或质粒载体。开放阅读框(编码tf的任何同种型)可以是可诱导或可抑制而用于控制,以实现合适的表达水平。包含开放阅读框的核酸可以是cdna、mrna或者合成的或工程改造的核酸。一些转录因子可能需要临界量的表达以有效地诱导分化,例如每个细胞相当于至少5、10、15、20、25或50个拷贝的orf。由于在高水平的可能毒性,其他因子可能需要小于某一表达阈值,例如每个细胞少于20、10或5个拷贝。还可以通过增加orf的拷贝数来实现增加的表达水平,例如通过使用更高拷贝数的载体或通过使用转座子。在一些实施方案中,核酸酶无效或“死亡”cas9变体可用于激活所需转录因子的转录。参见,例如,chavez等人,naturemethods13:563-569,2016。在其他实施方案中,可以使用修饰的rna——编码转录因子但使用改善稳定性和降低降解的合成核苷酸的rna。在一些情况下,使用适合于特定细胞类型的培养基可以增加诱导该细胞类型表达的orf的表达。orf的表达可以从非表达的基因,从低水平表达的基因或从以强健水平表达的基因增加。过表达是表达水平高于诱导前从以低、中或高水平表达的基因表达的水平。
外源性开放阅读框通常是不同于细胞中的相似基因或mrna的开放阅读框。它可以被工程改造为具有不同的控制序列,例如启动子、操纵子、增强子、终止子等。它可以被工程改造为不具有内含子。它可以被工程改造为融合到在人基因组中它不与之融合的第二开放阅读框。
可使用本文描述的方法产生的分化的细胞将具有多重应用。它们可用于再生医学,例如将细胞移植到需要某种类型细胞的受体中。它们可用于在细胞培养中和移植后的药物测试。细胞可以用于将产品递送到身体的一部分,例如如果它们天然产生,或被工程改造以产生和分泌产品。
细胞中的药物测试可以使用已知或未知的物质以具有某种生物活性。这些物质可以是元素、化合物或混合物,无论是天然的还是合成的。细胞可用于确定潜在药物的所需活性,或相反地确定物质的不良作用或缺乏此类作用。物质与细胞的接触可以在培养物中或在人体或动物体内。无论接触发生在何处,都可以在体外或体内测定该物质的活性或副作用。
在被测细胞中观察到的变化不受限制。可以针对对细胞生长、细胞凋亡、分泌的产物、特定产物的表达等的影响来观察细胞。可以编辑这些细胞的基因组以匹配在患有疾病的患者中发现的突变。可以使用本领域已知用于这种改变的任何类型的测定法,包括但不限于免疫测定法、形态学观察、组织化学染色、逆转录聚合酶链反应、蛋白质印迹、质谱、杂交测定法、电生理学等。
干细胞可以从任何来源获得。一种特别有用的来源是人诱导多能干细胞。还可以使用小鼠诱导多能干细胞和小鼠胚胎干细胞,以及来自其他动物的此类细胞。人胚胎干细胞的使用可能受到控制的或在伦理上是不希望的,但这些可以使用。
可以通过作为该分化细胞类型的特征或定义的任何性质或性质组来识别分化的细胞。例如,不同的细胞类型具有独特的转录组。转录组可以用作匹配和识别未知细胞类型与已知细胞类型的手段。转录组可以定性地或定量地使用。类似地,蛋白质组可以用作识别未知的分化细胞类型的手段。基于形态学、生长习性、分泌产物、酶活性、细胞功能等,可以识别一些细胞类型。可以使用本领域已知的用于识别细胞的任何手段。
以上公开内容总体上描述了本发明。本文公开的所有参考文献明确地通过引用并入。通过参考以下具体实施例可以获得更完整的理解,这些实施例仅出于说明的目的提供,并不意图限制本发明的范围。
实施例1
我们决定通过结合现有资源的因子来构建完整的tforf文库。通过从头基因合成获得缺少的tf。该“人转录因子组”包含1,578种经典人tf,其由全合一tet-on慢病毒载体骨架内的诱导型启动子系统驱动,用于在hipsc中稳定整合。通过筛选人转录因子组,我们发现超过70种tf诱导hipsc身份的丧失,表明tf改变细胞身份的普遍效力。该资源、整个文库以及单个tf将在addgene(非营利性质粒库)公开获得,并且可以获得其中可诱导某些tf的hipsc系的子集。我们以每个hipsc单种tf的方式应用人转录因子组,以识别将干细胞转化为其他细胞身份或增强多能性的单种tf。进行高通量荧光细胞分选(facs)与下一代测序和随后的生物信息学分析相组合,以筛选两个hipsc系中的tf。我们显示表达水平是关键的,并且可以通过使用转座子介导的表达盒整合来提高。人转录因子组在hipsc中的应用证实了超过10种tf是细胞命运转化的tf。此外,我们发现了超过一百种tf增强多能性,它们可能有助于提高干细胞培养的稳健性。
实施例2
生成和应用人转录因子组
人干细胞中进行系统和全面的tf范围诱导筛选需要可用的tf表达文库。值得注意的是,只有部分人文库,例如orfeome中包含的tf是可访问的。因此,我们决定从可用资源中或通过从头基因合成组装tf来编译“人转录因子组”,这是一个代表所有经典人转录因子的1,578种tf的表达文库(vaquerizas等人,2009年),并进一步策划。
选择plix403慢病毒载体是因为它允许基因组转基因整合,来自tet-on系统的多西环素诱导型tf表达和对转导细胞的嘌呤霉素选择。通过合并gateway克隆将穿梭载体(pentr)中的单独tf克隆到plix403中。为了区分异位tf与内在表达,用在tf的c末端上的gateway重组位点下游的主链上翻译的v5表位标签标记tf。plix403载体包含第二泛启动子盒,其驱动在小分子多西环素存在下激活teton启动子所需的rta3基因和双顺反子嘌呤霉素选择标志物。在dna质粒文库中亚克隆后,通过下一代测序可检测到约98%的tf,随后用于产生慢病毒颗粒。
我们用人转录因子组以低感染复数(moi=0.1)转导来自个人基因组计划和atccdys0100人ipsc系的pgp1,使得细胞最多将接受单个慢病毒整合。总之,我们转染了两个细胞系,每个细胞系都用完整的人转录因子组池以及两个子池,这样具有六个独立转导。为了获得对文库的充分覆盖,我们确保在慢病毒转导后平均每个tf存在于至少一百个细胞中。赋予对抗生素博来霉素、杀稻瘟菌素和潮霉素的抗性但不诱导分化的基因也被转导作为阴性对照。然后使用嘌呤霉素对转导的细胞选择tf整合,扩增并加入多西环素4天以进行连续tf诱导。facs将染色的群体分离成分化的tra-1-60low和多能tra-1-60high群体。对于这些群体中的每一个,使用通用引物pcr扩增整合的基因,并测序。
实施例3
转录因子范围广泛筛选人诱导多能干细胞的多能性中的改变
为了鉴定诱导干细胞为任何分化的细胞的tf,我们设计了一种筛选单独tf的策略,这些tf有效地导致多能性的丧失,而不富集具有任何特定细胞类型标志物的细胞。我们使用荧光激活细胞分选(facs)方法,其能够对人转录因子组进行多重评估,然后通过使用新一代测序进行tf鉴定。为了测量多能性的丧失,我们针对硫酸角质素细胞表面抗原tra-1-60进行染色,该抗原在从多能性退出时迅速丧失。重要的是,因为我们的目的是鉴定有效的分化诱导剂,我们在标准的mtesr1干细胞培养基中进行了筛选。
我们首先旨在全面识别会导致多能性丧失的单独tf。为了对每种tf的分化潜能进行评分,我们通过将在分化的tra-1-60low群体中测序的归一化读数的数值除以多能tra-1-60high群体来计算每种tf的比率。我们预期与多能性tra-1-60high群体相比,诱导分化的tf在tra-1-60low群体中高度富集,因此具有高比率。相反,与多能性群体相比,减少自发分化的tf,例如通过维持多能性,在分化的群体中具有较少的读数。我们基于截短的荧光蛋白的评分设定了tf没有影响的阈值。预期增加细胞增殖而不影响多能性的tf将具有与这些截短的荧光蛋白类似的分化评分。
基于这种分化评分指标,与截短的荧光蛋白质对照相比,我们鉴定了超过70种诱导多能性丧失的tf(“分化诱导tf”)和超过100种强化多能性的tf(“多能性-增强tf”)。为了评估该筛选的质量,我们对分化诱导tf进行了基因分组富集分析(gsea)。我们发现分化诱导tf在发育过程和系统发育中得到富集,这与在我们的筛选中它们诱导多能性丧失的能力是一致的。就蛋白质结构域而言,通常存在于参与发育的tf中的基础螺旋-环-螺旋dna结合结构域被富集,而锌指和küppel相关盒(krab)结构域被耗尽。总体而言,这些结果表明,我们在人干细胞中的筛选再次发现了已在体内模型生物中识别的发育上重要的tf。
实施例4
当以高水平表达时,转录因子诱导快速和有效的分化
为了制作快速有效地诱导hipsc为细胞类型的遗传配方,我们工程改造了可诱导型单tf表达细胞系,其可以根据需要产生目的细胞类型。我们最初旨在紧密模仿筛选的条件,即单拷贝慢病毒整合。我们最初的努力成功地验证了筛选,但是分化效率很弱(~10%),类似于基于crispr-cas9激活子的分化实验。为了克服这一挑战,同时保持我们的简单分化方案的目标,而无需额外的生长因子、机械步骤或选择,我们想知道整合的慢病毒载体的低tf表达水平是否是高效分化的瓶颈。我们推测,某些关键的靶基因可能以tf结合和转录激活的低概率被封闭;因此,在理论上,更高的表达将增加成功结合以及因此可能激活诱导从多能性退出的正反馈环的转录事件的概率。
为了表达高水平的tf,我们首先测试了高滴度慢病毒颗粒的转导,这导致大量细胞死亡。为了提高hipsc的转导效率和活力(vialibility),我们构建了基于piggybac转座子的载体,其具有相似的多西环素诱导型tf表达和使用嘌呤霉素来选择转导细胞的能力。重要的是,这种转座子系统允许对tf的容易的高拷贝整合;在我们的手中,我们平均每个基因组约15个整合拷贝,如通过数字液滴pcr评估的。由于这种集成效率,将拷贝数设置为每个细胞单个tf是具有挑战性的。因此,我们决定不重复使用慢病毒系统的筛选,而是选择具有高分化评分的tf用于亚克隆到piggybac载体中。
使用这种高表达系统,我们评估了分化效率。通过明视野显微镜观察,我们观察到干细胞形态的快速丧失,特别是远离集落的迁移和采用不同的细胞形态。我们通过针对nanog、oct4和sox2的细胞内流式细胞术来量化干细胞身份的丧失。未诱导的干细胞具有>90%nanog+oct4+sox2+细胞,而多西环素诱导的细胞具有<10%nanog+oct4+sox2+细胞。
实施例5
tf诱导谱系的系统分类
接下来,我们需要一种先验识别生成的细胞谱系的方法-我们需要一种类似于blast的方法,但是是用于组织谱。已经发表了一些研究,其通常比较基因表达谱,从而推断出常见的药物靶点、疾病突变效应等;然而,基因的广泛性不允许针对在geneexpressionomnibus中编目的表达谱来严格和明确地识别细胞谱系。类似blast的方法还需要广泛的参考组来比较;然而,基于机械基因调控网络的算法cellnet对于每个组织需要许多样品,这是目前无法获得的。我们系统地使用来自许多组织的数千个rna-seq数据集作为训练数据。我们采用了基于机器学习算法的keygenes,针对抗高质量组织表达数据集对我们的转录组进行了系统的blast。
诱导干细胞身份丧失的tf可能是由转化为分化的细胞类型,或者是在没有特定身份的情况下一般细胞身份丧失而引起。为了系统地确定这些tf可能诱导的谱系,我们首先需要一种系统的方法来对细胞类型进行分类。我们策划了一系列大规模人组织表达谱研究,以训练用于细胞类型的机器学习分类器。该策划(curation)包含代表来自gtex研究、humanproteinexpressionatlas和illuminahumanbodymap的组织的rna-seq样品。然后我们将其应用作为keygenes的训练数据,其是用于细胞类型识别的基于lasso回归的分类器。
为了确定由这些tf产生的细胞谱系,我们对每个细胞群体进行了rna-seq,并将它们用作对扩展的keygenes分类器的查询。
有趣的是,这些tf在成人组织中的表达不能预测在hipsc中产生哪些谱系。例如,etv2诱导内皮分化,但在睾丸中表达最高,atoh1激活神经元细胞身份,但在结肠和小肠中高表达,而cdx2诱导胎盘身份,但也在结肠和小肠中高表达。因此,单独的观察性研究似乎不能预测哪些tf可以诱导哪些谱系,并且表明转化细胞类型的合成方法不一定体现体内发育。
这些细胞谱系的特异性标志物的表达来自rna-seq数据。为了增强向这些谱系的分化,我们在这些谱系的标准培养条件存在下诱导tf表达,并通过流式细胞术评估谱系特异性标志物的转化效率。通过免疫组织化学染色来测试形态学和谱系特异性标志物表达。总之,这些数据表明tf衍生的细胞可以有效且快速地产生。
实施例6
实验方法
转录因子组的注释和手动策划(curation)
典型的人转录因子之前由vaquerizas等人,2009注释,其基于计算搜索那些以序列特异性方式,但不是酶促的并且不形成核心起始复合物的一部分来结合dna的基因,产生1,591个tf(分类为“a”和“b”,其具有对于调节功能的实验证据,“其他”作为具有未定义的dna结合结构域的可能tf;排除“x”类,因为其具有混杂的dna结合结构域)。我们进一步包括预测但没有实验证据的tf(“c”类)。根据hugo基因命名委员会(hgnc)填写以下主要tf家族:锌指(包括含c2h2结构域),同源结构域(包括lim、pou、tale、hoxl、nkl、prd亚家族),基本螺旋-环-螺旋和叉子头(forkhead)。去除了由hgnc注释的假基因。移除重复和未定位的基因,并使用hgnc多符号检查器将所有基因转换为批准的基因名称。人转录因子组中tf的最终靶标组包含1,578种基因。
人转录因子组的装配和质量控制
在yang等人2011年,jolma等人,transomictechnologiescdnas,orfs(transomicinc),亚利桑那州立大学的dnarepository,以及gen9的密码子优化合成的基础上,将所有tf克隆到pdonr系列标准化的gataway兼容载体中。
将人转录因子组合并克隆到plix403病毒载体中
为了将合并的lr克隆进行到plix403病毒表达载体(addgene41395)中,将每个96孔板的dna组合到其自己的子池中并使用qubitdsdnabroadrangeassaykit(invitrogenq32853)进行定量。将75ng的pentr-转录因子组子池用于lrclonaseii(invitrogen11791100)反应过夜并用蛋白酶k消化。将1μl反应物转化到oneshotstbl3化学感受态细胞(invitrogenc737303)中,接种到具有100μg/ml羧苄青霉素的50cm2lb琼脂平板上并在30℃孵育过夜。进行连续稀释以估计每个平板的菌落数。每个平板生长大约10,000到20,000个菌落,代表每个96成员子池的100到200倍覆盖率。
刮下每个子池平板的菌落,使用qiagenplasmidplusmidikit(qiagen12943)提取dna以产生plix403-转录因子组子池。为了克隆效率和文库覆盖率,合并pentr和plix403子池以产生pentr-转录因子组和plix403-转录因子组。在covariss2上将5μg每个池剪切至200bp,并使用用于illumina的nebnextultradnalibraryprepkit(nebe7370l)将1μg用于文库制备。
慢病毒的生产和转导
如前所述,使用45μgdna对两个15cm培养皿生产慢病毒。用转录因子组慢病毒以感染复数(moi)=0.1转导hipsc。
流式细胞术分析和荧光激活细胞分选(facs)
用胰蛋白酶消化细胞,洗涤并重悬于facs缓冲液(含10%fbs的pbs)中。对于表面抗原,用荧光团缀合的抗体和活力染料celltracecalceinblue,am(lifetechnologies,c34853)以1×107个细胞/ml在黑暗中在冰上对活细胞染色30分钟。对于细胞内染色,使用bdcytofix固定缓冲液(bdbiosciences,554655)以1×107个细胞/ml固定细胞20分钟,用bdperm/wash缓冲液(bdbiosciences,554723)洗涤,并在bdperm/wash缓冲液中透化10分钟,然后在黑暗中用抗体和dapi染色30分钟。将染色的细胞用facs缓冲液洗涤两次,过滤到滤器加盖的管(falcon,352235)中并在bdlsrfortessa上运行。通过用单荧光团缀合的抗体染色abctotalantibodycompensationbeads(lifetechnologies,a10497)来确定对于光谱重叠的补偿。转录组文库制备和测序
将trizol(lifetechnologies,15596-018)直接加入细胞中并孵育3分钟,并使用direct-zolrnaminiprep(zymoresearch,r2050)进行rna提取。通过qubitrnahskit(molecularprobes,q32852)定量rna。使用poly(t)珠(biooscientific,512979)将1μg用于poly(a)分离,并使用nextflexrapiddirectionalqrna-seq试剂盒(biooscientific,5130-02d)用于具有独特分子标识符(umi)的rna-seq文库制备。通过掺入sybrgold(lifetechnologies,s11494)在lightcycler实时定量pcr机(roche)上扩增文库。收集中间对数扩增的文库并使用ampurexp珠子(agencourt,a63881)进行纯化。通过tapestation(agilent)和定量pcr(kapabiosystems)对文库进行质量控制。
转导和产生稳定的细胞系
对于各piggybac转导,使用nucleofectorx-unit,使用nucleofectorp3溶液(lonza,v4xp-3032)对细胞500,000至800,000个细胞进行核转染。选择并扩增嘌呤霉素抗性细胞。
- 还没有人留言评论。精彩留言会获得点赞!