维持细胞存活率的组合物和方法与流程
本申请要求美国临时申请号62/404,170(2016年10月4日提交)和62/405,477(2016年10月7日提交)的优先权,其全部内容通过引用并入本发明。本申请还涉及2017年10月4日提交的名称为“用于细胞冷冻保存的组合物和方法”的国际申请号pct/cn2017/,其全部内容通过引用并入本发明。
本发明主要涉及在体外维持生物材料的存活率的领域。更具体地说,本发明涉及用于在冷冻保存之后解冻时维持生物材料(例如:细胞以及组织)的存活率的组合物和方法。
背景技术:
0℃或0℃以下的冷冻保存技术通常用于长期保存生物材料,例如:动物和植物的细胞和组织(包括人类细胞和组织)。请参阅thompson等人,cryopreservationandthawingofmammaliancells,december2014,els,johnwiley&sons,ltd:chichester.doi:10.1002/9780470015902.a0002561.pub2。有效长期储存哺乳动物细胞对于可否将这些细胞成功的应用于临床和作为研究工具是至关重要的。举例来说,干细胞可应用于细胞移植、组织工程和再生医学。而冷冻保存的卵母细胞、精子和胚胎则可用于辅助生殖技术。在移植医学中,需要冷冻保存皮肤、眼角膜、胰岛和心脏瓣膜等活体组织。
细胞可保存于零度以下(例如:-70℃以下)达数月或数年。然而,细胞于解冻时以及解冻后并不稳定。主要由存活率表示的细胞稳定性随着细胞在解冻过程期间和之后接触的环境而变化。已经显示,解冻速率、渗透应力以及冷冻保护剂的毒性会在解冻后损伤细胞。请参阅thompson等人,cryopreservationandthawingofmammaliancells,december2014,els,johnwiley&sons,ltd:chichester.doi:10.1002/9780470015902.a0002561.pub2。如果将所述细胞注射入受试者中(例如:通过细胞治疗、输血或骨髓移植等方式),则如何于解冻后获得较高细胞存活率是非常重要的,因为再注射死亡或损伤的细胞是无效的。同样地,当细胞必须被重新培养时,高的细胞存活率同样也是重要的。
当细胞从冷冻状态转变为代谢活性状态时,如何维持其存活率是一项具有挑战性的任务。因此,有必要改进用于维持解冻后的细胞存活率的介质和方法。
技术实现要素:
本发明提供一种含有约5wt%至约15.7wt%、约5wt%至约7.5wt%、约10wt%至约15.7wt%、约0.8wt%至约15.7wt%、约2.4wt%至约7wt%或者约9.3wt%至约14.6wt%明胶的稳定细胞的介质(前述的百分比为相对于稳定细胞的介质的总重量百分比)。
本发明还提供一种组合物,其包含生物材料(例如:一个或多个细胞、组织、器官和/或病毒颗粒)以及含有约0.8wt%至约15.7wt%、约2.4wt%至约7wt%或者约9.3wt%至约14.6wt%的明胶。
在一些实施方案中,生物材料(例如:一个或多个细胞、组织、器官和/或病毒颗粒)已经从冷冻保存状态解冻。在一些实施方案中,解冻后的细胞存活率至少为70%或至少为80%。
本发明提供一种用于维持生物材料存活率(例如:细胞存活率)的方法,该方法包括:将生物材料(例如:一个或多个细胞、组织、器官和/或病毒颗粒)与稳定细胞的介质混合以形成混合物(或形成稳定细胞的介质和生物材料(例如:一个或多个细胞、组织、器官和/或病毒颗粒)的组合)。
本发明提供一种用于维持细胞存活率的方法,该方法包括:将一个或多个细胞与稳定细胞的介质混合以形成混合物(或形成稳定细胞的介质和生物材料(例如:一个或多个细胞、组织、器官和/或病毒颗粒)的组合),其中所述混合物(或组合)含有约0.8wt%至约15.7wt%、约2.4wt%至约7wt%或约9.3wt%至约14.6wt%的明胶。
在一些实施方案中,于混合步骤之前,一个或多个细胞被置于细胞悬浮液中。
在一些实施方案中,对于混合步骤,所述稳定细胞的介质与细胞悬浮液的体积比范围为约6.25至约12.5或约5至约10。
在一些实施方案中,所述细胞于细胞悬浮液中的浓度为约7.5x105至约7.5x107个细胞/ml。
在一些实施方案中,所述方法还包含于混合步骤之前将稳定细胞的介质置于约25至约37℃的温度。
在一些实施方案中,于混合步骤之前,所述一个或多个细胞是在已从冷冻保存状态解冻的冷冻保存组合物中。在一些实施方案中,所述冷冻保存状态的温度范围约为-70至-200℃。
在一些实施方案中,解冻后的细胞存活率至少为70%或至少为80%。
在一些实施方案中,所述冷冻保存组合物包含:甘油、二甲基亚砜(dmso)和/或聚乙二醇(peg)。
在一些实施方案中,于混合步骤之后,所述混合物中细胞的浓度为约105至约107个细胞/ml。
在一些实施方案中,明胶具有约100千道尔顿(kd)至约200kd的重均分子量(或分子量或平均分子重量)。在一些实施方案中,明胶包含变性的胶原。
在一些实施方案中,所述稳定细胞的介质是具有约190至约325的胶冻值(bloomvalue)的热可逆水凝胶。
在一些实施方案中,所述细胞是哺乳动物细胞。在一些实施方案中,所述细胞是人的、猪的、狗的、马的或牛的细胞。在一些实施方案中,所述细胞包含肿瘤细胞。在一些实施方案中,所述细胞包含成纤维细胞。在一些实施方案中,所述细胞包含干细胞。
在一些实施方案中,所述稳定细胞的介质还包含氨基酸、细胞因子、脂质、生长因子、抗生素、抗霉菌素、类固醇激素、蛋白质激素或其组合。
本发明提供试剂盒,其包含本发明组合物或所述稳定细胞的介质。
附图说明
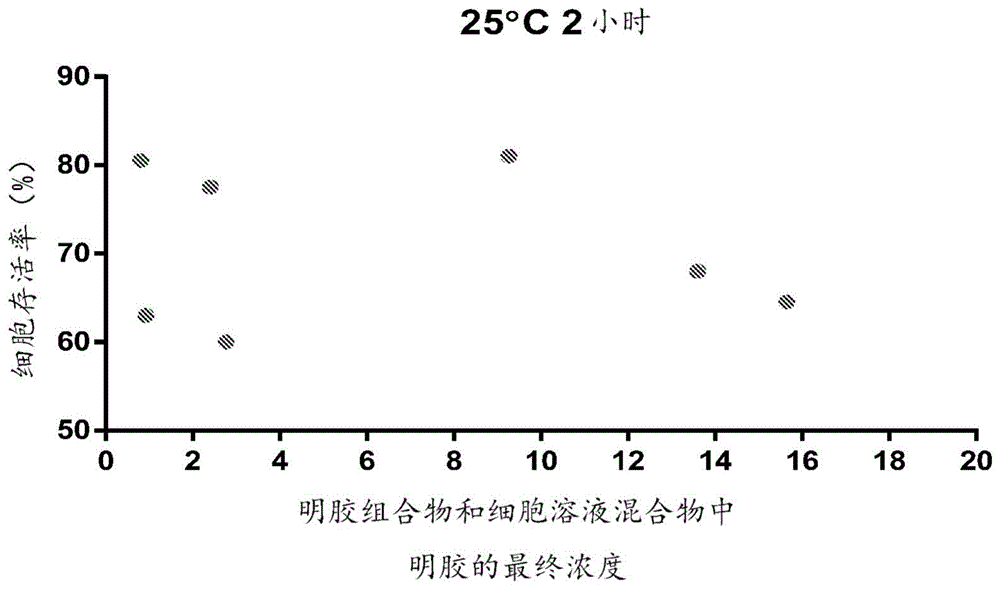
图1是显示明胶浓度和温育温度和时间对解冻后细胞存活率的影响的图。在实验中,首先将细胞在基于甘油的冷冻溶液中冷冻。将解冻的细胞悬浮液(在冷冻溶液中)和含有明胶的稳定细胞的介质混合。将混合物在25℃温育2小时,然后测定解冻后的细胞存活率。
图2是显示明胶浓度和温育温度和时间对解冻后细胞存活率的影响的图。在实验中,首先将细胞在基于甘油的冷冻溶液中冷冻。将解冻的细胞悬浮液(在冷冻溶液中)和含有明胶的稳定细胞的介质混合。将混合物在25℃温育4小时,然后测定解冻后的细胞存活率。
图3是显示明胶浓度和温育温度和时间对解冻后细胞存活率的影响的图。在实验中,首先将细胞在基于甘油的冷冻溶液中冷冻。将解冻的细胞悬浮液(在冷冻溶液中)和含有明胶的稳定细胞的介质混合。在对照样品中,将解冻的细胞悬浮液(在冷冻溶液中)和dmem混合。将混合物在30℃温育2小时,然后测定解冻后的细胞存活率。
图4是显示明胶浓度和温育温度和时间对解冻后细胞存活率的影响的图。在实验中,首先将细胞在基于甘油的冷冻溶液中冷冻。将解冻的细胞悬浮液(在冷冻溶液中)和含有明胶的稳定细胞的介质混合。在对照样品中,将解冻的细胞悬浮液(在冷冻溶液中)和dmem混合。将混合物在30℃温育4小时,然后测定解冻后的细胞存活率。
图5是显示明胶浓度和温育温度和时间对解冻后细胞存活率的影响的图。在实验中,首先将细胞在基于甘油的冷冻溶液中冷冻。将解冻的细胞悬浮液(在冷冻溶液中)和含有明胶的稳定细胞的介质混合。将混合物在27℃温育2小时,然后测定解冻后的细胞存活率。
图6是显示明胶浓度和温育温度和时间对解冻后细胞存活率的影响的图。在实验中,首先将细胞在基于甘油的冷冻溶液中冷冻。将解冻的细胞悬浮液(在冷冻溶液中)和含有明胶的稳定细胞的介质混合。在对照样品中,将解冻的细胞悬浮液(在冷冻溶液中)和dmem混合。将混合物在37℃温育2小时,然后测定解冻后的细胞存活率。
图7是显示明胶浓度和温育温度和时间对解冻后细胞存活率的影响的图。在实验中,首先将细胞在基于甘油的冷冻溶液中冷冻。将解冻的细胞悬浮液(在冷冻溶液中)和含有明胶的稳定细胞的介质混合。在对照样品中,将解冻的细胞悬浮液(在冷冻溶液中)和dmem混合。将混合物在37℃温育4小时,然后测定解冻后的细胞存活率。
图8是显示明胶浓度和温育时间对解冻后细胞存活率的影响的图。在实验中,首先将细胞在基于甘油的冷冻溶液中冷冻。将解冻的细胞悬浮液(在冷冻溶液中)和含有明胶的稳定细胞的介质混合。在对照样品中,将解冻的细胞悬浮液(在冷冻溶液中)和dmem混合。将混合物在37℃温育,然后测定解冻后的细胞存活率。
图9是显示明胶和温育时间对解冻后细胞存活率的影响的图。在实验中,首先将细胞在基于dmso的冷冻溶液中冷冻。将解冻的细胞悬浮液(在冷冻溶液中)和含有明胶的稳定细胞的介质混合。在对照样品中,将解冻的细胞悬浮液(在冷冻溶液中)和dmem或10%fbs/dmem混合。将混合物在25℃温育,然后测定解冻后的细胞存活率。
具体实施方式
本发明提供一种包含例如明胶的稳定细胞的介质。所述稳定细胞的介质帮助维持细胞存活率,例如在将冷冻保存的生物材料解冻后。通过与所述稳定细胞的介质混合,可以在所期待的时间内维持细胞存活率。
然后,生物材料(例如细胞)可用于各种研究和临床环境,例如,用于基于细胞的治疗,辅助生殖技术,或用于接受化学疗法或放射疗法的患者。在一个实施方案中,可以将生物材料施用于受试者。
在一些实施方案中,生物材料(例如,细胞、组织、器官或病毒颗粒)从冷冻保存(从冷冻保存的状态)解冻(或已经解冻)。在一些实施方案中,生物材料已经处于冷冻保存状态。在一些实施方案中,在与稳定细胞的介质混合的同时,生物材料处于从冷冻保存解冻的过程中或者已经从冷冻保存解冻。在一些实施方案中,在与本发明的稳定细胞的介质组合/混合后,细胞具有至少约50%、至少约60%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%的解冻后存活率。
在一些实施方案中,当生物材料(例如:细胞、组织、器官或病毒颗粒)从冷冻保存解冻(或已被解冻)时,生物材料是在含有一种或多种渗透性冷冻保护剂,和/或一种或多种非渗透性冷冻保护剂的冷冻保存组合物中。渗透性冷冻保护剂的非限制性实例包括甘油、dmso、聚乙二醇、乙二醇和丙二醇(1,2-丙二醇、丙-1,2-二醇)。非渗透性冷冻保护剂的非限制性实例包括高分子量的分子,例如糖类(例如:蔗糖、海藻糖、麦芽糖)、糖、淀粉(例如:羟乙基淀粉),蛋白质(例如:白蛋白,例如血清白蛋白)、percoll、ficol、聚乙二醇、葡聚糖、聚乙烯吡咯烷酮、聚乙烯醇(pva)、血清、血浆和其他大分子。在一些实施方案中,冷冻保存组合物包含一种或多种冷冻保护剂,其包括但不限于甘油、二甲基亚砜(dmso)和/或聚乙二醇(peg)。
如本发明所用,术语“冷冻保存状态”是指处于冷冻保存温度的状态。
在具体的实施方案中,冷冻保存温度包括等于或低于约0℃,等于或低于约-20℃,等于或低于约-50℃,等于或低于约-60℃,等于或低于约-70℃,等于或低于约-80℃,等于或低于约-90℃,等于或低于约-100℃,等于或低于约-110℃,等于或低于约-120℃,等于或低于约-135℃,等于或低于约-196℃,约-70℃至约-200℃的温度,或在液氮中。
在一些实施方案中,生物材料(例如:细胞、组织、器官或病毒颗粒)在与稳定细胞的介质组合/混合之前处于低温保存状态。在一些实施方案中,生物材料(细胞、组织、器官)在与稳定细胞的介质组合/混合之前处于冻干状态(lyophilizedstate)。
在一些实施方案中,细胞在与稳定细胞的介质组合/混合之前处于细胞培养下。可以在亚汇合(sub-confluence)时、指数生长期、汇合时或汇合后收取细胞。
在一些实施方案中,在与稳定细胞的介质组合/混合之前,从受试者(例如,患者)收取细胞。
在一些实施方案中,在与本发明的稳定细胞的介质组合/混合后,细胞具有至少约50%、至少约60%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%,或至少约95%的存活率。
在一些实施方案中,所述细胞包含肿瘤细胞。在一些实施方案中,所述细胞包含成纤维细胞。在一些实施方案中,所述细胞包含干细胞。
在一些实施方案中,所述细胞包含哺乳动物细胞,其包含但不限于人的、猪的、狗的、马的或牛的细胞。
在一些实施方案中,本方法可以进一步包括向受试者(例如,患者)施用被本发明稳定细胞的介质处理的生物材料的步骤。
在一些实施方案中,稳定细胞的介质包含约5wt%至约15.7wt%的明胶(基于稳定细胞的介质的总重量)。在一些实施方案中,稳定细胞的介质包含约2wt%至约20wt%、约3wt%至约18wt%、约4wt%至约17wt%、约5wt%至约16wt%、约5wt%至约15.7wt%、约5wt%至约7.5wt%、约10wt%至约15.7wt%、约5wt%至约6wt%、约6wt%至约7.5wt%、约7.5wt%至约10wt%、约5wt%至约10wt%、约6wt%至约7.5wt%、约6wt%至约10wt%、约6wt%至约15.7wt%、约7.5wt%至约10wt%、约7.5wt%至约15.7wt%、约5wt%、约6wt%、约7.5wt%、约10wt%或者约15.7wt%的明胶,基于稳定细胞的介质的总重量。
在一些实施方案中,稳定细胞的介质含有(或由其组成或基本上由其组成)约5wt%至约15.7wt%明胶和溶剂(例如:培养基,例如:dmem、水、缓冲液、盐水溶液等)。在一些实施方案中,稳定细胞的介质含有(或由其组成或基本上由其组成)明胶浓度范围为约5wt%至约15.7wt%的明胶水溶液。
在一些实施方案中,稳定细胞的介质含有(或由其组成或基本上由其组成)约5wt%至约15.7wt%的明胶和缓冲系统(例如:生理缓冲液)。在一些实施方案中,稳定细胞的介质含有(或由其组成或基本上由其组成)约5wt%至约15.7wt%的明胶和盐溶液,和/或任何生理溶液。
在一些实施方案中,稳定细胞的介质含有(或由其组成或基本上由其组成)约5wt%至约15.7wt%的明胶和培养基(例如:细胞培养基)。
在一些实施方案中,在所述稳定细胞的介质中,明胶是与液体组合物混合的。在一些实施方案中,稳定细胞的介质含有(或由其组成或基本上由其组成)约5wt%至约15.7wt%的明胶和液体组合物。液体组合物的非限制性实例包括水、培养基、培养基混合物、缓冲系统(例如:生理缓冲液)、盐溶液和/或任何生理溶液。在一些实施方案中,所述液体组合物还包含补充剂、添加剂、额外量的一些介质组分等等。
在一些实施方案中,稳定细胞的介质含有(或由其组成或基本上由其组成)两种成分:第一种成分是明胶,其在稳定细胞的介质中浓度为约5wt%至约15.7wt%;第二种成分是盐水溶液(例如:等张盐水溶液)、缓冲系统(例如:生理缓冲液)、水和/或培养基(例如:细胞培养基)。
本发明提供了用于维持生物材料的存活率(例如,细胞存活率)的方法。该方法可包括将生物材料(例如,细胞、组织、器官或病毒颗粒)与稳定细胞的介质混合以形成混合物的步骤。在一些实施方案中,稳定细胞的介质包含约5wt%至约15.7wt%的明胶,基于稳定细胞的介质的总重量。
可以通过任何合适的方法将生物材料(例如,细胞、组织、器官或病毒颗粒)与本发明的稳定细胞的介质组合。在一些实施方案中,将稳定细胞的介质添加到生物材料中。在一些实施方案中,将生物材料加入到稳定细胞的介质中。在一个实施方案中,该方法包括在细胞悬浮液中提供细胞,并将稳定细胞的介质加入细胞悬浮液中,任选与其混合。在另一个实施方案中,该方法包括在细胞悬浮液中提供细胞,并将细胞悬浮液加入到稳定细胞的介质中,任选与其混合。
在一些实施方案中,在与本发明的稳定细胞的介质组合/混合之前,对细胞除去其培养基或保存介质(例如,离心,收取,以及任选地在缓冲溶液中洗涤)。
在一些实施方案中,在将细胞和本发明的稳定细胞的介质混合之前,细胞处于细胞悬浮液中。在一些实施方案中,将细胞悬浮在培养基(例如细胞培养基)、缓冲系统(例如生理缓冲液)、盐溶液和/或生理溶液中。
在一些实施方案中,细胞在细胞悬浮液中的浓度范围为约104个细胞/ml至约109个细胞/ml、约104个细胞/ml至约108个细胞/ml、约7.5x105个细胞/ml至约7.5x107个细胞/ml、约5x105个细胞/ml至约5x107个细胞/ml、约8x105个细胞/ml至约7.5x107个细胞/ml、约9x105个细胞/ml至约7.5x107个细胞/ml、约106个细胞/ml至约7.5x107个细胞/ml、约5x106个细胞/ml至约7.5x107个细胞/ml、约7.5x106个细胞/ml至约7.5x107个细胞/ml、约7.5x105个细胞/ml至约7.5x106个细胞/ml、约105个细胞/ml至约107个细胞/ml、约105个细胞/ml至约108个细胞/ml、约104个细胞/ml至约107个细胞/ml、约7.5x105个细胞/ml、约7.5x106个细胞/ml或者约7.5x107个细胞/ml、约105个细胞/ml、约106个细胞/ml或者约107个细胞/ml。在一些实施方案中,细胞在细胞悬浮液中的浓度范围为约7.5x105至约7.5x107个细胞/ml。在一些实施方案中,细胞在细胞悬浮液中的浓度为约7.5x106个细胞/ml。细胞在细胞悬浮液中的浓度可以高于109个细胞/ml或低于104个细胞/ml。
在一些实施方案中,将细胞和本发明的稳定细胞的介质混合以形成混合物。
本发明提供了维持细胞存活率的方法。该方法可包括将一个或多个细胞与稳定细胞的介质混合以形成混合物的步骤。在一些实施方案中,该混合物包含约0.8重量%至约15.7重量%的明胶。
在一些实施方案中,细胞(其可以在细胞悬浮液中或可以不在细胞悬浮液中)和本发明的稳定细胞的介质的混合物(或生物材料和稳定细胞的介质的组合)包含约0.8wt%至约15.7wt%的明胶(基于混合物的总重量)。在一些实施方案中,混合物(或组合)包含约0.5wt%至约20wt%、约0.6wt%至约18wt%、约0.7wt%至约17wt%、约0.8wt%至约16wt%、约0.8wt%至约15.7wt%、约0.5wt%至约15.7wt%、约1wt%至约17wt%、约2wt%至约14wt%、约3wt%至约9.5wt%、约4wt%至约14wt%、约2.4wt%至约7wt%、约9.3wt%至约14.6wt%、约5wt%至约7.5wt%、约10wt%至约15.7wt%、约5wt%至约6wt%、约6wt%至约7.5wt%、约7.5wt%至约10wt%、约5wt%至约10wt%、约6wt%至约7.5wt%、约6wt%至约10wt%、约6wt%至约15.7wt%、约7.5wt%至约10wt%、约7.5wt%至约15.7wt%、约5wt%、约6wt%、约7.5wt%、约10wt%或者约15.7wt%的明胶,基于混合物(或组合)的总重量。
在一些实施方案中,将细胞和本发明的稳定细胞的介质混合形成混合物,其中混合物中细胞的浓度范围为约104个细胞/ml至约109个细胞/ml、约104个细胞/ml至约108个细胞/ml、约105个细胞/ml至约107个细胞/ml、约106个细胞/ml至约107个细胞/ml、约105个细胞/ml至约106个细胞/ml、约105个细胞/ml至约108个细胞/ml、约104个细胞/ml至约107个细胞/ml、约105个细胞/ml、约106个细胞/ml或者约107个细胞/ml。在一些实施方案中,细胞以约105个细胞/ml至约107个细胞/ml的浓度存在于混合物中。在一些实施方案中,细胞以约106个细胞/ml的浓度存在于混合物中。混合物中细胞的浓度可高于109个细胞/ml或低于104个细胞/ml。
在一些实施方案中,在混合步骤中,稳定细胞的介质与细胞悬浮液(或含有生物材料的组合物)的体积比为约3至约25、约5至约20、约6至约18、约6至约15、约6.25至约12.5、约7至约12.5、约6.25至约15、约6.25至约20、约8至约12.5、约9至约12.5、约5至约12.5、约5至约10、约5至约8、约5、约6、约6.25、约7、约8、约9、约10、约11、约12、约12.5、约13、约14或者约15。
在一些实施方案中,在将混合物在约25℃、约27℃、约30℃或者约37℃的温度温育约1小时至约8小时、约2小时至约8小时、约3小时至约8小时、约2小时至约4小时、约1小时至约6小时、约4小时至约8小时、约1小时至约5小时、约1小时至约4小时、约1小时至约3小时、约1小时至约2小时、约2小时至约4小时、约2小时至约3小时、约3小时至约5小时、约5分钟至约20分钟、约5分钟至约30分钟、约10分钟至约1小时、约20分钟至约1小时、约30分钟、约1小时、约2小时、约3小时、约4小时、约5小时、约6小时、约7小时或者约8小时后,在生物材料(例如细胞,其可在细胞悬浮液中或者可不在细胞悬浮液中)和本发明的稳定细胞的介质的混合物中细胞的存活率的降低少于约40%、少于约30%、少于约20%、少于约10%、少于约9%、少于约8%、少于约7%、少于约6%、少于约5%、少于约4%、少于约3%或者少于约1%。
在一些实施方案中,在将混合物在约25℃、约27℃、约30℃或者约37℃的温度温育约1小时至约8小时、约2小时至约8小时、约3小时至约8小时、约2小时至约4小时、约1小时至约6小时、约4小时至约8小时、约1小时至约5小时、约1小时至约4小时、约1小时至约3小时、约1小时至约2小时、约2小时至约4小时、约2小时至约3小时、约3小时至约5小时、约5分钟至约20分钟、约5分钟至约30分钟、约10分钟至约1小时、约20分钟至约1小时、约30分钟、约1小时、约2小时、约3小时、约4小时、约5小时、约6小时、约7小时或者约8小时后,在生物材料(例如细胞,其可在细胞悬浮液中或者可不在细胞悬浮液中)和本发明的稳定细胞的介质的混合物中细胞的存活率为至少约50%、至少约60%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或者至少约95%。
本发明提供了包含生物材料(例如,一个或多个细胞、组织、器官)和约0.8wt%至约15.7wt%的明胶的组合物。在一些实施方案中,该组合物包含约0.8重量%至约15.7重量%的明胶(基于组合物的总重量)。在一些实施方案中,该组合物包含约0.5wt%至约20wt%、约0.6wt%至约18wt%、约0.7wt%至约17wt%、约0.8wt%至约16wt%、约0.8wt%至约15.7wt%、约0.5wt%至约15.7wt%、约1wt%至约17wt%、约2wt%至约14wt%、约3wt%至约9.5wt%、约4wt%至约14wt%、约2.4wt%至约7wt%、约9.3wt%至约14.6wt%、约5wt%至约7.5wt%、约10wt%至约15.7wt%、约5wt%至约6wt%、约6wt%至约7.5wt%、约7.5wt%至约10wt%、约5wt%至约10wt%、约6wt%至约7.5wt%、约6wt%至约10wt%、约6wt%至约15.7wt%、约7.5wt%至约10wt%、约7.5wt%至约15.7wt%、约5wt%、约6wt%、约7.5wt%、约10wt%或者约15.7wt%的明胶,基于组合物的总重量。
在一些实施方案中,生物材料(例如:细胞、组织、器官或病毒颗粒)是从冷冻保存(冷冻保存的状态)解冻的(或已经被解冻)。在一些实施方案中,生物材料已经处于冷冻保存下。在一些实施方案中,生物材料是处在从冷冻保存解冻的过程中或已经被解冻。
本发明的稳定细胞的介质可以是液体或固体。在一些实施方案中,所述稳定细胞的介质是浓缩组合物,例如以干燥形式(例如:粉末、片剂、颗粒或其它任何合适的物理形式),或液体形式,例如为2倍(2x)、3倍(3x)、4倍(4x)、5倍(5x)、6倍(6x)、7倍(7x)、8倍(8x)、9倍(9x)、10倍(10x)、15倍(15x)、20倍(20x)等的储液。所述储液可以使用例如:培养基、生理溶液、缓冲液、水等以2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍等进行稀释。干燥形式的稳定细胞的介质可以通过添加例如培养基、生理溶液、缓冲液、水等(例如:溶解于培养基、生理溶液、缓冲液、水等中)转化为液体形式。
在一些实施方案中,本发明讨论的组分的浓度是在本发明的稳定细胞的介质的储液中组分的浓度。在一些实施方案中,本发明讨论的组分的浓度是在本发明的稳定细胞的介质的工作溶液中组分的浓度。
所述稳定细胞的介质可以是溶液。在一些实施方案中,稳定细胞的介质是本发明所讨论的组分的水溶液。
在一些实施方案中,当制备所述稳定细胞的介质时,将本发明所讨论的组分(例如:明胶、明胶衍生物和/或白蛋白)溶解于平衡电解质溶液(例如:盐水溶液、培养基(例如细胞培养基))中。在一些实施方案中,稳定细胞的介质具有适当浓度的电解质(例如:钠离子、钾离子和/或氯离子)以维持正常的渗透压。在一个实施方案中,生理盐水溶液是磷酸盐缓冲盐溶液(pbs)。在一个实施方案中,盐水溶液包含以下中的一种或多种:氯化钠、氯化钾、硫酸镁、磷酸钾、氯化钙和碳酸氢钠。在一个实施方案中,盐水溶液是等渗盐水溶液(例如:与血浆或体液等渗)。
所述稳定细胞的介质可以包含缓冲系统(例如:生理缓冲液)。所述稳定细胞的介质可以包含平衡的盐溶液或任何生理溶液。
缓冲系统的非限制性实例包括磷酸缓冲液(例如:磷酸盐缓冲盐水(pbs))、bes、tes、乙酰氨基甘氨酸、甘氨酰胺、甘氨酰甘氨酸、tricine、talp、三乙醇胺、佛罗拿(veronal)和hepes。
在一些实施方案中,所述稳定细胞的介质中缓冲剂的浓度范围为约1mm至约1000mm、约1mm至约200mm、约5mm至约200mm或者约5mm至约50mm。
培养基的非限制性实例包括dulbecco'smodifiedeagle培养基(dmem)、最小必需培养基(mem)、knockout-dmem(ko-dmem)、glasgow最小必需培养基(g-mem)、eagle基本培养基(bme)、dmem/ham'sf12、advanceddmem/ham'sf12、iscove'smodifieddulbecco's培养基和最小必需培养基(mem)、ham'sf-10、ham'sf-12、medium199、rpmi1640培养基和其组合和/或其改良物。在一个实施方案中,细胞培养基是dmem。
在一些实施方案中,本发明的稳定细胞的介质在室温或环境温度(例如,在25℃)具有约6.0至约8.5、约6.5至约8、约6.9至约7.5或约7.2至约7.4的ph。
在一些实施方案中,稳定细胞的介质是以单位形式包装。在一个实施方案中,稳定细胞的介质包装成10ml、50ml、100ml、500ml或1l的体积。在一些实施方案中,稳定细胞的介质包装成1倍、5倍、10倍或20倍溶液。
本发明的稳定细胞的介质可以通过混合本发明所述的组分以固体形式获得,或通过将组分溶解在水、缓冲液、溶液、培养基等中作为水溶液获得。
本发明中所使用的百分比“%(w/v)”是指重量除以体积的百分比(w是以克计算,v是以毫升计算)。百分比“%(v/v)”是指体积百分比;百分比“%(w/w)”或“wt%”是指重量百分比。
关于数值的“约”是指所述数值的+10%。换句话说,数值可以在指定值的90%至110%的范围内。
明胶
本发明的稳定细胞的介质可包含明胶和/或明胶衍生物。如本发明所用,术语“明胶”可以指明胶或明胶衍生物。任何明胶或明胶衍生物均可用于本发明的稳定细胞的介质中。
在一些实施方案中,所述稳定细胞的介质中明胶的分子量(或重均分子量或平均分子量)为约15千道尔顿(kd)至约40kd、约25kd至约40kd、约25kd至约50kd、约25kd至约45kd、约40kd至约50kd、约10kd至约100kd、约40kd至约100kd、约50kd至约100kd、约100kd至约200kd、约100kd至约250kd、约80kd至约200kd、约150kd至约200kd、约100kd至约150kd或者约50kd至约200kd。
在一些实施方案中,本发明稳定细胞的介质中明胶的等电点(pi)为约4.5至约9、约5至约9、约5至约7、约6至约7、约5至约6、约7至约9或者约4.7至约5.2。
在一些实施方案中,明胶来自于哺乳动物组织。在一些实施方案中,明胶来自于动物胶原。在一些实施方案中,明胶来自于动物如牛、鸡、猪和鱼的皮肤、骨骼、结缔组织、肌腱、韧带等的原材料,但不局限于此。在一个实施方案中,明胶来自于牛、猪或其组合。在一些实施方案中,明胶来自于牛骨和猪皮、牛皮肤、猪肉、牛皮和/或鱼皮。在一个实施方案中,明胶是皮肤衍生的明胶或骨衍生的明胶。
在一些实施方案中,明胶是通过胶原的部分水解产生的肽和蛋白质的混合物。在一些实施方案中,明胶是胶原的水解形式。在一些实施方案中,明胶是变性胶原的形式。在一些实施方案中,明胶包含变性胶原。
在一些实施方案中,明胶可以是a型明胶或b型明胶。如本发明所用,a型明胶是由酸处理的原料得到的明胶;b型明胶是由碱处理的原料得到的明胶。
在一些实施方案中,为了生产明胶,通过化学水解和/或热水解进行胶原水解。在一个实施方案中,将胶原煮沸(例如,在水中)或加热(广泛地)以产生明胶。
在一些实施方案中,为了生产明胶,通过酸水解、碱水解和/或酶水解进行胶原水解。
在一些实施方案中,明胶的制造过程包含三个主要阶段:预处理、主要萃取步骤、以及精炼和回收处理。预处理是将原料准备好以供主要萃取步骤使用,并去除可对最终明胶产品的生理化学性质具有负面影响的杂质。主要萃取步骤可用热水或稀酸溶液作多阶萃取而将胶原水解成明胶。精炼和回收处理则包括:过滤、澄清、蒸发、灭菌、干燥、车辙(rutting)、研磨和/或筛分以从明胶溶液中除去水、混合所提取的明胶和/或获得干燥、混合和研磨的最终产品。
在一些实施方案中,本发明的稳定细胞的介质包含分级明胶,其通过特殊制备技术如超滤从常规明胶中获得。在一些实施方案中,通过除去肽/多肽的选定部分,或通过肽/多肽的各个部分的混合物,获得分级明胶。
明胶衍生物是化学改性的明胶,包括琥珀酰化(succinylated)明胶、硫醇化(thiolated)明胶,乙酰化(acetylated)明胶,邻苯二甲酸化(phthalated)明胶,琥珀酰(succinyl)明胶,氧化聚(oxypolygelatin)明胶或尿素交联(ureacross-linked)明胶,但不局限于此。在一个实施方案中,琥珀酰化明胶是通过琥珀酸或其盐或琥珀酸酐交联的明胶。在一些实施方案中,明胶衍生物是通过使明胶与酸酐(例如:琥珀酸(succinic)酸酐、柠康酸(citraconic)酸酐、衣康酸(itaconic)酸酐、乌头酸(aconitic)酸酐或马来酸(maleic)酸酐)反应而获得而来的(请参阅美国专利8,865,397和6,103,269)。
多肽
所述稳定细胞的介质可包含任何适当的多肽。在一些实施方案中,稳定细胞的介质包含多肽组分和液体组分。
如本发明中所述,多肽旨在包含任何由组织产生的或由合成产生的多肽,例如:胶原衍生的组分(例如:明胶)。在具体的实施方案中,多肽可包含(或由其组成)约50个氨基酸残基至约30,000个氨基酸残基,优选约100个氨基酸残基至约20,000个氨基酸残基,更优选约200个氨基酸残基至约10,000个氨基酸残基,更优选约300个氨基酸残基至约5,000个氨基酸残基,并且最优选约500个氨基酸残基至约2,000个氨基酸残基。
在一些实施方案中,多肽包含明胶、白蛋白或两者的组合。
在一些实施方案中,多肽是明胶或明胶衍生物(例如:琥珀酰化明胶)。在一些实施方案中,所述多肽是其他明胶样组分,例如:角蛋白(keratin)、核心蛋白聚糖(decorin)、聚集蛋白聚糖(aggrecan)、弹性蛋白(elastin)、层粘连蛋白(laminin)、巢蛋白(nidogen)、纤维蛋白(fibulin)、原纤维蛋白(fibrillin)、胶原、分级明胶、胶原水解物、植物蛋白质、植物蛋白水解物、弹性蛋白水解物、糖蛋白(包括蛋白聚糖)及其混合物。
也可以使用由其他类型组织而来的多肽。实例包括但不限于来自动脉、声带、胸膜、气管、支气管、肺泡隔、韧带、耳廓软骨或腹部筋膜的组织萃取物;肝的网状网络;肾的基底膜;或神经系统的神经鞘、蛛网膜、硬膜或软膜。
多肽可以包含天然组分和/或合成组分。天然组分的实例包括天然存在的蛋白质和多肽,但不局限于此。
在一些实施方案中,稳定细胞的介质含有约2wt%至约20wt%、约3wt%至约18wt%、约4wt%至约17wt%、约5wt%至约16wt%、约5wt%至约15.7wt%、约5wt%至约7.5wt%、约10wt%至约15.7wt%、约5wt%至约6wt%、约6wt%至约7.5wt%、约7.5wt%至约10wt%、约5wt%至约10wt%、约6wt%至约7.5wt%、约6wt%至约10wt%、约6wt%至约15.7wt%、约7.5wt%至约10wt%、约7.5wt%至约15.7wt%、约5wt%、约6wt%、约7.5wt%、约10wt%或者约15.7wt%的一种或多种多肽(如本发明中所述),基于稳定细胞的介质的总重量。
白蛋白
任何白蛋白或白蛋白衍生物均可用于本发明稳定细胞的介质中。
白蛋白的非限制性实例包括血清白蛋白(例如:人血清白蛋白或hsa)、血浆白蛋白(例如:人血浆白蛋白)、牛血清白蛋白和/或合成血清白蛋白、卵白蛋白、植物白蛋白或上述的组合。白蛋白的非限制性实例还包括胎牛血清。
白蛋白可以是天然来源的(例如,从天然来源纯化)或重组来源的(重组白蛋白)。在一个实施方案中,通过从人源的生物材料中纯化产生白蛋白。其可通过用于分级来自血液的血浆的常规技术(cohn等人,j.am.chem.soc.68(1946)459pp)或者通过根据j.liautaud等人描述的技术(13thinternationaliabsconference,budapest;a:"purificationofproteins.developmentofbiologicalstandard",karger(ed.),bale,27(1973)107pp)从人胎盘提取得到。在一个实施方案中,重组白蛋白在真核宿主中产生。
在一个实施方案中,术语“白蛋白”包括由该蛋白质的多态性产生的任何人白蛋白的天然变体。
水凝胶
在一些实施方案中,本发明的稳定细胞的介质是水凝胶。在一些实施方案中,本发明的稳定细胞的介质是热可逆水凝胶,其响应于温度的变化从可流动状态(液态)转变到凝胶的状态。在一些实施方案中,本发明的稳定细胞的介质在相转变温度或高于相转变温度时处于自由流动或液相,并在低于相转变温度时处于凝胶相(固相、非流动相)。请参阅美国专利号6,231,881和6,730,315。
在一些实施方案中,本发明的稳定细胞的介质在高于相变温度具有流体相(例如,明胶溶液)并且在相变温度或在低于相变温度具有凝胶相(例如,明胶水凝胶)。在一些实施方案中,流体相和凝胶相之间的转化是连续过程。在一些实施方案中,在凝胶相中,稳定细胞的介质的胶凝程度提供可操作的水凝胶。在一些实施方案中,相变温度也可以是临界温度,在该温度稳定细胞的介质的粘度确保稳定细胞的介质是可操作的水凝胶。在一些实施方案中,相变温度是熔点。
在一些实施方案中,稳定细胞的介质的相转变温度范围为约20℃至约45℃、约20℃至约40℃、约21℃至约39℃、约22℃至约38℃、约23℃至约37℃、约25℃至约37℃、约28℃至约37℃、约30℃至约37℃、约32℃至约37℃、高于约37℃或者约37℃。
在一些实施方案中,处于其液相的稳定细胞的介质与生物材料(例如:细胞、组织、器官、病毒颗粒等)组合/混合以形成混合物。
在一些实施方案中,将稳定细胞的介质置于约20℃至约45℃、约20℃至约40℃、约21℃至约39℃、约22℃至约38℃、约23℃至约37℃、约25℃至约37℃、约28℃至约37℃、约30℃至约37℃、约32℃至约37℃、高于约37℃或者约37℃,使其液化(或使其保持在液态),然后与生物材料(例如:细胞、组织、器官、病毒颗粒等)混合以形成混合物。
在一些实施方案中,稳定细胞的介质的胶凝时间为约5分钟至约1小时、约5分钟至约50分钟、约5分钟至约40分钟、约5分钟至约30分钟、约8分钟至约30分钟、约10分钟至约30分钟、约15分钟至约25分钟、约20分钟至约30分钟或者约10分钟至约20分钟。如本发明所用,术语“胶凝时间”是指本发明的稳定细胞的介质从其流体相转变为其凝胶相所需的时间。
在一些实施方案中,稳定细胞的介质(凝胶相的稳定细胞的介质)的胶冻值(bloomvalue)为约125至约225、约175至约225、约190至约225、约175至约325、约190至约325、约225至约325、至少或者等于约175、至少或者等于约190、至少或者等于约225、约190或者约200。
其他组分
在一些实施方案中,稳定细胞的介质还包含糖类、氨基酸、细胞因子、脂质、生长因子、抗生素(例如:青霉素、链霉素等)、抗霉菌素、类固醇激素、蛋白质激素、血清、氨基酸类似物、氨基酸衍生物和二价阳离子螯合剂例如乙二胺四乙酸(edta)或其盐类、蛋白质、盐类、甲酰胺、甲氧基化的化合物和/或聚合物(例如:聚乙烯吡咯烷酮和聚乙烯醇)或其组合。在一些实施方案中,稳定细胞的介质还包含甘氨酸、甘油、蔗糖、葡萄糖或其组合。
在一些实施方案中,稳定细胞的介质包含约300mg/l至约8,000mg/l、约500mg/l至约7,000mg/l、约1000mg/l至约6000mg/l、约1000mg/l至约4500mg/l、约500mg/l至约2300mg/l、约1,000mg/l、约4,500mg/l、约500mg/l或者约2,300mg/l的葡萄糖。
糖类(saccharides)
糖类包括:寡糖例如单糖、二糖、多糖等。糖类包括糖(sugars)。
糖类的非限制性实例包括:蔗糖、山梨醇、葡萄糖、果糖、半乳糖、海藻糖、甘露糖、棉子糖、水苏糖、葡聚糖、木糖、阿拉伯糖、甘露醇、木糖醇、肌醇、乳糖、麦芽糖、纤维二糖、乳糖醇、麦芽糖醇、甲基纤维素、羧甲基纤维素、糖原、直链淀粉、支链淀粉、菊粉、海藻酸钠、乙基纤维素、羟乙基纤维素、黄原胶、葡萄糖胺、半乳糖胺及其组合。请参阅美国专利号6,673,607和7,094,601。
氨基酸
本发明的稳定细胞的介质可包含一种或多种氨基酸或不包含一种或多种氨基酸。
氨基酸包括旋光异构体,即d-异构体和l-异构体。氨基酸包括α-氨基酸、β-氨基酸、γ-氨基酸、δ-氨基酸和非天然氨基酸。氨基酸的非限制性实例包括:丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、色氨酸、蛋氨酸、甘氨酸、丝氨酸、苏氨酸、半胱氨酸、谷氨酰胺、天冬酰胺、酪氨酸、赖氨酸、精氨酸、天冬氨酸、谷氨酸及其组合。请参阅cryobiology,41(4):257-279(2000)。
氨基酸衍生物也可用于本发明的组合物和方法中。氨基酸衍生物的非限制性实例包括:氨基酸盐类和氨基酸溶剂化物。氨基酸盐的非限制性实例包括:碱金属盐类或碱土金属盐类,例如:钠盐、钾盐和钙盐;氢卤酸盐类,例如:氢氟酸盐、盐酸盐、氢溴酸盐和氢碘酸盐;无机酸盐类,例如:硝酸盐、高氯酸盐、硫酸盐和磷酸盐;和有机酸盐类,例如:富马酸盐、琥珀酸盐、柠檬酸盐、草酸盐、马来酸盐、乙酸盐、乳酸盐和抗坏血酸盐。氨基酸溶剂化物的非限制性实例包括水合物、醇化物(例如,甲醇化物、乙醇化物)和醚合物(例如,乙醚合物)。
在一些实施方案中,本发明的稳定细胞的介质中的氨基酸浓度为0.01-10.0重量%,或0.1-1.0重量%。
维生素
在另一个实施方案中,稳定细胞的介质还包含一种或多种维生素。维生素的非限制性实例包括d-泛酸钙、氯化胆碱、叶酸、烟酰胺、盐酸吡哆醇、盐酸硫胺素和核黄素。
盐类
在一些实施方案中,所述稳定细胞的介质还包含一种或多种盐类,其包括无机盐和/或有机盐。无机盐的实例包括:氯化钾、碳酸氢钠、氯化钠和磷酸二氢钠、磷酸二氢钾、磷酸氢二钾、碳酸氢钠、氯化钙、氯化镁、碳酸氢钾、单磷酸钾及其组合,但不局限于此。
在一些实施方案中,稳定细胞的介质或组合物不包含血清。在一些实施方案中,稳定细胞的介质或组合物不包含任何直接人或动物来源的原料,或使用人或动物来源的材料生产的材料。
稳定细胞的介质或组合物可包含其他任选组分,包括但不限于肽、其他蛋白质、糖醇、氨基糖、糖蛋白和醇、ph控制剂、保湿剂、防腐剂、粘度控制剂,或其组合。请参阅美国专利号9,055,739。
解冻(thawing)
在一些实施方案中,与本发明稳定细胞的介质混合之前或期间,将生物材料(细胞、组织、器官)从冷冻保存(冷冻保存的状态)解冻(或已经解冻)。
用于保存生物材料的适当储存条件可包括维持生物材料存活的任何此类条件。此类条件可包括在或低于约0℃、在或低于约-20℃、在或低于约-50℃、在或低于约-60℃、在或低于约-70℃、在或低于约-80℃、在或低于约-90℃、在或低于约-100℃、在或低于约-110℃、在或低于约-120℃、在或低于约-135℃、在或低于约-196℃的冷冻保存温度或者在液氮中。对于低温保存,温度可以在0至8℃之间。在冷冻干燥样品的情况下,温度可以是0℃以上(例如:室温、环境温度等)或0℃以下的任何温度,只要材料远离湿气即可。
生物材料可以在保存状态(例如,冷冻保存状态)保持数天、数周、数月或数年,直到需要生物材料。当需要时,回收冷冻保存的生物材料并解冻。
在一些实施方案中,冷冻保存组合物中的生物材料在约42℃或低于约42℃、约10℃至约40℃、约20℃至约37℃、室温或者约37℃在水浴中(例如:将冷冻管或冷冻瓶放置在水浴中)解冻。
在一个实施方案中,冷冻保存组合物中的生物材料在约37℃的水浴中解冻。任选地,然后将其移至较低温度,例如4℃或冰上。
在一些实施方案中,使用“渐进(stepup)”解冻过程,其具有渐进加热速率(或升温增快速率)。例如,可以将冷冻瓶置于温度升高的顺序存储环境中,然后转移到体温附近的温度,例如温度约为37℃的水浴,或任何其他合适的温度。
在一些实施方案中,解冻冷冻保存组合物中的冷冻保存的生物材料的升温速率为约5℃/min至约80℃/min、约10℃/min至约70℃/min、约10℃/min至约60℃/min、约10℃/min至约50℃/min、约10℃/min至约40℃/min、约10℃/min至约30℃/min、约10℃/min至约20℃/min、约20℃/min至约40℃/min、大于约20℃/min、大于约25℃/min、大于约30℃/min、大于约35℃/min、大于约40℃/min或者约30℃/min。
在一些实施方案中,在解冻后,在用本发明的稳定细胞的介质处理之前或之后,将生物材料洗涤、悬浮于适当的介质中并且按需要处理以用于后续研究或临床应用。
在一些实施方案中,在解冻后并且在用本发明的稳定细胞的介质处理后,将细胞移至培养皿中进行再次培养。在研究或临床应用之前,细胞可以在合适的条件下培养约30分钟、约1小时、约6小时、约12小时、约24小时、约48小时、约72小时、约86小时、约110小时、约1周、约2周或者超过3周。请参阅美国专利公开号20170196221。
在一些实施方案中,在解冻后和用本发明的稳定细胞的介质处理后,立即再培养贴壁细胞或半贴壁细胞的复苏。
在一些实施方案中,在解冻后和用本发明的稳定细胞的介质处理后,生物材料在体内使用而无需介入的培养步骤。
在一些实施方案中,在解冻后和用本发明的稳定细胞的介质处理后,可以将细胞重新悬浮在适合于预期用途的流体或其他介质中。例如,细胞可以重悬于任何渗透支持的溶液中。在一些实施方案中,细胞可以重悬于生理上相容的缓冲液中,例如本发明所述的缓冲液。优选地,提供用于体内方便递送的组合物的任何生理学相容性材料可用于重悬细胞。
细胞存活率(viabilityofcells)
本发明的组合物和方法维持细胞存活率。
如本发明所用,术语“存活率”是指活的生物材料(例如细胞,例如,基于dna和/或完整细胞膜系统的存在,或活病毒)的百分比。在一些实施方案中,活的生物材料是指包含一些活细胞或细胞部分的生物材料,所述细胞或细胞部分具有代谢活性或在从保存状态释放后将变得具有代谢活性。
在一些实施方案中,生物材料(例如,细胞或病毒)的存活率为至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或者至少约95%。
在一些实施方案中,本发明组合物和方法确保细胞展示出有限量的或最小程度的细胞坏死和凋亡。在一些实施方案中,观察到小于约25%、小于约20%、小于约15%、小于约10%、小于约5%或小于约1%的细胞坏死和/或凋亡。
可以通过本领域已知的任何方法测量存活率。在一些实施方案中,存活率使用锥虫蓝内摄试验或通过测量碘化丙锭摄取来测量。在一些实施方案中,存活率通过测定细胞有效附着的能力(例如,附着测定)来测量。在一些实施方案中,增殖测定可用于确定附着的细胞在冷冻保存后是否可如预期的那样增殖。可以将附着和增殖效率与未经历冷冻保存的对照细胞进行比较。
本领域已知有各种测试来确定细胞的存活率和功能。在一些实施方案中,这些测试取决于细胞类型和细胞的所需用途。
对于干细胞或祖细胞,本发明所述的方法可进一步确保细胞保持其多能性。这可以通过确定谱系特异性标志物的表达来确定。例如,间质干细胞的功能表征可以包括使用市售的分化试剂盒和rt-pcr在体外诱导脂肪形成、成骨和软骨形成的分化以检测mrna的谱系特异性表达,其指示脂肪形成,成骨和软骨形成的分化潜力。类似地,可以通过分离mrna和测试细胞特异性标记来测试未分化干细胞的质量。在特定的实施方案中,保持分化成指定谱系的细胞的能力,即,与未处理的细胞没有显著差异。胚胎干(es)细胞的多能性可以使用本领域已知的方法测试,包括例如oct4-gfp表达、升高的碱性磷酸酶表达和ssea-1表面糖蛋白表达。可以应用几种体外方法来评估实验处理后的干细胞恢复。这些评估可包括但不限于膜完整性、代谢和其他功能测定和/或培养中的菌落生长,以及荧光测定,例如syto/eb。在一些实施方案中,可以使用分化测试、免疫表型表征和/或形态学检查来测定干细胞和/或祖细胞。
对于受精卵,可以确定卵裂率并与对照组比较以确定是否存在任何细胞损伤。卵母细胞的存活率可以通过检查冷冻保存后细胞的形态特征来确定。形态上存活的卵母细胞表现出完整的透明带和质膜和折射细胞质,而当在光学显微镜下观察时,未存活的卵母细胞看起来变性(degenerated)。卵母细胞存活和功能的最终标准是它们在体外和体内受健康精子受精的能力,然后是卵裂、胚泡和/或孵化或胎儿发育。参阅美国专利号9,538,745。
在一些实施方案中,本发明的保存组合物和方法以及生物材料可用于研究和/或临床应用(例如,基于细胞的疗法、移植、再生医学、诊断和基因测试、用于监视的细胞/组织库、毒性试验和体外受精)。
生物材料
术语“生物材料”表示细胞、细胞聚集体、组织、器官、生物流体、病毒颗粒和任何其他膜实体,例如脂质体(天然或合成的)。
可以用本发明的组合物(例如,稳定细胞的介质)和方法处理任何类型的细胞或组织。
在一些实施方案中,细胞是指哺乳动物细胞,包括人的细胞、鼠的细胞、猪的细胞、犬的细胞、马的细胞和牛的细胞,但不局限于此。细胞可来自濒危或受威胁物种的哺乳动物。细胞可来自人类或非人类哺乳动物,例如:猕猴家族(cercopithecoideafamily)、类人超家族(hominoideasuperfamily)、犬属家族(canisfamiliaris)、猫属家族(feliscatus)、仓鼠科(cricetidaespp.)、马属(equusspp.)(例如,家马(equuscaballus)、equusassinus)、马科家族(equidaefamily)、欧洲牛、瘤牛、牛科家族(bovidaefamily)、骆驼科家族(camelidaefamily)、印度水牛、山羊(capraaegagrushircus)、鹿科家族(cervidaefamily)、鹿亚科家族(cervinaefamily)、绵羊、大角羊(oviscanadensis)、家山羊(caprahircus)、家猪(susscrofadomestica)、金仓鼠属(mesocricetusspp.)、鼬属、豚鼠、长爪沙鼠、毛丝鼠属、褐家鼠、屋顶鼠、小家鼠、兔科家族(leporidaefamily)、穴兔、水羚羊属、鸡属、火鸡(meleagriagallopavo)、鸭科、林鼬、家鸽、野鸽、吐绶鸡、鸭嘴兽、冠孔雀、野牛、驼鸟属、美洲驼(lamaglama)、美洲鸵属、鸸鹋属、羊驼(lamapacos)、驯鹿(rangifertarandus)、牦牛(bosgrunniens)、双峰驼(camelusbactrianus)、单峰驼(camelusdromedarius)以及任何濒危或受威胁的物种。
本发明组合物和方法可用于处理微生物、细菌、非哺乳动物细胞(例如:昆虫细胞、禽类细胞、鱼类细胞等)或植物细胞。
细胞的非限制性实例包括干细胞、祖细胞、胚胎、精子、卵母细胞、配子母细胞和受精卵。
细胞可以是肿瘤细胞或非肿瘤细胞。在一个实施方案中,细胞是成纤维细胞。
生物材料可以包括以下任何一种:成纤维细胞、干细胞、祖细胞、全血或其部分、红细胞、白细胞、脐带血或其部分、脐带血细胞、骨髓、卵母细胞、精子、卵子、胚胎、软骨、卵巢、心脏、皮肤、肾脏、肝脏、肺脏,但不局限于此。另外,所述生物材料可以包含细胞生物体,其可以是真核生物或原核生物,其包括:细菌和酵母等。另外,生物材料还可以包含能够存活于冷冻保存的所有多细胞生物,例如:线虫。血液部分可以包括血液的任何部分,其包括血细胞(白细胞和/或红细胞)、血浆和/或溶质和/或亚细胞组分(例如:细胞的部分,例如:血小板、降解细胞的组分等)、蛋白质、脂质、抗体等。
本发明的组合物和方法可用于处理任何类型的细胞,包括但不限于衍生自组织和器官的细胞物质,包括但不限于胰岛细胞、软骨细胞、神经源细胞、肝源细胞、眼源细胞、整形外科源细胞、结缔组织细胞、再生源细胞、心脏和心血管源细胞。
干细胞包括成体干细胞、胚胎干细胞、诱导多能干细胞(ipsc)、外围血干细胞、脐带血干细胞、间质干细胞,源自组织和器官或其他来源的干细胞,包括胎儿和/或胚胎来源,以及干细胞与其他细胞和不同来源的混合物。成体干细胞包括:骨髓干细胞、造血干细胞、皮肤干细胞、眼睛干细胞、神经干细胞、心脏干细胞等。
在一些实施方案中,内胚层来源的干细胞是指肺上皮干细胞、胃肠道干细胞、胰腺干细胞或肝椭圆形红细胞(hepaticovalcell)和/或其祖细胞。在特定的实施方案中,泌尿生殖来源的细胞被分类为乳腺和前列腺干细胞或者卵巢和睾丸干细胞和/或其祖细胞。在特定的实施方案中,中胚层来源的细胞是骨髓细胞、造血干细胞、基质干细胞或心脏干细胞和/或其祖细胞。在特定的实施方案中,外胚层来源的细胞是神经干细胞、皮肤干细胞或眼睛干细胞和/或其祖细胞。
可以使用本发明的组合物(例如:稳定细胞的介质)和方法处理的细胞类型包括:例如分化的细胞(例如:成纤维细胞、上皮细胞、心肌细胞、肝细胞、神经细胞、表皮细胞、角化细胞、造血细胞、黑素细胞、软骨细胞、b细胞、t细胞、红细胞、巨噬细胞,单核细胞或肌细胞)和未分化的细胞(例如:胚胎干细胞、间质干细胞或成体干细胞)。细胞可以是单倍体、二倍体或四倍体。其他细胞包括来自膀胱、脑、食管、输卵管、心脏、肠、胆囊、肾、肝、肺、卵巢、胰腺、前列腺、脊髓、脾、胃、睾丸、胸腺、甲状腺、气管、输尿管、尿道或子宫的细胞。
在进一步特定的实施方案中,细胞来自成人的脑、骨髓、血管、骨骼肌、皮肤、牙齿、心脏、肠、肝脏或其他成人组织。在特定的实施方案中,细胞选自内胚层、泌尿生殖器、中胚层或外胚层来源。
组织包括:角膜、软骨、骨骼、皮肤、心脏瓣膜、胰岛、来自人类、动物、鱼类、贝类和植物的胚胎以及来自人和动物的卵巢组织。本发明组合物和方法也可处理工程化组织和组织构建体。
在一些实施方案中,本发明的组合物和方法可用于处理辅助生殖技术中的卵母细胞或精子,或用于接受化学疗法或放射疗法的患者。该方法还可用于干细胞的处理,然后干细胞可用作基于干细胞的疗法、细胞移植、组织工程和再生医学的基础。该方法还可用于处理动物的卵母细胞或精子,这种动物很少或有灭绝的危险,以备将来用于辅助生殖技术以保护物种。该方法可进一步用于畜牧业目的(例如,动物的繁殖和饲养),例如,用于处理来自动物如牛、猪和绵羊的胚胎干细胞、配子体、卵母细胞或精子。
生物材料可用于治疗各种疾病。举例来说,在数个实施方案中,眼细胞用于治疗眼病,包括但不限于年龄相关性黄斑变性(湿或干)、糖尿病性黄斑水肿、特发性脉络膜新血管形成或高度近视性黄斑变性。在一些眼睛实施方案中,使用rpe细胞。在数个实施方案中,心脏干细胞被用于治疗心血管疾病,例如:心肌梗塞、缺血性心脏组织损伤、充血性心力衰竭、动脉瘤、动脉粥样硬化诱发事件、脑血管意外(中风)和冠状动脉疾病。在数个实施方案中,肝干细胞用于治疗肝病,例如:肝炎、肝硬化、癌症等。可使用本发明的方法和装置治疗其他组织中的疾病,例如:肾、肺、胰脏、肠、骨和/或软骨以及神经组织等。在一些实施方案中,收取的骨髓干细胞可用于重建由于白血病、癌症或减少血细胞计数的疗法而减少的造血细胞。
本发明的组合物和方法也可用于各种治疗方法。细胞疗法或细胞治疗通常可包括人或动物细胞的移植以替换或修复受损组织和/或细胞。细胞疗法已用于重建关节受损软骨、修复脊髓损伤、加强弱化的免疫系统、治疗自身免疫性疾病,并帮助患有阿尔茨海默病、帕金森病和癫痫等神经系统疾病的患者。进一步的用途包括治疗各种慢性疾病,例如动脉硬化、先天性缺陷和性功能障碍。
细胞疗法通常包括注射异种的(xenogenic)、同种的(allogenic)(来自另一个人供体)或自体的(autologous)(其中细胞被取出并移植回相同的患者)的全细胞或细胞提取物。
病毒或病毒颗粒可以是任何病毒。在一些实施方案中,病毒或病毒颗粒包含:腺病毒、腺相关病毒、逆转录病毒、疱疹病毒等。在一些实施方案中,病毒或病毒颗粒是可用于基因疗法的那些病毒或病毒颗粒。
试剂盒
本发明还提供了试剂盒,其包含本发明的稳定细胞的介质(本发明中所述的固体或液体形式)或组合物。这样的试剂盒可以包括一个或多个含有稳定细胞的介质或本发明组合物的容器。在一个实施方案中,试剂盒包含稳定细胞的介质或本发明组合物(其可以包含或不包含生物材料)。在一个实施方案中,试剂盒包含生物材料,其用于用本发明的稳定细胞的介质处理。
在一些实施方案中,试剂盒可以包含使用的说明书且应用于本发明中的任何方法中。在一个实施方案中,试剂盒包含用稳定细胞的介质和方法处理生物材料的说明书。所述试剂盒可以进一步包含基于鉴定所述受试者是否需要所述治疗来选择适合于治疗的受试者的说明。在一些实施方案中,说明书包括将用本发明稳定细胞的介质处理的生物材料给予需要治疗的受试者的说明。在一些实施方案中,试剂盒中提供的说明书是标签或包装插页上的书面说明书。标签或包装插页还可指示生物材料的临床和/或研究应用。
试剂盒的多个部分可以同时或按时间顺序交错使用,即,在不同的时间点使用,并且对于试剂盒的任何组分具有相同或不同的时间间隔。可以选择时间间隔以获得期望的效果。
本发明所提供的试剂盒是置于合适的包装中。其中,合适的包装包括小瓶(例如:冷冻瓶)、瓶、安瓿、管(例如:冷冻管)、袋、烧瓶、罐、软包装等,但不局限于此。此外还包含了与特定装置(例如:冷冻容器、冷冻瓶和/或冷冻管)组合使用的包装。
试剂盒任选地可提供额外的组分,例如:缓冲液和说明信息(interpretiveinformation)。通常,试剂盒包括容器和容器上或与容器相关联的标签或包装插页。在一些实施方案中,本发明提供了包含上述试剂盒的内容物的制品。
以下是本发明的实施例,但不应成为限制条件。
实施例1
实验编号1
明胶是从gelita购得(明胶是由牛皮所制备而成;批号:l600217)。通过将明胶溶解在dmem中制备含有15.7wt%明胶的稳定细胞的介质。
将包含甘油的冷冻保存组合物中的胎儿皮肤成纤维细胞fe002-sk2细胞从冷冻保存中解冻。然后将该细胞悬浮液与稳定细胞的介质混合以形成混合物。
作为对照样品,将包含甘油的冷冻保存组合物中的细胞从冷冻保存中解冻,然后将细胞悬浮液与dmem混合以形成混合物。
稳定细胞的介质(或对照样品的dmem)与细胞悬浮液的体积比为12.5。细胞(在细胞悬浮液中)和稳定细胞的介质(或对照样品的dmem)通过使用1000μl
混合物在30℃或37℃温育0小时(时间为0代表没进行温育)、2小时或4小时。对于每种条件,将样品重复两次。全部细胞总数、活细胞数和死细胞数则使用adam-mc自动细胞计数器(digitalbio)进行测定。细胞存活率通过下式计算:[(活细胞数)/(总细胞数)]×100%。
如表1中所示,包含明胶的稳定细胞的介质中的细胞在30℃或37℃温育2小时或4小时后保持其存活率。换句话说,在30℃或37℃温育2小时或4小时后,细胞的存活率与它们在时间0时的存活率相似。相比之下,与dmem混合的细胞的存活率在30℃或37℃温育2小时或4小时后降低了约48%(2小时)或56%(4小时)。该实验证实了含有明胶的稳定细胞的介质的保护作用。
表1
实验编号2
明胶是从gelita购得(批号l600217)。通过将明胶溶解在水中而制备含有15.7wt%明胶的稳定细胞的介质。
将包含甘油的冷冻保存组合物中的细胞从冷冻保存中解冻。然后将该细胞悬浮液与稳定细胞的介质混合以形成混合物。稳定细胞的介质与细胞悬浮液的体积比为12.5。细胞(在细胞悬浮液中)和稳定细胞的介质通过使用1000μl
将混合物在37℃温育0小时(时间0代表没进行温育)、1小时、2小时、4小时、8小时或24小时。对于每种条件,将样品重复两次。全部细胞总数、活细胞数和死细胞数则使用adam-mc自动细胞计数器(digitalbio)进行测定。如本发明所述计算细胞的存活率。
如表2中所示,包含明胶的稳定细胞的介质中的细胞在37℃温育长达4小时(1小时,2小时或4小时)后保持其存活率。换句话说,在37℃温育长达4小时后,细胞的存活率与它们在时间0时的存活率相似。在37℃温育8小时后,细胞存活率仍然可以维持在超过70%。该实验证实了含有明胶的稳定细胞的介质的保护作用。
表2
实验编号3
明胶是从gelita购得(批号:l600217)。通过将明胶溶解在水中制备含有15.7wt%明胶的稳定细胞的介质。
将包含dmso的冷冻保存组合物中的细胞从冷冻保存中解冻。然后将该细胞悬浮液与稳定细胞的介质混合以形成混合物。作为对照样品,将包含dmso的冷冻保存组合物中的细胞从冷冻保存中解冻,然后将细胞悬浮液与dmem或10%fbs/dmem混合以形成混合物。
稳定细胞的介质(或对照样品的dmem)与细胞悬浮液的体积比为10。细胞(在细胞悬浮液中)和稳定细胞的介质(对照样品的dmem或10%fbs/dmem)通过使用1000μl
混合物在25℃温育0小时(时间0代表没进行温育)、2小时、4小时或8小时。对于每种条件,将样品重复两次。全部细胞总数、活细胞数和死细胞数则使用adam-mc自动细胞计数器(digitalbio)进行测定。计算细胞存活率。
如表3中所示,包含明胶的稳定细胞的介质中的细胞在25℃温育2小时或4小时后保持其存活率。换句话说,在25℃温育2小时或4小时后,细胞的存活率与它们在时间0时的存活率相似。在25℃温育8小时后,细胞存活率仍然可以维持到高于80%。相反,在25℃培养长达8小时后,与dmem混合的细胞的存活率降低约13%(2小时),21%(4小时)或32%(8小时)。类似地,在25℃温育长达8小时后,与10%fbs/dmem混合的细胞的存活率降低约19%(2小时)或34%(4小时或8小时)。该实验证实了含有明胶的稳定细胞的介质的保护作用。
表3
实验编号4
明胶是从nippi购得(明胶是由牛、猪和/或鱼等来源所制备而成;批号:s150806)。通过将明胶溶解在水中制备含有10wt%明胶的稳定细胞的介质。
将包含甘油的冷冻保存组合物中的细胞从冷冻保存中解冻。然后将该细胞悬浮液与稳定细胞的介质混合以形成混合物。稳定细胞的介质与细胞悬浮液的体积比为12.5。
与实验1-3不同,在该实验中,细胞(细胞悬浮液中)和稳定细胞的介质通过使用带针的注射器抽吸而混合。在临床环境中,连接到注射器的18g针将用于吸出并混合细胞和稳定细胞的介质。
混合物在37℃温育0小时(时间为0代表没进行温育)、2小时、4小时、6小时、8小时或24小时。对于每种条件,将样品重复两次或重复三次。全部细胞总数、活细胞数和死细胞数则使用adam-mc自动细胞计数器(digitalbio)进行测定。如本发明所述计算细胞的存活率。
如表4中所示,包含明胶的稳定细胞的介质中的细胞在37℃温育长达6小时(2小时,4小时或6小时)后保持其存活率。换句话说,在37℃温育长达4小时后,细胞的存活率与时间0时的存活率相似。在37℃温育8小时后,细胞存活率略有下降。在37℃温育24小时后,细胞存活率降低至约30%。该实验证实了含有明胶的稳定细胞的介质的保护作用。
表4
如本发明所用,“sd”代表标准偏差。
实验编号5
明胶是从nippi购得(批号:s150806)。通过将明胶溶解在水中而制备含有10wt%明胶的稳定细胞的介质。
将包含甘油的冷冻保存组合物中的细胞从冷冻保存中解冻。然后将该细胞悬浮液与稳定细胞的介质混合以形成混合物。稳定细胞的介质与细胞悬浮液的体积比为12.5。
使用带针的注射器通过抽吸混合细胞(细胞悬浮液中)和稳定细胞的介质。在临床环境中,连接到注射器的18g针将用于抽吸并混合细胞和稳定细胞的介质。
混合物在25℃或30℃温育0小时(时间为0代表没进行温育)、2小时、4小时、6小时、8小时、24小时或72小时。对于每种条件,将样品重复两次或重复三次。全部细胞总数、活细胞数和死细胞数则使用adam-mc自动细胞计数器(digitalbio)进行测定。如本发明所述计算细胞的存活率。
如表5中所示,包含明胶的稳定细胞的介质中的细胞在25℃温育长达24小时(2小时,4小时,6小时,8小时或24小时)后保持其存活率。换句话说,在25℃温育长达24小时后,细胞的存活率与它们在时间0时的存活率相似。包含明胶的稳定细胞的介质中的细胞在30℃温育长达8小时(2小时,4小时,6小时或8小时)后保持其存活率。换句话说,在30℃温育长达8小时后,细胞的存活率与它们在时间0时的存活率相似。在30℃温育24小时后,细胞存活率仍然可以维持超过70%。
表5
实验编号6
明胶是从nippi购得(批号:s150806)。通过将明胶溶解在水中而制备含有5wt%明胶的稳定细胞的介质。
将包含甘油的冷冻保存组合物中的细胞从冷冻保存中解冻。然后将该细胞悬浮液与稳定细胞的介质混合以形成混合物。
作为对照样品,将包含甘油的冷冻保存组合物中的细胞从冷冻保存中解冻,然后将细胞悬浮液与dmem混合以形成混合物。
稳定细胞的介质(或对照样品的dmem)与细胞悬浮液的体积比为12.5。细胞(在细胞悬浮液中)和稳定细胞的介质(或对照样品的dmem)通过使用1000μl
混合物在37℃温育0小时(时间为0代表没进行温育)或2小时。全部细胞总数、活细胞数和死细胞数则使用adam-mc自动细胞计数器(digitalbio)进行测定。计算细胞存活率。
如表6中所示,在37℃温育2小时后,与含有明胶的稳定细胞的介质混合的细胞的存活率高于与dmem混合的细胞的存活率。
表6
实验编号7
明胶是从nippi购得(批号:s150806)。通过将明胶溶解在水中而制备含有6wt%明胶的稳定细胞的介质。
将包含甘油的冷冻保存组合物中的细胞从冷冻保存中解冻。然后将该细胞悬浮液与稳定细胞的介质混合以形成混合物。
作为对照样品,将包含甘油的冷冻保存组合物中的细胞从冷冻保存中解冻,然后将细胞悬浮液与dmem混合以形成混合物。
稳定细胞的介质(或对照样品的dmem)与细胞悬浮液的体积比为12.5。使用1000μl
混合物在37℃温育0小时(时间为0代表没进行温育)或2小时。全部细胞总数、活细胞数和死细胞数则使用adam-mc自动细胞计数器(digitalbio)进行测定。计算细胞存活率。
如表7中所示,在37℃温育2小时后,与含有明胶的稳定细胞的介质混合的细胞的存活率高于与dmem混合的细胞的存活率。
表7
实验编号8
明胶是从nippi购得(批号:s150806)。通过将明胶溶解在水中而制备含有7.5wt%明胶的稳定细胞的介质。
将包含甘油的冷冻保存组合物中的细胞从冷冻保存中解冻。然后将该细胞悬浮液与稳定细胞的介质混合以形成混合物。
作为对照样品,将包含甘油的冷冻保存组合物中的细胞从冷冻保存中解冻,然后将细胞悬浮液与dmem混合以形成混合物。
稳定细胞的介质(或对照样品的dmem)与细胞悬浮液的体积比为12.5。使用1000μl
混合物在37℃温育0小时(时间为0代表没进行温育)或2小时。全部细胞总数、活细胞数和死细胞数则使用adam-mc自动细胞计数器(digitalbio)进行测定。计算细胞存活率。
如表8中所示,在37℃温育2小时后,与含有明胶的稳定细胞的介质混合的细胞的存活率高于与dmem混合的细胞的存活率。
表8
实验编号9
明胶是从gelita购得(批号:l600217)。通过将明胶溶解在水中而制备含有15.7wt%明胶的稳定细胞的介质。
将包含甘油的冷冻保存组合物中的细胞从冷冻保存中解冻。然后将该细胞悬浮液与稳定细胞的介质混合以形成混合物。
稳定细胞的介质与细胞悬浮液的体积比为6.25。使用1000μl
混合物在27℃或37℃温育0小时(时间0代表没进行温育)、2小时或4小时。对于每种条件,将样品重复两次。全部细胞总数、活细胞数和死细胞数则使用adam-mc自动细胞计数器(digitalbio)进行测定。计算细胞存活率。
如表9中所示,包含明胶的稳定细胞的介质中的细胞在27℃或37℃温育2小时或4小时后保持其存活率。换句话说,在27℃或37℃温育2小时或4小时后,细胞的存活率与它们在时间0时的存活率相似。
表9
实验编号10
明胶是从gelita购得(批号:l600217)。通过将明胶溶解在水中而制备含有15.7wt%明胶的稳定细胞的介质。
将包含甘油的冷冻保存组合物中的细胞从冷冻保存中解冻。然后将该细胞悬浮液与稳定细胞的介质混合以形成混合物。稳定细胞的介质与细胞悬浮液的体积比为12.5。
使用带针的注射器通过抽吸混合细胞(细胞悬浮液中)和稳定细胞的介质。在临床环境中,将连接到注射器的18g针用于抽吸并混合细胞和稳定细胞的介质。
混合物在23℃、27℃或30℃温育0小时(时间为0代表没进行温育)、1小时或2小时。对于每种条件,将样品重复两次。全部细胞总数、活细胞数和死细胞数则使用adam-mc自动细胞计数器(digitalbio)进行测定。如本发明所述计算细胞的存活率(表10)。
表10
实施例2明胶浓度和温度对细胞存活率的影响
实验条件如表11所示。
表11
制备含有1wt%、3wt%或17wt%明胶的稳定细胞的介质。将稳定细胞的介质在37℃水浴中温育,以确保在与细胞混合之前转化为流体相。
将细胞扩增、收取并冷冻保存。在实验之前,将3至5个fe002-sk2细胞(第12代;p12)(其为胎儿皮肤成纤维细胞)的冷冻管解冻。每个冷冻管在0.4ml中含有3×106细胞。将所有3-5个冷冻管的内容物合并并混合。
对于dmem组:
(1)5倍稀释:将20μl细胞与80μldmem合并(细胞稀释5倍)。计数解冻后细胞的数量。
(2)12.5倍稀释:将20μl细胞与230μldmem混合(细胞稀释12.5倍)。计数解冻后细胞的数量。
对于稳定细胞的介质(包含明胶)组:
(1)5倍稀释,37℃:将200μl细胞和800μl稳定细胞的介质(明胶溶液)加入1.5-mleppendorf管中,并混合。在时间0(t0)分析细胞存活率。将剩余的测试样品在37℃水浴中温育。在以下时间点再次分析细胞存活率:2小时(t2),4小时(t4)和8小时(t8)。
(2)12.5倍稀释,37℃:将200μl细胞和2300μl明胶溶液加入到15ml离心管中,并混合。在时间0(t0)分析细胞存活率。将剩余的测试样品在37℃水浴中温育。在以下时间分析细胞存活率:时间点:2小时(t2)、4小时(t4)和8小时(t8)。
类似地,还在25℃针对5倍稀释和12.5倍稀释测试了细胞存活率。
表12在以不同倍数(5倍或12.5倍)用明胶溶液稀释并在25℃温育后的细胞存活率
表13在以不同倍数(5倍或12.5倍)用明胶溶液稀释并在37℃温育后的细胞存活率
表14在用5倍明胶溶液稀释并在25℃温育后的细胞存活率(原始数据)
表15用12.5倍明胶溶液稀释并在25℃温育后的细胞存活率(原始数据)
表16在用5倍明胶溶液稀释并在37℃温育后的细胞存活率(原始数据)
表17在用12.5倍明胶溶液稀释并在37℃温育后的细胞存活率(原始数据)
讨论
结果显示,与dmem相比,当与包含1wt%、3wt%或17wt%明胶的稳定细胞的介质一起温育时,解冻后细胞存活率更高。在25℃或37℃,与用稳定细胞的介质稀释12.5倍的细胞相比,用稳定细胞的介质稀释5倍的细胞表现出更高和更长的存活率。
实施例3工作明胶浓度对细胞存活率的影响
表18和图1–9显示了明胶的工作浓度对细胞存活率的影响,基于实施例1中的实验编号1-10(“实验1”至“实验10”)和实施例2的数据。
表18
实施例4基于明胶的溶液与用于在解冻后维持细胞存活率的其他溶液之间的比较
材料
adamaccuchip和adam溶液来自nanoentek。dmem和胎牛血清(fbs)来自gibco。牛血清白蛋白来自sigma。
测试溶液(稳定细胞的介质,dmem或fbs)包括:
·溶液a(“溶液a”):dmem
·溶液b(“溶液b”):在dmem中10wt%的明胶
·溶液c(“溶液c”):在dmem中5wt%的白蛋白
·溶液d(“溶液d”):在dmem中10wt%的白蛋白
·溶液e(“溶液e”):在dmem中15.7wt%的白蛋白
·溶液f(“溶液f”):fbs
将成纤维细胞(fe002-sk2)以7.5×106个细胞/ml的浓度在包含甘油的冷冻保存组合物中冷冻。
将1150μl的每种测试溶液af分配到2mleppendorf管中,每种溶液具有3个管。
将冷冻保存的成纤维细胞在37℃水浴中解冻。将所有细胞悬浮液合并到一个管中。将100μl解冻的细胞悬浮液加入到含有1150μl测试溶液的每个eppendorf管中以形成混合物。测试溶液(稳定细胞的介质或dmem或fbs)与细胞悬浮液的体积比为11.5。
将混合物在37℃温育2小时。对于每种条件,将样品重复三次。细胞总数、活细胞数和死细胞数通过使用adam-mc自动细胞计数器(digitalbio)测定。通过下式计算细胞的存活率:[(活细胞数)/(总细胞数)]×100%。
如表19中所示,在37℃温育2小时后,包含明胶的稳定细胞的介质中细胞的存活率约为77.3%。包含5wt%、10wt%或15.7wt%白蛋白的稳定细胞的介质中细胞的存活率分别为约48.7%、49.7%和60.7%。基于明胶的溶液能够比其他测试溶液更好地维持解冻的细胞存活率。
表19与各种测试溶液混合的细胞的存活率
示例性系统和方法在以下条目中列出:
条目1.一种用于维持细胞存活率的方法,所述方法包含以下步骤:将一个或多个细胞与稳定细胞的介质混合而形成混合物,其中所述稳定细胞的介质包含相对于所述稳定细胞的介质总重约5wt%至约15.7wt%的明胶。
条目2.如条目1所述的方法,其中所述稳定细胞的介质包含约5wt%至约7.5wt%的明胶。
条目3.如前述条目中的任一项所述的方法,其中所述稳定细胞的介质包含约10wt%至15.7wt%的明胶。
条目4.如前述条目中的任一项所述的方法,其中所述混合物包含相对于所述混合物总重约0.8wt%至约15.7wt%的明胶。
条目5.如前述条目中的任一项所述的方法,其中所述混合物包含约2.4wt%至约7wt%的明胶。
条目6.如前述条目中的任一项所述的方法,其中所述混合物包含约9.3wt%至约14.6wt%的明胶。
条目7.如前述条目中的任一项所述的方法,其中于混合步骤之前,所述一个或多个细胞被置于细胞悬浮液中。
条目8.如前述条目中的任一项所述的方法,其中所述稳定细胞的介质与细胞悬浮液的体积比范围为约6.25至约12.5。
条目9.如前述条目中的任一项所述的方法,其中所述稳定细胞的介质与细胞悬浮液的体积比范围为约5至约10。
条目10.如前述条目中的任一项所述的方法,其中所述细胞于细胞悬浮液中的浓度为约7.5x105个细胞/ml至约7.5x107个细胞/ml。
条目11.如前述条目中的任一项所述的方法,其中于混合步骤之前,所述一个或多个细胞是在已从冷冻保存状态解冻的冷冻保存组合物中。
条目12.如前述条目中的任一项所述的方法,其中所述冷冻保存状态的温度范围为约-70℃至-200℃。
条目13.如前述条目中的任一项所述的方法,其中所述细胞解冻后的存活率至少为70%。
条目14.如前述条目中的任一项所述的方法,其中所述细胞解冻后的存活率至少为80%。
条目15.如前述条目中的任一项所述的方法,其中所述冷冻保存组合物包含:甘油、二甲基亚砜(dmso)和/或聚乙二醇(peg)。
条目16.如前述条目中的任一项所述的方法,还包含于混合步骤之前,将所述稳定细胞的介质的温度保持于约25℃至约37℃。
条目17.如前述条目中的任一项所述的方法,其中所述明胶具有重均分子量约100千道尔顿(kd)至约200kd。
条目18.如前述条目中的任一项所述的方法,其中所述明胶包含变性的胶原。
条目19.如前述条目中的任一项所述的方法,其中所述稳定细胞的介质是具有胶冻值约190至约325的热可逆水凝胶。
条目20.如前述条目中的任一项所述的方法,其中所述细胞是哺乳动物细胞。
条目21.如前述条目中的任一项所述的方法,其中所述细胞是人的、猪的、狗的、马的或牛的细胞。
条目22.如前述条目中的任一项所述的方法,其中所述细胞包含肿瘤细胞。
条目23.如前述条目中的任一项所述的方法,其中所述细胞包含成纤维细胞。
条目24.如前述条目中的任一项所述的方法,其中所述细胞包含干细胞。
条目25.如前述条目中的任一项所述的方法,其中所述混合物中细胞的浓度为约105个细胞/ml至约107个细胞/ml。
条目26.如前述条目中的任一项所述的方法,其中所述稳定细胞的介质还包含氨基酸、细胞因子、脂质、生长因子、抗生素、抗霉菌素、类固醇激素、蛋白质激素或其组合。
条目27.一种用于细胞维持存活率的方法,所述方法包含以下步骤:将一个或多个细胞与稳定细胞的介质混合而形成混合物,其中所述混合物包含约0.8wt%至约15.7wt%的明胶。
条目28.如前述条目中的任一项所述的方法,其中所述混合物包含约2.4wt%至约7wt%的明胶。
条目29.如前述条目中的任一项所述的方法,其中所述混合物包含约9.3至约14.6wt%的明胶。
条目30.如前述条目中的任一项所述的方法,其中于混合步骤之前,所述一个或多个细胞被置于细胞悬浮液中。
条目31.如前述条目中的任一项所述的方法,其中所述稳定细胞的介质与细胞悬浮液的体积比范围为约6.25至约12.5。
条目32.如前述条目中的任一项所述的方法,其中所述稳定细胞的介质与细胞悬浮液的体积比范围为约5至约10。
条目33.如前述条目中的任一项所述的方法,其中所述细胞于细胞悬浮液中的浓度为约7.5x105个细胞/ml至约7.5x107个细胞/ml。
条目34.如前述条目中的任一项所述的方法,其中于混合步骤之前,所述一个或多个细胞是在已从冷冻保存状态解冻的冷冻保存组合物中。
条目35.如前述条目中的任一项所述的方法,其中所述细胞解冻后的存活率至少为70%。
条目36.如前述条目中的任一项所述的方法,其中所述冷冻保存组合物包含:甘油、二甲基亚砜(dmso)和/或聚乙二醇(peg)。
条目37.如前述条目中的任一项所述的方法,还包含于混合步骤之前,将所述稳定细胞的介质的温度保持于约25℃至约37℃。
条目38.如前述条目中的任一项所述的方法,其中所述明胶具有重均分子量约100千道尔顿(kd)至约200kd。
条目39.如前述条目中的任一项所述的方法,其中所述明胶包含变性的胶原。
条目40.如前述条目中的任一项所述的方法,其中所述细胞是哺乳动物细胞。
条目41.如前述条目中的任一项所述的方法,其中所述细胞是人的、猪的、狗的、马的或牛的细胞。
条目42.如前述条目中的任一项所述的方法,其中所述细胞包含肿瘤细胞。
条目43.如前述条目中的任一项所述的方法,其中所述细胞包含成纤维细胞。
条目44.如前述条目中的任一项所述的方法,其中所述细胞包含干细胞。
条目45.一种组合物,其包含一个或多个细胞以及约0.8wt%至约15.7wt%的明胶。
条目46.如条目45所述的组合物,其包含约2.4wt%至约7wt%的明胶。
条目47.如条目45-46中任一项所述的组合物,其包含约9.3wt%至约14.6wt%的明胶。
条目48.如条目45-47中任一项所述的组合物,其中所述一个或多个细胞已从冷冻保存状态解冻。
条目49.如条目45-48中任一项所述的组合物,其中所述细胞解冻后的存活率至少为70%。
条目50.如条目45-49中任一项所述的组合物,其中所述明胶具有重均分子量约100千道尔顿(kd)至约200kd。
条目51.如条目45-50中任一项所述的组合物,其中所述明胶包含变性的胶原。
条目52.如条目45-51中任一项所述的组合物,其中所述细胞是哺乳动物细胞。
条目53.如条目45-52中任一项所述的组合物,其中所述细胞是人的、猪的、狗的、马的或牛的细胞。
条目54.如条目45-53中任一项所述的组合物,其中所述细胞包含肿瘤细胞。
条目55.如条目45-54中任一项所述的组合物,其中所述细胞包含成纤维细胞。
条目56.如条目45-55中任一项所述的组合物,其中所述细胞包含干细胞。
条目57.一种试剂盒,其包含如条目45至56中任一项所述的组合物。
本发明的范围不受上文具体示出和描述的内容的限制。本领域技术人员将认识到,对于所描述的材料、构造、结构和尺寸的示例存在合适的替代方案。在本发明的描述中引用和讨论了许多参考文献,包括专利和各种出版物。提供这些参考文献的引用和讨论仅仅是为了阐明本发明的描述,而不是承认任何参考文献是本发明所述发明的现有技术。本说明书中引用和讨论的所有参考文献都通过引用整体并入本发明。在不脱离本发明的精神和范围的情况下,本领域普通技术人员将想到本发明所述内容的变化、修改和其他实施方式。虽然已经示出和描述了本发明的一些实施例,但是对于本领域技术人员来说显而易见的是,在不脱离本发明的精神和范围的情况下,可以进行改变和修改。在前面的描述中阐述的内容仅作为说明而不是作为限制。
- 还没有人留言评论。精彩留言会获得点赞!