mRNA的功能化方法与流程
本发明涉及mrna的功能化方法。更具体而言,本发明涉及mrna转运载体的稳定化方法、mrna疫苗等。
背景技术:
mrna递送作为用来安全且持续地供给治疗用蛋白质的方法而备受关注。另一方面,mrna在生物体内会迅速酶解,这是一个重大课题。针对这一课题,正在研究使用mrna转运载体来保护mrna而使其不被分解的方法和对mrna分子本身进行改良的方法,但是,生物体内的rna酶非常强大,因此需要进一步的技术革新。
关于对mrna分子本身进行改良的方法,研究了将mrna的部分碱基置换为经化学修饰的碱基的方法(例如,非专利文献1)。截至目前已经详尽地研究了各种化学修饰碱基,但是并未报道可以大幅提高mrna的耐酶解性的方法。另外,进行修饰的方式屡屡导致从mrna翻译为蛋白质的翻译效率大幅下降,因此进行自由的化学修饰较为困难。
在此,专利文献1记载了一种聚阳离子型聚合物与mrna的聚离子复合物,并且记载了将其用于mrna的递送。另外,非专利文献2中记载了高分子胶束型mrna转运载体的稳定性、酶解的评价和对聚合物进行胆固醇修饰的效果。但是,这些文献没有记载在生物体内不会大幅降低从mrna翻译为蛋白质的翻译效率、但可以提高mrna的耐酶解性的、mrna转运载体的稳定化方法。
另外,减弱病原体的致病性而使用的以往的活疫苗有由于致病性恢复而产生副作用的担心。另外,使病原体丧失致病性而使用的以往的灭活疫苗存在由于不会出现感染细胞而难以诱导细胞免疫的问题。
dna疫苗、mrna疫苗等核酸疫苗使用核酸来呈递抗原蛋白。即,核酸疫苗通过使所给药的核酸转移至抗原呈递细胞的核内或细胞质、使抗原蛋白表达并呈递抗原蛋白,从而激活免疫。核酸疫苗没有致病性恢复的问题,因此认为其安全性高于活疫苗。另外,核酸疫苗由于进行了抗原呈递细胞呈递抗原蛋白、从而能够诱导细胞免疫,因此核酸疫苗的用途能够拓展到癌症、慢性感染症。而且核酸疫苗能够仅通过改变序列来进行比较自由的核酸设计,因此核酸疫苗还具有下述优点:可以用于癌症的个性化治疗;以及,由于能够迅速应对病毒变异,从而能够快速应对大流行病;等。
对于其中的dna疫苗,一般认为,存在由向宿主基因组随机插入所致的诱变风险。另一方面,使用mrna呈递抗原蛋白的mrna疫苗一般认为不存在宿主基因组诱变风险,因此近年备受关注。
为了通过mrna疫苗得到免疫诱导效果,需要在表达抗原蛋白的同时诱发炎症反应。但是,mrna本身的免疫原性低,因此难以诱发炎症反应。因此,一直以来需要除了mrna之外还同时给药用于诱发炎症反应的佐剂(例如专利文献2)。
这样的传统mrna疫苗存在以下3个问题。第一个问题是,在使用外源物质作为佐剂时,需要非常注意其安全性。第2个问题是,当所给药的mrna与佐剂的组织分布不同时,可能不能对表达抗原蛋白的细胞诱发充分的炎症反应。第3个问题是,在对生物体给药mrna时,往往需要转运载体来保护mrna不被酶解,但是转运载体的功能有可能会受佐剂的影响。
在此,非专利文献3记载了将mrna与作为佐剂成分的鱼精蛋白一体化而成的物质作为mrna疫苗。
现有技术文献
专利文献
专利文献1:wo2015/121924a
专利文献2:日本特表2012-502074号公报
非专利文献
非专利文献1:meis,j.e.andchen,f.(2002)epicentreforum9(1),10
非专利文献2:uchida,s.,etal.,biomaterials(2016)82,p.221-228.
非专利文献3:karl-josefkallenetal.,humanvaccines&immunotherapeutics(2013)9:10,p.2263-2276
技术实现要素:
发明要解决的问题
在这样的状况之下,需要功能化mrna。
本发明的第1方式的目的在于,提供mrna转运载体的新的稳定化方法。
本发明的第2方式和第3方式的目的在于,提供能够高效地进行蛋白质表达和免疫诱导的新的mrna疫苗。
用于解决问题的方案
本发明人反复进行了深入研究,结果发现,通过使具有与mrna互补的序列的rna寡聚物与mrna杂交,可以使mrna功能化,从而完成了本发明。
另外,本发明人发现,对具有与mrna互补的序列的rna寡聚物进行化学修饰并使其与mrna杂交则可以进行mrna的化学修饰,由此,可以使该mrna稳定化、或者通过将该mrna搭载于转运载体可以使转运载体稳定化,从而完成了本发明的第1方式。
另外,本发明人发现,通过使具有与编码抗原的mrna的polya(多聚腺苷酸)序列互补的序列的rna寡聚物与mrna杂交,可以由mrna高效地表达蛋白质和诱导免疫等,从而完成了本发明的第2方式。
本发明人还发现,使具有与编码抗原的mrna的序列互补的序列的第1rna寡聚物与mrna杂交、并且使具有与第1rna寡聚物互补的序列的第2rna寡聚物与第1rna寡聚物杂交,从而可以由mrna高效地表达蛋白质和诱导免疫等,从而完成了本发明的第3方式。
本发明如下所述。
一种功能化mrna,其含有双链rna,所述双链rna包含mrna、和与mrna杂交的至少1个经修饰的rna寡聚物。
本发明的第1方式如下所述。
[1-1]一种转运载体,其为内包有编码目标基因的mrna、和与该mrna杂交的至少1个rna寡聚物的上述mrna的转运载体,
rna寡聚物含有:
(a)由与mrna的序列互补的12~40碱基的序列构成的rna序列、或
(b)和与mrna的序列互补的12~40碱基的序列具有90%以上的同一性且与mrna杂交的rna序列,
并且所述rna寡聚物经化学修饰。
[1-1a]一种转运载体,其为内包有编码目标基因的mrna、和与该mrna杂交的至少1个rna寡聚物的上述mrna的转运载体,
rna寡聚物含有:
(a)由与mrna的序列互补的12~40碱基的序列构成的rna序列、或
(b)和与mrna的序列互补的12~40碱基的序列具有90%以上的同一性且与mrna杂交的rna序列,
并且所述rna寡聚物未经化学修饰或经化学修饰。
[1-2]根据上述[1-1]或[1-1a]所述的转运载体,其中,上述rna序列由15~23碱基的序列构成。
[1-3]根据上述[1-2]所述的转运载体,其中,上述rna序列由17碱基的序列构成。
[1-4]根据上述[1-1]~[1-3]中任一项所述的转运载体,其中,上述化学修饰介由1~5碱基的突出序列而在rna寡聚物的序列的5’末端或3’末端进行。
[1-5]根据上述[1-4]所述的转运载体,其中,上述突出序列为2碱基的序列。
[1-6]根据上述[1-1]~[1-5]中任一项所述的转运载体,其中,上述化学修饰为利用疏水性基团的修饰。
[1-7]根据上述[1-6]所述的转运载体,其中,上述利用疏水性基团的修饰为胆固醇修饰。
[1-8]根据上述[1-1]~[1-5]中任一项所述的转运载体,其中,上述化学修饰为聚乙二醇修饰。
[1-9]根据上述[1-1]~[1-8]中任一项所述的转运载体,其中,上述转运载体为高分子胶束或脂质性mrna载体。
[1-10]一种药物组合物,其含有上述[1-1]~[1-9]中任一项所述的转运载体。
[1-11]一种转运载体的稳定化方法,其包括如下步骤:使编码目标基因的mrna、和与该mrna杂交的至少1个rna寡聚物内包于转运载体,
rna寡聚物含有:
(a)由与mrna的序列互补的12~40碱基的序列构成的rna序列、或
(b)和与mrna的序列互补的12~40碱基的序列具有90%以上的同一性且与mrna杂交的rna序列,
并且所述rna寡聚物经化学修饰。
[1-11a]一种转运载体的稳定化方法,其包括下述步骤:使编码目标基因的mrna、和与该mrna杂交的至少1个rna寡聚物内包于转运载体,
rna寡聚物含有:
(a)由与mrna的序列互补的12~40碱基的序列构成的rna序列、或
(b)和与mrna的序列互补的12~40碱基的序列具有90%以上的同一性且与mrna杂交的rna序列,
并且,所述rna寡聚物未经化学修饰或经化学修饰。
[1-12]一种双链rna,其包含编码目标基因的mrna、和与该mrna杂交的至少1个rna寡聚物,
rna寡聚物含有:
(a)由与mrna的序列互补的12~40碱基的序列构成的rna序列、或
(b)和与mrna的序列互补的12~40碱基的序列具有90%以上的同一性且与mrna杂交的rna序列,
并且,所述rna寡聚物未经化学修饰或经化学修饰。
[1-13]根据上述[1-12]所述的双链rna,其中,上述rna序列由15~23碱基的序列构成。
[1-14]根据上述[1-13]所述的双链rna,其中,上述rna序列由17碱基的序列构成。
[1-15]根据上述[1-12]~[1-14]中任一项所述的双链rna,其中,上述化学修饰介由1~5碱基的突出序列而在rna寡聚物的序列的5’末端或3’末端进行。
[1-16]根据上述[1-15]所述的双链rna,其中,上述突出序列为2碱基的序列。
[1-17]根据上述[1-12]~[1-16]中任一项所述的双链rna,其中,上述化学修饰为利用疏水性基团的修饰。
[1-18]根据上述[1-17]所述的双链rna,其中,上述利用疏水性基团的修饰为胆固醇修饰。
[1-19]根据上述[1-12]~[1-16]中任一项所述的双链rna,其中,上述化学修饰为聚乙二醇修饰。
[1-20]一种mrna转运载体,上述[1-12]~[1-19]中任一项所述的双链rna内包于转运载体中。
[1-21]根据上述[1-20]所述的转运载体,其中,上述转运载体为高分子胶束或脂质性mrna载体。
[1-22]一种药物组合物,其含有上述[1-20]或[1-21]中任一项所述的转运载体。
本发明的第2方式如下所述。
[2-1]一种mrna疫苗,其含有双链rna,所述双链rna由编码抗原的mrna、和与该mrna的至少polya序列杂交的至少1个rna寡聚物构成,上述至少1个rna寡聚物未经化学修饰。
[2-1a]一种mrna疫苗,其含有双链rna,所述双链rna由编码抗原的mrna、和与该mrna的至少polya序列杂交的至少1个rna寡聚物构成,上述至少1个rna寡聚物未经化学修饰或经化学修饰。
[2-2]根据上述[2-1]或[2-1a]所述的mrna疫苗,其中,rna寡聚物由10~500碱基序列构成。
[2-3]根据上述[2-1]~[2-2]中任一项所述的mrna疫苗,其中,rna寡聚物在5’末端具有三磷酸结构。
[2-4]根据上述[2-1]~[2-3]中任一项所述的mrna疫苗,其中,双链rna是1个rna寡聚物与mrna的至少polya序列杂交而成的。
[2-5]根据上述[2-1]~[2-4]中任一项所述的mrna疫苗,其中,双链rna为裸露的形态。
[2-6]根据上述[2-1]~[2-5]中任一项所述的mrna疫苗,其不与佐剂一起使用。
[2-7]根据上述[2-1]~[2-6]中任一项所述的mrna疫苗,其用于在需要预防或治疗疾病的对象中预防或治疗该疾病。
[2-8]一种预防或治疗疾病的方法,包含下述步骤:对需要预防或治疗疾病的对象,给药上述[2-1]~[2-6]中任一项所述的mrna疫苗。
本发明的第3方式如下所述。
[3-1]一种mrna疫苗,其含有双链rna,所述双链rna由编码抗原的mrna、以及与该mrna杂交的至少1个第1rna寡聚物和与该第1rna寡聚物杂交的第2rna寡聚物构成,
第1rna寡聚物含有:
(a)从5’末端起依次含有第1rna序列和第2rna序列的rna序列,其中,所述第1rna序列由与mrna的序列互补的12~40碱基的序列构成,所述第2rna序列由与第2rna寡聚物的序列互补的10~200碱基的序列构成、
(b)从5’末端起依次含有第1rna序列和第2rna序列的rna序列,其中,所述第1rna序列和与mrna的序列互补的12~40碱基的序列具有90%以上的同一性且与mrna杂交,所述第2rna序列和与第2rna寡聚物的序列互补的10~200碱基的序列具有90%以上的同一性且与第2rna寡聚物杂交、
(c)从5’末端起依次含有第2rna序列和第1rna序列的rna序列,其中,所述第2rna序列由与第2rna寡聚物的序列互补的10~200碱基的序列构成,所述第1rna序列由与mrna的序列互补的12~40碱基的序列构成、或者
(d)从5’末端起依次含有第2rna序列和第1rna序列的rna序列,其中,所述第2rna序列和与第2rna寡聚物的序列互补的10~200碱基的序列具有90%以上的同一性且与第2rna寡聚物杂交,所述第1rna序列和与mrna的序列互补的12~40碱基的序列具有90%以上的同一性且与mrna杂交。
[3-2]根据上述[3-1]所述的mrna疫苗,其中,第1rna寡聚物由22~240碱基的序列构成。
[3-3]根据上述[3-1]或[3-2]所述的mrna疫苗,其中,与1个mrna杂交的第1rna寡聚物的数量为1~50个。
[3-4]根据上述[3-1]~[3-3]中任一项所述的mrna疫苗,其中,第1rna寡聚物含有上述(a)的rna序列或上述(b)的rna序列,第2rna寡聚物在5’末端具有三磷酸结构。
[3-5]根据上述[3-1]~[3-3]中任一项所述的mrna疫苗,其中,第1rna寡聚物含有上述(c)的rna序列或上述(d)的rna序列,第1rna寡聚物在5’末端具有三磷酸结构。
[3-6]根据上述[3-1]~[3-5]中任一项所述的mrna疫苗,其中,第2rna寡聚物与第1rna寡聚物进行杂交的那一侧的双链rna的末端为平滑末端。
[3-7]根据上述[3-1]~[3-6]中任一项所述的mrna疫苗,其中,第2rna寡聚物含有10~200碱基的序列。
[3-8]根据上述[3-1]~[3-7]中任一项所述的mrna疫苗,其中,双链rna为裸露的形态。
[3-9]根据上述[3-1]~[3-8]中任一项所述的mrna疫苗,其不与佐剂一起使用。
[3-10]根据上述[3-1]~[3-9]中任一项所述的mrna疫苗,其用于在需要预防或治疗疾病的对象中预防或治疗该疾病。
发明的效果
本发明可以提供功能化mrna。
本发明的第1方式提供mrna、或mrna转运载体的新的稳定化方法。优选的是,本发明的第1方式可以在生物体内、在维持从mrna翻译为蛋白质的翻译效率的状态下实现比较自由的mrna修饰。更优选的是,本发明的第1方式可以抑制生物体内的mrna的酶解。
本发明的第2方式和第3方式提供能够高效表达蛋白质和诱导免疫的新的mrna疫苗。优选的是,本发明的第2方式和第3方式的mrna疫苗即使不与佐剂同时给药也能呈递抗原和诱导免疫。更优选的是,本发明的第2方式和第3方式的mrna疫苗可以诱导更强的细胞免疫。进一步优选的是,本发明的第2mrna疫苗和第3mrna疫苗可以诱导比单独给药mrna时更强的体液免疫。
附图说明
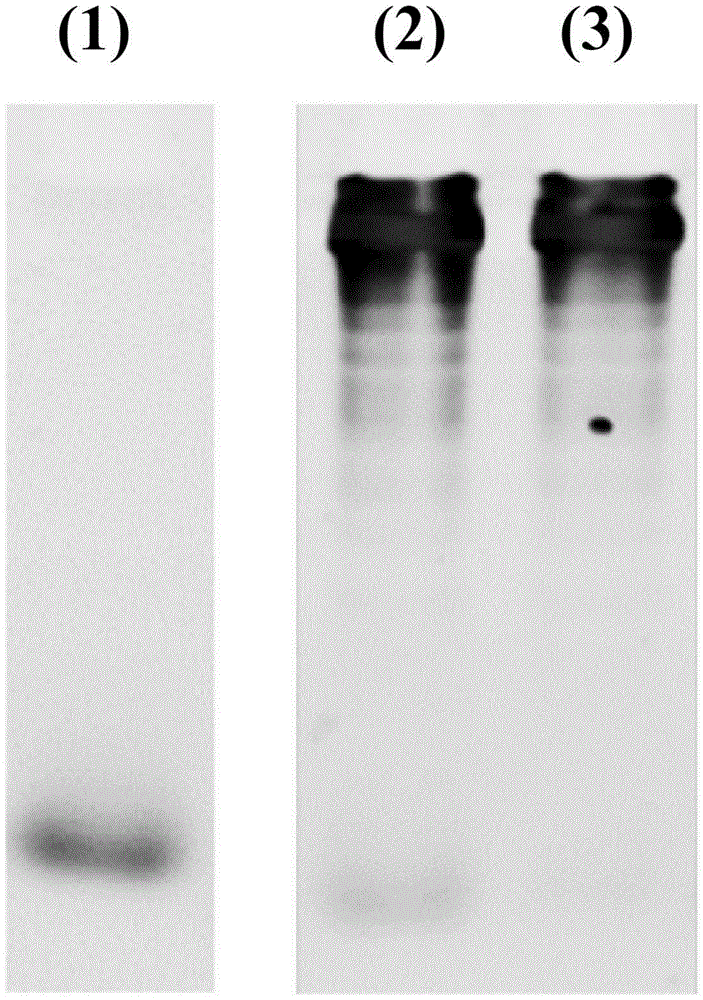
图1是示出rna寡聚物与mrna杂交的电泳图像。(1)突出端(overhang)2碱基(1)单独;(2)与突出端2碱基(1)杂交后的mrna;(3)未与突出端2碱基(1)杂交的mrna。
图2是示出rna寡聚物与mrna杂交所产生的影响的图。(a)mrna向培养细胞的导入效率;(b)无细胞系统中的蛋白质翻译效率。
图3是示出内包了杂交有rna寡聚物的mrna的高分子胶束的物理化学性质的图。(a)peg-pasp(det)+rna寡聚物(-);(b)peg-pasp(det)-chol+rna寡聚物(-);(c)peg-pasp(det)+未修饰rna寡聚物;(d)peg-pasp(det)-chol+未修饰rna寡聚物;(e)peg-pasp(det)+chol-rna寡聚物;(f)peg-pasp(det)-chol+chol-rna寡聚物。
图4-1是示出chol修饰rna寡聚物与mrna杂交所带来的、对稳定性的影响的图。(a)peg-pasp(det)-chol;(b)peg-pasp(det);(c)peg-pasp(det)-chol;(d)peg-pasp(det);(e)peg-pasp(det)-chol。
图4-2:如上所述。
图5是示出chol修饰rna寡聚物与mrna杂交所带来的、对稳定性的影响的图。(a)peg-pasp(det)-chol+寡聚物(-);(b)peg-pasp(det)-chol+chol寡聚物;(c)peg-pasp(det)+寡聚物(-);(d)peg-pasp(det)+chol寡聚物。
图6是示出多个chol修饰rna寡聚物与mrna杂交对稳定性的影响的图。10v/v%的fbs条件。
图7是示出多个chol修饰rna寡聚物与mrna杂交带来的、对向细胞导入时的蛋白质翻译效率的影响的图。10v/v%的fbs条件。
图8是示出将在3’侧对寡聚物进行chol修饰的情况、与在5’侧对寡聚物进行chol修饰的情况进行比较的图。(a)对稳定性的影响、(b)导入至细胞时的蛋白质翻译效率。
图9是示出chol修饰rna寡聚物与mrna杂交所带来的、对无细胞系统的蛋白质翻译效率的影响的图。
图10是示出chol修饰rna寡聚物对内源基因表达的影响的图。
图11是示出chol修饰rna寡聚物与mrna杂交所带来的、对稳定性的影响的图。(a)凝胶电泳(peg-plys+寡聚物(-));(b)凝胶电泳(peg-plys+chol寡聚物);(c)翻译效率。
图12是示出使用了小鼠的血中稳定性试验结果的图。
图13是示出对肺给药chol修饰rna寡聚物的结果的图。(a)蛋白质表达效率;(b)mrna量。
图14是实施例中制作的gaussia萤光素酶(gluc)的mrna序列(序列号1)。下划线部分为开放阅读框(openreadingframe)。
图15是实施例中使用的gaussia萤光素酶(gluc)的编码序列(序列号32)。
图16是实施例中使用的luc的mrna序列(序列号33)。下划线部分为开放阅读框。
图17是使mrna转运载体稳定化的示意图。
图18是示出peg修饰rna寡聚物与mrna杂交所带来的翻译效率的变化的图。
图19是示出peg修饰rna寡聚物与mrna杂交所带来的稳定化效果的变化的图。(a)实验步骤、(b)对稳定性的影响。
图20是示出peg化mrna的表达试验结果的图。
图21是示出gaussia萤光素酶(gluc或luc)mrna的正义链和反义链的图。(a)gluc正义链、(b)gluc反义链(嵌入有polyu(聚尿苷酸))、(c)gluc反义链(无polyu)、和(d)polyu。
图22是示出双链rna的图。(a)mrna:rna、(b)mrna:rnapolyu(-)、(c)mrna:polyu、和(d)mrna:polyuppp(-)。
图23是示出将双链rna导入树突状细胞株(dc2.4)的结果的图。(a)干扰素β表达量和(b)luc表达量。
图24是示出对小鼠给药双链rna的结果的图。(a)luc表达量、(b)干扰素β表达量、和(c)白介素6表达量。
图25是示出对小鼠给药双链rna的结果的图。(a)从给药起至细胞数定量为止的步骤、和(b)产生ifn-γ的细胞数。
图26是示出对小鼠给药双链rna的结果的图。(a)从给药起至抗ovaigg的血清中浓度定量为止的步骤、和(b)抗ovaigg的血清中浓度。
图27是实施例中制作的gluc正义链的序列(序列号51)。下划线部分为开放阅读框。
图28是实施例中制作的gluc反义链(嵌入有polyu)的序列(序列号52)。
图29是实施例中制作的gluc反义链(无polyu)的序列(序列号53)。
图30是实施例中制作的polyu的序列(序列号54)。
图31是实施例中制作的ova正义链的序列(序列号55)。下划线部分为开放阅读框。
图32是实施例中制作的polyu的序列(序列号56)。
图33是实施例中使用的gaussia萤光素酶(gluc)的编码序列(序列号57)。
图34是实施例中使用的卵清蛋白(ova)的编码序列(序列号58)。
图35是示出将双链rna导入树突状细胞株(dc2.4)、并确认萤光素酶表达量的结果的图。
图36是实施例中制作的3个polyu的序列。(a)各polyu的制作方法、和(b)各polyu的序列(分别为序列号56、54和59)。
图37是示出双链rna的图。
图38是示出将双链rna导入树突状细胞株(dc2.4)的结果的图。干扰素β相对于未给药的相对表达量。
图39是示出将双链rna导入树突状细胞株(dc2.4)的结果的图。白介素6相对于未给药的相对表达量。
图40是示出将双链rna导入树突状细胞株(dc2.4)的结果的图。luc相对于单链rna的相对表达量。
图41是实施例中使用的载体的序列(序列号65)。
具体实施方式
以下详细说明本发明,但以下的实施方式是用于说明本发明的例示,本发明可以在不脱离其主旨的范围内以各种方式实施。另外,本说明书中引用的全部刊行物、例如现有技术文献、公开公报、专利公报及其它专利文献均以其整体组入到本说明书中作为参照。另外,本说明书参照并引入了作为本申请的优先权基础的日本专利申请日本特愿2016-252487号(2016年12月27日申请)和日本特愿2016-252488号(2016年12月27日申请)的权利要求书、说明书和附图的公开内容。
在此提供功能化mrna,其含有双链rna,所述双链rna包含mrna、和与mrna杂交的至少1个经修饰的rna寡聚物。以下说明功能化mrna的各方式。
1.本发明的第1方式
1.1.本发明的第1方式的概要
以往,在mrna的碱基修饰中,难以进行自由的化学修饰的设计。在此,本发明人想到了,能否对具有与mrna互补的序列的rna寡聚物进行化学修饰、再使其与mrna杂交从而进行mrna的化学修饰(图1)。这种情况下,由于mrna本身是天然物质而不会妨碍翻译的过程,期待能够实现自由的化学修饰。另一方面,也担心进行杂交会妨碍翻译过程,因此首先使各种链长的rna寡聚物杂交,再调查杂交对翻译效率的影响。由此获知,有rna寡聚物链长越长则翻译效率越降低的倾向。另一方面,获知17~40碱基的rna寡聚物可以充分防止与杂交相伴随的表达下调(图2)。特别是17碱基的寡聚物,几乎观察不到与杂交相伴随的表达下调(图2)。由上述可知,通过使用12~40碱基的rna寡聚物可以充分维持翻译效率。
然后,对作为化学修饰的1例的胆固醇(chol)修饰rna寡聚物的杂交进行了研究(图17)。如果进行chol修饰,则在mrna转运载体上搭载mrna时,转运载体由于疏水作用而稳定化,结果可期待防止mrna的酶解(图17)。作为mrna转运载体,使用用生物相容性聚合物、聚乙二醇(peg)覆盖的高分子胶束(图3、图17)。已经阐明,该高分子胶束尤其是在体内环境中显示较高的安全性和mrna导入效率。
调查搭载了杂交有chol修饰rna寡聚物的mrna的高分子胶束在血清中的耐酶解性,结果获知杂交显著提高了耐酶解性(图4)。结果,成功地使mrna对于培养细胞的导入效率显著提高(图7)。另外,生物体内广泛存在聚阴离子,因此高分子胶束在聚阴离子存在下的稳定性至关重要,实际上,通过本技术抑制了聚阴离子存在下的胶束破坏(图5)。而且,在小鼠的经呼吸道肺给药中对mrna导入效率进行了比较,结果此处也得到由杂交带来的提高导入效率的效果(图13)。根据以上结果可明确,本发明的第1方式使mrna搭载转运载体(例如高分子胶束)稳定化,结果是可以抑制各种环境下的mrna酶解。另外,在多个高分子胶束组成下均得到这样的由chol修饰寡聚物所带来的稳定化效果(图11),可以称之为用于提高mrna的耐酶解性的高通用性平台。
对于rna寡聚物而言,无论在5’和3’中的哪个末端对chol基进行修饰都不会大幅影响稳定性和mrna的蛋白质表达效率(图8)。另外,也可以在rna寡聚物的互补序列与chol基之间插入不进行杂交的突出序列。例如:在使用修饰有chol的嵌段共聚物的情况下,与无突出序列的情况相比较、有2碱基的突出序列存在的情况得到了更高的稳定化效果的倾向(图4的(a)和(c))。另一方面,在使用无chol修饰的嵌段共聚物的情况下,即使没有突出序列也得到更优异的稳定化效果(图4的(b)和(d))。
关于所杂交的chol修饰rna寡聚物的数量,在仅为1个时也得到非常高的稳定性提高效果,随着数量的增加,稳定性进一步提高(图6、11)。另一方面,当数量大幅增加时,观察到过度稳定化所引起的mrna翻译受抑制的倾向(图9)。我们估计,根据给药系统的不同,所要求的稳定性也不同,与此相伴的chol修饰寡聚物的最佳数量也不同。
我们认为,通过对rna寡聚物进行化学修饰、再使其与mrna杂交可以自由地对mrna进行化学修饰。但是,担心杂交会导致由mrna的翻译效率下降,因此,对于将经化学修饰的rna寡聚物与mrna杂交后用于mrna的酶解抑制的这种研究还没有进行。
本发明人研究了用各种链长的rna寡聚物进行杂交,结果发现,作为具有可以形成稳定的杂交的链长且不影响翻译效率的组成,具有12~40碱基的互补序列的rna寡聚物较好。另外发现,在使用了化学修饰rna寡聚物的杂交的高分子胶束的稳定化中,化学修饰位置为5’末端或3’末端均可(图8)。另外发现,在rna寡聚物的互补序列与chol基之间可以没有突出序列,或者有1~5碱基的突出序列。通过使用具有这些特征的化学修饰rna寡聚物可得到较高的酶解抑制效果这一结果,是由以往的生物化学知识无法预期的。
而且,本发明的第1方式是可以抑制mrna本身或各种转运载体(例如高分子胶束)中的mrna的酶解的具有通用性的技术。
1.2.双链rna和转运载体
本发明的第1方式提供一种双链rna,其含有编码目标基因的mrna、和与该mrna杂交的至少1个rna寡聚物,
rna寡聚物含有:
(a)由与mrna的序列互补的12~40碱基的序列构成的rna序列、或
(b)和与mrna的序列互补的12~40碱基的序列具有90%以上的同一性且与mrna杂交的rna序列,
并且,所述rna寡聚物未经化学修饰或经化学修饰。
双链rna可以内包于转运载体。或者,双链rna可以未内包于转运载体,即,可以为裸露的形态。前者的本发明的第1方式提供一种转运载体,其为内包有编码目标基因的mrna、和与该mrna杂交的至少1个rna寡聚物的上述mrna的转运载体,
rna寡聚物含有:
(a)包含与mrna的序列互补的12~40碱基的序列的rna序列、或
(b)和与mrna的序列互补的12~40碱基的序列具有90%以上的同一性且与mrna杂交的rna序列,
并且,所述rna寡聚物未经化学修饰或经化学修饰。
转运载体只要能够内包核酸并且递送到对象体内的合适部位即可,没有特别限定。转运载体例如为高分子胶束、脂质性mrna载体或阳离子型聚合物复合体,更优选为高分子胶束或脂质性mrna载体。
高分子胶束具有双层结构,所述双层为:由凝聚的核酸和阳离子型聚合物形成的内核;和、由亲水性聚合物形成的外壳。阳离子型聚合物例如为聚氨基酸衍生物。亲水性聚合物例如为聚乙二醇(“peg”)。内核通过物理手段或化学手段封入mrna。外壳利用其物理化学性质将内壳中所封入的mrna递送到规定的组织。高分子胶束可以通过胞吞作用进入细胞内。高分子胶束例如可以利用嵌段聚合物上的聚阳离子与核酸的相互作用(聚离子复合物(“pic”)),此外还可以利用其与无机分子的杂化胶束。作为pic型高分子胶束可列举例如:通过peg-pasp(det)-chol、peg-pasp(det)、peg-plys与mrna的多分子缔合形成的pic胶束(参照后述的实施例);嵌段共聚物中使用了pasp(tet)、pasp(tep)之类的其它聚阳离子的高分子胶束(uchida,s.,etal.,biomaterials(2016)82,p.221-228);以及,使用了三嵌段共聚物的高分子胶束(osawa,s.,etal.biomacromolecules17,p354-361(2016))。作为与无机分子的杂化胶束,可列举例如:peg化磷酸钙(cap)颗粒(pittela,etal.,biomaterials(2011)32,p.3106-3114);peg化二氧化硅颗粒(miyata,k.,etal.biomaterials(2010)31,p4764-4770)。
脂质性mrna载体有使脂质或阳离子脂质形成载体、然后内包或结合有mrna的形态。例如,由选自下述组中的一种或多种物质形成并将其与mrna混合而得到的形态,所述物质为:n-[1-(2,3-二油酰氧基)丙基]-n,n,n-三甲基氯化铵(dotma)、2,3-二油酰氧基-n-[2-(精胺甲酰氨基)乙基]-n,n-二甲基-1-丙铵基三氟乙酸(dospa)、1,2-二油酰氧基-3-(三甲基铵)丙烷(dotap)、n-[1-(2,3-双十四烷氧基)丙基]-n,n-二甲基-n-(2-羟乙基)溴化铵(dmrie)或dc-胆固醇之类的阳离子性脂质;二硬脂酰磷脂酰胆碱(dspc)或二油酰磷脂酰乙醇胺(dope)之类的中性磷脂;peg化脂质;和、胆固醇。
阳离子型聚合物复合体例如为直链状或支链状聚乙烯亚胺、聚赖氨酸、聚精氨酸、壳聚糖衍生物、聚甲基丙烯酸衍生物与mrna的混合物。
这些转运载体可以利用公知方法或以其为基准的方法来制备。
在几个实施方式中,转运载体所内包的mrna的量使得转运载体的阳离子电荷(+)与mrna的阴离子电荷(-)之比(+/-比)为例如0.5~200,优选为1~50,更优选为1~10。
本领域技术人员可以根据目的适当选择目标基因。目标基因例如为报告基因、生长因子基因、细胞生长因子基因、细胞生长抑制因子基因、细胞凋亡促进因子基因、细胞凋亡抑制因子基因、癌抑制基因、转录因子基因、基因组编辑基因或疫苗抗原基因。例如,对于需要使特定细胞增殖的对象,给药内包有编码该特定细胞的生长因子基因的mrna的转运载体,从而可以对该对象的疾病、状态进行处置。
作为报道分子,可列举例如发光蛋白和荧光蛋白。
作为生长因子,可列举例如上皮生长因子(egf)、胰岛素样生长因子(igf)、神经生长因子(ngf)、脑源神经营养因子(bdnf)、血管内皮细胞生长因子(vegf)、粒细胞集落刺激因子(g-csf)、粒细胞巨噬细胞集落刺激因子(gm-csf)、血小板源生长因子(pdgf)、促红细胞生成素(epo)、血小板生成素(tpo)、碱性成纤维细胞生长因子(bfgf或fgf-2)和肝细胞生长因子(hgf)。
作为细胞生长抑制因子,可列举例如p21、p17、p16和p53。
作为细胞凋亡促进因子,可列举例如:smac/diablo;凋亡诱导因子(aif);htra2;bad;bim;bax;p53;胱天蛋白酶1、2、3、4、5、6、7、8、9和10(例如胱天蛋白酶2、3、6、7、8、9和10,优选为胱天蛋白酶3、6和7);fas配体(fasl)、肿瘤坏死因子相关凋亡诱导配体(trail)以及foxo1。
作为细胞凋亡抑制因子,可列举例如:抗凋亡因子(例如flip、mcl-1、xiap、crma、bcl-2和bcl-xl)。
作为癌抑制基因,可列举例如:p53、视网膜母细胞瘤基因(rb)、结直肠腺癌基因(apc)、神经纤维瘤1型基因(nf1)、神经纤维瘤2型基因(nf2)、wt1、vhl、brca1、brca2、chek2、乳腺丝抑蛋白、p73、smad4、msh2、mlh1、pms2、dcc、磷酸酶张力蛋白同源物(pten)、sdhd、p16、p57kip2、ptc、tsc1、tsc2、ext1和ext2。
作为转录因子,可列举例如:runt相关转录因子1(runx1)、p53、c-fos、c-jun、creb、c/ebp、myod、c-myc、c-myb、oct3/4、nf-κb、nf-at、mef-2和细胞外信号响应因子(srf)。
作为基因组编辑基因,可列举例如:锌指核酸酶(zincfingernuclease,znf)、类转录激活因子效应物核酸酶(transcriptionactivatorlikeeffectornuclease,talen)以及聚集的规则间隔短回文重复和crispr相关蛋白9[clustered,regularlyinterspaced,shortpalindromicrepeat(crispr)/crispr-associated(cas)9]基因。
作为疫苗抗原基因,可列举例如:病原体抗原和肿瘤特异性抗原。
mrna是指信使rna,通常含有5’非翻译区(5’utr)、编码区和3’非翻译区(3’utr)。mrna通常还含有5’末端的帽子结构(5’cap)和3’末端的polya序列。
这里所使用的mrna可以是下述的任一种。
(1)依次包含5’cap、5’utr、编码区、3’utr和polya的mrna。
(2)依次包含5’cap、5’utr、编码区和polya的mrna。
(3)依次包含5’utr、编码区、3’utr和polya的mrna。
(4)依次包含5’utr、编码区和polya的mrna。
(5)依次包含5’cap、5’utr、编码区和3’utr的mrna。
(6)依次包含5’cap、5’utr、编码区的mrna。
(7)依次包含5’utr、编码区和3’utr的mrna。
(8)依次包含5’utr、编码区的mrna。
编码目标基因的mrna可以如下制作:利用公知方法使编码目标基因的模板dna在体外环境下转录,从而制作。例如可以按照blood108(13)(2006)4009-17中记载的方法制作。具体而言,可以如下制作:将在蛋白质编码序列的下游整合有polya/t链的模板dna,在polya/t链的紧下游处切断,在含有翻译酶、核苷、5’帽子类似物的缓冲液中进行体外转录,然后对mrna进行纯化,从而制作。mrna的更具体的制备方法记载于后述的实施例中。
在几个实施方式中,mrna本身的碱基未经化学修饰。这种情况下,mrna本身是天然的,因此可以期待翻译的过程几乎不会被妨碍。在另外几个实施方式中,mrna本身的碱基进行了化学修饰。已知mrna本身的碱基的化学修饰例如可以提高mrna的耐酶解性、减轻免疫原性。这种mrna本身的化学修饰碱基可列举例如:甲基化碱基(例如5-甲基胞嘧啶)、硫修饰碱基(例如2-硫尿苷)、假尿苷、n1甲基假尿苷和5甲氧基尿苷。
rna寡聚物是含有如下序列的的rna链。
(a)由与mrna的序列互补的12~40碱基的序列构成的rna序列、或
(b)和与mrna的序列互补的12~40碱基的序列具有90%以上的同一性且与mrna杂交的rna序列。
“具有90%以上的同一性的rna序列”中的“90%以上”的范围为例如90%以上、91%以上、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上、99%以上、99.1%以上、99.2%以上、99.3%以上、99.4%以上、99.5%以上、99.6%以上、99.7%以上、99.8%以上、或99.9%以上。上述同一性的数值通常是越大越优选。需要说明的是,rna序列的同一性可以使用blast(例如,参照altzshuls.f.etal.,j.mol.biol.215,403(1990))等分析程序确定。使用blast的情况下,使用各程序的默认参数。
“与mrna杂交”是指:在后述的杂交条件下,rna寡聚物与mrna进行杂交。
按照与mrna的连续12~40碱基的序列杂交的方式来设计rna寡聚物。在几个实施方式中,rna寡聚物的序列由与mrna的序列互补的12~30碱基的序列构成。更优选的是,rna寡聚物的序列由与mrna的序列互补的15~23碱基的序列构成。进一步优选的是,rna寡聚物的序列由与mrna的序列互补的17碱基的序列构成。
rna寡聚物所杂交的、mrna中的位置可以是5’utr、编码区、3’utr和polya序列中的任意位置。对于rna寡聚物而言,期望首先预测mrna的二级结构、并且按照与mrna链中不具有二级结构的部分进行杂交的方式来设计rna寡聚物。即,优选按照与mrna全长序列中的、不具有二级结构的部分进行杂交的方式来设计rna寡聚物。作为预测mrna的二级结构的软件,可列举例如后述实施例中记载的软件。
在几个实施方式中,按照与mrna的polya的序列进行杂交的方式来设计rna寡聚物。
rna寡聚物的化学修饰既可以不介由突出序列而进行,也可以介由突出序列而进行。在此,“突出序列”是不与mrna进行杂交的序列。
在不介由突出序列进行化学修饰的情况下,rna寡聚物优选仅由上述(a)或(b)的rna序列构成。这种情况下,化学修饰对rna寡聚物序列的例如5’末端或3’末端进行。在几个实施方式中,当转运载体为未被疏水性基团修饰的转运载体(例如未被疏水性基团修饰的嵌段共聚物)时,rna寡聚物的化学修饰是不介由突出序列来进行的。
另一方面,在介由突出序列进行化学修饰的情况下,rna寡聚物优选包含上述(a)或(b)的rna序列和突出序列。这种情况下,介由1~5碱基的突出序列对rna寡聚物的上述(a)或(b)的rna序列的5’末端或3’末端进行化学修饰。在介由突出序列进行化学修饰的情况下,突出序列的链长优选为1~4碱基,更优选为1~3碱基,进一步优选为2碱基。如果突出序列的链长为1~5碱基,则可以期待较高的mrna稳定化效果。在几个实施方式中,当转运载体为被疏水性基团修饰的转运载体(例如被疏水性基团修饰的嵌段共聚物)时,介由1~5碱基的突出序列对rna寡聚物的上述(a)或(b)的rna序列的5’末端或3’末端进行rna寡聚物的化学修饰。
对于rna寡聚物而言,可以介由突出序列对上述(a)或(b)的rna序列的5’末端和3’末端中的任一末端进行化学修饰。这里,有时将介由突出序列进行了化学修饰的rna寡聚物称为“化学修饰寡聚物”。
化学修饰例如为可以使裸露的双链rna或mrna转运载体稳定化的修饰。作为这种化学修饰,可列举例如:利用疏水性基团的修饰、利用聚乙二醇的修饰。作为利用疏水性基团的修饰,可列举胆固醇修饰和生育酚修饰。如果利用疏水性基团进行修饰则在mrna转运载体上搭载mrna时,可期待下述效果:转运载体通过疏水作用而稳定化,结果可以防止mrna的酶解。在几个实施方式中,利用疏水性基团的修饰为胆固醇修饰。利用疏水性基团的修饰例如可以利用(s.l.beaucage,etal.,tetrahedronletters(1981)22,p.1859-1862)中记载的亚磷酰胺法或以其为基准的方法来进行。利用疏水性基团的修饰例如可以如下所述地进行。在合成rna寡聚物后,使亚酰胺(amidite)化的疏水性基团与rna寡聚物的5’末端oh基反应,从而可以得到5’末端导入了疏水性基团的rna寡聚物。另外,通过利用亚磷酰胺法由oh基末端的疏水性基团进行rna合成,可以得到3’末端导入了疏水性基团的rna寡聚物。
需要说明的是,“化学修饰”的定义中不包括5’末端的三磷酸结构。
利用聚乙二醇(peg)进行修饰时,当在mrna转运载体上搭载mrna时,转运载体被聚乙二醇链覆盖,由于其隐身性(stealth)而稳定化,而且由于聚乙二醇链的屏蔽效应(shieldingeffect),表面电位降低,从而可以避免被作为阳离子性蛋白质的分解酶识别。其结果是,可以期待防止mrna的酶解的效果。利用聚乙二醇的修饰例如可以利用文献m.oishi,etal.,chembiochem6(4),2005,718-725中记载的方法或以其为基准的方法来进行。更具体而言,可以使用dms(o)mt-amino-modifier(glenreserch)等引发剂合成rna寡聚物,进行脱保护,从而得到5’末端氨基化rna寡聚物。使该5’末端氨基化rna寡聚物与例如peg-n-羟基琥珀酰亚胺反应,从而可以得到peg化rna寡聚物。作为所使用的聚乙二醇,可列举例如:重均分子量1000~80000的直链状的peg;该分子量的2支链型、4支链型、8支链型等支链状的peg等。
与mrna杂交的未经化学修饰rna寡聚物或经化学修饰rna寡聚物的数量为至少1个,优选为1~50个,更优选为1~15个,进一步优选为1~5个。mrna的稳定性随着rna寡聚物的数量的增加而进一步提高。如果rna寡聚物的数量在1~50个的范围,则可以使mrna翻译效率维持在较高的水平。
在使多个未经化学修饰rna寡聚物或经化学修饰rna寡聚物与mrna杂交时,在几个实施方式中,按照各未经化学修饰rna寡聚物或经化学修饰rna寡聚物在mrna上不重叠的方式来设计rna寡聚物。
可以利用公知方法和条件进行rna寡聚物与mrna的杂交。杂交时,升温并静置一定时间后,缓慢降温。进行升温的目的是,使mrna或寡聚物的分子内、分子间预先存在的互补键断开,从而使mrna与寡聚物更高效地结合。只要保证了适当的杂交,则该温度、时间可适当调节。缓慢降温的方式可增加杂交的特异性。另外,寡聚物链长对杂交条件的设定影响不大。应一边评价杂交效率一边设定适当的条件。例如,可列举后述的实施例中记载的方法和条件。
另外,本发明的第1方式提供一种mrna的稳定化方法,其包括下述步骤:使至少1个rna寡聚物与编码目标基因的mrna杂交,得到双链rna,其中,
rna寡聚物含有:
(a)由与mrna的序列互补的12~40碱基的序列构成的rna序列、或
(b)和与mrna的序列互补的12~40碱基的序列具有90%以上的同一性且与mrna杂交的rna序列,
并且,所述rna寡聚物未经化学修饰或经化学修饰。
稳定化方法中,与未经化学修饰rna寡聚物或经化学修饰rna寡聚物杂交的mrna可以内包于转运载体。或者,与未经化学修饰rna寡聚物或经化学修饰rna寡聚物杂交的mrna也可以不内包于转运载体,即,可以为裸露的形态。优选的是,与未经化学修饰rna寡聚物或经化学修饰rna寡聚物进行了杂交的mrna内包于转运载体。前者的本发明的第1方式提供一种转运载体的稳定化方法,其包括下述步骤:使编码目标基因的mrna、和与该mrna杂交的至少1个rna寡聚物内包于转运载体,其中,rna寡聚物含有:
(a)由与mrna的序列互补的12~40碱基的序列构成的rna序列、或
(b)和与mrna的序列互补的12~40碱基的序列具有90%以上的同一性且与mrna杂交的rna序列,
并且,所述rna寡聚物未经化学修饰或经化学修饰。
稳定化方法中使用的mrna、rna寡聚物、转运载体、化学修饰等如上述转运载体的相关说明部分所述。
1.3.药物组合物
本发明的第1方式提供一种药物组合物,其含有上述双链rna或转运载体。药物组合物被用于将mrna、或内包有mrna的转运载体递送到对象体内。
“对象”为人或人以外的生物,例如禽类和非人哺乳动物(例如牛、猴子、猫、小鼠、大鼠、豚鼠、仓鼠、猪、狗、兔子、羊和马)。
药物组合物可以静脉内给药、动脉内给药、经口给药、组织内给药(例如膀胱内给药、胸腔内给药、腹腔内给药、眼内给药、脑内给药)、经皮给药、经粘膜给药、经肺给药或经直肠给药而向对象给药。特别期望静脉内给药、经皮给药、经粘膜给药。以适合于这些给药方式的剂型、例如各种注射剂、经口剂、输液剂、吸入剂、滴眼剂、软膏剂、洗剂、栓剂进行给药。关于给药量、给药次数和给药间隔等各条件,可以由本领域技术人员在考虑mrna的种类、剂型、年龄或体重等对象状态、给药途径、疾病性质和程度的基础上适当设定。
药物组合物可以用于下述治疗:向成为各种疾病的原因的细胞中导入编码期望的基因的mrna的治疗。因此,本发明的第1方式还提供各种疾病的治疗方法,其包括下述步骤:将药物组合物向需要进行各种疾病的治疗的对象给药。需要说明的是,给药量、给药次数和给药间隔等各条件与上述相同。
要治疗的各种疾病可列举例如:癌、病毒性疾病、代谢性疾病、循环器官疾病、神经疾病、肾脏/泌尿器官疾病、恶性血液疾病、期待促进凋亡或抑制凋亡的疾病、胶原病、呼吸器官疾病和消化器官疾病。
对于药物组合物而言,可以适当选择、使用药剂制造中通常使用的赋形剂、填充剂、增量剂、结合剂、润湿剂、崩解剂、润滑剂、表面活性剂、分散剂、缓冲剂、保存剂、溶解助剂、防腐剂、矫味矫臭剂、无痛化剂、稳定剂和等渗剂等并利用常规方法制备。在制成静脉内注射剂(包括输液剂)时,例如以单位剂量安瓿或多剂量容器的状态等来提供。
在几个实施方式中,关于mrna的给药量,通常在考虑mrna的种类、剂型、年龄和体重等对象状态、给药途径、疾病性质和程度的基础上例如对成人为每天0.1mg~5g/人的范围内,优选为1mg~2g/人的范围内。该给药量有时也根据目标疾病的种类、给药方式、靶分子而不同。因此,某些情况下为其以下即充分,另外有时则需要其以上的用量。另外,可以1天1次至数次给药,或以1天至数天的间隔给药。
1.4.mrna递送用试剂盒
本发明的第1方式的mrna递送用试剂盒,其特征在于,含有与上述未经化学修饰rna寡聚物或经化学修饰rna寡聚物进行了杂交的mrna。与未经化学修饰rna寡聚物或经化学修饰rna寡聚物杂交的mrna可以内包于转运载体。或者,与未经化学修饰rna寡聚物或经化学修饰rna寡聚物杂交的mrna可以不内包于转运载体,即,可以为裸露的形态。优选的是,与未经化学修饰rna寡聚物或经化学修饰rna寡聚物进行了杂交的mrna内包于转运载体。前者的本发明的第1方式的mrna递送用试剂盒,其特征在于,含有转运载体。该试剂盒例如可以优选用于各种疾病的治疗方法,所述各种疾病的治疗方法使用与上述未经化学修饰rna寡聚物或经化学修饰rna寡聚物杂交的mrna或转运载体。
试剂盒中,与上述未经化学修饰rna寡聚物或经化学修饰rna寡聚物杂交的mrna或转运载体的保存状态没有限定,可以考虑其稳定性(保存性)和使用容易性等而选择溶液状或粉末状等状态。
试剂盒中,除了与上述未经化学修饰rna寡聚物或经化学修饰rna寡聚物杂交的mrna或转运载体以外,还可以含有其它构成要素。作为其它构成要素,可列举例如:各种缓冲液和使用说明书(使用指南)。
2.本发明的第2方式
2.1.本发明的第2方式的概要
mrna本身的免疫原性低,因此难以诱发炎症反应。因此,传统的使用单链的mrna的疫苗不可避免地要组合使用用于有效诱发炎症反应的佐剂。
在此,已知当将rna制成双链时会诱导更强的炎症反应。因此,本发明人想到下述方案:对于编码抗原蛋白的单链的mrna,使具有与该mrna互补的序列的rna链(“互补链rna”)与其杂交而形成双链rna来给药。通过施加不发生由互补链rna的蛋白质表达的控制,从而可以期待如下效果:双链rna得到作为目标的蛋白质表达、同时实现充分的免疫诱导。另外,可以认为,rna分子本身存在于生物体内、并不是使用外源物质,因此在使用双链rna时,可确保较高的安全性。
在使互补链rna与mrna的全长杂交时,与未进行杂交的mrna相比,观察到非常强的炎症反应(图23的(a)),但从mrna的蛋白质表达效率降至1/100以下(图23的(b))。因此,本发明人想到用更短的互补链进行部分性杂交的方案。获知,作为形成双链的部位与编码序列杂交的情况下,蛋白质表达效率下降,但如果互补链(polyu)主要与附加在3’末端的polya序列杂交,则几乎不会使蛋白质表达效率下降(图23的(b)),并且诱发了强烈炎症反应(图23的(a))。
因此,本发明的第2方式提供一种mrna疫苗,其含有双链rna,所述双链rna包含编码抗原的mrna、和与该mrna的至少polya序列杂交的至少1个rna寡聚物,上述至少1个rna寡聚物未经化学修饰或经化学修饰。本发明的第2方式的mrna疫苗可以同时实现高效地表达蛋白质和诱导免疫能力。
关于使用本发明的第2方式的mrna疫苗能否实际提高疫苗效果这一点,着眼于细胞免疫而评价了对小鼠的免疫诱导能力(图25的(a))。这里,使用卵清蛋白(ova)作为模型抗原,将表达ova的mrna向小鼠的腹股沟淋巴结给药。接着,回收给药1周后的脾脏细胞,通过elispot法评价其中的特异性地与ova反应的细胞数量。于是获知,向淋巴结给药的情况下,polya序列上杂交有互补链rna(polyu)的mrna与未杂交的mrna相比,显著强烈地诱导了抗原特异性细胞免疫(图25的(b))。从而证实,使用本发明的第2方式的mrna疫苗可提高细胞免疫诱导效果。
进而,对于体液免疫,使用本发明的第2方式的mrna疫苗对小鼠的免疫诱导能力进行了评价(图26的(a)),获知polya序列上杂交有互补链rna(polyu)的mrna,与未杂交的mrna相比,显著强烈地诱导了抗原特异性体液免疫(图26的(b))。
对于polya序列上杂交有polyu的mrna诱发炎症反应的机制也进行了查证。已知细胞内受体rig-i在双链rna识别中发挥重要作用。并且有报道指出,在rig-i与双链rna的结合中,一条rna链的5’末端被三磷酸化这一点很重要。我们获知,在使用使5’末端被三磷酸化的互补链rna(polyu)与polya序列杂交而成的mrna时,与使用使5’末端没有被三磷酸化的互补链rna(rnappp(-))与polya序列杂交而成的mrna时相比,诱发了更强的炎症反应(图23的(a))。因此暗示,rig-i与针对杂交了polya序列的mrna的炎症反应强烈相关。
在此,杂交有polyu时诱发了炎症反应,但使互补链与蛋白质编码序列杂交时,则没有怎么引起炎症(图23的(a))。强烈暗示了,依赖于所使用的互补链,利用rig-i的三磷酸识别不同,我们猜测有如下可能性:在polyu的情况下,5’末端在mrna末端被露出,三磷酸容易立体地被rig-i识别的可能性;三磷酸周围的序列中包含多个u但au键弱,因此三磷酸的运动性提高,从而容易被识别等。由此强烈暗示了如下可能性:互补链的选择对于rig-i介导的自然免疫应答而言是重要的。
通常已知双链rna被导入细胞内时,会诱发强烈的炎症反应。但是获知,当全长的互补链结合于mrna时,会抑制由mrna的蛋白质表达。本发明的第2方式使互补链以polya序列为中心进行位点特异性杂交,从而可以在确保从mrna的蛋白质表达的状态下诱发炎症反应。
2.2.mrna疫苗
本发明的第2方式提供一种mrna疫苗,其含有双链rna,所述双链rna由编码抗原的mrna、和与该mrna的至少polya序列杂交的至少1个rna寡聚物构成,上述至少1个rna寡聚物未经化学修饰或经化学修饰。
2.2.1.mrna
mrna是指信使rna,通常含有5’非翻译区(5’utr)、编码区和3’非翻译区(3’utr)。mrna通常还含有5’末端的帽子结构(5’cap)和3’末端的polya序列。
mrna疫苗中所使用的mrna可以是下述的任一种。
(1)依次包含5’cap、5’utr、编码区、3’utr和polya的mrna。
(2)依次包含5’cap、5’utr、编码区和polya的mrna。
(3)依次包含5’utr、编码区、3’utr和polya的mrna。
(4)依次包含5’utr、编码区和polya的mrna。
mrna疫苗中所使用的mrna可以如下制作:利用公知方法使编码目标基因的模板dna在体外环境下转录,从而制作。例如可以按照blood108(13)(2006)4009-17中记载的方法制作。具体而言,如下制作:将在蛋白质编码序列的下游整合有polya/t链的模板dna,在polya/t链的紧下游处切断,在含有翻译酶、核苷、5’帽子类似物的缓冲液中进行体外转录,然后对mrna进行纯化,从而制作。mrna的更具体的制备方法如后述的实施例的记载。
作为mrna的编码区所编码的抗原,可以从适合于诱发免疫应答的公知抗原中任意选择。作为抗原,更具体而言,可列举肿瘤抗原、来自病毒的抗原、来自细菌的抗原、来自真菌的抗原、来自原生生物的抗原、来自动物的抗原、来自植物的抗原、自身免疫病的自身抗原等。mrna所编码的抗原可以是1个抗原,或者、也可以是2个以上(例如2个、3个、4个或5个以上)的相同或不同的抗原。在本发明的第2方式的几个实施方式中,mrna所编码的抗原为1个抗原。
mrna的polya序列的长度例如为10~500碱基,优选为30~300碱基,更优选为60~250碱基。
mrna的5’utr和3’utr的序列可以是与天然产生的序列具有100%的序列同一性的序列,或者也可以将部分序列或其整体置换为其它5’utr和/或3’utr的序列。作为其它5’utr和/或3’utr的序列,可列举例如:编码球蛋白、羟基类固醇(17-β)脱氢酶4或白蛋白的mrna的5’utr和/或3’utr的序列。
在几个实施方式中,mrna未经修饰。这种情况下,mrna本身是天然的,因此可以期待翻译的过程几乎不会被妨碍。
在另外几个实施方式中,为了使mrna进一步稳定化,可以对mrna进行修饰。作为mrna的修饰,可列举mrna的碱基的化学修饰、mrna的编码区的g/c含量的修饰、mrna的cap结构的修饰等。
已知mrna的碱基的化学修饰例如可以提高mrna的耐酶解性。这种mrna本身的化学修饰碱基可列举例如:甲基化碱基(例如5-甲基胞嘧啶)、硫修饰碱基(例如2-硫尿苷)、假尿苷、n1甲基假尿苷和5甲氧基尿苷。
mrna的编码区的g/c含量的修饰为使g(鸟嘌呤)/c(胞嘧啶)的含量变大的修饰,从而可以形成更稳定的mrna。
mrna的cap结构的修饰是使5’侧的第1位或第2位的核糖的2位为甲氧基的修饰,还已知该修饰可提高表达效率。
mrna的制备和修饰可以利用公知方法或以其为基准的方法来进行。
2.2.2.rna寡聚物
本发明的第2方式中,mrna的至少polya序列与至少1个rna寡聚物杂交。另外,该rna寡聚物不含化学修饰。
1个rna寡聚物所杂交的mrna的序列例如为下述中的任一序列。
(1)mrna的polya序列中的连续序列。
(2)mrna的3’utr和polya序列中的连续序列。
(3)mrna的编码区和polya序列中的连续序列。
(1)mrna的polya序列中的连续序列的情况下,按照1个rna寡聚物与polya序列的整体(100%)或一部分杂交、且该rna寡聚物不与其紧前方的序列(即,3’utr或编码区)杂交的方式来设计rna寡聚物。在此,polya序列的一部分是指:碱基长大于polya序列的全长的0%且小于其100%、并且为例如10碱基长以上的碱基长(优选为17碱基长以上的碱基长)的序列。优选mrna的polya序列部分存在与rna寡聚物杂交的17碱基以上的互补序列。
在将mrna设计为在polya序列的紧前方含有3’utr序列的情况下,1个rna寡聚物所杂交的序列可以是(2)mrna的3’utr和polya序列中的连续序列。这种情况下,按照1个rna寡聚物与polya序列的整体(100%)或一部分和其紧前方的3’utr序列的一部分的连续序列杂交的方式来设计rna寡聚物。这种情况下,1个rna寡聚物可以例如按照与碱基长大于polya序列的全长的0%且小于其100%、并且为例如10碱基长以上的碱基长(例如10、11、12、13、14、15、16或17碱基长以上的碱基长,优选为17碱基长以上的碱基长)的序列和碱基长大于其紧前方的3’utr序列的全长的0%且小于其100%的序列杂交的方式来设计。优选在mrna的polya序列部分和3’utr序列部分存在与rna寡聚物杂交的合计17碱基以上的互补序列。rna寡聚物所杂交的mrna的3’utr序列部分越短则越优选,例如为1~30碱基长,优选为1~25碱基长,更优选为1~2碱基长。
在将mrna设计为在polya序列的紧前方含有编码序列的情况下,1个rna寡聚物所杂交的序列可以是(3)mrna的编码序列和polya序列中的连续序列。这种情况下,按照1个rna寡聚物与polya序列的整体(100%)或一部分和其紧前方的编码序列的一部分的连续序列杂交的方式来设计rna寡聚物。这种情况下,1个rna寡聚物例如可以按照与碱基长大于polya序列的全长的0%且小于其100%、并且为例如10碱基长以上的碱基长(例如10、11、12、13、14、15、16或17碱基长以上的碱基长,优选为17碱基长以上的碱基长)的序列和碱基长大于其紧前方的编码序列的全长的0%且小于其100%的序列杂交的方式来设计。优选在mrna的polya序列部分和编码序列部分存在与rna寡聚物杂交的合计17碱基以上的互补序列。rna寡聚物所杂交的mrna的编码序列部分越短则越优选,例如为1~30碱基长,优选为1~25碱基长,更优选为1~2碱基长。
rna寡聚物具体可列举以下例子。
(a)具有与上述(1)~(3)中的任一连续序列互补的序列的rna寡聚物、或
(b)具有下述rna序列且与mrna杂交的rna寡聚物,所述rna序列和与上述(1)~(3)中的任一连续序列互补的序列具有90%以上的同一性。
“具有90%以上的同一性的rna序列”中的“90%以上”的范围为例如90%以上、91%以上、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上、99%以上、99.1%以上、99.2%以上、99.3%以上、99.4%以上、99.5%以上、99.6%以上、99.7%以上、99.8%以上、或99.9%以上。上述同一性的数值通常是越大越优选。需要说明的是,rna序列的同一性可以使用blast(例如,参照altzshuls.f.etal.,j.mol.biol.215,403(1990))等分析程序确定。使用blast的情况下,使用各程序的默认参数。
“与mrna杂交”是指:在后述的杂交条件下,rna寡聚物与mrna进行杂交。
rna寡聚物可以还含有其它序列,或者也可以不含其它序列。“其它序列”例如为制作rna寡聚物时残留的启动子序列、限制酶序列、除此之外还有设计rna寡聚物时不得不残留的序列、或它们的一部分。含有“其它序列”的情况下,“其它序列”的碱基长例如为1~30碱基,优选为1~25碱基,更优选为1~2碱基。
rna寡聚物优选由至少10碱基的序列构成,更优选由至少17碱基的序列构成,进一步优选由至少30碱基的序列构成,特别优选由至少60碱基的序列构成。另外,在几个实施方式中,rna寡聚物优选由10~500碱基的序列构成,更优选由17碱基~500碱基的序列构成,进一步优选由30~300碱基的序列构成,特别优选由60~250碱基的序列构成。rna寡聚物的碱基长可以考虑mrna的polya序列的长度等而适当设计。
几个方式的rna寡聚物不含化学修饰。另外几个方式的rna寡聚物含有化学修饰。化学修饰可列举例如利用疏水性基团的修饰。作为利用疏水性基团的修饰,可列举胆固醇修饰和生育酚修饰。另外,作为化学修饰,还可列举例如聚乙二醇修饰。
需要说明的是,“化学修饰”的定义中不包括5’末端的三磷酸结构。
rna寡聚物的制备可以利用公知方法或以其为基准的方法进行。rna寡聚物通过体外转录基于模板dna制作。原理上,rna寡聚物的制备可以与上述的mrna的制作几乎同样地进行,但是,mrna的情况下,在转录时添加5’帽子类似物,而制作rna寡聚物时则不添加帽子类似物。从而在利用生物学手段制备rna寡聚物时,可以形成5’末端具有三磷酸结构的rna寡聚物。三磷酸的除去方法如后所述。
2.2.3.双链rna
双链rna是上述的mrna与至少1个上述的rna寡聚物杂交而成的物质。
双链rna可以通过mrna与rna寡聚物的杂交反应来制备。更具体而言,可以按照后述的实施例中记载的条件或以其为基准的条件来进行杂交反应。与1个mrna杂交的rna寡聚物的数量为至少1个,优选为1~5个,更优选为1~3个,进一步优选为1~2个,特别优选为1个。
可以利用公知方法和条件进行rna寡聚物向mrna的杂交。更具体而言,杂交时,升温并静置一定时间后,缓慢降温。进行升温的目的是,使mrna或寡聚物的分子内、分子间预先存在的互补键断开,从而使mrna和寡聚物更高效地结合。只要保证了适当的杂交,则该温度、时间可适当调节。尤其是,polya、polyu预先与其它序列结合的可能性低,可以设为更平缓的升温条件。缓慢降温的方式可增加杂交的特异性。另外,寡聚物链长对杂交条件的设定影响不大。应一边评价杂交效率一边设定适当的条件。例如,可列举后述的实施例中记载的方法和条件。
在几个实施方式中,双链rna具有rna寡聚物的5’末端的三磷酸结构。通过制成具有rna寡聚物的5’末端的三磷酸结构,从而可以诱发更强的炎症反应。
在另外几个实施方式中,双链rna不具有rna寡聚物的5’末端的三磷酸结构。去除三磷酸化的方法可以利用公知方法或以其为基准的方法来进行。作为去除三磷酸化的方法,例如,可列举如后述的实施例那样的、使用热敏磷酸酶(antarcticphosphatase)(newenglandbiolabs,cat.no.m0289s)的方法。
在几个实施方式中,双链rna为裸露的形态。即,双链rna不伴有转运载体。
在另外几个实施方式中,双链rna为内包于转运载体的形态。转运载体只要能够内包双链mrna并且能够将双链mrna递送到对象体内的优选位置即可,没有特别限定。转运载体为脂质性mrna载体或阳离子型聚合物复合体,更优选为高分子胶束或脂质性mrna载体。
高分子胶束具有双层结构,所述双层为:由凝聚的核酸和阳离子型聚合物形成的内核;和由亲水性聚合物形成的外壳。阳离子型聚合物例如为聚氨基酸衍生物。亲水性聚合物例如为聚乙二醇(“peg”)。内核通过物理手段或化学手段封入mrna。外壳利用其物理化学性质将内壳中所封入的mrna递送到规定的组织。高分子胶束可以通过胞吞进入细胞内。高分子胶束例如可以利用嵌段聚合物上的聚阳离子与核酸的综合作用(聚离子复合物(“pic”)),此外还可以利用其与无机分子的杂化胶束。作为pic型高分子胶束可列举例如:通过peg-pasp(det)-chol、peg-pasp(det)、peg-plys与mrna的多分子缔合形成的pic胶束;嵌段共聚物中使用了pasp(tet)、pasp(tep)之类的其它聚阳离子的高分子胶束(uchida,s.,etal.,biomaterials(2016)82,p.221-228);以及,使用了三嵌段共聚物的高分子胶束(osawa,s.,etal.biomacromolecules17,p354-361(2016))。作为与无机颗粒的杂化型高分子胶束,可列举例如:peg化磷酸钙(cap)颗粒(pittela,etal.,biomaterials(2011)32,p.3106-3114);peg化二氧化硅颗粒(miyata,k.,etal.biomaterials(2010)31,p4764-4770)。
脂质性mrna载体呈下述形态:使脂质或阳离子脂质形成载体、并且内包或结合有mrna的形态。例如:由选自下述组中的一种或多种物质形成并将其与mrna混合而得到的,所述物质为:n-[1-(2,3-二油酰氧基)丙基]-n,n,n-三甲基氯化铵(dotma)、2,3-二油酰氧基-n-[2-(精胺甲酰氨基)乙基]-n,n-二甲基-1-丙铵基三氟乙酸(dospa)、1,2-二油酰氧基-3-(三甲基铵)丙烷(dotap)、n-[1-(2,3-双十四烷氧基)丙基]-n,n-二甲基-n-(2-羟乙基)溴化铵(dmrie)或dc-胆固醇之类的阳离子性脂质;二硬脂酰磷脂酰胆碱(dspc)或二油酰磷脂酰乙醇胺(dope)之类的中性磷脂;peg化脂质;和胆固醇。
阳离子型聚合物复合体例如为直链状或支链状聚乙烯亚胺、聚赖氨酸、聚精氨酸、壳聚糖衍生物、聚甲基丙烯酸衍生物与mrna的混合物。
这些转运载体可以利用公知方法或以其为基准的方法来制备。
2.2.4.佐剂
在几个优选方式中,rna疫苗不与佐剂一起使用。
在另外几个实施方式中,rna疫苗与佐剂一起使用。在与佐剂一起使用的情况下,rna疫苗可以与佐剂一起制剂化。佐剂是适合于强化免疫反应的任意化合物。这种佐剂是公知的,本领域技术人员可以从任意的佐剂中选择合适的佐剂。
2.3.疾病的预防或治疗
mrna疫苗可以用于在需要预防或治疗疾病的对象中预防或治疗该疾病。
所预防或治疗的疾病可列举例如癌症、病毒性感染症、细菌性感染症、真菌感染症、原生生物感染症和自身免疫病。通过与所预防或治疗的疾病相应地适当选择上述mrna的编码区所编码的抗原,可以预防或治疗该疾病。
“对象”为人或人以外的生物,例如禽类和非人哺乳动物(例如牛、猴子、猫、小鼠、大鼠、豚鼠、仓鼠、猪、狗、兔子、羊和马)。
mrna疫苗可以按照常规方法制剂化。在几个实施方式中,mrna疫苗含有药物上可接受的添加剂。作为药物上可接受的添加剂,可列举水、药物上可接受的有机溶剂、胶原蛋白、聚乙烯醇、聚乙烯基吡咯烷酮、羧基乙烯基聚合物、羧甲基纤维素钠、聚丙烯酸钠、藻酸钠、水溶性葡聚糖、羧甲基淀粉钠、果胶、甲基纤维素、乙基纤维素、黄原胶、阿拉伯胶、酪蛋白、琼脂、聚乙二醇、双甘油、甘油、丙二醇、凡士林、石蜡、硬脂醇、硬脂酸、人血清白蛋白、甘露醇、山梨醇、乳糖、药物上可接受的表面活性剂等。
可根据mrna疫苗的剂型,从上述中单独或适当组合地选择上述添加剂。例如,在以注射用制剂形式使用时,可以使用如下制备的制剂:将纯化后的双链rna溶解于溶剂(例如生理盐水、缓冲液、葡萄糖溶液等),向其中加入tween80、tween20、明胶、人血清白蛋白等,从而得到。或者,为了制成使用前溶解的剂型也可以制成冷冻干燥品。作为冷冻干燥用赋形剂,可列举例如:甘露醇、葡萄糖、乳糖、蔗糖、甘露醇、山梨醇等糖类;来自玉米、小麦、水稻、马铃薯或其它植物的淀粉等淀粉;甲基纤维素、羟丙甲基纤维素或羧甲基纤维素钠等纤维素;阿拉伯胶、黄蓍胶等胶类;明胶、胶原蛋白等等。
mrna疫苗的给药量可以根据对象的年龄、性别、症状、给药途径、给药次数、剂型等适当选择。mrna疫苗的有效给药量为减轻疾病的征兆或状态的疫苗量。这样的mrna疫苗的治疗效果和毒性可以通过细胞培养或实验动物的标准药学步骤、例如ed50(在总体的50%中,对于治疗而言有效的用量)和ld50(对于总体的50%为致死性的用量)来确定。在几个实施方式中,对于成人,将mrna疫苗的给药量设为每天10ng~1g、100ng~100mg、1μg~10μg、或30μg~300μg的mrna的范围。
可以适当选择mrna疫苗的给药途径,包括例如经皮、鼻腔内、经支气管、肌肉内、腹腔内、静脉内、皮下、直肠内和阴道内的途径,但不限于这些途径。
关于mrna疫苗的给药次数,可以设为1次,或者当副作用为在临床上可接受的范围内时可以设为多次。
在几个实施方式中,测定给药mrna疫苗时的抗体效价或细胞免疫活性。例如,可以从生物体采集血液并对血清中的igg进行定量,从而评价抗体效价。可以从生物体分离和培养淋巴细胞,测定3h-胸苷的引入,从而评价细胞免疫活性。
2.4.试剂盒
本发明的第2方式的试剂盒,其特征在于,含有上述mrna疫苗。该试剂盒例如可以优选用于上述各种疾病的治疗方法,其中,所述各种疾病的治疗方法使用上述rna疫苗。
试剂盒中,上述mrna疫苗的保存状态没有限定,考虑到其稳定性(保存性)和使用容易性等,可以选择溶液状或粉末状等状态。
试剂盒除了上述mrna疫苗以外,可以还含有其它构成要素。作为其它构成要素,可列举例如:各种缓冲液和使用说明书(使用指南)。试剂盒中可以含有或不含佐剂。优选的是,试剂盒不含佐剂。
3.本发明的第3方式
3.1.本发明的第3方式的概要
已知细胞内受体rig-i在双链rna识别中发挥重要作用。并且有报道指出,在rig-i与双链rna的结合中,一条rna链的5’末端被三磷酸化这一点很重要。制作了将5’末端被三磷酸化的第2rna寡聚物与第1rna寡聚物杂交,再将其与mrna杂交而成的双链mrna。图37的双链mrna例示出每1个mrna杂交有5个rna寡聚物的情况。另一方面,后述的实施例中使用了每1个mrna上杂交有1~3个rna寡聚物的物质。使用这些双链mrna的情况下,与未杂交的mrna相比,免疫激活作用提高(图38和39)、另外,mrna的表达效率得到维持(图40)。此时,免疫激活作用随着与mrna杂交的双链rna寡聚物的个数的增加而提高(图38和39)。因此暗示,rig-i与针对杂交有rna寡聚物的mrna的炎症反应强烈相关。
本发明的第2方式的特定mrna疫苗尽管蛋白质表达效率稍稍下降(图40的“mrna:pu”),但在使用上述双链mrna的情况下,翻译活性得到充分维持(图40的“1个”、“2个”和“3个”)。进而,通过调整所杂交的rna寡聚物数量,可以调节免疫应答的强度(图38和39的“1个”、“2个”和“3个”)。过度的炎症除了会成为副作用的原因以外,在得到疫苗效果方面也可能是不优选的。通过改变rna寡聚物的数量可以调节此次的免疫应答强度,这一点对于得到就获得疫苗效果而言适当强度的炎症反应方面极为重要。
另外,本发明的第3方式的mrna疫苗与第2方式的mrna疫苗相比,容易构建对rig-i识别而言很重要的平滑5’末端三磷酸化结构。
进而,本发明的第3方式的mrna疫苗在通过体外转录来制备第2rna链时,目标rna的互补链rna也会作为副产物被转录出来,但是与第2方式的特定mrna疫苗相比,可以容易地避免该副产物的产生。
3.2.mrna疫苗
本发明的第3方式提供一种mrna疫苗,其含有双链rna,所述双链rna由编码抗原的mrna、以及与该mrna杂交的至少1个第1rna寡聚物和与该第1rna寡聚物杂交的第2rna寡聚物构成,
第1rna寡聚物含有:
(a)从5’末端起依次含有第1rna序列和第2rna序列的rna序列,其中,所述第1rna序列由与mrna的序列互补的12~40碱基的序列构成,所述第2rna序列由与第2rna寡聚物的序列互补的10~200碱基的序列构成、
(b)从5’末端起依次含有第1rna序列和第2rna序列的rna序列,其中,所述第1rna序列和与mrna的序列互补的12~40碱基的序列具有90%以上的同一性且与mrna杂交,所述第2rna序列和与第2rna寡聚物的序列互补的10~200碱基的序列具有90%以上的同一性且与第2rna寡聚物杂交、
(c)从5’末端起依次含有第2rna序列和第1rna序列的rna序列,其中,所述第2rna序列由与第2rna寡聚物的序列互补的10~200碱基的序列构成,所述第1rna序列由与mrna的序列互补的12~40碱基的序列构成、或者
(d)从5’末端起依次含有第2rna序列和第1rna序列的rna序列,其中,所述第2rna序列和与第2rna寡聚物的序列互补的10~200碱基的序列具有90%以上的同一性且与第2rna寡聚物杂交,所述第1rna序列和与mrna的序列互补的12~40碱基的序列具有90%以上的同一性且与mrna杂交。
3.2.1.mrna
mrna是指信使rna,通常含有5’非翻译区(5’utr)、编码区和3’非翻译区(3’utr)。mrna通常还含有5’末端的帽子结构(5’cap)和3’末端的polya序列。
mrna疫苗中所使用的mrna可以是下述的任一种。
(1)依次包含5’cap、5’utr、编码区、3’utr和polya的mrna。
(2)依次包含5’cap、5’utr、编码区和polya的mrna。
(3)依次包含5’utr、编码区、3’utr和polya的mrna。
(4)依次包含5’utr、编码区和polya的mrna。
mrna疫苗中所使用的mrna可以如下制作:利用公知方法使编码目标基因的模板dna在体外环境下转录,从而制作。例如可以按照blood108(13)(2006)4009-17中记载的方法制作。具体而言,如下制作:将在蛋白质编码序列的下游整合有polya/t链的模板dna,在polya/t链的紧下游处切断,在含有翻译酶、核苷、5’帽子类似物的缓冲液中进行体外转录,然后对mrna进行纯化,从而制作。mrna的更具体的制备方法如后述的实施例的记载。
作为mrna的编码区所编码的抗原,可以从适合于诱发免疫应答的公知抗原中任意选择。作为抗原,更具体而言,可列举肿瘤抗原、来自病毒的抗原、来自细菌的抗原、来自真菌的抗原、来自原生生物的抗原、来自动物的抗原、来自植物的抗原、自身免疫病的自身抗原等。mrna所编码的抗原可以是1个抗原,或者也可以是2个以上(例如2个、3个、4个或5个以上)的相同或不同的抗原。在本发明的第3方式的几个实施方式中,mrna所编码的抗原为1个抗原。
mrna的polya序列的长度例如为10~500碱基,优选为30~300碱基,更优选为60~250碱基。
mrna的5’utr和3’utr的序列可以是与天然产生的序列具有100%的序列同一性的序列,或者也可以将部分序列或其整体置换为其它5’utr和/或3’utr的序列。作为其它5’utr和/或3’utr的序列,可列举例如编码球蛋白、羟基类固醇(17-β)脱氢酶4或白蛋白的mrna的5’utr和/或3’utr的序列。
在几个实施方式中,mrna未经修饰。这种情况下,mrna本身是天然的,因此可以期待翻译的过程几乎不会被妨碍。
在另外几个实施方式中,为了使mrna进一步稳定化,可以对mrna进行修饰。作为mrna的修饰,可列举mrna的碱基的化学修饰、mrna的编码区的g/c含量的修饰、mrna的cap结构的修饰等。
已知mrna的碱基的化学修饰例如可以提高mrna的耐酶解性。这种mrna本身的化学修饰碱基可列举例如:甲基化碱基(例如5-甲基胞嘧啶)、硫修饰碱基(例如2-硫尿苷)、假尿苷、n1甲基假尿苷和5-甲氧基尿苷。
mrna的编码区的g/c含量的修饰为使g(鸟嘌呤)/c(胞嘧啶)的含量变大的修饰,从而可以形成更稳定的mrna。
还已知,mrna的cap结构的修饰是使5’侧的第1位或第2位的核糖的2位为甲氧基的修饰,从而可提高表达效率。
mrna的制备和修饰可以利用公知方法或以其为基准的方法来进行。
3.2.2.rna寡聚物
本发明的第3方式中,至少1个第1rna寡聚物与mrna杂交。另外,进一步地,第2rna寡聚物与第1rna寡聚物杂交。
第1rna寡聚物是含有下述rna序列的rna链:
(a)从5’末端起依次含有第1rna序列和第2rna序列的rna序列,其中,所述第1rna序列由与mrna的序列互补的12~40碱基的序列构成,所述第2rna序列由与第2rna寡聚物的序列互补的10~200碱基的序列构成、
(b)从5’末端起依次含有第1rna序列和第2rna序列的rna序列,其中,所述第1rna序列和与mrna的序列互补的12~40碱基的序列具有90%以上的同一性且与mrna杂交,所述第2rna序列和与第2rna寡聚物的序列互补的10~200碱基的序列具有90%以上的同一性且与第2rna寡聚物杂交、
(c)从5’末端起依次含有第2rna序列和第1rna序列的rna序列,其中,所述第2rna序列由与第2rna寡聚物的序列互补的10~200碱基的序列构成,所述第1rna序列由与mrna的序列互补的12~40碱基的序列构成、或者
(d)从5’末端起依次含有第2rna序列和第1rna序列的rna序列,其中,所述第2rna序列和与第2rna寡聚物的序列互补的10~200碱基的序列具有90%以上的同一性且与第2rna寡聚物杂交,所述第1rna序列和与mrna的序列互补的12~40碱基的序列具有90%以上的同一性且与mrna杂交。
“具有90%以上的同一性的rna序列”中的“90%以上”的范围为例如90%以上、91%以上、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上、99%以上、99.1%以上、99.2%以上、99.3%以上、99.4%以上、99.5%以上、99.6%以上、99.7%以上、99.8%以上、或99.9%以上。上述同一性的数值通常是越大越优选。需要说明的是,rna序列的同一性可以使用blast(例如,参照altzshuls.f.etal.,j.mol.biol.215,403(1990))等分析程序确定。使用blast的情况下,使用各程序的默认参数。
“与mrna杂交”是指:在后述的杂交条件下,rna寡聚物与mrna进行杂交。“与第1rna杂交”是指:在后述的杂交条件下,第2rna寡聚物与第1rna杂交。
按照与mrna的连续12~40碱基的序列杂交的方式来设计第1rna寡聚物的第1rna序列。在几个实施方式中,第1rna寡聚物的第1rna序列由与mrna的序列互补的12~30碱基的序列构成。更优选的是,第1rna寡聚物的第1rna序列由与mrna的序列互补的15~23碱基的序列构成。进一步优选的是,第1rna寡聚物的序列的第1rna序列由与mrna的序列互补的17碱基的序列构成。
rna寡聚物所杂交的mrna中的位置可以是5’utr、编码区、3’utr和polya序列中的任意位置。对于rna寡聚物,期望预测mrna的二级结构、并且按照与mrna链中不具有二级结构的部分进行杂交的方式来设计rna寡聚物。即,优选按照rna寡聚物与mrna全长序列中的、不具有二级结构的部分进行杂交的方式来设计rna寡聚物。作为预测mrna的二级结构的软件,可列举例如后述实施例中记载的软件。在几个实施方式中,按照rna寡聚物与mrna的5’utr、编码区和3’utr的至少1个序列进行杂交的方式来设计rna寡聚物。
关于第1rna寡聚物的第2rna序列,在第1rna序列为上述各碱基长的基础上按照与第2rna寡聚物的连续10~200碱基的序列杂交的方式来设计。在几个实施方式中,在第1rna序列为上述各碱基长的基础上,第1rna寡聚物的第2rna序列由与第2rna寡聚物的序列互补的15~150碱基的序列构成。更优选的是,在第1rna序列为上述各碱基长的基础上,第1rna寡聚物的第2rna序列由与第2rna寡聚物的序列互补的20~100碱基的序列构成。进一步优选的是,在第1rna序列为上述各碱基长的基础上,第1rna寡聚物的序列的第2rna序列由与第2rna寡聚物的序列互补的20~80碱基的序列构成。
第1rna寡聚物的第2rna序列例如按照下述方式来设计。即,按照满足以下的(i)~(iv)中的至少1个、更优选满足2个、3个或4个的方式来设计。在几个优选方式中,第1rna寡聚物的第2rna序列按照至少满足以下的(i)和(ii)、更优选还满足以下的(iii)和(iv)中的至少1个的方式来设计。
(i)当通过使模板dna在体外环境下转录来制备含有5’末端三磷酸化的第2rna寡聚物时,不形成与目标rna寡聚物的互补链rna(副产物)、
(ii)第2rna寡聚物与第1rna寡聚物进行杂交的那一侧的双链rna的末端采取5’末端三磷酸化结构,优选采取平滑5’末端三磷酸化结构、
(iii)第2rna序列和第2rna寡聚物不与mrna上的序列杂交、和
(iv)第1rna寡聚物和第2rna寡聚物不形成二级结构。
在此,为了实现“(i)当通过使模板dna在体外环境下转录来制备含有5’末端三磷酸化的第2rna寡聚物时,不产生目标rna寡聚物的互补链rna(副产物)”,例如按照以下方式来设计。即,按照除去了转录互补链rna所需的碱基的方式,来制备第2rna寡聚物。因此,按照即使除去该碱基也能够转录作为目标的第2rna寡聚物的方式,来设计模板dna。例如在体外转录序列gugugugugu(序列号67)时,可能会产生序列acacacacac(序列号68)作为副产物,但通过除去a而进行体外转录,则避免了该副产物的生成。并且按照能够制备这样的第2rna寡聚物的方式来设计第1rna寡聚物的第2rna序列。
另外,为了实现“(ii)第2rna寡聚物与第1rna寡聚物进行杂交的那一侧的双链rna的末端采取5’末端三磷酸化结构,优选采取平滑5’末端三磷酸化结构”,则按照下述方式来设计。
即,当第1rna寡聚物为上述(a)的rna序列或上述(b)的rna序列时,通过体外转录5’末端具有三磷酸化结构的第2rna寡聚物,从而制备第2寡聚物。优选的是,此时按照第2寡聚物的5’末端与第1寡聚物的3’末端杂交时形成平滑末端的方式来制备第1寡聚物。然后,按照能够制备这样的第1rna寡聚物和第2rna寡聚物的方式来设计第1rna寡聚物的第2rna序列。
另一方面,当第1rna寡聚物为上述(c)的rna序列或上述(d)的rna序列时,通过体外转录第1rna寡聚物,来制备第1rna寡聚物。优选的是,此时按照第1rna寡聚物的5’末端与第2rna寡聚物的3’末端杂交时形成平滑末端的方式,来制备第2寡聚物。然后,按照可以形成这样的第1rna寡聚物和第2rna寡聚物的方式来设计第1rna寡聚物的第2rna序列。
为了实现“(iii)第2rna序列和第2rna寡聚物不与mrna上的序列杂交”,用可以预测多个rna链的二级结构的软件(nupack,http://www.nupack.org)等对设计后的二级结构进行检验。
为了实现“(iv)第1rna寡聚物和第2rna寡聚物不形成二级结构”,用可以预测多个rna链的二级结构的软件(nupack,http://www.nupack.org)等对设计后的二级结构进行检验。
第1rna寡聚物的第1rna序列与第2rna序列之间可以包含或不含接头序列。在几个实施方式中,包含接头序列。关于接头序列的碱基长,在第1rna序列和第2rna序列为上述各碱基长的基础上,优选为1~100碱基,更优选为2~30碱基,进一步优选为2~20碱基。具体而言,按照与mrna、rna寡聚物的其它部位不进行杂交或难以进行杂交的方式来设计接头序列。在几个实施方式中,为了使接头序列难以与mrna杂交,而设计使用了腺嘌呤(a)、尿嘧啶(u)的接头。此时,使用了u的接头在达到一定长度以上时有可能与polya结合,因此原则上优选使用a。例如接头序列为上述碱基长的寡聚腺嘌呤序列。但是,与接头序列的该位置对应的mrna为尿嘧啶(u)时,如果将该位置的碱基设为腺嘌呤(a)则会与mrna杂交。这种情况下,优选将该位置的碱基变更为尿嘧啶(u)。
第1rna寡聚物可以还含有其它序列,或者也可以不含其它序列。在几个实施方式中,包含其它序列。“其它序列”例如为制作rna寡聚物时残留的启动子序列、限制酶序列、以及设计rna寡聚物时不得不残留的序列、或它们的一部分。含有“其它序列”的情况下,“其它序列”的碱基长例如为1~30碱基,优选为1~25碱基,更优选为1~2碱基。
第2rna寡聚物含有与第1rna寡聚物的第2rna序列杂交的例如10~200碱基的序列,优选含有15~150碱基的序列,更优选含有20~100碱基的序列,进一步优选含有24碱基的序列。第2rna寡聚物的设计方法如上述第1rna寡聚物的第2rna序列中所说明那样。
第2rna寡聚物可以还含有其它序列,或者也可以不含其它序列。“其它序列”例如为制作rna寡聚物时残留的启动子序列、限制酶序列、除此以外还有设计rna寡聚物时不得不残留的序列、或它们的一部分。含有“其它序列”的情况下,“其它序列”的碱基长例如为1~30碱基,优选为1~25碱基,更优选为1~2碱基。
在几个实施方式中,第1rna寡聚物和第2rna寡聚物不含化学修饰。在另外几个方式的第1rna寡聚物和第2rna寡聚物含有化学修饰。化学修饰可列举例如利用疏水性基团的修饰。作为利用疏水性基团的修饰,可列举胆固醇修饰和生育酚修饰。另外,作为化学修饰,还可列举例如聚乙二醇修饰。
需要说明的是,“化学修饰”的定义中不包括5’末端的三磷酸结构。
第1rna寡聚物和第2rna寡聚物的制备可以利用公知方法或以其为基准的方法进行。具体而言,第1rna寡聚物和第2rna寡聚物例如通过体外转录基于模板dna制作。原理上,第1rna寡聚物和第2rna寡聚物的制备可以与上述的mrna的制作几乎同样地进行,但是,mrna的情况下,在转录时添加5’帽子类似物,而制作第1rna寡聚物和第2rna寡聚物时则不添加帽子类似物。从而在利用生物学手段制备第1rna寡聚物和第2rna寡聚物时,可以形成5’末端具有三磷酸结构的rna寡聚物。三磷酸的除去方法如后所述。可以化学合成5’末端不具有三磷酸结构的rna寡聚物。
3.2.3.双链rna
在此,“双链rna”是指:上述的mrna与至少1个上述的第1rna寡聚物杂交、并且第1rna寡聚物与第2rna寡聚物杂交而成的物质。另外,有时将由第1rna寡聚物与杂交了第1rna寡聚物的第2rna寡聚物构成的物质称为“双链rna寡聚物”。
双链rna可以通过mrna与第1rna寡聚物的杂交反应、以及第1rna寡聚物与第2rna寡聚物的杂交反应而制备。更具体而言,杂交反应可以按照后述的实施例中记载的条件或以其为基准的条件来进行。
与1个mrna杂交的第1rna寡聚物的数量为至少1个,优选为1~50个,更优选为1~15个,进一步优选为1~5个。如果第1rna寡聚物的数量在1~50个的范围,则可以使mrna翻译效率维持在较高的水平。另外,当与1个mrna杂交的由第1rna寡聚物和第2rna寡聚物构成的双链rna寡聚物的个数增加时,免疫激活作用提高。因此,可以通过调节与1个mrna杂交的由第1rna寡聚物和第2rna寡聚物构成的双链rna寡聚物的个数,来调节免疫反应。
因此,这里提供一种调节免疫反应的方法,其包括下述步骤:调节杂交到1个mrna上的双链rna寡聚物的个数。
另外,杂交到1个第1rna寡聚物上的第2rna寡聚物的数量为1个。
可以利用公知方法和条件进行rna寡聚物向mrna的杂交。更具体而言,杂交时,升温并静置一定时间后,缓慢降温。进行升温的目的是,使mrna或寡聚物的分子内、分子间预先存在的互补键断开,从而使mrna和寡聚物更高效地结合。只要保证了适当的杂交,则该温度、时间可适当调节。尤其是,polya、polyu预先与其它序列结合的可能性低,可以设为更平缓的升温条件。缓慢降温的方式可增加杂交的特异性。另外,寡聚物链长对杂交条件的设定影响不大。应一边评价杂交效率一边设定适当的条件。例如,可列举后述的实施例中记载的方法和条件。
在几个实施方式中,双链rna中的、rna寡聚物的5’末端具有三磷酸结构。通过使rna寡聚物的5’末端具有三磷酸结构,从而可以诱发更强的炎症反应。
在另外几个实施方式中,双链rna中的、rna寡聚物的5’末端不具有三磷酸结构。去除三磷酸化的方法可以利用公知方法或以其为基准的方法来进行。去除三磷酸化的方法,例如,可列举如后述的实施例那样使用热敏磷酸酶(antarcticphosphatase)(newenglandbiolabs,cat.no.m0289s)的方法。
在几个实施方式中,双链rna的、第2rna寡聚物与第1rna寡聚物进行杂交那一侧的末端为平滑末端。已知当平滑末端的5’具有三磷酸化结构时,可提高rig-i介导的免疫诱导。在通过体外转录来转录含有5’末端三磷酸化的rna时,按照不形成目标rna的互补链rna的方式来设计。这里,除去了转录互补链rna所需的碱基而制备rna。因此,按照即使除去该碱基也能转录作为目标的rna的方式来设计。例如在体外转录序列gugugugugu(序列号67)时,可能会产生序列acacacacac(序列号68)作为副产物,但通过除去a而进行体外转录,则避免了该副产物的生成。
在几个实施方式中,双链rna为裸露的形态。即,双链rna不伴有转运载体。
在另外几个实施方式中,双链rna为内包于转运载体的形态。转运载体只要内包双链mrna并且可以将双链mrna递送到对象体内的优选位置即可,没有特别限定。转运载体为脂质性mrna载体或阳离子型聚合物复合体,更优选为高分子胶束或脂质性mrna载体。
高分子胶束具有双层结构,所述双层为:由凝聚的核酸和阳离子型聚合物形成的内核;和由亲水性聚合物形成的外壳。阳离子型聚合物例如为聚氨基酸衍生物。亲水性聚合物例如为聚乙二醇(“peg”)。内核通过物理手段或化学手段封入mrna。外壳利用其物理化学性质将内壳中所封入的mrna递送到规定的组织。高分子胶束可以通过胞吞进入细胞内。高分子胶束例如可以利用嵌段聚合物上的聚阳离子与核酸的综合作用(聚离子复合物(“pic”)),此外还可以利用其与无机分子的杂化胶束。作为pic型高分子胶束可列举例如:通过peg-pasp(det)-chol、peg-pasp(det)、peg-plys与mrna的多分子缔合形成的pic胶束;嵌段共聚物中使用了pasp(tet)、pasp(tep)之类的其它聚阳离子的高分子胶束(uchida,s.,etal.,biomaterials(2016)82,p.221-228);以及,使用了三嵌段共聚物的高分子胶束(osawa,s.,etal.,biomacromolecules17,p354-361(2016))。作为与无机颗粒的杂化型高分子胶束,可列举例如:peg化磷酸钙(cap)颗粒(pittela,etal.,biomaterials(2011)32,p.3106-3114);peg化二氧化硅颗粒(miyata,k.,etal.,biomaterials(2010)31,p4764-4770)。
脂质性mrna载体呈下述形态:使脂质或阳离子脂质形成载体、并且内包或结合有mrna的形态。例如:由选自下述组中的一种或多种物质形成并将其与mrna混合而得到的,所述物质为:n-[1-(2,3-二油酰氧基)丙基]-n,n,n-三甲基氯化铵(dotma)、2,3-二油酰氧基-n-[2-(精胺甲酰氨基)乙基]-n,n-二甲基-1-丙铵基三氟乙酸(dospa)、1,2-二油酰氧基-3-(三甲基铵)丙烷(dotap)、n-[1-(2,3-双十四烷氧基)丙基]-n,n-二甲基-n-(2-羟乙基)溴化铵(dmrie)或dc-胆固醇之类的阳离子性脂质;二硬脂酰磷脂酰胆碱(dspc)或二油酰磷脂酰乙醇胺(dope)之类的中性磷脂;peg化脂质;和胆固醇。
阳离子型聚合物复合体例如为直链状或支链状聚乙烯亚胺、聚赖氨酸、聚精氨酸、壳聚糖衍生物、聚甲基丙烯酸衍生物与mrna的混合物。
这些转运载体可以利用公知方法或以其为基准的方法来制备。
3.2.4.佐剂
在几个优选方式中,rna疫苗不与佐剂一起使用。
在另外几个实施方式中,rna疫苗与佐剂一起使用。在与佐剂一起使用的情况下,rna疫苗可以与佐剂一起制剂化。佐剂是适合于强化免疫反应的任意化合物。这种佐剂是公知的,本领域技术人员可以从任意的佐剂中选择合适的佐剂。
3.3.疾病的预防或治疗
mrna疫苗可以用于在需要预防或治疗疾病的对象中预防或治疗该疾病。
所预防或治疗的疾病可列举例如癌症、病毒性感染症、细菌性感染症、真菌感染症、原生生物感染症和自身免疫病。通过与所预防或治疗的疾病相应地适当选择上述mrna的编码区所编码的抗原,可以预防或治疗该疾病。
“对象”为人或人以外的生物,例如禽类和非人哺乳动物(例如牛、猴子、猫、小鼠、大鼠、豚鼠、仓鼠、猪、狗、兔子、羊和马)。
mrna疫苗可以按照常规方法制剂化。在几个实施方式中,mrna疫苗含有药物上可接受的添加剂。作为药物上可接受的添加剂,可列举水、药物上可接受的有机溶剂、胶原蛋白、聚乙烯醇、聚乙烯基吡咯烷酮、羧基乙烯基聚合物、羧甲基纤维素钠、聚丙烯酸钠、藻酸钠、水溶性葡聚糖、羧甲基淀粉钠、果胶、甲基纤维素、乙基纤维素、黄原胶、阿拉伯胶、酪蛋白、琼脂、聚乙二醇、双甘油、甘油、丙二醇、凡士林、石蜡、硬脂醇、硬脂酸、人血清白蛋白、甘露醇、山梨醇、乳糖、药物上可接受的表面活性剂等。
可根据mrna疫苗的剂型,上述中单独或适当组合地选择上述添加剂。例如,在以注射用制剂形式使用时,可以使用如下制备的制剂:将纯化后的双链rna溶解于溶剂(例如生理盐水、缓冲液、葡萄糖溶液等),向其中加入tween80、tween20、明胶、人血清白蛋白等,从而得到。或者,为了制成使用前溶解的剂型,可以制成冷冻干燥品。作为冷冻干燥用赋形剂,可列举例如:甘露醇、葡萄糖、乳糖、蔗糖、甘露醇、山梨醇等糖类;来自玉米、小麦、水稻、马铃薯或其它植物的淀粉等淀粉;甲基纤维素、羟丙甲基纤维素或羧甲基纤维素钠等纤维素;阿拉伯胶、黄蓍胶等胶类;明胶、胶原蛋白等等。
mrna疫苗的给药量可以根据对象的年龄、性别、症状、给药途径、给药次数、剂型等适当选择。mrna疫苗的有效给药量为减轻疾病的征兆或状态的疫苗量。这样的mrna疫苗的治疗效果和毒性可以通过细胞培养或实验动物的标准药学步骤、例如ed50(在总体的50%中,对于治疗而言有效的用量)和ld50(对于总体的50%为致死性的用量)来确定。在几个实施方式中,对于成人,将mrna疫苗的给药量设为每天10ng~1g、100ng~100mg、1μg~10μg、或30μg~300μg的mrna的范围。
可以适当选择mrna疫苗的给药途径,包括例如经皮、鼻腔内、经支气管、肌肉内、腹腔内、静脉内、皮下、直肠内和阴道内的途径,但不限于这些途径。
关于mrna疫苗的给药次数,可以设为1次,或者当副作用为在临床上可接受的范围内时可以设为多次。
在几个实施方式中,测定给药mrna疫苗时的抗体效价或细胞免疫活性。例如,可以从生物体采集血液并对血清中的igg进行定量,从而评价抗体效价。可以从生物体分离和培养淋巴细胞,测定3h-胸苷的引入,从而评价细胞免疫活性。
3.4.试剂盒
本发明的第3方式的试剂盒,其特征在于,含有上述mrna疫苗。该试剂盒例如可以优选用于上述各种疾病的治疗方法,其中,所述各种疾病的治疗方法中使用了上述rna疫苗。
试剂盒中,上述mrna疫苗的保存状态没有限定,考虑到其稳定性(保存性)和使用容易性等,可以选择溶液状或粉末状等状态。
试剂盒除了上述mrna疫苗以外,可以还含有其它构成要素。作为其它构成要素,可列举例如:各种缓冲液和使用说明书(使用指南)。试剂盒中可以含有或不含佐剂。优选的是,试剂盒不含佐剂。
通过以下实施例更详细地说明本发明,但不应理解为本发明限定于这些实施例。
实施例
实施例1-1:各种嵌段共聚物的合成
1.1.peg-pasp(det)-chol的合成
按照报道合成了peg-pasp(det)-chol(oba,m.,etal.,biomaterials(2011)32,p.652-663)(方案1)。合成方案为如下所述。
方案1
[化1]
首先,通过以α-甲氧基-ω-氨基-聚乙二醇(meo-peg-nh2,peg的mw:12kda)为引发剂的β-苄基-l-天冬氨酸-n-羧酸酐(nca-bla)的开环聚合合成peg-聚(β-苄基-l-天冬氨酸酯)(peg-pbla)。取meo-peg-nh2505mg,溶解于苯,冷冻干燥一晚。冷冻干燥后,在ar气氛下,使meo-peg-nh2和nca-bla在二甲基甲酰胺(dmf):二氯甲烷(dcm)=1:10混合溶剂中完全溶解。将nca-bla溶液添加到meo-peg-nh2溶液中,在25℃下搅拌3天。将反应溶液在正己烷/乙酸乙酯(3:2)混合溶液中再沉淀,回收peg-pbla。然后,将peg-pbla真空干燥,得到白色粉末。pbla的聚合度为68(n=68)。需要说明的是,上述式中,m=293。
然后,向合成的peg-pbla的ω末端导入胆固醇基。向溶解于dcm(4ml)的peg-pbla(200mg)中,缓慢添加溶解于11v/v%三乙胺(tea)/dcm混合溶液(200μl)的胆固醇氯甲酸酯(328mg),在室温下搅拌24小时。使反应溶液在二乙醚中再沉淀,回收peg-pbla-胆固醇(chol)。
通过所回收的peg-pbla-chol的氨解反应(aminolysisreaction)合成peg-pasp(det)-chol。使peg-pbla-chol(100mg)溶解于苯,冷冻干燥,将干燥的peg-pbla-chol和干燥二亚乙基三胺(det)(相对于pbla为50当量)溶解于含0.5m硫脲的n-甲基-2-吡咯烷酮(nmp)。将这些溶液冷却到10℃,将peg-pbla-chol溶液缓慢滴加到det溶液中,搅拌1小时。反应后,在使溶液温度保持为10度以下的条件下将反应溶液用5nhcl水溶液中和,用0.01nhcl水溶液在4℃下透析1天。然后,用离子交换水在4℃下再透析1天。透析后,将溶液冷冻干燥,从而得到peg-pasp(det)-chol白色粉末。
1.2.peg-pasp(det)的合成
另外,通过同样的peg-pbla的氨解反应合成了peg-pasp(det)(方案2)。
方案2
[化2]
将peg-pbla(200mg)溶解于苯,冷冻干燥,将干燥后的peg-pbla和干燥二亚乙基三胺(det)(相对于pbla为50当量)溶解于含0.5m硫脲的nmp。将这些溶液冷却到10℃,将peg-pbla溶液缓慢滴加到det溶液中,搅拌1小时。反应后,在使溶液温度保持10度以下的条件下将反应溶液用5nhcl水溶液中和,用0.01nhcl水溶液在4℃下透析1天。然后,用离子交换水在4℃再透析1天。透析后将溶液冷冻干燥,从而得到peg-pasp(det)白色粉末。需要说明的是,上述式中,n=68,m=293。
实施例1-2:mrna的制备
通过体外转录由模板dna制备mrna,这里,模板dna如下制作。首先,由pcmv-gluccontrolplasmid(newenglandbiolabs,ipswich,ma,usa),将gluc编码序列(图15和序列号32)插入到psp73载体(promega)的hindiii、xba1位点,从而制作t7-glucplasmid。然后,将a120-(bsmbi切断部位)插入到t7-glucplasmid的ecor1-bgl2位点,从而制作t7-glucpolya120plasmid。然后,在用bsmbi切断之后,用t4dna聚合酶(宝生物)进行末端的平滑化,并用于以下的体外转录。
mrna如下制作:使用mmessagemmachine(商品名)t7(thermofisherscientific)进行编码了gaussia萤光素酶(gluc)的上述限制酶处理,在体外环境下转录平滑化的模板dna(t7-glucpolya120plasmid),从而制作。使用rneasyminikit(qiagen)对转录而得的mrna进行纯化、回收。利用nanodrop(thermofisherscientific)测定所回收的mrna浓度。另外,通过使用了agilent2100bioanalyzer(agilenttechnologies)的电泳法来确认制作了目标mrna。
由nanodrop确认,制作了500~1000ng/μl这样高浓度的、260nm与280nm的吸光度比为2.0~2.2这样高纯度的mrna。另外,通过bioanalyzer分析,确认制作了所需大小的mrna。
将所制作的mrna的序列示于图14和序列号1。在图14的序列中,下划线部分为开放阅读框(orf),orf的上游为5’utr(54碱基),orf的下游有3’utr(52碱基),进而其下游的120a为polya序列。
在此,对于polya数量,理论上模板dna中组入了120bp的polya,mrna中则为119碱基。但是,在dna扩增、mrna制备的阶段,其数量可能会改变。
实施例1-3:rna寡聚物的杂交反应
如下设计、制备了rna寡聚物。用rna二级结构预测软件(http://rtips.dna.bio.keio.ac.jp/ipknot/)对glucmrna的二级结构进行预测,针对rna链中不具有二级结构的部分设计了rna寡聚物。rna寡聚物是包括5’末端或3’末端的胆固醇修饰、委托了hokkaidosystemscienceinc.合成的。需要说明的是,下述rna寡聚物序列中的下划线部分表示突出端序列。另外,错配chol-rna寡聚物为不与mrna杂交的19mer的chol修饰polya。“chol-突出端”表示rna寡聚物的5’末端修饰有胆固醇,“chol-突出端3’”表示rna寡聚物的3’末端修饰有胆固醇。
rna寡聚物
17mer(1)(序列号2):ucuuugagcaccuccag
17mer(2)(序列号3):cucuagaugcaugcucg
17mer(3)(序列号4):cucggccacagcgaugc
17mer(4)(序列号5):gcggcagccacuucuug
17mer(5)(序列号6):aucucaggaaugucgac
23mer(序列号7):uccaucucuuugagcaccuccag
40mer(序列号8):cuuuccgggcauuggcuuccaucucuuugagcaccuccag
60mer(序列号9):acagccccuggugcagccagcuuuccgggcauuggcuuccaucucuuugagcaccuccag
突出端2碱基(1)(序列号10):aaucuuugagcaccuccag
chol-突出端0(1)(17mer(1);序列号2):ucuuugagcaccuccag
chol-突出端2碱基(1)(序列号10):aaucuuugagcaccuccag
chol-突出端5碱基(1)(序列号11):aauaaucuuugagcaccuccag
chol-突出端0(2)(17mer(2);序列号3):cucuagaugcaugcucg
chol-突出端2碱基(2)(序列号12):aacucuagaugcaugcucg
chol-突出端5碱基(2)(序列号13):aauaacucuagaugcaugcucg
chol-突出端2碱基(3)(序列号14):aacucggccacagcgaugc
chol-突出端2碱基(4)(序列号15):aagcggcagccacuucuug
chol-突出端2碱基(5)(序列号16):auaucucaggaaugucgac
chol-突出端2碱基(6)(序列号17):aagcagccagcuuucccgg
chol-突出端2碱基(7)(序列号18):aaacucuuugucgccuucg
chol-突出端2碱基(8)(序列号19):aauugaggcagccaguugu
chol-突出端2碱基(9)(序列号20):uagugggacaggcagauca
chol-突出端2碱基(10)(序列号21):aauugaagucuucguuguu
chol-突出端2碱基(11)(序列号22):aauuuuuuuuuuuuuuuuu
chol-突出端3’2碱基(1)(序列号23):ucuuugagcaccuccagau
错配chol-rna寡聚物(序列号24):aaaaaaaaaaaaaaaaaaa
相对于mrna,将1当量的rna寡聚物(突出端2碱基(1))在65℃下加热5分钟,经过10分钟后冷却到30℃,从而进行杂交反应。通过聚丙烯酰胺凝胶电泳对所制备的rna寡聚物修饰mrna进行评价。向mrna溶液(1×tbe缓冲液)中添加甘油溶液以使最终浓度成为5wt%,在100v、800ma、200w、30分钟的条件下进行电泳。
将其结果示于图1。图1的(2)和(3)分别是对未经chol修饰的rna寡聚物(突出端2碱基(1))、未进行杂交的mrna进行的电泳。图1的(1)中仅对图1的(2)中进行杂交的量中的1/16量的rna寡聚物(突出端2碱基(1))进行电泳。如果未发生杂交,则在图1的(2)中的、与图1的(1)相同的位置应观察到来自rna寡聚物的条带,但实际上几乎观察不到。即,可确认大多数的rna寡聚物进行了杂交。
从而,本实施例可以确认rna寡聚物进行了杂交。
实施例1-4:在培养细胞和无细胞系统中的mrna表达能力评价
在使用培养细胞的评价中,将raw264.7细胞以300000细胞/孔的量接种到12孔板中,在含有10v/v%胎牛血清(fbs)的达尔伯克改良伊格尔培养基(dulbecco’smodifiedeaglemedium,dmem)中孵育24小时。孵育后,将dmem交换为opti-mem(商品名)(thermofisherscientific),按照实施例1-2中制备的glucmrna或实施例1-3中制备的杂交有rna寡聚物(17mer(1)、23mer、40mer或60mer)的glucmrna达到1μg/孔的量,来添加由lipofectamine(商品名)ltx(thermofisherscientific)和mrna构成的复合物。转染起4小时后回收培养基,用照度计评价其中所含的gluc的量。
在用无细胞系统评价时,使用兔网织红细胞裂解液系统(promega)评价实施例1-2中制备的mrna或实施例1-3中制备的杂交有rna寡聚物(17mer(1)、23mer、40mer或60mer)的glucmrna的表达能力。按照规程制备含有mrna的混合溶液后,在30℃下孵育90分钟。使用照度计测定发光强度,从而评价所表达的gluc。
将其结果示于图2。如图2的(a)所示,研究培养细胞中的mrna导入效率的结果是,杂交有链长23mer以上的寡聚物时(23mer、40mer、60mer),与使用未进行杂交的mrna时(寡聚物(-))相比,gluc表达量显著下降。另一方面,修饰有17mer的寡聚物时的表达量与使用未进行杂交的mrna时几乎为同等。另一方面,如图2的(b)所示,无细胞系统的蛋白质翻译效率则不取决于rna寡聚物的链长而是保持恒定,与未进行杂交的mrna几乎为同等程度。即,对于无细胞系统,未观察到杂交所致的翻译效率下降。由以上实验可知,由于细胞内的某种机制,在杂交有长链长时表达会下降。由上述可知,期望将rna寡聚物的链长设为12~40mer。
这里,图2中,“**”和“***”表示与未经寡聚物修饰时相比,有p<0.01、p<0.001这样的统计学上的显著性差异。关于统计处理,在anova检验后,以未经寡聚物修饰时为对照进行dunnett检验。
从而,本实施例中对培养细胞中的mrna的导入效率进行确认的结果是,可确认长链长rna寡聚物使表达下调,但17mer的rna寡聚物则可以大体上维持表达(图2的(a))。另一方面,可确认无细胞系统的蛋白质翻译效率不取决于rna寡聚物的链长、而是保持恒定(图2的(b))。
实施例1-5:内包mrna的pms的制备
这里使用实施例1-2中制备的glucmrna或实施例1-3中制备的杂交有rna寡聚物(突出端2碱基(1)或chol-突出端2碱基(1))的glucmrna。
将peg-pasp(det)-chol和glucmrna分别单独溶解于10mmhepes缓冲液(ph7.4)。按照ph7.4下((pasp(det)的正电荷数)/(mrna的负电荷数))(n+/p-比)为1.5的方式来调整peg-pasp(det)-chol的浓度。向mrna溶液中添加peg-pasp(det)-chol溶液以使mrna最终浓度为33.3μg/ml的方式,从而制备高分子胶束(pms)。用zetasizernano(malveminstruments)评价pms的粒径和多分散性。另外,用透射型电子显微镜(tem)观察所制备的pms。关于由peg-pasp(det)构成的pms,也用同样的方法制备。
将其结果示于表1和2、图3。
[表1]
表1:利用dls测得的内包mrna的pms的流体力学半径
[表2]
表2:利用tem观察得到的pms的核尺寸
实施例1-6:血清中的耐酶解性试验
这里使用实施例1-2中制备的glucmrna或实施例1-3中制备的杂交有以下的rna寡聚物的glucmrna。
图4的(a)和(b)的实验中使用的rna寡聚物
chol-突出端0(1)
chol-突出端2碱基(1)
chol-突出端5碱基(1)
错配chol-rna寡聚物
图4的(c)和(d)的实验中使用的rna寡聚物
chol-突出端0(2)
chol-突出端2碱基(2)
chol-突出端5碱基(2)
错配chol-rna寡聚物
图4的(e)中使用的rna寡聚物
chol-突出端2碱基(11)
按照与实地例5同样的条件制备各pms。需要说明的是,图4的(a)、(c)、(e)实验中使用peg-pasp(det)-chol,图4的(b)和(d)实验中使用peg-pasp(det)。
将胎牛血清(fbs)用10mmhepes缓冲液(ph7.4)稀释到规定浓度,向其中添加pm溶液后,在37℃下静置15分钟。然后,使用rneasyminikit(qiagen)从溶液中提取rna。将提取的rna逆转录成互补dna(cdna)后,用qrt-pcr对残留的cdna进行定量评价。以fbs存在下未经37℃静置时的mrna量为100%,以相对值表示。
将其结果示于图4。如图4的(a)所示,使用peg-pasp(det)-chol时,杂交有具有2碱基的突出端的寡聚物的组与未进行杂交的组相比,可见血清中的稳定性的显著提高。需要说明的是,虽然在无突出端时也观察到稳定性提高的倾向,但不具有显著性差异。5碱基的情况下则未见稳定化效果。另一方面,使用peg-pasp(det)的情况下,在无突出端时和有2碱基的突出端时,均可见稳定性的提高(图4的(b))。以上的数据在使用所杂交的位置不同的其它寡聚物时也得以再现(图4的(c):peg-pasp(det)-chol,图4的(d):peg-pasp(det))。需要说明的是,错配chol-rna寡聚物是如下得到的:将不与mrna杂交的19mer的chol修饰polya与mrna混合,形成pm,此时血清中的耐酶解性未提高,表明必需进行杂交才能得到效果。
另外,对于杂交有相对于polya序列有2碱基的突出端的chol修饰寡聚物的mrna和peg-pasp(det)-chol所形成的pm,也可见杂交所带来的稳定化作用(图4的(e))。
由此可知,使用peg-pasp(det)-chol的情况下,使用有2碱基的突出端且经胆固醇修饰的寡聚物则显示出特别高的稳定性(图4的(a)和(c))。另一方面,使用peg-pasp(det)的情况下,无突出端时和有2碱基的突出时均可见稳定性的提高(图4的(b)和(d))。另外可知,对于杂交的位置而言,不仅与蛋白质编码序列杂交时、与polya部分杂交时稳定性也提高(图4的(e))。
实施例1-7:琼脂糖凝胶电泳
这里使用实施例1-2中制备的glucmrna或实施例1-3中制备的杂交有rna寡聚物(chol-突出端2碱基(1))的glucmrna。
按照与实地例5同样的条件制备各pms。
按照成为tris40mm、乙酸20mm、乙二胺四乙酸(edta)·2na1mm的方式制备1×tae缓冲液(tris-乙酸-edta缓冲液),用氢氧化钠水溶液调节到ph7.4,将其作为电泳用缓冲液。制作0.9重量%琼脂糖凝胶,向pm溶液15μl中加入与a/p比(聚阴离子的负电荷数/mrna的磷酸基数)相应的葡聚糖硫酸5μl和750mmnacl溶液5μl后,在37℃下孵育1小时。孵育后,加入上样缓冲液2.5μl,以100v进行60分钟电泳,确认有无mrna的放出。
将其结果示于图5。
图5的(a)~(d)中,最左侧的列均为裸mrna(nakedmrna),如果从胶束中放出mrna则会在与裸mrna相同的位置观察到条带。在未杂交chol修饰寡聚物时、即使用图5的(a)的peg-pasp(det)-chol时、以及使用图5的(c)的peg-pasp(det)时,在a/p比1.5至2下可见来自胶束的大量mrna的放出。另一方面,杂交有chol修饰寡聚物时,使用任意聚合物时均是在a/p比为2时也几乎看不到mrna的放出(图5的(b)和(d))。
由此可知:利用chol寡聚物抑制了mrna的放出(图5的(b)和(d))。
实施例1-8:增加所杂交的寡聚物的数量时的、血清中的耐酶解性试验
这里,使用实施例1-2中制备的glucmrna或实施例1-3中制备的杂交有以下的rna寡聚物的glucmrna。
chol-突出端2碱基(1)
chol-突出端2碱基(2)
chol-突出端2碱基(3)
chol-突出端2碱基(4)
chol-突出端2碱基(5)
按照与实施例1-5同样的条件,使用peg-pasp(det)-chol制备各pms。
使用在1个位置或5个位置杂交有chol修饰寡聚物的mrna,通过与实施例1-6同样的方法进行实验。需要说明的是,在未修饰寡聚物(unmodifiedoligo)中,使用突出端2碱基(1)。在chol修饰寡聚物为1个的实验(chololigox1)中,使用chol-突出端2碱基(1)。另外,在chol修饰寡聚物为5个的实验(chololigox5)中,使用chol-突出端2碱基(1)~(5)。
将其结果示于图6。与未杂交的mrna相比,在1个位置进行了修饰时(chololigox1),稳定性提高;另外,在5个位置进行了修饰时(chololigox5),与在1个位置进行修饰时(chololigox1)相比,显示出更高的稳定性。
实施例1-9:pms的萤光素酶表达试验
这里,使用实施例1-2中制备的glucmrna或实施例1-3中制备的杂交有以下的rna寡聚物的glucmrna。
chol-突出端2碱基(1)
chol-突出端2碱基(2)
chol-突出端2碱基(3)
chol-突出端2碱基(4)
chol-突出端2碱基(5)
17mer(1)
按照与实地例5同样的条件,使用peg-pasp(det)-chol制备各pms。
将huh-7细胞(5000个细胞/孔)接种于96孔板,在含有10v/v%fbs的dmem(100μl)中孵育24小时。将培养基更换为含有10v/v%fbs的新鲜培养基后,加入含有250ng的mrna的pms溶液7.5μl。孵育24小时后,回收10μldmem的上清,使用照度计测定gluc的发光强度。
使用在1个位置或5个位置杂交有chol修饰寡聚物的mrna。需要说明的是,在chol修饰寡聚物为1个的实验(chololigox1)中,使用chol-突出端2碱基(1)。另外,在chol修饰寡聚物为5个的实验(chololigox5)中,使用chol-突出端2碱基(1)~(5)。进而,在未修饰寡聚物的实验(unmodifiedoligo)中,使用突出端2碱基(1)17mer(1)。
将其结果示于图7。导入了经1个或5个chol寡聚物修饰的mrna的组(chololigox1或chololigox5)与导入了未杂交寡聚物的mrna的组(未杂交(-))或导入了经无chol修饰的寡聚物修饰的mrna的组(未修饰寡聚物)相比,显示出较高mrna的萤光素酶表达效率。
由此可知,通过chol寡聚物修饰,表达上调。另外,从寡聚物的个数角度来看未观察到差异。
实施例1-10:用chol修饰5’侧时与修饰3’侧时的比较
这里,使用实施例1-2中制备的glucmrna、实施例1-3中制备的杂交有以下的rna寡聚物的glucmrna、或杂交有与其设计在相同位置且3’侧具有2碱基的突出序列的以下序列的寡聚物的glucmrna。
chol-突出端2碱基(1)
chol-突出端3’2碱基(1)
按照与实施例5同样的条件,使用peg-pasp(det)-chol制备各pms。按照与实施例1-8同样的方法进行血清耐性试验,按照与实施例1-9同样的方法将pm导入到huh-7细胞,评价gluc表达量。
将血清耐性试验的结果示于图8的(a),将gluc表达量的结果示于图8的(b)。在任一评价中,chol的修饰位置为3’时与5’时均未观察到大的差异。
实施例1-11:无细胞系统中的chol修饰mrna的翻译效率的评价
这里,使用实施例1-2中制备的glucmrna或实施例1-3中制备的杂交有以下的rna寡聚物的glucmrna。
chol-突出端2碱基(1)
chol-突出端2碱基(2)
chol-突出端2碱基(3)
chol-突出端2碱基(4)
chol-突出端2碱基(5)
该评价中,mrna未内包于pm,而是以单体使用。
在使用无细胞系统的评价中,使用兔网织红细胞裂解液系统(rabbitreticulocytelysatesystem,promega)评价修饰有chol-rna寡聚物的mrna的表达能力。按照规程制备含有mrna的混合溶液后,在30℃下孵育90分钟。使用照度计测定发光强度,来评价所表达的gluc。
将其结果示于图9。确认杂交有chol-rna寡聚物的mrna在无细胞系统中的蛋白质翻译效率随着chol-rna寡聚物数量的增加而逐渐减少。即,获知多个chol基导致mrna翻译效率下降。
在此,在chol-rna寡聚物数量为1个的实验中,使用chol-突出端2碱基(1)。在chol-rna寡聚物数量为2个的实验中,使用chol-突出端2碱基(1)和(3)。在chol-rna寡聚物数量为3个的实验中,使用chol-突出端2碱基(1)~(3)。在chol-rna寡聚物数量为4个的实验中,使用chol-突出端2碱基(1)~(4)。在chol-rna寡聚物数量为5个的实验中,使用chol-突出端2碱基(1)~(5)。
实施例1-12:对内源基因表达的影响
这里,使用与实施例1-3同样地设计、制备的以下的rna寡聚物、或如后所述地制备的以下的sirna。“chol-”表示在rna寡聚物的5’末端修饰有胆固醇。
在此,将rna寡聚物的设计中使用的lucmrna的序列示于图16和序列号33。
lucoligo(序列号25):ucgaaguacucagcgua
chol-oligoluc(序列号26):aaucgaaguacucagcgua
oligoscr(序列号27):ucuuugagcaccuccag
chol-oligoscr(序列号27):ucuuugagcaccuccag
siluc(有义链)(序列号28):cuuacgcugaguacuucgadtdt
siluc(反义链d)(序列号29):ucgaaguacucagcguaagdtdt
siscramble(siscr)(有义链)(序列号30):uucuccgaacgugucacgudtdt
siscr(反义链)(序列号31):acgugacacguucggagaadtdt
在此,sirna委托hokkaidosystemscienceinc.合成,并直接使用。
将稳定表达luc的hela-luc细胞(caliperlifescience公司)(5000细胞/孔)接种到96孔板,在含有10v/v%fbs的dmem(100μl)中孵育24小时。然后,将培养基更换为无血清培养基(opti-mem(商品名)(thermofisherscientific))(100μl),对细胞添加由lipofectaminernaimax(thermofisherscientific)和rna寡聚物或sirna构成的复合物。孵育4小时后,除去添加的各复合物。转染起24小时后,使用细胞裂解缓冲液溶解细胞,使用照度计评价10μl细胞溶解液中的萤光素酶表达量。
将其结果示于图10。在此,siluc、lucoligo和chololigoluc分别表示以luc序列为靶的sirna、未修饰rnaoligo和chol修饰rnaoligo,siscr、oligoscr、chololigoscr表示与gluc序列无同源性的序列的sirna、未修饰rnaoligo和chol修饰rnaoligo。在图2和7所示的培养细胞的转染实验中,使用8nm浓度的oligo时,该浓度下内源基因表达并未下调。如果不是与sirna相比为1000倍这种高浓度下则观察不到内源基因表达的减少,因此推测对内源基因的影响非常微弱。如图10所示,确认序列与sirna的反义链相同的rna寡聚物和其它序列的rna寡聚物组与sirna相比,不会敲除内源基因。由以上结果确认,rna寡聚物使mrna功能化且不抑制内源基因。
实施例1-13:利用peg-plys进行的研究
按照报道合成peg-plys(k.osadaetal.,biomaterials33,325-332,(2012))(方案3)。合成方案如下所述。
方案3
[化3]
取meo-peg-nh2400mg溶解于苯,冷冻干燥一晚。冷冻干燥后,在ar气氛下,使meo-peg-nh2和nca-lys(tfa)完全溶解于0.5m二甲基甲酰胺(dmf)溶剂。将nca-lys(tfa)溶液添加到meo-peg-nh2溶液中,在25℃下搅拌3天。使反应溶液在正己烷/乙酸乙酯(3:2)混合溶液中再沉淀,回收peg-plys(tfa)。然后,将peg-plys(tfa)真空干燥,得到白色粉末。然后,在含有0.1nnaoh的甲醇混合溶剂中在35℃下反应6小时,进行tfa基的脱保护。利用透析而纯化后,得到peg-plys白色粉末。根据1h-nmr分析,所回收的peg-plys的plys聚合度为69。
这里,使用实施例1-2中制备的glucmrna或实施例1-3中制备的杂交有以下的rna寡聚物的glucmrna。
chol-突出端2碱基(1)
chol-突出端2碱基(2)
chol-突出端2碱基(3)
chol-突出端2碱基(4)
chol-突出端2碱基(5)
在pm的制作中,使peg-plys和mrna分别单独溶解于10mmhepes缓冲液(ph7.4)。按照ph7.4下((plys的正电荷数)/(mrna的负电荷数))(n+/p-比)为2的方式来调整peg-plys的浓度。按照mrna最终浓度为33.3μg/ml的方式向mrna溶液中添加peg-plys溶液,从而制备pms。
使用所合成的peg-plys,与实施例1-7中的peg-pasp(det)-chol同样地进行凝胶电泳。另外,与实施例1-9中的peg-pasp(det)-chol同样地进行萤光素酶表达试验。
在凝胶电泳实验中,使用在1个位置杂交有chol修饰寡聚物的mrna,在萤光素酶表达实验中,使用在1个位置或5个位置杂交有chol修饰寡聚物的mrna。此时,在chol修饰寡聚物为1个的实验(chololigox1)中,使用chol-突出端2碱基(1)。另外,在chol修饰寡聚物为5个的实验(chololigox5)中,使用chol-突出端2碱基(1)~(5)。
将其结果示于图11。与包含peg-pasp(det)、peg-pasp(det)-chol的pms同样(图5)地,在包含peg-plys的pms的情况下,通过使用chol-rna寡聚物(chol-突出端2碱基(1)),加入聚阴离子时的mrna放出得到抑制(图11的(b)),而且导入细胞时的mrna的蛋白质表达效率提高(图11的(c))。另一方面,不使用chol-rna寡聚物时,在a/p比1.5至2时可见来自胶束的大量mrna的放出(图11的(a))。由此可知,在各种组成的聚阳离子的情况下,chol修饰寡聚物的杂交对其稳定化有效。
实施例1-14:使用小鼠的血中稳定性试验
这里,使用实施例1-2中制备的glucmrna或实施例1-3中制备的杂交有以下的rna寡聚物的glucmrna。
chol-突出端2碱基(1)
chol-突出端2碱基(2)
chol-突出端2碱基(3)
chol-突出端2碱基(4)
chol-突出端2碱基(5)
chol-突出端2碱基(6)
chol-突出端2碱基(7)
chol-突出端2碱基(8)
chol-突出端2碱基(9)
chol-突出端2碱基(10)
将peg-pasp(det)-chol和mrna分别单独溶解于10mmhepes缓冲液(ph7.4)。按照ph7.4下((pasp(det)的正电荷数)/(mrna的负电荷数))(n+/p-比)为1.5的方式来调整peg-pasp(det)-chol的浓度。按照mrna最终浓度为200μg/ml的方式向mrna溶液中添加peg-pasp(det)-chol溶液,从而制备pms。
对balb/c小鼠(雌性、6周龄),由尾静脉给药含有40μg的mrna的pms溶液200μl。在2.5分钟、5分钟、10分钟后,由尾静脉采集2μl的血液。使用rneasyminikit(qiagen)由采集的血液提取mrna,将提取的mrna逆转录为cdna后,利用qrt-pcr对残留的cdna进行定量评价。通过student-t检验进行统计处理。
将其结果示于图12。如图12所示,杂交有10个chol修饰寡聚物时观察到血中滞留性提高的倾向。
实施例1-15:使用小鼠的、pms对肺的局部给药
这里,使用实施例1-2中制备的glucmrna或实施例1-3中制备的杂交有以下的rna寡聚物的glucmrna。
chol-突出端2碱基(1)
chol-突出端2碱基(2)
chol-突出端2碱基(3)
chol-突出端2碱基(4)
chol-突出端2碱基(5)
按照与实施例5同样的方法,使用peg-pasp(det)-chol制备各pms。
将balb/c小鼠(雌性、6周龄)的气管切开,利用喷雾器将含有1.67μg的mrna的pms溶液50μl直接对肺给药。24小时后将小鼠的肺摘出,匀浆后,用照度计对其中所含的gluc蛋白质量进行定量。另外,为了对肺中残留的glucmrna量进行定量,使用给药4小时后的肺,用rneasyminikit(qiagen)提取mrna,将提取的rna逆转录成cdna后,利用qrt-pcr对残留的cdna进行定量评价。此时,基于组织中所含的肌动蛋白量将mrna表达量标准化。
将其结果示于图13。如图13的(a)所示,杂交有5个chol修饰寡聚物的mrna与未进行杂交的mrna相比,得到显著高的mrna的蛋白质表达效率。另外,如图13的(b)所示,通过杂交有5个chol修饰寡聚物,肺组织中未被分解的残留mrna量也显著增加,因此可知生物体内的稳定性提高。另外,关于安全性,未杂交的mrna和杂交有5个chol修饰寡聚物的mrna,给药后的肺组织中的(c)干扰素β、(d)白介素6的表达量没有显著变化,均为低值,因此认为安全性有保证。
由此可知,稳定性提高的结果(图13的(b))是表达上调(图13的(a))。由此可知在体内也是有效的。
实施例1-15:聚乙二醇(peg)化mrna的制作
如下制作peg化mrna。用rna二级结构预测软件(http://rtips.dna.bio.keio.ac.jp/ipknot/)预测glucmrna的二级结构,针对rna链中不具有二级结构的部分设计rna寡聚物。rna寡聚物在5’末端含有peg修饰,委托genedesign公司合成。在此,使用重均分子量12000的直链peg。并且,从genedesign公司购买以下的5’末端peg修饰rna寡聚物。
序列p1(序列号34):5’-peg-acucuuugucgccuucg-3’
序列p2(序列号35):5’-peg-cucggccacagcgaugc-3’
序列p3(序列号36):5’-peg-ucuuugagcaccuccag-3’
序列p4(序列号37):5’-peg-cucuagaugcaugcucg-3’
序列p5(序列号38):5’-peg-gcggcagccacuucuug-3’
序列p6(序列号39):5’-peg-aucucaggaaugucgac-3’
序列p7(序列号40):5’-peg-gcagccagcuuuccggg-3’
序列p8(序列号41):5’-peg-uugaggcagccaguugu-3’
序列p9(序列号42):5’-peg-ugaucuuguccaccugg-3’
序列p10(序列号43):5’-peg-gaugaacuucuucaucu-3’
序列p11(序列号44):5’-peg-gugggacaggcagauca-3’
序列p12(序列号45):5’-peg-uugaagucuucguuguu-3’
序列p13(序列号46):5’-peg-gggcaacuucccgcggu-3’
序列p14(序列号47):5’-peg-cugcuccaugggcucca-3’
序列p15(序列号48):5’-peg-cuugcuggcaaaggucg-3’
在以下的实施例1-16~18中,作为mrna,使用实施例1-3中制备的mrna。相对于mrna,加入1当量的rna寡聚物,在65℃下加热5分钟,经过10分钟后冷却到30℃,从而进行杂交反应。从而制作peg化mrna。
实施例1-16:peg修饰rna寡聚物与mrna杂交所带来的翻译效率变化
使用在1个位置、5个位置、10个位置或15个位置杂交有peg修饰rna寡聚物的mrna。需要说明的是,在peg修饰rna寡聚物为1个、5个、10个和15个的各实验中,使用实施例1-15中制作的以下的peg修饰rna寡聚物。
peg修饰rna寡聚物为1个的实验:序列p1
peg修饰rna寡聚物为5个的实验:序列p1~p5
peg修饰rna寡聚物为10个的实验:序列p1~p10
peg修饰rna寡聚物为15个的实验:序列p1~p15
进而,在peg修饰rna寡聚物为0个的实验中,使用的是仅将mrna在65℃下加热5分钟并经过10分钟后冷却到30℃而得的产物。
实验分别进行3次。
使用兔网织红细胞裂解液系统(promegaco.,madison,wi),评价所制备的mrna样品在无细胞系统中的蛋白质翻译效率。将含有300ng的glucmrna的样品溶液添加到兔网织红细胞裂解物中,在30℃下孵育90分钟后,使用renillaluciferaseassaykit(promega)对10μl反应溶液的发光强度进行定量。使用mithraslb940(bertholdtechnologiesco.)进行测定。
将其结果示于图18。可见随着peg量增加而翻译活性有一些下降,但是即使使用15个peg修饰rna寡聚物修饰mrna,与未修饰的情况相比也得到64%左右的翻译活性。
在此,图18中,“*”表示与未经寡聚物修饰时相比、在p<0.05下有统计上的差异显著性。统计处理为anova检验后,以未经寡聚物修饰的情况为对照进行dunnett检验。
实施例1-17:peg修饰rna寡聚物与mrna杂交所带来的稳定化效果
使用在1个位置、5个位置、10个位置或15个位置杂交有peg修饰rna寡聚物的mrna。需要说明的是,在peg修饰寡聚物为1个、5个、10个和15个的各实验中,使用实施例1-15中制作的以下的peg修饰寡聚物。
peg修饰寡聚物为1个的实验:序列p1
peg修饰寡聚物为5个的实验:序列p1~p5
peg修饰寡聚物为10个的实验:序列p1~p10
peg修饰寡聚物为15个的实验:序列p1~p15
进而,在peg修饰寡聚物为0个的实验中,使用仅将mrna在65℃下加热5分钟并经过10分钟后冷却到30℃而得的产物。
实验分别进行3次。
相对于fbs的稳定性的确认试验的步骤如图19的(a)所示。将含有100ng的glucmrna的样品在0.5%胎牛血清(fbs,dainipponsumitomopharmaco.,ltd.,osaka,japan)溶液中、在37℃下孵育15分钟。然后,添加含有1v/v%2-巯基乙醇的rlt缓冲液(quiage,hilden,germany)350μl,在65℃下孵育5分钟后,在冰上迅速冷却,从而使peg-rna寡聚物变性。用rneasyminikit(quiagen)将mrna纯化后,用revertraace(商品名)qpcrrtmastermixwithgdnaremover(toyoboco.,ltd.,osaka,japan)逆转录成互补dna(cdna)。利用定量rt-pcr(qrt-pcr)对逆转录而得的cdna进行定量评价。在此,qrt-pcr测定中使用下述序列的引物。
正向(序列号49):tgagattcctgggttcaagg
反向(序列号50):gtcagaacactgcacgttgg
将其结果示于图19的(b)。表明peg修饰寡聚物提高了耐酶解性。另外,存在所修饰的peg寡聚物的数量越多则耐酶解性越高的倾向。
实施例1-18:peg化mrna的表达试验
使用在15个位置杂交有peg修饰rna寡聚物的mrna。需要说明的是,peg修饰寡聚物为15个的实验中,使用实施例1-15中制作的以下的peg修饰寡聚物。
peg修饰寡聚物为15个的实验:序列p1~p15
进而,在peg修饰寡聚物为0个的实验中,使用仅将mrna在65℃下加热5分钟并经过10分钟后冷却到30℃而得的产物。
实验分别进行3次。
如下进行使用培养细胞(huh-7细胞)时的mrna表达试验。将人肝癌细胞(huh-7细胞)以5000细胞/孔接种到96孔板中,在潮湿的含5%co2空气中、在37℃下孵育24小时。除去血清培养基后,更换为无血清培养基(opti-mem,thermofisherscientificinc.,waltham,ma)100μl,添加含有250ng的glucmrna的样品溶液。4小时后,使用renillaluciferaseassaykit(promega)对10μl上清液中的发光强度进行定量。使用mithraslb940(bertholdtechnologiesco.)进行测定。
将其结果示于图20。在使用培养细胞时,peg修饰mrna与未修饰时相比,显示出显著高的表达。我们认为,这是由peg修饰mrna的稳定化效果引起的。
实施例2-1:各种双链rna的制作
由pcmv-gluccontrolplasmid(newenglandbiolabs,ipswich,ma,usa),将gluc编码序列(序列号57和图33)插入到psp73载体(promega)的hindiii、xba1位点,从而制作t7-glucplasmid。
向t7-glucplasmid的ecor1-bgl2位点插入a120-(bsmb1切断部位),从而制作t7-glucpolya120plasmid。
如图21的(a)所示,将t7-glucpolya120plasmid用bsmbi切断,利用mmessagemmachinet7ultrakit(thermofisherscientific),由t7启动子转录,从而制作gluc正义链。在用该试剂盒制作rna时,5’末端修饰有cap。
如图21的(b)所示,将t7-glucpolya120plasmid用hindiii切断,用megascript(注册商标)sp6transcriptionkit(thermofisherscientific),由sp6启动子转录,从而制作gluc反义链(嵌入polyu)。这里,不添加cap类似物而制作rna,因此5’末端未进行cap修饰,呈键合有三磷酸基的状态。
如图21的(c)所示,将t7-glucplasmid用hindiii切断,用megascript(注册商标)sp6transcriptionkit(thermofisherscientific),由sp6启动子转录,从而制作gluc反义链(无polyu)。
如图21的(d)所示,将t7-glucpolya120plasmid用smai切断,用megascript(注册商标)sp6transcriptionkit(thermofisherscientific),由sp6启动子转录,由此制作polyu。polyu含有与polya整体序列互补的序列(120碱基)、和位于其下游的与mrna的3’utr的一部分(即,3’utr的约37%的碱基长的序列)互补的序列(19碱基)。需要说明的是,polyu中,上游还含有作为其它序列(17碱基)的、sp6启动子内的序列和克隆中使用的限制酶序列。即,这里使用的polyu具有156碱基长的序列。另外,5’末端具有三磷酸结构。
以下示出制作的正义链、反义酸和polyu的碱基序列。
gluc正义链(序列号51和图27)
gluc反义链(嵌入polyu)(序列号52和图28)
gluc反义链(无polyu)(序列号53和图29)
polyu(序列号54和图30)
在此,在图27的序列中,下划线部分为开放阅读框(orf),orf的上游为5’utr(54碱基长),在orf的下游有3’utr(52碱基长),进而其下游的119a为polya序列。
在此,关于polya的数量,理论上模板dna中整合有120bp的polya,由t7启动子转录的mrna具有119碱基的a,由sp6启动子转录的rna有120碱基的u。但是,在dna扩增、mrna制备阶段其数量可能会改变。
使用所制作的正义链、反义链和polyu按照下述制作双链rna。首先,使10mmhepes缓冲液中以等摩尔量含有正义链、反义链或polyu,从而制备rna浓度为300μg/ml的溶液。将该溶液在65℃下维持5分钟后,经过10分钟后降低到30℃,从而进行杂交。
在去除三磷酸化时,使用南极磷酸酯酶(newenglandbiolabs,cat.no.m0289s)。
在此,图22中示出了所制作的双链rna的示意图。图22的(a)为mrna:rna,图22的(b)为mrna:rnapolyu(-),图22的(c)为mrna:polyu,图22的(d)为mrna:polyuppp(-)。
需要说明的是,图22中,mrna的蛋白质编码序列的上游有5’utr、下游存在3’utr。
实施例2-2:使用树突状细胞株的、双链rna疫苗的优化
将dc2.4细胞以1000000/孔接种到6孔板中,24小时后进行培养基更换而置换为无血清培养基opti-mem(商品名)(thermofisherscientific),然后使用lipofectamine(商品名)ltx(thermofisherscientific)以2.5μg/孔给药mrna。4小时后,利用rneasyminikit(qiagen)从细胞中纯化rna,利用revertraaceqpcrrtmastermix(toyobo)制成互补dna(cdna)后,用taqmangeneexpressionassay(appliedbiosystems)调查干扰素β的表达量。此时,利用激动蛋白b的表达量进行标准化。另外,利用renillaluciferaseassaysystem(promega)对培养基中所含的gluc蛋白质量进行定量。
将其结果示于图23。以全长进行杂交的mrna:rna可以诱发强列炎症反应(图23的(a)),但是由mrna的gluc蛋白质表达量与单链mrna相比降低100倍左右(图23的(b))。另一方面,mrna:rnapolyu(-)与mrna:rna相比,炎症反应显著减弱(图23的(a)),而且gluc表达量也与mrna:rna为同等程度(图23的(b))。与此相对地,仅主要在polyu部分进行杂交的情况下,观察到与mrna:rna同等强度的炎症反应(图23的(a)),而且由mrna的蛋白质表达量也保持了与单链mrna几乎为同等程度的水平(图23的(b))。需要说明的是,这里,反义链rna的5’末端为三磷酸化状态,已知该状态可被细胞内核酸受体rig-i识别并诱发强烈炎症反应。因此,为了调查三磷酸与炎症反应的关系,导入杂交有去除了三磷酸的polyu的mrna,结果炎症反应与三磷酸化polyu时相比下降。由此可知,通过使rna寡聚物具有5’末端三磷酸,可诱发更强的炎症反应。
mrna:rnapolyu(-)的情况下不怎么引起炎症,因此强烈暗示:rig-i所进行的三磷酸识别根据互补链而不同。我们推测:polyu的情况下,5’末端在mrna末端露出,三磷酸可能立体地容易被rig-i识别;三磷酸周围的序列中包含多个u而au键弱,因此三磷酸的运动性提高,可能因此容易被识别等。由此强烈暗示:互补链的选择对于rig-i介导的自然免疫应答而言可能很重要。
由此可知:在使互补链(polyu)主要杂交到mrna的3’末端所添加的polya链部分时,会诱发强烈炎症反应且几乎不降低蛋白质表达效率。
实施例2-3:杂交有polyu的mrna的淋巴结内给药
与实施例2-2同样地制作mrna:polyu。将含有glucmrna3μg的10μl的10mmhepes溶液对c57bl6n小鼠的腹股沟淋巴结给药。4小时后回收腹股沟淋巴结,用被动裂解缓冲液(promega)溶解,利用renillaluciferaseassaysystem(promega)对luc表达量进行定量。另外,用rneasyminikit(qiagen)提取rna,用revertraaceqpcrrtmastermix(toyobo)制成互补dna(cdna)后,使用taqmangeneexpressionassay(thermofisherscientific)调查干扰素β和白介素6的表达量。此时,利用激动蛋白b的表达量进行标准化。
将其结果示于图24。结果是,与图23的使用培养细胞的分析同样地,仅杂交polyu的情况下,炎症反应与单链mrna相比显著提高(图24的(b)和(c)),进而由mrna的gluc表达效率与单链mrna几乎为同等程度(图24的(a))。
由此可知:在体内,杂交有polyu的mrna也诱发强烈炎症反应且不会大幅损害翻译效率。
实施例2-4:利用杂交有polyu的mrna进行的细胞免疫诱导
将由genscript公司进行了密码子优化的ova编码序列(序列号58和图34)插入到psp73载体(promega)的xhoi、ecor1位点,从而制作t7-ovapolya120plasmid。将t7-ovapolya120plasmid用bsmbi切断,利用mmessagemmachinet7ultrakit(thermofisherscientific),由t7启动子进行转录,从而制作ova正义链将t7-glucpolya120plasmid用ecori切断,利用megascript(注册商标)sp6transcriptionkit(thermofisherscientific),由sp6启动子进行转录,从而制作polyu。
在此,polyu含有与polya整体序列互补的序列(120碱基)、和位于其下游的与mrna的3’utr的一部分(即,3’utr的约83%的碱基长的序列)互补的序列(5碱基)。需要说明的是,这里使用的polyu含有作为其它序列(17碱基)的sp6启动子内的序列和克隆中使用的限制酶序列。即,这里使用的polyu具有142碱基长的序列。另外,5’末端具有三磷酸结构。
以下示出所制作的正义链和polyu的碱基序列。
ova正义链(序列号55和图31)
polyu(序列号56和图32)
需要说明的是,图31的序列中,下划线部分为开放阅读框(orf),orf的上游为5’utr(16碱基),orf的下游有3’utr(6碱基),进而其下游的119a为polya序列。
关于a、u的数量,与实施例2-1时同样地,分别地,由t7启动子转录而得的mrna具有119碱基的a,由sp6启动子转录而得的rna具有120碱基的u。但是,在dna扩增、mrna制备阶段其数量可能会改变。
与实施例2-2同样地制作杂交有polyu的表达ova的mrna(mrna:polyu)。具体而言,使10mmhepes缓冲液中以等摩尔量含有正义链、反义链或polyu,从而制备rna浓度为300μg/ml的溶液。将该溶液在65℃下维持5分钟后,经过10分钟后降至30℃,从而进行杂交。
图25的(a)示出以下的实验步骤。首先,将含有ovamrna3μg的10μl的10mmhepes溶液对c57bl6n小鼠的腹股沟淋巴结给药。7天后,回收脾脏细胞,用ifn-γelispotplus、mouse(-)hrp试剂盒(mabtech公司)进行酶联免疫印迹(elispot)分析。这里,向96孔板中以250000细胞/孔进行接种。在最终ova浓度10μg/ml下培养24小时,然后测定ifn-γ产生细胞数。
将其结果示于图25的(b)。图25的(b)的纵轴表示与ova反应、产生ifn-γ的脾细胞的数量,为细胞免疫的指标。如图25的(b)所示,单链的ovamrna几乎不能诱导细胞免疫,而杂交有polyu的ovamrna(mrna:polyu)则观察到显著的细胞免疫反应。
由此可知:通过杂交polyu,可以诱导更强的细胞免疫。
实施例2-5:利用杂交有polyu的mrna进行的体液免疫诱导
通过与实施例2-4同样的方法将ovamrna对c57bl6n小鼠给药,7天后采血(图26的(a))。用mouseanti-ovaiggantibodyassaykit(chondrex公司)对血清中的抗ovaigg进行定量。
将其结果示于图26的(b)。单链mrna的情况下,ova反应性igg值与对照组相比几乎不上升,而杂交有polyu的ovamrna(mrna:polyu)的情况下则观察到igg值的显著上升。
由此可知:通过杂交polyu可以诱导更强的体液免疫。
实施例2-6:使用树突状细胞的双链rna疫苗的优化
通过与实施例2-2同样的方法,定量树突状细胞(d.c.2.4细胞)中的由mrna的蛋白质表达量(即,萤光素酶表达量)。
其中,将d.c.2.4细胞以40,000/孔接种于96孔板进行实验。另外,作为rna寡聚物,使用以下3种。
polyu(与3’utr互补的序列的链长:5碱基)(序列号56、图36的(b))
polyu(与3’utr互补的序列的链长:19碱基)(序列号54、图36的(b))
polyu(与3’utr互补的序列的链长:50碱基)(序列号59、图36的(b))
“polyu(与3’utr互补的序列的链长:5碱基)(序列号56)”:将t7-glucpolya120plasmid用ecori切断,利用megascript(注册商标)sp6transcriptionkit(thermofisherscientific),由sp6启动子转录,从而制作(图36的(a))。
“polyu(与3’utr互补的序列的链长:19碱基)(序列号54)”:将t7-glucpolya120plasmid用smai切断,利用megascript(注册商标)sp6transcriptionkit(thermofisherscientific),由sp6启动子转录,从而制作(图36的(a))。
需要说明的是,“polyu(与3’utr互补的序列的链长:5碱基)(序列号56)”含有与mrna的3’utr的一部分(即,3’utr(52碱基长)的约10%的碱基长的序列)互补的序列(5碱基)。
另外,polyu(与3’utr互补的序列的链长:19碱基)含有与mrna的3’utr的一部分(即,3’utr(52碱基长)的约36%的碱基长的序列)互补的序列(19碱基)。
“polyu(与3’utr互补的序列的链长:50碱基)”:将t7-glucpolya120plasmid用noti切断,利用megascript(注册商标)sp6transcriptionkit(thermofisherscientific),由sp6启动子转录,从而制作(图36的(a))。
在此,polyu含有与polya整体的序列互补的序列(120碱基)、位于其下游的与mrna的3’utr的一部分(即,3’utr(52碱基长)的约96%的碱基长的序列)互补的序列(50碱基)。需要说明的是,这里使用的polyu还含有作为其它序列(17碱基)的sp6启动子内的序列和克隆中使用的限制酶序列。即,这里使用的polyu具有187碱基长的序列。另外,5’末端具有三磷酸结构。
将其结果示于图35。如图35所示,可知各polyu的与3’utr互补的序列的链长越短则越可维持由mrna的蛋白质表达,因此越优选。
实施例3-1:rna寡聚物的杂交反应
如下制作合成rna寡聚物。首先,对于与glucmrna互补的第1序列,利用rna二级结构预测软件(http://rtips.dna.bio.keio.ac.jp/ipknot/)预测glucmrna的二级结构,针对rna链不具有二级结构的部分设计rna寡聚物。对于突出序列,使用a或u按照尽量不与mrna链杂交的方式来设计。对于与5’ppp-rna寡聚物互补的第2序列,首先设计5’ppp-rna寡聚物的序列,得到与该序列互补的第2序列。5’ppp-rna寡聚物中使用了gu的重复序列,其具有下述特征:通过用不含atp的系统进行体外转录而抑制生成互补链的副产物,另外gu重复序列这一rna本身不形成二级结构。作为与该5’ppp-rna寡聚物互补的序列,得到第2序列,此时,按照5’ppp-rna寡聚物的三磷酸化的5’末端平滑的方式进行序列设计。
委托公司按照该方式设计的合成rna寡聚物的合成,从而购买从5’侧起包含与glucmrna互补的17碱基的序列、2碱基的突出序列、与5’ppp-rna寡聚物互补的24碱基的序列的以下的合成rna寡聚物。
合成rna寡聚物由hokkaidosystemscienceinc.购买。
合成rna寡聚物序列1(序列号60):cagccagcuuuccgggcuacacacacacacacacacacacacc
合成rna寡聚物序列2(序列号61):acucuuugucgccuucgaucacacacacacacacacacacacc
合成rna寡聚物序列3(序列号62):gcggcagccacuucuuguacacacacacacacacacacacacc
如下所述地制作5’ppp-rna寡聚物。首先,将dr274载体(addgene)用bsai切断,向此处插入使以下2种寡聚物杂交而成的序列。
dna寡聚物(序列号63):taggtgtgtgtgtgtgtgtgtgtgtgggccc
dna寡聚物(序列号64):aaacgggcccacacacacacacacacacaca
由此制作图41所示的碱基序列(序列号65)的载体。然后,将图41所示的碱基序列(序列号65)的载体用apai和snabi切断,通过体外转录制备5’ppp-rna寡聚物。体外转录时,使用不含atp的反应液,从而抑制目标序列的互补链rna的转录。由此制备5’被三磷酸化的以下的5’ppp-rna寡聚物。
5’ppp-rna寡聚物(序列号66):ggugugugugugugugugugugug
通过合成rna寡聚物序列1~3与5’ppp-rna寡聚物的杂交,可期待它们进行杂交的那一侧得到平滑5’末端三磷酸化结构。
24nt1个:将5’ppp-rna寡聚物、合成rna寡聚物序列1、glucmrna以摩尔比1:1:1混合、杂交而得。
24nt2个:将5’ppp-rna寡聚物、合成rna寡聚物序列1和2、glucmrna以摩尔比1:1:1:1混合、杂交而得。
24nt3个:将5’ppp-rna寡聚物、合成rna寡聚物序列1、2和3、glucmrna以摩尔比1:1:1:1:1混合、按照以下的条件杂交而得。
在以下的实施例3-2和3-3中,作为glucmrna,使用实施例1-3中制备的glucmrna。通过在65℃下加热5分钟、经过10分钟后冷却到30℃而进行杂交反应。
另外,实施例3-3中,作为“mrna:pu”,使用实施例2-1中制备的“mrna:polyu”。
实施例3-2:免疫激活
将dc2.4细胞以400000/孔接种到12孔板中,24小时后进行培养基更换而置换为无血清培养基opti-mem(商品名)(thermofisherscientific),然后使用lipofectamine(商品名)ltx(thermofisherscientific)以2.5μg/孔给药mrna。4小时后,使用rneasyminikit(qiagen)从细胞中纯化rna,用revertraaceqpcrrtmastermix(toyobo)制成互补dna(cdna)后,使用taqmangeneexpressionassay(appliedbiosystems)调查干扰素β和白介素6的表达量。此时,利用激动蛋白b的表达量进行标准化。
将其结果示于图38和图39。随着由5’ppp-rna寡聚物和合成rna寡聚物构成的双链结构的增加,干扰素β和白介素6的表达量增加。由此可知,随着双链结构的增加,免疫激活效果增大。
实施例3-3:蛋白质翻译
将dc2.4细胞以40000/孔接种到96孔板,24小时后进行培养基更换而置换为无血清培养基opti-mem(商品名)(thermofisherscientific),然后使用lipofectamine(商品名)ltx(thermofisherscientific)以0.25μg/孔给药mrna。4小时后,利用renillaluciferaseassaysystem(promega)对gluc蛋白质的量进行定量。
将其结果示于图40。随着由5’ppp-rna寡聚物和合成rna寡聚物构成的双链结构的增加,可见翻译活性下降一些,但是即使在结合3个时,与单链rna相比也保持了70%左右的翻译活性。与方式2的mrna:pu相比,得到优异的翻译活性。
这里,关于图38~40的p值的统计处理,在anova检验后进行tukey检验,统计上显示出差异显著性。
产业上的可利用性
mrna递送作为安全且持续地供给治疗用蛋白质的方法,其在医疗中的应用备受期待。另一方面,mrna在生物体内会迅速酶解,这是一个重大课题。针对这一课题、本发明的第1方式通过对mrna分子本身进行化学修饰,从而显著抑制了内包于高分子胶束时的mrna的酶解,成功地提高了mrna导入效率。这里使用的内包mrna的高分子胶束在中枢神经疾病、运动感觉系统疾病、肝疾病、恶性肿瘤等各种疾病的模型动物的治疗实验中,显示出优异的效果,以未来的临床应用为目标的研究也在推进中。高分子胶束的组成根据靶脏器、给药方法而不同,本发明的第1方式的技术可以使各种组成的胶束稳定化,因此可以广泛应用。
mrna疫苗被认为是一种结构完全不同于传统疫苗的药物。其特征可列举可自由构建所要表达的抗原蛋白、可以诱导细胞免疫。另外,作为同类型的核酸疫苗,也存在dna疫苗的研究例子,但是dna存在随机插入宿主基因组所致的诱变风险,成为实用化障碍,而mrna则没有该风险。
在以往的使用单链的mrna的疫苗的开发中,以美国、德国为中心,不可避免地要使用用于有效诱发炎症反应的佐剂。本发明的第2方式和第3方式的mrna疫苗可以不使用佐剂,仅通过mrna就能有效诱发炎症反应,另外,可以在抗原呈递的同时且在原位诱发炎症反应。
mrna疫苗在给药途径(皮下给药、肌肉内给药、经粘膜给药等)、转运载体等方面不挑剔,可根据用途、目的灵活应用。另外,mrna疫苗中使用的mrna是基于化学反应而纯化的,可以仅通过改变碱基序列来应对所有的蛋白质,因此预计规模上的优点可以是成本大幅降低。这些是与传统疫苗相比显著不同的优点。本发明的第2方式和第3方式的疫苗作为一种新的疫苗系统,可期待用于癌症等的个性化治疗、能够迅速应对病毒变异的感染症疫苗等巨大的市场中。
序列号1~27:合成rna
序列号28~31:合成dna/rna
序列号32:合成dna
序列号33:合成rna
序列号34~48:合成rna
序列号49和50:合成dna
序列号51~56:合成rna
序列号57和58:合成dna
序列号59:合成rna
序列号60~62:合成rna
序列号63~65:合成dna
序列号66~68:合成rna
序列表
<110>国立大学法人东京大学(theuniversityoftokyo)
<120>mrna的功能化方法
<130>g1576wo
<150>jp2016-252487
<151>2016-12-27
<150>jp2016-252488
<151>2016-12-27
<160>68
<170>patentinversion3.5
<210>1
<211>783
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>1
gggagaccggccucgagcagcugaagcuugguaccgagcucggauccagccaccauggga60
gucaaaguucuguuugcccugaucugcaucgcuguggccgaggccaagcccaccgagaac120
aacgaagacuucaacaucguggccguggccagcaacuucgcgaccacggaucucgaugcu180
gaccgcgggaaguugcccggcaagaagcugccgcuggaggugcucaaagagauggaagcc240
aaugcccggaaagcuggcugcaccaggggcugucugaucugccugucccacaucaagugc300
acgcccaagaugaagaaguucaucccaggacgcugccacaccuacgaaggcgacaaagag360
uccgcacagggcggcauaggcgaggcgaucgucgacauuccugagauuccuggguucaag420
gacuuggagcccauggagcaguucaucgcacaggucgaucuguguguggacugcacaacu480
ggcugccucaaagggcuugccaacgugcaguguucugaccugcucaagaaguggcugccg540
caacgcugugcgaccuuugccagcaagauccagggccagguggacaagaucaagggggcc600
gguggugacuaagcggccgcucgagcaugcaucuagaggauccccggguaccgagcucga660
auucaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaa720
aaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaa780
aaa783
<210>2
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>2
ucuuugagcaccuccag17
<210>3
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>3
cucuagaugcaugcucg17
<210>4
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>4
cucggccacagcgaugc17
<210>5
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>5
gcggcagccacuucuug17
<210>6
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>6
aucucaggaaugucgac17
<210>7
<211>23
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>7
uccaucucuuugagcaccuccag23
<210>8
<211>40
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>8
cuuuccgggcauuggcuuccaucucuuugagcaccuccag40
<210>9
<211>60
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>9
acagccccuggugcagccagcuuuccgggcauuggcuuccaucucuuugagcaccuccag60
<210>10
<211>19
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>10
aaucuuugagcaccuccag19
<210>11
<211>22
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>11
aauaaucuuugagcaccuccag22
<210>12
<211>19
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>12
aacucuagaugcaugcucg19
<210>13
<211>22
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>13
aauaacucuagaugcaugcucg22
<210>14
<211>19
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>14
aacucggccacagcgaugc19
<210>15
<211>19
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>15
aagcggcagccacuucuug19
<210>16
<211>19
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>16
auaucucaggaaugucgac19
<210>17
<211>19
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>17
aagcagccagcuuucccgg19
<210>18
<211>19
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>18
aaacucuuugucgccuucg19
<210>19
<211>19
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>19
aauugaggcagccaguugu19
<210>20
<211>19
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>20
uagugggacaggcagauca19
<210>21
<211>19
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>21
aauugaagucuucguuguu19
<210>22
<211>19
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>22
aauuuuuuuuuuuuuuuuu19
<210>23
<211>19
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>23
ucuuugagcaccuccagau19
<210>24
<211>19
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>24
aaaaaaaaaaaaaaaaaaa19
<210>25
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>25
ucgaaguacucagcgua17
<210>26
<211>19
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>26
aaucgaaguacucagcgua19
<210>27
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>27
ucuuugagcaccuccag17
<210>28
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成dna/rna
<400>28
cuuacgcugaguacuucgatt21
<210>29
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成dna/rna
<400>29
ucgaaguacucagcguaagtt21
<210>30
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成dna/rna
<400>30
uucuccgaacgugucacgutt21
<210>31
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成dna/rna
<400>31
acgugacacguucggagaatt21
<210>32
<211>558
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成dna
<400>32
atgggagtcaaagttctgtttgccctgatctgcatcgctgtggccgaggccaagcccacc60
gagaacaacgaagacttcaacatcgtggccgtggccagcaacttcgcgaccacggatctc120
gatgctgaccgcgggaagttgcccggcaagaagctgccgctggaggtgctcaaagagatg180
gaagccaatgcccggaaagctggctgcaccaggggctgtctgatctgcctgtcccacatc240
aagtgcacgcccaagatgaagaagttcatcccaggacgctgccacacctacgaaggcgac300
aaagagtccgcacagggcggcataggcgaggcgatcgtcgacattcctgagattcctggg360
ttcaaggacttggagcccatggagcagttcatcgcacaggtcgatctgtgtgtggactgc420
acaactggctgcctcaaagggcttgccaacgtgcagtgttctgacctgctcaagaagtgg480
ctgccgcaacgctgtgcgacctttgccagcaagatccagggccaggtggacaagatcaag540
ggggccggtggtgactaa558
<210>33
<211>1653
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>33
auggaagacgccaaaaacauaaagaaaggcccggcgccauucuauccgcuggaagaugga60
accgcuggagagcaacugcauaaggcuaugaagagauacgcccugguuccuggaacaauu120
gcuuuuacagaugcacauaucgagguggacaucacuuacgcugaguacuucgaaaugucc180
guucgguuggcagaagcuaugaaacgauaugggcugaauacaaaucacagaaucgucgua240
ugcagugaaaacucucuucaauucuuuaugccgguguugggcgcguuauuuaucggaguu300
gcaguugcgcccgcgaacgacauuuauaaugaacgugaauugcucaacaguaugggcauu360
ucgcagccuaccgugguguucguuuccaaaaagggguugcaaaaaauuuugaacgugcaa420
aaaaagcucccaaucauccaaaaaauuauuaucauggauucuaaaacggauuaccaggga480
uuucagucgauguacacguucgucacaucucaucuaccucccgguuuuaaugaauacgau540
uuugugccagaguccuucgauagggacaagacaauugcacugaucaugaacuccucugga600
ucuacuggucugccuaaaggugucgcucugccucauagaacugccugcgugagauucucg660
caugccagagauccuauuuuuggcaaucaaaucauuccggauacugcgauuuuaaguguu720
guuccauuccaucacgguuuuggaauguuuacuacacucggauauuugauauguggauuu780
cgagucgucuuaauguauagauuugaagaagagcuguuucugaggagccuucaggauuac840
aagauucaaagugcgcugcuggugccaacccuauucuccuucuucgccaaaagcacucug900
auugacaaauacgauuuaucuaauuuacacgaaauugcuucugguggcgcuccccucucu960
aaggaagucggggaagcgguugccaagagguuccaucugccagguaucaggcaaggauau1020
gggcucacugagacuacaucagcuauucugauuacacccgagggggaugauaaaccgggc1080
gcggucgguaaaguuguuccauuuuuugaagcgaagguuguggaucuggauaccgggaaa1140
acgcugggcguuaaucaaagaggcgaacugugugugagagguccuaugauuauguccggu1200
uauguaaacaauccggaagcgaccaacgccuugauugacaaggauggauggcuacauucu1260
ggagacauagcuuacugggacgaagacgaacacuucuucaucguugaccgccugaagucu1320
cugauuaaguacaaaggcuaucagguggcucccgcugaauuggaauccaucuugcuccaa1380
caccccaacaucuucgacgcaggugucgcaggucuucccgacgaugacgccggugaacuu1440
cccgccgccguuguuguuuuggagcacggaaagacgaugacggaaaaagagaucguggau1500
uacgucgccagucaaguaacaaccgcgaaaaaguugcgcggaggaguuguguuuguggac1560
gaaguaccgaaaggucuuaccggaaaacucgacgcaagaaaaaucagagagauccucaua1620
aaggccaagaagggcggaaagaucgccguguaa1653
<210>34
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>34
acucuuugucgccuucg17
<210>35
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>35
cucggccacagcgaugc17
<210>36
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>36
ucuuugagcaccuccag17
<210>37
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>37
cucuagaugcaugcucg17
<210>38
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>38
gcggcagccacuucuug17
<210>39
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>39
aucucaggaaugucgac17
<210>40
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>40
gcagccagcuuuccggg17
<210>41
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>41
uugaggcagccaguugu17
<210>42
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>42
ugaucuuguccaccugg17
<210>43
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>43
gaugaacuucuucaucu17
<210>44
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>44
gugggacaggcagauca17
<210>45
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>45
uugaagucuucguuguu17
<210>46
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>46
gggcaacuucccgcggu17
<210>47
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>47
cugcuccaugggcucca17
<210>48
<211>17
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>48
cuugcuggcaaaggucg17
<210>49
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成dna
<400>49
tgagattcctgggttcaagg20
<210>50
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成dna
<400>50
gtcagaacactgcacgttgg20
<210>51
<211>783
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>51
gggagaccggccucgagcagcugaagcuugguaccgagcucggauccagccaccauggga60
gucaaaguucuguuugcccugaucugcaucgcuguggccgaggccaagcccaccgagaac120
aacgaagacuucaacaucguggccguggccagcaacuucgcgaccacggaucucgaugcu180
gaccgcgggaaguugcccggcaagaagcugccgcuggaggugcucaaagagauggaagcc240
aaugcccggaaagcuggcugcaccaggggcugucugaucugccugucccacaucaagugc300
acgcccaagaugaagaaguucaucccaggacgcugccacaccuacgaaggcgacaaagag360
uccgcacagggcggcauaggcgaggcgaucgucgacauuccugagauuccuggguucaag420
gacuuggagcccauggagcaguucaucgcacaggucgaucuguguguggacugcacaacu480
ggcugccucaaagggcuugccaacgugcaguguucugaccugcucaagaaguggcugccg540
caacgcugugcgaccuuugccagcaagauccagggccagguggacaagaucaagggggcc600
gguggugacuaagcggccgcucgagcaugcaucuagaggauccccggguaccgagcucga660
auucaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaa720
aaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaa780
aaa783
<210>52
<211>777
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>52
gaaccagaucucgucucuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuu60
uuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuu120
uuuuuuuuuuuuuuuuugaauucgagcucgguacccggggauccucuagaugcaugcucg180
agcggccgcuuagucaccaccggcccccuugaucuuguccaccuggcccuggaucuugcu240
ggcaaaggucgcacagcguugcggcagccacuucuugagcaggucagaacacugcacguu300
ggcaagcccuuugaggcagccaguugugcaguccacacacagaucgaccugugcgaugaa360
cugcuccaugggcuccaaguccuugaacccaggaaucucaggaaugucgacgaucgccuc420
gccuaugccgcccugugcggacucuuugucgccuucguagguguggcagcguccugggau480
gaacuucuucaucuugggcgugcacuugaugugggacaggcagaucagacagccccuggu540
gcagccagcuuuccgggcauuggcuuccaucucuuugagcaccuccagcggcagcuucuu600
gccgggcaacuucccgcggucagcaucgagauccguggucgcgaaguugcuggccacggc660
cacgauguugaagucuucguuguucucggugggcuuggccucggccacagcgaugcagau720
cagggcaaacagaacuuugacucccaugguggcuggauccgagcucgguaccaagcu777
<210>53
<211>663
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>53
gaaccagaucugauaucaucgaugaauucgagcucgguacccggggauccucuagaugca60
ugcucgagcggccgcuuagucaccaccggcccccuugaucuuguccaccuggcccuggau120
cuugcuggcaaaggucgcacagcguugcggcagccacuucuugagcaggucagaacacug180
cacguuggcaagcccuuugaggcagccaguugugcaguccacacacagaucgaccugugc240
gaugaacugcuccaugggcuccaaguccuugaacccaggaaucucaggaaugucgacgau300
cgccucgccuaugccgcccugugcggacucuuugucgccuucguagguguggcagcgucc360
ugggaugaacuucuucaucuugggcgugcacuugaugugggacaggcagaucagacagcc420
ccuggugcagccagcuuuccgggcauuggcuuccaucucuuugagcaccuccagcggcag480
cuucuugccgggcaacuucccgcggucagcaucgagauccguggucgcgaaguugcuggc540
cacggccacgauguugaagucuucguuguucucggugggcuuggccucggccacagcgau600
gcagaucagggcaaacagaacuuugacucccaugguggcuggauccgagcucgguaccaa660
gcu663
<210>54
<211>156
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>54
gaaccagaucucgucucuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuu60
uuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuu120
uuuuuuuuuuuuuuuuugaauucgagcucgguaccc156
<210>55
<211>1303
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>55
gggagaccggccucgagaugggcagcaucggggcagcaagcauggaguuuuguuuugacg60
uguuuaaggaacugaaagugcaucacgcuaaugagaauaucuucuacugccccaucgcca120
uuaugucugcccuggcuaugguguaucugggagcuaaggacaguaccagaacacagauca180
acaaggugguccgcuucgacaaacugcccggguuuggcgacagcauugaggcucagugug240
gcacuuccgugaauguccacagcucccugagggacauccugaaccagauuaccaagccua300
augacguguacuccuucucucuggccucccggcuguacgcugaggaaagguaucccaucc360
ugccugaguaccugcagugcgugaaagaacuguauaggggcggacuggagccaaucaacu420
uucagacagccgcugaccaggccagagaacugauuaauucuuggguggagagucagacua480
acgguaucauucgcaaugugcugcagcccucuagugucgauagccagaccgcuauggugc540
uggucaacgcaaucguguucaagggccugugggagaagaccuucaaggacgaagauacuc600
aggcaaugccauuccgagugacagagcaggaaagcaaacccguccagaugauguaucaga660
ucggccuguucagaguggcuagcauggcauccgagaagaugaaaauucuggaacugccuu720
uugccucaggaaccaugagcaugcuggugcugcugccagacgaggucagugggcuggagc780
agcuggaaucaaucauuaacuucgagaagcugacugaauggaccucaagcaaugugaugg840
aggaacgaaagaucaaagucuaccugccucggaugaagauggaggaaaaauauaaccuga900
ccuccgugcugauggcuauggguauuacagaugucuuuuccucuagugccaaucugucug960
gcaucucaagcgccgagucccugaagauuucucaggcagugcacgcagcccaugcagaga1020
ucaaugaagccggccgcgagguggucggaucugcagaagccgggguggacgcugcaagug1080
ucucagaggaguuccgggccgaucauccauuucuguucuguaucaaacauauugccacaa1140
augccgugcuguucuucgguagaugcgugucaccaugagaauucaaaaaaaaaaaaaaaa1200
aaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaa1260
aaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaa1303
<210>56
<211>142
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>56
gaaccagaucucgucucuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuu60
uuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuu120
uuuuuuuuuuuuuuuuugaauu142
<210>57
<211>558
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成dna
<400>57
atgggagtcaaagttctgtttgccctgatctgcatcgctgtggccgaggccaagcccacc60
gagaacaacgaagacttcaacatcgtggccgtggccagcaacttcgcgaccacggatctc120
gatgctgaccgcgggaagttgcccggcaagaagctgccgctggaggtgctcaaagagatg180
gaagccaatgcccggaaagctggctgcaccaggggctgtctgatctgcctgtcccacatc240
aagtgcacgcccaagatgaagaagttcatcccaggacgctgccacacctacgaaggcgac300
aaagagtccgcacagggcggcataggcgaggcgatcgtcgacattcctgagattcctggg360
ttcaaggacttggagcccatggagcagttcatcgcacaggtcgatctgtgtgtggactgc420
acaactggctgcctcaaagggcttgccaacgtgcagtgttctgacctgctcaagaagtgg480
ctgccgcaacgctgtgcgacctttgccagcaagatccagggccaggtggacaagatcaag540
ggggccggtggtgactaa558
<210>58
<211>1161
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成dna
<400>58
atgggcagcatcggggcagcaagcatggagttttgttttgacgtgtttaaggaactgaaa60
gtgcatcacgctaatgagaatatcttctactgccccatcgccattatgtctgccctggct120
atggtgtatctgggagctaaggacagtaccagaacacagatcaacaaggtggtccgcttc180
gacaaactgcccgggtttggcgacagcattgaggctcagtgtggcacttccgtgaatgtc240
cacagctccctgagggacatcctgaaccagattaccaagcctaatgacgtgtactccttc300
tctctggcctcccggctgtacgctgaggaaaggtatcccatcctgcctgagtacctgcag360
tgcgtgaaagaactgtataggggcggactggagccaatcaactttcagacagccgctgac420
caggccagagaactgattaattcttgggtggagagtcagactaacggtatcattcgcaat480
gtgctgcagccctctagtgtcgatagccagaccgctatggtgctggtcaacgcaatcgtg540
ttcaagggcctgtgggagaagaccttcaaggacgaagatactcaggcaatgccattccga600
gtgacagagcaggaaagcaaacccgtccagatgatgtatcagatcggcctgttcagagtg660
gctagcatggcatccgagaagatgaaaattctggaactgccttttgcctcaggaaccatg720
agcatgctggtgctgctgccagacgaggtcagtgggctggagcagctggaatcaatcatt780
aacttcgagaagctgactgaatggacctcaagcaatgtgatggaggaacgaaagatcaaa840
gtctacctgcctcggatgaagatggaggaaaaatataacctgacctccgtgctgatggct900
atgggtattacagatgtcttttcctctagtgccaatctgtctggcatctcaagcgccgag960
tccctgaagatttctcaggcagtgcacgcagcccatgcagagatcaatgaagccggccgc1020
gaggtggtcggatctgcagaagccggggtggacgctgcaagtgtctcagaggagttccgg1080
gccgatcatccatttctgttctgtatcaaacatattgccacaaatgccgtgctgttcttc1140
ggtagatgcgtgtcaccatga1161
<210>59
<211>187
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>59
gaaccagaucucgucucuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuu60
uuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuuu120
uuuuuuuuuuuuuuuuugaauucgagcucgguacccggggauccucuagaugcaugcucg180
agcggcc187
<210>60
<211>43
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>60
cagccagcuuuccgggcuacacacacacacacacacacacacc43
<210>61
<211>43
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>61
acucuuugucgccuucgaucacacacacacacacacacacacc43
<210>62
<211>43
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>62
gcggcagccacuucuuguacacacacacacacacacacacacc43
<210>63
<211>31
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成dna
<400>63
taggtgtgtgtgtgtgtgtgtgtgtgggccc31
<210>64
<211>31
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成dna
<400>64
aaacgggcccacacacacacacacacacaca31
<210>65
<211>2153
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>合成dna
<400>65
tgggcctttcttcggtagaaaatcaaaggatcttcttgagatcctttttttctgcgcgta60
atctgctgcttgcaaacaaaaaaaccaccgctaccagcggtggtttgtttgccggatcaa120
gagctaccaactctttttccgaggtaactggcttcagcagagcgcagataccaaatactg180
ttcttctagtgtagccgtagttaggccaccacttcaagaactctgtagcaccgcctacat240
acctcgctctgctaatcctgttaccagtggctgctgccagtggcgataagtcgtgtctta300
ccgggttggactcaagacgatagttaccggataaggcgcagcggtcgggctgaacggggg360
gttcgtgcacacagcccagcttggagcgaacgacctacaccgaactgagatacctacagc420
gtgagctatgagaaagcgccacgcttcccgaagggagaaaggcggacaggtatccggtaa480
gcggcagggtcggaacaggagagcgcacgagggagcttccagggggaaacgcctggtatc540
tttatagtcctgtcgggtttcgccacctctgacttgagcatcgatttttgtgatgctcgt600
caggggggcggagcctatggaaaaacgccagcaacgcagaaaggcccacccgaaggtgag660
ccaggtgattacatttaggtcctcattagaaaaactcatcgagcatcaagtgaaactgca720
atttattcatatcaggattatcaataccatatttttgaaaaagccgtttctgtaatgaag780
gagaaaactcaccgaggcagttccataggatggcaagatcctggtatcggtctgcgattc840
cgactcgtccaacatcaatacaacctattaatttcccctcgtcaaaaataaggttatcaa900
gtgagaaatcaccatgagtgacgactgaatccggtgagaatggcaagagtttatgcattt960
ctttccagacttgttcaacaggccagccattacgctcgtcatcaaaatcactcgcaccaa1020
ccaaaccgttattcattcgtgattgcgcctgagcgagacgaaatacgcgatcgccgttaa1080
aaggacaattacaaacaggaatcgaatgcaaccggcgcaggaacactgccagcgcatcaa1140
caatattttcacctgaatcaggatattcttctaatacctggaatgctgttttccctggga1200
tcgcagtggtgagtaaccatgcatcatcaggagtacggataaaatgcttgatggtcggaa1260
gaggcataaattccgtcagccagtttagcctgaccatctcatctgtaacatcattggcaa1320
cgctacctttgccatgtttcagaaacaactctggcgcatcgggcttcccatacaatcgat1380
agattgtcgcacctgattgcccgacattatcgcgagcccatttatacccatataaatcag1440
catccatgttggaatttaatcgcggcttcaagcaagacgtttcccgttgaatatggctca1500
ttttagcttccttagctcctgaaaatctcgataactcaaaaaatacgcccggtagtgatc1560
ttatttcattatggtgaaagttggaacctcttacgtgccgatcaagtcaaaagcctccgg1620
tcggaggcttttgactttctgctatggaggtcaggtatgatttaaatggtcagtattgag1680
cctcaggaaacagctatgacatcaagctgactagataatctagctgatcgtggaccgatc1740
atacgtataatgccgtaagatcacgggtcgcagcacagctcgcggtccagtagtgatcga1800
cactgctcgatccgctcgcaccgctagctaatacgactcactataggtgtgtgtgtgtgt1860
gtgtgtgtgggcccgttttagagctagaaatagcaagttaaaataaggctagtccgttat1920
caacttgaaaaagtggcaccgagtcggtgcttttaaaaagcttggatcgacgagagcagc1980
gcgactggatctgtcgcccgtctcaaacgcaaccctccggcggtcgcatatcattcagga2040
cgagcctcagactccagcgtaactggactgcaatcaactcactggctcaccttccggtcc2100
acgatcagctagaatcaagctgactagataaactggccgtcgttttacacggg2153
<210>66
<211>24
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>66
ggugugugugugugugugugugug24
<210>67
<211>10
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>67
gugugugugu10
<210>68
<211>10
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>合成rna
<400>68
acacacacac10
- 还没有人留言评论。精彩留言会获得点赞!