抑制CD73表达的免疫抑制恢复寡核苷酸的制作方法
本公开涉及与胞外酶(nt5e或cd73)的核酸序列杂交的免疫抑制恢复寡核苷酸,以及包含这种免疫抑制恢复寡核苷酸和药用载体、赋形剂和/或稀释剂的药物组合物。
背景技术:
近年来,通过应用免疫疗法,特别是通过所谓的“免疫检查点”的抑制剂,对如恶性肿瘤的几种不同疾病的治疗非常成功。这些检查点是免疫系统中的分子,其上调(共刺激分子)或下调信号。治疗方法的概念基于内源性抗肿瘤免疫反应的激活。例如,许多癌症分别通过抑制t细胞和nk细胞活性来保护自己免受免疫系统的侵害。免疫检查点调节剂,即刺激剂或抑制剂,例如针对ctla-4、pd-1、pd-l1、lag-3、vista、a2ar、btla、ido、cd39、cd73、stat3、tdo2、tim-3、mica、nkg2a、kir、tigit、tgf-β、ox40、gitr、cd27、cd160、2b4和4-1bb中的一种或多种。
cd73需要被认为是提高对不同类型癌症的免疫力的一种新颖且有前景的候选物。cd73是一种胞外酶(ntpdase),并且催化amp向免疫抑制性腺苷的转化。cd73协同作用,但在cd39的下游,已知将atp转化为adp,并将adp转化为amp。腺苷通过腺苷受体a1、腺苷受体a2a、腺苷受体a2b和腺苷受体a3发挥其作用。表达腺苷受体并因此可能受腺苷的免疫调节作用影响的免疫细胞的范围包括t淋巴细胞、自然杀伤(nk)细胞、nkt细胞、巨噬细胞、dc、中性粒细胞、肥大细胞和b细胞。
cd73存在于大多数组织和许多细胞类型中,包括淋巴细胞的亚群、巨噬细胞、树突细胞、内皮细胞和上皮细胞。缺氧诱导小鼠微血管内皮细胞中的cd73mrna、蛋白质表达并增加cd73活性。特别地,cd73在许多不同的人(实体和血液)肿瘤中高度表达,并且其升高的表达和活性与肿瘤侵袭性和转移相关并且具有较短的患者存活期。cd73的rna表达和酶活性在不同的乳腺癌细胞系中是可变的。
将死的癌细胞将atp释放到肿瘤微环境中的细胞外空间。活的肿瘤细胞通常表达高水平的cd39和cd73,并将atp转化为免疫抑制性腺苷。由此,肿瘤细胞能够进行不受控制的增殖和扩增。通过与淋巴细胞上的a2a或a2b受体结合,腺苷介导对这些细胞的免疫抑制信号。例如,t细胞的增殖、细胞毒性细胞因子产生和激活受到抑制。nk细胞显示出降低的细胞毒性潜力。腺苷诱导巨噬细胞中的替代激活(免疫抑制性m2表型),导致促炎性细胞因子产生减少,但免疫抑制性细胞因子il-10的产生增加。cd73作为相关治疗靶标在不同肿瘤中的重要作用由以下事实强调:使用cd73或a2a受体敲除小鼠的肿瘤模型显示出改善的疾病结果。
抗人cd73单克隆抗体如innatepharma的抗cd73抗体(例如,innatepharmaposter#iph_poster_aarc2016_cd73)目前正在基于免疫肿瘤学细胞的试验中进行临床前研究。然而,由于空间位阻,针对cd73的单克隆抗体可能无法定位于肿瘤微环境中。此外,cd73的不可水解的小分子抑制剂如ampcp(腺苷5'-(α,β-亚甲基)二磷酸;例如,结构20,2161-2173,2012年12月5日)(其为adp类似物)竞争性地抑制cd73活性,已经在动物模型中体外和体内测试,但需要相对高的浓度和重复给药以成功阻断cd73酶活性。
免疫疗法已经导致长期缓解,但到目前为止只对小患者群体。原因可能是许多免疫检查点和可选的其它免疫抑制机制参与例如免疫系统和肿瘤细胞之间的相互作用。免疫检查点和潜在的其它机制的组合可以根据肿瘤和受试者的个体状况而不同,以逃避身体的防御。
为了抑制几种免疫抑制机制,使用抗体和/或小分子的常用方法不适合或几乎不适合,因为分子靶标位于细胞内或不具有酶活性。因此,安全有效地抑制如cd73的“免疫检查点”功能的药剂将是治疗患有例如由该酶活性影响的疾病或病症的患者的重要补充。
本发明的寡核苷酸分别在抑制cd73的表达和活性方面非常成功。寡核苷酸的作用方式不同于抗体或小分子的作用方式,并且寡核苷酸对于例如以下是非常有利的
(i)肿瘤组织在实体肿瘤中的渗透,
(ii)分别阻断靶标的多项功能和活动,
(iii)寡核苷酸彼此或与抗体或小分子的组合,和
(iv)抑制对于抗体是不可接近的或通过小分子可抑制的细胞内效果。
因此,通过反义寡核苷酸在mrna水平上靶向癌症和免疫细胞上的cd73表达是开发和改进例如分别针对不同癌症和免疫疾病的免疫疗法的有前景的最新技术方法。
技术实现要素:
本发明涉及寡核苷酸,如包含约10至20个核苷酸的免疫抑制恢复(immunosuppression-reverting)寡核苷酸,其中至少一个核苷酸被修饰。寡核苷酸与例如seqidno.1(人)的胞外酶cd73的核酸序列和/或seqidno.2(小鼠)的序列杂交。修饰的核苷酸例如选自由桥接核酸(例如,lna、cet、ena、2’氟修饰的核苷酸或2'o-甲基修饰的核苷酸)组成的组。在一些实施方式中,寡核苷酸抑制至少50%的cd73表达,并且在一些实施方式中,寡核苷酸以纳摩尔浓度抑制cd73的表达。
与rnai相比,反义寡核苷酸具有显着的优势。可以在体外转染反义寡核苷酸而不转染试剂,因此与使用专门转染rnai的转染试剂的转染相比,该转染更接近体内条件。在不同组织中体内全身给予反义寡核苷酸是可能的,而体内给予rnai依赖于递送系统,如galnac,例如在肝脏中。此外,反义寡核苷酸比rnai短,因此在合成和吸收入细胞方面较不复杂。rnai规律地显示同样可以启动rnai的随从链的脱靶(off-target)效果。随从链risc加载是rnai药物的重要问题,因为随从链可能将rnai活性导向非预期的靶标,导致毒副作用。“(参见chackalamannil,rotella,ward,comprehensivemodicinalchemistryiiielsevier,03.06.2017)。反义寡核苷酸不包含随从链。
本发明还涉及药物组合物,其包含本发明的免疫抑制恢复寡核苷酸和可选的药用载体、赋形剂和/或稀释剂。在一些实施方式中,该药物组合物另外包含化学治疗剂,如铂或吉西他滨,另一种寡核苷酸、抗体和/或例如在肿瘤治疗中有效的小分子。
在一些实施方式中,本发明的寡核苷酸与另一种寡核苷酸、抗体和/或小分子组合,这些化合物中的每一种在药物组合物中分离或组合,其中寡核苷酸、抗体和/或小分子抑制或刺激免疫抑制因子,如ido1、ido2、ctla-4、pd-1、pd-l1、lag-3、vista、a2ar,cd39、cd73、stat3,tdo2、tim-3、tigit、tgf-β、btla、mica、nkg2a、kir、cd160、chop和/或xbp1。另外或可替代地,寡核苷酸、抗体和/或小分子抑制或刺激免疫刺激因子,例如4-1bb、ox40、kir、gitr、cd27和/或2b4。
此外,本发明涉及本发明的寡核苷酸或药物组合物在预防和/或治疗其中涉及cd73失衡的疾病的方法中的用途。在一些实施方式中,该病症是例如自身免疫病症,例如自身免疫性关节炎或胃肠道自身免疫疾病,例如炎性肠病(ibd)或结肠炎、免疫病症,例如由于慢性病毒感染如hiv感染引起的免疫衰竭、心血管疾病、炎性疾病,例如慢性气道炎症、细菌、病毒和/或真菌感染,例如败血症或牛结核分支杆菌(mycobacteriumbovis)感染、肝脏疾病、慢性肾病、精神疾病和/或癌症cd73具有许多生理学作用,如调节屏障功能、适应低氧、缺血预处理、抗炎、白细胞渗出。cd73在癌细胞上的表达和激活与不良的预后相关并且可能促进转移。cd73促进人乳腺癌细胞的粘附、迁移、侵袭和胶质瘤细胞的增值,并且这些过程与酶的腺苷生产无关。在一些实施方式中,例如局部或全身给予本发明的寡核苷酸或药物组合物。
本文引用或参考的所有文件(“本文引用的文件”),以及本文引用的文件中引用或参考的所有文件,以及本文或本文通过引证并入的任何文件提及的任何产品的任何制造商的说明、描述、产品规格和产品说明书,并且可以用于本发明的实践中。更具体地,所有参考文件通过引用并入,其程度如同每个单独的文件被具体和单独地指出通过引证并入。
附图说明
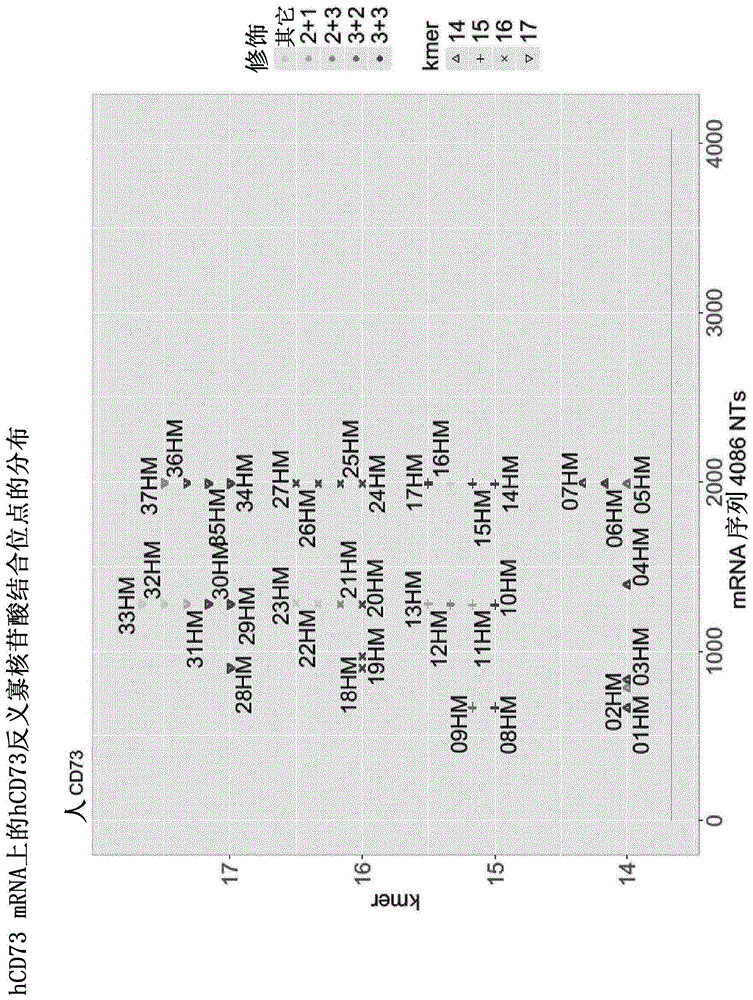
图1描绘了人(h)cd73反义寡核苷酸结合位点在seqidno.1的hcd73mrna(nm_002526.3)上的分布以及它们的(一个或多个)修饰和长度。将hcd73反义寡核苷酸与seqidno.1的hcd73mrna序列比对。不同的灰度表示不同的lna修饰,且符号表示反义寡核苷酸的不同长度。
图2a-2e描绘了在第一轮和第二轮筛选(图2a和2b(第1部分和第2部分))中在人癌细胞系a-172(人胶质母细胞瘤)中和在一轮筛选中(图2c(第1部分和第2部分))中在efo-21(人卵巢囊腺癌)中、在一轮筛选中在一个鼠细胞系4t1(乳腺癌)中(图2d(第1部分和第2部分))和在一轮筛选中在人类skov-3(人类卵巢腺癌)细胞中(图2e)的hmcd73反义寡核苷酸的hcd73mrna敲除功效。用10μm的相应的反义寡核苷酸处理a-172、efo-21、4t1和skov-3细胞3天。作为对照,用neg1处理细胞,neg1是具有序列cgtttaggctatgtactt的反义寡核苷酸(描述于wo2014154843a1中)。描绘了相对于未处理的细胞的残留的人或小鼠cd73mrna表达。将表达值归一化为管家基因gapdh或hprt1的表达值。描绘的是一式三份的孔的平均值+/-sd。
图3a和3b显示了人efo-21细胞与人a-172细胞相比(图3a)和人a-172细胞与小鼠4t1细胞相比(图3b)的hmcd73反义寡核苷酸功效的相关性分析。
图4a和4b显示了skov-3细胞和efo-21(人卵巢癌)中选择的hmcd73反义寡核苷酸的浓度依赖性hmcd73mrna敲除,选择的hmcd73反义寡核苷酸为a05008hm(seqidno.4)、a05009hm(seqidno.6)、a05018hm(seqidno.3)、a05026hm(seqidno.8)和a05028hm(seqidno.5)(图4a)和efo21细胞中的a05018hm(seqidno.3)、a05027hm(seqidno.30)、a05028hm(seqidno.5)和a05037hm(seqidno.39)(图4b)。skov-3和efo-21细胞用指定浓度的相应反义寡核苷酸处理3天。描绘了与未处理的对照细胞(设定为100)相比的残留的hcd73表达。将hcd73mrna表达值归一化为管家基因hprt1的表达。描述的是一式三份的孔的平均值+/-sd。浓度依赖性靶标敲除用于计算表7的skov-3细胞和表8的efo-21细胞的ic50值。
图5a至5c描绘了hmcd73反义寡核苷酸在人和小鼠癌细胞系中的hmcd73mrna敲除功效。efo-21(人卵巢囊腺癌(图5a))、skov-3(人卵巢腺癌(图5b))和4t1(小鼠乳腺癌(图5c))细胞用10μm的相应的反义寡核苷酸处理3天。描绘了相对于未处理细胞(设定为1)的残留hmcd73mrna表达。将表达值归一化为管家基因hprt1的表达。描绘的是一式三份的孔的平均值+/-sd。
图6显示了用指定浓度的相应的反义寡核苷酸处理efo-21细胞3天。将hcd73mrna表达值归一化为管家基因hprt1的表达。描绘了相对于未处理细胞(设定为100)的残留hcd73mrna表达。描绘的是一式三份的孔的平均值+/-sd。
图7a和7b描绘了通过a05008hm(seqidno.4)、a05018hm(seqidno.3)和a05028hm(seqidno.5)的浓度依赖性hcd73mrna和蛋白质敲除。通过流式细胞术分析cd73的蛋白质表达和细胞活力(图7a),并在用指定的反义寡核苷酸处理6天后,进行skov-3细胞的7-aad染色(图7b)。作为对照,用neg1类似地处理细胞。描绘了相对于未用任何反义寡核苷酸处理的对照细胞的数量(=1)的cd73蛋白表达的中值荧光强度(图7a)和总死亡细胞(7-aad阳性细胞)(图7b)。
图8显示了反义寡核苷酸处理后skov3和efo-21细胞上cd73蛋白表达的敲除。在用a05018hm(seqidno.3)处理6天后分析两种测试的细胞系上的cd73蛋白表达。作为对照,用neg1类似地处理细胞。描绘了相对于未用任何反义寡核苷酸处理的对照细胞的表达(=1)的cd73蛋白表达的中值荧光强度。
图9a-9d描绘了hcd73敲除对skov-3和efo-21细胞的细胞外焦磷酸水平和细胞活力的影响。来自用a05018hm(seqidno.3)处理6天的efo-21细胞(图9a)和skov-3细胞(图9c)的细胞上清液中分析作为腺苷产生的间接量度的焦磷酸酯的生成。在测量之前,将外源amp在指定时间点以500μm添加到细胞中。使用细胞滴度蓝(celltiterblue)试验测试使用a05018hm(seqidno.3)的处理对efo-21细胞(图9b)和skov-3细胞(图9d)的细胞活力的影响。
图10a至10c显示以5μm用cd73特异性反义寡核苷酸a05018hm(黑色柱)或对照寡核苷酸s6(白色柱)处理的efo-21细胞,总处理时间为6天。通过流式细胞术分析hcd73蛋白表达。图10a描绘了相对于未处理细胞(斑点柱;设定为1)的残留hcd73表达。为了分析降解细胞外amp的能力,在终止前6.5小时将300μm的amp加入细胞或无细胞pbs(条带柱)中。图10b显示相对于不含amp补充pbs的细胞(设定为1)的相对amp水平,且图10c显示细胞上清液(细胞条件的pbs)中的绝对腺苷浓度。描绘的是对于无细胞pbs的条件的3孔的平均值+/-sd或单个值。
图11a至11c描绘了用细胞增殖染料标记,用抗cd3激活并用5μm的cd73特异性反义寡核苷酸a05018hm(黑色柱)或对照寡核苷酸s6(白色柱)处理5天的总处理时间的人cd4+t细胞。在载体对照(条纹柱)中,仅用抗cd3激活细胞。随后,在寡核苷酸处理开始后第3天和第4天将300μm的amp或载体加入细胞中。图11a显示cd73蛋白表达,图11b描绘了增殖,且图11c显示cd4+t细胞的绝对细胞数,其在寡核苷酸处理开始后第5天使用流式细胞术分析。描绘的是一式三份的孔的平均值+/-sd。
图12描绘了hmcd73反义寡核苷酸(a05027hm)处理对小鼠肝脏中mcd73mrna表达的体内作用。图12中描绘的结果显示a05027hm或媒介物处理的小鼠(白色柱)的肝脏中的mcd73mrna水平。
图13显示了seqidno.1(nm_002526.3)的hcd73mrna。
具体实施方式
本发明首次提供了人和鼠寡核苷酸,其与外核苷酶cd73的mrna序列杂交并分别抑制例如肿瘤细胞或肿瘤相关免疫细胞上的cd73的表达和活性。结果,atp水平增加,且其降解产物如adp、amp和免疫抑制性腺苷水平降低。所有这些效果分别导致抗肿瘤免疫细胞增加,免疫激活(例如,通过细胞毒性t细胞或nk细胞)和肿瘤细胞的识别和消除。因此,本发明的寡核苷酸代表了用于预防和/或治疗其中cd73表达和活性分别增加的疾病的方法的感兴趣且高效的工具。
在下文中,将更详细地描述本发明的元素。这些元素与特定实施方式一起列出,然而,应该理解,它们可以以任何方式和任何数量组合以产生另外的实施方式。不应将各种描述的实施例和实施方式解释为将本发明仅限于明确描述的实施方式。应该理解,该描述支持和包含将明确描述的实施方式与任何数量的公开元素组合的实施方式。此外,除非上下文另有说明,否则本申请中的所有描述的元素的任何排列和组合应该被认为是由本申请的说明书公开。
在整个说明书和权利要求书中,除非上下文另有要求,否则词语“包括(comprise)”或如“包括(comprises)”或“包括(comprising)”的变体将被理解为暗示包括所述成员、整数或步骤,或成员、整数或步骤的组,但不排除任何其它成员、整数或步骤,或成员、整数或步骤的组。除非在本文中另有说明或上下文明显矛盾,否则在描述本发明的上下文中使用的术语“一个”和“一种”和“该”以及类似的指代(特别是在权利要求的上下文中)应被解释为涵盖单数和复数。本文中对数值范围的描述仅旨在用作单独提及落入该范围内的每个单独值的速记法。除非本文另有说明,否则每个单独的值被并入说明书中,如同其在本文中单独引用一样。除非本文另有说明或上下文明显矛盾,否则本文所述的所有方法均可以任何合适的顺序进行。本文提供的任何和所有实例或示例性语言(例如,“如”,“例如”)的使用仅旨在更好地说明本发明,而不是对另外要求保护的本发明的范围构成限制。说明书中的任何语言都不应被解释为表示对于本发明的实践必不可少的任何未要求保护的要素。
本发明的寡核苷酸是例如反义寡核苷酸,其包含10至25个核苷酸、10至15个核苷酸、15至20个核苷酸、12至18个核苷酸或14至17个核苷酸或由其组成。例如,寡核苷酸包含10、11、12、13、14、15、16、17、18、19、20或25个核苷酸或由其组成。本发明的寡核苷酸包含至少一个修饰的核苷酸。修饰的核苷酸是例如,桥连核苷酸如锁核酸(lna,例如,2’,4’-lna)、cet、ena、2'氟修饰的核苷酸、2'o-甲基修饰的核苷酸或它们的组合。在一些实施方式中,本发明的寡核苷酸包含具有相同或不同修饰的核苷酸。在一些实施方式中,本发明的寡核苷酸包含修饰的磷酸主链,其中磷酸是例如硫代磷酸或甲基磷酸或两者。
本发明的寡核苷酸在寡核苷酸的3'-末端和/或5'-末端和/或寡核苷酸内的任何位置包含一个或多个修饰的核苷酸,其中修饰的核苷酸在1、2、3、4、5或6个修饰的核苷酸的行中,或修饰的核苷酸与一个或多个未修饰的核苷酸组合。下表1给出了包含修饰的核苷酸的寡核苷酸的本实施方式,例如由(+)表示的lna和由(*)表示的硫代磷酸(pto)。分别包含表1的序列由其组成的寡核苷酸可以包含任何其它修饰的核苷酸以及修饰的和未修饰的核苷酸的任何其它组合。表1的寡核苷酸与人和鼠cd73的mrna杂交:
表1:与例如分别为seqidno.1和seqidno.2的人和鼠cd73杂交的反义寡核苷酸的列表。neg1是代表未与seqidno.1和seqidno.2的cd73杂交的阴性对照的反义寡核苷酸。
本发明的寡核苷酸例如与seqidno.1和/或seqidno.2的人或鼠cd73的mrna杂交。这种寡核苷酸称为cd73反义寡核苷酸。
在一些实施方式中,本发明的寡核苷酸抑制至少约50%、55%、60%、65%、70%、75%、80%、85%、90%、92%、94%、95%、96%、97%、98%、99%或100%的cd73,例如人、鼠cd73表达。因此,本发明的寡核苷酸是免疫抑制恢复寡核苷酸,其例如在细胞、组织、器官或受试者中恢复免疫抑制。本发明的寡核苷酸以纳摩尔或微摩尔浓度,例如0.1、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900或950nm,或1、10或100μm的浓度抑制cd73的表达。
在一些实施方式中,本发明的寡核苷酸以1、3、5、9、10、15、27、30、40、50、75、82、100、250、300、500或740nm,或1、2.2、3、5、6.6或10μm的浓度使用。
在一些实施方式中,本发明涉及药物组合物,其包含本发明的寡核苷酸和药用载体、赋形剂和/或稀释剂。在一些实施方式中,药物组合物还包含化学治疗剂、另一种寡核苷酸、抗体和/或小分子。
在一些实施方式中,本发明的寡核苷酸或药物组合物用于预防和/或治疗病症的方法。在一些实施方式中,本发明的寡核苷酸或药物组合物用于预防和/或治疗病症的方法与放射疗法结合使用。放射疗法可以进一步与化学疗法(例如铂、吉西他滨)结合使用。该病症特征在于例如cd73失衡,即与正常健康细胞、组织、器官或受试者中的水平相比,cd73水平增加。cd73水平分别通过例如增加的cd73表达和活性而增加。cd73水平可以通过任何标准方法测量,例如本领域技术人员已知的免疫组织化学、蛋白质印迹、定量实时pcr或quantigene测定。
本发明的寡核苷酸或药物组合物局部或全身给予,例如口腔、舌下、经鼻、皮下、静脉内、腹膜内、肌肉内、瘤内、鞘内、透皮和/或直肠给予。可替换地或组合地,给予离体处理的免疫细胞。寡核苷酸单独给予或与本发明的另一种免疫抑制恢复寡核苷酸组合给予,并可选地与另一种化合物如另一种寡核苷酸、抗体、小分子和/或化学治疗剂(例如铂、吉西他滨)组合给予。在一些实施方式中,其他的寡核苷酸(即,不是本发明的一部分)、抗体和/或小分子有效预防和/或治疗自身免疫性疾病,例如自身免疫性关节炎或胃肠道自身免疫疾病,如炎性肠病(ibd)或结肠炎、免疫疾病,例如由于慢性病毒感染如hiv感染引起的免疫衰竭、心血管疾病、炎性疾病例如慢性气道炎症、细菌、病毒和/或真菌感染,例如败血症或牛结核分支杆菌感染、肝脏疾病、慢性肾病、精神病症(例如,精神分裂症、双相情感障碍、阿尔茨海默病)和/或癌症。
本发明的寡核苷酸或药物组合物用于例如预防和/或治疗实体瘤或血液肿瘤的方法。通过使用本发明的寡核苷酸或药物组合物可预防和/或可治疗的癌症的实例是乳腺癌、肺癌、恶性黑色素瘤、淋巴瘤、皮肤癌、骨癌、前列腺癌、肝癌、脑癌、喉癌、胆囊癌、胰腺癌、睾丸癌、直肠癌、甲状旁腺癌、甲状腺癌、肾上腺癌、神经组织癌、头颈癌、结肠癌、胃癌、支气管癌、肾癌、基底细胞癌、鳞状细胞癌、转移性皮肤癌、骨肉瘤、尤文氏肉瘤、网状细胞肉瘤、脂肪肉瘤、骨髓瘤、巨细胞瘤、小细胞肺肿瘤、胰岛细胞瘤、原发性脑肿瘤、脑膜瘤、急性和慢性淋巴细胞和粒细胞瘤、急性和慢性髓性白血病、毛细胞瘤、腺瘤、增生、髓样癌、肠神经节瘤、肾母细胞瘤(wilm’stumor)、精原细胞瘤、卵巢肿瘤、平滑肌瘤、宫颈非典型增生(dysplasia)、视网膜母细胞瘤、软组织肉瘤、恶性类癌、局部皮损、横纹肌肉瘤、卡波西肉瘤、骨原性肉瘤、恶性高钙血症、肾细胞瘤、真性红细胞增多症、腺癌、间变性星形细胞瘤、多形性胶质母细胞瘤、白血病或表皮样癌。
在一些实施方式中,本发明的两种或更多种寡核苷酸在同一时间点一起给予,例如在药物组合物中,或单独给予,或以交错的间隔给予。在其它实施方式中,本发明的一种或多种寡核苷酸与另一种化合物,如另一种寡核苷酸(即,不是本发明的一部分)、抗体、小分子和/或化学治疗剂,在同一时间点,例如在药物组合物中一起给予,或单独给予或以交错的间隔给予。在这些组合的一些实施方式中,免疫抑制恢复寡核苷酸分别抑制免疫抑制因子和其它寡核苷酸(即,不是本发明的一部分),抗体和/或其小分子抑制物(拮抗剂)或刺激物(激动剂)和/或另一种免疫抑制因子和/或免疫刺激因子。免疫抑制因子选自由例如ido1、ido2、ctla-4、pd-1、pd-l1、lag-3、vista、a2ar、cd39、cd73、stat3,tdo2、tim-3、tigit、tgf-β、btla、mica、nkg2a、kir、cd160、chop、xbp1和它们的组合组成的组。免疫刺激因子选自由例如4-1bb、ox40、kir、gitr、cd27、2b4和它们的组合组成的组。
免疫抑制因子是其表达和/或活性例如在细胞、组织、器官或受试者中增加的因子。免疫刺激因子是其水平取决于细胞、组织、器官或受试者及其个体状况而在细胞、组织、器官或受试者中升高或降低的因子。
与本发明的寡核苷酸或药物组合物组合的抗体是例如抗pd-1抗体、抗pd-l1抗体或双特异性抗体。与本发明的寡核苷酸或药物组合物组合的小分子是例如ampcp(腺苷5′-(α,β-亚甲基)二磷酸酯,;例如structure20,2161-2173,december5,2012),其作用为adp类似物并且因此是cd73活性的竞争性抑制剂。
本发明的受试者是例如哺乳动物、鸟或鱼。
实施例
以下实施例说明了本发明的不同实施方式,但本发明不限于这些实施例。对内源表达cd73的细胞(即该细胞不代表包含转染的报道基因构建体的人工系统)进行以下实验。与更接近治疗相关的体内系统的内源系统相比,这种人工系统通常显示出更高程度的抑制和更低的ic50值。此外,在以下实验中,不使用转染剂,即进行自主递送(gymnoticdelivery)。已知转染剂会增加影响ic50值的寡核苷酸的活性(参见例如zhanget,al,genetherapy,2011,18,326-333;stantonet,al,nucleicacidtherapeutics,vol.22,no.5,2012)。由于使用转染剂的人工系统难以或不可能转化为治疗方法,并且目前尚无批准用于寡核苷酸的转染制剂,因此在没有任何转染剂的情况下进行以下实验。
实施例1:人cd73反义寡核苷酸的设计
为了设计对人(h)cd73具有特异性的反义寡核苷酸,使用具有seqidno.1的hcd73mrna序列(nm_002526.3)和具有seqidno.2的mcd73mrna序列(nm_0011851.4)。根据内部标准设计14、15、16和17聚体,在所有实验中使用neg1(在wo2014154843a1中描述)作为对照反义寡核苷酸(表1)。hcd73mrna上的hcd73寡核苷酸结合位点的分布如图1所示。
实施例2:hmcd73反义寡核苷酸在人癌细胞系中的功效筛选
为了分析本发明的hcd39反义寡核苷酸在癌细胞系中对hmcd73mrna表达的敲除的功效,使用单剂量(浓度:10μm,不添加任何转染试剂,该过程称为自主递送)的相应的反义寡核苷酸处理a-172(人胶质母细胞瘤,atcc)、efo-21(人卵巢囊腺癌,dsmz)和小鼠4t1(小鼠乳腺细胞,atcc)细胞;如图2a、2b、2c和2d所示。使用quantigenesingleplex测定(affymetrix)在三天后分析hcd73、hgapdh和hhprt1或mcd73和mhprt1mrna表达。hmcd73mrna表达值分别归一化至hgapdh(a-172)、hhprt1(efo-21)或mhprt1(4t1)mrna表达值。引人注目的是,如图2a至2d所示,观察到对于5种(a-172细胞)反义寡核苷酸分别>80%和>60%的敲除效率;对于7种(efo-21细胞反义寡核苷酸)>80%的敲除效率,对于10种(4t1细胞)反义寡核苷酸>90%的敲除效率。
为了进一步分析hmcd73反义寡核苷酸对癌细胞系中cd73mrna表达的影响,将人skov-3(人卵巢腺癌,atcc)细胞用10μm的相应的反义寡核苷酸处理3天,不添加任何转染试剂。作为对照,用neg1处理细胞,neg1是一种与任何人或小鼠mrna没有序列互补性的寡核苷酸。作为载体对照,用培养基处理细胞。将cd73表达值归一化至hprt1值,并相对于未处理的细胞(设定为1)显示。引人注目的是,skov-3细胞中的33种测试的反义寡核苷酸中的2种的hcd73mrna水平降低了≥80%(参见图2e)。用对照寡核苷酸neg1处理不会降低这三种细胞系中的cd73mrna。
与未处理的细胞相比,hmcd73的平均归一化的mrna表达的确切值和管家基因mrna的相应的相对表达在下面对于a-172细胞(表2和3为第1和第2轮筛选)、efo-21细胞(表4)、4t1细胞(表5)和skov-3细胞(表6)给出:
表2:第一轮筛选的与未处理的细胞相比的反义寡核苷酸处理的a-172细胞中的平均归一化hcd73mrna表达值的列表。
表3:第二轮筛选的与未处理的细胞相比的反义寡核苷酸处理的a-172细胞中的平均归一化hcd73mrna表达值的列表。
表4:与未处理的细胞相比,反义寡核苷酸处理的efo-21细胞中的平均归一化hcd73mrna表达值的列表。
表5:与未处理的细胞相比,反义寡核苷酸处理的4t1细胞中的平均归一化mcd73mrna表达值的列表。
表6:相对于未处理的细胞(设定为1),反义寡核苷酸处理的skov-3细胞中的平均归一化hmcd73mrna表达值。
实施例3:,人efo-21与人a-172细胞相比以及人a172与小鼠4t1细胞相比的反义寡核苷酸功效的相关性分析。
为了进一步在三种测试的细胞系a-172、efo-21和4t1中选择具有最高活性的候选物,进行相关性分析(来自图2b至2d的数据)。如图3a和图3b所示,选择5种有效的反义寡核苷酸,即a05008hm(seqidno.4)、a05009hm(seqidno.6)、a05018hm(seqidno.3)、a05026hm(seqidno.8)和a05028hm(seqidno.5)(标记为黑色)用于测定a-172、efo-21和4t1细胞中的ic50。重要的是,对照反义寡核苷酸neg1对所有三种测试的细胞系中的hcd39的表达没有负面影响。
实施例4:分别在skov-3细胞和efo-21细胞中选择的hmcd73反义寡核苷酸的ic50测定(mrna水平)
为了确定hmcd73反义寡核苷酸a05008hm(seqidno.4)、a05009hm(seqidno.6)、a05018hm(seqidno.3)、a05026hm(seqidno.8)和a05028hm(seqidno.5)的ic50,用滴定量的相应的反义寡核苷酸(浓度:10μm、3.3μm、1.1μm、370nm、120nm、41nm、14nm或4.5nm)处理skov-3细胞(人卵巢癌细胞,atcc)(图4a)。三天后分析hmcd73mrna表达。如图4a和下表7所示,与未处理的细胞相比,反义寡核苷酸a05008hm(seqidno.4)、a05018hm(seqidno.3)和a05028hm(seqidno.5)在hcd39mrna的下调方面在skov-3细胞中具有最高的效力,最大靶标抑制率分别为86%、88%和75%。skov-3细胞中的浓度依赖性靶标敲除用于计算表7中所示的ic50值:
表7:skov-3细胞中选择的hmcd73反义寡核苷酸的ic50值和靶标抑制的概览。
在efo-21细胞中的进一步测试中测定选择的hmcd73特异性反义寡核苷酸的ic50值。因此,用10μm、3.3μm、1.1μm、370nm、120nm、41nm、14nm或4.5nm的a05018hm(seqidno.3)、a05027hm(seqidno.30)、a05028hm(seqidno.5)和a05037hm(seqidno.39)处理efo-21细胞。在处理3天后分析hcd73mrna表达。图4b描绘了通过hmcd73反义寡核苷酸的hmcd73mrna表达的浓度依赖性降低。通过graphpadprism计算ic50值,并显示在表8中:
表8:在efo-21细胞中选择的hmcd73反义寡核苷酸的ic50值和靶标抑制
实施例5:hmcd73反义寡核苷酸在人和小鼠癌细胞系中的第三轮筛选
对于第三轮筛选,设计了新的反义寡核苷酸。这些反义寡核苷酸基于来自第一轮筛选的有效反义寡核苷酸,其具有长度、mrna上的确切位置和化学修饰模式的修改。人efo-21(卵巢囊腺癌)(图5a)、人skov-3(卵巢腺癌)(图5b)和小鼠4t1(乳腺癌)(图5c)细胞用10μm的相应的反义寡核苷酸不添加任何转染试剂处理3天。作为对照,用s6处理细胞,s6是一种与任何人或小鼠mrna没有序列互补性的寡核苷酸。作为载体对照,用培养基处理细胞。在第一轮筛选中显示出有效活性的反义寡核苷酸a05008hm、a05018hm和a05028hm用作参照。对于efo-21细胞(表9)、skov-3细胞(表10)和4t1细胞(表11)列出了相对于未处理的细胞(设定为1)的归一化至hprt1的hmcd73的平均mrna表达的值(图5a-c)。引人注目的是,efo-21细胞中13个测试的aso中的11个的cd73mrna水平降低≥80%(参见图5a),skov-3细胞中的13个测试的aso中的7个降低≥80%(参见图5b),并且在4t1细胞中的13个测试的aso中的9个降低≥80%(参见图5c)。用对照寡核苷酸s6处理在三种细胞系中没有有效地降低cd73mrna。
表9:相对于未处理的细胞(设定为1),反义寡核苷酸处理的efo-21细胞中的平均归一化hmcd73mrna表达值。
表10:相对于未处理的细胞(设定为1),反义寡核苷酸处理的skov-3细胞中的平均归一化hmcd73mrna表达值。
表11:相对于未处理的细胞(设定为1),反义寡核苷酸处理的4t1细胞中的平均归一化hmcd73mrna表达值。
实施例6:在efo-21细胞中第三轮筛选的选择的hmcd73反义寡核苷酸的ic50测定(mrna水平)
hmcd73反义寡核苷酸a05038hm(seqidno.42)、a05041hm(seqidno.45)、a05042hm(seqidno.45)和a05044hm(seqidno.46)在三种细胞系efo-21、skov-3和4t1中显示出有效的单剂量活性。为了研究效果的浓度依赖性并为了测定ic50值,用10μm、3.3μm、1.1μm、370nm、120nm、41nm、14nm或4.5nm的相应的反义寡核苷酸处理efo-21-细胞。在第一轮筛选中显示出有效活性的反义寡核苷酸a05018hm用作参照。处理3天后分析hcd73mrna表达。图6描绘了hmcd73反义寡核苷酸对hcd73表达的浓度依赖性降低。graphpadprism计算的ic50值如表12所示:
表12:在efo-21细胞中在滴定浓度下选择的hmcd73反义寡核苷酸的ic50值和靶标抑制
实施例7:a05008hm(seqidno.4)、a05018hm(seqidno.3)和a05028hm(seqidno.5)对cd73蛋白表达和细胞活力的浓度依赖性影响
高效hmcd73反义寡核苷酸a05008hm(seqidno.4)、a05018hm(seqidno.3)和a05028hm(seqidno.5)关于它们对hcd73蛋白表达的敲除效力及它们在不同浓度下对细胞活力的影响详细表征。因此,用不同浓度的相应的反义寡核苷酸处理skov-3细胞三天。然后,将细胞在含有指定浓度的反义寡核苷酸的新鲜dmem培养基中温育另外3天。使用cd73抗体(克隆ad2)和7-aad通过流式细胞术分析蛋白质表达以研究活力。如图7a所示,所有三种反义寡核苷酸在所有指定的浓度下显示出hcd73蛋白的有效抑制,而用neg1的处理没有抑制作用。然而,细胞活力部分地受a05028hm影响(图7b)。相反,a05008hm(seqidno.4)和a05018hm(seqidno.3)在任何测试的条件下都不影响skov-3细胞的活力。表13总结了skov-3细胞中选择的人cd73反义寡核苷酸a05008hm(seqidno.4)、a05018hm(seqidno.3)和a05028hm(seqidno.5)的蛋白质敲除效率:
表13:在skov-3细胞中在滴定浓度下选择的hmcd73反义寡核苷酸的cd73蛋白表达的抑制
实施例8:cd73蛋白敲除对人efo-21和skov-3细胞中的细胞外焦磷酸酯水平的影响
腺苷是通过hmcd73的atp降解过程中产生的一种主要的免疫抑制分子。可以通过比色磷酸酯测定试剂盒(ab65622,abcam)通过在amp降解为腺苷期间产生的焦磷酸酯间接检测腺苷。因此,用5μm的反义寡核苷酸a05018hm处理人skov-3和efo21细胞6天(3+3)。在3天后,用含有5μm的反义寡核苷酸的新鲜dmem培养基替换dmem培养基。通过流式细胞术在6天后确认两种测试的细胞系中的cd73的蛋白质敲除(图8)。作为对照,用neg1处理细胞(图8)。在指定的时间点向细胞中加入500μm的amp后,在细胞上清液中分析efo-21细胞(图9a)和skov-3细胞(图9c)产生的游离磷酸酯。如由细胞滴度蓝(celltiterblue)测试研究的,用反义寡核苷酸的处理不影响efo-21细胞(图9b)和skov-3细胞(图9d)的细胞活力。值得注意的是,用a05018hm处理后,efo-21和skov-3细胞的磷酸酯生产效率明显降低(图9a,9c),导致与用阴性对照neg1处理的细胞和与未处理的细胞相比,磷酸酯浓度低约1.5倍(图9a、9c、表14)。因此,抗cd73特异性反义寡核苷酸处理可以有效阻断癌细胞的腺苷产生。在表14中,给出了来自用a05018hm处理的skov-3和efo21细胞的细胞上清液的磷酸酯浓度以及来自相应的对照反应的浓度。
表14:在cd73蛋白敲除后和向细胞添加外源amp后,作为人efo-21和skov-3细胞上清液中的腺苷的间接检测方法的磷酸酯浓度测定。
实施例9:hmcd73特异性反义寡核苷酸对人卵巢癌细胞系的细胞外amp的降解和至腺苷的转化的影响的研究
a05018hm在抑制人癌细胞中的hcd73mrna和蛋白表达方面表现出显着活性。在以下实验中,在efo-21细胞中研究了hmcd73反义寡核苷酸处理对细胞外amp降解为免疫抑制性腺苷的能力的影响。
amp以及腺苷水平可以通过质谱测定。为了分析hmcd73反义寡核苷酸处理对人efo-21细胞将细胞外amp转化为腺苷的能力的影响,用5μm的反义寡核苷酸a05018hm或对照寡核苷酸s6处理细胞,总处理时间为6天。作为载体对照,仅用培养基处理细胞。
在处理6天后通过流式细胞术分析cd73蛋白表达,并且与用s6处理的细胞(白色柱;图10a)相比,在用a05018hm处理的细胞(黑色柱)中被显着抑制。为了研究降解细胞外amp的能力,在处理6天后,用补充有300μm的amp的pbs替换细胞培养基,并温育6.5小时。为了研究在不存在细胞的情况下amp的降解,将300μm的amp加入到无细胞的pbs中并孵化6.5h(斑点柱)。
此后,通过质谱测定细胞上清液(细胞条件pbs)和无细胞pbs中的amp和腺苷水平。与无细胞pbs中的amp水平(条带柱;图10b)相比,未处理的细胞的细胞上清液中的amp水平(虚线柱)有效降低,而腺苷水平增加(图10c)。这表明细胞相关的amp至腺苷的转化能力强。引人注目的是,在与s6处理的细胞(白色柱)或载体处理的细胞的上清液(斑点柱;图10b和10c,表15和16)相比时,在a05018hm处理的efo-21细胞(黑色柱)的上清液中amp水平显着增加,且腺苷水平显着降低。因此,这些数据清楚地表明用a05018hm处理人efo-21细胞显着抑制细胞将细胞外amp转化为免疫抑制性腺苷的能力。
表15:用amp处理efo-21细胞后相对于无细胞pbs(设定为1)的细胞上清液中的相对amp浓度的测定。
表16:用amp处理efo-21细胞后细胞上清液中的绝对腺苷浓度的测定。
实施例10:在存在或不存在细胞外atp的情况下hmcd73特异性反义寡核苷酸对t细胞增殖的影响的研究
本发明的先前结果(参见实施例9)揭示了用a05018hm处理人癌细胞系显着抑制了它们将细胞外amp转化为腺苷的能力。由于cd39-cd73轴对t细胞功能起重要作用,因此研究了在存在或不存在细胞外amp情况下,a05018hm对人cd4+t细胞的增殖的影响。因此,用细胞增殖染料标记人cd4+t细胞,用抗cd3激活并用5μm的反义寡核苷酸a05018hm(黑色柱)或对照寡核苷酸s6(白色柱)处理5天的总处理时间。在载体对照(条纹柱)中,仅用抗cd3激活细胞。随后,在寡核苷酸处理开始后第3天和第4天将300μm的amp或载体加入细胞中。在寡核苷酸处理开始后第5天,使用流式细胞术分析cd4+t细胞的cd73蛋白表达、增殖和绝对细胞数。
cd4+t细胞的a05018hm处理有效抑制cd73蛋白表达(图11a)。在没有细胞外amp的情况下,在a05018hm、s6、和载体处理的cd4+t细胞之间未观察到增殖(图11b上图)或绝对细胞数(图11c)的差异。引人注目的是,补充300μm的amp减少增殖(图11b下图)并且显着降低用s6或载体处理的cd4+t细胞的绝对数量(图11c)。相反,通过补充含有amp的细胞培养基,没有减少a05018hm处理的cd4+t细胞的增殖(图11b下图)。因此,在a05018hm处理的细胞中,amp补充几乎不减少绝对t细胞数(图11c)。
总之,这些结果表明,补充含有amp的细胞培养基显着减少了表达cd4+t细胞的cd73的增殖和绝对细胞数。引人注目的是,通过a05018hm处理的cd73蛋白敲除逆转了补充的amp对t细胞增殖的抑制作用,最可能通过抑制免疫抑制性腺苷的形成。
实施例11:人/小鼠交叉反应cd73反义寡核苷酸(a05027hm)在小鼠肝脏中的体内mcd73mrna敲除
选择有效的hmcd73反义寡核苷酸a5027hm,并研究在全身给予未配制的寡核苷酸后其对balb/c小鼠的肝脏中的mcd73mrna表达的影响。因此,在第1、2、3、4、5、8、10和12天以20mg/kg的剂量皮下注射a05027hm处理balb/c小鼠(5只小鼠/组)。作为对照,用载体处理balb/c小鼠(盐水,6只小鼠/组)。在最后一次反义寡核苷酸处理(第15天)后三天,处死小鼠并取样肝脏用于分析mcd73mrna水平。图12中描绘的结果显示a05027hm或载体处理的小鼠(白色柱)的肝脏中的mcd73mrna水平。引人注目的是,与载体对照相比,在用a05027hm处理小鼠后mcd73mrna水平显着(p=0.0043)减少。
- 还没有人留言评论。精彩留言会获得点赞!