一种基于抗菌药物差异培养的近缘微生物质谱鉴定方法与流程
本发明涉及微生物质谱鉴定技术领域,尤其涉及一种基于抗菌药物差异培养的近缘微生物质谱鉴定方法。
背景技术:
基质辅助激光解吸电离飞行时间质谱(matrix-assistedlaserdesorption/ionizationtimeofflightmassspectrometry,maldi-tofms)技术可以对细菌的完整蛋白进行检测,根据图谱中特征性质谱峰,对细菌种、属进行准确鉴定,具有一定的溯源能力。该技术具有鉴定速度快、检测低成本、操作简便、结果准确等优势,因而在细菌鉴定中得到很好的发展。
近缘微生物的核酸序列相近,蛋白表达也基本一致,因此近缘微生物的maldi-tofms质谱图极为相似,仅在某些低丰度质谱峰或是质谱峰强度上存在细微差别,从而使近缘微生物的参考质谱图不可避免地出现最佳相似度的匹配。现有微生物maldi-tofms鉴定技术基于样品质谱图和参考质谱图的匹配以及相似度排序,虽然具备一定的细菌分型能力,但尚无法解决近缘微生物鉴定结果混淆的弊端。
具体来说,以志贺菌和大肠埃希菌为例,所述2种细菌属于近缘微生物范畴,核酸序列相似,其中16srrna基因全长仅1-2个碱基的差别,从遗传角度来看,志贺菌可被定义为是大肠埃希菌不产气的生物型。然而,大肠埃希菌多数属于正常肠道菌群,而志贺菌为致病菌,从医学角度来说有必要将志贺菌和大肠埃希菌做出正确区别。常规鉴别手段是采用生化反应,利用微生物在不同的培养条件下发生不同的生化反应,再根据培养基颜色变化、产气等反应现象判断微生物种属,检测时长一般在8小时-3天不等(甚至需要耗时3-5天),该方法鉴定周期长,操作步骤复杂,结果受操作者主观判断影响,很难满足目前快速、准确鉴定细菌的需求。maldi-tofms技术虽然检测速度快,但是由于志贺菌和大肠埃希菌的蛋白质谱图基本一致,maldi-tofms技术只能鉴别到志贺菌属或大肠埃希菌属,无法正确鉴定二者,志贺菌常被错误地鉴定为大肠埃希菌,这一点是maldi-tofms技术在细菌鉴定应用中公知的不足之处。
技术实现要素:
本发明的目的在于克服现有技术中的缺陷,提供一种基于抗菌药物差异培养的近缘微生物质谱鉴定方法,将生化鉴定法的原理与maldi-tofms技术相结合,采用差异条件培养改变细菌特征性蛋白表达,应用maldi-tofms技术快速检测差异蛋白,实现近亲缘性志贺菌和大肠埃希菌的快速鉴别。
为实现上述目的,本发明采用如下技术方案:
本发明的第一个目的是提供一种基于抗菌药物差异培养的近缘微生物质谱鉴定方法,其包括以下步骤:
步骤1)将试验细菌以菌液的方式在添加抗菌药物的培养基中培养一预定时间,获得细菌试验样品;
步骤2)对步骤1)中获得的细菌试验样品进行细菌蛋白前处理;
步骤3)采用质谱仪对步骤2)中处理后的细菌试验样品进行检测,并采集数据;
步骤4)对步骤3)采集的数据进行处理与比对分析,以鉴定所述近缘微生物。
为了进一步优化上述方法,本发明采取的技术措施还包括:
进一步地,所述近缘微生物为志贺菌和大肠埃希菌。
进一步地,所述抗菌药物包括喹诺酮类抗菌药、氨基糖苷类抗生素、青霉素类抗生素中的至少一种;更进一步地,所述抗菌药物包括喹诺酮类抗菌药、氨基糖苷类抗生素、青霉素类抗生素中的一种。
进一步地,所述喹诺酮类抗菌药选自萘啶酮酸、诺氟沙星、依诺沙星、环丙沙星、氧氟沙星、左氧氟沙星、培氟沙星、司帕沙星;所述氨基糖苷类抗生素选自卡那霉素、庆大霉素、小诺霉素、妥布霉素、丁胺卡那霉素、链霉素、大观霉素、依替米星、奈替米星、阿米卡星;所述青霉素类抗生素选自羧苄青霉素、青霉素g、青霉素v、甲氧西林、氨苄青霉素、羟氨苄青霉素、羧噻吩青霉素、氧哌嗪青霉素;更进一步地,所述喹诺酮类抗菌药为萘啶酮酸;所述氨基糖苷类抗生素为卡那霉素;所述青霉素类抗生素包为羧苄青霉素。
进一步地,所述培养基中抗菌药物的浓度为2.5~5μg/ml,细菌在培养基中的培养时间为24h-72h;更进一步地,所述培养基中抗菌药物的浓度为5μg/ml,细菌在培养基中的培养时间为24h。
进一步地,步骤1)中细菌培养的具体步骤如下:试验前,取适量黏附有冻存菌株的橡胶圈置于增菌液中,恒温静置培养一定时间,制得菌液;将菌液均匀涂布于添加抗菌药物的培养基表面,恒温静置培养一定时间,挑取单个菌落,悬浮于装有纯水的离心管中,获得细菌试验样品。更具体地说,试验用细菌工作代菌株储存于-80℃低温冰箱;试验前,取适量黏附有冻存菌株的橡胶圈置于增菌液中,于35℃恒温静置培养24h,制得菌液;将菌液均匀涂布于不同条件(抗菌药物不同、抗菌浓度不同等)培养基表面,35℃恒温静置培养一定时间,在生物安全柜中挑取单个菌落,悬浮于装有300μl纯水的1.5ml离心管中,获得细菌试验样品。
进一步地,所述步骤2)细菌蛋白前处理的具体如下:将细菌试验样品进行离心,弃上清,加入甲酸水溶液,涡旋混合,再加入乙腈,离心,去上清液,点于样品板上;待样品点干燥后再滴加基质,放置干燥后进样。具体来说,将装有细菌试验样品的1.5ml离心管置于离心机中,12000g/min离心3min,弃上清,加入50μl70%甲酸水溶液,涡旋混合3min,再加入50μl乙腈,12000g/min离心3min,去上清液1μl点于样品板上;待样品点干燥后再滴加1μl基质,放置干燥后进样。
进一步地,所述步骤3)中质谱仪的检测条件如下:样品板载入质谱仪后激活激光系统,稳定30min,采用标准蛋白校正仪器,设置激光强度为3200。
进一步地,所述步骤4)中数据的处理及分析步骤如下:采用采样软件对采集的数据进行处理,在分析软件中同时打开试验细菌的待比对图谱,校正图谱基线,去除图谱噪音,对比图谱。具体来说,采用采样软件对质谱仪采集的数据进行对比分析,在分析软件中同时打开待比对图谱,选择advancedbaselinecorrection,设置参数为2.0,校正图谱基线。选择noisefilter去除图谱噪音,对比图谱,缺少或增加特征质谱峰的为大肠埃希菌,否则为志贺菌。
进一步地,所述质谱仪为maldi-tofms高分辨质谱仪,采样软件为4000seriesexplorer4.0数据处理系统,分析软件为dataexplorerv4.5。
进一步地,比对分析所得的所述特征质谱峰(差异蛋白的质荷比)为m/z4866±10、m/z8369±10、m/z9064±10、m/z9745±10。
本发明的第二个目的是提供一种应用于上述方法中的用于鉴定近缘微生物的培养基,其为在普通细菌培养基中添加抗菌药物;其中,所述普通细菌培养基为适于添加抗生素的培养基,例如tsa培养基等;所述抗菌药物为萘啶酮酸、卡那霉素、羧苄青霉素中的一种;所述近缘微生物为志贺菌和大肠埃希菌。
与现有技术相比,本发明具有以下有益效果:
本发明仅需在微生物常规培养时添加1组或以上不同配方的适当培养基,同时培养一段时间后挑取培养基上的微生物菌落进行maldi-tofms质谱分析,通过比较不同培养条件下微生物的蛋白质谱图差异,确定细菌种属。
本发明利用微生物在不同培养条件下蛋白表达存在差异,采用maldi-tofms检测差异蛋白来实现近缘微生物的鉴定,不依赖于基于参考质谱图库的质谱图匹配方法。因此,本发明所述近缘微生物鉴定技术可以弥补现有微生物maldi-tofms鉴定方法中因质谱图匹配所引起的近缘微生物鉴定结果混淆的不足之处。
在本发明所述的质谱鉴定方法中,由于微生物培养与差异培养同时进行,并不需要额外的实验时间,相比传统maldi-tofms鉴定方法,本发明鉴定准确度更好,适用于传统maldi-tofms方法不能鉴别的近缘微生物。本发明与传统生化鉴定相比,本发明只需要一个实验,在数分钟内完成,而传统生化鉴定方法需要耗时数小时甚至数日,并且需要多项实验组合验证得出鉴定结果,相比而言,本发明更加快速、简便易行。
附图说明
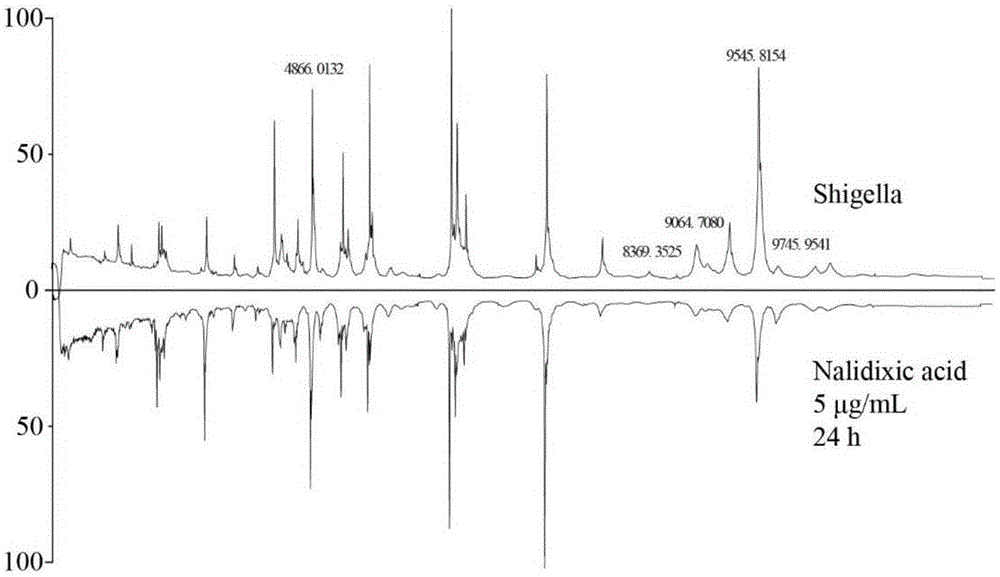
图1为本发明一实施例中志贺菌(cmcc51252)经过5μg/ml萘啶酮酸处理前后的图谱差异对比图;其中,上图为志贺菌在tsa培养基中培养24h时的maldi-tofms质谱图,下图为志贺菌在含有5μg/ml萘啶酮酸的tsa培养基中培养24h时的maldi-tofms质谱图。
图2为本发明一实施例中志贺菌(cmcc51252)在tsa培养基中培养以及经过2.5μg/ml和5μg/ml萘啶酮酸处理后的图谱差异对比图。
图3为本发明一实施例中志贺菌(cmcc51252)在tsa培养基中培养以及经过5μg/ml萘啶酮酸处理24h、48h和72h后的图谱差异对比图。
图4为本发明一实施例中大肠埃希菌(cmcc44102)经过5μg/ml萘啶酮酸处理前后的图谱差异对比图;其中,上图为大肠埃希菌在tsa培养基中培养24h时的maldi-tofms质谱图,下图为大肠埃希菌在含有5μg/ml萘啶酮酸的tsa培养基中培养24h时的maldi-tofms质谱图。
图5为本发明一实施例中大肠埃希菌(cmcc44102)在tsa培养基中培养以及经过2.5μg/ml和5μg/ml萘啶酮酸处理后的图谱差异对比图。
图6为大肠埃希菌(cmcc44102)在tsa培养基中培养以及经过5μg/ml萘啶酮酸处理24h、48h和72h后的图谱差异对比图。
图7为本发明一实施例中志贺菌(cmcc51252)经过5μg/ml卡那霉素处理前后的图谱差异对比图;其中,上图为志贺菌在tsa培养基中培养24h时的maldi-tofms质谱图,下图为志贺菌在含有5μg/ml卡那霉素的tsa培养基中培养24h时的maldi-tofms质谱图。
图8为本发明一实施例中志贺菌(cmcc51252)在tsa培养基中培养以及经过2.5μg/ml和5μg/ml卡那霉素处理后的图谱差异对比图。
图9为本发明一实施例中志贺菌(cmcc51252)在tsa培养基中培养以及经过5μg/ml卡那霉素处理24h、48h和72h后的图谱差异对比图。
图10为本发明一实施例中大肠埃希菌(cmcc44102)经过5μg/ml卡那霉素处理前后的图谱差异对比图;其中,上图为大肠埃希菌在tsa培养基中培养24h时的maldi-tofms质谱图,下图为大肠埃希菌在含有5μg/ml卡那霉素的tsa培养基中培养24h时的maldi-tofms质谱图。
图11为本发明一实施例中大肠埃希菌(cmcc44102)在tsa培养基中培养以及经过2.5μg/ml和5μg/ml卡那霉素处理后的图谱差异对比图。
图12为本发明一实施例中大肠埃希菌(cmcc44102)在tsa培养基中培养以及经过5μg/ml卡那霉素处理24h、48h和72h后的图谱差异对比图。
图13为本发明一实施例中志贺菌(cmcc51252)经过5μg/ml羧苄青霉素处理前后的图谱差异对比图;其中,上图为志贺菌在tsa培养基中培养24h时的maldi-tofms质谱图,下图为志贺菌在含有5μg/ml羧苄青霉素的tsa培养基中培养24h时的maldi-tofms质谱图。
图14为本发明一实施例中大肠埃希菌(cmcc44102)经过5μg/ml羧苄青霉素处理前后的图谱差异对比图;其中,上图为大肠埃希菌在tsa培养基中培养24h时的maldi-tofms质谱图,下图为大肠埃希菌在含有5μg/ml羧苄青霉素的tsa培养基中培养24h时的maldi-tofms质谱图。
具体实施方式
本发明提供一种基于抗菌药物差异培养的近缘微生物质谱鉴定方法,其包括如下步骤:步骤1)将试验细菌以菌液的方式在添加抗菌药物的培养基中培养一预定时间,获得细菌试验样品;步骤2)对步骤1)中获得的细菌试验样品进行细菌蛋白前处理;步骤3)采用质谱仪对步骤2)中处理后的细菌试验样品进行检测,并采集数据;步骤4)对步骤3)采集的数据进行处理与比对分析,以鉴定近缘微生物。
下面结合附图和实施例,对本发明的具体实施方式作进一步描述。以下实施例仅用于更加清楚地说明本发明的技术方案,而不能以此来限制本发明的保护范围。
实施例1
本实施例为一较佳形式的基于抗菌药物差异培养的近缘微生物质谱鉴定方法。
在本实施例所述的质谱鉴定方法中,采用的仪器及原材料如下所示:
1.实验仪器
ab4800maldi-tofms高分辨质谱仪,采样软件为4000seriesexplorer4.0数据处理系统,分析软件为dataexplorerv4.5,均购自美国ab-sciex公司;eppendorf5424r台式高速冷冻离心机购自德国艾本德公司;三洋mir-254型号恒温培养箱,购自日本三洋公司。
2.化学试剂
甲醇、乙腈为美国merck公司生产的色谱纯试剂,甲酸为sigma的色谱纯试剂,纯水为millipore系统纯化去离子水。
在本实施例中,所述质谱鉴定方法的具体步骤如下:
(1)细菌培养
试验用细菌工作代菌株储存于-80℃低温冰箱。试验前,取适量黏附有冻存菌株的橡胶圈置于增菌液中,于35℃恒温静置培养24h,制得菌液。将菌液均匀涂布于不同条件(抗菌药物种类不同、浓度不同等)培养基表面,35℃恒温静置培养一定时间,在生物安全柜中挑取单个菌落,悬浮于装有300μl纯水的1.5ml离心管中,获得细菌试验样品。
(2)细菌蛋白前处理
将装有细菌试验样品的1.5ml离心管置于离心机中,12000g/min离心3min,弃上清,加入50μl70%甲酸水溶液,涡旋混合3min,再加入50μl乙腈,12000g/min离心3min,去上清液1μl点于maldi-tof样品板上。待样品点干燥后再滴加1μl基质,放置干燥后进样。
(3)maldi-tofms检测条件
样品板载入质谱仪后激活激光系统,稳定30min,采用标准蛋白校正仪器,设置激光强度为3200,检测样品点。
(4)数据处理与分析
采用ab公司的4000seriesexplorerv4.5软件对maldi-tofms采集的数据进行对比分析。具体步骤如下:在dataexplorerv4.5软件中同时打开待比对图谱,选择advancedbaselinecorrection,设置参数为2.0,校正图谱基线。选择noisefilter去除图谱噪音,对比图谱。
实施例2
本实施例采用喹诺酮类抗菌药处理细菌,具体来说采用萘啶酮酸处理细菌,采用普通的tsa培养基作为对比,其质朴鉴定方法如实施例1所述,其谱图的对比结果如下:
志贺菌(cmcc51252)经过5μg/ml萘啶酮酸处理24h后,maldi-tofms质谱图与tsa培养基中培养24h的质谱图无显著差异(图1),且不随萘啶酮酸浓度(2.5、5μg/ml)和培养时间(5μg/ml,24、48、72h)延长而变化(图2、3)。大肠埃希菌(cmcc44102)经过5μg/ml萘啶酮酸处理24h后,maldi-tofms图谱中m/z4866、m/z8369、m/z9064、m/z9745的质谱峰强度随萘啶酮酸浓度(2.5、5μg/ml)增加显著降低,呈现浓度依赖关系(图4、5)。萘啶酮酸下调上述4种蛋白丰度的作用在培养24h时具有最大效应,之后作用强度随时间延长而减弱,培养72h后蛋白丰度回复至正常(图6)。
实施例3
本实施例采用氨基糖苷类抗生素处理细菌,具体来说采用5μg/ml卡那霉素处理细菌24h,采用tsa培养基作为对比,其质朴鉴定方法如实施例1所述,其谱图的对比结果如下:
志贺菌(cmcc51252)经过5μg/ml卡那霉素处理24h后,maldi-tofms质谱图与tsa培养基中培养24h的质谱图无显著差异(图7),且不随卡那霉素浓度(2.5、5μg/ml)和培养时间(5μg/ml,24、48、72h)延长而变化(图8、9)。大肠埃希菌(cmcc44102)经过5μg/ml卡那霉素处理24h后,maldi-tofms图谱中m/z4866、m/z8369、m/z9064、m/z9745的质谱峰强度随卡那霉素浓度(2.5、5μg/ml)增加显著降低,呈现浓度依赖关系(图10、11)。卡那霉素下调上述4种蛋白丰度的作用在培养24h时具有最大效应,之后作用强度随时间延长而减弱,培养72h后蛋白丰度回复至正常(图12)。
实施例4
本实施例采用青霉素类抗生素处理细菌,具体来说采用羧苄青霉素处理细菌,采用tsa培养基作为对比,其质朴鉴定方法如实施例1所述,其谱图的对比结果如下:
志贺菌(cmcc51252)经过5μg/ml羧苄青霉素处理24h后,maldi-tofms质谱图与tsa培养基中培养24h的质谱图无显著差异(图13)。大肠埃希菌(cmcc44102)经过5μg/ml羧苄青霉素处理24h后,maldi-tofms图谱中m/z4866、m/z8369、m/z9064、m/z9745的质谱峰强度显著降低(图14)。
通过上述实施例可知,志贺菌(cmcc51252)和大肠埃希菌(cmcc44102)在不同条件下培养,志贺菌的maldi-tofms图谱均无显著变化,大肠埃希菌的maldi-tofms图谱则在抗菌药物处理下4个质谱峰强度下调,说明发生4种蛋白表达显著下降,可理解的是这4种蛋白的分子量可能会因为校正因素、仪器自身因素发生偏移,其分子量为检测值的±5~10da;志贺菌(cmcc51252)和大肠埃希菌(cmcc44102)在同浓度抗菌药处理24h后,志贺菌的maldi-tofms图谱无显著变化,大肠埃希菌的maldi-tofms图谱中m/z4866、m/z8369、m/z9064、m/z9745的质谱峰强度显著降低,这表明本发明所述的培养基及鉴定方法为差异图谱鉴别志贺菌和大肠埃希菌提供实验依据。
以上对本发明的具体实施例进行了详细描述,但其只作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对该实用进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!