硫酸肝素与FK506共轭物酶化学合成以及应用的制作方法
本发明属于医药化工技术领域,具体涉及一种硫酸肝素与fk506共轭物酶化学合成以及应用。
背景技术:
硫酸肝素(heparansulfate,hs)是线性黏多糖,由己糖醛酸与氨基葡萄糖重复二糖结构组成,之间由α-1,4-糖苷键,具有抗凝血、抗病毒、抗炎、抗肿瘤作用以及调控胚胎发育,尤其其调控胚胎发育作用引人注意。干细胞包括肿瘤干细胞中培养中,硫酸肝素的高度硫酸化形式-肝素是干细胞生长必需外源性的物质,不加或缺乏时,生长受阻,提示核内硫酸肝素调控胚胎发育的重要性。细胞核中的硫酸肝素存在与否,直接改变许多细胞生长速率,细胞核内硫酸肝素对细胞行为的调控越来越引起科学家高度关注。随着高分辨成像和高亲和力抗体等分子技术的发展,发现细胞核中硫酸肝素存在比我们想象中更普遍,而且细胞核中硫酸肝素结构与其它细胞器中的硫酸结构差异明显,进一步强调核内硫酸肝素生物作用机制与构效关系的重要性。
硫酸肝素是内源性功能生物高分子,由内质网启动生物合成,经高尔基体延长加工成不同长度与硫酸化程度硫酸肝素,最后再由不同的载体转运到靶部位发挥生物功能,然而,由于硫酸肝素水溶性极大,如何被转运到细胞核中以及硫酸肝素中决定转运功能强弱的结构片段都不清楚等等问题,严重制约理解核内生物作用机制和构效关系的厘清(核内硫酸肝素及其细胞功能的控制,基质生物,2014,35,56-59)。因此,外源性硫酸肝素稳定有序安全地穿膜入核是研究核内硫酸肝素生物功能新的解决方法之一。
经对现有技术的文献检索发现,临床上免疫抑制剂fk506(tacrolimus)是一种大环内酯,常用来预防器官(包括肝脏、肾脏、心脏及胰)移植后的同种移植排斥反应,具有高特异靶向fkp12、脂溶性强、生物兼容性好以及代谢稳定等特性(合成配体控制信号转导,科学,1993,262,1019-1024.),能充当体内运输载体,但容易引起免疫抑制副作用。fk506的环外丙烯基中双键是产生免疫抑制效应功能结构片段,破坏烯丙基双键消除fk506免疫抑制活性(通过免疫亲和素-配体复合物的t细胞信号抑制与钙调酶活性丧失有关,生物化学,1992,31,3896-3901.),但目前并没有报道利用fk506携带硫酸肝素穿膜,更没有利用fk506的环外双键作为连接位点共轭硫酸肝素,引导其穿膜入核。本发明以fk506为载体,与不同结构的硫酸肝素共轭,将外源性硫酸肝素携带入核,是研究核内硫酸肝素调控细胞生物功能以及构效关系的比较方便方法,目前为止未见报道。但是,由于硫酸肝素来源困难,天然提取分离往往是混合物,化学合成的硫酸肝素步骤多、产率低,本发明采用酶化学方法制备各种结构确定的硫酸肝素。
技术实现要素:
本发明的目的在于克服上述现有技术存在的不足,提供一种硫酸肝素与fk506共轭物酶化学合成以及应用;具体是一种通过具有靶向特异性fkp12的免疫抑制剂药物fk506共轭酶化学制备所得不同结构的硫酸肝素,应用于核内硫酸肝素生物功能以及构效关系研究。本发明所述的共轭物设计独特,所述的合成反应条件温和,反应试剂易得,所述共轭物可携带硫酸肝素穿膜入核,可作为核内硫酸肝素生物功能与构效关系研究的工具小分子或探针。
本发明涉及的硫酸肝素-fk506共轭物,是结构式i所代表的化合物,其中,r2、r3、r4为氢或磺酰基(so3-),r1为氢、乙酰基(ac-)或磺酰基(so3-),n为1~6,y为不同芳香烃或3~10碳饱和或非饱和的脂肪烃,或芳香烃与饱和或不饱和脂肪烃共价交替链接,x为氧原子(-o-)或硫原子(-s-)或酰胺键(-conh2-)或酯键(-coo-),这些化合物可用于探索核内硫酸肝素的作用机制以及构效关系研究或者治疗因核内硫酸肝素异常引发的疾病。
具体而言,本发明的目的是通过以下技术方案实现:
第一方面,本发明涉及硫酸肝素-fk506共轭物,其结构式如式i所示:
i,其中,r2、r3、r4为氢或磺酰基(so3-),r1为氢、乙酰基(ac-)或磺酰基(so3-),n为1~6;y为芳香烃、c3~10的饱和或非饱和的脂肪烃、芳香烃与c3~10饱和或不饱和脂肪烃的共价交替链接形成的基团,x为氧原子(-o-)、硫原子(-s-)、酰胺键(-conh2-)或酯键(-coo-)。
优选的,所述芳香烃包括苯环或杂芳环。所述杂芳环包括吡啶、嘧啶、呋喃、噻吩、吲哚或嘌呤。
优选的,所述c3~10的饱和的脂肪烃为
第二方面,本发明一种硫酸肝素-fk506共轭物的酶化学合成方法,以对硝基苯基β-d-葡萄糖醛酸苷为起始原料,在硫酸肝素生物合成用系列重组酶的作用下,合成硫酸肝素
优选的,所述硫酸肝素生物合成用系列重组酶选自pmsh2,kfia,nst,ndstc5-epi,2-ost,6-ost,3-ost。
优选的,所述合成方法,具体包括如下步骤:
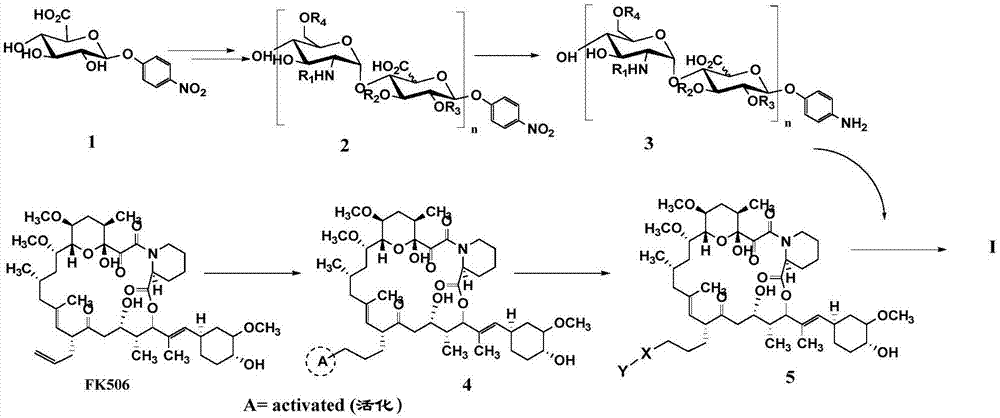
s1、在30℃~37℃下,以对硝基苯基-β-d-葡萄糖醛酸苷为起始原料,在hs聚合酶heparosansynthase-2frompasteurellamultocida(pmsh2)或kfia催化下,与udp-活化乙酰氨基葡萄糖(udp-glcnac)或udp-活化三氟乙酰氨基葡萄糖(udp-glcntfa)、udp-活化葡萄糖醛酸(udp-glca)交替反应延长至戊糖;再按目标结构的要求,经n-磺酰基转移酶(n-deacetylase/n-sulfotransferase,ndst)、2-o-磺酰转移酶(2-o-sulfotransferase,2-ost)、c5-异构酶(c5-epimerase,c5-epi)、6-o-磺酰转移酶(6-o-sulfotransferase,6-ost)、3-o-磺酰转移酶(6-o-sulfotransferase,3-ost)中的一种或几种催化,制备得到重复二糖单位硫酸肝素
s2、在氢气保护下,将所述重复二糖单位硫酸肝素溶入水中,用10%pd/c催化氢化,常温下搅拌半小时,得到含芳香胺硫酸肝素
s3、在氮气保护下,以无水四氢呋喃为溶剂,特异性活化fk506的环外双键后与不同长度活化的连接子(linker)反应得含有链接子的fk506衍生物
s4、在氮气保护下,将所述含芳香胺硫酸肝素与含有链接子的fk506衍生物混溶于1,4-二氧六环与20μm-150μm醋酸钠缓冲液中,常温下充分搅拌3~5小时,得所述硫酸肝素-fk506共轭物。
优选的,步骤s2中,所述催化氢化采用的氢源选自氢气、甲酸铵中的一种或几种。
优选的,步骤s3中,特异性活化fk506的环外双键后与连接子的反应包括如下步骤:
a1、以无水二氯甲烷为溶剂,fk506与化合物
a2、以无水二氯甲烷为溶剂,所述化合物6与y-h和二环己基二亚胺按物质的量比为1:1.05-1.2:1.1-2混合反应,生成所述含有链接子的fk506衍生物。
优选的,步骤s4中,所述醋酸钠缓冲液的ph为5.0-6.0;所述醋酸钠缓冲液与1,4-二氧六环的体积比1:1-1:4。所述醋酸钠缓冲液为醋酸钠与醋酸混合而成。
第三方面,本发明涉及一种所述的硫酸肝素-fk506共轭物的用途,所述硫酸肝素-fk506共轭物作为研究核内硫酸肝素的生物功能和/或构效关系的工具小分子或探针。
第四方面,本发明涉及一种所述的硫酸肝素-fk506共轭物在制备治疗因核内硫酸肝素异常引发的疾病的药物中的用途。
与现有技术相比,本发明具有如下有益效果:
1、本发明方法可共价耦合两种极性相差很大物质,一个是水溶性极大的结构确定硫酸肝素,一个是脂溶性极强fk506衍生物,高产率地得到硫酸肝素-fk506共轭物i;
2、本发明方法涉及的fk506的环外双键环活化,采用与fk506其它功能团兼容的反应如点击反应等等,避免繁琐的保护与脱保护步骤,确保fk506活化的产率,用于后续硫酸肝素-fk506共轭物制备;
3、本发明方法涉及的14c同位素硫酸肝素首次采取酶催化法标记,条件温和,产率高,经酶催化14c同位素标记,放射性强弱测定分析发现,所得共轭物能大大地提高硫酸肝素的穿膜入核能力,其它现有技术很难完成,无法与其比拟;
4、本发明合成方法所制备的硫酸肝素-fk506共轭物,穿膜入核后,可以作为核内硫酸肝素生物功能与具体作用机制探索的小分子工具或探针,挖掘核内硫酸肝素的构效关系以及用于治疗与诊断因核内硫酸肝素变化引起疾病。同时,本发明方法可以作为核内其它水溶性大的生理物质的生物功能与作用机制探索模型。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
图1为本发明的硫酸肝素-fk506共轭物的合成路线图;
图2为fk506的活化示例路线图;
图3为fk506-硫酸肝素共轭物10、13的合成路线图。
具体实施方式
下面结合实施例对本发明进行详细说明。以下实施例在以本发明技术方案为前提下进行实施,以硫酸肝素四糖、硫酸肝素十二糖为硫酸肝素代表性结构,以硫醚键共价偶联fk506,给出了详细的实施方式和具体的操作过程,将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干调整和改进。这些都属于本发明的保护范围。
实施例1、硫酸肝素-fk506共轭物的合成
本实施例具体涉及硫酸肝素四糖-fk506共轭物(10)和硫酸肝素十二糖-fk506共轭物(13)合成,反应路线图如图1所示。
1,含有链接子的fk506衍生物的合成
如图2所示,经不同反应特异性活化fk506的环外双键,再与不同长度活化的连接子(linker)反应得含有链接子的fk506衍生物。
1.1,化合物6的合成
fk506(0.404g,0.5mmol),和2-巯基乙酸(39.5mg,0.52mmol),苯偶酰二甲基缩酮(6.4mg,25.0nmol)先后溶入8ml无水二氯甲烷中,在365nm紫外照射下,搅拌15分钟,直接用硅胶柱纯化(乙酸乙酯/丙酮=1:1,v/v)得443.5mg白色固体,产率99%。(rf=0.51).1hnmr(400mhz,cdcl3):5.32-5.19(d,j=52.0hz,1h),5.07-4.98(m,2h),4.59-4.40(m,1h),3.99-3.54(m,3h),3.41-3.26(m,10h),3.21-2.19(d,j=8hz,2h)3.05-2.99(m,2h),2.88-2.36(m,11h),2.35-2.24(m,2h),2.19-1.22(m,28h),1.06-0.72(m,11h).esi-ms(m/z),c42h73no14s(m):[m-h]-,计算值894.4679,测定值894.4685.
1.2,化合物7的合成
在氮气保护下,化合物6(0.447g,0.5mmol),和n-羟基琥珀酰亚胺(59.8mg,0.52mmol),二环己基二亚胺(ddc)(111.24mg,0.54mmol)分别溶入20ml无水四氢呋喃中,室温搅拌2小时,加入石油醚促沉,过滤,减压浓缩,粗品用硅胶柱纯化(乙酸乙酯/丙酮=1:1,v/v)得446.5mg白色固体,产率90%。rf=0.53.1hnmr(400mhz,cdcl3):5.32-5.18(d,j=56.0hz,1h),5.08-4.99(m,1h),4.57-4.33(m,2h),4.01-3.53(m,3h),3.42-3.26(m,11h),3.05-2.98(m,2h),2.86(d,j=16hz,2h),2.69(d,j=16hz,2h),2.37-1.86(m,14h),1.78-1.56(m,15h),1.45-1.32(m,10h),1.20-1.06(m,5h),1.03-0.86(m,8h).13hnmr(100mhz,cdcl3):213.1,196.5,172.3,169.2,169.1,168.9,166.1,165.8,164.5,157.1,138.9,132.8,132.6,129.6,129.4,122.8,97.1,84.2,75.1,93.6,72.8,70.3,56.9,56.4,51.9,49.3,48.4,43.0,39.9,39.3,34.9,34.7,33.8,32.6,32.5,31.2,30.5,29.5,27.5,26.2,25.6,25.5,25.4,24.9,24.5,20.5,16.3,15.9,14.3,9.6.esi-ms(m/z)c50h76n2o16s(m):[m+na+],计算值1015.4808,测定值1015.4815.
2,fk506-硫酸肝素共轭物10、13的合成,合成线路如图3所示。
2.1,对硝基苯基-β-(2-n-磺酰基葡萄糖-α-1,4-葡萄糖醛酸-β-1,4-(2-n-磺酰基葡萄糖)-α-1,4-葡萄糖醛酸)糖苷(8)的合成
将315mg对硝基苯基-β-d-葡萄糖醛酸苷(1mmol)溶于20mltris(25mm,ph7.2)缓冲液中,反应液中氯化锰浓度为5mm,然后,分别加入1.25mmoludp-glcntfa和1.05mg聚合酶pmhs2,30℃反应过夜,polyii-hplc监测反应进程,c18层析柱(1.5×70cm,biotage,0~100%甲醇水溶液(含有0.1%三氟乙酸)作为流动相,流速2ml/min)纯化得二糖,离心浓缩干燥得白色粉末直接溶于20ml含有5mm氯化锰tris缓冲溶液(25mm,ph7.2),先后加入1.25mmol的udp-glca与聚合酶pmhs2,37℃反应过夜,经c18柱纯化后(如同二糖监测与纯化方法)得三糖,重复延长glcntfa的步骤制备四糖,后者不经纯化,直接在冰浴上加入过量的0.1m氢氧化锂,反应半小时后定量除去三氟乙酰基,esi-ms监控反应进程,反应液经1m盐酸调至ph=7,所得产物重新溶入ph7.0的2-(n-morpholino)ethanesulfonicacid(2-(n-吗啉)乙磺酸,mes,50mm)缓冲液中,加入1.12mg的nsulfotransferase(n-磺酰基转移酶,nst)(nst具有ndst磺酰化的功能)。和过量的磺酰基供体3'-磷酸腺苷-5'-磷酸硫酸酯(paps,2.5equiv.),在37℃下反应过夜,polyii-hplc监控进程,直接经daea制备纯化850mg硫酸肝素四糖8,产率为87.5%(以对硝基苯基-β-d-葡萄糖醛酸苷计算)。1hnmr(600mhz,cdcl3):8.23(d,j=12hz,2h),7.21(d,j=12hz,2h),5.63(d,j=3.6hz,1h),5.59(d,j=3.6hz,1h),5.31(d,j=7.2hz,1h),4.56(d,j=7.2hz,1h),4.13(d,j=7.2hz,1h),3.98-3.20(m,18h).esi-ms,m/z:c30h43n3o29s2,计算值973.14,测定值973.46.
2.2,对胺基苯基-o-β-(2-n-磺酰基-葡萄糖-α-1,4-葡萄糖醛酸-β-1,4-(2-n-磺酰基-葡萄糖)-α-1,4-葡萄糖醛酸)糖苷(9)的合成
将195mg化合物8溶液双重蒸馏水中,加入20mg10%pd/c,通入氢气催化,定量还原硝基至氨基,硅藻土过滤,得188mg化合物9。esi-ms,m/z:计算值c30h45n3o27s2,943.17,测定值943.56.
2.3,对硝基苯基β-硫酸肝素十二糖苷(11)的合成
将315mg对硝基苯基-β-d-葡萄糖醛酸苷(1mmol)溶于20mltris(25mm,ph7.2)缓冲液中,反应液氯化锰浓度为5mm,然后,先后加入1.25mmoludp-glcntfa和1.05mg聚合酶pmhs2,30℃反应过夜,polyii-hplc监测反应进程,c18柱层析(1.5×70cm,biotage,0~100%甲醇水溶液(含有0.1%三氟乙酸)作为流动相,流速2ml/min)纯化得二糖,离心浓缩干燥得白色粉末直接溶于20ml含有5mm氯化锰tris缓冲溶液(25mm,ph7.2),先后加入1.25mmol的udp-glca与聚合酶pmhs2,37℃反应过夜,经c18柱纯化后(如同二糖监测、纯化方法)得三糖,再交替重复上述步骤9次,每步按相同监测与纯化方法,制备966mg白色泡沫状硫酸肝素十二糖,产率为39.9%(以对硝基苯基-β-d-葡萄糖醛酸苷为计)。1hnmr(600mhz,cdcl3):8.21(d,j=12hz,2h),7.18(d,j=12hz,2h),5.34(m,6h),5.24(d,j=5.2hz,1h),4.47(m,5h),4.03(d,j=6.0hz,1h),3.89-3.24(m,60h),2.02(s,18h).esi-ms,m/z:c90h131n7o69,计算值2413.69,测定值2416.92.
2.4,对氨基苯基β-硫酸肝素十二糖苷(12)的合成
将48.3mg化合物11溶液双重蒸馏水中,加入5mg10%pd/c,通入氢气催化,还原硝基至氨基,硅藻土过滤,离心浓缩得45.0mg克化合物12,产率94.3%。esi-ms,m/z:c90h133n7o67,计算值2383.72,测定值2384.92.
2.5,硫酸肝素四糖-fk506共轭物(10)的合成
将11.4mg化合物9(0.012mmol)溶入5mlph=5.5的50μm醋酸钠缓冲液与1,4-二氧六环(v:v=1:1)中,随后将溶有9.93mg化合物7(0.01mmol)的1,4-二氧六环溶液滴加,5分钟之内滴加完,搅拌4小时,hplc监测反应进程,c18-hplc制备液相纯化得12.4mg。(uv=254nm,流动相是0%~100甲醇水溶液(0.1%三氟乙酸),产率68%。esi-ms,m/z:c76h116n4o40s3计算值1820.63,测定值1821.21.
2.6,硫酸肝素十二糖-fk506共轭物(13)的合成
将28.6mg化合物12(0.12mmol)溶入5mlph=5.550mm的醋酸钠缓冲液与1,4-二氧六环(v:v=1:1)中,随后溶有9.93mg化合物7(0.01mmol)的1,4-二氧六环溶液滴加,5分钟之内滴加完,搅拌5小时,hplc监测反应进程,c18-hplc制备液相纯化得15.7mg目标化合物。(uv=254nm,流动相是0%~100甲醇水溶液,含有0.1%三氟乙酸),产率48%。esi-ms,m/z:c136h204n8o80s计算值3261.18,测定值,3263.41.
实施例2、fk506-硫酸肝素共轭物10、13穿膜入核能力测定
同位素14c标记方法及入核放射性强弱的测定:在聚合酶pmsh2作用下,将udp-14cglca引入到硫酸肝素与fk506共轭物10和13,得到同位素14c标记硫酸肝素非还原端的共轭物,c18-hplc检测反应进程,用制备hplc分离纯化,浓缩干燥所得14c标记共轭物与细胞共孵育,数小时后,破膜,离心分离细胞核,液体闪烁计数器测定细胞核放射性强弱,以14c标记未共轭前的硫酸肝素化合物9,12为对照。
具体操作:将1x105个hek293t细胞种植到6孔板中培养,细胞达到指数生长期,汇集度达到60%~80%,加入5000cpma待测化合物,每个样品重复3个孔,培养箱(37℃,5%co2)中继续培养4h,共孵育完毕,小心用培养基清洗3次,除去细胞膜外的放射性物质,用0.2%tritonx-100冰上破细胞膜,15,000×g离心收集细胞核,液体闪烁计数器测定放射性强弱。
测定结果如下表1,表明硫酸肝素-fk506共轭物穿膜入核能力明显增强,强度达10倍以上。
表1共轭物10,13穿膜入核测定结果
注,a表示测量结果是三次独立实验的平均值。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变形或修改,这并不影响本发明的实质内容。
- 还没有人留言评论。精彩留言会获得点赞!